Corps de l’article
La peau est la première ligne de défense qui protège le corps de la déshydratation, des blessures et des infections. Les annexes de la peau, comme les poils et les glandes sébacées, ont aussi un effet protecteur. La peau est constituée de deux couches tissulaires : la plus superficielle est l’épiderme et la couche intermédiaire est le derme (Figure 1B). Les cellules de l’épiderme, les kératinocytes, sont des cellules spécialisées exprimant une grande variété de filaments intermédiaires appelés kératines, qui confèrent à la peau ses propriétés de résistance mécanique et d’imperméabilité ((→) m/s 2002, n° 1, p. 45).
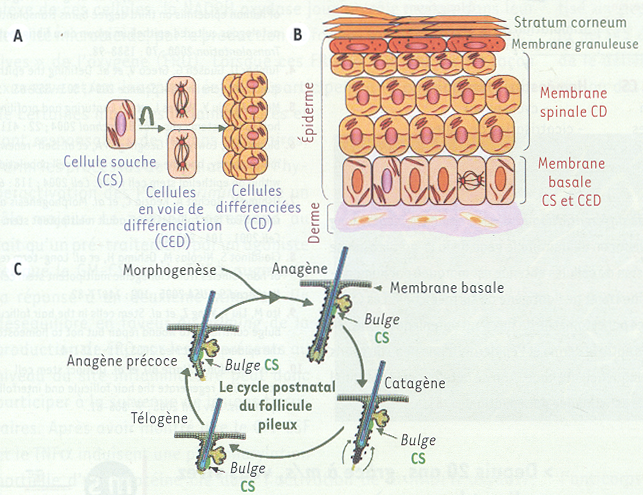
Figure 1
Peau et follicule pileux.
A. Cellules souches (CS) de la membrane basale. Les CS s’autorenouvellent et produisent des cellules en voie de différenciation (CED) qui se divisent et se différencient (CD). B. Cellules souches de la membrane basale et organisation de la peau. La couche la plus superficielle de la peau est l’épiderme. L’épiderme est un épithelium pluristratifé composé par une membrane basale, comprenant des CS et des CED, une membrane spinale composée de CD, une membrane granuleuse et une couche cornée, cette dernière jouant un rôle vital de barrière contre les aggressions extérieures. C. Follicule pileux et cycle pilaire. Anagène : phase de croissance du follicule pileux. Catagène : phase de régression. Telogène: phase de quiescence du follicule pileux.
Chez les mammifères, l’épiderme se renouvelle continuellement. La desquamation des cellules à la surface de la peau doit naturellement être compensée par le renouvellement de l’épiderme, assuré par les kératinocytes de la couche basale qui se divisent activement et se différencient en cellules de la couche cornée. Ces activités de renouvellement et de réparation de l’épiderme impliquent l’existence de cellules souches (CS).
Les CS sont définies par leur propriété d’autorenouvellement, c’est-à-dire qu’au moins une des cellules filles possèdent les mêmes caractéristiques que la CS initiale, et par leur capacité de différenciation en cellules matures qui composent leur tissu d’origine (Figure 1A) ((→) m/s 2004, n° 3, p. 265).
Il est généralement admis que l’épiderme interfolliculaire (EIF) et le follicule pileux comportent leurs propres CS spécialisées capables de maintenir le développement du tissu indépendamment l’un de l’autre.
Contrairement aux CS du follicule pileux, qui sont confinées dans une niche appelée bulge [1] (Figure 1C) ((→) m/s 2003, n° 6-7, p. 683), les CS de l’EIF résident le long de la membrane basale de l’épiderme. La couche basale de l’épiderme est composée d’une population hétérogène de cellules proliférant et se différenciant (Figure 1B). La capacité de prolifération et de régénération tissulaire des CS épidermiques a été démontrée par leur culture in vitro suivie par leur transplantation chez les patients atteints de brûlures étendues. Des kératinocytes isolés de l’EIF sont capables de former en culture trois types de clones ayant différents potentiels prolifératifs [2]. Les holoclones, dérivant probablement d’une CS épidermique, représentent les colonies non différenciées ayant le plus fort potentiel de prolifération et pouvant être amplifiés à long terme. Les méroclones, dérivant de cellules en voie de différenciation, ont un potentiel de prolifération intermédiaire et les paraclones, provenant de cellules différenciées, ne survivent pas en culture. En 1975, Howard Green et al. ont défini les conditions de culture des CS de l’EIF permettant ainsi l’amplification de kératinocytes à partir de zones saines chez des patients sévèrement brûlés, et par la suite leur greffe. En Europe, l’équipe de Yann Barrandon [3] a été une pionnière dans l’isolement des CS de patients sévèrement brûlés, suivie par leur expansion et par la transplantation de couches d’épithélium stratifié produites in vitro. Leurs résultats apportent la preuve que les CS adultes constituent une source idéale pour une application thérapeutique. Un autre aspect de l’utilisation des CS adultes en culture est la thérapie génique pour traiter des maladies épidermiques héréditaires. Par exemple, des CS épidermiques de patients souffrant d’épidermolyse jonctionnelle ont été isolées et corrigées par transduction du gène déficient codant pour la laminine 5.
La régénération folliculaire, quant à elle, se fait par vagues successives associant une phase de croissance (anagène), une phase de régression (catagène) et une phase de repos (télogène) (Figure 1C). De nombreuses avancées ont été réalisées dans la caractérisation des CS du follicule pileux chez la souris. Il est maintenant possible de les extraire de leur niche par cytométrie de flux, soit grâce à l’utilisation de souris transgéniques exprimant un traceur spécifiquement exprimé par les cellules du bulge [4, 5], soit en utilisant des marqueurs membranaires comme l’intégrine α6 ou β4 en combinaison avec l’antigène de surface CD34 [6]. Les CS de l’EIF sont quant à elles encore peu caractérisées et aucun marqueur n’a été identifié qui permette de les isoler sélectivement.
Plusieurs méthodes ont été employées pour étudier le potentiel de différenciation des CS du bulge comprenant : (1) des études de transplantation de fragments de follicule pileux [7] ; (2) des analyses clonales et de transplantation directe des cellules extraites de leur niche chez des souris immunodéficientes [5, 6, 8] ; (3) des expériences génétiques permettant de suivre in vivo les CS [7] (Figure 2). Ces travaux ont montré que les CS du bulge sont clonogéniques in vitro, c’est-à-dire capables de former préférentiellement des clones à haut potentiel prolifératif (holoclones), et sont multipotentes in vivo, capables de donner naissance à toutes les lignées de cellules épithéliales de la peau, non seulement les follicules pileux et les glandes sébacées, mais aussi les kératinocytes de l’épiderme [6, 8]. Il a également été montré qu’en réponse à des blessures, les CS du follicule pileux étaient capables de contribuer à la régénération non seulement du follicule pileux mais aussi à celle de l’épiderme et des glandes sébacées [4]. Ces résultats ont suggéré que le follicule pileux était le lieu où résidaient les CS multipotentes de la peau et que les CS du bulge pouvaient être mobilisées afin de réparer l’épiderme cutané lors d’une blessure. Cependant, les CS du follicule pileux ne sont pas indispensables au renouvellement de l’EIF car la paume des mains par exemple, totalement dépourvues de poils, se renouvelle normalement. Des modèles génétiques chez la souris suggèrent qu’en l’absence de blessure, les CS du bulge ne participent pas au renouvellement de l’EIF [5, 9, 10] (Figure 2).
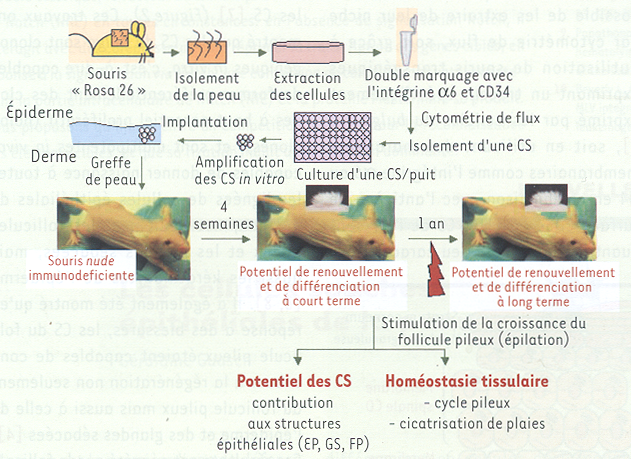
Figure 2
Méthodes utilisées pour étudier le potentiel de différenciation et d’autorenouvellement à long terme des CS du follicule pileux.
Une souris exprimant de façon ubiquitaire le gène de la β-galactosidase est utilisée pour isoler les cellules de la peau. La suspension de cellules obtenue est marquée par immunofluorescence avec des anticorps spécifiques de l’intégrine α6 et de l’antigène de surface CD34. Les CS du bulge, positives pour ces deux marqueurs, sont collectées par cytométrie de flux pour obtenir des clones en culture. Les clones de kératinocytes sont alors implantés entre le derme et l’épiderme d’une peau de souris et cette peau est finalement greffée sur une souris immunodéficiente nude. Afin de déterminer le potentiel à long terme des CS du bulge, la croissance des follicules est stimulée par épilation [6, 8].
L’isolement des CS du bulge a permis de définir leur profil transcriptionnel [4-6]. Cette signature moléculaire permet de définir les gènes et les voies de signalisation actives dans les CS épithéliales du follicule pileux. Cette signature peut être comparée à la signature d’autres types de CS. Il est intéressant de noter que 14 % des ARNm spécifiquement surexprimés dans d’autres types de CS (comme les CS hématopoïétiques, neuronales et embryonnaires) sont aussi présents dans la signature du bulge [4, 6] suggérant que certains gènes sont impliqués dans les propriétés uniques et communes aux CS. Ces bases de données vont permettre de répondre à de nombreuses questions encore sans réponse : existe-t-il un mécanisme moléculaire commun qui gouverne l’autorenouvellement des CS et leur maintien dans un état indifférencié ? Quelles sont les voies de signalisation par lesquelles une CS quiescente est activée en réponse à une lésion cutanée ? Quelles sont les propriétés des CS dans un environnement tumoral ? Un cancer résulte d’un processus à plusieurs étapes durant lesquelles s’accumulent des mutations dans certains gènes. Dans la majorité des cancers, la cellule cible dans laquelle s’accumulent les mutations, reste inconnue. Les CS, du fait de leur capacité à s’autorenouveler indéfiniment, pourraient être ces cellules cibles initiales dans lesquelles apparaît la mutation oncogénique. La possibilité d’isoler les CS épithéliales va permettre maintenant d’étudier la place des CS dans les cancers de la peau.
Parties annexes
Remerciements
L’auteur remercie Cédric Blanpain pour ses critiques et suggestions dans la préparation de cet article. Merci à Human Frontier Science Program et au Laboratoire du Dr Elaine Fuchs pour leur soutien financier.
Références
- 1. Fuchs E, Tumbar T, Guasch G. Socializing with the neighbors : stem cells and their niche. Cell 2004 ; 116 : 769-78.
- 2. Barrandon Y, Green H. Three clonal types of keratinocyte with different capacities for multiplication. Proc Natl Acad Sci USA 1987 ; 84 : 2302-6.
- 3. Ronfard V, Rives JM, Neveux Y, et al. Long-term regeneration of human epidermis on third degree burns transplanted with autologous cultured epithelium grown on a fibrin matrix. Transplantation 2000 ; 70 : 1588-98.
- 4. Tumbar D, Guasch G, Greco V, et al. Defining the epithelial stem cell niche in skin. Science 2004 ; 303 : 359-63.
- 5. Morris RJ, Liu Y, Marles L, et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol 2004 ; 22 : 411-7.
- 6. Blanpain C, Lowry WE, Geoghegan A, et al. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell 2004 ; 118 : 635-48.
- 7. Oshima H, Rochat A, Kedzia C, et al. Morphogenesis and renewal of hair follicles from adult multipotent stem cells. Cell 2001 ; 104 : 233-45.
- 8. Claudinot S, Nicolas M, Oshima H, et al. Long-term renewal of hair follicles from clonogenic multipotent stem cells. Proc Natl Acad Sci USA 2005 ; 102 : 14677-82.
- 9. Ito M, Liu Y, Yang Z, et al. Stem cells in the hair follicule bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med 2005 ; 11 : 1351-4.
- 10. Levy V, Lindon C, Harfe BD, et al. Distinct stem cell populations regenerate the hair follicule and interfollicular epidermis. Dev Cell 2005 ; 9 : 855-61.
Liste des figures
Figure 1
Peau et follicule pileux.
A. Cellules souches (CS) de la membrane basale. Les CS s’autorenouvellent et produisent des cellules en voie de différenciation (CED) qui se divisent et se différencient (CD). B. Cellules souches de la membrane basale et organisation de la peau. La couche la plus superficielle de la peau est l’épiderme. L’épiderme est un épithelium pluristratifé composé par une membrane basale, comprenant des CS et des CED, une membrane spinale composée de CD, une membrane granuleuse et une couche cornée, cette dernière jouant un rôle vital de barrière contre les aggressions extérieures. C. Follicule pileux et cycle pilaire. Anagène : phase de croissance du follicule pileux. Catagène : phase de régression. Telogène: phase de quiescence du follicule pileux.
Figure 2
Méthodes utilisées pour étudier le potentiel de différenciation et d’autorenouvellement à long terme des CS du follicule pileux.
Une souris exprimant de façon ubiquitaire le gène de la β-galactosidase est utilisée pour isoler les cellules de la peau. La suspension de cellules obtenue est marquée par immunofluorescence avec des anticorps spécifiques de l’intégrine α6 et de l’antigène de surface CD34. Les CS du bulge, positives pour ces deux marqueurs, sont collectées par cytométrie de flux pour obtenir des clones en culture. Les clones de kératinocytes sont alors implantés entre le derme et l’épiderme d’une peau de souris et cette peau est finalement greffée sur une souris immunodéficiente nude. Afin de déterminer le potentiel à long terme des CS du bulge, la croissance des follicules est stimulée par épilation [6, 8].