Abstracts
Résumé
L’adsorption du Victoria Bleu Basique (VBB) sur du carton usagé (CU) a été étudiée et comparée à celle sur de la sciure de bois (SB). Le CU a été caractérisé par différentes techniques analytiques. Les paramètres influençant la réaction ont été déterminés, tels que le pH, le dosage des adsorbants et le temps de contact. L’étude cinétique a révélé que la réaction de surface s’adapte au modèle de pseudo-second ordre et que la diffusion intraparticulaire est une étape déterminante après les premières minutes. L’influence de la température sur l’adsorption a permis de déterminer les paramètres thermodynamiques (∆G°, ∆H° et ∆S°). La modélisation des résultats expérimentaux prédit une chimisorption spontanée, endothermique dont la rétention se fait suivant un mécanisme intermédiaire, entre une distribution en monocouche et celle en multicouche, sur le CU. À pH 6 la capacité d’adsorption du CU, égale à 205 mg∙g-1, est cinq fois supérieure à celle de la SB.
Mots-clés :
- carton usagé,
- sciure de bois,
- Victoria Bleu Basique,
- adsorption,
- modélisation
Abstract
The adsorption of Victoria Blue Basic (VBB) dye on used cardboard (UC) was studied and compared to that on sawdust (SD). UC was characterized by several analytical techniques. The parameters influencing the reaction, such as pH, adsorbent dosage and contact time, were determined. The kinetic study revealed that the surface reaction fits a pseudo-second order model and that intra-particle diffusion is a determining step after the first minutes of contact. The influence of temperature on the adsorption allowed the determination of the thermodynamic parameters (ΔG°, ΔH° and ΔS°). Modeling of the experimental results predicted a spontaneous, endothermic sorption, the retention of which follows an unclear mechanism, between a monolayer and multilayer distribution on the UC. At pH 6, the adsorption capacity of the UC is 205 mg∙g-1, which is five times greater than that of SD.
Keywords:
- used cardboard,
- sawdust,
- Victoria Blue Basic,
- adsorption,
- modeling
Article body
1. Introduction
Les rejets de certaines industries, entre autres, l’industrie textile, les tanneries ou encore l’industrie de pulpe et papier sont parfois très chargées de colorants. La plupart de ces colorants sont peu biodégradables et résistent aux traitements biologiques. Différentes techniques de dépollution des eaux résiduaires ont été appliquées, avec des efficacités et des coûts de traitement variables. Nous pouvons classer ces procédés en deux catégories : les méthodes non destructives telles que l’adsorption (LONAPPAN et al., 2016), la coagulation (CRINI et BADOT, 2007), la filtration membranaire (ALLÈGRE et al., 2006), et les méthodes destructives telles que la photocatalyse (MURUGANANDHAM, 2004), l’ozonation (LIN et LIN, 1991) et l’oxydation (LIN et PENG, 1995).
Plusieurs de ces méthodes se sont avérées efficaces, mais leur application exige des coûts élevés. Parmi les méthodes dont les coûts sont modérés, l’adsorption se place en bonne position en matière d’efficacité. Pour éviter le problème des prix de revient élevés des charbons actifs, les recherches se sont focalisées sur le choix de certains adsorbants disponibles et bon marché (MCKAY et ALLEN, 1980).
L’adsorption consiste à fixer des molécules ou ions polluants, appelés adsorbats, sur des matériaux solides appelés adsorbants. Plusieurs matériaux minéraux tels que les argiles (BOUBERKA et al., 2005), les zéolites (ALPAT et al., 2008), ou organiques tels que les polymères synthétiques (DAOUD, 2000) et naturels (BOUHDADI et al., 2011), ou encore les composites tels que les nanoparticules de zinc (KATARIA et al., 2016) ont été testés à l’échelle de laboratoire. La modélisation statistique et mathématique de la cinétique et des isothermes de l’adsorption est souvent employée pour décrire le mode d’interactions adsorbat-adsorbant (SELLAOUI et al., 2015). Les modèles établis dans ce cas expriment une information approximative de ces interactions. Leur application de manière rigoureuse doit respecter trois paramètres essentiels : (i) comparaison des quantités adsorbées calculées théoriquement avec celles déterminées expérimentalement pour une saturation totale; (ii) le coefficient de régression r2 doit être le plus élevé possible (proche de l’unité) et enfin, (iii) les résultats doivent être en accord avec les paramètres thermodynamiques.
La sciure de bois a été utilisée en tant qu’adsorbant dans beaucoup de recherches, vu son prix de revient modéré (BELAID et KACHA, 2011; FERRERO, 2007; GARG et al., 2003; GARG et al., 2004; KHATTRI et SINGH, 2000; MALIK, 2003; ÖZACAR et SENGIL, 2005). Sa capacité d’adsorption est, dans beaucoup de cas, très modérée et ne peut être comparée à celle du charbon actif.
Le carton usagé fait partie des biomasses (bioadsorbants); il est constitué essentiellement de fibres cellulosiques végétales traitées, agglomérées en amas et se distingue par sa disponibilité et son coût négligeable. Il peut être utilisé en remplacement à la sciure du bois.
La présence de la couleur dans les eaux même en infime concentration est visible à l’oeil nu, elle est indésirable puisqu’elle perturbe la vie des écosystèmes (HU, 2001). Les colorants, suivant leur charge dans l’eau, sont classés en anioniques et cationiques. De ce fait, leurs interactions avec les biomasses sont tributaires, aussi bien, de leurs groupements actifs que des fonctions de surface offertes par les bio-adsorbants. Ces interactions peuvent être d’ordre physique (forces de Van Der Waals, ou liaisons hydrogène), chimique (liaisons covalentes, ioniques ou de coordinence) ou encore combiné (physiques et chimiques).
L’étude de la cinétique et les équilibres thermodynamiques de l’adsorption permettent d’apporter des réponses, d’une part, sur la faisabilité, le temps de réaction, les dosages mis en oeuvre et d’autre part, sur les mécanismes régissant le processus de l’adsorption.
Cette étude a pour objectif d’étudier l’élimination, par adsorption sur les particules du carton usagé, d’un colorant textile nommé Victoria Bleu Basique dans des eaux synthétiquement préparées. Il est cationique en solution aqueuse et appartient au groupe de colorants triarylméthane (KATARIA et al., 2016). La mise en valeur et la récupération du carton usagé, matériau très disponible et de coût négligeable est la tâche principale de cette étude. La sciure de bois a été utilisée dans cette étude à titre indicatif de comparaison. La cinétique et les isothermes ont été modélisées pour élucider les mécanismes régissant le processus de l’adsorption.
2. Matériel et méthodes
2.1 Matériaux
2.1.1 Sciure de bois
La sciure de bois utilisée dans cette étude est la même que celle utilisée précédemment (BELAID et KACHA, 2011). La fibre brute a été séchée à l’air libre avant d’être broyée et tamisée pour en extraire la fraction de particules de diamètre inférieur à 200 μm. La fraction ainsi sélectionnée a été lavée avec de l’eau distillée pendant 2 h, séparée de la solution par filtration sous vide, ensuite séchée à 80 °C pendant 48 h. L’opération est répétée plusieurs fois jusqu’à ce que le pH de la solution devienne neutre, ensuite la sciure de bois ainsi lavée a été stockée dans des sachets étanches en plastique.
2.1.2 Colorant
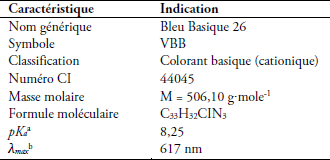
Le colorant considéré dans cette étude est de couleur bleue dénommé Victoria Bleu Basique (Sigma-Aldrich), de très haut degré de pureté (98 %); il a été fourni par la société Fluka Analytical (Afrique du Sud). La figure 1 et le tableau 1 présentent, respectivement, sa structure moléculaire et ses principales caractéristiques. Il a été utilisé tel qu’il a été fourni, sans aucune purification préalable. Les solutions colorées à déférentes concentrations ont été préparées par dilution à partir d’une solution mère de 250 mg∙L-1, à l’aide de l’eau distillée.
Figure 1
Structure chimique du colorant Victoria Bleu Basique
Chemical structure of Victoria Blue Basic dye
Tableau 1
Principales caractéristiques du colorant Victoria Bleu Basique
Main characteristics of Victoria Blue Basic dye
2.1.3 Carton usagé (CU)
Le carton usagé utilisé provient d’un emballage de téléviseurs plasma de marque Maxi Power, importé en Algérie via l’exportateur chinois China International Limited. L’échantillon a été séché à l’air libre, puis fragmenté et tamisé pour en extraire la fraction de particules de diamètre inférieur à 200 µm. La fraction ainsi sélectionnée a été séchée à 80 °C pendant 48 h, puis refroidie dans un dessiccateur et finalement stockée dans des sachets étanches en plastique.
2.1.4 Caractérisation du CU
Un échantillon de CU ainsi préparé a été caractérisé par différentes techniques. Pour étudier la morphologie externe, la structure et la composition du matériau à l'échelle nanométrique, nous avons utilisé un microscope électronique à balayage, couplé à la spectroscopie des rayons X à dispersion d’énergie (EDX) de type Quanta 250 à filament de tungstène, fabriqué par la compagnie FEI (Eindhoven, Hollande). Ce microscope est couplé à un système analytique complet de microanalyse EDS (EDAX AMTEK, Octane Pro, États-Unis) géré par le logiciel TEAM. Le microscope est muni d'un porte-échantillon en métal et de forme circulaire auquel est collé l’échantillon à analyser en utilisant un ruban adhésif de carbone hautement conducteur. Le dispositif contenant l’échantillon est placé ensuite dans la chambre intérieure du microscope sur un vernier permettant de déplacer le matériau et de réaliser le balayage.
La diffraction des rayons X a été réalisée à l’aide d’un puissant diffractomètre de la nouvelle gamme D8 Advance A 25 ECO (BRUKER, Allemagne), utilisant la radiation monochromatique Kα du cuivre (Cu Kα-radiation) (λ = 1,5406 A°), à la tension de 40 kV et le courant de 25 mA, travaillant avec la configuration θ-θ et géré par le logiciel EVA.
L’analyse par spectroscopie infrarouge a été réalisée sans préparation préalable des échantillons de CU, avant et après adsorption du colorant, à l’aide d’un spectromètre à transformée de Fourier (α ALPHA-T FTIR BRUKER, Allemagne), piloté par un logiciel Opus 6.5 et muni d’un accessoire de réflectance totale atténuée (ATR) en cristal de diamant robuste.
La surface spécifique BET du CU a été déterminée à l’aide d’un Micromeritics ASAP 2020 (Surface Area and Porosimetry Analyser, États-Unis). Le pH pour lequel la charge du matériau est égale à zéro (pHPZC) a été déterminé suivant la méthode indiquée par CRINI et BADOT (2007).
2.2 Méthodes
L'étude de l'adsorption du colorant sur les deux adsorbants a été réalisée dans un réacteur fermé en régime discontinu. Les conditions opératoires influençant le rendement de la réaction ont été déterminées. Au début de chaque expérience, une quantité bien déterminée d’adsorbant a été dispersée dans 100 mL de solution de concentration initiale C0 en colorant. Les mélanges réactionnels ont été agités à 600 rpm à l’aide d’un agitateur à barreau magnétique chauffant, à température réglable, pendant un temps bien déterminé, à 25 °C. À la fin de chaque expérience, l’adsorbant est séparé du mélange par centrifugation. La concentration résiduelle en colorant C est alors déterminée en utilisant un spectrophotomètre de type Colorimeter Fisher Bioblock scientific 1100, doté de cellules en verre cylindrique (Ø = 10 mm), à la longueur d’onde d’absorption maximale (λmax = 617 nm).
2.2.1 Influence du dosage de l’adsorbant
Pour situer l’influence du dosage de l’adsorbant sur l’adsorption du VBB, des masses croissantes de chaque matériau ont été ajoutées à des volumes de 100 mL de solutions colorées à 20 mg∙L-1 en VBB. Les mélanges sont agités pendant 1 h à une température de 25 °C. Les échantillons ainsi traités ont été centrifugés et la concentration résiduelle du colorant dans le surnageant a été déterminée par spectrophotométrie.
2.2.2 Effet du pH initial de la solution
Le comportement du colorant utilisé est très dépendant du pH de l’eau : au pH < 8, il est de couleur bleue et possède une longueur d’absorption maximale (λmax) égale à 617 nm, mais aux pH > 8, il acquiert une couleur rouge, conduisant au changement de sa λmax. Le tableau 1 indique que le pKa du colorant est égal à 8,25, ce qui explique que ce comportement est dû au fait que le colorant possède deux formes, selon que le pH de la solution soit au-dessus ou au-dessous de 8.
L’influence du pH sur l’adsorption d’une série de solutions colorées à 20 mg∙L-1 en VBB a été suivie. Le pH des solutions a été ajusté sur les valeurs de 3 à 7 en ajoutant quelques gouttes de solutions de HCl (0,1 N) ou de NaOH (1 N). Les dosages d’adsorbants utilisés sont, respectivement, 0,070 g pour la sciure de bois et de 0,025 g pour le carton usagé. Les mélanges ont été ensuite agités à 600 rpm pendant 60 min, à 25 °C. Les concentrations résiduelles en colorant ont été déterminées par spectrophotométrie.
2.2.3 Effet du temps de contact : cinétique
L’influence du temps de contact sur le rendement de la réaction a été suivie en utilisant, séparément, 0,070 g de SB et 0,025 g de CU dans des solutions colorées à 20 mg∙L-1 en VBB. Afin de déterminer le temps d’équilibre, les mélanges réactionnels ont été réglés sur les conditions opératoires de pH initial de la solution (pH = 6), de l’agitation magnétique (600 rpm) et de température de 25 °C.
2.2.4 Effet de la température : thermodynamique
L’étude de l’influence de la température lors de l’adsorption du VBB sur les deux solides a été réalisée aux températures de 288, 298, 308 et 318 K avec des volumes de 100 mL de solution colorée par le VBB à 20 mg∙L-1 et à pH = 6. Les dosages mis en oeuvre pour cette étude étaient de 0,07 g pour la sciure de bois et de 0,025 g pour le carton usagé. Les mélanges ont été agités jusqu’à l’équilibre sous une vitesse de 600 rpm. La concentration résiduelle du colorant a été déterminée par spectrophotométrie UV-Visible à la longueur d’onde λmax du colorant.
3. Résultats et discussion
3.1 Caractérisation du CU
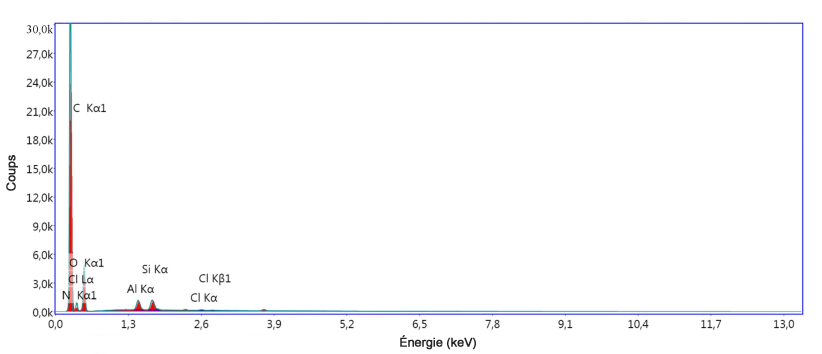
L’examen microscopique du CU à l’aide du microscope électronique à balayage (MEB) montre une structure filamentaire due à la présence de fibres cellulosiques constituées d'une suite de molécules de glucose. Ces fibres sont aussi bien courtes que longues et plus ou moins larges ou épaisses. Elles sont rangées de manière aléatoire, laissant apparaitre des cavités et des canaux (Figure 2). Le spectre EDX (Figure 3) indique que le matériau est composé essentiellement de carbone (51,03 %) et d’oxygène (44,87 %).
Figure 2
Image MEB du carton usagé
SEM image of used cardboard
Figure 3
Pics du spectre EDX du carton usagé
Peaks of the EDX spectrum of used cardboard
L’analyse du CU par rayons X montre que le matériau est constitué de 57,1 % d’un état amorphe et de 42,9 % d’un état cristallin. Cette faible cristallinité ne permet pas au matériau de développer une grande surface spécifique. Le diffractogramme DRX de l’échantillon (Figure 4) présente plusieurs pics caractéristiques de cellulose, de calcite et de cellulose ammoniacale, dont la teneur est respectivement égale à 50, 36,5 et 13,4 %.
Figure 4
Diffractogramme DRX du carton usagé
X-ray diffractogram of used cardboard
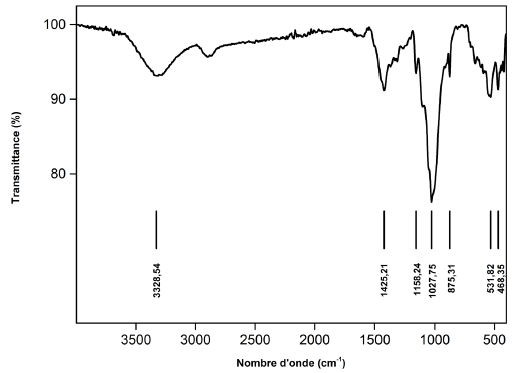
Le spectre IRTF du CU enregistré entre 400 et 4000 cm-1 est représenté sur la figure 5. Le spectre présente les caractéristiques de la cellulose, dont la bande large qui apparait entre 3 320 - 3 330 cm-1 liée à la vibration d'élongation de la liaison O–H. Celles observées à 872 et 659 cm-1 sont caractéristiques de la déformation par cisaillement de la liaison C–H dans le cycle aromatique. La bande de déformation des molécules d'eau peut être attribuée à celle observée aux environs de 1 580 cm-1. À 1 425 cm-1 on distingue la bande de la liaison C–C (aromatique). Les bandes caractéristiques liées à la vibration d'étirement O–C–C, apparaissent à 1 158 et 1 160 cm-1.
Figure 5
Spectre IRTF du carton usagé
FTIR spectrum of used cardboard
La surface spécifique du CU, déterminée à la pression relative p/p° = 0,296026227, a été trouvée égale à 1,0192 m2∙g-1. Le volume total des pores dont le diamètre est inférieur à 187,21 nm, déterminé à la pression relative p/p° = 0,989661564, est égal à 0,003640 cm3∙g-1 et la largeur moyenne des pores est de 14,28481 nm. La taille moyenne des particules est de l’ordre de 5,886 µm.
3.2 Effet du dosage de l’adsorbant
Le dosage de l’adsorbant est l’un des paramètres les plus influents dans le processus de transfert de matière pendant la réaction d’adsorption. Celui-ci assure un certain nombre de sites actifs capables d’interagir avec des molécules ou ions en solution. Néanmoins, ce dosage doit être bien étudié : un nombre de sites insuffisant crée une saturation non efficace, due à l’encombrement des espèces à adsorber autour des sites; par contre, un nombre de sites en excès favorise des interactions entre les sites occupés par les espèces adsorbées et ceux libres.
Le dosage des deux adsorbants a été étudié entre 0,005 et 0,900 g, pour le carton usagé et entre 0,200 et 1,000 g pour la sciure de bois. La figure 6 exprime la dépendance entre le dosage utilisé et le pourcentage d’élimination du colorant à partir de la solution. Il est aisé de voir que le carton usagé est plus efficace que la sciure de bois pour les faibles dosages; on atteint 94 % d’élimination avec un dosage de 0,025 g pour le carton usagé, alors qu’avec la sciure de bois ce pourcentage nécessite un dosage environ deux fois et demi supérieur (0,070 g) et la quantité de colorant extraite à ce niveau est de l’ordre de 75 mg∙g-1 et 28 mg∙g-1, respectivement pour le carton usagé et la sciure de bois.
Figure 6
Influence du dosage de l’adsorbant sur l’élimination du colorant Victoria Bleu Basique en solution aqueuse (C0 = 20 mg∙L-1, V = 100 mL, t = 1 h, v = 600 rpm, pH = 6, T = 25 °C)
Effect of the adsorbent dosage on Victoria Blue Basic dye removal from aqueous solution (C0 = 20 mg∙L-1, V = 100 mL, t = 1h, v = 600 rpm, pH = 6, T = 25°C)
Il est observé sur la figure 6 que la rétention du colorant augmente avec l’augmentation de la masse de l’adsorbant en solution pour les deux adsorbants, d’abord avec des quantités extraites importantes de colorant, ensuite un ralentissement de la fixation est observé au fur et à mesure que les masses des adsorbants deviennent conséquentes en solution. Enfin, un plateau indiquant un équilibre entre l’adsorption et la désorption est observé pour les masses supérieures. Ce phénomène est attribué à un épuisement du soluté dissout en solution.
3.3 Influence du pH initial
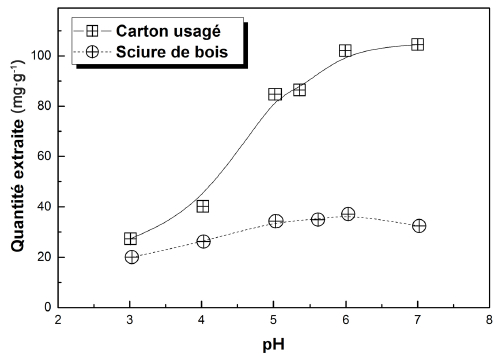
L’influence du pH initial des solutions colorées a été étudiée entre pH 3 et 7. Il n’était pas possible d’étendre cette échelle aux valeurs de pH supérieures pour garder la même forme du colorant pendant les manipulations. La figure 7 exprime cette dépendance pour des dosages de carton et de sciure de bois, respectivement égaux à 0,025 g et 0,07 g. Nous pouvons en retenir d’abord, que les deux adsorbants ont pratiquement le même comportement, avec une rétention maximale du colorant au pH situé entre 6 et 7. Le pH du milieu, pour lequel la charge portée par la surface du matériau est nulle (pHPZC), a été trouvé égal à 7,93, ce qui explique que le taux de rétention du colorant augmente avec l’augmentation du pH pour atteindre le maximum à pH = 7. Il a été obtenu 96 % d’élimination par le CU et 89 % d’élimination par la SB. Par ailleurs, les quantités fixées par le carton sont plus importantes comparées à celles fixées par la sciure de bois pour les dosages utilisés. Pour un pH initial égal à 6, les quantités extraites sont de l’ordre de 76 mg∙g-1 et 26 mg∙g-1, respectivement pour le CU et la SB.
Figure 7
Influence du pH initial des solutions sur la quantité extraite du colorant Victoria Bleu Basique (C0 = 20 mg∙L-1, mUC = 0,025 g, mSD = 0,07g, V = 100 mL, t = 1 h, v = 600 rpm, T = 25 °C)
Effect of initial pH of the solutions on Victoria Blue Basic dye extracted amounts (C0 = 20 mg∙L-1, mUC = 0.025 g, mSD = 0.07g, V = 100 mL, t = 1h, v = 600 rpm, T = 25°C)
3.4 Cinétique de l’adsorption
L’adsorption est le phénomène qui exprime le partage d’un soluté entre la solution où il est dissous et le solide sur lequel il se fixe. Ce phénomène a lieu aux interfaces solide-liquide et il est quantifié suivant le taux de transfert de masse de l’adsorbat par unité de masse de l’adsorbant. Comme il n’est pas toujours facile de préciser la surface exacte de l’adsorbant intervenant dans ce déplacement (CHITOUR, 2004), il sera utile de rapporter certaines informations concernant le mécanisme de ce déplacement depuis la solution jusqu’aux sites actifs de l’adsorbant. L’adsorption des colorants sur les bio-adsorbants a été avérée chimique dans beaucoup de cas (HO et MCKAY, 1998); cela implique que la réaction entre les groupements de surface de l’adsorbant et les ions du colorant basique en solution représente une étape non négligeable dans le processus de l’adsorption. Néanmoins, pour atteindre la surface interne du matériau, les processus de diffusion externe (interparticulaire) ou interne (intraparticulaire) peuvent aussi être pris en considération dans la détermination de l’étape limitante (BELAID et al., 2013).
3.4.1 Influence du temps de contact
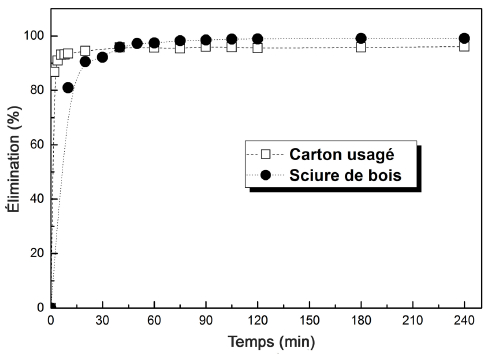
Le temps de contact a été suivi entre 0 et 240 min pour le carton usagé et la sciure de bois. La figure 8 montre que les allures des courbes se diffèrent l’une de l’autre : celle qui correspond au carton usagé présente deux pentes presque perpendiculaires, dont la première est verticale indiquant une fixation très rapide de quantités importantes de colorant pendant les 30 premières minutes de la réaction, et la deuxième est horizontale présentant un plateau d’équilibre à partir de 40 min. L’adsorption du colorant dans ce cas laisse supposer l’existence d’une grande affinité entre l’adsorbant et les cations du colorant, vu que la masse utilisée est relativement faible. Par contre, la fixation des molécules de colorant sur la sciure de bois semble moins rapide, ce qui est visible à partir de la figure 8. En effet, la courbe présente deux parties dont l’une indique que le pourcentage d’élimination augmente avec l’augmentation du temps de contact pendant les 60 premières minutes, puis l’équilibre est établi à partir de 70 min. Dans les deux cas, l’adsorption rapide des molécules du colorant est attribuée à l’existence de sites libres pendant les premières minutes, mais au fur et à mesure les sites se saturent et le nombre de sites libres est réduit. Les quantités extraites de colorant sont beaucoup plus importantes dans le cas du carton (>67 mg∙g-1 à 40 min) que celles extraites avec la sciure de bois (28 mg∙g-1 à 90 min).
Figure 8
Influence du temps de contact sur l’élimination du colorant Victoria Bleu Basique par les adsorbants (C0 = 20 mg∙L-1, mUC = 0,025 g, mSD = 0,07g, V = 100 mL, v = 600 rpm, pH = 6, T = 25 °C)
Effect of contact time on the Victoria Blue Basic dye removal by adsorbents (C0 = 20 mg∙L-1, mUC = 0.025 g, mSD = 0.07g, V = 100 mL, v = 600 rpm, pH = 6, T = 25°C)
3.4.2 Cinétique de pseudo-premier ordre
L’équation 1 de Lagergren (LAGERGREN, 1898) exprime la forme développée du pseudo-premier ordre :
![]() (1)
(1)
où qt (mg∙g-1) et qe (mg∙g-1) sont les quantités d’adsorbat extraites aux temps t et à l’équilibre, respectivement; k1 (min-1) est la constante de vitesse du pseudo-premier ordre.
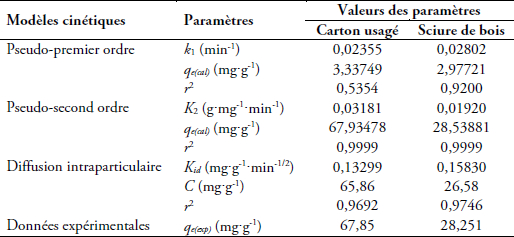
Les constantes du pseudo-premier ordre sont extrapolées à partir de la courbe log(qe - qt) vs t. Au vu des valeurs calculées de k1, qe et r2 pour les deux adsorbants (Tableau 2), il s’avère que le modèle du pseudo-premier ordre ne traduit pas bien la réaction d’adsorption. Ce modèle, en faveur d’une diffusion interparticulaire contrôlée (ALLEN et al., 2005), est désavoué par les valeurs expérimentales des quantités de colorant adsorbées.
Tableau 2
Paramètres cinétiques de l’adsorption du colorant Victoria Bleu Basique sur les deux adsorbants
Kinetic parameters of Victoria Blue Basic dye adsorption on adsorbents
3.4.3 Cinétique de pseudo-second ordre
L’équation 2 exprime la forme développée du pseudo-second ordre (HO et MCKAY, 1999) :
 (2)
(2)
qt (mg∙g-1) et qe (mg∙g-1) sont les quantités d’adsorbat extraites aux temps t et à l’équilibre, respectivement; k2 (g∙mg-1∙min-1) est la constante de vitesse du pseudo-second ordre.
En traçant les courbes 1/qtvst, il est facile de calculer, par extrapolation, les valeurs des constantes du pseudo-second ordre. La figure 9 représente l’application de ce modèle aux résultats obtenus expérimentalement. Au vu des valeurs des constantes, nous pouvons dire que le modèle du pseudo-second ordre traduit de manière efficace le processus d’adsorption (Tableau 2). Les valeurs de qe calculées pour les concentrations de colorant utilisées, reflètent bien celles obtenues expérimentalement pour les deux adsorbants, avec des coefficients de régression (r2) très proches de l’unité (Tableau 2). Cet ordre de réaction laisse prédire une chimisorption dont la diffusion intraparticulaire peut jouer un rôle important dans le contrôle de ce processus (HO et MCKAY, 1999).
Figure 9
Ajustement de l’adsorption du colorant Victoria Bleu Basique au modèle de pseudo-second ordre
Adjustment of Victoria Blue Basic dye adsorption to the pseudo-second order model
3.4.4 Phénomènes de diffusion
Ces phénomènes expriment le déplacement des molécules (ou ions) de la solution vers la surface du solide (l’adsorbant). Les deux types de diffusion, d’abord externe (diffusion interparticulaire) puis interne (diffusion intraparticulaire) peuvent parfois être des étapes limitatives pour un processus d’adsorption. Pour confirmer l’intervention de telle ou telle diffusion dans le processus global, les résultats expérimentaux doivent s’aligner sur leurs modèles mathématiques déjà établis (KUMAR, 2007).
3.4.4.1 Diffusion interparticulaire
La forme linéaire de l’équation de ce type de diffusion est donnée par l’équation 3 :
 (3)
(3)
où Ce (mg∙L-1) est la concentration à l’équilibre du soluté en solution; a est l’aire de l’interface solide/liquide; V est le volume de solution; k' est la constante de vitesse de la diffusion interparticulaire.
Le tracé de ln([C0 - Ce]/[Ct - Ce]) vst permet d’atteindre les valeurs des constantes de ce modèle. Au vu des valeurs obtenues de k' et de r2, nous constatons que ce modèle ne conduit pas à une bonne corrélation des points expérimentaux, pour les deux adsorbants, ce qui nous permet de dire que la diffusion interparticulaire ne représente pas une étape limitative dans le processus de l’adsorption du colorant sur les deux adsorbants. Les sites d’adsorption actifs que comportent les adsorbants sur leur surface externe sont facilement accessibles aux cations du colorant.
3.4.4.2 Diffusion intraparticulaire
La forme linéaire de l’équation de ce type de diffusion est donnée par l’équation 4 :
![]() (4)
(4)
où kid (mg∙g-1∙min-1/2) est la constante de vitesse de diffusion intraparticulaire; C est une constante.
Le tracé de qtvst1/2 qui représente une droite dont la pente est égale à kid et la coordonnée à l’origine égale à C qui peut, selon le cas, passer ou non par l’origine, permet d’atteindre les valeurs des constantes de ce modèle.
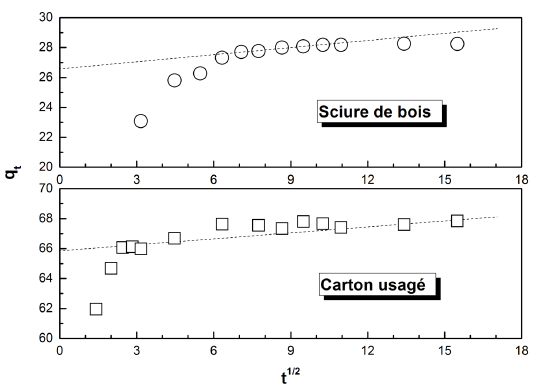
La figure 10 montre que la diffusion intraparticulaire, pas très représentative de la cinétique de l’adsorption dans les premières minutes du temps de contact, commence à avoir de l’importance au fur et à mesure que l’avancement de la réaction augmente. La réaction de surface est donc plus rapide dans les premières minutes du temps de contact, à cause de la disponibilité de sites libres sur la surface des deux matériaux. Le tableau 2 montre que les points expérimentaux peuvent être ajustés à ce modèle sur une large plage du temps de contact avec un bon coefficient de régression r2, en particulier avec la sciure de bois. Cela nous laisse dire que la diffusion intraparticulaire, négligeable au début de la réaction, devient une étape importante dans le contrôle de la cinétique du processus d’adsorption. KATARIA et al., (2016) indiquent que si la droite ne passe pas par l’origine (C ≠ 0), la diffusion intraparticulaire devient la seule étape limitative du processus d’adsorption.
Figure 10
Ajustement de l’adsorption du colorant Victoria Bleu Basique au modèle de diffusion intra-particulaire
Adjustment of Victoria Blue Basic dye adsorption to the intra-particle diffusion model
3.5 Influence de la température : thermodynamique
Dans beaucoup de cas, la température provoque des effets importants sur le phénomène de l’adsorption. Son augmentation favorise non seulement la mobilité des ions en solution, mais permet aussi aux molécules de l’adsorbat de pénétrer le plus loin possible dans les pores internes des particules de l’adsorbant. Cette augmentation aurait donc un effet sur la capacité d’adsorption.
L’influence de la température sur le taux de rétention du colorant sur les deux adsorbants a été étudiée entre T = 288 K et T = 318 K. La courbe de la figure 11 présente l’effet de la température dans les deux cas et montre que le taux de rétention augmente avec l'augmentation de la température, ce qui nous amène à dire que le processus de l’adsorption serait endothermique (ΔH° > 0).
Figure 11
Effet de la température sur l’adsorption du colorant Victoria Bleu Basique (C = 20 mg∙L-1, mUC = 0,025 g, mSB = 0,07 g, V = 100 mL, t = 40 min, v = 600 rpm, pH = 6)
Temperature effect on the adsorption of Victoria Blue Basic dye (C = 20 mg∙L-1, mUC = 0.025 g, mSB = 0.07 g, V = 100 mL, t = 40 min, v = 600 rpm, pH = 6)
Les équilibres thermodynamiques de l’adsorption peuvent être exprimés par les équations 5, 6 et 7 :
![]() (5)
(5)
![]() (6)
(6)
 (7)
(7)
où Kd (L∙g-1) est la constante de distribution; R (J∙mol-1∙K-1) est la constante des gaz parfaits; T (K) est la température absolue.
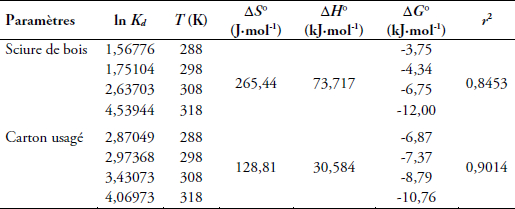
Le tracé de Kdvs (1/T) donne une droite dont la pente est égale à -ΔH°/R et l’ordonnée à l’origine égale à ΔS°/R. À partir de la figure 11, nous pouvons, par extrapolation, calculer les paramètres thermodynamiques de l’adsorption : l’enthalpie libre standard (ΔG°), l’enthalpie standard (ΔH°) et l’entropie standard (ΔS°). Le tableau 3 présente les résultats obtenus pour les deux adsorbants. Les valeurs des trois paramètres indiquent que le processus d’adsorption du colorant, dans les deux cas, est spontané (ΔG° < 0), endothermique (ΔH° > 0) et que de possibles interactions entre ions adsorbés et/ou les ions non adsorbés font augmenter l’entropie standard (ΔS° > 0). En plus, il est à supposer dans le cas du CU que la rétention des molécules du colorant ne se fait pas, peut-être, en simple monocouche, mais suivant une distribution particulière. SELLAOUI et al., (2015) indiquent que l’agitation thermique influe sur le nombre de couches adsorbées, créant une augmentation du désordre autour des sites. Cela conduit à l'augmentation de la quantité adsorbée en raison de l'adsorption endothermique qui n'est pas habituelle dans un phénomène classique d'adsorption. Par ailleurs, la valeur de ΔH°, calculée pour le CU est inférieure à 40 kJ∙mol-1, tandis que celle pour le cas de la SB, beaucoup plus grande, est supérieure à 40 kJ∙mol-1 (Tableau 3). Le type d’adsorption dans ce cas n’est pas le même pour les deux adsorbants.
Tableau 3
Paramètres thermodynamiques de l’adsorption du colorant Victoria Bleu Basique sur les deux adsorbants
Thermodynamic parameters of Victoria Blue Basic dye adsorption on adsorbents
3.6 Isothermes d’adsorption
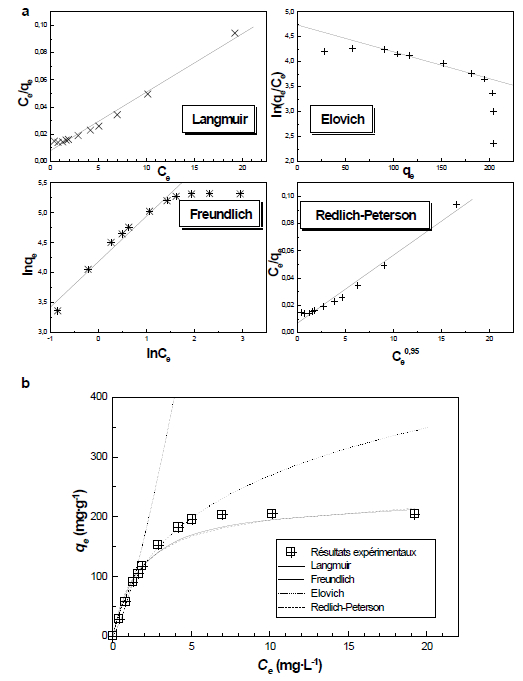
Ce sont les courbes tracées à température constante et exprimant les quantités de l’adsorbat, extraites de la solution, en fonction de la concentration résiduelle de l’adsorbat à l’équilibre [qe = f(Ce)]. Pour élucider le type de rétention de l’adsorbat sur l’adsorbant, plusieurs modèles à deux constantes (ex. Langmuir, Freundlich, Temkin et Elovich) d’une part et à trois constantes (ex. Redlich-Peterson, Langmuir-Freundlich et Toth) d’autre part, sont utilisés.
Pour situer le type de distribution des cations colorés sur les deux adsorbants, nous avons utilisé les quatre modèles suivants exprimant différentes distributions de l’adsorbat sur les sites de l’adsorbant : Langmuir, Freundlich, Elovich et Redlich-Peterson. Le modèle de Langmuir traduit une fixation en monocouche de l’adsorbat sur des sites de même énergie et sans interactions entre les molécules adsorbées.
La forme linéaire de l’équation de Langmuir est donnée par l’équation 8 :
![]() (8)
(8)
où qe (mg∙g-1) est la capacité d’adsorption à l’équilibre; qm (mg∙g-1) est la capacité d’adsorption de saturation et KL (L∙mg-1) est la constante de Langmuir.
Pour indiquer si l’adsorption est favorable ou non suivant ce modèle, on utilise généralement le paramètre RL, dit paramètre d’équilibre, exprimé par l’équation 9 :
![]() (9)
(9)
Celui-ci indique que l’adsorption est favorable lorsque (0 < RL < 1) et non favorable lorsque (RL > 1). Les constantes de ce modèle peuvent être calculées, par extrapolation, à partir de la droite Ce/qevsCe.
Le modèle de Freundlich assume que la distribution des cations de l’adsorbat se fait sur des sites de différentes énergies, avec possibilité d’interactions entre les cations de l’adsorbat. La valeur de (0 < 1/n < 1) indique que l’adsorption est favorable.
La forme linéaire de l’équation de Freundlich est donnée par l’équation 10 :
 (10)
(10)
où qe (mg∙g-1) est la capacité d’adsorption à l’équilibre; n et KF [(mg∙g-1(L∙mg-1)1/n] sont les constantes de Freundlich. Les constantes de ce modèle peuvent être calculées, par extrapolation, à partir de la droite log qevs log Ce.
La relation d’Elovich exprime l’évolution du recouvrement des sites d’adsorption, tout en avançant que le nombre de sites d’adsorption augmente exponentiellement avec l’adsorption, ce qui suppose une adsorption en multicouche. La forme linéaire de l’équation d’Elovich est donnée par l’équation 11 :
 (11)
(11)
où qe (mg∙g-1) et qm (mg∙g-1) sont les capacités d’adsorption à l’équilibre et de saturation respectivement et KE (L∙mg-1) est la constante d’Elovich. Le tracé de ln(qe/Ce) vsqe permet d’atteindre les valeurs de qm et KE.
Le modèle de Redlich-Peterson combine les paramètres des équations de Langmuir et ceux de Freundlich. Le mécanisme d’adsorption est hybride, il peut être appliqué à la fois au système homogène ou hétérogène et ne peut suivre une adsorption en monocouche idéale. Plusieurs auteurs (ALLEN et al., 2005; KUMAR, 2007) proposent d’utiliser ce modèle en phase liquide.
La forme linéaire de l’équation de Redlich-Peterson est donnée par l’équation 12 :
 (12)
(12)
où qe (mg∙g-1) et qm (mg∙g-1) sont les capacités d’adsorption à l’équilibre et de saturation respectivement; KL est la constante de Langmuir et n est la constante de Freundlich.
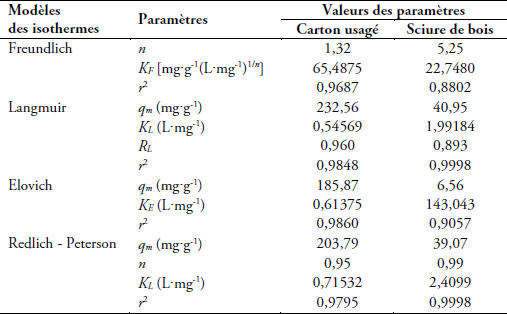
Le tableau 4 donne les valeurs calculées des constantes des quatre modèles, avec leurs coefficients de régression (r2) respectifs. De la revue des résultats de calcul, il ressort que le modèle qui reflète le mieux le phénomène d’adsorption des cations du colorant sur la sciure de bois est celui de Langmuir, qui s’ajuste bien sur tous les points déterminés expérimentalement, avec le paramètre d’équilibre RL trouvé égal à 0,893 (0 < RL < 1), ce qui signifie que l’adsorption est favorable. Le coefficient de régression r2 est aussi le meilleur par rapport aux autres modèles utilisés (r2 = 0,9998). La capacité d’adsorption calculée (qcalmax = 40,45 mg∙g-1) est pratiquement celle déterminée expérimentalement (40,95 mg∙g-1). Enfin, la forme non linéaire de ce modèle est superposable sur celle expérimentale (Tableau 4). Ceci nous amène à dire que la fixation du VBB sur la sciure de bois est réalisée en monocouche sur des sites d’adsorptions énergétiquement homogènes et sans interaction entre les cations adsorbés du colorant.
Tableau 4
Application des modèles des isothermes à l’adsorption du colorant Victoria Bleu Basique sur les deux adsorbants
Isotherm models applied for Victoria Blue Basic dye adsorption on adsorbents
Ces constatations faites dans le cas de la sciure de bois ne sont pas toujours valables dans le cas du carton usagé. En effet, et surtout pour les faibles concentrations, on observe que plus d’un modèle peut être valable pour exprimer le mode de rétention. Les modèles de Langmuir (adsorption en monocouche), d’Elovich et Redlich-Peterson (adsorption en multicouches) possèdent des r2 comparables (0,9848, 0,9860 et 0,9795, respectivement). D’autre part, les capacités d’adsorption (qcalmax = 233, 186 et 204 mg∙g-1) ne sont pas loin de celle déterminée expérimentalement (qexpmax = 205 mg∙g-1). Les formes non linéaires des équations des trois modèles passent par la majorité des points expérimentaux, ce qui laisse supposer que l’adsorption n’est, peut-être, pas traduite par aucun de ces modèles (Figure 12). SELLAOUI et al. (2015), indiquent que le phénomène d’adsorption est souvent contrôlé par quatre paramètres :
le nombre de molécules par site (n) qui représente le nombre de molécules qui seraient liées dans la solution juste avant l'adsorption et qui seraient adsorbées sur le site récepteur sous forme d'un agrégat, soit en une molécule par site ou deux molécules par site;
la densité des sites récepteurs, qui a une relation avec l’accessibilité aux sites par les molécules pendant l’agrégation;
le nombre total de couches, qui a une relation avec l’agitation thermique qui influe sur le nombre de couches adsorbées, créant une augmentation du désordre autour des sites;
la quantité adsorbée après saturation totale des sites, qui dépend de la température dont l’augmentation conduit à l'augmentation de la quantité adsorbée.
Figure 12
Isothermes d’adsorption du colorant Victoria Bleu Basique sur le carton usagé : a) formes linéaires et b) formes non linéaires
Adsorption isotherms of Victoria Blue Basic dye on used cardboard: a) linear forms and b) nonlinear forms
Toutes ces constatations nous conduisent à supposer que le mécanisme de la rétention sur le CU, matériau caractérisé par une surface spécifique modérée (S = 1, 0192 m2∙g-1) et une cristallinité faible, suit une distribution particulière qui reste à élucider.
Cette supposition est renforcée par les résultats de la thermodynamique, qui indiquent une augmentation de désordre (ΔS° > 0). La figure 13 est en accord avec cette supposition, puisqu’on y remarque une agglomération de particules sur la fibre du carton usagé.
Figure 13
Image MEB du carton usagé après adsorption du colorant Victoria Bleu Basique
SEM image of used cardboard after adsorption of Victoria Blue Basic dye
Les pics du spectre EDX du carton usagé après adsorption (Figure 14) indiquent l’apparition de ceux de l’azote (N) et du chlore (Cl) à la place de ceux du calcium (Ca) et du magnésium (Mg). Le spectre infrarouge du carton usagé après adsorption (Figure 15) va dans le même sens, puisqu’on y remarque la disparition de bandes et apparition de nouvelles bondes. À partir de ces deux figures, nous pouvons conclure qu’il y a eu effectivement une réaction entre le colorant et les fonctions de surface de l’adsorbant. L’étude de la fixation d’autres colorants comme adsorbats peut conduire à éclaircir le mécanisme de l’adsorption.
Figure 14
Pics du spectre EDX du carton usagé après adsorption du colorant Victoria Bleu Basique
Peaks of the EDX spectrum of used cardboard after adsorption of Victoria Blue Basic dye
Figure 15
Spectre FTIR du carton usagé après adsorption du colorant Victoria Bleu Basique
FTIR spectrum of used cardboard after adsorption of Victoria Blue Basic dye
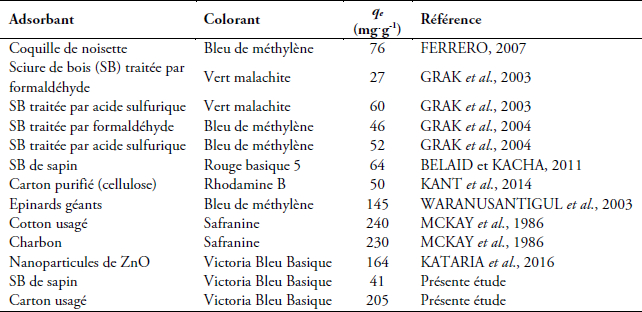
La comparaison des capacités d’adsorption des adsorbants utilisés dans cette étude avec celles d’autres adsorbants cités dans la littérature scientifique a été donnée sur le tableau 5. Les valeurs indiquées montrent que la capacité d’adsorption du carton usagé se place parmi les meilleures en matière de rétention des colorants basiques.
Tableau 5
Comparaison des capacités d’adsorption de certains adsorbants pour l’élimination des colorants basiques à partir des solutions aqueuses
Comparative adsorption capacities of certain adsorbents for basic dyes removal from aqueous solutions
4. Conclusion
L’adsorption du colorant VBB sur le carton usagé et la sciure de bois a fait l’essentiel de cette étude. L’étude des cinétiques, de la thermodynamique et des équilibres a été exploitée pour identifier les mécanismes de la rétention. La réaction de surface, plus rapide avec le carton usagé, suit le modèle de pseudo-second ordre dans les deux cas. Cet ordre de réaction est en faveur d’une chimisorption dont la diffusion intraparticulaire représente une étape non négligeable dans le contrôle de la cinétique du processus global d’adsorption.
L’adsorption s’effectue au pH situé entre 6 et 7, avec fixation de quantités plus importantes sur le carton usagé, pour les dosages utilisés. Le processus d’adsorption du colorant, dans les deux cas, est spontané (ΔG° < 0), endothermique (ΔH° > 0) et que de possibles interactions entre ions adsorbés et ceux en solution font augmenter l’entropie standard (ΔS° > 0). Les valeurs élevées de ΔH°, notamment dans le cas de la sciure de bois, indiquent qu’il s’agit bien d’une chimisorption.
Le modèle de Langmuir exprime bien les équilibres de l'adsorption sur la sciure, mais dans le cas du carton usagé, le mécanisme reste à déterminer, car aucun des modèles des isothermes ne peut exprimer seul ce mécanisme. Le conglomérat des molécules de colorant autour des sites d'adsorption est plus proche d’une distribution en multicouche que celle en monocouche.
Appendices
Remerciements
Les auteurs remercient vivement la Direction générale de la Recherche scientifique et du Développement technologique (DGRSDT) du Ministère de l’Enseignement supérieur et de la Recherche scientifique, Algérie, pour leur assistance financière, ainsi que le Centre de Recherche en Analyses physico-chimiques (CRAPC), Algérie, pour les analyses de caractérisation.
Référecens bibliographiques
- ALLÈGRE C., P. MOULIN, M. MAISSEU et F. CHARBIT (2006). Treatment and reuse of reactive dyeing effluents. J. Membr. Sci., 269, 15-34.
- ALLEN S.J., Q. GAN, R. MATTHEWS et P.A. JOHNSON (2005). Kinetic modeling of the adsorption of basic dyes by kudzu. J. Colloid Interface Sci., 286, 101-109.
- ALPAT S.K., Ö. ÖZBAYRAK, Ş. ALPAT et H. AKÇAY (2008). The adsorption kinetics and removal of cationic dye, Toluidine Blue O, from aqueous solution with Turkish zeolite, J. Hazard. Mater., 151, 213-220.
- BELAID K.D. et S. KACHA (2011). Étude cinétique et thermodynamique de l’adsorption d’un colorant basique sur la sciure de bois. Rev. Sci. Eau, 24, 131-144.
- BELAID K.D., S. KACHA, M. KAMECHE et Z. DERRICHE (2013). Adsorption kinetics of some textile dyes onto granular activated carbon. J. Env. Chem. Eng., 1, 496-503.
- BOUBERKA Z., S. KACHA, M. KAMECHE, S. ELMALEH et Z. DERRICHE (2005). Sorption study of an acid dye from an aqueous solutions using modified clays. J. Hazard. Mater., 119, 117-124.
- BOUHDADI R., M. EL MOUSSAOUITI, B. GEORGE, S. MOLINA et A. MERLIN (2011). Acylation de la cellulose par le chlorhydrate de chlorure de 3-pyridinoyl : application dans l’adsorption du plomb Pb2+. C. R. Chim., 14, 539-547.
- CHITOUR C.E. (2004). Physico-chimie des surfaces. Office des Publications Universitaires (OPU), Ben Aknoun, Alger, Algérie, 464 p.
- CRINI G. et P.M. BADOT (2007). Traitement et épuration des eaux industrielles polluées : Procédés membranaires, bioadsorption et oxydation chimique. Presses Universitaires de Franche-Comté, Besançon, France, 354 p.
- DAOUD M. (2000). Polymer adsorption. C. R. Acad. Sci. Ser. IV Phys., 1, 1125-1133.
- FERRERO F. (2007). Dye removal by low cost adsorbents: Hazelnut shells in comparison with wood sawdust. J. Hazard. Mater., 142, 144-152.
- GARG V.K., R. GUPTA, A.B. YADAV et R. KUMAR (2003). Dye removal from aqueous solution by adsorption on treated sawdust. Biores. Technol., 89, 121-124.
- GARG V.K., M. AMITA, R. KUMAR et R. GUPTA (2004). Basic dye (methylene blue) removal from simulated wastewater by adsorption using Indian Rosewood sawdust: a timber industry waste. Dyes and Pigments, 63, 243-250.
- HO Y.S. et G. MCKAY (1998). Kinetic models for the sorption of dye from aqueous solution by wood. Process Saf. Environ. Prot., 76, 183-191.
- HO Y.S. et G. MCKAY (1999). Pseudo-second order model for sorption processes. Process Biochem., 34, 451-465.
- HU T.L. (2001). Kinetics of azoreductase and assessment of toxicity of metabolic products from azo dyes by Pseudomonas luteola. Water Sci. Technol., 43, 261-269.
- KANT A., P. GAIJON et U. NADEEM (2014). Adsorption studies of rhodamine B from aqueous solution using low cost material: equilibrium and kinetics studies. Inter. J. of Current Res., 6, 7790-7796.
- KATARIA N., V.K. GARG, M. JAIN et K. KADIRVELU (2016). Preparation, characterization and potential use of flower shaped Zinc oxide nanoparticles (ZON) for the adsorption of Victoria Blue B dye from aqueous solution. Adv. Powder Technol., 27, 1180-1188.
- KHATTRI S.D. et M.K. SINGH (2000). Colour removal from synthetic dyewastewater using a bioadsorbent. Water Air Soil Pollut., 120, 283-294.
- KUMAR K.V. (2007). Pseudo-second order models for the adsorption of safranin onto activated carbon: comparison of linear and non-linear regression methods. J. Hazard. Mater., 142, 564-567.
- LAGERGREN S. (1898). Zur theorie der sogenannten adsorption gelöster stoffe. K. Sven. Vetenskapsakademiens Handl., 24, 1-39.
- LIN S.H. et C.M. LIN (1991). Decolorization of textile waste effluents by ozonation. J. Environ. Syst., 21, 143-156.
- LIN S.H. et C.F. PENG (1995). Treatment of textile wastewater by Fenton’s reagent. J. Environ. Sci. Health A, 30, 89-98.
- LONAPPAN L., T. ROUISSI, R.K. DAS, S.K. BRAR, A.A. RAMIREZ, M. VERMA, R.Y. SURAMPALLI et J.R. VALERO (2016). Adsorption of methylene blue on biochar microparticles derived from different waste materials. Waste Manag., 49, 537-544.
- MALIK P.K. (2003). Use of activated carbons prepared from sawdust and rice-husk for adsorption of acid dyes: a case study of Acid Yellow 36. Dyes and Pigments, 56, 239-249.
- MCKAY G. et S.J. ALLEN (1980). Surface mass transfer processes using peat as an adsorbent for dyestuffs. Can. J. Chem. Eng., 58, 521-526.
- MCKAY G., G. RAMPRASAD et P. PRATAPAMOWLI (1986). Equilibrium studies for the adsorption of dyestuffs from aqueous solution by low-cost materials. Water Air Soil Pollut., 29, 273-283.
- MURUGANANDHAM M. (2004). Photochemical oxidation of reactive azo dye with UV–H2O2 process. Dyes and Pigments, 62, 269-275.
- ÖZACAR M. et I. A. SENGIL (2005). Adsorption of metal complex dyes from aqueous solutions by pine sawdust. Biores. Technol., 96, 791-795.
- SELLAOUI L., H. GUEDIDI, S. KNANI, L. REINERT, L. DUCLAUX et A. BEN LAMINE (2015). Application of statistical physics formalism to the modeling of adsorption isotherms of ibuprofen on activated carbon. Fluid Phase Equilibria, 387, 103-110.
- WARANUSANTIGUL P., P. POKETHITIYOOK, M. KRUATRACHUE et E.S. UPATHAM (2003). Kinetics of basic dye (methylene blue) biosorption by giant duckweed (Spirodela polyrrhiza). Environ. Pollut., 125, 385-392.
List of figures
Figure 1
Structure chimique du colorant Victoria Bleu Basique
Chemical structure of Victoria Blue Basic dye
Figure 2
Image MEB du carton usagé
SEM image of used cardboard
Figure 3
Pics du spectre EDX du carton usagé
Peaks of the EDX spectrum of used cardboard
Figure 4
Diffractogramme DRX du carton usagé
X-ray diffractogram of used cardboard
Figure 5
Spectre IRTF du carton usagé
FTIR spectrum of used cardboard
Figure 6
Influence du dosage de l’adsorbant sur l’élimination du colorant Victoria Bleu Basique en solution aqueuse (C0 = 20 mg∙L-1, V = 100 mL, t = 1 h, v = 600 rpm, pH = 6, T = 25 °C)
Effect of the adsorbent dosage on Victoria Blue Basic dye removal from aqueous solution (C0 = 20 mg∙L-1, V = 100 mL, t = 1h, v = 600 rpm, pH = 6, T = 25°C)
Figure 7
Influence du pH initial des solutions sur la quantité extraite du colorant Victoria Bleu Basique (C0 = 20 mg∙L-1, mUC = 0,025 g, mSD = 0,07g, V = 100 mL, t = 1 h, v = 600 rpm, T = 25 °C)
Effect of initial pH of the solutions on Victoria Blue Basic dye extracted amounts (C0 = 20 mg∙L-1, mUC = 0.025 g, mSD = 0.07g, V = 100 mL, t = 1h, v = 600 rpm, T = 25°C)
Figure 8
Influence du temps de contact sur l’élimination du colorant Victoria Bleu Basique par les adsorbants (C0 = 20 mg∙L-1, mUC = 0,025 g, mSD = 0,07g, V = 100 mL, v = 600 rpm, pH = 6, T = 25 °C)
Effect of contact time on the Victoria Blue Basic dye removal by adsorbents (C0 = 20 mg∙L-1, mUC = 0.025 g, mSD = 0.07g, V = 100 mL, v = 600 rpm, pH = 6, T = 25°C)
Figure 9
Ajustement de l’adsorption du colorant Victoria Bleu Basique au modèle de pseudo-second ordre
Adjustment of Victoria Blue Basic dye adsorption to the pseudo-second order model
Figure 10
Ajustement de l’adsorption du colorant Victoria Bleu Basique au modèle de diffusion intra-particulaire
Adjustment of Victoria Blue Basic dye adsorption to the intra-particle diffusion model
Figure 11
Effet de la température sur l’adsorption du colorant Victoria Bleu Basique (C = 20 mg∙L-1, mUC = 0,025 g, mSB = 0,07 g, V = 100 mL, t = 40 min, v = 600 rpm, pH = 6)
Temperature effect on the adsorption of Victoria Blue Basic dye (C = 20 mg∙L-1, mUC = 0.025 g, mSB = 0.07 g, V = 100 mL, t = 40 min, v = 600 rpm, pH = 6)
Figure 12
Isothermes d’adsorption du colorant Victoria Bleu Basique sur le carton usagé : a) formes linéaires et b) formes non linéaires
Adsorption isotherms of Victoria Blue Basic dye on used cardboard: a) linear forms and b) nonlinear forms
Figure 13
Image MEB du carton usagé après adsorption du colorant Victoria Bleu Basique
SEM image of used cardboard after adsorption of Victoria Blue Basic dye
Figure 14
Pics du spectre EDX du carton usagé après adsorption du colorant Victoria Bleu Basique
Peaks of the EDX spectrum of used cardboard after adsorption of Victoria Blue Basic dye
Figure 15
Spectre FTIR du carton usagé après adsorption du colorant Victoria Bleu Basique
FTIR spectrum of used cardboard after adsorption of Victoria Blue Basic dye
List of tables
Tableau 1
Principales caractéristiques du colorant Victoria Bleu Basique
Main characteristics of Victoria Blue Basic dye
Tableau 2
Paramètres cinétiques de l’adsorption du colorant Victoria Bleu Basique sur les deux adsorbants
Kinetic parameters of Victoria Blue Basic dye adsorption on adsorbents
Tableau 3
Paramètres thermodynamiques de l’adsorption du colorant Victoria Bleu Basique sur les deux adsorbants
Thermodynamic parameters of Victoria Blue Basic dye adsorption on adsorbents
Tableau 4
Application des modèles des isothermes à l’adsorption du colorant Victoria Bleu Basique sur les deux adsorbants
Isotherm models applied for Victoria Blue Basic dye adsorption on adsorbents
Tableau 5
Comparaison des capacités d’adsorption de certains adsorbants pour l’élimination des colorants basiques à partir des solutions aqueuses
Comparative adsorption capacities of certain adsorbents for basic dyes removal from aqueous solutions