Abstracts
Résumé
Les toxines cyanobactériennes sont des contaminants importants des écosystèmes aquatiques et constituent un risque pour la santé humaine. Les cyanobactéries peuvent libérer des toxines dans l’eau, particulièrement lors de la lyse des cellules qui se produit souvent au moment de leur passage à travers la filière conventionnelle de potabilisation des eaux. Dans cet article de revue de la littérature, les normes sur la qualité de l’eau concernant les toxines ainsi que les principales méthodes de détection des toxines sont d’abord présentées. Les méthodes d’élimination des cyanobactéries et des cyanotoxines sont ensuite décrites et leur performance discutée. Les procédés conventionnels présentés sont la coagulation/floculation, la clarification, la filtration sur sable, l’utilisation du charbon actif ainsi que l’oxydation chimique par chloration ou par le permanganate de potassium. Les méthodes alternatives présentement en développement pour optimiser les systèmes actuels de potabilisation des eaux ou remplacer les technologies conventionnelles trop peu efficaces pour l’élimination des polluants émergents (par ex., les procédés d’oxydation avancée et la filtration membranaire) sont également présentées. Des procédés conventionnels tels que la chloration peuvent s’avérer inadéquats, notamment par leur manque de fiabilité pour l’oxydation des cyanotoxines et par le risque encouru suite à la formation de sous-produits toxiques (par ex., les organochlorés). Des méthodes alternatives telles que la combinaison d’ozone et de peroxyde d’hydrogène permettent une oxydation fiable des cyanotoxines en assurant un effet rémanent à la sortie du contacteur. Ce type de traitement peut être facilement mis en oeuvre dans les usines de potabilisation des eaux possédant déjà une unité d’ozonation. L’utilisation du charbon actif, notamment sous forme de poudre, peut être efficace lors de contaminations ponctuelles par les fleurs d’eau de cyanobactéries. Ce document fait ainsi une synthèse de ces procédés chimiques, physiques ou physico-chimiques contribuant à l’élimination des cyanotoxines et des cyanobactéries lors de la potabilisation des eaux.
Mots-clés :
- Cyanobactérie,
- cyanotoxine,
- microcystine,
- traitement de l’eau,
- potabilisation des eaux,
- eau potable,
- oxydation,
- filtration
Abstract
Cyanobacterial toxins are important contaminants of aquatic ecosystems and present a risk for human health. Cyanobacteria can release toxins in water, particularly following cell lysis, which often happens during their passage through a conventional water treatment plant. In this literature review, water quality guidelines for the elimination of cyanotoxins and major detection methods of cyanotoxins are briefly presented. The processes used for cyanobacteria and cyanotoxin removal from drinking water are then reviewed and their performance discussed. The conventional methods presented are: coagulation/flocculation, clarification, sand filtration, activated carbon and chemical oxidation with chlorination or potassium permanganate. Alternative methods that are presently developed to enhance existing treatment plants or to replace conventional technologies that are less effective in removing emergent pollutants (e.g., advanced oxidation processes and membrane filtration) are also presented. Conventional methods such as chlorination can be inappropriate, notably because of their inability to fully oxidize cyanotoxins and the associated risk of formation of toxic by-products (e.g., organochlorinated compounds). Alternative methods such as the combination of ozone and hydrogen peroxide are more reliable to eliminate cyanotoxins, with a residual effect downstream from the treatment contactor. In addition, this type of treatment can be easily implemented in water treatment plants that are already using ozonation. The use of activated carbon, notably in the form of powder, can be efficient in the case of point contamination by cyanobacterial blooms. This document aims to synthesize these chemical, physical and physico-chemical methods to eliminate cyanotoxins and cyanobacteria during the treatment of drinking water.
Keywords:
- Cyanobacteria,
- cyanotoxin,
- microcystin,
- drinking water,
- water treatment,
- oxidation,
- filtration
Article body
1. Introduction
Le développement de fleurs d’eau de cyanobactéries est une problématique répandue à l’échelle mondiale et leur fréquence d’apparition connaît une augmentation importante depuis les dernières décennies (CHEN et al., 2003). Au Québec, par exemple, les fleurs d’eau de cyanobactéries ont touché 156 plans d’eau en 2007 et 138 plans d’eau en 2008 (MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L’ENVIRONNEMENT ET DES PARCS, 2008). Au moins 40 stations québécoises de production d’eau potable s’alimentent dans les eaux de surface de systèmes aquatiques perturbés ou ayant été perturbés par les fleurs d’eau (ELLIS, 2008). Les fleurs d’eau de cyanobactéries sont responsables de la dégradation de l’aspect esthétique des plans d’eau ainsi que de la production de différents types de composés malodorants et de toxines. Le risque sanitaire associé aux cyanotoxines est sans doute l’impact négatif le plus important. Plus de 40 espèces de cyanobactéries toxiques sont connues, mais ce potentiel toxique ne s’exprime pas en tout temps (CARMICHAEL, 2001; CHORUS et BARTRAM, 1999). Le risque sanitaire est influencé par le type et la concentration de cyanotoxines ainsi que par la période d’exposition des organismes (CHORUS et BARTRAM, 1999).
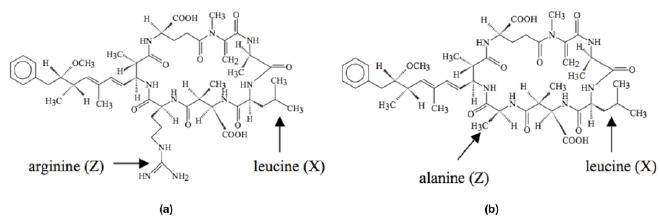
Les cyanotoxines peuvent se retrouver sous forme intracellulaire (dans la cyanobactérie) ou extracellulaire (libérée dans l’eau). Les effets sur la santé sont multiples et permettent de distinguer plusieurs classes de cyanotoxines. Les hépatotoxines, représentées par les microcystines (MC) (cf. Liste des abbréviations à la fin), la cylindrospermospine (CYN) et la nodularine (NOD) causent des dommages au foie. Les neurotoxines anatoxine-a (ANT), saxitoxine (SAX) et CYN endommagent le système nerveux. Les CYN sont également cytotoxiques car elles dérèglent le fonctionnement des cellules et elles sont génotoxiques par leurs effets délétères sur les gènes. Pour leur part, les dermatotoxines, représentées par les lipopolysaccharides (LPS), sont présentes dans les parois cellulaires de nombreuses espèces de cyanobactéries et exercent un effet irritant pour la peau (CARMICHAEL, 2001; FALCONER et HUMPAGE, 2005). La microcystine (MC) est la cyanotoxine la plus couramment observée et étudiée. Bien que plus de 70 variantes de MC soient connues, l’hépatotoxine MR-LR est la plus commune et particulièrement toxique, avec une LD50 aussi faible que 50 µg•kg-1 dans certaines conditions (RODRIGUEZ et al., 2008). La MC est un peptide cyclique hydrophobe constitué de sept acides aminés et ayant conservé le groupement Adda (acide 3-amino-9-methoxy-2,6,8-trimethyl-10-phenyldeca-4,6-dienoique) (SIVONEN et JONES, 1999). Les variantes de cette molécule proviennent généralement de la substitution de deux acides aminés entre les positions 2 et 4 (Figure 1) ou du retrait/ajout d’un groupement méthyle en positions 3 et 7. Les MC ont un diamètre de 3 nm et un poids moléculaire de 900 à 1 100 Da (LEE et WALKER, 2008). Leur structure moléculaire leur confère une toxicité variable et influence leur degré de résistance aux conditions ambiantes (AGENCE FRANÇAISE DE SÉCURITE SANITAIRE DES ALIMENTS et AGENCE FRANÇAISE DE SECURITÉ SANITAIRE DE L’ENVIRONNEMENT ET DU TRAVAIL, 2006; CHORUS et BARTRAM, 1999). La MC a été identifiée chez au moins 11 genres de cyanobactéries, dont Microcystis, Anabaena et Oscillatoria. La CYN est couramment retrouvée en milieu naturel et elle a été observée chez cinq genres de cyanobactéries, dont Aphanizomenon, pouvant s’accumuler dans le métalimnion plutôt qu’en surface (donc plus difficile à détecter). La cyanotoxine ANT est moins répandue mais elle est pourtant reconnue pour être présente chez au moins neuf genres de cyanobactéries (CHORUS et BARTRAM, 1999).
Figure 1
Structure des molécules de (a) MC-LR et de (b) MC-LA (tirée de COOK et NEWCOMBE, 2008).
Molecular structures of (a) MC-LR and (b) MC-LA (from COOK and NEWCOMBE, 2008).
L’Organisation Mondiale de la Santé (OMS; normes sur la qualité de l’eau) ainsi que plusieurs pays proposent une limite pour l’eau potable de 1 µg•L-1 pour les MC et indiquent également des seuils de concentration pour les SAX, ANT et CYN (Tableau 1). D’après RODRIGUEZ et al. (2007), davantage de travaux sont nécessaires pour être en mesure de formuler des recommandations tenant compte de tous les facteurs d’interférence et permettant d’optimiser les méthodes d’élimination des cyanotoxines dans l’eau potable. Étant donné que la revitalisation des écosystèmes et le contrôle des fleurs d’eau semblent être difficilement réalisables à courte échéance, il est nécessaire de développer des filières de potabilisation des eaux qui soient suffisamment performantes. Cette efficacité est primordiale pour la santé des citoyens qui boivent l’eau puisée dans les sources d’eau présentant un fort potentiel de perturbation par les cyanobactéries. Les usines de potabilisation des eaux devraient s’adapter en intégrant, par exemple, à moindre coût, les procédés d’oxydation avancée pouvant éliminer les micropolluants organiques tels que les cyanotoxines.
Tableau 1
Normes sur la qualité de l'eau pour les cyanotoxines (adapté de HOEGER et al., 2005).
Water quality guidelines for cyanotoxins (adapted from HOEGER et al., 2005).
L’efficacité d’une usine de traitement d’eau pour l’élimination de ce type de polluants (cyanotoxines) dépend de plusieurs paramètres : la concentration totale des cyanotoxines, la structure moléculaire ainsi que la nature intracellulaire ou extracellulaire des toxines qui contaminent une prise d’eau (WESTRICK, 2008). Ces substances sont en général des macromolécules complexes qui comportent plusieurs groupements fonctionnels ou groupes chromophoriques tels que les groupements carboxyliques (-COOH), hydroxyle (OH), amine (-NH2) ou carbonyle (-CO) (Figure 1). En fonction de la disposition et de la nature de ces groupements, ces molécules possèdent des sites potentiellement réactifs vis-à-vis des oxydants. Par exemple, les groupements donneurs d’électrons (-OH, -NH2, etc.) entraînent une augmentation de la densité électronique autour du noyau aromatique qui induit une augmentation de la réactivité de ces composés. À l’inverse, les groupements attracteurs d’électrons (-CHO, -CO, etc.) diminuent la densité électronique et sont par conséquent moins réactifs vis-à-vis des oxydants tels que le chlore (DORÉ, 1989). Les MC extracellulaires sont particulièrement problématiques car elles sont chimiquement stables en solution et sous le rayonnement solaire (TSUJI et al., 1994). De plus, les cyanotoxines dissoutes dans l’eau posent un problème sérieux aux gestionnaires, car ces contaminants échappent pour la plupart au traitement classique de potabilisation des eaux, comprenant la coagulation/floculation, la décantation, la filtration et la chloration (ELLIS, 2008; HIMBERG et al., 1989; KEIJOLA et al., 1988). Des stratégies efficaces de traitement devront être adoptées dans les usines de potabilisation des eaux pour atteindre de manière optimale les normes ou les recommandations concernant la qualité de l’eau potable qui évoluent vers une sévérité croissante (WANG et al., 2007). De nombreux procédés ont été développés afin d’optimiser l’élimination des cyanotoxines, incluant le prétraitement avec d’autres oxydants que le chlore (par ex., O3, O3/H2O2), le charbon actif (CA), la filtration membranaire et la photolyse par rayonnement ultraviolet (UV) employée seule ou en combinaison avec l’ozone (WESTRICK, 2008). De plus, les riverains d’un plan d’eau qui s’y alimentent directement sont davantage exposés à un risque. Des unités de traitement efficaces de type résidentiel devraient être accessibles dans de tels cas, mais elles ne sont pas encore disponibles sur le marché.
Les objectifs de cette étude sont de produire une revue de la littérature sur les procédés d’élimination des cyanotoxines et des cyanobactéries et de discuter de leurs limites, efficacité, et applicabilité dans les usines de potabilisation des eaux.
2. Sources d’eau et évaluation de la toxicité
En présence de fleurs d’eau de cyanobactéries, des mesures immédiates ou à court terme peuvent être adoptées afin de minimiser les risques pour la santé. Notons, par exemple, des techniques de prélèvement sélectif permettant d’éviter de puiser l’eau contaminée en repositionnant périodiquement les prises d’eau à des profondeurs où la biomasse des cyanobactéries est réduite (FALCONER, 2005). Cette approche est basée sur une connaissance du patron de distribution verticale des populations de cyanobactéries, un phénomène qui varie dans le temps (de façon diurne et saisonnière) et propre à chaque plan d’eau (LAVOIE et al., 2007). Ce prélèvement sélectif peut également être réalisé en aval d’une zone de filtration sur sable (bank filtration) ou encore être protégé par des barrières qui restreignent le déplacement des fleurs d’eau à la surface des plans d’eau (HRUDEY et al., 1999). Ces méthodes visant à optimiser le choix du site ou la profondeur de prélèvement de l’eau peuvent être efficaces pour réduire la quantité de cyanobactéries dans l’eau brute, et conséquemment réduire la quantité de toxines intracellulaires qui arrivent à l’usine de potabilisation. Par contre, ces méthodes sont peu efficaces dans plusieurs situations, par exemple, lorsque la communauté de cyanobactéries est distribuée de façon uniforme dans le plan d’eau.
Pour évaluer la performance d’un procédé d’élimination (ou de neutralisation) des cyanotoxines, il est important de tenir compte des méthodes utilisées pour mesurer la toxicité dans l’eau brute ainsi que du type de témoin analytique employé lors des études de performance. L’efficacité variable de ces méthodes pourrait compromettre la robustesse des conclusions présentées dans les études de performance des usines de potabilisation des eaux. Il est donc nécessaire de tenir compte des méthodes de mesures et de leur limitation lors de la comparaison des procédés d’élimination des cyanotoxines (BARBEAU et al., 2008; HOEGER et al., 2005). Les analyses utilisées pour certifier un procédé d’élimination des cyanotoxines sous les seuils établis nécessitent une expertise et des équipements spécialisés (CHORUS et BARTRAM, 1999). D’après HARADA (1999), aucune technique ne permet de mesurer adéquatement l’ensemble des cyanotoxines. Par exemple, les résultats obtenus à l’aide de trois méthodes d’analyse de toxines (PPIA, Adda-ELISA, HPLC) varient selon les conditions d’utilisation (CHOI et al., 2007; HOEGER et al., 2005). La méthode PPIA mesure l’interaction biochimique entre les toxines et l’unité catalytique des phosphatases (fonction cellulaire vitale). L’efficacité du procédé de purification de l’eau est évaluée par le degré d’inhibition de la réaction entre la toxine et les récepteurs des protéines phosphatases lorsque la structure de la molécule est altérée. Bien que la méthode PPIA soit peu spécifique, elle est simple et peut être utilisée pour le dépistage des microcystines dans l’eau (VAN APELDOORN et al., 2007). Une méthode standard qui combine un système HPLC et une analyse spectrophotométrique dans l’UV est proposée par l’Organisation internationale de normalisation pour doser trois variantes de microcystines (MC-LR, -RR et -YR) (INTERNATIONAL ORGANISATION FOR STANDARDISATION, 2005).
La chromatographie liquide couplée à la spectrométrie de masse (LC-MS) est une méthode d’analyse de toxines couramment utilisée (QUILLIAM, 1998). Une combinaison des méthodes LC-MS et MS (tandem de spectromètres de masse) permet l’identification de plusieurs types de toxines dans des échantillons naturels complexes. Au Québec, cette méthode est utilisée par le Centre d’expertise en analyse environnementale du Québec pour l’analyse des anatoxines-a, des nodularines et des microcystines (MC-LA, -LF, -LR, -LY, -LW, -RR, -YR) (CEAEQ, communication personnelle). L’utilisation de la chromatographie liquide ne permet de doser que les toxines pour lesquelles des standards sont disponibles sur le marché, ce qui mène à une sous-estimation de la concentration totale des MC (HOEGER et al., 2005). À notre connaissance, seules sept des 70 variantes connues de MC sont commercialisées (MC-LA, -LF, -LR, -LY, -LW, -RR, -YR).
Les sondes moléculaires fluorescentes fournissent de nouvelles méthodes de détection des cellules de cyanobactéries et des cyanotoxines. Trois catégories principales de sondes moléculaires ont été conçues : les sondes lectines qui ciblent des cellules entières, les sondes anticorps qui ciblent des molécules extraites telles que les cyanotoxines et les sondes ADN qui ciblent les gènes responsables de la synthèse de toxines. Ces méthodes moléculaires sont en constant développement, et, à notre connaissance, seules des sondes de type lectine et les tests de type ELISA sont disponibles sur le marché. La méthode Adda-ELISA détecte l’ensemble des molécules ayant un groupement Adda libre (microcystines et nodularines) (VAN APELDOORN et al., 2007). Cette méthode détecte les molécules qui auraient pu être dégradées pendant les manipulations, ce qui assure un dosage des cyanotoxines plus performant comparativement à la méthode PPIA (HOEGER et al., 2005). Par contre, les sondes moléculaires fluorescentes doivent être calibrées et adaptées aux caractéristiques régionales du site d’étude afin de tenir compte de la variabilité génétique entre les espèces en fonction de leur aire de répartition géographique (SCHOLIN et al., 2003).
Les études sur l’élimination des cyanobactéries et des cyanotoxines ont surtout été réalisées en laboratoire (ROSITANO et al., 2001) ou elles étaient orientées vers un procédé à l’échelle pilote (CHOW et al., 1999). Peu d’études ont évalué la performance d’une filière de potabilisation des eaux (HOEGER et al., 2005; JURCZAK et al., 2005; RAPALA et al., 2002).
3. Méthodes conventionnelles d’élimination des cyanotoxines
3.1 Coagulation et floculation
La coagulation/floculation des cellules cyanobactériennes et leur élimination subséquente assurent par la même occasion l’élimination des cyanotoxines intracellulaires. Des études récentes ont démontré que le type de coagulant influence la formation des flocs de M. aeruginosa (TEIXEIRA et ROSA, 2006). Par exemple, un coagulant fortement basique (60-70 % de basicité relative) constitué de polychlorosulfate basique d’aluminium (WAC, water aluminium chloride) induit la formation de flocs plus volumineux, comparativement à l’utilisation d’alun (Al2(SO4)3). Les flocs formés à l’aide de WAC décantent plus facilement mais ils seront difficiles à faire flotter (TEIXEIRA et ROSA, 2006). D’après CHOW et al. (1997; 1999) et DRIKAS et al. (2001), un procédé de coagulation et floculation assure un abattement de trois unités logarithmiques de cellules cyanobactériennes (M. aeruginosa, Anabaena circinalis) sans endommager l’intégrité des parois cellulaires de façon significative ni libérer de toxines. Une culture unicellulaire de M. aeruginosa de forme sphérique et chargée négativement peut être uniquement éliminée par déstabilisation et neutralisation des charges (coagulation seule), alors qu’une culture coloniale de M. aeruginosa requiert une coagulation suivie d’une floculation (agrégation des particules à l’aide de polymère) (BERNHARDT et CLASEN, 1991).
D’après SVRCEK et SMITH (2004), aucun coagulant ne démontre de potentiel satisfaisant pour l’élimination des toxines dissoutes (extracellulaires). Les travaux de ROSITANO et NICHOLSON (1994) ont démontré l’inefficacité des traitements avec des coagulants comme le sulfate ferrique et l’alun pour éliminer les MC dissoutes. Une autre étude a permis d’observer une faible élimination des MC, soit jusqu’à 39 %, lors de l’utilisation de 60 mg•L-1 d’alun dans une filière de potabilisation des eaux (LAMBERT et al., 1996). Ainsi, selon les données actuelles, la coagulation est inefficace pour l’élimination des toxines extracellulaires (DRIKAS et al., 2001; KEIJOLA et al., 1988), mais elle peut être efficacement employée pour éliminer les toxines intracellulaires si la lyse des cellules est évitée. La lyse des cellules de cyanobactéries entraînant une libération de toxines intracellulaires se produit en cas de stress mécanique ou chimique (SCHMIDT et al., 2002).
3.2 Décantation
Le type de clarificateur ou de décanteur utilisé peut avoir un effet sur le taux d’élimination de cellules cyanobactériennes. Un plus long temps de rétention de l’eau dans l’unité de décantation (DE) favorise l’élimination. Par exemple, les clarificateurs avec lit de boue (sludge blanket) permettent d’atteindre jusqu’à 90 % d’élimination des cellules et sont plus efficaces que les décanteurs statiques classiques (MOUCHET et BONNELYE, 1998). Les boues doivent être gérées de façon appropriée car la lyse des cellules et la libération de toxines ont été observées dans les boues de clarificateurs (DRIKAS et al., 2001). Cette libération des toxines intracellulaires atteint parfois 100 % après 48 heures (SIVONEN et JONES, 1999).
Lorsque l’eau brute est faiblement turbide, les flocs formés pendant la coagulation-floculation sont généralement peu denses et flottent mieux qu’ils ne décantent, et ce, dépendamment du type de coagulant et de polymère utilisé. La flottation à air dissous (FAD) est alors l’étape de clarification à prioriser (LETTERMAN, 1999). Cette étape est réalisée en saturant l’eau d’air par pressurisation. La pressurisation constitue la technique de production de microbulles la plus répandue. Les bulles (50 à 70 µm) sont obtenues par détente d’une solution enrichie en air dissous sous une pression de quelques bars (trois à huit bars). Il est important de noter que dans le système de FAD, c’est une partie de l’eau traitée qui est pressurisée et non pas l’eau brute. Les microbulles générées entraînent les flocs dans leur déplacement vers la surface de l’eau. Ce processus de FAD est généralement plus efficace que la sédimentation pour la clarification d’eau où la densité algale est élevée (LETTERMAN, 1999). Les algues possèdent certaines caractéristiques (petite taille, faible densité cellulaire et charge négative à la surface des cellules) qui favorisent leur flottation (TEIXEIRA et ROSA, 2006). De plus, certaines cyanobactéries telles que Microcystis aeruginosa (Figure 2) possèdent des vacuoles gazeuses qui leur permettent de migrer verticalement dans la colonne d’eau (OLIVER et GANF, 2000), ce qui pourrait favoriser la flottation. La FAD préserve davantage l’intégrité des cellules par comparaison à la décantation, diminuant ainsi la libération des toxines intracellulaires. Par ailleurs, les boues des procédés de flottation sont retirées plus fréquemment que dans les procédés de sédimentation, ce qui limite les risques de lyse des cellules. HRUDEY et al. (1999) citent plusieurs études où les processus de FAD atteignent différents rendements d’élimination des cyanobactéries. Les résultats indiquent que l’efficacité varie selon les espèces étudiées. Jusqu’à 80 % de cellules de Microcystis et 100 % de cellules d’Anabaena peuvent être éliminées, dépendamment de la taille des microorganismes. En effet, la flottabilité de ces microorganismes (pouvant être ici assimilés à des colloïdes) dépend de la probabilité de rencontre avec les bulles d’air et elle est d’autant plus grande que les microorganismes sont petits. En général, plus le rapport surface/volume des microorganismes (surface spécifique) est grand, mieux ils peuvent être fixés par les bulles. Par contre, cette méthode semble inefficace pour éliminer les cellules d’Oscillatoria (30 % d’élimination) dans les conditions de l’étude rapportées par HRUDEY et al. (1999).
Une étude récente compare l’efficacité de deux combinaisons de filières de potabilisation des eaux, soit CO/FL/FAD et CO/FL/DE, pour éliminer les cellules de M. aeruginosa sans les endommager (TEIXEIRA et ROSA, 2006). Leurs essais démontrent que la filière incluant la FAD offrait un meilleur rendement que la filière incluant la DE, soit de 93 à 98 % d’élimination de la biomasse (chlorophylle a), combiné à une faible libération des toxines (8 à 15 %) lorsque les conditions d’opération suivantes étaient appliquées : un faible taux de recyclage (8 %), une dose de coagulant de 3 mg Al2O3•L-1, une coagulation avec un gradient de vitesse de 380•s-1 pendant deux minutes et une floculation relativement longue mais moins intense (8 min à 70 s-1). Les auteurs ont mis en évidence l’importance d’une coagulation-floculation sur la déstabilisation des particules et la formation de flocs résistants mais suffisamment petits pour flotter, afin d’accroître l’efficacité de l’étape de flottation subséquente.
Figure 2
Colonie de Microcystis aeruginosa, une espèce potentiellement toxique (échelle = 60 µm).
Colony of Microcystis aeruginosa, a potentially toxic species (scale = 60 µm).
3.3 Filtration sur sable
La filtration assure l’élimination des particules en suspension comme les argiles et les limons, les flocs coagulés et les microorganismes (LETTERMAN, 1999). Les opérations peuvent inclure une filtration directe (sans coagulation-floculation préalable) ou encore une filtration conventionnelle (avec coagulation-floculation préalable). La filtration conventionnelle permet d’éliminer plus de 60 % des cyanotoxines intracellulaires. Par contre, les fortes doses de coagulant utilisées en combinaison avec ce type de procédé induisent un risque de colmatage rapide des filtres et peuvent entraîner la lyse des cellules. Le colmatage des filtres peut également survenir en présence de fortes biomasses et entraîner le relargage des cyanotoxines dans l’eau suite à la lyse des cellules (HENDRICKS, 1991; SVRCEK et SMITH, 2004). L’objectif de la filtration est d’éliminer les cellules cyanobactériennes intactes. Pour éviter la lyse des cellules, il est nécessaire d’éviter l’accumulation de cellules à la surface des filtres en réduisant la charge à l’entrée des filtres et en effectuant des lavages plus fréquents. La filtration directe (sans coagulation-floculation préalable) est généralement inefficace pour éliminer les cyanotoxines intracellulaires (SIVONEN et JONES, 1999). Par contre, l’utilisation de filtres multicouches combinés à un prétraitement adéquat peuvent assurer une efficacité d’élimination considérable (MOUCHET et BONNELYE, 1998). Par exemple, l’élimination des MC atteint 14 à 60 % avec une coagulation-floculation à l’alun et une filtration sur un filtre bicouche de sable et d’anthracite (LAMBERT et al., 1996).
Dans une étude en laboratoire portant sur la performance de la filtration sur sable, KEIJOLA et al. (1988) ont obtenu des taux variables d’élimination selon le type de cyanotoxines, soit de 30 à 65 % des toxines produites par Oscillatoria (80 % des MC et 70 % des ANT). La filtration lente sur sable est réalisée avec une plus faible charge hydraulique que la filtration rapide, ce qui permet le développement d’un biofilm à la surface des filtres. Ce phénomène est impliqué dans le processus de purification car il assure la biodégradation de matières organiques et minérales dissoutes (HENDRICKS, 1991). La biodégradation de la MC a souvent été démontrée (par ex., JONES et ORR, 1994). D’après une étude de GRÜTZMACHER et al. (2002) réalisée sur 25 jours, la filtration lente sur sable assure un taux d’élimination de 43 % à 99 % des MC. Les auteurs précisent que l’augmentation de la concentration des MC extracellulaires ainsi qu’une température inférieure à 4 °C caractérisent la période où l’élimination des MC est plus faible (<85 %). Le suivi à court terme (30 heures) de l’élimination des MC dissoutes appliquées en doses ponctuelles démontre toutefois un taux d’élimination de 90 %, expliqué par la biodégradation réalisée par le biofilm à une température modérée (entre 5 et 20 °C selon les conditions expérimentales) (GRÜTZMACHER et al., 2002). L’efficacité d’élimination est plus importante si le biofilm a développé au préalable une résistance aux cyanotoxines présentes dans l’eau (GRÜTZMACHER et al., 2002). Dans ce cas, le biofilm est déjà adapté au substrat, il n’y a pas de période de latence et le taux d’élimination est optimal. Le taux d’élimination diminue avec des températures plus froides, probablement lié à une réduction du taux métabolique des microorganismes composant le biofilm (GRÜTZMACHER et al., 2002).
Les sites où l’eau de surface s’écoule d’abord à travers le sol de façon naturelle (bank filtration) assurent une première filtration et fournissent généralement une eau brute de meilleure qualité. La construction d’une structure reproduisant ce phénomène naturel en amont d’une prise d’eau améliore la qualité de l’eau avant son entrée dans la filière de potabilisation des eaux (HRUDEY et al., 1999). Le potentiel de ce type de filtration semble toutefois limité (SVRCEK et SMITH, 2004). Par exemple, MILLER et FALLOWFIELD (2001) ont observé que la biodégradation des hépatotoxines était faible dans ce type de filtration.
3.4 Traitement au charbon actif
Deux types de charbon actif (CA) sont utilisés pour éliminer la matière organique dissoute de l’eau : le charbon actif en poudre (CAP) et le charbon actif en grain (CAG). Les paramètres généralement utilisés pour évaluer la qualité du CAP, tels que la surface volumique ou le nombre de phénol ou d’iode, ne donnent aucune information sur sa capacité à adsorber les cyanotoxines (SVRCEK et SMITH, 2004). L’efficacité d’élimination varie en fonction de la solubilité des différentes toxines et de leur comportement d’adsorption (LAWTON et al., 1999). L’efficacité d’adsorption des cyanotoxines est également influencée par le degré de porosité du CA, particulièrement pour les molécules dont le diamètre atteint 3 nm, tel que dans le cas des MC. Ces grosses molécules ne peuvent entrer dans les micropores du CA (diamètre inférieur à 2 nm), ce qui empêche leur adsorption (LETTERMAN, 1999; SVRCEK et SMITH, 2004). Des pores de plus grande taille peuvent être obtenus selon le type de matière première utilisée dans la fabrication du CA (charbon, bois, noix de coco). Le CA issu du bois possède davantage de mésopores (2 à 50 nm), il est donc plus efficace (FAWELL et al., 1993).
Le CAP est souvent ajouté dans l’eau de façon intermittente en cas de contamination ponctuelle (WESTRICK, 2008), un processus particulièrement intéressant car facile à mettre en oeuvre. Bien que le CAP soit inefficace pour éliminer les cellules cyanobactériennes, une dose supérieure à 20 mg•L-1 assure une élimination de 80 % des cyanotoxines (SIVONEN et JONES, 1999). Le traitement sur CAP est considéré comme l’une des techniques les plus efficaces pour éliminer les MC comparativement aux procédés conventionnels de floculation-filtration-chloration (HIMBERG et al., 1989; RODRIGUEZ et al., 2007). Le CA est toutefois dispendieux et son utilisation est donc limitée, particulièrement dans les pays moins fortunés (WARHURST et al., 1997). Le modèle de COOK et NEWCOMBE (2002) montre que l’efficacité d’adsorption du CAP varie selon le type de MC (MC-LA < MC-LR < MC-YR < MC-RR).
Dans l’une des premières études sur l’efficacité du CAP, deux toxines extraites d’une fleur d’eau de M. aeruginosa ont été éliminées avec succès (HOFFMAN, 1976). Après un traitement à 80 et 800 mg•L-1 de CAP, les deux échantillons de toxines n’étaient plus toxiques pour les souris utilisées dans ces tests. Par contre, des doses de CAP aussi élevées sont rarement utilisées dans les usines de potabilisation des eaux généralement conçues pour administrer des concentrations de 5 à 50 mg•L-1 de CAP. Dans une étude en laboratoire, KEIJOLA et al. (1988) et HIMBERG et al. (1989) ont démontré qu’une concentration de 5 mg•L-1 de CAP n’élimine que 34 % des MC et 50 % des ANT. DONATI et al. (1994) ont évalué que pour éliminer 98 % des MC-LR (50 µg•L-1), 25 mg•L-1 de CAP de bois combinés à un temps de contact de 30 min sont nécessaires. Cette étude démontre également que le CAP issu de la noix de coco offre un rendement inférieur, soit 60 % d’élimination pour une dose de 50 mg•L-1 et un temps de contact de 30 min. FAWELL et al. (1993) et WARHURTS et al. (1997) ont confirmé que le CAP issu du bois est le plus efficace pour éliminer les MC. Le CAP obtenu à partir de bois est également le plus performant pour l’élimination des SAX et les CYN. Une élimination presque totale de ces toxines (4,7 µg•L-1) est atteint avec 15 mg•L-1 de CAP pour un temps de rétention de 30 min (NEWCOMBE et NICHOLSON, 2002). Dans les dernières décennies, plusieurs études se sont penchées sur le dosage de CAP permettant d’optimiser les infrastructures conventionnelles de traitement pour que l’élimination des cyanotoxines atteigne les normes recommandées par l’OMS. Il est recommandé de concevoir un procédé à base de CAP (issu du charbon de bois) et pouvant injecter plus de 30 mg•L-1 de CAP. Pour les conditions généralement rencontrées au Québec, les paramètres initiaux d’utilisation suggérés sont une concentration de 10 mg•L-1 de CAP et un temps de contact de 20 min. De plus, le CAP doit être utilisé en prétraitement afin de permettre son élimination subséquente par clarification ou filtration (BARBEAU et al., 2008).
La présence de substances organiques dans l’eau (par ex., les acides humiques et fulviques) peut nuire à l’efficacité du traitement par le CAP. En effet, cette matière organique entre en compétition avec les cyanotoxines pour les sites d’adsorption sur le CAP (DONATI et al., 1994). D’autres études ont confirmé que l’adsorption de MC-LR et MC-LA varie avec la concentration de carbone organique dissous (COD) dans l’eau (COOK et NEWCOMBE, 2002). Un dosage élevé de CAP devra être ajusté en fonction de la concentration de carbone organique total et de la matière organique dans l’eau à traiter (SIVONEN et JONES, 1999). Une connaissance du COD présent dans l’eau brute peut permettre de mieux prédire l’élimination des toxines pour une dose donnée de CAP (LAWTON et ROBERTSON, 1999; SVRCEK et SMITH, 2004).
Le CAG est généralement utilisé pour la conception des colonnes en flux continu ou des lits filtrants (SVRCEK et SMITH, 2004). Le CAG a un rôle de matériau adsorbant et filtrant, mettant en jeu des phénomènes d’adsorption physique et chimique. Ce type de procédé possède une forte capacité d’adsorption et un contrôle technique plus aisé (SVRCEK et SMITH, 2004). L’adsorption des molécules sur un filtre de CAG permet d’éliminer 90 % des cyanotoxines extracellulaires (BRUCHET et al., 1998) et plus de 60 % des cyanotoxines intracellulaires (SIVONEN et JONES, 1999). Les toxines demeurent adsorbées sur le charbon actif jusqu’à ce qu’elles soient biodégradées (SVRCEK et SMITH, 2004), ce qui peut constituer un risque de relargage, par exemple si le filtre n’est pas remplacé assez souvent. Par ailleurs, un filtre de CAG possède une durée de vie très courte (moins de six mois), ce qui limite grandement l’intérêt de ce procédé pour les installations municipales (BARBEAU et al., 2008).
HART et al. (1998) ont utilisé une colonne de test rapide afin de simuler la performance du CAG sous plusieurs conditions. Leurs résultats indiquent qu’une exposition continue à une dose entre 5 et 20 µg•L-1 de toxines limite la durée de vie des filtres sur lit de CAG. Une durée de vie de 30 jours à été mesurée pour le modèle le plus performant (HART et al., 1998). Cette durée de vie se calcule au temps nécessaire pour que l’effluent atteigne une concentration en toxines supérieure à 10 % de la concentration initiale. BRUCHET et al. (1998) ont observé une élimination de 90 % des MC (50 µg•L-1) sur un débit de filtration de 7 000 à 12 000 m3 d’eau par m3 de carbone. Au delà de ce débit maximal, une saturation par le COD serait en partie responsable de la diminution de l’efficacité d’élimination des cyanotoxines jusqu’à 63 %. LAMBERT et al. (1996) ont étudié l’efficacité de colonnes de CAG ayant préalablement été en opération pendant cinq mois dans une usine de potabilisation des eaux. Leurs résultats confirment l’existence d’une compétition entre la matière organique et les MC-LR. En effet, en présence de 20 mg•L-1 de COD dans l’eau brute, l’efficacité d’élimination des MC-LR n’atteint que 40 à 60 %.
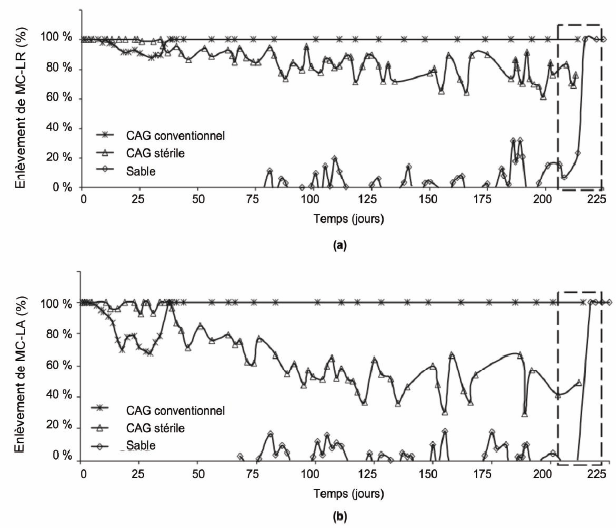
La capacité d’adsorption du CAG est limitée dans le temps (quelques semaines à quelques mois), mais ce phénomène est compensé par le développement d’un biofilm qui dégrade les cyanotoxines après quelques semaines d’utilisation. L’activité biologique permet d’augmenter l’efficacité et la durée de vie des filtres de CAG (SIVONEN et JONES, 1999). L’efficacité des biofilms à dégrader les cyanotoxines varie selon les conditions opératoires et il est difficile de prévoir le développement de la biomasse et la biodégradation qu’elle assurera réellement. Bien que LAMBERT et al. (1996) n’aient observé aucune biodégradation de MC-LR par le biofilm formé sur CAG pendant une période d’un mois, d’autres auteurs ont attribué une part de l’élimination des MC à la biomasse active dans les filtres (BRUCHET et al., 1998; HART et al., 1998). Une autre étude basée sur des essais en colonnes de CAG a démontré un faible rendement d’élimination dans la première phase d’utilisation, mais par la suite, une élimination suffisante des MC-LR et MC-LA abaissant la concentration dans l’effluent sous les limites de détection (NEWCOMBE et al., 2002). Ceci suggère que le biofilm s’est adapté aux toxines et qu’il les dégradait efficacement après une certaine période de latence. Des études récentes ont confirmé l’efficacité de la filtration sur CAG pour éliminer jusqu’à 70 % les MC (40 % des MC-LA) et ont démontré que l’élimination fait intervenir à la fois les phénomènes de biodégradation par les bactéries hétérotrophes présentes dans le biofilm et le processus d’adsorption des molécules aromatiques dans les mésopores (WANG et al., 2007). Les auteurs démontrent que l’efficacité de la biodégradation dépend de la durée de la période de latence, de la concentration initiale des bactéries dans le biofilm et de la température. Leurs essais sur colonnes de CAG ont confirmé que le phénomène d’adsorption est particulièrement important dans la première phase d’utilisation et qu’il peut être modélisé afin de prédire l’efficacité de différents types d’ouvrage impliquant l’utilisation de CAG (Figure 3). L’influence d’un biofilm actif à la surface du CAG est également évaluée à l’aide du modèle. Il est prédit que l’adsorption des MC est entravée par la présence d’un biofilm.
Figure 3
Élimination des (a) MC-LR et des (b) MC-LA à l'aide des procédés de CAG conventionnel avec biofilm, de CAG stérile et de filtre sur sable; les zones encadrées indiquent l'initiation de la période de biodégradation dans la colonne de sable (tirée de WANG et al., 2007).
Removal of (a) MC-LR and (b) MC-LA through the use of conventional granular activated carbon (GAC) with biofilm, sterile GAC and sand columns; the dashed area represents the onset of biodegradation in the sand column (from WANG et al., 2007).
Plusieurs types de procédés d’appoint adaptés à une utilisation domestique sont disponibles sur le marché pour la purification de l’eau du robinet. L’unité de traitement le plus utilisé est un système composé d’un filtre intégré à un récipient. Ce type de système permet de filtrer l’eau à travers une cartouche préparée avec un mélange de CAG et une résine échangeuse d’ions. D’après LAWTON et al. (1999), l’efficacité de ce type de système varie en fonction de la morphologie des cellules et des colonies, retenant jusqu’à 60 % des formes filamenteuses comparativement à 10 % pour les formes unicellulaires. L’élimination des MC atteint 32 à 57 % avec des cartouches neuves et jusqu’à 88 % après trois passages de la même eau à travers le filtre. Ces résultats démontrent qu’il est nécessaire d’optimiser l’efficacité de ce type de filtre individuel avant de les commercialiser comme une méthode efficace d’élimination des cyanotoxines (SVRCEK et SMITH, 2004).
3.5 Méthodes conventionnelles d’oxydation chimique
Les études portant sur les procédés d’oxydation ont surtout évalué l’élimination des MC (HITZFELD et al., 2000). L’élimination des CYN et ANT par des procédés chimiques a été peu étudiée (RODRIGUEZ et al., 2007). Plusieurs auteurs ont évalué l’effet de la qualité de l’eau sur l’élimination de cyanotoxines et se sont concentrés sur l’effet du pH et de la concentration en COD. L’effet de ces facteurs dépend également du type et de la quantité d’oxydant utilisée dans le procédé (HOEGER et al., 2002). Les études comparant l’efficacité de plusieurs oxydants évaluent généralement l’efficacité en pourcentage, en fonction d’une certaine dose d’oxydant ou du niveau résiduel de ce dernier.
3.5.1 Oxydation par le chlore
Le chlore est un produit chimique couramment utilisé comme désinfectant dans les usines de potabilisation des eaux. Cet oxydant attaque les molécules aromatiques et les amines, mais avec une efficacité inférieure à celle des procédés employant l’ozone comme oxydant (SVRCEK et SMITH, 2004). Une pré-chloration aux doses habituelles de 0,25 à 2,0 mg•L-1 améliore la coagulation mais ce traitement induit la lyse des cellules cyanobactériennes (SIVONEN et JONES, 1999). SVRCEK et SMITH (2004) recommandent de limiter la dose de chlore sous 3 mg•L-1 afin d’éviter la formation excessive de thihalométhane (THM). L’efficacité de la post-chloration à oxyder les cyanotoxines résiduelles dépend de la performance des étapes précédentes de la filière de traitement pour éliminer la matière organique qui interfère avec la réaction entre les toxines et le chlore résiduel (SVRCEK et SMITH, 2004). Après une filtration, des conditions de pH inférieur à 8 combinées à une dose suffisante de chlore ou de bioxyde de chlore permettent d’éliminer de façon efficace certaines cyanotoxines, à l’exception de l’ANT (NICHOLSON et al., 1994; SIVONEN et JONES, 1999).
Les premiers travaux sur l’élimination des MC par chloration ont démontré que cette méthode était inefficace, et ce, malgré les doses substantielles utilisées s’élevant à 5 mg HClO•L-1 (HOFFMAN, 1976). La présence de matière organique dans l’eau de cette étude pourrait avoir consommé le chlore, diminuant ainsi sa disponibilité pour inactiver les cyanotoxines (SVRCEK et SMITH, 2004). Les résultats de ACERO et al. (2005) démontrent au contraire que les MC sont éliminées efficacement lorsque la chloration est réalisée à un pH inférieur à 8. Les auteurs ont caractérisé le taux de chloration de MC-LR équivalent à 475•M-1•s-1 (pH 4,8) et à 9,8 M-1•s-1 (pH 8,8). Avec une concentration résiduelle de chlore typique d’un traitement de pré-oxydation et de désinfection finale (1,0 et 0,5 mg•L-1), la demi-vie des MC-LR varie de quelques minutes (pH 6) à une heure (pH 8). La réactivité des MC-RR et MC-YR lors de la chloration est semblable à celle de la MC-LR (ACERO et al., 2005). L’effet du pH sur l’efficacité d’élimination des MC par chloration a également été démontré par les travaux de NICHOLSON et al. (1994). Par exemple, un taux d’élimination de 79 % des toxines a été enregistré en imposant un pH de 7, alors que seulement 0,4 % d’élimination a été obtenue en imposant un pH de 10. L’acide hypochloreux (HClO) qui est l’espèce prédominante à pH 7 serait donc plus efficace que l’ion hypochlorite (ClO-) (espèces prédominantes à pH basique) pour l’élimination des MC lors de la chloration des eaux.
L’efficacité de la chloration varie pour les autres types de cyanotoxines. NICHOLSON et al. (1994) ont observé une élimination négligeable des ANT par la chloration. ROSITANO et NICHOLSON (1994) ont démontré que la chloration des ANT (20 µg•L-1) n’assure que 15 % d’élimination à une dose de 15 mg HClO•L-1 pendant 30 minutes de contact à un pH de 7. Les travaux de NICHOLSON et al. (2003) suggèrent pour leur part que l’inactivation des SAX augmente avec le pH. L’élimination des SAX atteint 95 % à pH 9 avec un traitement fournissant une concentration de chlore résiduel de 0,5 mg•min-1•L-1 et un temps de contact de 30 minutes (NEWCOMBE et NICHOLSON, 2002). Les auteurs attribuent cette efficacité d’élimination à la forme non protonée que prennent les molécules dans ces conditions, laquelle augmente leur susceptibilité à l’oxydation. La diminution de la toxicité des MC et des SAX suite à la chloration a également été démontrée par des essais de PPIA et de mutagénèse (NEWCOMBE et NICHOLSON, 2002; TSUJI et al., 1997). L’efficacité du chlore pour oxyder les CYN et MC-LR a récemment été confirmée par RODRIGUEZ et al. (2007). Lorsqu’un mélange de cyanotoxines est susceptible de contaminer la source d’eau, il est important de prendre en considération que les MC et CYN sont inactivées plus efficacement aux pH entre 4,8 et 7,0, que les SAX sont davantage éliminées à pH élevé (près de 9) et que les ANT pourraient n’être que faiblement éliminées (WESTRICK, 2008).
Bien que le chlore soit efficace à détruire certains types de cyanotoxines, des sous-produits de dégradation, dont des composés organiques halogénés (par ex., chloroforme et autres THM) et des acides haloacétiques (HAA), peuvent être formés en présence de matière organique. La toxicité des sous-produits formés restreindrait donc l’utilisation de fortes doses en chlore (RODRIGUEZ et al., 2007). Selon SVRCEK et SMITH (2004), les recherches actuelles sont désormais orientées vers la caractérisation des sous-produits toxiques issus de la dégradation de cyanotoxines. Les auteurs suggèrent toutefois que l’importance relative de ces sous-produits devrait être négligeable par rapport à la toxicité des cyanotoxines ou des sous-produits formés directement par la réaction entre le chlore et la matière organique tels que les THM. Ces hypothèses ont récemment été confirmées par les travaux de RODRIGUEZ et al. (2008). Leurs essais de PPIA démontrent que les sous-produits de chloration des MC-LR et MC-RR sont 500 fois moins toxiques que les molécules intactes. La réduction de la toxicité suite à la chloration a également été démontrée pour une CYN, bien que des sous-produits de dégradation aient induit des dommages au foie des souris ainsi qu’une mutagénèse accrue (SHAW et al., 2001).
Des procédés de désinfection employant des chloramines (HN2Cl, NHCl2 et NCl3) sont inefficaces pour dégrader les cyanotoxines (WESTRICK, 2008). Les chloramines, qui réagissent avec les amines tertiaires et les molécules aromatiques, ont peu d’effet sur les MC et les NOD (17 % d’élimination), même après une période de traitement de cinq jours avec 20 mg•L-1 de chloramine (NICHOLSON et al., 1994).
3.5.2 Oxydation au permanganate de potassium
Le permanganate de potassium fut introduit comme traitement chimique de l’eau en Angleterre dès 1913 (GALVIN et MELLADO, 1998). Il est largement utilisé depuis 1969 en Europe et aux États-Unis (LETTERMAN, 1999) comme agent oxydant fort, capable de détruire les composés organiques et les microorganismes (SVRCEK et SMITH, 2004). Dans une filière classique de potabilisation des eaux, il est surtout utilisé pendant l’étape de pré-oxydation. L’ajout de permanganate de potassium en prétraitement (1 à 5 mg•L-1 ) améliore la coagulation des cellules cyanobactériennes mais provoque leur lyse, augmentant la concentration de cyanotoxines en solution (SCHMIDT et al., 2002). Par ailleurs, une étude réalisée dans des infrastructures de potabilisation des eaux au Wisconsin (É.-U.) a démontré que l’ajout de permanganate de potassium en prétraitement assure une réduction de 61 % des MC en moyenne (KARNER et al., 2001). Dans une eau déjà clarifiée ou filtrée, l’ajout de permanganate de potassium permet l’élimination de plus de 95 % des cyanotoxines extracellulaires (SIVONEN et JONES, 1999). Les travaux de ROSITANO et al. (1998) ont démontré qu’un traitement avec 2 mg•L-1 de permanganate de potassium permet l’élimination de près de 90 % des MC-LR (1 mg•L-1) après un temps de contact de 10 minutes. Le permanganate de potassium est particulièrement efficace pour éliminer l’ANT résiduelle (RODRIGUEZ et al., 2007). L’étude récente de RODRIGUEZ et al. (2008) a démontré lors d’essais de PPIA que les sous-produits de réaction des MC-LR et MC-RR avec le permanganate de potassium sont 400 fois moins toxiques que les molécules intactes, même pour de fortes concentrations. En revanche, il est nécessaire d’éliminer le résiduel de permanganate et de s’assurer que la teneur en manganèse totale soit inférieure à la norme de potabilité (valeur guide de 500 µg Mn•L-1; OMS, 1998). La présence du manganèse peut également être problématique car il peut donner une coloration rose à l’eau. Cette couleur évolue ensuite vers le brun-orange par suite de la précipitation du MnO2.
4. Méthodes alternatives d’élimination des cyanotoxines
L’utilisation de méthodes alternatives et de technologies plus avancées pour éliminer les cyanotoxines se sont développées dans les dernières décennies et les succès rencontrés sont variables (SVRCEK et SMITH, 2004). Ces traitements avancés incluent l’ozonation, la photolyse par rayonnement UV, les procédés d’oxydation avancée et la filtration membranaire.
4.1 Traitement par ozonation
La dose d’oxydant nécessaire pour éliminer les toxines (MC-LR) diminue selon l’ordre suivant : dioxyde de chlore > permanganate de potassium > ozone (FAWELL et al., 1993; HALL et al., 2000). L’ozone est très réactif envers les liaisons insaturées des molécules de MC et NOD et il induit la formation de composés carbonyles par la réaction avec les ozonides formés. La destruction des doubles liaisons du groupement Adda (défini plus haut) élimine la toxicité des molécules de MC et NOD (CARMICHAEL, 1997). Les molécules telles que les MC sont plus facilement oxydables car elles possèdent des doubles liaisons carbone-carbone et une structure aromatique réagissant fortement avec l’ozone. Les ANT et les SAX sont davantage récalcitrantes que les MC car elles possèdent une structure moléculaire plus simple (KEIJOLA et al., 1988; NEWCOMBE et NICHOLSON, 2002; ROSITANO et al., 2001).
L’interférence de la matière organique (COD) entraîne également une baisse de l’efficacité de l’ozonation (WESTRICK, 2008). Au cours d’une pré-oxydation, une trop faible dose risque de dégrader les cellules de cyanobactéries sans pouvoir éliminer les cyanotoxines libérées. En présence de matière organique, la dose d’ozone nécessaire pour éliminer la totalité des MC est plus grande. Par exemple, en présence de cellules de M. aeruginosa, un traitement de 1 mg O3•L-1 pendant cinq minutes ne permet d’éliminer que 90 % de cyanotoxines (220 µg•L-1 de MC-LR équivalent). À l’opposé, en absence de matière organique, les toxines en solution (166 µg•L-1 de MC-LR) sont éliminées sous la limite de détection à la suite d’un ajout de 0,2 mg O3•L-1 pendant quatre minutes (ROSITANO et al., 1998). De plus, il est conseillé de réaliser l’ozonation dans l’eau préalablement clarifiée ou filtrée afin d’éviter la lyse des cellules.
Une post-ozonation permet d’éliminer plus de 98 % des cyanotoxines lorsque la demande en ozone associée aux contaminants bactériens, organiques et inorganiques a été satisfaite (SIVONEN et JONES, 1999). Les premières études sur la potabilisation des eaux par l’ozonation ont démontré que cette méthode est une des plus efficaces pour éliminer les cyanotoxines (HIMBERG et al., 1989; KEIJOLA et al., 1988). Ces études ont rapporté une efficacité d’élimination atteignant 100 % pour les MC (60 µg•L-1) avec une ozonation à 1 mg O3•L-1. Par ailleurs, l’étude de NEWCOMBE et al. (2002) indique que la toxicité des MC diminue suite à une ozonation, suggérant que les produits de dégradation générés lors de ce traitement sont peu délétères. Les travaux de ROSITANO et al. (1998) ont démontré que la dégradation des cyanotoxines par l’ozone est plus efficace en milieu acide qu’en milieu alcalin (pH supérieur à 7,5). Cela suggère que les cyanotoxines réagissent davantage avec l’ozone qu’avec les radicaux hydroxyles (°OH; SVRCEK et SMITH, 2004). La réaction des toxines avec l’ozone est relativement rapide; les doses requises et le temps de contact sont généralement faibles, soit de l’ordre de la concentration utilisée de façon conventionnelle (par ex., 0,4 mg O3•L-1 pendant quatre minutes). L’application de cette méthode dans des filières de potabilisation des eaux est réaliste car les doses généralement appliquées sont suffisantes pour l’élimination efficace des MC, NOD et ANT. RODRIGUEZ et al. (2007) ont développé des constantes d’oxydation pour les toxines CYN, MC-LR et ANT afin de modéliser les besoins en oxydants selon la méthode et le pH employés. Un dosage adapté à la qualité de l’eau permet d’éliminer la plupart des cyanotoxines à l’exception de certains types de SAX (SVRCEK et SMITH, 2004).
4.2 Traitement par photolyse au rayonnement ultraviolet
L’absorption du rayonnement UV par les molécules organiques peut provoquer leur destruction sans nécessiter l’ajout de produits chimiques dans l’eau. Le processus implique généralement le passage de l’eau sous des lampes UV de longueurs d’ondes comprises entre 200 et 300 nm (ZHOU et SMITH, 2001). La photolyse de l’eau induit la réaction suivante (OPPENLÄDER et GLIESE, 2000; PARSONS, 2004) :
Le rayonnement UV a couramment été utilisé pour éliminer les microorganismes tels que Cryptosporidium parvum (ZHOU et SMITH, 2001). Selon TSUJI et al. (1995), les cyanotoxines (en l’occurrence la MC-LR) peuvent être complètement décomposées après 10 minutes d’exposition au rayonnement UV (254 nm) en appliquant une intensité de 2,55 mW•cm-2.
4.3. Traitement par des procédés d’oxydation avancée
Les procédés d’oxydation avancée (POA) ont été conçus afin d’optimiser les capacités oxydatives d’agents oxydants comme l’ozone ou les UV en accélérant la cinétique de leurs réactions d’oxydoréduction (ZHOU et SMITH, 2001). Les POA assurent une production suffisante de radicaux hydroxyles pour purifier l’eau sous une pression atmosphérique normale et à température ambiante (GLAZE et al., 1987; MUNTER et al., 2001). Le procédé UV-H2O2 en est un exemple. L’énergie du rayonnement UV dissocie la molécule de H2O2, générant deux radicaux hydroxyles très réactifs qui réagiront avec les contaminants organiques ou subiront un cycle de décomposition-formation de H2O2, comme il est indiqué ci-dessous (ZHOU et SMITH, 2001) :
La performance des POA varie selon le type de composé à éliminer et les différentes réactions menant à la production de radicaux hydroxyles sont considérées complexes (MUNTER et al., 2001; ZHOU et SMITH, 2001). Le procédé doit fournir suffisamment de H2O2 pour que près de 30 % des UV émis entre 200 et 300 nm soit absorbés. Ce type d’oxydation avancée en aval d’une filtration assure une bonne élimination des cyanotoxines mais le H2O2 doit être dosé adéquatement afin d’éviter une forte concentration résiduelle qui consomme beaucoup de chlore. Il est à noter que la concentration résiduelle de H2O2 ne peut pas dépasser la valeur maximale de 0,5 mg•L-1 autorisée dans l’eau traitée aux États-Unis et en Europe. En contrepartie, l’utilisation du H2O2 pour la production d’eau potable n’est pas encore autorisée au Québec (ELLIS, 2008).
La combinaison O3-H2O2 permet la décomposition des molécules d’ozone en radicaux hydroxyles, une réaction favorisée en milieu acide. L’oxydation est généralement effectuée avec un temps de séjour de l’eau dans les contacteurs de l’ordre de 10 minutes. Une injection fractionnée à divers niveaux du contacteur d’ozonation permet de maintenir le rapport O3-H2O2 (ratio H2O2/O3 = 0,5) en tout point du réacteur (PAILLARD et al., 1988). L’ajout du H2O2 à l’ozone accélère la décomposition de l’ozone (MUNTER et al., 2001; ZHOU et SMITH, 2001) selon la réaction suivante :
Après la formation des radicaux hydroxyles, la propagation des réactions en chaîne des radicaux et l’oxydation des contaminants suivent les mêmes mécanismes que ceux qui se produisent pendant l’ozonation (ZHOU et SMITH, 2001). La combinaison de H2O2 avec l’ozone améliore à la fois la vitesse et l’efficacité de dégradation des cyanotoxines. Les MC-LR (1 mg•L-1) passent sous le seuil de détection après 30 minutes d’un traitement combinant l’ozone (0,2 mg•L-1) et le H2O2 (0,1 mg•L-1) (ROSITANO et al., 1998). D’autres travaux ont confirmé l’efficacité des systèmes UV-H2O2 et O3-H2O2 (AL MOMANI et al., 2008; QIAO et al., 2005), mais certains paramètres doivent être mieux définis, tels que les doses optimales d’H2O2 et l’interaction avec la matière organique naturelle. L’avantage du système réside en sa simplicité d’utilisation et son efficacité bactéricide, ce qui explique son développement à grande échelle aux États-Unis et en Europe comme étape de désinfection dans la potabilisation des eaux. D’autres part, l’introduction du procédé d’oxydation par O3-H2O2 entre la filtration sur sable et la filtration sur CAG permet d’augmenter la durée de vie du CAG (CHROMOSTAT et al., 1993; PAILLARD, 1994).
Les procédés impliquant strictement l’utilisation du H2O2 pour la potabilisation des eaux sont peu répandus (LAWTON et ROBERTSON, 1999). Bien que des données thermodynamiques suggèrent que le H2O2 soit un bon oxydant, la cinétique de la réaction n’est pas favorable dans de nombreuses applications de potabilisation des eaux (SVRCEK et SMITH, 2004). Les recherches de ROSITANO et al. (1998) ont démontré que le H2O2 utilisé seul est relativement inefficace pour la dégradation des MC-LR (1 mg•L-1), avec moins de 10 % d’élimination après 10 minutes de traitement et une dose de 2 mg H2O2•L-1. FAWELL et al. (1993) ont également démontré que l’utilisation d’H2O2 sans combinaison avec d’autres réactifs est inefficace pour l’élimination des MC-LR, autant dans les eaux brutes que clarifiées.
Les POA hétérogènes sont des technologies basées sur l’irradiation d’un catalyseur, en général un semi-conducteur (par ex., le TiO2), qui peut être photo-excité pour former des sites électro-donneurs ou électro-accepteurs d’électrons et induire ainsi des réactions d’oxydoréduction. L’irradiation du semi-conducteur conduit à l’oxydation des groupes hydroxyles à la surface de la molécule TiO2 pour former des radicaux hydroxyles. La dégradation de polluants peut ainsi s’effectuer à la surface du semi-conducteur avec ces radicaux hydroxyles (ROBERTSON et al., 1999; SVRCEK et SMITH, 2004; LEGRINI et al., 1993).
Il est difficile de prévoir l’efficacité in situ du procédé UV-TiO2 en raison de la diversité des conditions environnementales propres aux différents types de source d’eau. Certains auteurs ont observé que la présence de phycocyanine (PC), un pigment important des cyanobactéries qui absorbe la lumière aux mêmes longueurs d’onde que le TiO2, diminue la performance du procédé (ROBERTSON et al., 1999). À l’opposé, TSUJI et al. (1994) soutiennent que la PC peut agir comme catalyseur et favoriser la destruction complète des toxines après un mois de rayonnement solaire naturel. Par ailleurs, l’efficacité catalytique du TiO2in situ est limitée puisque le rayonnement UV ne représente que 5 % de l’énergie solaire totale reçue à la surface de la Terre et que ces rayons sont rapidement absorbés à la surface de l’eau par la matière organique dissoute (CHOI et al., 2007).
La combinaison du TiO2 avec un produit dopant contenant de l’azote permet de modifier la structure du catalyseur (N-TiO2) et en conséquence, induit une modification de la gamme de longueurs d’onde à laquelle le catalyseur est sensible (ASAHI et al., 2001; BURDA et al., 2003). L’utilisation de N-TiO2 préparé selon CHOI et al. (2007) détruit 50 % des MC-LR en 30 minutes et plus de 90 % après 120 minutes d’exposition à la lumière visible (> 420 nm). L’introduction supplémentaire de dopants anioniques en présence du catalyseur TiO2 a démontré un potentiel élevé pour l’élimination photo-catalytique des cyanotoxines telles que les MC-LR ou d’autres composés organiques toxiques. Bien que la photo-catalyse des MC-LR ne soit pas aussi rapide qu’avec le rayonnement UV, ces résultats sont particulièrement intéressants car la partie visible du spectre solaire est une source d’énergie accessible et plus abondante que les UV (CHOI et al., 2007). CORNISH et al. (2000) ont étudié l’efficacité des POA homogènes et hétérogènes (UV-TiO2; UV-0,6 % H2O2; UV-TiO2-0,6 % H2O2) pour éliminer les MC. Après 30 minutes, l’élimination des MC-LR atteint 90 % pour ces trois POA.
4.4 Traitement par des techniques à membrane
L’utilisation des membranes à basse pression (microfiltration (MF) et ultrafiltration (UF)) comme méthode alternative de filtration est de plus en plus répandue dans les usines de potabilisation des eaux. CHOW et al. (1997) ont démontré que les membranes MF et UF permettent d’éliminer jusqu’à 98 % des cellules de M. aeruginosa en raison de la taille des pores membranaires (0,01 à 1,0 µm) inférieure à la taille des cellules de cette espèce. Ce type de traitement assure un abattement de six unités logarithmiques de la densité cellulaire (MOUCHET et BONNELYE, 1998). Un prétraitement impliquant une coagulation assure la formation de plus gros flocs, ce qui facilite le délogement des cellules pendant le rinçage. L’élimination par rinçage des cellules de M. aeruginosa accumulées dans les membranes est plus performant avec les membranes d’UF que les membranes de MF (CHOW et al., 1997). Ainsi, le risque de lyse des cellules sera moins élevé avec des membranes d’UF qu’avec des membrane de MF. Le type d’écoulement (frontal ou tangentiel) peut influencer la performance du procédé car une forte pression transmembranaire (~200 kPa) affecte l’intégrité des cellules, ce qui pourrait provoquer leur lyse et la libération de toxines intracellulaires (CHOW et al., 1997). L’utilisation de l’écoulement tangentiel (application d’une vitesse de filtration relativement élevée) permet la réduction du colmatage membranaire, mais une trop forte vitesse pourrait entraîner la lyse des cellules avec les forces de cisaillement mises en jeu. Avec un écoulement frontal, la pression qui s’exerce sur les cellules est forte et le risque de lyse des cellules de cyanobactéries est plus élevé. Le risque de lyse des cellules sera d’autant plus élevé que la pression transmembranaire sera importante.
Dans une étude récente, LEE et WALKER (2008) ont étudié les mécanismes responsables de l’élimination des cyanotoxines MC-LR pendant l’application d’une UF. Les auteurs ont observé l’influence des caractéristiques de la membrane, de la concentration de MC-LR (jusqu’à 50 µg•L-1) à l’affluent, du taux de recirculation de l’eau et de la pression hydrostatique exercée sur le système. Pendant la première période d’utilisation du filtre, le mécanisme d’élimination principal est l’adsorption de ces toxines à la membrane. L’adsorption est attribuée à des interactions hydrophobes, mais les liaisons hydrogènes et les propriétés physiques de surface (épaisseur, porosité, rugosité) exercent également une influence sur ce phénomène. L’exclusion par la taille assure également une élimination des MC-LR. Une membrane d’UF en polysulfone très hydrophobe adsorbe jusqu’à 91 % des MC-LR. Au contraire, l’élimination de MC-LR est faible avec des membranes d’acétate de cellulose (0,9 %), un matériau plutôt hydrophile. Les auteurs suggèrent que l’augmentation du transport convectif, associé à l’augmentation de la pression et du taux de recyclage de l’eau induisent une adsorption accrue des MC-LR. Le phénomène d’adsorption par les pores est au contraire moins important (LEE et WALKER, 2008).
Les membranes fonctionnant à haute pression de type osmose inverse (OI) et nanofiltration (NF) retiennent les molécules dont la taille est supérieure à 100 et 200 Da, respectivement (WESTRICK, 2008). Ces membranes peuvent éliminer plus de 99 % des cellules cyanobactériennes et plus de 95 % des cyanotoxines (95 % pour la MC-LR; 99 % pour la MC-RR), tout en éliminant une large gamme de contaminants bactériologiques, organiques ou inorganiques (NEUMANN et WECKESSER, 1998; SIVONEN et JONES, 1999). Les concentrations initiales de MC-LR et MC-RR, entre 70 et 130 µg•L-1, correspondent à des conditions naturelles en période de fleurs d’eau de cyanobactéries (NEUMANN et WECKESSER, 1998). Les NOD peuvent également être retenues au cours du traitement par OI (VUORI et al., 1997). La concentration de NOD dans le perméat est demeurée sous de la limite de détection, de l’ordre de 0,5 µg•L-1, avant la saturation du système. L’efficacité d’élimination diminue lorsque la membrane est saturée, des traces de NOD ainsi qu’une augmentation de salinité sont alors détectées dans le perméat traité. Les membranes OI étant couramment utilisées pour dessaler les eaux saumâtres, il est intéressant de noter qu’un système bien calibré permettrait d’éliminer efficacement les NOD.
L’utilisation de membrane NF permet d’éliminer les MC de l’eau en plus de limiter l’accumulation des toxines à la surface de la membrane (FAWELL et al., 1993). MUNTISOV et TRIMBOLI (1996) ont confirmé que la membrane NF permet d’éliminer une contamination ponctuelle de MC-LR et de NOD de l’ordre de 8 µg•L-1. L’étude de TEIXEIRA et ROSA (2005) démontre pour sa part que l’élimination des variantes de MC étudiées (MC-LR, MC-LY et MC-LF) atteint jusqu’à 97 %, et que le type et la concentration en matière organique ainsi que le pH ne semblent pas influencer la performance de ce procédé. Les concentrations en MC dans le perméat de la NF sont demeurées sous le seuil de 1 µg•L-1 de MC-LR (adopté par l’OMS) et généralement en dessous de la limite de détection. Toutefois, un rejet de toxines dans l’effluent du filtre peut survenir en fonction des conditions d’utilisation du procédé et des propriétés des molécules et du matériau de la membrane.
L’implantation de procédés membranaires OI et NF dans une usine existante est considérée complexe et coûteuse mais peut s’avérer idéale pour de nouvelles installations de petites tailles (ELLIS, 2008). Des filières hybrides de procédés membranaires ont été étudiées par MOUCHET et BONNELYE (1998). Ces auteurs suggèrent qu’un système de CAP et de membranes UF combiné à une sédimentation classique et/ou une ozonation est le système le plus prometteur pour assurer l’élimination simultanée de presque toutes les cyanobactéries et leurs toxines.
En somme, les procédés d’élimination des cyanotoxines et des cyanobactéries sont nombreux. Aux tableaux 2 et 3 sont proposées quelques applications, réalisées en grande partie à l’échelle de banc d’essai en laboratoire, pour l’oxydation chimique de ces polluants (chloration, ozonation, procédé d’oxydation avancé, etc.) ou leur élimination utilisant un processus de séparation physico-chimique (coagulation/floculation, décantation, adsorption sur charbon actif, filtration membranaire, etc.). Un taux d’élimination allant jusqu’à 100 % peut être atteint dépendamment du procédé employé. Parmi les cyanotoxines testées, la MC-LR reste de loin la toxine la plus étudiée afin de mettre en évidence la performance des procédés d’élimination des toxines.
Tableau 2
Comparaison des différents procédés physico-chimiques appliqués pour l'élimination des cyanotoxines et des cyanobactéries.
Comparison of different physico-chemical processes used for cyanotoxin and cyanobacteria removal.
Tableau 3
Comparaison des différents procédés d'oxydation chimique appliqués pour l'élimination des cyanotoxines et cyanobactéries.
Comparison of chemical oxidation process used for cyanotoxin and cyanobacteria removal.
5. Conclusions et perspectives
Les cyanobactéries sont des organismes qui peuvent synthétiser un large éventail de toxines pouvant nuire à la santé humaine. Sachant que la fréquence des fleurs d’eau de cyanobactéries dans les eaux de surface augmente avec le développement urbain et agricole dans les bassins versants et que ces eaux sont parfois utilisées comme sources d’eau potable, il devient important d’optimiser les méthodes de potabilisation des eaux permettant d’éliminer les cyanobactéries et leurs toxines. Le choix du procédé de potabilisation pour la réduction des cyanotoxines dépendra principalement du type de toxines et si elles sont intracellulaires ou extracellulaires. De plus, l’élimination des cyanotoxines, comme tout autre contaminant devant être éliminé par une filière de potabilisation des eaux, devrait être réalisée selon une approche de barrières multiples.
Une solution consiste à optimiser les filières de traitement de potabilisation des eaux. L’élimination des cyanotoxines intracellulaires est efficace avec l’utilisation des procédés physiques suivants, permettant d’éliminer les cellules sans provoquer la lyse : la coagulation/floculation combinée à une clarification (par décantation ou flottation) et une filtration (sur sable ou membranes MF ou UF). L’utilisation du CA, surtout sous forme de poudre (CAP), est également intéressante pour des contaminations ponctuelles de fleurs d’eau de cyanobactéries. Le CAP est efficace pour adsorber les toxines sous certaines conditions, mais une optimisation selon le type de toxines et la matière organique présente dans l’eau est requise. Par ailleurs, l’intégration d’un traitement sur CAG, notamment en filtration bicouche (sable/CAG), peut constituer une alternative de choix dans le cas de la modernisation d’une usine. Le CAG doit être remplacé ou régénéré dès que la concentration en cyanotoxines à la sortie du filtre dépasse la concentration maximale admissible. La sélection des matériaux (nature, densité, taille effective et friabilité) est réalisée en tenant compte des contraintes hydrauliques. Une telle installation permettra non seulement d’accroître l’efficacité de la filière de potabilisation des eaux mais contribuera également à accroître la capacité de production sans procéder nécessairement à la construction de nouvelles infrastructures.
Malgré ces avancées, les méthodes d’élimination des toxines extracellulaires doivent être perfectionnées. Les procédés d’oxydation tels que la chloration et l’ozonation, déjà en place dans les filières de traitement, peuvent s’avérer intéressants en raison de leur pouvoir de désinfection et étant donné la maîtrise des infrastructures déjà existantes dans ce domaine. La chloration permet d’oxyder efficacement les MC dans les conditions d’opération couramment utilisées dans les usines de potabilisation des eaux. L’utilisation de permanganate de potassium élimine efficacement les ANT et l’ozonation élimine à la fois les MC et ANT. La biodégradation combinée à l’ozonation permettent d’éliminer l’ensemble des toxines intra et extracellulaires. En présence de plusieurs problématiques (micropolluants, goûts et odeurs, sous-produits toxiques), il est recommandé de privilégier le procédé d’ozonation. Le dosage des procédés de chloration et d’ozonation doit être ajusté à la qualité de l’eau brute afin d’éviter la formation de sous-produits toxiques. Une meilleure caractérisation et le développement de méthodes de quantification des sous-produits toxiques sont cependant nécessaires.
Ces méthodes conventionnelles devront être optimisées, par exemple en les combinant avec des processus d’oxydation avancée tels que les systèmes UV-H2O2 ou O3-H2O2. Le système d’oxydation avancée le plus utilisé et éprouvé est le couplage O3-H2O2, couramment employé pour l’élimination des composés phytosanitaires (pesticides). Ce traitement combiné est également performant pour l’élimination des cyanobactéries et des toxines grâce à la génération des radicaux libres. Il peut être facilement mis en oeuvre dans les usines de potabilisation des eaux possédant déjà une unité d’ozonation.
Appendices
Annexe
Liste des abréviations
DE = décantation
ANT = anatoxine-a
CO = coagulation
CA = charbon actif
CAG = charbon actif en grain
CAP = charbon actif en poudre
Chla = chlorophylle a
COD = carbone organique dissous
CYN = cylindrospermopsine
Da = Dalton
EBCT = empty bed contact time
ELISA = enzyme linked immunosorbent assay
FL = floculation
FAD = flottation à air dissous
H2O2 = peroxyde d’hydrogène
HAA = acides haloacétiques
HPLC = chromatographie liquide sous haute pression
kPa = kilopascal
LD50 = dose mortelle pour 50% des individus telle qu’obtenue avec un bioessai in vivo
LPS = lipopolysaccharides
MC = microcystine
MC-LR, -RR, -YR, -LW, -LF, -LA = différentes variantes de MC
MF = microfiltration
NF = nanofiltration
NOD = nodularine
O3 = ozone
OI = osmose inverse
OMS = Organisation Mondiale de la Santé
oOH = radical hydroxyle
HOBr = acide hypobromeux
PC = phycocyanine
POA = procédés d’oxydation avancée
PPIA = protein phosphatase inhibition assay
ppm = partie par million
SAX = saxitoxines
TiO2 = dioxyde de titane
THM = thihalométhane
UF = ultrafiltration
UV = rayonnement ultraviolet
WAC = water aluminium chloride (polychlorosulfate basique d’aluminium)
Références bibliographiques
- ACERO J.L., E. RODRIGUEZ et J. MERILUOTO (2005). Kinetics of reactions between chlorine and the cyanobacterial toxins microcystins. Water Res., 39, 1628-1638.
- AGENCE FRANÇAISE DE SÉCURITÉ SANITAIRE DES ALIMENTS et AGENCE FRANÇAISE DE SÉCURITÉ SANITAIRE DE L’ENVIRONNEMENT ET DU TRAVAIL (2006). Risques sanitaires liés a la présence de cyanobactéries dans l’eau. Évaluation des risques liés à la présence de cyanobactéries et de leurs toxines dans les eaux destinées à l’alimentation, à la baignade et autres activités récréatives. Agence Française de Sécurité Sanitaire des Aliments et Agence Française de Sécurité Sanitaire de l’Environnement et du Travail, Paris, France, 231 p.
- AL MOMANI F., D.W. SMITH et M.G. EL-DIN (2008). Degradation of cyanobacteria toxin by advanced oxidation processes. J. Hazard Mater., 150, 238-249.
- ASAHI R., T. MORIKAWA, T. OHWAKI, K. AOKI et Y. TAGA (2001). Visible-light photocatalysis in nitrogen-doped titanium oxides. Science, 293, 269-271.
- AZEVEDO S. (2001). New Brazilian regulation for cyanobacteria and cyanotoxins in drinking water. Dans : Fifth International Conference on Toxic Cyanobacteria, 16 au 20 juillet, Noosa, Australie.
- BARBEAU B., A. CARRIÈRE, M. PRÉVOST, A. ZAMYADI et P. CHEVALIER (2008). Changements climatiques : Analyse de la vulnérabilité des installations québécoises de traitement de l’eau potable aux cyanobactéries toxiques. École Polytechnique de Montréal, Montréal, QC, Canada, 88 p.
- BERNHARDT H. et J. CLASEN (1991). Flocculation of micro-organisms. J. Water Supp. Res. Technol., 40, 76-87.
- BRUCHET A., F. BERNAZEAU, I. BAUDIN et P. PIERONNE (1998). Algal toxins in surface water: Analysis and treatment. Water Supp., 16, 619-623.
- BURDA C., Y. LOU, X. CHEN, A.C.S. SAMIA, J. STOUT et J.L. GOLE (2003). Enhanced nitrogen doping in TiO2 nanoparticles. Nano Lett., 3, 1049-1051.
- CARMICHAEL W.W. (1997). The cyanotoxins. Adv. Bot. Res., 27, 211-256.
- CARMICHAEL W.W. (2001). Health effects of toxin-producing cyanobacteria: The cyanohabs. Hum. Ecol. Risk Assess., 7, 1393-1407.
- CHEN Y.W., B.Q. QIN, K. TEUBNER et M.T. DOKULIL (2003). Long-term dynamics of phytoplankton assemblages: Microcystis-domination in lake Taihu, a large shallow lake in China. J. Plankton Res., 25, 445-453.
- CHOI S.G., T.J. HA, B.G. YU, S. SHIN, H.H. CHO et H.H. PARK (2007). Application of mesoporous TiO2 as a thermal isolation layer for infrared sensors. Thin Solid Films, 516, 212-215.
- CHORUS I. et J. BARTRAM (1999). Toxic cyanobacteria in water: A guide to their public health consequences, monitoring and management. CHORUS I. and J. BARTRAN (Éditeurs), E & FN Spon, London, Angleterre, 416 p.
- CHOW C.W.K., M. DRIKAS, J. HOUSE, M.D. BURCH et R.M.A. VELZEBOER (1999). The impact of conventional water treatment processes on cells of the cyanobacterium microcystis aeruginosa. Water Res., 33, 3253-3262.
- CHOW C.W.K., S. PANGLISCH, J. HOUSE, M. DRIKAS, M.D. BURCH et R. GIMBEL (1997). A study of membrane filtration for the removal of cyanobacterial cells. J. Water Supp. Res. Technol., 46, 324-334.
- CHROMOSTAT N., J.D. LAAT, M. DORÉ, H. SUTY et M. POUILLOT (1993). Étude de la dégradation de triazine par O3/H2O2 et O3. Cinétique et sous-produits de dégradation. Water Supp., 11, 149-157.
- COOK D. et G. NEWCOMBE (2002). Removal of microcystin variants with powdered activated carbon. Water Sci. Technol., 2, 201-207.
- COOK D. et G. NEWCOMBE (2008). Comparison and modeling of the adsorption of two microcystin analogues onto powdered activated carbon. Environ. Technol., 29, 525-534.
- CORNISH B.J.P.A., L.A. LAWTON et P.K.J. ROBERTSON (2000). Hydrogen peroxide enhanced photocatalytic oxidation of microcystin-LR using titanium dioxide. Appl. Catal. B-Environ., 25, 59-67.
- DONATI C., M. DRIKAS, R. HAYES et G. NEWCOMBE (1994). Microcystin-LR adsorption by powdered activated carbon. Water Res., 28, 1735-1742.
- DORÉ M. (1989). Chimie des oxydants et traitement des eaux. Tec et Doc (Éditeur), Lavoisier, Paris, France, 528 p.
- DRIKAS M., C.W.K. CHOW, J. HOUSE et M.D. BURCH (2001). Using coagulation, flocculation, and settling to remove toxic cyanobacteria. J. Am. Water Works Assoc., 93, 100-111.
- ELLIS D. (2008). Guide d’intervention pour les propriétaires, les exploitants ou les concepteurs de stations de production d’eau potable municipales aux prises avec une problématique de fleurs d’eau de cyanobactéries. Ministère du Développement durable, de l’Environnement et des Parcs, Direction des politiques de l’eau, ISBN 978-2-550-53297-2, Québec, QC, Canada, 46 p.
- FALCONER I.R. et A.R. HUMPAGE (2005). Health risk assessment of cyanobacterial (blue-green algal) toxins in drinking water. Int. J. Environ. Res. Public Health, 2, 43-50.
- FALCONER I.R. (2005). Cyanobacterial toxins of drinking water supplies: Cylindrospermopsins and Microcystins. CRC Press, Boca Raton, FL, USA, 279 p.
- FAWELL J., J. HART, H. JAMES et W. PARR (1993). Blue-green algae and their toxins: Analysis, toxicity, treatment, and environmental control. Water Supp., 11, 109-121.
- FITZGERALD D.J., D. CUNLIFFE et M. BURCH (1999). Development of health alerts for cyanobacteria and related toxins in drinking water in South Australia. Environ. Toxicol., 14, 203-209.
- GALVIN R.M. et J.M.R. MELLADO (1998). Potassium permanganate as pre-oxidant in a reverse osmosis water plant. Water S.A., 24, 361-363.
- GILROY D.J., K.W. KAUFFMAN, R.A. HALL, X. HUANG et F.S. CHU (2000). Assessing potential health risks from microcystin toxins in blue-green algae dietary supplements. Environ. Health Persp., 108, 435-439.
- GLAZE W.H., J.W. KANG et D.H. CHAPIN (1987). The chemistry of water-treatment processes involving ozone, hydrogen-peroxide and ultraviolet-radiation. Ozone-Sci. Eng., 9, 335-352.
- GRUTZMACHER G., G. BOTTCHER, I. CHORUS et H. BARTEL (2002). Removal of microcystins by slow sand filtration. Environ. Toxicol., 17, 386-394.
- HALL T., J. HART, B. CROLL et R. GREGORY (2000). Laboratory-scale investigations of algal toxin removal by water treatment. J. Chart. Inst. Water Environ. Manag., 14, 143-149.
- HARADA K. (1999). Recent advances of toxic cyanobacteria researches. J. Health Sci., 45, 150-165.
- HART J., J. FAWELL et B. CROLL (1998). The fate of both intra- and extracellular toxins during drinking water treatment. Water Supp., 16, 611-616.
- HENDRICKS D. (1991). Manual of design for slow sand filtration. AWWA Research Foundation et American Water Works Association, Denver, CO, USA, 274 p.
- HIMBERG K., A.-M. KEIJOLA, L. HIISVIRTA, H. PYYSALO et K. SIVONEN (1989). The effect of water treatment processes on the removal of hepatotoxins from microcystis and oscillatoria cyanobacteria: A laboratory study. Water Res., 23, 979-984.
- HITZFELD B.C., S.J. HOEGER et D.R. DIETRICH (2000). Cyanobacterial toxins: Removal during drinking water treatment, and human risk assessment. Environ. Health Persp., 108, 113-122.
- HOEGER S.J., D.R. DIETRICH et B.C. HITZFELD (2002). Effect of ozonation on the removal of cyanobacterial toxins during drinking water treatment. Environ. Health Persp., 110, 1127-1132.
- HOEGER S.J., B.C. HITZFELD et D.R. DIETRICH (2005). Occurrence and elimination of cyanobacterial toxins in drinking water treatment plants. Toxicol. Appl. Pharm., 203, 231-242.
- HOFFMAN J.R. (1976). Removal of microcystis toxins in water purification processes. Water S.A., 2, 58 60.
- HRUDEY S., M.D. BURCH, M. DRIKAS et R. GREGORY (1999). Remedial measures. Dans : Toxic Cyanobacteria in Water: A Guide to Their Public Health Consequences, Monitoring, and Management. CHORUS I. et J. BARTRAM (Éditeurs), E & FN Spon, New York, USA, pp. 275-312.
- INTERNATIONAL ORGANISATION FOR STANDARDISATION (2005). ISO 20179:2005. Water quality. Determination of microcystins. Method using solid phase extraction (SPE) and high performance liquid chromatography (HPLC) with ultraviolet (UV) detection. http://www.iso.org/iso/iso_catalogue/ catalogue_tc/catalogue_detail.htm?csnumber=34098 (consultation le 15 novembre 2009).
- JONES G.J. et P.T. ORR (1994). Release and degradation of microcystin following algicide treatment of a Microcystis-aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay. Water Res., 28, 871-876.
- JURCZAK T., M. TARCZYNSKA, K. IZYDORCZYK, J. MANKIEWICZ, M. ZALEWSKI et J. MERILUOTO (2005). Elimination of microcystins by water treatment processes - examples from Sulejow reservoir, Poland. Water Res., 39, 2394-2406.
- KARNER D.A., A.J.H. STANDRIDGE, G.W. HARRINGTON et R.P. BARNUM (2001). Microcystin algal toxins in source and finished drinking water. J. Am. Water Works Assoc., 93, 72-81.
- KEIJOLA A., K. HIMBERG, A. ESALA, K. SIVONEN et L. KIISVIRATA (1988). Removal of cyanobacterial toxins in water treatment processes: Laboratory and pilot plant experiments. Toxic. Assess., 3, 643-656.
- LAMBERT T.W., C.F.B. HOLMES et S.E. HRUDEY (1996). Adsorption of microcystin-LR by activated carbon and removal in full scale water treatment. Water Res., 30, 1411-1422.
- LAVOIE I., I. LAURION et W.F. VINCENT (2007). Les fleurs d’eau de cyanobactéries : Vulnérabilité des prises d’eau. Institut national de la recherche scientifique, rapport no 16, Québec, QC, Canada, 12 p.
- LAWTON L.A. et P.K.J. ROBERTSON (1999). Physico-chemical treatment methods for the removal of microcystins (cyanobacterial hepatotoxins) from potable waters. Chem. Soc. Rev., 28, 217-224.
- LAWTON L.A., P.K.J. ROBERTSON, B.J.P.A. CORNISH et M. JASPARS (1999). Detoxification of microcystins (cyanobacterial hepatotoxins) using TiO2 photocatalytic oxidation. Environ. Sci. Technol., 33, 771-775.
- LEE J. et H.W. WALKER (2008). Mechanisms and factors influencing the removal of microcystin-LR by ultrafiltration membranes. J. Membrane Sci., 320, 240–247.
- LEGRINI O., E. OLIVEROS et A.M. BRAUN (1993). Photochemical processes for water treatment. Chem. Rev., 93, 671-698.
- LETTERMAN R.D. (1999). Water quality and treatment: A handbook of community water supplies, fifth edition. American Water Works Association et McGraw-Hill, New York, NY, USA, 1248 p.
- MILLER M.J. et H.J. FALLOWFIELD (2001). Degradation of cyanobacterial hepatotoxins in batch experiments. Water Sci. Technol., 43, 229-232.
- MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L’ENVIRONNEMENT ET DES PARCS (2008). Bilan des lacs et cours d’eau touchés par les fleurs d’eau d’algues bleu-vert au Québec. http://www.mddep.gouv.qc.ca/eau/algues-bv/bilan/ (consultation le 27 août 2008).
- MINISTRY OF HEALTH, NEW ZEALAND (2008). Drinking-water standards for New Zealand 2005 (revised 2008). Ministry of Health, Wellington, Nouvelle-Zélande, 163 p.
- MOUCHET P. et V. BONNELYE (1998). Solving algae problems: French expertise and world-wide applications. J. Water Supp. Res. Technol., 47, 125-141.
- MUNTER R., S. PREIS, J. KALLAS, M. TRAPIDO et Y. VERESSININA (2001). Advanced oxidation processes (AOPs): Water treatment technology for the twenty-first century. Kemia-Kemi, 28, 354-362.
- MUNTISOV M. et P. TRIMBOLI (1996). Removal of algal toxins using membrane technology. Water J. Aust. Water Assoc., 23, 34.
- NATIONAL HEALTH AND MEDICAL RESEARCH COUNCIL, AUSTRALIAN GOVERNMENT (2004). National water quality management strategy, Australian drinking water guidelines 6. Australian Government, National Health and Medical Research Council, Natural Resource Management Ministerial Council, Canberra, Australie, 615 p.
- NEUMANN U. et J. WECKESSER (1998). Elimination of microcystin peptide toxins from water by reverse osmosis. Environ. Toxic. Water, 13, 143-148.
- NEWCOMBE G., S. BROOKE, P. CULLUM, B.C. NICHOLSON et N. SLYMAN (2002). Oxidation, adsorption and biological treatment for algal toxin removal. Dans : Proceedings of the AWWA 2002 Water Quality Technology Conference, Seattle, Washington, 10-14 november 2002. CD-ROM American Water Works Association, Denver, CO, USA, 5 p.
- NEWCOMBE G. et M. BURCH (2003). Toxic blue-green algae: Coming to a neighborhood near you? Opflow, 29, 4-7.
- NEWCOMBE G. et B.C. NICHOLSON (2002). Treatment options for the saxitoxin class of cyanotoxins. Water Sci. Technol., 2, 271-275.
- NICHOLSON B.C., J. ROSITANO et M.D. BURCH (1994). Destruction of cyanobacterial peptide hepatotoxins by chlorine and chloramine. Water Res., 28, 1297-1303.
- NICHOLSON B.C., G.R. SHAW, J. MORRALL, P.J. SENOGLES, T.A. WOODS, J. PAPAGEORGIOU, C. KAPRALOS, W. WICKRAMASINGHE, B.C. DAVIS, G.K. EAGLESHAM et M.R. MOORE (2003). Chlorination for degrading saxitoxins (paralytic shellfish poisons) in water. Environ. Technol., 24, 1341-1348.
- OLIVER R.L. et G.G. GANF (2000). Freshwater blooms, Dans : The Ecology of Cyanobacteria. Their Diversity in Time and Space. WHITTON B.A. et M. POTTS (Éditeurs), Kluwer Academic Publishers, Dordrecht, Pays-Bas, pp. 149-194.
- OPPENLÄDER T. et S. GLIESE (2000). Mineralization of organic micropollutants (homologous alcohols and phenols) by vacuum-UV-oxidation (H2O2-VUV) with an incoherent xenon-excimer lamp at 172 nm. Chemosphere, 40, 15-21.
- ORGANISATION MONDIALE DE LA SANTÉ (1998). Guidelines for drinking-water quality. Second edition. Addendum to volume 2: Health criteria and other supporting information. World Health Organization, Genève, Suisse, 283 p.
- PAILLARD H. (1994). Étude de la minéralisation de la matière organique dissoute en milieu aqueux dilué par ozonation, oxydation avancée O3/H2O2 et ozonation catalytique hétérogène. Thèse de Doctorat, Univ. Poitiers, France, 224 p.
- PAILLARD H., R. BRUNET et M. DORÉ (1988). Conditions optimales d’application du système oxydant ozone-peroxyde d’hydrogène. Water Res., 22, 91-103.
- PARSONS S. (2004). Advanced oxidation processes for water and wastewater treatment. PARSONS. S. (Éditeur), IWA Publishing, Alliance House, Londres, Angleterre, 356 p.
- QIAO R.P., N. LI, X.H. QI, Q.S. WANG et Y.Y. ZHUANG (2005). Degradation of microcystin-RR by UV radiation in the presence of hydrogen peroxide. Toxicon, 45, 745-752.
- QUILLIAM M.A. (1998). Liquid chromatography-mass spectrometry: A universal method for analysis of toxins?, Dans : Harmful Algae. Proceedings of the VIII International Conference on Harmful Algae, Vigo, Spain, 25-29 juin 1997. REGUERA B., J. BLANC, M.L. FERNANDEZ et T. WYATT (Éditeurs), Intergovernmental Oceanographic Commission of UNESCO, Vigo, Espagne, pp. 509-514.
- RAPALA J., K. LAHTI, L.A. RASANEN, A.-L. ESALA, S.I. NIEMELA et K. SIVONEN (2002). Endotoxins associated with cyanobacteria and their removal during drinking water treatment. Water Res., 36, 2627-2635.
- ROBERTSON P.K.J., L.A. LAWTON et B.J.P.A. CORNISH (1999). The involvement of phycocyanin pigment in the photodecomposition of the cyanobacterial toxin, microcystin-LR. J. Porphyr. Phthalocya., 3, 544-551.
- RODRIGUEZ E., G.D. ONSTAD, T.P.J. KULL, J.S. METCALF, J.L. ACERO et U. VON GUNTEN (2007). Oxidative elimination of cyanotoxins: Comparison of ozone, chlorine, chlorine dioxide and permanganate. Water Res., 41, 3381-3393.
- RODRIGUEZ E.M., J.L. ACERO, L. SPOOF et J. MERILUOTO (2008). Oxidation of MC-LR and -RR with chlorine and potassium permanganate: Toxicity of the reaction products. Water Res., 42, 1744-1752.
- ROSITANO J., G. NEWCOMBE, B. NICHOLSON et P. SZTAJNBOK (2001). Ozonation of NOM and algal toxins in four treated waters. Water Res., 35, 23-32.
- ROSITANO J. et B.C. NICHOLSON (1994). Water treatment techniques for the removal of cyanobacterial toxins from water. Australian Centre for Water Quality Research, Report 2/94, Salisbury, Australie, 55 p.
- ROSITANO J., B.C. NICHOLSON et P. PIERONNE (1998). Destruction of cyanobacterial toxins by ozone. Ozone-Sci. Eng., 20, 223-238.
- SANTÉ CANADA (2008). Guidelines for Canadian drinking water quality, summary table. Federal-Provincial-Territorial Committee on Drinking Water of the Federal-Provincial-Territorial Committee on Environmental and Occupational Health, Ottawa, ON, Canada, 14 p.
- SCHMIDT W., H. WILLMITZER, K. BORNMANN et J. PIETSCH (2002). Production of drinking water from raw water containing cyanobacteria - pilot plant studies for assessing the risk of microcystin breakthrough. Environ. Toxicol., 17, 375-385.
- SCHOLIN C., E. VRIELING, L. PEPERZAK, L. RHODES et P. RUBLEE (2003). Detection of HAB species using lectin, antibody and DNA probes, Dans : Manual on Harmful Marine Microalgae. HALLEGRAEFF G.M., D.M. ANDERSON et A.D. CEMBELLA (Éditeurs), UNESCO, Paris, France, pp. 131-163.
- SHAW G.R., X. SHEN, W. WICKRAMASINGHE, P. SENOGLES, G.K. EAGLESHAM, P.K.S. LAM et M.R. MOORE (2001). Toxicological aspects of byproducts of chlorination of the cyanobacterial toxin, cylindrospermopsin. Dans : Toxicology and Sustainable Development - Meeting the Challenge.IXth International Congress of Toxicology, 8-12 juillet, Brisbane, Australie, 164, 174-174.
- SIVONEN K. et G. JONES (1999). Cyanobacterial toxins, Dans : Toxic Cyanobacteria in Water: A Guide to Their Public Health Consequences, Monitoring, and Management. CHORUS I. et J. BARTRAM (Éditeurs), E & FN Spon, London, Angleterre, pp. 41-111.
- SVRCEK C. et D.W. SMITH (2004) Cyanobacteria toxins and the current state of knowledge on water treatment options: A review. J. Environ. Eng. Sci., 3, 155-185.
- TEIXEIRA M.R. et M.J. ROSA (2006). Comparing dissolved air flotation and conventional sedimentation to remove cyanobacterial cells of Microcystis aeruginosa part 1: The key operating conditions. Sep. Purif. Technol., 52, 84-94.
- TSUJI K., S. NAITO, F. KONDO, N. ISHIKAWA, M.F. WATANABE, M. SUZUKI et K. HARADA (1994). Stability of microcystins from cyanobacteria - effect of light on decomposition and isomerization. Environ. Sci. Technol., 28, 173-177.
- TSUJI K., T. WATANUKI, F. KONDO, M.F. WATANABE, H. NAKAZAWA, M. SUZUKI, H. UCHIDA et K. HARADA (1997). Stability of microcystins from cyanobacteria -iv. Effect of chlorination on decomposition. Toxicon, 35, 1033-1041.
- TSUJI K., T. WATANUKI, F. KONDO, M.F. WATANABE, S. SUZUKI, H. NAKAZAWA, M. SUZUKI, H. UCHIDA et K. HARADA (1995). Stability of microcystins from cyanobacteria. 2. Effect of uv light on decomposition and isomerization. Toxicon, 33, 1619-1631.
- VAN APELDOORN M.E., H.P. VAN EGMOND, G.J.A. SPEIJERS et G.J.I. BAKKER (2007). Toxins of cyanobacteria. Mol. Nutr. Food Res., 51, 7-60.
- VUORI E., A. PELANDER, K. HIMBERG, M. WARIS et K. NIINIVAARA (1997). Removal of nodularin from brackish water with reverse osmosis or vacuum distillation. Water Res., 31, 2922-2924.
- WANG H.X., L. HO, D.M. LEWIS, J.D. BROOKES et G. NEWCOMBE (2007). Discriminating and assessing adsorption and biodegradation removal mechanisms during granular activated carbon filtration of microcystin toxins. Water Res., 41, 4262-4270.
- WARHURST A.M., S.L. RAGGETT, G.L. MCCONNACHIE, S.J.T. POLLARD, V. CHIPOFYA et G.A. CODD (1997). Adsorption of the cyanobacterial hepatotoxin microcystin-LR by a low-cost activated carbon from the seed husks of the pan-tropical tree, Moringa oleifera. Sci. Total Environ., 207, 207-211.
- WESTRICK J.A. (2008). Cyanobacterial toxin removal in drinking water treatment processes and recreational waters, Dans : Cyanobacterial Harmful Algal Blooms: State of the Science and Research Needs. HUDNELL H.K. (Éditeur), Springer, New York, USA, pp. 275-290.
- ZHOU H. et D.W. SMITH (2001). Advanced technologies in water and wastewater treatment. Can. J. Civil Eng., 28, 49-66.
List of figures
Figure 1
Structure des molécules de (a) MC-LR et de (b) MC-LA (tirée de COOK et NEWCOMBE, 2008).
Molecular structures of (a) MC-LR and (b) MC-LA (from COOK and NEWCOMBE, 2008).
Figure 2
Colonie de Microcystis aeruginosa, une espèce potentiellement toxique (échelle = 60 µm).
Colony of Microcystis aeruginosa, a potentially toxic species (scale = 60 µm).
Figure 3
Élimination des (a) MC-LR et des (b) MC-LA à l'aide des procédés de CAG conventionnel avec biofilm, de CAG stérile et de filtre sur sable; les zones encadrées indiquent l'initiation de la période de biodégradation dans la colonne de sable (tirée de WANG et al., 2007).
Removal of (a) MC-LR and (b) MC-LA through the use of conventional granular activated carbon (GAC) with biofilm, sterile GAC and sand columns; the dashed area represents the onset of biodegradation in the sand column (from WANG et al., 2007).
List of tables
Tableau 1
Normes sur la qualité de l'eau pour les cyanotoxines (adapté de HOEGER et al., 2005).
Water quality guidelines for cyanotoxins (adapted from HOEGER et al., 2005).
Tableau 2
Comparaison des différents procédés physico-chimiques appliqués pour l'élimination des cyanotoxines et des cyanobactéries.
Comparison of different physico-chemical processes used for cyanotoxin and cyanobacteria removal.
Tableau 3
Comparaison des différents procédés d'oxydation chimique appliqués pour l'élimination des cyanotoxines et cyanobactéries.
Comparison of chemical oxidation process used for cyanotoxin and cyanobacteria removal.