Abstracts
Résumé
Dans le cadre de travaux sur le comportement des composés des butylétains dans les milieux côtiers froids, des échantillons d’eau, de matière particulaire en suspension et de seston (phyto- et zooplancton) ont été prélevés à huit (8) stations le long du fjord du Saguenay (Canada) et dans la baie des Ha! Ha! en mai 2001. Les concentrations en butylétains totaux (MBT + DBT + TBT) étaient significativement plus élevées en surface (26 à 206 ng Sn L-1) que dans les échantillons de fond (7 à 30 ng Sn L-1). Les niveaux trouvés à l’embouchure du fjord étaient deux fois plus élevés que ceux observés dans son axe principal et cinq fois plus élevés que ceux dans la baie des Ha! Ha! dont les concentrations variaient de 40 à 55 ng Sn L-1 avec les plus élevées à proximité de Port‑Alfred. Le tributylétain (TBT) est toujours le composé minoritaire, que ce soit dans les eaux de surface (de 1 à 5 %) ou dans la couche d’eau profonde (5 à 24 %). Le dibutylétain (DBT) domine dans les deux masses d’eau avec des proportions d’environ 85 % pour la surface et de 34 à 90 % au fond. Le monobutylétain (MBT) est présent dans toute la colonne d’eau avec des pourcentages fluctuant de 4 à 15 % dans les eaux de surface et de 2 à 46 % dans les eaux profondes. Les butylétains sont également présents dans tous les échantillons de seston. En surface, les concentrations des métabolites (DBT + MBT) sont plus élevées (25 à 59 ng Sn g-1) que celles du TBT (10 et 20 ng Sn g-1). Dans la couche de fond, le TBT est majoritaire dans le seston avec des concentrations similaires entre les stations d’environ 30 ng Sn g-1. Les facteurs de bioconcentration obtenus à partir des données du seston confirment que les niveaux de TBT dans l’eau sont suffisants pour induire une bioaccumulation par étape au sein de la chaîne alimentaire. Enfin, les concentrations en TBT dans la colonne d’eau semblent bien au-dessus du niveau susceptible de perturber l’écosystème en causant des effets chroniques sur la reproduction de plusieurs organismes ou en affaiblissant leurs systèmes immunitaires.
Mots-clés:
- Butylétains,
- distribution spécifique,
- devenir des butylétains,
- colonne d’eau,
- milieu côtier froid,
- toxicité
Abstract
In order to understand the fate of butyltin compounds in cold coastal ecosystems, samples of water, suspended particulate matter and seston (phyto- and zoo-plankton) were taken in the Saguenay Fjord, a deep and narrow glacial valley filled with seawater from the St. Lawrence Estuary (Canada) and used as a navigation channel to reach an upstream industrial area. On one hand, this study was designed to evaluate the butyltin contamination level of waters of the Fjord. On the other hand, the samples were used to better understand the behaviour of tributyltin (TBT) and its breakdown products (dibutyltin (DBT), monobutyltin (MBT)) in the water column and its associated ecosystem. In addition, this study enabled us to establish if concentrations found in the Fjord may represent a toxic threat for the biota.
The water sampling was carried out at eight stations and various depths along the Saguenay Fjord and in the Baie des Ha! Ha! in May 2001. During this same expedition, samples of seston were also collected at 5 and 70 m depth for the same stations. Butyltins were extracted according to a well defined protocol and quantified by gas chromatography - mass spectrometry (GC-MS) on an Ion Trap GC/MS operated in single ion monitoring (SIM) mode. In the water column, concentrations of total butyltins (MBT + DBT + TBT) were significantly higher in surface samples (26 to 206 ng Sn L-1) than in deep samples (7 to 30 ng Sn L-1). The levels found at the mouth of the Fjord were two times higher than those observed along its main axis and five times higher than those in the Baie des Ha! Ha! where concentrations varied from 40 to 55 ng Sn L-1 with the highest values observed near Port Alfred. Tributyltin (TBT) was always a minor component in water surface (from 1 to 5%) as well as in the deep water layer (5 to 24%). Dibutyltin (DBT) dominated in the two water masses with proportions of approximately 85% for surface and from 34 to 90% at the bottom. Monobutyltin (MBT) was present in all waters, contributions fluctuating from 4 to 15% in surface water and from 2 to 46% in deep water. Butyltin compounds were also present in all seston samples. In the surface layer, concentrations of metabolites (DBT + MBT) were higher (25 to 59 ng Sn g-1) than TBT itself (10 to 20 ng Sn g-1). However, TBT dominated in the deep samples (70 m depth) with similar concentrations among stations of approximately 30 ng Sn g‑1.
This study presented the first evidence of the widespread butyltin contamination of Saguenay Fjord with levels typically reported for contaminated coastal areas. The shipping traffic was considered as the main source of continuous butyltin inputs, essentially TBT, but industrial activities located along the St. Lawrence Estuary were also suspected of generating the release of significant quantities of DBT, and thus contributing to the total reservoir of butyltins. The particular oceanographic conditions of the Saguenay Fjord (tidal cycles, strong stratification of water column) were responsible for the variation of concentrations among stations but also among depths. In addition, results observed in this study (high bioconcentration factors) confirmed the affinity of TBT for particulate matter compared to its metabolite, DBT. The chemical properties of TBT (low solubility, high water-sediment and water-octanol partition coefficients) are such that the processes of sorption and bioaccumulation in organisms are favoured. Bioconcentration factors calculated from seston data confirmed that the levels of TBT in water were sufficient to induce a stepwise bioaccumulation throughout the food chain. Consequently, suspended particular matter and organisms were the two compartments responsible for the TBT elimination from the water column to sediment. On the other hand, because of its higher solubility and a lower water-sediment partition coefficient, DBT was the major compound in the dissolved phase and its behaviour was influenced by hydrographic conditions. Lastly, TBT concentrations in the water column seemed well above the level likely to disturb the ecosystem by causing chronic effects on the reproduction of several organisms or by disturbing their immune systems.
Keywords:
- Butyltins,
- specific distribution,
- fate of butyltin,
- water,
- cold coastal ecosystems,
- toxicity
Article body
1. Introduction
Depuis près d’une trentaine d’années, le tributylétain (TBT) est un polluant reconnu du milieu marin (YANG et MAGUIRE, 2000). Largement utilisé comme biocide dans les peintures antisalissures, ce composé a reçu une attention particulière dès la fin des années 70, en raison de ses effets dévastateurs sur les organismes marins, plus particulièrement les mollusques, les bivalves (ALZIEU et al., 2000) et les gastéropodes (GIBBS et al., 1988).
Malgré la mise en place d’une réglementation sur l’usage des peintures à base de TBT dans plusieurs pays, et ce depuis les années 1980, ces peintures continuent d’être utilisées sur les navires >25 m, mais aussi dans les pays encore non réglementés, ayant pour conséquence une contamination ubiquiste et persistante par les butylétains avec une menace toxique envers tous les écosystèmes marins mondiaux (MICHEL et al., 2001; SUDARYANTO et al., 2002). Sa présence n’est pas seulement détectée dans les zones côtières mais également dans les environnements océaniques et profonds à des teneurs parfois élevées (HOCH, 2001). Or, le TBT est connu pour être toxique même à de très faibles concentrations de l’ordre de 1 à 20 ng L-1 (FENT, 1996).
Dans le milieu naturel, le TBT peut subir une débutylation successive en dibutylétain (DBT) puis en monobutylétain (MBT), deux métabolites apparemment moins toxiques, permettant ainsi l’élimination graduelle du TBT. Relativement rapide dans la colonne d’eau (MAGUIRE et TKACZ, 1985), ce processus est fortement ralenti dans le compartiment sédimentaire rendant ainsi le TBT plus persistant, particulièrement dans les milieux froids (<10 oC) (De MORA et PELLETIER, 1997). Par conséquence, ces sites contaminés représentent une source potentielle de contamination à long terme pour l’écosystème aquatique (HARRIS et al., 1996). D’autant plus que certaines régions arctiques et sub-arctiques semblent fortement contaminées (STRAND et al., 2003; ST‑ LOUIS et al., 1997a).
Bien que le TBT soit toxique à faibles concentrations et bien qu’il soit très persistant dans le sédiment, il n’existe encore aucune étude approfondie sur le TBT et ses produits de dégradation (DBT, MBT) décrivant et prévoyant leur distribution et leurs effets en milieu marin en général, et en milieu côtier froid en particulier. C’est dans une telle perspective que le fjord du Saguenay a été choisi pour une étude sur le comportement des butylétains dans un écosystème côtier nordique et semi-fermé. Deux précédentes études menées dans ce fjord ont bien démontré la présence ubiquiste des butylétains aussi bien dans les organismes benthiques que dans les sédiments, mais également leur persistance et le risque toxicologique relativement élevé envers tout le biote (VIGLINO et al., 2004; VIGLINO et al., 2005). Tenter de modéliser le comportement des butylétains dans un écosystème aquatique de grande taille exige également des connaissances sur leur distribution et devenir dans la colonne d’eau. Compte tenu de l’absence de données, une troisième étude, dont les résultats sont présentés dans cet article, a été réalisée dans la colonne d’eau du fjord du Saguenay. Cette étude nous a permis, d’une part, d’évaluer la contamination des eaux du fjord et, d’autre part, de tenter de mieux comprendre le cheminement du TBT et de ces produits de dégradation dans ce compartiment de l’écosystème, et enfin d’établir si les concentrations retrouvées pourraient représenter une menace pour le biote.
2. Méthodologie
2.1 Échantillonnage
Fin mai 2001, une expédition océanographique s’est déroulée dans le fjord du Saguenay à bord de l’Alcide-C-Horth (Ancien chalutier de 33 m transformé en navire océanographique et utilisé par l’Université du Québec à Rimouski pour ses expéditions océanographiques jusqu’en 2003). L’échantillonnage a été effectué dans l’estuaire du Saint-Laurent à proximité de l’embouchure du fjord (SL1), dans l’axe principal du fjord (FJ0, SAG-30, SAG-16) et enfin dans la baie des Ha! Ha! (SAG-13, SAG-09, SAG-07 et SAG-02) (Figure 1). Après avoir effectué des profils de pH, température-salinité pour chacune des stations, l’eau a été prélevée à l’aide de bouteilles Niskin de 5 et 12 litres (préalablement nettoyées puis rincées avec l’eau à échantillonner) aux profondeurs 0, 5, 10, 50 et 100 m (excepté pour la station SAG-02 où seul les échantillons de surface ont été prélevés). L’eau des bouteilles Niskin a été sous-échantillonnée pour les mesures du matériel particulaire en suspension (MPS), du carbone organique particulaire (COP) et le rapport C/N ainsi que pour la détermination des butylétains. Les échantillons ont été réalisés en triplicata et le coefficient de variation pour les MPS est de 5 %, pour le COP de 2 % et le rapport C/N de 3 %. Pendant cette même mission, des échantillons de plancton ont été récoltés à l’aide d’un filet remorqué à une vitesse de 2 noeuds pendant 15 minutes (maille : 180 µm) à 5 m de profondeur pour les stations SAG-02, 09, 13, 16 et 30 et à 70 m aux stations SAG-09, 13 et 16 (Figure 1). Ces échantillons biologiques ont été conservés à -20 ºC pour la détermination ultérieure des butylétains. Pendant l’échantillonnage du plancton, le filet a été parfois colmaté par des agrégats phytoplanctoniques en raison d’un bloom de printemps. Ainsi, les échantillons de surface sont en partie composés de cellules phytoplanctoniques avec du zooplancton tandis que ceux prélevés à 70 m sont principalement composés de zooplancton de taille supérieure à 180 µm. Étant donné que la composition planctonique n’a pas été déterminée, ces échantillons sont appelés « seston » ci-après.
Figure 1
Localisation des stations échantillonnées dans l’estuaire du Saint-Laurent, le fjord du Saguenay et la Baie des Ha!Ha!.
Location of sampled stations in the St. Lawrence Estuary, the Saguenay Fjord and the Baie des Ha! Ha!.
2.2 Analyses chimiques
Pour des raisons d’optimisation des analyses, les butylétains de la colonne d’eau ont été extraits immédiatement après l’échantillonnage directement à bord de l’Alcide-C-Horth et selon la méthode modifiée de MICHEL et AVERTY (1991). Un volume d’eau de 2 L non filtrée (important pour la suite) a été placé dans une ampoule à décanter (en utilisant 3 ampoules par profondeur pour une volume total de 6 litres). Une fois le pH ajusté à 5,5 par de l’acide nitrique et l’addition de 0,1 mL d’une solution aqueuse à 4 % de tétraéthylborate de sodium (NaBEt4), l’ampoule a été agitée manuellement et vigoureusement pendant 5 min. Un mélange de 10 mL d’iso-octane:pentane (1:4) a ensuite été ajouté, suivi d’une nouvelle agitation de 10 min. Après un temps de décantation de 30 min et l’ajout de 100 µl de tétrabutylétain (TeBuSn) comme standard interne, la phase organique a été récupérée puis transférée dans un tube conique (12 mL) afin de réduire le volume sous azote jusqu’à 0,5 mL. Un volume de 0,5 mL de dichlorométhane (pour éliminer les risques de sorption sur le verre) a été additionné à l’extrait avant que celui-ci soit stocké dans une fiole ambrée à -20 oC pour les analyses chimiques au laboratoire.
L’extraction des butylétains sur le seston a été réalisée en laboratoire à partir de la méthode de CHAU et al. (1997a) telle que modifiée et déjà décrite dans une précédente étude (VIGLINO et al., 2005).
Quantification : Une première analyse a permis de constater que, parmi les butylétains, le tributylétain était présent dans chaque extrait mais difficilement quantifiable. C’est pourquoi dans le but d’optimiser la quantification du TBT dans les échantillons et d’éliminer le dichlorométhane, les extraits dans les trois fioles ambrées correspondant à la même station et même profondeur ont été réunis dans un même tube conique et le volume réduit sous azote à 0,2 mL. Le dosage des butylétains (1,0 µL de l’extrait) a été effectué avec un chromatographe à gaz couplé à un spectromètre de masse (Finnigan PolarisQ Ion Trap GC/MS) fonctionnant en recherche d’ions spécifiques SIM (single ion monitoring) et selon des conditions opératoires décrites précédemment (VIGLINO et al., 2004). La limite de détection instrumentale était de 1,5 pg Sn/µL injecté pour le TBT, DBT et le MBT, ce qui correspondait à une limite de détection de la méthode de 0,15 ng Sn/L pour chacun des composés. L’identification des butylétains était basée sur leur spectre de masse et leur temps de rétention. La quantification des aires était établie par rapport au standard interne (TeBuSn). Comme il n’existe pas de standard certifié pour ce type d’échantillon, le rendement de la méthode a été quantifié à partir d’une solution d’eau originaire du fjord du Saguenay additionnée d’une solution de butylétains (MBT + DBT + TBT) de concentration de 60 ng Sn/L. Les taux de récupération (n = 6) ont été de 72 ± 7 % (moy ± DS) pour le TBT, 83 ± 5 % pour le DBT et 82 ± 4 % pour le MBT. Les données ci-dessous n’ont pas été corrigées par rapport à ce rendement.
2.3 Analyses statistiques
Une ANOVA à un facteur avec un test de Tukey (Software®SPSS 9.0) a été utilisée afin de déterminer des différences significatives entre les sites ou entre les échantillons de surface et ceux de la masse d’eau profonde.
3. Résultats
3.1 Caractéristiques des eaux du fjord
Les caractéristiques physico-chimiques des masses d’eau du fjord échantillonnées dans cette étude sont similaires à celles rapportées dans des études antérieures (SCHAFER et al., 1990; PELLETIER et al., 1999). La figure 2 illustre le profil salinité/température typique de la station SAG-09 montrant une colonne d’eau fortement stratifiée, composée de deux masses d’eau telle que retrouvée à toutes les autres stations. En surface (0-10 m), on observe une mince lentille d’eau peu salée avec un gradient de salinité de l’amont vers l’aval. Dans la baie des Ha! Ha!, la salinité moyenne en surface était de 3,2 ± 0,4 ‰ (moy ± DS) et pour le fjord de 7,9 ± 0,3 ‰. Cette différence est causée par un mélange des eaux douces s’écoulant du bassin de drainage (les rivières Ha! Ha! et à Mars) et des eaux salées en provenance du fleuve (SCHAFER et al., 1990). La température de cette couche de surface est sujette aux variations saisonnières, avec une température moyenne dans le fjord de 7,8 ± 0,05 ºC et pour la baie de 10,2 ± 0,1 ºC au moment de notre échantillonnage quoique cette masse d’eau peut atteindre une température de 16 ºC en été (SHAFER et al., 1990). Sous cette couche d’eau saumâtre se profile une masse d’eau salée, plus dense et homogène possédant une salinité stable toute l’année (29,3 ± 0,4 ‰) avec une température moyenne de 1,2 ± 0,3 ºC. Le pH (non présenté) ne varie pas entre les stations mais on observe une légère différence entre les deux masses d’eau avec une valeur moyenne de 7,2 ± 0,3 pour la couche de surface et 7,6 ± 0,1 pour la couche profonde.
Figure 2
Salinité et température de la colonne d’eau au centre de la baie des Ha! Ha!.
Salinity and temperature profiles in the water column of the Baie des Ha! Ha!.
L’abondance de la matière particulaire en suspension (MPS) pour la couche de surface dans le Saint-Laurent est en moyenne de 12,4 mg L-1, valeur supérieure à celles retrouvées dans la fjord et la Baie des Ha! Ha! (tableau 1). Ces dernières varient peu entre les stations mais augmentent avec la profondeur, particulièrement dans la couche de surface (0‑10 m) où la valeur moyenne à 0 m est de 4,6 mg L-1 et atteint un maximum de 8 mg L-1 à 10 m, profondeur où se situe la zone d’interface eau saumâtre-eau salée (ANDERSSON et al., 2001). Pour la couche d’eau profonde, l’abondance de matière en suspension reste homogène avec une valeur moyenne de 9,8 mg L‑1. Les mesures de carbone organique particulaire (COP) indiquent clairement que les particules des eaux de surface sont nettement plus riches en carbone organique que celles de la couche profonde (tableau 1). Ces résultats soulignent le caractère plutôt minéral du matériel en suspension se trouvant dans la couche d’eau profonde résultant probablement de la minéralisation de la matière organique au cours de sa chute. D’autre part, les valeurs retrouvées à la surface sont nettement supérieures aux données fournies par THERRIAULT et al. (1984) indiquant des valeurs de l’ordre de 150 à 200 µg L‑1 pour des mesures effectuées en août. La présence d’un bloom lors de notre échantillonnage peut expliquer ces valeurs plus élevées à la surface tandis que celles mesurées dans la couche de fond sont plus homogènes et coïncident avec des études précédentes (PELLETIER et al., 1999).
Tableau 1
Concentrations moyennes (n=3) de la matière en suspension, MPS (mg L-1), du carbone organique, COP (µg L-1) ainsi que le rapport C/N à différentes profondeurs pour les stations du St-Laurent, du fjord du Saguenay et de la baie des Ha! Ha!.
Mean concentrations of suspended particulate matter, MPS (mg L-1), organic carbon, COP (µg L-1) and the C/N ratios at different depths for stations in St. Lawrence Estuary, the Saguenay Fjord, and the Baie des Ha! Ha!.
Globalement, le rapport C/N semble indiquer la présence de matière organique particulaire d’origine marine pour l’estuaire et d’origine plutôt terrestre pour le fjord du Saguenay (tableau 1). Toutefois, des valeurs plus faibles suggérant une production marine planctonique se retrouvent aux stations correspondant à un carbone organique particulaire élevé, ce qui confirme l’hypothèse d’un bloom algal lors de l’échantillonnage.
3.2 Butylétains dans la colonne d’eau
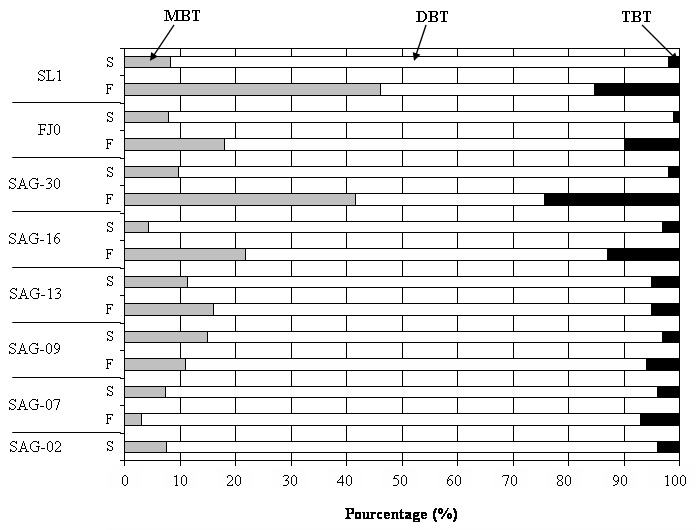
Les butylétains ont été détectés dans tous les échantillons analysés avec des concentrations en butylétains totaux (MBT + DBT + TBT) significativement plus élevées en surface de 0 à 10 m (26 à 206 ng Sn L-1) que dans les échantillons de fond (7 à 30 ng Sn L-1) (p≤0,02) (figure 3). À la surface, les concentrations les plus élevées s’observent dans l’estuaire du St-Laurent (SL1). Les niveaux trouvés dans le St-Laurent sont deux fois plus élevés que ceux observés dans l’axe principal du fjord et cinq fois plus élevés que ceux dans la baie des Ha! Ha! dont les concentrations varient de 40 à 55 ng Sn L-1 avec les plus élevées vers les stations proches de l’installation portuaire de Port‑Alfred (SAG-07 et SAG-02). Les concentrations obtenues pour les échantillons de fond sont toujours plus faibles que celles de surface, quelle que soit la station. Cette différence est tout de même moins marquée aux stations les plus en amont du Saguenay (figure 3). Concernant les proportions entre les différentes espèces de butylétains (TBT, DBT, MBT), le TBT est toujours le composé minoritaire, que ce soit dans les eaux de surface avec des pourcentages variant de 1 à 5 % ou dans la couche d’eau profonde (5 à 24 %). Le dibutylétain (DBT) domine dans les deux masses d’eau avec des proportions d’environ 85 % pour la surface et de 34 à 90 % au fond (figure 4). Le MBT est également présent à travers toute la colonne d’eau avec des pourcentages fluctuant de 4 à 15 % dans les eaux de surface et de 2 à 46 % dans les eaux profondes.
Figure 3
Concentrations (ng Sn L-1) des butylétains totaux dans les eaux de surface et profondes à l’embouchure du fjord du Saguenay (SL1), dans l’axe principal du fjord du Saguenay (FJ0, SAG-30, SAG-16) et dans la Baie des Ha! Ha! (SAG-13, SAG-09 et SAG-07, SAG-02).
Concentrations (ng Sn L-1) of total butyltins in surface and deep waters sampled at the mouth of the Saguenay Fjord (SL1), along the main axis of the Fjord (FJ0, SAG-30, SAG-16) and in the Baie des Ha! Ha! (SAG-13, SAG-09 et SAG-07, SAG-02).
Figure 4
Pourcentages (%) des espèces de butylétains (MBT, DBT, TBT) dans les eaux de surface et profondes à l’embouchure du fjord du Saguenay (SL1), dans l’axe principal du fjord du Saguenay (FJ0, SAG-30, SAG-16) et dans la Baie des Ha! Ha! (SAG-13, SAG-09, SAG-07, SAG-02).
Percentages (%) of butyltin species (MBT, DBT, TBT) in surface and deep waters sampled at the mouth of the Saguenay Fjord (SL1), along the main axis of the Fjord (FJ0, SAG-30, SAG-16) and in the Baie des Ha! Ha! (SAG-13, SAG-09 et SAG-07, SAG-02).
3.3 Butylétains dans le seston
Les butylétains sont également présents dans tous les échantillons de seston (tableau 2). En surface, les concentrations des métabolites (DBT, MBT) sont plus élevées que celles du TBT; elles varient peu entre les stations et sont de 30 à 58 ng Sn g-1 pour le DBT, de 25 à 39 ng Sn g-1 pour le MBT tandis que les concentrations du TBT se distribuent entre 10 et 20 ng Sn g-1. À l’inverse, dans la couche de fond, le TBT est globalement majoritaire avec des concentrations similaires entre les stations soit de 30 à 32 ng Sn g-1.
Tableau 2
Concentrations des butylétains dans le seston (ng Sn/g-1 poids humide) et dans l’eau (ng Sn/mL-1) de la couche de surface (S) et profonde (F) collectés dans l’axe principal du fjord et dans la Baie des Ha! Ha!. Estimation des facteurs de bioconcentration à partir de ces mêmes échantillons (BCF = [seston]/ [eau]).
Concentration of butyltins in seston (ng Sn/g-1 wet weight) and in water (ng Sn/ mL-1) in the surface (S) and deep (F) layers collected in the main axis of the Fjord and the Baie des Ha! Ha!. Bioconcentration factors estimated for the same samples (BCF = [seston]/[water]).
3.4 Facteurs de bioconcentration (BCF)
Les facteurs de bioconcentration représentent le rapport entre la concentration dans le seston et celle trouvée dans la colonne d’eau correspondante [ng Sn g-1 poids humide]/ [ng Sn mL-1 d’eau]. Ces facteurs ont été calculés pour chacun des composés de butylétains à la fois pour les échantillons de surface et ceux à 70 m (tableau 2).
Dans les eaux de surface, les BCFTBT sont les plus élevés (6,7 x 103 à 1,3 x 104) comparés aux facteurs des métabolites (BCFDBT et BCFMBT) qui varient de 2,8 x 102 à 1,4 x 103 pour le MBT et 7,0 x 102 à 1,5 x 103 pour le DBT. Aucune différence significative n’a été observée entre les différentes stations, et ce, pour les trois composés.
Concernant les échantillons collectés dans la couche d’eau profonde, les BCFTBT sont constants entre les stations (2,0 à 2,1 x 104) mais significativement deux fois plus élevés que ceux des eaux de surface (p≤0,001). Pour le DBT, les valeurs varient entre 1,6 et 5,7 x 102, valeurs significativement plus faibles que celles trouvées dans les eaux de surface (p≤0,02) (tableau 2). Enfin pour le MBT, les valeurs sont similaires à celles observées dans les eaux de surface et varient entre 3,8 et 7,5 x 102.
3.5 Estimation des concentrations de butylétains sur la matière particulaire
Pour des raisons de limite de détection de la méthode analytique, les concentrations des butylétains n’ont pu être obtenues directement sur la matière particulaire en suspension (MPS). Cependant, en utilisant les coefficients de partition eau-sédiment (Kd) et les concentrations de chacune des espèces chimiques dans l’eau, une estimation de la quantité de TBT, DBT et MBT a pu être établie pour la MPS de la couche de surface et des eaux profondes. Les résultats sont rassemblés au tableau 3. Les concentrations en TBT particulaire varient relativement peu entre les stations de même qu’en fonction de la profondeur. Les valeurs se situent entre 13 et 22 ng Sn g‑1 (poids sec) pour la couche surface et 11‑27 ng Sn g-1 pour la couche profonde. Pour le DBT, il y a une variation des concentrations entre les stations mais également en fonction de la profondeur, les concentrations les plus élevées sont situées à la surface, soit des concentrations variant de 19 à 68 ng Sn g‑1, et pour la couche profonde, de 1,4 à 15 ng Sn g‑1. Enfin, les niveaux de MBT varient aussi en fonction des stations et de la profondeur (7 à 29 ng Sn g-1 pour la surface et de 3 à 16 ng Sn g-1 pour les eaux profondes).
Tableau 3
Estimation de la concentration (ng Sn/g-1) de chaque espèce de butylétains (TBT, DBT, MBT) dans la matière particulaire présente dans la couche de surface (S) et profonde (F) pour les stations du fjord du Saguenay et dans la Baie des Ha! Ha!.
Estimation of the concentration (ng Sn/g-1) of each butyltin species (TBT, DBT, MBT) in the particulate matter present in the surface (S) and deep (F) layers for stations in the Saguenay Fjord and in the Baie des Ha! Ha!.
[MBT]part = Kd (MBT)(L/g) x [MBT]eau(ng/L), (Kd tiré de Dowsonetal. (1993))
[DBT]part = Kd (DBT)(L/g) x [DBT]eau(ng/L), (Kd tiré de VIGLINO etal. (2004))
[TBT]part = Kd (TBT)(L/g) x [TBT]eau(ng/L), (Kd tiré de VIGLINO etal. (2004))
4. Discussion
4.1 État de contamination
Cette étude présente les premières évidences sur la contamination des butylétains dans la colonne d’eau du fjord du Saguenay. Si l’on considère les butylétains totaux, les niveaux présents dans le Saint-Laurent et en aval du fjord sont comparables à ceux observés dans plusieurs eaux côtières mondiales et canadiennes exposées à un trafic maritime modéré (MICHEL et al., 2001; GOMEZ-ARIZA et al., 2001; GUI-BIN et al., 2001). Les niveaux observés dans la Baie des Ha! Ha! sont similaires à ceux trouvés dans les eaux océaniques, mais également dans un fjord norvégien, Oslofjord, de caractéristiques océanographiques proches de celles du Saguenay et où les niveaux variaient de 5 à 47 ng Sn L‑1 (FØLSVIK et al., 2002). Le trafic maritime présent dans le Saint-Laurent, dix fois supérieur à celui du fjord, pourrait expliquer les niveaux importants en butylétains des eaux de surface de l’estuaire. Mais il faut signaler que ces niveaux sont particulièrement élevés en DBT. Certes, le DBT provient en partie de la dégradation du TBT mais la présence d’une source secondaire en DBT n’est pas à exclure sachant que ce composé est utilisé dans une large gamme d’activités industrielles, notamment dans la fabrication des plastiques, activité présente en amont du Saint‑Laurent (CHAU et al., 1997b; DABOVAL & DARTOIS, 1997). Dans le fjord, les niveaux les plus élevés sont présents uniquement dans les eaux de surface à l’embouchure (FJ0, SAG-30) puis une décroissance des concentrations s’observe à la station SAG-16. Ce gradient des concentrations peut s’expliquer en partie par l’intrusion des eaux contaminées du Saint-Laurent dans le fjord sous l’influence des marées. Ce processus hydrodynamique permet un échange régulier entre les masses d’eau de l’estuaire du Saint-Laurent et le fjord du Saguenay avec toutefois une influence dans le fjord diminuant de l’aval vers l’amont suivant l’intensité des marées (SHAFER et al., 1990; De LADURANTAYE et al., 1984).
Le caractère fortement stratifié de la colonne d’eau dans le fjord du Saguenay conduit à une advection limitée entre les deux masses d’eau et peut expliquer la différence de niveaux de contamination des butylétains observée entre la masse d’eau de surface et celle de la couche profonde. En effet, la présence d’une pycnocline permanente réduit les mélanges entre la couche d’eau saumâtre à la surface et la masse d’eau plus salée, plus froide et moins contaminée au fond (TEN HALLERS-TJABBES et al., 2003). C’est principalement la matière particulaire en suspension (vivante ou inerte) qui permet un transport des butylétains. Les butylétains sorbés sur cette matière peuvent être échangés entre les deux masses d’eau, soit par la sédimentation des particules, ou soit par la migration verticale nycthémérale des espèces zooplanctoniques (RAINVILLE, 1979). C’est pourquoi les résultats ne montrent aucune différence significative entre les concentrations en butylétains des échantillons du seston des deux couches (p≤0,05).
Dans la baie des Ha! Ha! les niveaux observés s’expliquent non pas par l’influence de la contamination du Saint-Laurent mais par la présence d’une installation portuaire où accostent de nombreux bateaux commerciaux (VIGLINO et al., 2004). Tout comme dans l’axe principal du fjord, la colonne d’eau de la baie est stratifiée, ce qui explique les différences de contamination observées entre les deux masses d’eau excepté à la station SAG-13 située à la frontière de l’axe principal du fjord et de la baie, zone à régime plus turbulent où l’advection est donc plus importante (SCHAFER et al., 1990).
À la lumière de ces résultats, les niveaux observés en aval du fjord seraient l’empreinte du Saint‑Laurent tandis que les niveaux dans la baie représenteraient la contamination locale due aux passages des bateaux dans le fjord jusqu’aux installations du Port‑Alfred.
4.2 Dynamique des butylétains
Si l’on considère la distribution des espèces de butylétains (TBT, DBT, MBT), cette étude se démarque des autres études réalisées dans les eaux côtières. En effet, généralement, le TBT est soit le composé majoritaire, soit présent à des niveaux similaires à ceux du DBT et du MBT (GOMEZ-ARIZA et al., 2001; GUI-BIN et al., 2001). Dans le cas du fjord, le DBT est le composé majoritaire dans la colonne d’eau et le TBT est présent à de très faibles pourcentages (1 à 5 % dans les eaux de surface). D’autre part, cette distribution dans la colonne d’eau se différencie de celles observées dans le sédiment et les organismes du fjord qui démontraient la prédominance du TBT (VIGLINO et al., 2004; VIGLINO et al., 2005). Compte tenu de ces observations, les résultats obtenus dans cette étude (par exemple les facteurs de bioconcentration élevés) confirment que le TBT a plus d’affinité pour la matière particulaire que son métabolite, le DBT.
Sous les conditions physico-chimiques du fjord (pH, salinité, température, etc.), les propriétés chimiques du TBT sont telles que les processus de sorption sur le matériel particulaire et de bioaccumulation dans les organismes sont favorisés. En effet, principalement sous forme d’hydroxyde (TBTOH) et de chlorure de TBT (TBTCl), celui-ci présente une faible solubilité et des coefficients de partition eau-sédiment (1,0 x 104 à 1,2 x 104 L kg‑1) et eau-octanol élevés (Kow = 5 000 à 7 000) (ARNOLD et al., 1997; LAUGHLIN et al., 1986; VIGLINO et al., 2004). Les BCFTBT dans la couche profonde sont deux fois plus élevés que ceux de la couche de surface et inversement pour BCFDBT. Il y a donc plus de TBT dans les organismes capturés à 70 m par rapport à ceux capturés en surface, bien que les concentrations totales en butylétains dans le seston ne varient pas en fonction de la profondeur (VIGLINO et al., 2005). Ainsi, la bioaccumulation du TBT semble un facteur plus important dans la couche profonde et cette observation peut résulter d’une différence dans la nature de l’échantillon du seston entre les deux couches. À la surface, le phytoplancton prédominait et celui-ci est connu pour dégrader le TBT en DBT tandis que le zooplancton majoritaire à 70 m tendrait à bioaccumuler surtout le TBT avec des capacités de dégradation moins importantes (ST-LOUIS et al., 1997b; TSANG et al., 1999). Notre étude antérieure sur les espèces benthiques tend à montrer que les petits crustacés qui composent le zooplancton sont de bons bioaccumulateurs du TBT (VIGLINO et al., 2005).
L’étude réalisée sur les sédiments du fjord a révélé que presque 90 % du TBT libéré chaque année dans le système aquatique se déposait par la suite sur le sédiment (VIGLINO et al., 2004) impliquant un transport vertical important vers le compartiment sédimentaire. Une des particularités essentielles du fjord est la présence d’une interface turbide située dans la pycnocline au sein de laquelle la matière en suspension participe à d’intenses processus d’adsorption et de séquestration (ANDERSSON et al., 2001). Cette caractéristique, associée à la sorption élevée du TBT sur la matière en suspension, pourrait expliquer l’importance du sédiment en tant que réservoir du TBT via la sédimentation des particules.
Les produits de dégradation du TBT dominent dans la colonne d’eau, essentiellement du DBT à des niveaux élevés et principalement dans la phase dissoute, compte tenu des très faibles teneurs en MPS. D’autre part, les facteurs de bioconcentration du DBT sont dix fois moins élevés que ceux du TBT dans la couche de surface et 50 fois plus faibles dans la couche de fond révélant ainsi une accumulation par le seston moins importante du DBT que le TBT. De même, les concentrations de DBT estimées sur la matière particulaire inerte diminuent avec la profondeur. Ces observations résultent d’une solubilité plus élevée et d’un coefficient de partition eau-sédiment plus faible pour le DBT que le TBT (HOCH et al., 2003; LAUGHLIN et al., 1986).
Pour tenter de mieux illustrer l’affinité du TBT pour le particulaire ainsi que l’affinité du DBT avec le dissous, la figure 5 rassemble les pourcentages de TBT et DBT calculés dans les différents compartiments présents dans le fjord (dissous, particulaire, seston, benthos, etc.). Les pourcentages dans l’eau, la matière particulaire et le seston sont issus de cette étude, tandis que ceux présents dans les organismes benthiques et le sédiment proviennent des études ultérieures (VIGLINO et al., 2004; VIGLINO et al., 2005). Ainsi, l’augmentation du pourcentage du TBT à travers la colonne d’eau jusqu’au sédiment résulte, entre autres, de la désorption du DBT.
Figure 5
Schéma résumant les proportions (%) (min-max) de TBT et DBT dans chaque compartiment de l’écosystème du fjord du Saguenay, soit : la colonne d’eau (dissous, matières particulaires), le sédiment et les organismes benthiques. Les valeurs en noir représentent le pourcentage du TBT et celles en gris le DBT présents dans chacun des sous-compartiments.
Schematic summary of the relative distribution (%) (min-max) of TBT and DBT in compartments of the Saguenay Fjord: water column (dissolved, particulate matter), sediments and benthic organisms. TBT values are in black and those of DBT appear in gray.
Bien que peu étudié en raison probablement de sa faible toxicité comparée à celles du TBT et du DBT, le MBT est également présent dans tous les compartiments à un faible pourcentage mais il semble avoir une affinité préférentielle pour la matière en suspension. Cette observation coïncide avec des travaux déjà réalisés sur la sorption du MBT démontrant que ce mécanisme dépend à la fois de la charge cationique présente sur la molécule de MBT et des caractéristiques de la matière en suspension (DOWSON et al., 1993; OHTSUBO, 1999).
4.3 Toxicité des butylétains
L’accumulation des butylétains au sein du réseau trophique du Saguenay a déjà été observée et discutée dans une précédente étude révélant une contamination ubiquiste dans tous les organismes, et ce, à des concentrations variant de 8 à 1 483 ng Sn g-1 (poids sec) (VIGLINO et al., 2005). D’autre part, les facteurs de bioconcentration obtenus à partir des données du seston confirment que les niveaux de TBT dans l’eau sont également suffisants pour induire une bioaccumulation par étape au sein de la chaîne alimentaire. Les concentrations en TBT présentes dans la colonne d’eau semblent suffisantes pour perturber l’écosystème en causant des effets chroniques sur la reproduction de plusieurs organismes ou affaiblissant leurs systèmes immunitaires (FENT, 1996; ALZIEU, 2000). Par exemple, une concentration aussi basse que 1,23 ng Sn L‑1 est suffisante pour inhiber la croissance des larves de copépodes (Arcasia tonsa) (KUSK et PETERSON, 1997). Certaines études démontrent certes une toxicité du DBT mais inférieure à celle du TBT pour certains organismes tels que les algues ou organismes benthiques (HUANG et al., 1996; FARGAŠOVÀ, 1998). Mais de récents travaux démontrent des effets immunotoxiques du DBT égaux ou même supérieurs à ceux du TBT, que ce soit chez les invertébrés ou les organismes supérieurs (O’HALLORAN et al., 1998). Dans le fjord du Saguenay, les concentrations de DBT varient de 20 à 200 ng Sn L‑1 alors que de récentes études démontrent qu’une concentration aussi faible que 1 ng Sn L‑1 de DBT induit une perturbation du système immunitaire des bivalves (Mytilus edulis) (ST-JEAN et al., 2002 a et b). NAKATA et al. (2002) démontrent une immunosuppression induite par les butylétains et spécifiquement le DBT au niveau de lymphocytes de mammifères marins et d’êtres humains.
Dans le fjord, les organismes aquatiques étant exposés aux deux contaminants TBT et DBT, l’interaction des deux composés sur le système immunitaire devrait être envisagée, à savoir la présence ou pas d’une additivité de la toxicité des deux composés immunotoxiques. À notre connaissance, il n’existe encore aucune étude traitant des interactions potentielles entre TBT et DBT; cela reste un domaine à explorer.
5. Conclusion
Nos travaux montrent que les butylétains étaient présents dans toute la colonne d’eau du fjord du Saguenay fin mai 2001 à des concentrations variables mais toujours plus élevées dans la couche de surface. Ce phénomène semble permanent puisque des analyses de butylétains effectuées en mai 2000 aux mêmes stations montrent le même profil (L. Viglino, données non publiées). Le trafic maritime constitue une source d’apport continue de butylétains, essentiellement le TBT, mais les activités industrielles situées le long du fleuve du Saint-Laurent sont soupçonnées d’engendrer le relargage de quantités non négligeables de DBT et de contribuer au bilan global des butylétains.
Les caractéristiques environnementales du fjord ainsi que les propriétés chimiques distinctes pour le TBT et le DBT influencent le devenir de ces deux composés dans la colonne d’eau. Le mécanisme de sorption sur la matière particulaire (vivante, inerte) ainsi que la bioaccumulation sont deux mécanismes responsables de l’élimination du TBT de la colonne d’eau via le sédiment. Le DBT est le composé principal dans la phase dissoute et son cheminement est influencé par les mouvements des masses d’eau. Enfin, les niveaux détectés de TBT et DBT dans la colonne d’eau seraient suffisants pour induire une toxicité sur les organismes du réseau trophique du fjord du Saguenay.
Appendices
Remerciements
Les auteurs tiennent à remercier le capitaine, les membres de l’équipage du navire Alcide C. Horth et toute l’équipe scientifique de la mission SAG-2001 pour leur collaboration durant l’échantillonnage et leur support technique. Ce travail a été supporté par la Chaire de recherche canadienne en écotoxicologie marine et le programme CRSNG-découverte (EP).
Références
- ALZIEU C., 2000. Impact of tributyltin on marine invertebrates. Ecotoxicology, 9, 71-76.
- ANDERSSON P.S., PORCELLI D., GUSTOFSSON OE., INGRI J., WASSEBURG G.J., 2001. The importance of colloids for the behavior of uranium isotopes in the low-salinity zone of a stable estuary. Geochim. Cosmochim. Acta., 65, 13-25.
- ARNOLD C.G., WEIDENHAUPT A., DAVID M.M., MULLER S.R., HARDERLEIN S.B., 1997. Aqueous speciation and 1-octanol-water partitioning of tributyl and triphenyltin: effect of pH and ion composition. Environ. Sci. Technol., 31, 2596-2602.
- CHAU Y.K., YANG F., BROWN M., 1997a. Evaluation of derivatization techniques for the analysis of organotin compounds in biological tissue. Anal. Chim. Acta., 338, 51-55.
- CHAU Y.K., MAGUIRE R.J., BROWN M., YANG F., BATCHELOR S.P., 1997b. Occurrence of organotin compounds in the Canadian aquatic environment five years after the regulation of antifouling uses of tributlytin. Water Qual. Res. J. Canada, 32, 453-521.
- DABOVAL B., DARTOIS J., 1997. L’assainissement des eaux usées industrielles du Québec : État de situation en 1995, 20e Symposium sur les eaux usées : Rejets industriels et prévention de la pollution, Collection Environnement, Hors-Série, n° 10, Delisle C.E. et Bouchard, M.A., (Éditeurs), Montréal, 1997, pp. 3-24.
- DE LADURANTAYE R., THERRIAULT J.C., LACROIX G., CÔTÉ R., 1984. Processus advectifs et répartition du zooplancton dans un fjord. Mar. Biol., 82, 21-29.
- DE MORA S.J., PELLETIER E., 1997. Environmental tributyltin research: Past, present, future. Environ. Technol., 18, 1169-1177.
- DOWSON P.H., BUBB J.M., LESTER J.N., 1993. Temporal distribution of organotins in the aquatic environment:five years after the 1987 UK retail ban on TBT based antifouling paints. Mar. Pollut. Bull., 26, 487-494.
- FARGAŠOVÀ A., 1998. Comparison of tributyltin compound effects on the alga Scenedesmus quadricauda and the benthic organisms Tubifex tubifex and Chironomus plumosus. Ecotoxicol. Environ. Safe., 41, 222-230.
- FENT K., 1996. Ecotoxicology of organotin compounds. Crit. Rev.Toxicol., 26, 1-117.
- FØLSVIK N., BREVIK E.M., Berge J.A., 2002. Organotin compounds in a Norwegian fjord. A comparison of concentration levels in semipermeable membrane devices (SPMDS), blue mussels (Mytilus edulis) and water samples. J. Environ. Monit., 4, 280-283.
- GIBBS P.E., PASCOE P.L., BURT G.R., 1988. Sex change in the female dog-whelk, Nucella lapillus, induced by tributyltin from antifouling paints. J. Mar. Biol. Assoc. U. K., 68, 715-731.
- GOMEZ-ARIZA J.L., GIRALDEZ I., MORALES E., 2001. Occurrence of organotin compounds in water, sediments and mollusca in estuarine systems in the southwest of Spain. Water Air Soil Pollut., 126, 253-270.
- GUI-BIN J., QUN-FANG Z., JI-YAN L., DI-JING W., 2001. Occurence of butyltin compounds in the waters of selected lakes, rivers and coastal environments from China. Environ. Pollut., 115, 81-87.
- HARRIS J.R.W., CLEARY J.J., VALKIR A.O., 1996. Particle-water partitioning and the role of sediments as a sink and secondary source of TBT. Dans : «Organotin», Champ M.A. and Seligman P.F. (Éditeurs), pp. 55-94.
- HOCH M., 2001. Organotin compounds in the environment-an overview. Appl. Geochem., 16, 719-743.
- HOCH M., ALONSO-AZCARATE J., LISCHICK M., 2003. Assessment of adsorption behavior of dibutyltin (DBT) to clay-rich sediments in comparison to the highly toxic tributlytin (TBT). Environ. Pollut.,123, 217-227.
- HUANG G., DAI S., SUN H., 1996. Toxic effects of organotin species on algae. Appl. Organomet. Chem., 10, 377-387.
- KUSK K.O., PETERSEN S., 1997. Acute and chronic toxicity of tributyltin and linear alkylbenzene sulfonate to the marine copepod, Acartia tonsa. Environ. Toxicol. Chem., 16, 1629-1633.
- LAUGHLIN R.B., Jr FRENCH W., GUARD H.E., 1986. Accumulation of bis(tributyltin)oxide by the marine mussel Mytilus edulis. Environ. Sci. Technol., 20, 884-890.
- MAGUIRE R.J., TKACZ R.J., 1985. Degradation of the tri-n-butyltin species in water and sediment from Toronto Harbor. J. Agr. Food Chem., 33, 947-953.
- MICHEL P., AVERTY B., 1991. Tributyltin analysis in seawater by GCFPD after direct aqueous phase ethylation using sodium tetraethylborate. Appl. Organomet. Chem., 5, 393-397.
- MICHEL P., AVERTY B., ANDRAL B., CHIFFOLEAU J.F., GALGANI F., 2001. Tributyltin along the coasts of Corsica (western Mediterranean): a persistent problem. Mar. Pollut. Bull., 42, 1128-1132.
- NAKATA H., SAKAKIBARA A., KANOH M., KUDO S., WATANABE H., NAGAI N., MIYAZAKI N., ASANO Y., TANABE S., 2002. Evaluation of mitogen-induced responses in marine mammal and human lymphocytes by in-vitro exposure of butyltins and non-ortho coplanar PCBs. Environ. Pollut., 120, 245-253.
- O’HALLORAN K., AHOKAS J.T., WRIGHT P.F.A., 1998. Response of fish immune cells to in vitro organotin exposures. Aquat. Toxicol., 40, 141-156.
- OHTSUBO M. 1999. Organotin compounds and their adsorption behavior on sediments. Clay Science, 10, 519-539.
- PELLETIER É., MOSTAJR B., ROY S., GOSSELIN M., GRATTON Y., CHANUT J.P., BELZILE C., DEMERS S., THIBAULT D., 1999. Crue éclair de juillet 1996 dans la région du Saguenay (Québec). 1. Impacts sur la colonne d’eau de la baie des Ha! Ha! et du fjord du Saguenay. Can. J. Fish. Aquat. Sci., 56, 2120-2135.
- RAINVILLE L., 1979. Étude comparative de la distribution verticale et de la composition des populations du zooplancton du fjord du Saguenay et de l’estuaire du St-Laurent. Mémoire de maîtrise, Université Laval, Québec,120 p.
- SCHAFER C.T., SMITH J.N., CÔTÉ R., 1990. The Saguenay Fjord: A major tributary to the St. Lawrence Estuary. Dans: El-Sabh M.I. & Silverberg N. (Éditeurs), Oceanography of a large-Scale Estuarine System. Coastal and Estuarine Studies. Springer-Verlag, New York, NY, USA, pp. 378-420.
- ST-JEAN S.D., PELLETIER É., COURTENAY S.C., 2002 a. Hemocyte functions and bacterial clearance affected in vivo by TBT and DBT in the blue mussel Mytulis edulis. Mar. Ecol. Prog. Ser., 236, 163-178.
- ST-JEAN S.D., PELLETIER É., COURTENAY S.C., 2002 b. Very low levels of waterborne butyltins modulate hemocyte function in the blue mussel Mytulis edulis. Mar. Ecol. Prog. Ser., 236, 155-161.
- ST-LOUIS R., GOBEIL C., PELLETIER É., 1997a. Tributyltin and its degradation products in the St. Lawrence Estuary, Canada. Environ. Technol., 18, 1209-1218.
- ST-LOUIS R., PELLETIER É., MARSOT P.,1997b. A mechanistic approach to tributyltin (TBT) sorption by marine microflagellated alga Pavlova lutheri. Appl. Organomet. Chem., 11, 543-550.
- STRAND J., JACOBSEN J.A., PEDERSEN B., GRANMO A., 2003. Butyltin compounds in sediment and molluscs from the shipping strait between Denmark and Sweden. Environ. Pollut., 124, 7-15.
- SUDARYANTO A., TAKAHASHI S., MONIRITH I., ISMAIL A., MUCHTAR M., ZHENG J., RICHARDSON B.J., SUBRAMANIAN A., PRUDENTE M., DUC HUE N. TANABE S., 2002. Asia-Pacific mussel watch:monitoring of butyltin contamination in coastal waters of Asian developing countries. Environ. Toxicol. Chem., 10, 2119-2130.
- TEN-HALLERS-TJABBES C.C., WEGENER J.W., VAN HATTUM B., KEMP J.F., TEN HALLERS E., REITSEMA T.J., BOON J.P., 2003. Imposex and organotin concentrations in Buccinum undatum and Neptunea antiqua from the North Sea: relationship to shipping density and hydrographical conditions. Mar. Environ. Res., 55, 203-233.
- THERRIAULT J.C., de LADURANTAYE R., INGRAM R.G., 1984. Particule matter exchange across a fjord sill. Est. Coast. Shelf Sci., 18, 52-64.
- TSANG C.K., LAU P.S., TAM N.F.Y., WONG Y.S., 1999. Biodegradation capacity of tributyltin by two Chlorella species. Environ. Pollut., 105, 289-297.
- VIGLINO L., PELLETIER É., ST LOUIS R., 2004. Highly persistent butyltins in Northern marine sediments: a long term threat for the Saguenay Fjord (Canada). Environ. Toxicol. Chem., 23, 2673-2681.
- VIGLINO L., PELLETIER É., LEE L.E.J.,2005. Butyltin species in benthic and pelagic organisms of the Saguenay Fjord (Canada) and imposex occurrence in the Common Whelk (Buccinum undatum). Arch. Environ. contam. Toxicol., 49, 1-17.
- YANG F., MAGUIRE R.J., 2000. Occurrence and seasonal variation of tributyltin in marinas on Lake Ontario, Canada. Water Qual. Res. J. Canada, 35, 681-691.
List of figures
Figure 1
Localisation des stations échantillonnées dans l’estuaire du Saint-Laurent, le fjord du Saguenay et la Baie des Ha!Ha!.
Location of sampled stations in the St. Lawrence Estuary, the Saguenay Fjord and the Baie des Ha! Ha!.
Figure 2
Salinité et température de la colonne d’eau au centre de la baie des Ha! Ha!.
Salinity and temperature profiles in the water column of the Baie des Ha! Ha!.
Figure 3
Concentrations (ng Sn L-1) des butylétains totaux dans les eaux de surface et profondes à l’embouchure du fjord du Saguenay (SL1), dans l’axe principal du fjord du Saguenay (FJ0, SAG-30, SAG-16) et dans la Baie des Ha! Ha! (SAG-13, SAG-09 et SAG-07, SAG-02).
Concentrations (ng Sn L-1) of total butyltins in surface and deep waters sampled at the mouth of the Saguenay Fjord (SL1), along the main axis of the Fjord (FJ0, SAG-30, SAG-16) and in the Baie des Ha! Ha! (SAG-13, SAG-09 et SAG-07, SAG-02).
Figure 4
Pourcentages (%) des espèces de butylétains (MBT, DBT, TBT) dans les eaux de surface et profondes à l’embouchure du fjord du Saguenay (SL1), dans l’axe principal du fjord du Saguenay (FJ0, SAG-30, SAG-16) et dans la Baie des Ha! Ha! (SAG-13, SAG-09, SAG-07, SAG-02).
Percentages (%) of butyltin species (MBT, DBT, TBT) in surface and deep waters sampled at the mouth of the Saguenay Fjord (SL1), along the main axis of the Fjord (FJ0, SAG-30, SAG-16) and in the Baie des Ha! Ha! (SAG-13, SAG-09 et SAG-07, SAG-02).
Figure 5
Schéma résumant les proportions (%) (min-max) de TBT et DBT dans chaque compartiment de l’écosystème du fjord du Saguenay, soit : la colonne d’eau (dissous, matières particulaires), le sédiment et les organismes benthiques. Les valeurs en noir représentent le pourcentage du TBT et celles en gris le DBT présents dans chacun des sous-compartiments.
Schematic summary of the relative distribution (%) (min-max) of TBT and DBT in compartments of the Saguenay Fjord: water column (dissolved, particulate matter), sediments and benthic organisms. TBT values are in black and those of DBT appear in gray.
List of tables
Tableau 1
Concentrations moyennes (n=3) de la matière en suspension, MPS (mg L-1), du carbone organique, COP (µg L-1) ainsi que le rapport C/N à différentes profondeurs pour les stations du St-Laurent, du fjord du Saguenay et de la baie des Ha! Ha!.
Mean concentrations of suspended particulate matter, MPS (mg L-1), organic carbon, COP (µg L-1) and the C/N ratios at different depths for stations in St. Lawrence Estuary, the Saguenay Fjord, and the Baie des Ha! Ha!.
Tableau 2
Concentrations des butylétains dans le seston (ng Sn/g-1 poids humide) et dans l’eau (ng Sn/mL-1) de la couche de surface (S) et profonde (F) collectés dans l’axe principal du fjord et dans la Baie des Ha! Ha!. Estimation des facteurs de bioconcentration à partir de ces mêmes échantillons (BCF = [seston]/ [eau]).
Concentration of butyltins in seston (ng Sn/g-1 wet weight) and in water (ng Sn/ mL-1) in the surface (S) and deep (F) layers collected in the main axis of the Fjord and the Baie des Ha! Ha!. Bioconcentration factors estimated for the same samples (BCF = [seston]/[water]).
Tableau 3
Estimation de la concentration (ng Sn/g-1) de chaque espèce de butylétains (TBT, DBT, MBT) dans la matière particulaire présente dans la couche de surface (S) et profonde (F) pour les stations du fjord du Saguenay et dans la Baie des Ha! Ha!.
Estimation of the concentration (ng Sn/g-1) of each butyltin species (TBT, DBT, MBT) in the particulate matter present in the surface (S) and deep (F) layers for stations in the Saguenay Fjord and in the Baie des Ha! Ha!.






![Concentrations des butylétains dans le seston (ng Sn/g-1 poids humide) et dans l’eau (ng Sn/mL-1) de la couche de surface (S) et profonde (F) collectés dans l’axe principal du fjord et dans la Baie des Ha! Ha!. Estimation des facteurs de bioconcentration à partir de ces mêmes échantillons (BCF = [seston]/ [eau]).](/en/journals/rseau/2006-v19-n1-rseau1034/012260ar/media/012260art006n.png)

