Abstracts
Résumé
L’objectif de ce travail est l’étude de la répartition, la migration, la spéciation et la biodisponibilité du Cr dans les différents horizons du sol au niveau d’un pilote à Phragmites australis (Cav.) Trin ex Steudel de traitement du rejet du tannage au chrome. Les résultats obtenus sont comparés à ceux d’un pilote non planté. La spéciation chimique du Cr total a été réalisée par cinq extractions séquentielles. L’extraction du chrome biodisponible est effectuée par CaCl2 (0,1 M). Les résultats de la répartition du Cr montrent que l’horizon superficiel renferme des teneurs élevées en Cr 80 % et que cette accumulation est statistiquement différente entre les deux pilotes (p<0,05) : 48 ± 4 g·kg-1 pour le système planté et 39 ± 7 g·kg-1 pour le système non planté. Les résultats de la spéciation chimique totale du Cr indiquent qu’il est très lié à la phase oxydable : 36 ± 10 % pour le système planté (PP) et 54 ± 9 % pour le système non planté (NPP). La teneur en Cr retenue dans la fraction résiduelle présente 26 ± 3 % et 25 ± 2 % respectivement pour le système PP et NPP. La proportion du Cr retenue dans la fraction carbonate est de 19,5 ± 5 % pour le système PP et 10,7 ± 5 % pour le système NPP. La part du Cr associée à la phase réductible présente 18 ± 6 % et 10 ± 4 % respectivement pour le système PP et NPP. Pour les deux pilotes le Cr total est peu échangeable et sa teneur biodisponible est faible. En outre, les résultats montrent que la présence de Phragmites australis a provoqué la libération partielle du Cr de la fraction organique mobile vers les formes carbonate et réductible relativement stables dans le système planté. Les résultats trouvés montrent que Phragmites australis présente une accumulation assez importante en Cr au niveau des racines : 1690 ± 124 mg·kg-1 en matière sèche. Le calcul du bilan global de l’épuration révèle que le Cr est surtout retenu par le sol (94 %) et que 5 % du Cr est prélevé par la plante. Cependant, la présence de Phragmites australis assure une porosité suffisante pour la percolation des eaux en traitement et permet le traitement d’un volume d’eau usée plus grand.
Mots clés:
- chrome,
- tannerie,
- sol,
- mobilité,
- spéciation,
- biodisponibilité,
- Phragmites australis
Summary
The present study illustrates the distribution, mobility, bioavailability and speciation of total chromium (Cr) in the various strata of a constructed reed bed soil in comparison to unplanted soil under arid climate conditions. The operationally determined speciation of Cr was investigated using a five-step sequential extraction method using CaCl2 (0.1 M) to extract bioavailable Cr.
The results indicated that there was a significant accumulation of total Cr, reaching 80% in the surface strata for the planted (PP) and unplanted (NPP) systems. Analysis of variance (ANOVA) showed a significant difference (p<0.05) in Cr accumulation in the surface of the soil between the PP system (48 ± 4 g·kg-1) and the NPP system (39 ± 7 g·kg‑1). The partitioning results indicated that the percentage of Cr in the exchangeable phase was very low. The Cr was mainly associated with the oxidizable phase: 36 ± 10% for the PP system and 54 ± 9% for the NPP system. The residual phase contained 26 ± 3%, 25 ± 2% of the Cr for the PP and NPP systems, respectively. The carbonate fraction represented 19.5 ± 5% for PP system and 10.7 ± 5% for NPP system, whereas the reducible fraction represented 18 ± 6% for the PP system and 10 ± 4% for the NPP system. The sequential extraction results showed that Phragmites australis had the ability to partially transfer Cr from the mobile oxidizable fraction to the less mobile reducible and carbonate fractions. Indeed, Cr was relatively unavailable to the plant but the results did show that Phragmites australis accumulated an appreciable amount of Cr in the roots (1690 mg·kg-1 dry matter). Furthermore, after 13 months, the soil had accumulated high amounts of chromium (94%) with only 5% of the Cr accumulated in Phragmites australis. The presence of plants ensures a sufficient porosity for the percolation of water for treatment, which makes it possible to treat a larger volume of wastewater and to reduce the required soil surface area needed for treatment.
Key-words:
- chromium,
- tannery,
- soil,
- mobility,
- speciation,
- bioavailability,
- Phragmites australis
Article body
1. Introduction
Le chrome est présent dans l’environnement principalement sous deux formes : le Cr(III) et le Cr(VI). La forme hexavalente est plus toxique que la forme trivalente et également davantage soluble dans l’eau. Le chrome trivalent est la forme la plus stable mais ayant des propriétés chimiques plus complexes que le chrome hexavalent. Le chrome trivalent a peu d’affinité pour l’oxygène, c’est pour cette raison qu’il a tendance à former nombre de complexes avec des ligands organiques. Le chrome hexavalent est un puissant oxydant. On le retrouve sous des formes d’oxyanions qui sont très solubles. L’oxydation de Cr (III) en Cr (VI) peut se faire dans les sols humides (BARTLETT et JAMES, 1979) et sera favorisée avec l’élévation du pH du sol (STOMBERG et al., 1984). La spéciation du chrome (VI) et (III) dépend de plusieurs paramètres comme le pH, leur concentration et la disponibilité en ligand.
Le secteur industriel marocain est composé de 6 070 unités dont 31 % sont des industries du textile et du cuir. Les industries du cuir consomment 120 t Cr/an (SCANDIACONSULT INTERNATIONAL, 1999).
Dans l’industrie du cuir, il y a essentiellement deux types de procédés de tannage : le tannage végétal et le tannage au chrome. Les traitements des effluents issus de ces deux procédés de tanneries peuvent être acquis soit par moyen physico-chimique, soit par procédé biologique ou par combinaison des deux (KABDASLI et al., 1993; NOZAKI et al., 1993; SZPYRKOWICZ et al., 1995; TALINI, 1994; TÜNAY et al., 1994). La plupart des processus biologiques reconnus ont été recommandés ou utilisés souvent après un prétraitement pour diminuer la charge en chrome. Des études ont développé des protocoles de traitement de ce type d’effluent par des lits à macrophytes (ALDRICH et al., 2003; BARRERA-DIAZ et al., 2004; BEGG et al., 2001; HOW et al., 2003; POLPRASERT et al., 1996; QIAN et al., 1999; SHUTES et al., 2001; SINHA et al., 2002; TIGLYENE et al., 2005). En effet, une étude effectuée par TIGLYENE et al. (2005) a montré qu’après passage de l’effluent de tannerie à travers des colonnes plantées de Phragmites australis en écoulement vertical (88 % du sable), une élimination de 99 % en Cr total et un abattement de 74 % en DCO totale sont obtenus. Les macrophytes jouent un rôle clé dans le fonctionnement des stations de traitement utilisant les plantes aquatiques (Phragmites australis, Typha latifolia, Cyperus exaltatus, etc.). Dans ces systèmes de traitement, plusieurs processus sont responsables de l’élimination des métaux. Ils incluent un ensemble de réactions physico-chimiques, biologiques et microbiologiques qui se déroulent dans les sites aérobies et anaérobies des zones humides (EGER, 1994). Ces éléments métalliques sont retenus dans ces systèmes par absorption par les plantes, par les micro-organismes de la rhizosphère, par immobilisation au niveau du sol via des mécanismes tel que l’adsorption au niveau des sites d’échanges, fixation à la matière organique, incorporation dans la structure du sol et précipitation sous formes de composés insolubles (EGER, 1994; WIEDER, 1990).
Par ailleurs, la connaissance de la concentration en métal total est souvent insuffisante pour évaluer le risque dû à sa présence dans le sol (GUPTA, 1984). Les métaux lourds peuvent, à partir de l’horizon supérieur, présenter une certaine mobilité le long des horizons des sols et regagner les nappes phréatiques (BAVEYE et al., 1999; KAFKA et KURAS, 1994; LEGRET et al., 1988). Le chrome en général et le chrome (VI) en particulier peuvent migrer jusqu’à des horizons profonds du sol (LOSI et al., 1994 ; SELIM et al., 1989).
La spéciation chimique des éléments métalliques en traces renseigne sur leur comportement probable dans le milieu. Elle peut être acquise en analysant la distribution des éléments dans les différentes phases chimiques du sol : carbonate (acido-soluble), réductible (oxydes de Fe et de Mn), oxydable (organique et sulfure), échangeable et résiduelle. En pratique, cette compartimentation peut se faire à partir des extractions chimiques simples ou séquentielles utilisant des réactifs d’agressivité croissante. De nombreux extractants peuvent être utilisés pour définir un compartiment du sol (LEBOURG et al., 1996). Toutefois, le degré de fixation ou de relargage des métaux est lié à leurs formes chimiques et à leurs associations avec les différentes phases constitutives du sol qui conditionnent leur disponibilité pour les végétaux ainsi que leur mobilité dans les solutions du sol (LEGRET et al., 1988). Dans ce sens, sous une forme adsorbée sur des hydroxydes métalliques, le chrome est peu disponible aux plantes. La concentration en Cr des végétaux est principalement contrôlée par sa teneur en solution dans le sol. Le chrome, dans un sol neutre ou basique, sera plus disponible vis-à-vis des plantes que dans un sol acide (INERSI, 2004). Cependant, plusieurs auteurs ont rapporté que les teneurs en éléments dans les tissus des plantes varient avec la concentration et la forme auxquelles la plante est exposée (BLAKE et al., 1987; JACKSON et al., 1991; NAKADA et al., 1979). En effet, CARY et al. (1977) ont montré qu’il y a une meilleure translocation du chrome vers la tige à partir d’une solution du Cr (VI) qu’avec une solution de Cr (III).
L’objectif de ce travail est : i) d’étudier la rétention et la migration du Cr dans le profil du sol, ii) de déterminer la spéciation chimique du Cr au niveau d’un pilote planté de traitement du rejet de tannage au chrome; et iii) d’évaluer la biodisponibilité du Cr et sa bioaccumulation dans la plante. L’intérêt est porté plus particulièrement sur la comparaison d’un pilote planté par Phragmites australis (Cav.) Trin ex Steudel avec un pilote non planté.
2. Matériel et méthodes
Le pilote expérimental est constitué de pots (capacité : 120 litres; diamètre : 50 cm) remplis sur une épaisseur de 15 cm de gravier et de 60 cm de sol. Trois pots sont plantés de jeunes tiges de Phragmites australis (36 tiges m-2). Trois autres pots non plantés sont pris comme témoin.
Le matériel végétal utilisé est Phragmites australis (Cav.) Trin ex Steudel ou roseau des marais. C’est une espèce très productive, qui s’adapte facilement aux différentes conditions du milieu (NÈGRE, 1961).
Le sol utilisé a une texture : limono - argilo - sableuse [argile : 3,5 %; limon : 8,5 %; sable : 88 % (sable grossier + sable fin : 72,1 %; sable très fin : 15,9 %)]. C’est un sol basique qui est riche en matières organiques. Sa conductivité électrique est élevée (Tableau 1). Les teneurs en métaux lourds du sol sont dans les normes de l’OMS (1989) : Zn=300 mg·kg‑1; Pb=100 mg·kg-1; Cr=150 mg·kg-1 et Cu=100 mg·kg-1 (GODIN, 1983). Le choix s’est porté sur ce sol sachant qu’il a une capacité de rétention de l’eau (14 %) et des matières dissoutes dans ses espaces intercellaires. D’après SOLTNER (1990), il s’agit d’un sol basique biologiquement actif qui favoriserait la prolifération d’une flore bactérienne assurant la décomposition, l’humification et la minéralisation des matières organiques. En effet, des études ont montré que certains micro-organismes, souvent isolés à partir du sable qui constitue leur habitat naturel, sont les principaux décomposeurs de la matière organique et ils sont capables d’exsuder des substances très variées à action antibactérienne, antifongique ou antiparasitaire (BARAKATE et al., 2002; BARAKATE et al., 2003; BEHAL, 2000; CHEN, 1995; KHATTABI et al., 2002; WU et CHEN, 1995).
Tableau 1
Caractéristiques physico-chimiques du sol (nombre d’échantillons = 4).
Physico-chemical characteristics of soil (number of samples = 4).
Paramètres |
Teneurs |
|---|---|
ph |
8,63 ± 0,25 |
% m.o |
4,7 ± 1,3 |
% humidité |
21 ± 7 |
cE (µs·cm‑1) |
400 ± 45 |
Cl (mg·Kg‑1) |
71 ± 33 |
Na (mg·g‑1) |
2,7 ± 1,2 |
Mg (mg·g‑1) |
0,36 ± 0,2 |
Ca (mg·kg‑1) |
760 ± 261 |
Zn (mg·kg‑1) |
12 ± 4 |
Pb (mg·kg‑1) |
1,2 ± 0,7 |
Fe (mg·kg‑1) |
71 ± 37 |
Cr (mg·kg‑1) |
0,6 ± 0,1 |
Cu (mg·kg‑1) |
0,35 ± 0,12 |
Les eaux usées à traiter sont originaires d’une tannerie semi-moderne, implantée dans le quartier industriel de la ville de Marrakech. Ces effluents présentent un pH acide (Tableau 2). Ils ont une conductivité électrique élevée reflétant leurs richesses en sels. La concentration en chlorures enregistrée (20,6±1,3 g·L-1) et en chrome (1 230±123 mg·L-1) dépasse largement celle recommandée par les normes de l’OMS (1989) de rejets d’effluents qui sont de 0,7 g·L-1 et de 2 mg·L-1 respectivement.
Tableau 2
Caractéristiques physico-chimiques de l’eau usée de tannerie (nombre d’échantillons = 20).
Physico-chemical characteristics of tannery wastewater (number of samples = 20).
Paramètres |
Teneurs |
|---|---|
pH |
3,08 ± 1,16 |
CE (ms·cm‑1) |
118 ± 50 |
MES (mg·L‑1) |
233 ± 24 |
DBO5 (mg·L‑1) |
45 ± 2 |
DCO (mg·L‑1) |
2500 ± 13 |
Cl- (g·L‑1) |
20,6 ± 1,3 |
NH4+ (mg·L‑1) |
520 ± 19 |
Cr (g·L‑1) |
1,23 ± 0,12 |
CE (ms·cm‑1) : conductivité électrique en millisemens par centimètre
L’expérience a été menée durant 13 mois, s’étalant du mois d’août 2002 au mois d’août 2003. Tout au long de cette période d’étude, les 2 pilotes ont été irrigués par l’eau du tannage diluée à 50 % (Cr=780±196 mg·L-1) qui correspond d’après les tests réalisés à la teneur maximale de tolérance au chrome de Phragmites australis (TIGLYENE et al., 2005). L’alimentation des deux systèmes se fait par bâchée de 30 litres fractionnée en 3 bâchées élémentaires de 10 litres/jour pendant 3 jours successifs suivis d’une période de repos de 4 jours. L’écoulement se fait par translation verticale à travers le sol. Les dilutions ont été effectuées par une eau de puits.
La mesure du potentiel d’hydrogène (pH) est effectuée avec un pH-mètre de type ORION. La conductivité électrique (CE) est mesurée à l’aide d’un conductivimètre type Tacussel (RODIER, 1984). La détermination des matières en suspension (MES) consiste à séparer les phases solide et liquide par filtration sur filtre de porosité 0,45 µm. Le filtre est pesé après séchage à 105 °C (AFNOR, T90-105). La demande chimique en oxygène (DCO) est estimée par oxydation par un excès de bichromate de potassium à chaud et en milieu acide (AFNOR, T90-101). La demande biologique en oxygène (DBO5) est faite selon la méthode respirométrique par DBO-mètre (AFNOR, T90-103). Les chlorures sont dosés selon la méthode de Mohr (RODIER, 1984). Le dosage des ions ammoniums s’effectue selon la méthode colorimétrique au bleu d’indophénol (RODIER, 1984). Le dosage du chrome total est effectué par spectrophotométrie d’absorption atomique (AFNOR, T90-112). Pour chaque paramètre quatre répétitions ont été effectuées.
2. Fonctionnement hydraulique du système pilote
La ville de Marrakech est soumise à un climat méditerranéen aride, chaud, à hiver frais, caractérisé par une pluviométrie faible et variable. La saison sèche s’étend du mois de mars jusqu’au mois d’octobre. La particularité du climat de la ville de Marrakech est le passage sans transition de la période chaude de longue durée (mars à octobre) à la période froide (novembre à février) de courte durée (Figure 1). L’étude du fonctionnement hydrologique des deux pilotes testés a montré que le débit moyen à la sortie du système planté est trois fois plus élevé que celui du lit non planté, ce qui permet de traiter un volume d’eau usée plus important ou bien de réduire la superficie nécessaire par équivalent habitant (Tableau 3). Aucun signe de colmatage n’a été détecté aussi bien dans les pots plantés de Phragmites australis que dans les pots non plantés (TIGLYENE et al., 2005).
Figure 1
Évolution temporelle de la température et de la pluviométrie.
Temporal changes in temperature and rainfall.
Tableau 3
Caractéristiques hydrauliques du système planté et du sol non planté (nombre d’échantillons = 50).
Hydrological characteristics of planted and unplanted systems (number of samples =50).
|
Lit planté |
Lit non planté |
|---|---|---|
Volume à l’entrée (L) |
15 |
15 |
Temps d’infiltration |
3 h 35 min |
10 h 45 min |
Volume restitué (L) |
6 ± 3,4 |
9 ± 2,5 |
% de restitution |
40 |
60 |
Débit moyen (mL·min‑1) |
35 ± 13 |
12 ± 7 |
Pertes d’eau en (%) |
57,5 ± 2,4 |
38 ± 2,7 |
2.2 Évolution de la concentration du Chrome total
La concentration moyenne en Cr total dans l’effluent appliquée à l’entrée des différents pilotes varie de 534 mg·L-1 à 1 000 mg·L-1 avec une teneur moyenne de 780±196 mg·L-1. Les teneurs en Cr total enregistrées à la sortie du lit à Phragmites varient de 2,2 mg·L-1 à 3 mg·L-1 avec une concentration moyenne de 2±0,5 mg·L-1. La concentration en chrome total des eaux usées à la sortie du sol non planté varie de 2,5 mg·L-1 à 4 mg·L-1 avec une valeur moyenne de 2,4±1,3 mg·L-1.
Le taux d’élimination du chrome total calculé sur la base des charges en tenant compte des pertes d’eau par chaque système est représenté dans la figure 2. Pour les deux systèmes, la rétention du chrome total varie de 97 % à 100 % avec une élimination moyenne de 99 % (TIGLYENE et al., 2005). L’analyse de la variance au seuil de 5 % indique qu’il n’y a pas de différence significative pour l’abattement du Cr entre les deux systèmes planté et non planté et que l’effet de saison est négligeable pour les deux systèmes (p>0,05).
Figure 2
Pourcentage d’abattement du Cr total pour les deux systèmes planté et non planté.
Percent removal of total Cr in the planted and unplanted systems.
2.3 Répartition et mobilité du Chrome
2.3.1 Prélèvement du sol
En fin de période d’étude (septembre 2003) et au niveau de chaque pilote, des profils du sol ont été réalisés, de la surface à l’horizon, à l’aide d’une tarière : 0-5 cm, 5-10 cm, 10-15 cm, 15-20 cm, 20-30 cm, 30-40 cm, 40-50 cm et 50-60 cm.
Au niveau de chaque pilote et pour chaque horizon du sol, six échantillons ont été prélevés sur toute la surface. Les points de prélèvements sont pris de manière aléatoire.
2.3.2 Minéralisation du sol
Un échantillon du sol de 0,5 g est séché à l’air libre, tamisé (fraction < 125 µm) puis calciné à 550 °C dans un four à moufle pendant deux heures. Il a été additionné de 10 mL de HF (50 %) et porté à sec. Le résidu est dissout par 5 mL de HNO3 (60 %) pendant 2 h à chaud jusqu’à disparition des vapeurs rousses. La solution obtenue est ajustée à 10 mL par l’eau bi-distillée.
2.4 Spéciation chimique du Chrome
Pour l’étude de la spéciation, les échantillons sont traités selon le schéma d’extraction séquentielle préconisé par TESSIER et al. (1979) et modifié par LEGRET (1992). La procédure d’extraction utilisée pour la séparation des cinq phases est la suivante :
Étape 1 : fraction échangeable : 1 g d’échantillon de sol est mis en solution dans 16 mL de CaCl2 (1 M) et placé sous agitation pendant 2 h à température ambiante. Après centrifugation à 5 300 g, le chrome dans la fraction échangeable est dosé dans le surnageant et le culot subit la deuxième étape.
Étape 2 : fraction oxydable (fraction organique et sulfures) : le culot de l’étape 1 est mis en solution dans 16 mL du mélange H2O2 8,8 M + HNO3 0,02 M (v/v) (5+3) et placé sous agitation pendant 5 h à température ambiante et 1 h à 98 °C. L’extraction se fait dans 10 ml de CH3COONH4 3,5 M et placé sous agitation pendant 1 h à température ambiante. Le chrome, dans la phase oxydable, est dosé dans le surnageant et le culot subit la troisième étape.
Étape 3 : fraction acido-soluble (carbonates) : le culot de l’étape 2 est mis en solution dans 35 ml du mélange CH3COOH 1 M + CH3COONH4 0,6 M (v/v) (1+1) et placé sous agitation pendant 5 h à température ambiante. Le Cr dans la phase acido-soluble est dosé dans le surnageant et le culot subit l’étape 4.
Étape 4 : fraction réductible (oxyde de Fe et de Mn) : le culot de l’étape 3 est mis en solution dans 35 mL de NH2OH·HCl 0,1 M + CH3COOH 25 % (v/v) (1+1) et placé sous agitation pendant 4 h à température ambiante et pendant 1 h à 98 °C. L’extraction se fait dans 10 mL CH3COONH4 3,5 M et placé sous agitation pendant 1 h à température ambiante. Le chrome lié à la phase réductible est dosé dans le surnageant et le culot subit l’étape 5.
Étape 5 : fraction résiduelle : le culot de l’étape 4 est calciné pendant 2 h à 550 °C dans un four à moufle. Le résidu est solubilisé dans 20 mL de HCl concentré (12 M) et HF 40 % (v/v).
Les extractions ont été réalisées dans des tubes de centrifugation en polyéthylène de 50 mL de capacité. Entre deux étapes, les suspensions ont été centrifugées pendant 30 min à 5 300 g.
2.5 Biodisponibilité du Chrome
Au cours de cette étude, le réactif CaCl2 (0,1 M) a été choisi pour l’extraction du chrome biodisponible (JUSTE et SOLDA, 1988; MENCH, 1993). Une prise de 10 g d’échantillon du sol est mise en contact avec 25 mL de solution de CaCl2 (0,1 M). Le mélange est soumis à une agitation mécanique pendant une durée d’au moins 16 heures. Les suspensions d’équilibre obtenues ont été centrifugées pendant 20 min à 5 300 g. Le surnageant est filtré sur filtre de 0,45 µm et servira pour le dosage du Cr.
2.6 Teneur en Chrome dans Phragmites australis
Les parties aériennes de Phragmites australis (feuille+tige) sont séparées des parties souterraines (racine+rhizome), puis chacune des deux parties est lavée rapidement avec de l’eau du robinet puis rincée abondamment par l’eau distillée. Des échantillons moyens et homogènes sont recueillis, séchés séparément dans l’étuve à 80 °C puis broyés. Les teneurs en chrome total ont été déterminées dans ces échantillons.
Une prise de 2 g de matière sèche de la plante est calcinée dans un four à 450 °C durant 4 h. Les cendres sont humidifiées par quelques gouttes de HNO3 dilué, remises au four pendant 1 h à 450 °C. Le résidu obtenu, additionné de 5 mL de HNO3 concentré, est ramené à sec sur bain de sable. La dissolution du résidu se fait par 5 mL d’H2O2 à chaud. La solution obtenue est ajustée à 10 mLpar HCl (5 %) (TAUZIN et JUSTE, 1986).
Afin de tester la faculté de Phragmites australis d’accumuler le chrome, l’analyse des résultats est effectuée par référence à un témoin : pots (capacité : 120 litres; diamètre : 50 cm) remplis sur une épaisseur de 15 cm de gravier et de 60 cm de sol planté par de jeunes tiges de Phragmites australis (36 tiges m-2) irriguées par l’eau de puits uniquement (sans effluent de tannerie), et avec les mêmes conditions expérimentales d’alimentation des deux systèmes pilotes (août 2002 - août 2003).
Phragmites australis utilisée dans ce travail a été prélevée dans une roselière irriguée par l’eau de puits. Les témoins ont été prélevés au début de la manipulation (lors de la récolte des plantes nécessaires à l’expérience). La teneur initiale (avant l’expérience) de Phragmites australis (traitée et témoin) en Cr est de : 0,19±0,05 mg·kg-1 en matière sèche dans les racines; 0,18±0,04 mg·kg-1 (rhizome); 0,023±0,010 mg·kg-1 (feuille) et 0,03±0,01 mg·kg-1 (tige).
2.7 Bilan de l’épuration
Le calcul du bilan du Cr pour les deux pilotes de traitement des eaux usées du tannage au chrome, avec ou sans plante, après 13 mois du fonctionnement, est basé sur l’évaluation de :
La charge totale (en g/pot) reçue par les deux pilotes durant toute la période d’étude.
La charge totale restituée (en g/pot) à la sortie de chaque pilote.
La part retenue (en g/pot) par les différentes parties du végétal.
La part retenue (en g/pot) par le sol.
2.8 Analyse statistique
Les résultats obtenus ont été traités par l’analyse de variance à un facteur (ANOVA) suivie du test de Duncan à 5 % d’erreur (logiciel SPSS).
3. Résultats et discussion
3.1 Variation verticale du pH du sol
TIGLYENE et al. (2005) ont montré que le pH de l’effluent à la sortie des deux systèmes pilotes augmente de deux à trois unités par rapport à celui des rejets du tannage à l’entrée. Le pH des eaux usées brutes à l’entrée des deux systèmes varie entre 4 ≤ pH ≤ 6 avec une valeur moyenne de 5,5. Le pH des eaux usées traitées à la sortie des deux systèmes varie entre 7,3 à 8 pour le système à Phragmites australis et entre 7,6 à 8,2 pour le sol non planté.
Toutefois, le pH mesuré au niveau des différents horizons du sol, à la fin de l’expérience, est un pH basique. Son évolution verticale le long du profil des deux pilotes montre que celui‑ci augmente d’une unité de la surface à l’horizon 5-10 cm puis demeure constant au niveau des horizons sous-jacents (Tableau 4). La valeur du pH de l’horizon de surface est moins importante par rapport au reste du profil dû à la nitrification des ions ammoniums et de l’azote organique (YATRIBI et al., 2000).
Tableau 4
Répartition verticale du pH pour les deux systèmes planté (PP) et non planté (NPP).
Vertical distribution of pH in the planted and unplanted systems.
Horizon (cm) |
0-5 |
5-10 |
10-15 |
15-20 |
20-30 |
30-40 |
40-50 |
50-60 |
|---|---|---|---|---|---|---|---|---|
Système (NPP) |
7,8 ±0,1 |
8,7 ±0,3 |
8,7 ±0,4 |
8,8 ±0,2 |
8,8 ±0,2 |
8,8 ±0,1 |
8,9 ±0,1 |
8,9 ±0,1 |
Système (PP) |
7,7 ±0,6 |
8,6 ±0,4 |
8,7 ±0,5 |
8,7 ±0,4 |
8,8 ±0,3 |
8,8 ±0,2 |
8,8 ±0,1 |
8,8 ±0,1 |
3.2 Répartition du chrome total en fonction de la profondeur
La teneur en Cr total dans le sol à l’état initial est de 0,6 mg·kg-1. Les résultats présentés dans le tableau 5 montrent que, pour les deux pilotes, le chrome se trouve dans tous les horizons du sol (0-60 cm) à des concentrations largement supérieures à celles recommandées par l’OMS (150 mg·kg-1). L’analyse des résultats indique également que, pour les deux systèmes pilotes planté (PP) et non planté (NPP), la teneur en Cr total évolue d’une manière décroissante des couches supérieures vers la profondeur.
Tableau 5
Teneur en Cr total dans les différents horizons du sol pour les deux systèmes planté et non planté.
Total Cr contents in different soil horizons in planted and unplanted systems.
|
Teneur en Cr (mg·kg‑1) |
|
|---|---|---|
Horizons (cm) |
Système planté |
Système non planté |
0-5 |
47 985 ± 4355 : (80%)* |
38 887 ± 6963 : (80%)* |
5-10 |
4712 ± 2010 : (8%) |
2786 ± 693 : (6%) |
10-15 |
2891 ± 287 : (5%) |
2448 ± 532 : (5%) |
15-20 |
1464 ± 128 : (2%) |
1647 ± 651 : (3%) |
20-30 |
1352 ± 804 : (2%) |
1470 ± 35 : (3%) |
30-40 |
554 ± 12 : (1%) |
337 ± 23 : (1%) |
40-50 |
543 ± 14 : (1%) |
511 ± 14 : (1%) |
50-60 |
604 ± 20 : (1%) |
442 ± 53 : (1%) |
Pourcentage d’accumulation par rapport à la teneur totale retenue par le sol (0-60 cm)
L’analyse de la variance au seuil de 5 % indique qu’il y a une différence significative entre les teneurs en chrome pour l’horizon supérieur (0-5 cm) pour le système planté 48±4 g·kg-1 et non planté 39±7 g·kg-1 (p < 0,05). Cette différence pourrait être liée à l’effet combiné de plusieurs facteurs : i) l’accumulation des métaux lourds au niveau de la rhizosphère (interface sol-racine) est différente de celle non rhizosphérique (GUCKERT et MOREL, 1988); et ii) l’activité importante des micro-organismes de la rhizosphère permet une complexation élevée du Cr pour le système planté (CHANDERS et BROOKS, 1993; JANSSON-CHARRIER et al., 1994).
Toutefois, pour les deux systèmes (PP) et (NPP), l’application du test ANOVA a montré, d’une part, qu’il y a une différence significative entre les teneurs en Cr pour l’horizon supérieur (0-5 cm) et celles des horizons sous-jacents du sol (5-60 cm), et d’autre part, entre les horizons (5-30 cm) et (30-60 cm) du sol (p < 0,05). En effet, une teneur importante de 80 % en Cr total est accumulée dans l’horizon supérieur (0-5 cm) pour les deux systèmes pilotes en comparaison aux horizons inférieurs (Tableau 5) : 1 % à 8 % pour le système planté et 1 % à 6 % pour le système non planté. Ceci corrobore les résultats obtenus par EMMERICH et al. (1982), HIGGINS (1984), LEGRET et al. (1988); et WILLIAMS et al. (1984). Dans ce sens, TAM et WONG (1994) ont constaté qu’au-delà de 4 cm de profondeur, la concentration en métaux décroît dans les échantillons de sol. Ce qui indique que la surface de sol traitant les rejets de tannage accumule un taux élevé en chrome total en comparaison aux horizons inférieurs.
Les résultats du tableau 5 montrent aussi que le Cr est un élément mobile et qui a pu migrer jusqu’à l’horizon (50-60 cm) pour les deux systèmes. Ces résultats sont en accord avec ceux obtenus dans plusieurs travaux (JUSTE et SOLDÀ, 1977; SELIM et al., 1989). LEGRET et al. (1988) ont montré que le Cr apporté par les boues peut migrer jusqu’à des horizons 80‑100 cm. De leur part, KAFKA et KURAS (1994) ont constaté que le Cr est concentré à 6 mètres de profondeur. Dans ce sens, il est rapporté par GUGGENBERG et al. (1994) que la complexation organique du Cr avec les acides hydrophyliques dissous facilite leur lessivage dans les horizons inférieurs.
Toutefois, l’accumulation du Cr dans le sol dépend de nombreux facteurs (GREFFARD et al., 1985) : pH, Eh (potentiel redox), texture, teneur en matière organique, teneur en calcaire, CEC (capacité d’échange cationique). En effet, le sol utilisé pour cette expérience présente des caractéristiques en faveur d’une bonne fixation du Cr : i) un pH basique (8,63) qui favorise la précipitation du Cr avec les carbonates et les oxydes de fer et de manganèse; et ii) une teneur assez importante en matière organique (4,7 %) qui est capable de piéger le Cr par complexation avec des ligands organiques complexants (COMBER et GARDNER, 2003) et par adsorption (BJERRE et SCHIERUP, 1985; HARTER, 1983; VAN BLADEL et al., 1988).
3.3 Spéciation du Cr total dans le profil du sol
-
Système planté (PP)
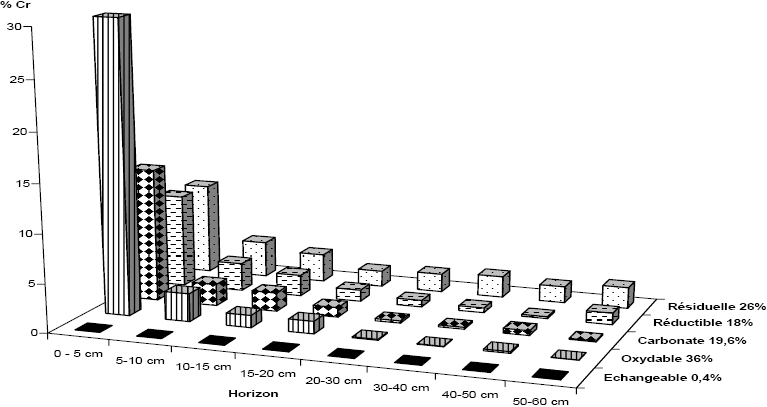
Les résultats de la spéciation du Cr (Figure 3) montrent un enrichissement des formes oxydables, réductibles, carbonates et résiduelles par le Cr pour l’horizon (0-5 cm) plus important que dans les niveaux sous-jacents (5-60 cm).
Pour les différents horizons du système (0-60 cm), la teneur en Cr liée à la fraction oxydable représente environ 0,2 % à 30 % et résiduelle 0,2 % à 9 %. La part associée au carbonate présente 0,1 % à 14 % du Cr total. Les teneurs en Cr dans la fraction réductible varient de 0,2 % à 10 %.
-
Système non planté (NPP)
L’analyse des résultats illustrée par la figure 4 montre que, pour les différents horizons du système non planté (0‑60 cm), le Cr est surtout localisé dans la fraction oxydable du sol 0,4 % à 23 %. La proportion du Cr retenue dans la fraction résiduelle varie de 1,4 % à 7 %. La part associée à la forme réductible du sol représente 0,4 % à 4 % et aux carbonates 0,2 % à 3 % du Cr total.
Figure 3
Répartition du Cr dans les différents horizons du sol pour le système planté.
Cr speciation in different soil horizons of the planted system.
Figure 4
Répartition du Cr dans les différents horizons du sol pour le système non planté.
Cr speciation in different soil horizons of the unplanted system.
Les résultats illustrés par les figures 3 et 4 révèlent également que, pour les deux systèmes, le Cr est très faiblement lié à la fraction échangeable (moins de 1 %). Ceci est dû au fait que le Cr (III), forme utilisée dans les opérations du tannage, est peu soluble dans l’eau (INERIS, 2004) et que sa précipitation est favorisée par le pH basique des différents horizons du sol (KOLELI, 2004). De plus, l’irrigation du système à Phragmites australis a entraîné un enrichissement plus important au niveau de l’horizon (0‑5 cm) des formes réductible et carbonate par le Cr que dans le système non planté. D’un autre coté, la forme du Cr associée à la fraction oxydable est la forme la plus mobile sous laquelle peut se trouver le Cr. Ceci pourrait expliquer sa migration jusqu’à l’horizon profond (50‑60 cm) pour les deux systèmes pilotes. Au vu de ces résultats, la spéciation chimique totale du Cr dans les deux systèmes est représentée comme suit :
Par ailleurs, l’application du test ANOVA a montré qu’il y a une différence significative de la spéciation chimique totale du Cr entre les deux systèmes pilotes (p<0,05).
Toutefois, LEGRET et al. (1987) ont montré que la fraction potentiellement mobilisée d’un métal pourrait être déduite par la somme de la fraction échangeable et de la fraction oxydable. Par conséquent, le Cr retenu dans le système non planté sera relargué en plus grande quantité que dans le système planté.
TIGLYENE et al. (2005) ont rapporté qu’il y a une meilleure oxygénation du sol dans le lit à Phragmites australis (abattement de 74 % en DCO totale) permettant aux bactéries aérobies de proliférer et d’assurer, en conséquence, une meilleure minéralisation et oxydation de la matière organique par rapport au système non planté (élimination de 60,5 % en DCO totale). En outre, il a été montré que le relargage métallique le plus facile à obtenir est celui provenant de la désorption métallique et de la destruction de la matière organique (CIAVATTA et al., 1993). De ce fait, il apparaît, d’après les résultats de la spéciation chimique totale du Cr que, dans le système planté, il y a une libération ou une transformation partielle du Cr de la fraction oxydable mobile pour s’associer aux phases carbonate et réductible relativement stables. Ces fractions constituent un réservoir du Cr partiellement disponible et susceptible de jouer un rôle de tampon de la fraction mobile.
En revanche, les résultats trouvés par KOLELI (2004) montrent que le Cr est présent sous forme : résiduelle (89,8 %) > oxydable (7,1 %) > réductible (2,1 %) > carbonate ≅ échangeable (0,8 %). Pour leur part, DURAND et AMBLES (2004) rapportent que le Cr est peu mobile et qu’il est principalement localisé dans la phase résiduelle. D’un autre coté, LEGRET et al. (1988, 1992) ont montré que le Cr se trouve essentiellement localisé dans la phase résiduelle (76,3 ‑ 78,8 %).
La différence, au niveau des résultats obtenus dans cette étude avec les autres travaux, est en rapport avec les caractéristiques physico-chimiques du sol ainsi que la nature et la concentration du Cr. Dans ce sens, il est rapporté par COMBER et GARDNER (2003) et par KOLELI (2004) que la matière organique, le pH et les carbonates du calcium sont parmi les facteurs qui influencent la spéciation du Cr. BÉNARD et al. (2003) ont montré que certaines bactéries du sol (Pseudomonas putida) peuvent également avoir une action sur la spéciation du chrome.
L’utilisation de la spéciation chimique a permis la destruction sélective de chaque phase composant le sol des différents horizons étudiés. Cette destruction est régie par des conditions physico-chimiques bien précises du milieu. Dans ce sens, il sera donc possible, en fonction des modifications physico-chimiques qui peuvent survenir sur le site d’étude, de prévoir : i) quelle phase risque d’être détruite, ii) connaître la quantité du Cr associée à cette phase; et iii) définir la quantité du métal susceptible de repasser en solution dans ce cas précis :
Si une destruction des matières organiques se produit : 36 % du Cr total dans le système planté (PP) et 54 % du Cr dans le système non planté (NPP) seraient relargués.
Si une baisse de pH a lieu, le relargage du Cr se ferait comme suit : 19,6 % Cr total dans le système (PP) et 10,7 % du Cr dans le système (NPP).
S’il y a une minéralisation des matières réductibles : 18 % Cr total dans le système (PP) et 10 % du Cr dans le système (NPP) seraient relargués.
En revanche, dans la phase résiduelle, se regroupent les composés très stables et qui, sauf exception, ne libéreront pas le métal à court ou à moyen terme (MAIZ et al., 2000).
3.4 Biodisponibilité du Cr total
Les résultats obtenus révèlent que la quantité extraite du chrome de la solution du sol par CaCl2 (0,1 M) est de 0,60±0,01 mg·kg-1 et 0,70±0,03 mg·kg-1 respectivement pour les deux systèmes (PP) et (NPP). Ces teneurs, faibles par rapport à celles enregistrées dans la phase solide du sol, montrent que le Cr se trouve sous d’autres formes (organique, carbonate, réductible, résiduelle).
Toutefois, la faible biodisponibilité du Cr est liée au pH du sol et à sa teneur en calcaire. Après 13 mois d’expérience, le sol a un pH basique (Tableau 4), sa teneur moyenne en calcaire est de 785±26 mg·kg-1. Plusieurs travaux ont montré que l’augmentation du pH (ELLIOT et al., 1986; PARDO et GUADALIX, 1996) et de la teneur en calcaire dans le sol (JUSTE et SOLDA, 1988; HYLANDER, 1995 a,b) est accompagnée d’une réduction de la biodisponibilité des métaux lourds. De ce fait, le Cr total prédomine sous forme organo-métallique soluble ou, sous forme précipité d’oxyde et hydroxydes associés ou inclus dans les oxydes de Fer et des complexes organo-métaliques insolubles (LOSI et al., 1994). De leur part, les carbonates constituent une phase de contrôle du processus de rétention métallique par adsorption et précipitation (MADRID et DIAZ-BARRIENTOS, 1992).
3.5 Teneur de Phragmites australis en Cr total
À la fin de l’expérience (septembre 2003), les résultats de la répartition du Cr dans la plante montrent que la teneur en Cr dans Phragmites australis traitée par l’eau du tannage au chrome est largement supérieure à celle de Phragmites australis irriguée par l’eau de puits (Tableau 6).
Tableau 6
Teneur en Cr total (mg·kg-1 en matière sèche) dans les différentes parties de Phragmites australis (moyenne ± écart type).
Total chromium contents (mg·kg-1 dry matter) in different parts of Phragmites australis (mean ± standard deviation).
|
Tige |
Feuille |
Rhizome |
Racine |
|---|---|---|---|---|
Plante traitée |
68 ± 27 |
67 ± 19 |
70 ± 31 |
1690 ± 124 |
Plante témoin |
0,03 ± 0,01 |
0,025 ± 0,011 |
0,18 ± 0,05 |
0,19 ± 0,07 |
Les résultats montrent que, d’une part, dans la plante traitée, l’incorporation du Cr se fait aussi bien dans les parties souterraines (racine + rhizome) qu’aériennes (tige + feuille); d’autre part, que la concentration en Cr est 24 à 25 fois plus élevée au niveau des racines par rapport, respectivement, aux rhizomes et aux parties aériennes (feuille + tige) de la plante. Par ailleurs, l’application de l’analyse de variance indique que la teneur en Cr présente une différence statistiquement significative entre la partie aérienne et la partie souterraine de Phragmites australis traitée (p<0,01). Dans ce sens, KABATA-PENDIAS (1992) a rapporté qu’une quantité plus importante en chrome est observée dans les racines plutôt que dans les feuilles, tandis que la concentration la plus faible se trouve dans les graines.
3.6 Biomasse du Phragmites australis
L’analyse des résultats du tableau 7 montre que la biomasse du Phragmites australis a diminué par rapport au stade initial de transplantation après 13 mois de fonctionnement du pilote. La réduction de la biomasse de Phragmites australis se manifeste surtout par une diminution plus importante de sa biomasse racinaire en comparaison à sa partie aérienne. En effet, le système racinaire de la plante est faiblement développé avec des racines qui tapissent les parois des pots. Dans ce sens, GRIES et GARBE (1989) ont rapporté que la réduction de la biomasse racinaire peut être une part de la stratégie de survie des plantes afin de réduire l’absorption et le transport des ions dans le rhizome et les tiges vertes. Toutefois, le comportement des plantes face à une pollution métallique se traduit de trois manières : i) la plante exclue le métal par des complexes organiques de l’exsudation racinaire (MOREL, 1985); ii) le métal pénètre dans la plante et trouve des voies de détoxification; dans ce cas il est bioaccumulé (MAITANI et al., 1996; ORTIZ et al., 1992); et iii) la plante ne dispose pas de mécanisme de détoxication et dans ces conditions le métal va agir sur son métabolisme avec toutes les conséquences sur la croissance du végétal.
Tableau 7
Biomasses de Phragmites australis obtenues au stade initial et final d’expérimentation (moyenne ± écart-type)
Biomass of Phragmites australis at the beginning and at the end of the experiment (mean ± standard deviation)
|
Biomasse initiale |
Biomasse finale |
|---|---|---|
|
Partie aérienne g (poids sec) / pot |
80 ± 23 |
57 ± 11 |
|
Partie racinaire g (poids sec) / pot |
236 ± 45 |
190 ± 32 |
3.7 Bilan de l’épuration
Le calcul du bilan du Cr pour les deux pilotes permettra de quantifier le rôle joué par les différentes composantes du système : la plante et le sol. Les résultats illustrés par le tableau 8 montrent que la part majoritaire du Cr se concentre au niveau du sol, 94 % et 98 % respectivement pour le système planté et non planté. Le chrome est essentiellement retenu au niveau du sol par : i) précipitation favorisée par le pH basique des différents horizons du sol; et ii) incorporation dans les différentes phases constitutives du sol (organique, carbonate, réductible et résiduelle) pour les deux systèmes pilotes.
Tableau 8
Bilan du chrome pour les deux systèmes planté et non planté - (moyenne ± écart type).
Mass balance of Cr for the planted and unplanted systems - (mean ± standard deviation).
Bilan en g / pot |
Système planté |
Système non planté |
|---|---|---|
Charge reçue |
222 ± 79 |
222 ± 79 |
Charge restituée |
2,3 ± 1,4 : (1%)* |
3,8 ± 1,7 : (2%)* |
Rétention par le végétal |
|
|
Partie aérienne |
3,1 ± 0,7 : (1%) |
- |
Partie racinaire |
7,5 ± 2,6 : (4%) |
- |
Rétention par le sol |
209 ± 69 : (94%) |
218 ± 53 : (98%) |
Pourcentage du Cr retenu par rapport à la charge totale reçue
Cependant, les résultats du bilan montrent que Phragmites australis retient uniquement 5 % du Cr apporté au système et qu’il est surtout concentré au niveau des racines dans le système planté. L’examen du tableau 8 montre que les charges restituées à la sortie des deux pilotes représentent 1 % et 2 % respectivement pour les systèmes planté et non planté. Bien que la teneur en Cr dans la plante soit faible, Phragmites australis joue un rôle important dans le système planté en maintenant une porosité suffisante pour assurer la percolation des eaux en traitement et, avec des temps de résidence hydraulique trois fois plus réduit, le système planté assure un abattement du chrome total (99 %) comparable à celui du système non planté (TIGLYENE et al., 2005). Ainsi, chaque compartiment du système joue un rôle important et complémentaire dans l’épuration.
4. Conclusion
La présente étude a été réalisée dans le but d’étudier la répartition, la migration, la spéciation et la biodisponibilité du Cr dans les différents horizons du sol d’un pilote planté de traitement du rejet de tannage au chrome après 13 mois de fonctionnement. L’intérêt est porté plus particulièrement sur la comparaison d’un pilote planté par Phragmites australis avec un pilote non planté.
L’étude de la localisation du chrome total a permis de suivre l’évolution de ce métal en fonction de la profondeur. Les résultats obtenus montrent, d’une part, que le chrome total est présent dans tous les horizons du sol à des concentrations décroissantes des couches supérieures vers la profondeur, d’autre part, que les résultats indiquent qu’il y a une accumulation importante de 80 % en Cr total dans l’horizon superficiel (0‑5 cm) pour les deux systèmes pilotes planté (PP) et non planté (NPP). Cependant, l’application du test ANOVA a montré qu’il y a une différence significative (p<0,05) entre les teneurs en chrome pour l’horizon supérieur (0-5 cm) : 48±4 g·kg-1 pour le système (PP) et 39±7 g·kg-1 pour le système (NPP). Les résultats montrent également que le Cr total est un élément mobile qui a pu migrer jusqu’à l’horizon profond (50‑60 cm) pour les deux systèmes.
L’étude de la distribution du Cr entre les différentes formes physico-chimiques du sol montre que le chrome total est peu échangeable et est principalement associé aux phases oxydables, résiduelles, carbonates et réductibles avec une prédominance dans la fraction oxydable pour les deux pilotes. La méthode d’extractions sélectives a permis de montrer que le chrome total n’est pas fixé de façon irréversible. En effet, Phragmites australis a favorisé la dissociation partielle du Cr de la fraction oxydable mobile vers les fractions carbonate et réductible relativement stables. Par conséquent, le Cr retenu dans le système non planté sera probablement relargué en grande quantité que dans le système planté.
L’évaluation de la biodisponibilité du chrome indique que sa teneur présente dans la solution du sol est faible.
Les résultats de la répartition du Cr total dans Phragmites australis montrent que l’accumulation du Cr est plus importante au niveau des parties souterraines (racine+rhizome).
L’établissement d’un bilan global de l’épuration, après 13 mois de fonctionnement du pilote planté, a permis de constater que le sol assure une rétention de 94 % du Cr total appliqué au système; 5 % du Cr est prélevé par Phragmites australis et 1 % du Cr est restitué à la sortie du pilote. La présence des plantes permet de maintenir une porosité suffisante pour assurer la percolation des eaux en traitement et augmenter la conductivité hydraulique du pilote grâce à son système racinaire. Le débit moyen du système planté est trois fois plus élevé que celui du lit non planté, ce qui permet de traiter un volume d’eau usée plus important ou bien de réduire la superficie nécessaire par équivalent habitant.
Appendices
Remerciements
Ce travail a bénéficié du soutien de :
Projet fédérateur du Pôle de Compétence Eau & environnement 2003-2007.
Projet MEDINDUS INCO-CT-2004, 509159.
Références bibliographiques
- AFNOR (1983). Recueil de normes françaises : eau, méthodes d’essai, 2e édition, Paris, 90-120.
- ALDRICH M.V., J.L GARDEA-TORRESDEY, J.R. PERALTA-VIDEA et J.G. PARSON (2003). Uptake and reduction of Cr(VI) to Cr(III) by mesquite (Prosopis spp.): chromate-plant interaction in hydroponics and solid media studied using XAS. Environ. Sci. Technol., 37, 1859-64.
- BARAKATE M., Y. OUHDOUCH, K. OUFDOU et C. BEAULIEU (2002). Characterization of rhizospheric soil streptomycetes from Moroccan habitats and their antimicrobial activities. World Microbiol. Biotechnol., 18, 49-54.
- BARAKATE M., R. ERRAKHI, S. LOQMAN et Y. OUHDOUCH (2003). Les actinomycètes en biotechnologie : lutte biologique contre les maladies phytopathogènes. 1er Symposium International de Virologie au Maroc, Virus et cancer. Marrakech-Maroc, 10-12 décembre pp. 54-58.
- BARRERA-DIAZ C., A. COLIN-CRUZ, F. URENA-NUNEZ, M. ROMERO-ROMO et M. PALOMAR-PARDAVE (2004). Cr(VI) removal from wastewater using low sorbent materials: roots of Typha latifolia and ashes. Environ. Technol., 25, 907-17.
- BARTLETT R.J. et B.R. JAMES (1988). Mobility and bioavailability of chromium in soils, in: Chromium in the Natural and Human Environments, J.O. Nriagu et E. Nieboer (Éditeurs), John Wiley & Sons, New York, N.Y., pp. 267-304.
- BAVEYE P., M.B. McBRIDE, D. BOULDIN, T.D. HINESLY, M.S. DAHDOH et M.F. ABDEL SABOUR (1999). Mass balance and distribution of sludge-borne trace elements in a silt loam soil following long-term applications of sewage sludge. Sci. Total. Environ., 227, 13‑28.
- BEGG J.S., R.L. LAVIGNE et P.L.M. VENEMAN (2001). Reed beds: Constructed wetlands for municipal wastewater treatment plant sludge dewatering. Wat. Sci. Tech., 44, 393-398.
- BEHAL V. (2000). Bioactive products from streptomycess. Adv. Appl. Microbiol., 47, 113-156.
- BENARD A., J. ROSE, J.L. HAZEMANN, A. MASION, J.Y. BOTTERO, A. VICHOT et D. LEMARCHAND (2003). Bioaccumulation et réduction de chrome par une souche bactérienne. J. Phys. IV., 107, 143-146.
- BJERRE G.K. et H.H. SCHIERUP (1985). Influence of water logging on availability and uptake of heavy metals by oats grown in different soils. Plant. Soil., 88, 45-56.
- BLAKE G., B. KAIGATE, A. FOURCY et C. BOUTIN (1987). Incorporation of cadmium by water hyacinth. Wat. Sci. Tech., 9, 123-128.
- CARY E., W. ALLAWAY et O. OLSON (1977a). Control of chromium concentrations in food plants. 1. Absorption and translation of chromium by plants. Agricol. Food. Chem., 25, 300-304.
- CARY E., W. ALLAWAY et O. OLSON (1977b). Control of chromium concentrations in food plants. 2. Chemistry of chromium in soils and its availability to plants. Agricol. Food. Chem., 25, 305-309.
- CHANDER K. et C. BROOKES (1993). Residual effects of zinc, cooper and nickel in sewage sludge on microbial biomass in a sandy loam. Soil. Biol. Biochem., 25, 1231-1239.
- CIAVATTA C., M. GOVI, A. SIMONI et P. SEQUI (1993). Evaluation of heavy metals during stabilisation of organic matter in compost produced with municipal solid wastes. Bio. Technol., 43, 147-153.
- COMBER S. et M. GARDNER (2003). Chromium redox in natural waters. Environ. Monit., 5, 410-3.
- DURAND C. et A. AMBLES (2004). Mobility of trace metals in retention pond sediments. Environ. Technol., 25, 881‑888.
- EGER P. (1994). Wetland treatment for trace metal removal from mine drainage: the importance of aerobic and anaerobic processes. Wat. Sci. Tech., 29, 249-256.
- ELLIOT H.A., M.R. LIBERATI et C.P. HUANG (1986). Competitive adsorption of heavy metals by Soils. J. Environ. Qual., 15, 214-219.
- EMMERICH W.E., L.J. LUND, A.L. PAGE et A.C. CHANG (1982). Solid phase forms of heavy metals in sewage sludge-treated soils. J. Environ. Qual., 11, 178-181.
- GODIN P. (1983). Les sources de pollution des sols : essai de quantification des risques dus aux éléments traces. Sci. Sol., 73-88.
- GREFFARD J., C. SARCIA et A. BOURG (1985). Étude de la contamination des sols sous les champs d’épandage d’Achères (Paris), Hydrogéol., 1, 55-64.
- GRIES C. et D. GARBE (1989). Biomass and nitrogen, phosphorus and heavy metal of Phragmites australis during the third growing season in a root zone wastewater treatment. Hydrobiol., 117, 97-104.
- GUCKERT A. et J.L. MOREL (1988). Rôle des exsudats racinaires dans le transfert sol-plante des éléments traces. C.R., Acad. Agric. Fr., 74, 25-35.
- GUGGENBERG G., B. GLASER et W. ZECH (1994). Heavy metal binding by hydrophobic and hydrophilic dissolved organic carbon fractions in a spodosol A and B horizon. Wat. Air. Soil. Pollut., 72, 11-127.
- GUPTA S.K. (1984). Importance of soil solution composition in deciding the best suitable analytical criteria for guidelines on maximum tolerable metal load and in assessing bio-significance of metals in soil. Agron., 23, 209-225.
- HARTER R.D. (1983). Effect of soil pH on adsorption of lead, copper, zinc, and nickel. Soil Sci. Soc. Am. J., 47, 47-51.
- HIGGINS A.J. (1984). Land application of sewage sludge with regard to cropping systems and pollution potential. J. Environ. Qual., 13, 441-448.
- HOW J.A., R.H. LOEPPERT, V.J. DEROSE, D.B. HUNTER et P.M. BERTSCH (2003). Localisation and speciation of chromium in subterranean clover using XRF, XANES, and EPR spectroscopy. Environ. Sci. Technol., 37, 4091-7.
- HYLANDER H.D. (1995a). Changes in plant nutrient content of barley as a result of lime, phosphorus, manganese, copper and zinc supplies on three Swedish mineral soils in a pot experiment. SwedishJ. Agric. Res., 25, 93-108.
- HYLANDER H.D. (1995b). Effect of lime, phosphorus, manganese, copper and zinc on plant mineral composition, yield of barley and level of extractable nutrients for an acid Swedish mineral soil. Soil. Plant. Anal., 26, 2913‑2928.
- INERIS (2004). Institut National de l’Environnement industriel et des Risques. Chromes et ses dérivés inorganiques. Rapport scientifique n. 2-3, Verneuil en-halatte, France, 11 p.
- JACKSON L.J., J.B. RASMUSSEN, R.H. PETERS et J. KALFF (1991). Empirical relationships between the element composition of aquatic macrophytes and their underlying sediments. Biogeochem., 12, 71-86.
- JANSSON-CHARRIER M., E. GUIBAL, R. SURJOUS et P. LE CLOIREC (1994). Élimination des métaux lourds par adsorption sur matériaux d’origine biologique. T.S.M. L’eau, juin, 6, 321-326.
- JUSTE C. et P. SOLDÀ (1977). Effets d’applications massives de boues de station d’épuration urbaines en monoculture de maïs : action sur le rendement et la composition des plantes et sur quelques caractéristiques du sol. Sci. Sol., 3, 147-155.
- JUSTE C. et P. SOLDA (1988). Influence de l’addition de différentes matières fertilisantes sur la biodisponibilité du cadmium, de manganèse, du nickel et du zinc contenus dans un sol sableux amendé par les boues de station d’épuration. Agron., 8, 897-904.
- KABATA-PENDIAS A. (1992). Trace elements in soils and plants. Boca Raton, C R C press, 2nd Ed, Blacksburg, VA, É-U, 315 p.
- KABDASLI I., O. TÜNAY et D. ORHON (1993). The treatability of chromium tannery waste. Wat. Sci. Tech., 28, 97-105.
- KAFKA Z. et M. KURAS (1994). Analysis of heavy metals in soils contaminated from different sources. FreseniusEnviron. Bull., 3, 407-412.
- KHATTABI A., L. HILALI, O. ASSOBHEI et F. GALVANTI (2002). Isolement de microorganismes d’origine marine (Maroc) antagonistes de Yersinia rukeri et Yersinia pseudotuberculosis. Biol. Biotech., 2, 28-32.
- KOLELI N. (2004). Speciation of chromium in 12 agricultural soils from Turkey. Chem., 57, 1473-1478.
- LEBOURG A., T. STERCKEMAN, H. CIESIELSKI et N. PROIX (1996). Intérêt de différents réactifs d’extraction chimique pour l’évaluation de la biodisponibilité des métaux trace du sol. Agron., 16, 201-215.
- LEGRET M., L. DIVET et P. MARCHANDISE (1987). Mobilité et extraction des métaux lourds associés aux boues de stations d’épuration. Wat. Res., 21, 541-547.
- LEGRET M., L. DIVET et C. JUSTE (1988). Movement and speciation of heavy metals in a soil amended with sewage sludge containing large amount of Cd and Ni. Wat. Res., 22, 953-959.
- LEGRET M. (1992). Speciation of heavy metals in sewage sludge and sludge amended soil. Environ. Anal. Chem., 51, 161-165.
- LOSI M.E., C. AMRHEIN et W.T.J.R. FRANKENBERGER (1994). Environmental biochemistry of chromium. Environ. Contam. Toxicol., 136, 91-121.
- MADRID L. et E. DIAZ-BERRIENTOS (1992). Influence of carbonate on the reaction of heavy metals in soils. Soil. Sci., 43, 709-721.
- MAITANI T., H. KUBOTA, K. SATO et Y. YAMADA (1996). The composition of metals bound to class III metallothionein (phytochelatin and its desglycyl pepetide) induced by various metals in root culture of Rubia tinchorum. Plant. Physiol., 110, 1145-1150.
- MAIZ I., I. ARAMBARRI, R. GARCIA et E. MILLAN (2000). Evaluation of heavy metal availability in polluted soils by two sequential extraction procedures using factor analysis. Environ. Pollut., 110, 3-9.
- MENCH M. (1993). Notions sur les éléments en traces pour une qualité des sols et des produits végétaux. Purpan., 166, 188-127.
- MOREL J.L. (1985). Contribution à l’étude des transferts de métaux lourds dans le système sol-plante : Le rôle des mucilages racinaires. Thèse de Doctorat. Univ. Nancy, France, 175 p.
- NAKADA M., K. FUKAYA, S. TAKESHITA et Y. WADA (1979). The accumulation of heavy metals in the submerged plant (Elodea nuttallii). Bull. Environ. Contam. Toxicol., 22, 21-27.
- NÈGRE R. (1961). Petite flore des régions arides du Maroc occidental, Tome I. Éditions du Centre National de la Recherche Scientifique, Paris, France, 70 p.
- NOZAKI J., I. MESSERSCHMIDT et D. GARCIA DE RODRIGUEZ (1993). Tannery wastes cleaning with natural polyelectrolytes. Chemical speciation studies of chromium. Arqule Biol. Technol., 36, 761-770.
- OMS (1989). L’utilisation des eaux usées en agriculture et aquaculture : Recommandations à visées sanitaires. Rapp. Tech., n° 788, 82 p.
- ORTIZ D.F., L. KREPPEL, D.M. SPEISER, G. SCHEEL et G. McDONALD (1992). Heavy metal tolerance in the fission yeast requiers an ATP-binding cassette-type vacuolar membrane transporter. EMBOJ J., 3491-3499.
- PARDO M.T. et M.E. GUADALIX (1996). Zinc sorption-desorption by two andepts: Effect of pH and support medium. Soil. Sci., 47, 257-263.
- POLPRASERT C., N.P DAN et N. THAYALAHUMARAN (1996). Application of constructed wetlands to treat some toxic wastewaters under tropical conditions. Wat. Sci. Tech., 34, 165-171.
- QIAN J.H., A. ZAYED et Y.L. ZHU (1999). Phytoaccumulation of trace elements by wetland plants: III. Uptake and accumulation of ten trace elements by twelve plant species. J. Environ. Qual., 28, 1448-1455.
- RODIER J. (1984). L’analyse de l’eau : eaux naturelles, eaux résiduaires, eau de mer, 7e Édition, DUNOD, Bordas, Paris, 134 p.
- SCANDIACONSULT INTERNATIONAL (1999). Étude de la réduction des rejets industriels sur la qualité des eaux des bassins d’Oum Er Bia et de Tensift, Maroc. Rapport du Ministère du Commerce, de l’Industrie et de l’Artisanat, Division de la protection de l’Environnement., Marrakech, Maroc, 18 p.
- SELIM H.M., M.C. AMACHER et I.K. ISKANDAR (1989). Modelling the transport of chromium (VI) in soil columns. Soil. Sci. Soc. Am. J., 53, 996-1004.
- SHUTES R.E., D.M. REVITT et L.N.L. SCHOLES (2001). An experimental constructed wetland system for the treatment of highway runoff in the UK. Wat. Sci. Technol., 44, 571-578.
- SINHA S., R. SAXENA et S. SINGH (2002). Comparative studies on accumulation of Cr from metal solution and tannery effluent under repeated metal exposure by aquatic plants: Its toxic effects. Environ. Monit. Assess., 80, 17‑31.
- SOLTNER D. (1990). Les bases de la production végétale, Tome I : le sol. 18e édition, Collection Sciences et Techniques agricoles, LAVOISIER (Éditeurs), Paris, France, 472 p.
- STOMBERG A.L., D.D. HEMPHILL et V.V. VOLK (1984). Yield and elemental concentration of sweet corn grown on tannery waste-amended soil. J. Environ. Qual., 13, 162‑166.
- SZPYRKOWICZ L., J. NAUMCZYK et F. ZILIOI-GRANDI (1995). Electrochemical treatment of tannery wastewater using Ti/Pt and Ti/Pt/Ir electrodes. Wat. Res., 29, 517-524.
- TALINI I. (1994). Pretreatment of tannery wastewaters. Wat. Sci. Tech., 29, 175-178.
- TAM N.F.Y. et Y.S. WONG (1994). Nutriment and heavy metal retention in mangrove sediment receiving wastewater. Wat. Sci. Tech., 29, 193-200.
- TAUZIN J. et C. JUSTE (1986). Évolution du contenu en métaux lourds d’un sol de limon maintenu en jachère nue après 56 années d’application continue de divers engrais et amendements. CR. Acad. Agric. Fr., 72, 739-746.
- TESSIER A., P.C.G. CAMPBELL et M. BISSON (1979). Sequential extraction procedure for speciation of particulate trace metals. Anal. Chem., 51, 844-851.
- TIGLYENE S., L. MANDI et A. JAOUAD (2005). Enlèvement du chrome par infiltration verticale sur lits de Phragmites australis (Cav.) Steudel., Rev. Sci. Eau., 18, 117‑198.
- TÜNAY O., D. ORHON et I. KABDASLI (1994). Pretreatment requirements for leather tanning industry wastewaters. Wat. Sci. Tech., 29, 121-128.
- VAN BLADEL R., J.M. GODFRIN et P. CLOOS (1988). Influence des propriétés physico-chimiques des sols sur l’adsorption des métaux lourds cuivre et zinc. Agron., 41, 729-744.
- WIEDER R.K. (1990). Metal cation binding to Sphagnum peat and sawdust: relation to wetland treatment of metal-polluted water. Wat. Air. Soil. Pollut., 53, 391-400.
- WILLIAMS D.E., J. VLAMIS, A.H. PAKITE et J.E. COREY (1984). Metal movement in sludge treated soils after six years of sludge addition: I-cadmium, copper, lead and zinc. Soil. Sci., 137, 351-359.
- WU R.Y. et M.H. CHEN (1995). Identification of the streptomyces strain KS3-5. Bot. Bull. Acad. Sin., 36, 201‑205.
- YATRIBI A., L. BOUKHARS, A. TOUMI et A. NEJMEDDINE (2000). Effets des déchets de tannerie avec ou sans chrome sur la nitrification dans des sols en zone aride (Marrakech, Maroc). Agron., 3, 140-150.
List of figures
Figure 1
Évolution temporelle de la température et de la pluviométrie.
Temporal changes in temperature and rainfall.
Figure 2
Pourcentage d’abattement du Cr total pour les deux systèmes planté et non planté.
Percent removal of total Cr in the planted and unplanted systems.
Figure 3
Répartition du Cr dans les différents horizons du sol pour le système planté.
Cr speciation in different soil horizons of the planted system.
Figure 4
Répartition du Cr dans les différents horizons du sol pour le système non planté.
Cr speciation in different soil horizons of the unplanted system.
List of tables
Tableau 1
Caractéristiques physico-chimiques du sol (nombre d’échantillons = 4).
Physico-chemical characteristics of soil (number of samples = 4).
Paramètres |
Teneurs |
|---|---|
ph |
8,63 ± 0,25 |
% m.o |
4,7 ± 1,3 |
% humidité |
21 ± 7 |
cE (µs·cm‑1) |
400 ± 45 |
Cl (mg·Kg‑1) |
71 ± 33 |
Na (mg·g‑1) |
2,7 ± 1,2 |
Mg (mg·g‑1) |
0,36 ± 0,2 |
Ca (mg·kg‑1) |
760 ± 261 |
Zn (mg·kg‑1) |
12 ± 4 |
Pb (mg·kg‑1) |
1,2 ± 0,7 |
Fe (mg·kg‑1) |
71 ± 37 |
Cr (mg·kg‑1) |
0,6 ± 0,1 |
Cu (mg·kg‑1) |
0,35 ± 0,12 |
Tableau 2
Caractéristiques physico-chimiques de l’eau usée de tannerie (nombre d’échantillons = 20).
Physico-chemical characteristics of tannery wastewater (number of samples = 20).
Paramètres |
Teneurs |
|---|---|
pH |
3,08 ± 1,16 |
CE (ms·cm‑1) |
118 ± 50 |
MES (mg·L‑1) |
233 ± 24 |
DBO5 (mg·L‑1) |
45 ± 2 |
DCO (mg·L‑1) |
2500 ± 13 |
Cl- (g·L‑1) |
20,6 ± 1,3 |
NH4+ (mg·L‑1) |
520 ± 19 |
Cr (g·L‑1) |
1,23 ± 0,12 |
CE (ms·cm‑1) : conductivité électrique en millisemens par centimètre
Tableau 3
Caractéristiques hydrauliques du système planté et du sol non planté (nombre d’échantillons = 50).
Hydrological characteristics of planted and unplanted systems (number of samples =50).
|
Lit planté |
Lit non planté |
|---|---|---|
Volume à l’entrée (L) |
15 |
15 |
Temps d’infiltration |
3 h 35 min |
10 h 45 min |
Volume restitué (L) |
6 ± 3,4 |
9 ± 2,5 |
% de restitution |
40 |
60 |
Débit moyen (mL·min‑1) |
35 ± 13 |
12 ± 7 |
Pertes d’eau en (%) |
57,5 ± 2,4 |
38 ± 2,7 |
Tableau 4
Répartition verticale du pH pour les deux systèmes planté (PP) et non planté (NPP).
Vertical distribution of pH in the planted and unplanted systems.
Horizon (cm) |
0-5 |
5-10 |
10-15 |
15-20 |
20-30 |
30-40 |
40-50 |
50-60 |
|---|---|---|---|---|---|---|---|---|
Système (NPP) |
7,8 ±0,1 |
8,7 ±0,3 |
8,7 ±0,4 |
8,8 ±0,2 |
8,8 ±0,2 |
8,8 ±0,1 |
8,9 ±0,1 |
8,9 ±0,1 |
Système (PP) |
7,7 ±0,6 |
8,6 ±0,4 |
8,7 ±0,5 |
8,7 ±0,4 |
8,8 ±0,3 |
8,8 ±0,2 |
8,8 ±0,1 |
8,8 ±0,1 |
Tableau 5
Teneur en Cr total dans les différents horizons du sol pour les deux systèmes planté et non planté.
Total Cr contents in different soil horizons in planted and unplanted systems.
|
Teneur en Cr (mg·kg‑1) |
|
|---|---|---|
Horizons (cm) |
Système planté |
Système non planté |
0-5 |
47 985 ± 4355 : (80%)* |
38 887 ± 6963 : (80%)* |
5-10 |
4712 ± 2010 : (8%) |
2786 ± 693 : (6%) |
10-15 |
2891 ± 287 : (5%) |
2448 ± 532 : (5%) |
15-20 |
1464 ± 128 : (2%) |
1647 ± 651 : (3%) |
20-30 |
1352 ± 804 : (2%) |
1470 ± 35 : (3%) |
30-40 |
554 ± 12 : (1%) |
337 ± 23 : (1%) |
40-50 |
543 ± 14 : (1%) |
511 ± 14 : (1%) |
50-60 |
604 ± 20 : (1%) |
442 ± 53 : (1%) |
Pourcentage d’accumulation par rapport à la teneur totale retenue par le sol (0-60 cm)
Tableau 6
Teneur en Cr total (mg·kg-1 en matière sèche) dans les différentes parties de Phragmites australis (moyenne ± écart type).
Total chromium contents (mg·kg-1 dry matter) in different parts of Phragmites australis (mean ± standard deviation).
|
Tige |
Feuille |
Rhizome |
Racine |
|---|---|---|---|---|
Plante traitée |
68 ± 27 |
67 ± 19 |
70 ± 31 |
1690 ± 124 |
Plante témoin |
0,03 ± 0,01 |
0,025 ± 0,011 |
0,18 ± 0,05 |
0,19 ± 0,07 |
Tableau 7
Biomasses de Phragmites australis obtenues au stade initial et final d’expérimentation (moyenne ± écart-type)
Biomass of Phragmites australis at the beginning and at the end of the experiment (mean ± standard deviation)
|
Biomasse initiale |
Biomasse finale |
|---|---|---|
|
Partie aérienne g (poids sec) / pot |
80 ± 23 |
57 ± 11 |
|
Partie racinaire g (poids sec) / pot |
236 ± 45 |
190 ± 32 |
Tableau 8
Bilan du chrome pour les deux systèmes planté et non planté - (moyenne ± écart type).
Mass balance of Cr for the planted and unplanted systems - (mean ± standard deviation).
Bilan en g / pot |
Système planté |
Système non planté |
|---|---|---|
Charge reçue |
222 ± 79 |
222 ± 79 |
Charge restituée |
2,3 ± 1,4 : (1%)* |
3,8 ± 1,7 : (2%)* |
Rétention par le végétal |
|
|
Partie aérienne |
3,1 ± 0,7 : (1%) |
- |
Partie racinaire |
7,5 ± 2,6 : (4%) |
- |
Rétention par le sol |
209 ± 69 : (94%) |
218 ± 53 : (98%) |
Pourcentage du Cr retenu par rapport à la charge totale reçue





 10.7202/705555ar
10.7202/705555ar