Abstracts
Résumé
L’utilisation du bénomyl et du thiabendazole (famille chimique des benzimidazoles), de l’azoxystrobine et du pyriméthanil montre, autant in vitro qu’in vivo, que ces fongicides sont faiblement à moyennement efficaces contre les agents pathogènes suivants : Rhizopus stolonifer, Penicillium expansum, Aspergillus niger, A. fumigatus, Alternaria alternata, Cladosporium herbarum, Fusarium oxysporum, Saccharomyces cerevisiae, Monilia fructigina, Cryptosporiopsis malicorticis, Spilocaea pomi et Trichothecium roseum. Utilisé in vitro, le chlorure de calcium seul à plus de 4 % est toléré par les douze espèces fongiques. In vivo et à basse température, le chlorure de calcium est efficace lorsqu’utilisé à 4 et 6 %. L’association de ces fongicides avec le chlorure de calcium (4 %) permet de diminuer l’intensité des lésions causées par la pourriture des pommes en conservation. Le chlorure de calcium apparaît intervenir en renforçant les liens avec les principaux sites d’action des fongicides de l’agent pathogène évalué.
Mots clés:
- Benzimidazoles,
- champignons pathogènes,
- chlorure de calcium,
- fongicides,
- pourriture des pommes
Abstract
The use of benomyl and thiabendazole (chemical family of the benzimidazoles), and of azoxystrobine and pyrimethanil shows that, in vitro as much as in vivo, these fungicides are slightly to moderately effective against the following pathogens: Rhizopus stolonifer, Penicillium expansum, Aspergillus niger, A. fumigatus, Alternaria alternata, Cladosporium herbarum, Fusarium oxysporum, Saccharomyces cerevisiae, Monilia fructigina, Cryptosporiopsis malicorticis, Spilocaea pomi and Trichothecium roseum. In vitro, calcium chloride used at more than 4% is tolerated by these pathogens. In vivo and at low temperature, calcium chloride is effective at 4 to 6%. The association of these fungicides with calcium chloride (4%) allows a better control of apple rot in conservation. Calcium chloride appears to intervene by reinforcing the bonds with the principal sites of action of fungicides of the pathogenic agent tested.
Keywords:
- Apple rot,
- benzimidazoles,
- calcium chloride,
- fungicides,
- pathogenic fungi
Article body
Introduction
Les maladies de conservation sont au premier rang des préoccupations des producteurs de pommes et de poires. Elles constituent un problème majeur en arboriculture fruitière. Par exemple, pendant la période d’entreposage, elles entraînent des pertes pouvant affecter jusqu’à la moitié de la récolte, les fruits atteints étant alors inutilisables (Selmaoui et al. 1997).
Au Maroc, Selmaoui (1999) a montré l’existence de cinq espèces fongiques susceptibles de provoquer une importante pourriture des pommes : Alternaria alternata (Fr.:Fr.) Keissl., Penicillium spp., Trichoderma harzianum Rifai, Trichothecium roseum (Pers.:Fr.) Link et Fusarium avenaceum (Fr.:Fr.) Sacc. Actuellement, la lutte contre les maladies de conservation demeure difficile. Elle se fait souvent à l’aide de fongicides et, même alors, les résultats ne sont souvent que partiellement positifs.
Cependant, malgré la diversité des produits utilisés, des cas de résistance à divers produits ont été détectés (Prusky 1985). Des souches de Penicillium expansum Link, résistantes aux benzimidazoles, ont été signalées sur des pommes aux États-Unis par Rosenberg et Meyer (1979). Le problème de résistance incite à chercher d’autres produits capables de lutter contre les champignons responsables de la pourriture des pommes et des poires en conservation.
Depuis longtemps, certains chercheurs (De Long 1937; Garman et Mathis 1956) ont mis l’accent sur l’importance du calcium dans le développement des maladies et accidents physiologiques des pommes et des poires. Des travaux plus récents ont également montré que le calcium confère aux fruits une grande résistance contre certains champignons tels Alternaria spp. (Biggs et al. 1993), Penicillium spp. (Conway 1982) et Leucostoma persoonii Höhn. (Biggs et Peterson 1990; Biggs et al. 1994), et contre A. alternata, T. roseum, T. harzianum, P. expansum et F. avenaceum (Selmaoui et Douira 2003).
Par ailleurs, les fongicides de la famille des benzimidazoles et des thiophanates se sont montrés inefficaces contre A. alternata et P. expansum, mais ils ont montré une efficacité contre T. roseum, T. harzianum et F. avenaceum (Selmaoui 1999; Selmaoui et al. 1997). Par contre, d’après ces auteurs, les traitements des pommes avec des fongicides de la famille des thiocarbamates inhibent le développement d’A. alternata et de P. expansum, alors qu’ils favorisent celui des autres champignons, d’où la nécessité de combiner les deux familles de fongicides pour limiter le développement de ce complexe fongique. Certains auteurs (Biggs et al. 1993) ont associé le chlorure de calcium aux fongicides pour lutter contre le développement de certains champignons.
Dans cette étude, nous avons évalué l’efficacité in vitro et in vivo de l’association chlorure de calcium–fongicides (bénomyl, thiabendazoles, azoxystrobine et pyriméthanil) à l’égard de douze espèces fongiques observées lors de la conservation des pommes.
Matériel et méthodes
Isolement des parasites responsables de la pourriture des pommes
L’isolement de Rhizopus stolonifer (Ehrenb.:Fr.) Vuill., P. expansum, Aspergillus niger Tiegh., A. fumigatus Fresen., Alternaria alternata, Cladosporium herbarum (Pers.:Fr.) Link, Fusarium oxysporum Schlechtend.:Fr., Saccharomyces cerevisiae Meyen ex E.C. Hansen, Monilinia fructigena (Aderh. & Ruhl.) Honey, Cryptosporiopsis malicorticis (Cordl.) Nannf., Spilocaea pomi Fr. et T. roseum a été réalisé à partir de pommes en conservation présentant des lésions, dans des chambres frigorifiques de la région de Kénitra (Maroc). Les pommes ont été désinfectées avec de l’hypochlorite de sodium à 5 % et les fragments ont été par la suite découpés et déposés sur milieu gélosé à base de pomme de terre (PSA, pour potato saccharose agar) coulé en boîtes de Pétri stériles. Par la suite, les boîtes ont été incubées à l’obscurité à une température de 25 °C. La purification des cultures a été obtenue après plusieurs repiquages successifs et clonage monosporale. L’identification a été effectuée par l’examen au microscope photonique de prélèvements du mycélium et des structures conidiennes sur PSA.
Fongicides et chlorure de calcium évalués
Les fongicides retenus pour cette étude ont été utilisés aux doses homologuées : bénomyl 50 % (methyl 1-(butylcarbamoyl)benzimidazol-2-ylcarbamate), 60 g hL-1 et thiabendazole (2-(thiazol-4-yl)benzimidazole), 150 g hL-1. Sous forme d’une suspension liquide concentrée, l’azoxystrobine (methyl (E)-2-{2-[6-(2-cyanophenoxy)pyrimidin-4-yloxy]phenyl}-3-methoxyacrylate) contenant 250 g L-1 a été utilisée à 1250 ppm et le pyriméthanil (N-(4,6-dimethylpyrimidin-2-yl)aniline) à 800 ppm. Le chlorure de calcium (CaCl2 à 96 %) a été évalué seul à 2, 4 et 6 %. Pour les associations fongicides–CaCl2, les fongicides ont été évalués en présence de 4 % de CaCl2.
Action des fongicides et du CaCl2 sur la croissance mycélienne
Les fongicides et le CaCl2 se présentent en général sous forme concentrée. Pour chacun d’eux, lorsque soluble dans l’eau, une solution mère a été préparée en solubilisant le produit dans l’eau distillée stérile; c’est notamment le cas du bénomyl et du thiabendazole. La fongitoxicité a été estimée en mesurant la croissance mycélienne de chaque espèce sur PSA selon deux directions perpendiculaires.
Pour chaque espèce fongique et chaque concentration de fongicide, de CaCl2 ou d’un mélange des deux, trois boîtes de Pétri ont été observées par essai. Pour chaque boîte, l’inoculation a été effectuée à l’aide d’un disque mycélien issu d’une culture âgée de 10 à 15 j d’incubation à 25 °C. Le pourcentage d’inhibition (Ic) de la croissance mycélienne par rapport au témoin a été calculé selon la formule suivante :
Cr0 : Croissance du champignon (en mm) sur le milieu de culture sans fongicide ni CaCl2.
Crc : Croissance du champignon (en mm) sur le milieu de culture à une concentration de fongicide ou de CaCl2.
Action des fongicides et du CaCl2 sur la germination des spores
Les espèces fongiques évaluées ont été cultivées sur le milieu PSA. Après 10 j d’incubation, la surface chargée de spores de chaque boîte a été raclée stérilement à l’aide d’une spatule métallique en présence de 10 mL d’eau distillée stérile. La suspension résultante a été filtrée puis ajustée à 103 spores mL-1. Une quantité de 0,2 mL de cette suspension a été étalée sur la surface des boîtes de Pétri contenant de l’eau gélosée stérile (15 g d’agar L-1), à laquelle le fongicide, le CaCl2 ou un mélange des deux a été ajouté. Les boîtes de Pétri ont été placées à l’obscurité à 25 °C. Après 24 h, le comptage des spores germées a été effectué sur un total de 200 spores. La spore était considérée comme germée si la longueur du tube germinatif était supérieure à son plus petit diamètre. Pour chaque traitement, trois boîtes ont été utilisées. Le pourcentage d’inhibition de la germination des spores (IG) par rapport au témoin a été calculé selon la formule suivante :
N0 : Nombre de spores germées sur le milieu de culture sans fongicide ni CaCl2.
Nc : Nombre de spores germées sur le milieu de culture en présence d’un fongicide, du CaCl2 ou d’un mélange des deux.
Action des fongicides et du CaCl2 sur la production des spores
Quatre rondelles de 5 mm de diam ont été découpées à l’aide d’un emporte-pièce à partir des cultures âgées de 10 j et ayant servi à la croissance mycélienne. Elles ont été placées dans un tube à vis contenant 1 mL d’eau distillée stérile avec une goutte de Tween 20. Les tubes ont été agités au vortex pendant 30 s, ce qui a permis le détachement des spores des conidiophores ou l’éclatement des sporocystes (pour le R. stolonifer). La suspension ainsi obtenue a été filtrée sur la mousseline afin d’éliminer les fragments mycéliens.
Le comptage du nombre total de spores a été effectué à l’aide d’une cellule de Malassez, à raison de trois comptages par suspension et par fongicide, ainsi que pour le CaCl2 ou un mélange des deux. Les moyennes de ces mesures ont par la suite été calculées. Les valeurs ont été exprimées en nombre de spores par mL. Le pourcentage d’inhibition de la sporulation (PIs) par rapport au témoin a été calculé comme suit :
N0 : Nombre de spores estimées sur le milieu de culture sans fongicide ni CaCl2.
Nc : Nombre de spores estimées en présence du fongicide, du CaCl2 ou d’un mélange des deux.
Test in vivo sur les différentes étapes du cycle de vie des champignons
Des pommes du cultivar Golden Delicious, préalablement stérilisées à l’alcool 90 %, ont été inoculées par des fragments mycéliens 24 h après blessures et traitement par les fongicides, le CaCl2 ou un mélange des deux. Les pommes traitées ont été réparties séparément dans des sachets en plastique noir, incubés les uns à 4 °C pendant 2 mois et les autres à 25 °C pendant 10 j. Au début, la pulvérisation des sachets avec de l’eau distillée stérile a permis de garder un taux d’humidité satisfaisant à l’intérieur de ceux-ci. L’efficacité, ou pourcentage d’inhibition, de chaque fongicide et du CaCl2 a été déterminée selon la formule suivante :
D0 : Diamètre de la pourriture sur les pommes du milieu de culture sans fongicide ni CaCl2.
Dc : Diamètre de la pourriture sur les pommes traitées par le fongicide, le CaCl2 ou un mélange des deux.
Pour chaque traitement, trois essais ont été effectués et, pour chaque essai, trois pommes ont été inoculées en trois points de leur partie équatoriale.
Pour l’analyse des résultats, des comparaisons multiples ont été réalisées avec le test de Duncan (Multiple Range Test) au seuil de 5 %.
Résultats
Efficacité in vitro et in vivo du chlorure de calcium
Dans les essais in vitro, le CaCl2 évalué à 2, 4 et 6 % a montré une efficacité faible à moyenne à réduire la croissance mycélienne et la germination des spores des différents champignons étudiés (Tableau 1), les pourcentages d’inhibition variant entre 8,5 et 58,80 %. Cette efficacité est cependant plus importante en ce qui concerne la sporulation des espèces fongiques étudiées puisqu’elle varie de 24,3 à 70,3 %.
Tableau 1
Efficacité in vitro du CaCl2 sur le développement des trois stades du cycle de vie de 12 espèces de champignons responsables de la pourriture des pommes en conservation
|
Champignons étudiés1 |
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Croissance mycélienne (mm)2 |
|||||||||||
CaCl2 |
|
|||||||||||
% |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
2 |
15,3b |
12,8b |
10,3b |
11,5b |
10,8b |
9,7b |
9,8b |
8,5b |
10,0c |
12,6b |
10,5b |
13,8b |
4 |
50,0a |
48,0a |
50,6a |
46,9a |
54,0a |
46,2a |
47,7a |
45,6a |
50,4a |
45,0a |
46,8a |
46,5a |
6 |
48,6a |
48,5a |
47,9a |
45,3a |
43,0b |
44,5a |
48,6a |
43,2a |
42,8b |
46,3a |
45,5a |
48,0a |
|
Germination conidienne (%)2 |
|||||||||||
CaCl2 |
|
|||||||||||
% |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
2 |
20,3c |
20,4c |
19,7c |
16,8c |
12,6c |
18,5c |
13,4c |
12,4c |
17,6c |
15,4c |
14,6c |
18,8c |
4 |
50,5a |
52,5a |
55,6a |
51,0a |
50,6a |
58,8a |
56,3a |
50,0a |
52,2a |
56,3a |
54,6a |
49,0a |
6 |
46,6b |
42,5b |
45,9b |
44,8b |
38,8b |
43,3b |
40,6b |
38,4b |
38,5b |
44,3b |
42,6b |
45,4b |
|
Sporulation (spores mL-1)2 |
|||||||||||
CaCl2 |
|
|||||||||||
% |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
2 |
30,8c |
30,5c |
28,4c |
29,5c |
25,5c |
25,8c |
26,4c |
24,3c |
27,7c |
28,3c |
27,0c |
28,5c |
4 |
50,0b |
50,0b |
58,1b |
50,0b |
52,3b |
52,6b |
58,1b |
50,0b |
52,1b |
51,0b |
53,0b |
46,3b |
6 |
70,3a |
68,3a |
69,5a |
53,8a |
46,9a |
52,5a |
63,3a |
64,6a |
65,5a |
68,8a |
65,5a |
70,2a |
Espèces de champignons : Rs : Rhizopus stolonifer, Pe : Penicillium expansum, An : Aspergillus niger, Af : Aspergillus fumigatus, Aa : Alternaria alternata, Ch : Cladosporium herbarum, Fox : Fusarium oxysporum, Sc : Saccharomyces cerevisiae, Mf : Monilia fructigena, Cm : Cryptosporiopsis malicorticis, Sp : Spilocaea pomi, Tr : Trichothecium roseum.
Sur une même colonne, deux résultats (moyenne des pourcentages d’inhibition) suivis de la même lettre ne différent pas significativement au seuil de 5 % (test Duncan’s Multiple Range).
Figure 1
Efficacité du CaCl2 sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation; 1A : CaCl2 2%, 1B : 4% et 1C : 6%.
Espèces de champignons : Rs : Rhizopus stolonifer, Pe : Penicillium expansum, An : Aspergillus niger, Af : Aspergillus fumigatus, Aa : Alternaria alternata, Ch : Cladosporium herbarum, Fox : Fusarium oxysporum, Sc : Saccharomyces cerevisiae, Mf : Monilia fructigena, Cm : Cryptosporiopsis malicorticis, Sp : Spilocaea pomi, Tr : Trichothecium roseum.
Pour une même température, les pourcentages d’inhibition ayant la même lettre ne diffèrent pas significativement au seuil de 5 %.
In vivo, l’efficacité du CaCl2 à réduire le développement de la pourriture sur les pommes en conservation est variable et augmente en fonction de la dose évaluée. Elle varie également en fonction de la température d’incubation des pommes traitées et inoculées avec les diffèrents champignons (Fig. 1). Par exemple, lorsque le CaCl2 est utilisé à 6 %, l’inhibition fluctue entre 40 et 66,5 % à 25 °C alors qu’elle se situe entre 72,5 et 97,8 % à 4 °C.
Il en ressort que le CaCl2 utilisé seul est plus efficace in vivo qu’in vitro pour contrer le développement des espèces fongiques responsables de la pourriture des pommes en conservation.
Efficacité in vitro des fongicides, du CaCl2 et d’un mélange de ces composés sur les différentes étapes du cycle de vie des champignons.
Effet des fongicides et du CaCl2 sur la croissance mycélienne
Le bénomyl et le thiabendazole (Tableau 2) ont faiblement réduit la croissance mycélienne de la majorité des champignons étudiés (variant de 12,6 à 36,2 %), les exceptions étant Aspergillus niger et A. fumigatus où l’inhibition atteint plus de 90 %. Par contre, l’efficacité de l’azoxystrobine et du pyriméthanil est notable sur la majorité des espèces fongiques évaluées (l’inhibition varie de 56 à 99 %), sauf pour A. niger, A. fumigatus et S. cerevisiae où l’inhibition ne dépasse pas 21 %. En présence du CaCl2, l’efficacité de ces deux derniers fongicides augmente généralement. Toutefois, les associations bénomyl–CaCl2 et thiabendazole–CaCl2 n’ont montré aucun effet sur la croissance mycélienne d’A. alternata, C. herbarum, F. oxysporum, S. cerevisiae, M. fructigina et T. roseum.
Tableau 2
Efficacité in vitro du CaCl2 (4 %) associé avec le bénomyl, le thiabendazole, l’azoxystrobine et le pryriméthanil sur les trois étapes du cycle de vie des champignons responsables de la pourriture des pommes
|
Champignons1 |
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Croissance mycélienne (mm)2 |
|||||||||||
Traitements |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
CaCl2 |
48,5d |
49,0e |
52,4c |
49,5d |
56,6c |
46,4b |
48,2d |
46,4c |
50,8d |
47,6d |
47,5d |
49,4b |
Bénomyl (B) |
35,4e |
32,0f |
98,5a |
86,3b |
21,6f |
26,3d |
19,4f |
18,3e |
28,2e |
23,5f |
30,4e |
27,7c |
B + CaCl2 |
60,0c |
55,6d |
100a |
96,5a |
20,0e |
36,2c |
28,8e |
30,5d |
32,4e |
36,0e |
40,5d |
44,3b |
Thiabendazole (T) |
12,6f |
69,6c |
90,4b |
98,4a |
30,4d |
26,6d |
32,0e |
20,5e |
60,8c |
31,0e |
31,4e |
36,2d |
T + CaCl2 |
55,0c |
75,0b |
93,9b |
94,2a |
35,6d |
36,4c |
44,5d |
32,6d |
26,0d |
64,5c |
51,4c |
45,0b |
Azoxystrobine (A) |
95,6a |
98,4a |
12,6e |
20,2e |
98,5a |
98,6a |
97,4a |
21,3e |
97,8a |
98,5a |
99,0ab |
96,0ab |
A + CaCl2 |
96,0a |
100a |
20,4d |
36,5c |
98,9a |
100a |
100a |
44,5c |
96,4a |
100a |
98,0a |
95,5a |
Pyriméthanil (P) |
83,5b |
82,0b |
92,0b |
91,0a |
56,0c |
96,5a |
56,4c |
82,6b |
83,2b |
86,0b |
97,0ab |
93,2ab |
P + CaCl2 |
84,6b |
80,0b |
96,5a |
92,0a |
64,3b |
94,6a |
64,0b |
91,9a |
95,5a |
94,8a |
100a |
99,5a |
|
Germination des spores (%)2 |
|||||||||||
Traitements |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
CaCl2 |
52,4d |
52,6b |
53,4b |
54,5c |
50,5c |
57,6c |
56,2c |
50,4c |
52,6c |
57,5b |
53,8c |
48,0c |
Bénomyl (B) |
36,6f |
32,6c |
96,2a |
99,6a |
35,0d |
24,0f |
20,6e |
24,2e |
25,5f |
22,6e |
36,5e |
34,4d |
B + CaCl2 |
44,0e |
91,6a |
92,2ab |
100a |
71,6b |
61,5c |
54,4c |
63,8a |
48,2d |
33,0d |
64,6b |
56,0b |
Thiabendazole (T) |
20,4j |
32,5c |
93,4ab |
94,7ab |
3,9e |
36,5e |
38,6d |
10,0f |
38,4e |
31,2d |
24,6f |
24,7e |
T + CaCl2 |
55,6d |
37,8c |
100a |
100a |
7,6e |
45,4d |
54,0c |
20,4e |
68,6b |
44,0c |
36,0e |
38,2d |
Azoxystrobine (A) |
98,0a |
97,5a |
18,0d |
20,4d |
99,7a |
98,8a |
99,5a |
12,4f |
90,4ab |
96,3a |
89,9a |
96,4a |
A + CaCl2 |
89,4b |
93,0a |
28,3cd |
24,0d |
98,9a |
94,2a |
100a |
33,0d |
96,4a |
100a |
96,9a |
100a |
Pyriméthanil (P) |
70,0c |
35,0c |
30,5c |
30,6bc |
78,5b |
79,4b |
68,6b |
58,4a |
46,5d |
40,3c |
43,0d |
57,5b |
P + CaCl2 |
83,2bc |
36,9c |
34,4c |
86,0b |
90,2ab |
72,6bc |
64,0b |
56,9b |
66,2b |
54,0b |
63,2b |
58,0b |
|
Sporulation (spores mL-1)2 |
|||||||||||
Traitements |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
CaCl2 |
48,8e |
49,3d |
56,6e |
51,6d |
50,8c |
55,4c |
56,2c |
51,6c |
54,0c |
49,3d |
51,2e |
48,5d |
Bénomyl (B) |
41,4f |
48,0d |
94,4a |
96,2a |
31,0e |
24,2f |
18,4f |
26,0e |
32,5f |
26,4e |
33,6f |
30,3e |
B + CaCl2 |
56,0d |
61,0cd |
91,2a |
94,4ab |
50,6c |
43,9d |
45,0d |
37,0d |
53,2c |
63,0b |
64,2d |
66,0c |
Thiabendazole (T) |
11,6h |
25,6e |
90,6b |
98,0a |
10,9e |
31,0e |
29,2e |
12,4j |
38,4e |
24,4e |
34,6j |
32,3e |
T + CaCl2 |
55,9d |
83,0b |
94,3a |
100a |
44,6d |
24,9e |
54,7c |
36,6d |
26,0j |
54,2c |
63,9d |
66,8c |
Azoxystrobine (A) |
35,4j |
99,5a |
10,0j |
11,6f |
99,8a |
17,5j |
98,9a |
22,4f |
16,0h |
96,2a |
97,5a |
98,7a |
A + CaCl2 |
64,2c |
100a |
21,0f |
16,4e |
96,5a |
98,2a |
99,5a |
34,0c |
41,2d |
96,4a |
98,5a |
99,0a |
Pyriméthanil (P) |
80,0b |
68,5d |
69,2d |
70,0c |
76,6b |
94,2ab |
92,7b |
79,0b |
88,0b |
94,1a |
78,0c |
83,2b |
P + CaCl2 |
90,4a |
73,9c |
71,5c |
84,1b |
94,0a |
92,4b |
95,0a |
86,6a |
90,9a |
96,7a |
86,0b |
93,2ab |
Espèces de champignons : Rs : Rhizopus stolonifer, Pe : Penicillium expansum, An : Aspergillus niger, Af : Aspergillus fumigatus, Aa : Alternaria alternata, Ch : Cladosporium herbarum, Fox : Fusarium oxysporum, Sc : Saccharomyces cerevisiae, Mf : Monilia fructigena, Cm : Cryptosporiopsis malicorticis, Sp : Spilocaea pomi, Tr : Trichothecium roseum.
Sur une même colonne, deux résultats (moyenne des pourcentages d’inhibition) suivis de la même lettre ne différent pas significativement au seuil de 5 % (test Duncan’s Multiple Range).
Figure 2
Efficacité du bénomyl (A) et de l’association bénomyl–CaCl2 (B) sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation.
Pour une même température, les pourcentages d’inhibition ayant la même lettre ne diffèrent pas significativement au seuil de 5 %.
Figure 3
Efficacité du thiabendazole (A) et de l’association thiabendazole-CaCl2 (B) sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation.
Pour une même température, les pourcentages d’inhibition ayant la même lettre ne diffèrent pas significativement au seuil de 5 %.
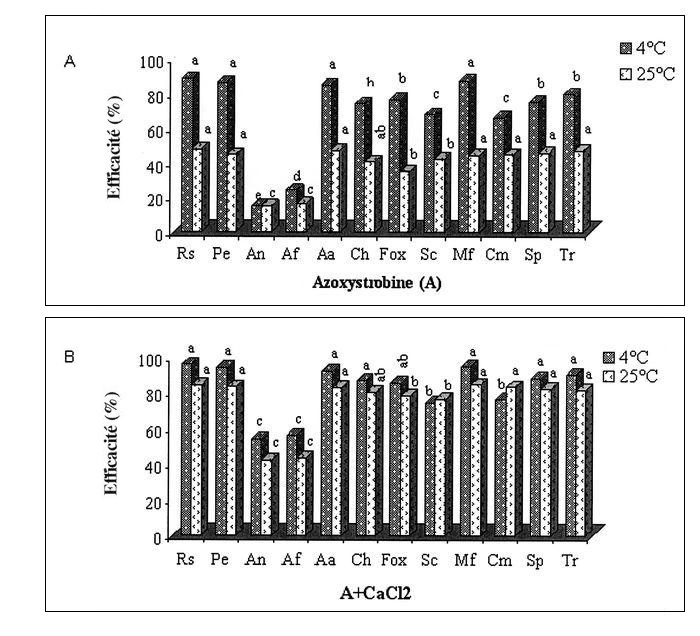
Figure 4
Efficacité de l’azoxystrobine (A) et de l’association azoxystrobine-CaCl2 (B) sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation.
Pour une même température, les pourcentages d’inhibition ayant la même lettre ne diffèrent pas significativement au seuil de 5 %.
Figure 5
Efficacité du pyriméthanil (A) et de l’association pyriméthanil–CaCl2 sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation.
Pour une même température, les pourcentages d’inhibition ayant la même lettre ne diffèrent pas significativement au seuil de 5 %.
Efficacité des fongicides et du CaCl2 sur la germination des spores
Comme pour la croissance mycélienne, l’efficacité du bénomyl et du thiabendazole sur la germination des spores (Tableau 2) est restée faible. En présence du CaCl2, l’efficacité de la majorité des fongicides évalués a augmenté d’une façon très importante vis-à-vis des espèces fongiques étudiées.
Efficacité des fongicides et du CaCl2 sur la sporulation
Les fongicides bénomyl et thiabendazole (Tableau 2) ont été dans l’ensemble faiblement efficaces sur la sporulation de toutes les espèces fongiques évaluées. En présence du CaCl2, l’efficacité de ces deux fongicides a augmenté envers la majorité des espèces de champignons.
En général, l’efficacité du bénomyl et du thiabendazole apparaît faible sur les trois stades de cycle de développement de toutes les espèces fongiques évaluées, à l’exception d’A. niger et d’A. fumigatus. Par contre, l’azoxystrobine est très efficace sur tous les champignons étudiés à l’exception d’A. niger et d’A. fumigatus alors que le pyriméthanil est très efficace sur toutes les espèces évaluées. En présence du CaCl2, l’efficacité de ces deux fongicides s’améliore, bien que pour certaines espèces aucune différence significative n’ait été notée.
Efficacité in vivo des associations fongicides–CaCl2
In vivo, tous les fongicides évalués ont été peu efficaces ou ont montré une efficacité variable à l’égard des espèces fongiques étudiées. Cette efficacité s’est améliorée en combinant le CaCl2 aux différents fongicides. Le taux d’inhibition a été plus important chez les pommes traitées, inoculées et conservées à 4 °C (efficacité variant de 56 à 98,3 %) comparativement à 25 °C, où l’efficacité a été très variable (entre 22 et 86 %) (Figs. 2, 3, 4 et 5).
Globalement, les résultats obtenus in vivo ont été approximativement comparables à ceux observés in vitro.
Discussion
Les résultats obtenus in vitro et in vivo montrent que les douze espèces de champignons étudiées (R. stolonifer, P. expansum, A. niger, A. fumigatus, A. alternata, C. herbarum, F. oxysporum, S. cerevisiae, M. fructigina, C. malicorticis, S. pomi et T. roseum) tolèrent le bénomyl et le thiabendazole (famille des benzimidazoles) utilisés aux doses homologuées. La résistance aux benzimidazoles a été signalée chez P. expansum affectant des pommes et des poires (Amiri et al. 2005; Errampalli et al. 2006; Francès et al. 2006; Maouni et al. 2002; Ramdani 1989; Wicks 1977) et chez Botrytis cinerea (Besri et Diatta 1985; Hmouni et al. 2003).
Nous avions précédemment noté la résistance d’A. niger et d’A. fumigatus à l’azoxystrobine (Attrassi et al. 2005), alors qu’un grand nombre d’espèces étaient sensibles à ce fongicide : R. stolonifer, P. expansum, A. alternata, C. herbarum, F. oxysporum, S. cerevisiae, M. fructigina, C. malicorticis, S. pomi et T. roseum. Par contre, le pyriméthanil a été efficace sur tous les champignons étudiés.
In vitro, le CaCl2 utilisé à 6 % est peu efficace vis-à-vis du complexe fongique rencontré au niveau des lésions des pommes. In vivo et à basse température, ce produit est efficace à partir de 4 %. Des résultats similaires ont été notés lors du traitement des espèces P. expansum et Alternaria spp., isolées des pommes et des poires, avec le CaCl2 (Biggs et al. 1993; Conway 1982; Maouni et al. 2001), ainsi que des A. alternata (deux isolats), T. roseum, T. harzianum, P. expansum et F. avenaceum, isolés des pommes (Selmaoui et Douira 2003), et du L. persoonii isolé des pêches (Biggs et al. 1994).
Dans ce sens, Conway et Sams (1984) ont rapporté que les ions Ca++ pourraient s’associer aux acides pectiques à des températures froides (4 °C), empêchant ainsi l’activité de l’enzyme fongique polygalacturonase. À des températures plus élevées (25 °C), le calcium serait insuffisant pour empêcher une telle activité enzymatique.
Les fongicides appartenant aux benzimidazoles (bénomyl et thiabendazole) agissent de façon systémique et ils ne possèdent qu’un seul site d’action. Ce sont des agents anti-mitotiques qui interfèrent spécifiquement avec la division nucléaire et avec d’autres processus liés à l’activité des microtubules et principalement avec la tubuline (protéine dont l’assemblage forme les microtubules) (Davidse et Flach 1978; Leroux 1993). Les microtubules sont des constituants majeurs du cytosquelette et du fuseau achromatique et toute substance susceptible d’interférer avec la formation ou le fonctionnement de ces microtubules bloque les divisions cellulaires et l’élongation des hyphes mycéliens (Paternelle et Lhoutellier 2002; Leroux 2003). Les fongicides benzimidazoles se fixent sur la β-tubuline de nombreux Ascomycota et Basidiomycota, mais leur interaction est faible avec celle des Oomycota (Leroux 2003).
L’usage agricole des benzimidazoles s’est trouvé fortement affecté par l’apparition de souches résistantes chez de nombreux champignons phytopathogènes (Brooks et Roberts 1999; Leroux 2003). Cette résistance acquise est liée à une moindre affinité de ces fongicides pour la β-tubuline et résulte de mutations dans les codons 198 ou 200 (Leroux 2003; Paternelle et Lhoutellier 2002). Ainsi, en position 198, chez les souches sensibles, le triplet GAG code pour un glutamate, alors que chez les résistantes, il y a notamment les triplets GCG et GGG, qui codent respectivement pour l’alanine et la glycine. En position 200, les β-tubulines des souches sensibles et résistantes comportent respectivement une phénylalanine (codon TTC) et une tyrosine (codon TAC) (Leroux 2003), ce qui peut en partie expliquer la sélectivité des benzimidazoles (Brooks et Roberts 1999; Lyr 1995; Paternelle et Lhoutellier 2002).
Le fongicide azoxystrobine agit sur la chaîne respiratoire. Chez les champignons, comme chez tous les Eucaryotes, les processus respiratoires correspondant au catabolisme oxydatif de molécules organiques sont la source d’énergie disponible sous forme d’ATP. Il se forme également des transporteurs d’électrons réduits, notamment le NADH et des métabolites essentiels comme l’acétate (Brooks et Roberts 1999; Leroux 2003; Paternelle et Lhoutellier 2002). Les mitochondries sont le siège de la plupart des oxydations cellulaires et renferment notamment une série de transporteurs d’électrons ainsi que l’ATP synthétase (Brooks et Roberts 1999; Leroux 2003). Plus d’un tiers des fongicides affectent ces derniers processus et, de ce fait, peuvent par exemple inhiber la germination des spores des champignons et aussi immobiliser les zoospores des Oomycota (Leroux 2003). Les strobilurines sont actives sur de nombreux Ascomycota, Basidiomycota et Oomycota, rencontrés notamment chez le blé, l’orge, le riz, la vigne et le pommier (Bahous et al. 2005; Brooks et Roberts 1999; Gullino et al. 2000; Knight et al. 1997). Il a été montré que, dans la plupart des cas, ce phénomène résulte d’une mutation ponctuelle au niveau du codon 143 du gène du cytochrome b. Les triplets GGT et GGA, qui codent pour une glycine chez les souches sensibles, sont remplacés par les triplets GCT ou GCA, qui codent pour une alanine chez les souches résistantes (Brooks et Roberts 1999; Leroux 2003; Paternelle et Lhoutellier 2002).
Le fongicide pyriméthanil, dont le mode d’action n’a pas été encore totalement élucidé, interfère au niveau des acides aminés et principalement lors de la biosynthèse de la méthionine. Il bloque alors la transformation des cystathionines en homocystéine puis en méthionine par l’enzyme cystathionine β lyase (Leroux 1993).
Les fongicides constituent un des moyens de lutte contre les champignons phytopathogènes et doivent contribuer, au même titre que les méthodes prophylactiques, les moyens biologiques ou les variétés résistantes, à une protection intégrée des cultures. Pour que la lutte chimique puisse continuer à jouer un rôle de premier ordre, il faudra développer de nouvelles matières actives utilisables à faible dose, agissant de façon curative, possédant une bonne persistance d’action, peu exposées à la résistance et ne présentant pas de risques pour le manipulateur, le consommateur et l’environnement. Des progrès doivent également être réalisés pour optimiser l’efficacité des traitements au champ et augmenter la disponibilité des matières actives (Brooks et Roberts 1999).
Pour lutter contre la pourriture des pommes en conservation, la stratégie d’association fongicides–CaCl2 donne des résultats très satisfaisants. L’association benzimidazoles–CaCl2 semble très efficace in vitro et in vivo vis-à-vis du complexe fongique étudié. Des résultats satisfaisants ont aussi été observés avec d’autres fongicides associés au CaCl2 (Biggs et al. 1993). Ainsi, l’augmentation de l’efficacité des fongicides benzimidazoles, azoxystrobine et pyriméthanil, en présence du CaCl2 pourrait s’expliquer par le fait que le CaCl2 est un sel. Il semble que les sels de calcium (chlorure de calcium) interviennent en renforçant les liens avec les principaux sites d’action des fongicides chez l’agent pathogène étudié.
Appendices
Références
- Amiri, A., D. Cholodowski et G. Bompeix. 2005. Adhesion and germination of waterborne and airborne conidia of Penicillium expansum to apple and inert surfaces. Physiol. Mol. Plant Pathol. 67 : 40–48.
- Attrassi, K., K. Selmaoui, A. Ouazzani Touhami, A. Badoc et A. Douira. 2005. Biologie et physiologie des principaux agents fongiques de la pourriture des pommes en conservation et lutte chimique par l’azoxystrobine. Bull. Soc. Pharm. Bordeaux 144 : 47-62.
- Bahous, M., A. Ouazzani Touhami, A. Badoc et A. Douira. 2005. Effet de l’azoxystrobine sur la pyriculariose, l’helminthosporiose et la curvulariose du riz. Bull. Soc. Pharm. Bordeaux 144 : 27-46.
- Besri, M. et F. Diatta. 1985. Résistance de Botrytis cinerea, agent de la pourriture grise de la tomate aux benzimidazoles, dicarboximides et sulfamides. Bull. OEPP 15 : 379-386.
- Biggs, A.R. et C.A. Peterson. 1990. Effect of chemical applications to peach bark wounds on accumulation of lignin and suberin and susceptibility to Leucostoma persoonii. Phytopathology 80 : 861-865.
- Biggs, A.R., M. Ingle et W.D. Solihati. 1993. Control of Alternaria infection of fruit of apple cultivar Nittany with calcium chloride and fungicides. Plant Dis. 77 : 976- 980.
- Biggs, A.R., M.M. El-Kholi et S.M. El-Neshawy. 1994. Effect of calcium salts on growth, pectic enzyme activity, and colonization of peach twigs by Leucostoma persoonii. Plant Dis. 78 : 886-890.
- Brooks, G.T. et T.R. Roberts. 1999. Pesticides chemistry and bioscience, the food environment challenge. R. Soc. Chem., Cambridge, UK. 438 p.
- Conway, W.S. 1982. Effect of post-harvest calcium treatment on decay of Delicious apples. Plant Dis. 66 : 402-403.
- Conway, W.S. et C.E. Sams. 1984. Possible mechanisms by which postharvest calcium treatment reduces decay in apples. Phytopathology 74 : 208-210.
- Davidse, L.C. et W. Flach. 1978. Interaction of thiabendazole with fungal rungal tubulin. Biochim. Biophys. Acta 543(1) : 82-90.
- DeLong, W.A. 1937. Calcium and boron contents of the apple fruit as related to the incidence of Blotchy cork. Plant Physiol. 12 : 552-556.
- Errampalli, D., N. Brubacer et J.R. DeEll. 2006. Sensitivity of Penicillium expansum to diphenylamine and thiabendazole and post-harvest control of blue mold with fludioxonil in ‘McIntosh’ apples. Post-harvest Biol. Technol. 39 : 101-107.
- Francès, J., A. Bonaterra, M.C. Moreno, J. Cabrefiga, E. Badosa et E. Montesinos. 2006. Pathogen aggressiveness and postharvest biocontrol efficiency in Pantoea agglomerans. Postharvest Biol. Technol. 39 : 299–307.
- Garman, P. et W.T. Mathis. 1956. Studies of mineral balance as related to occurrence of Baldwin spot in Connecticut. Bull. Conn. Agric. Exp. Stn. 601 : 1-19.
- Gullino, M.L., P. Leroux et C.M. Smith. 2000. Uses and challenge of novel compounds for plant disease control. Crop Prot. 19 : 1-11.
- Hmouni, A., L. Oihabi, A. Badoc et A. Douira. 2003. Étude de la résistance de Botrytis cinerea aux benzimidazoles, dicarboximides et dithiocarbamates dans les cultures abritées de tomate de la région du Gharb (Maroc). Bull. Soc. Pharm. Bordeaux 142 : 79-100.
- Knight, S.C., V.M. Anthony, A.M. Brady, A.J. Greenland, S.P. Heaney, D.C. Murray, K.A. Powell, M.A. Schultz, C.A. Spoinks, P.A. Worthington et D. Youle. 1997. Rational and perspectives on the development of fungicides, Annu. Rev. Phytopathol. 35 : 349-372.
- Leroux, P. 1993. Prévoir, une résistance peut en cacher une autre. Perspect. Agric. 185 : 95-98.
- Leroux, P. 2003. Modes d’action des produits phytosanitaires sur les organismes pathogènes des plantes. Biol. Pathol. Vég. 326 : 9-21.
- Lyr, H. 1995. Modern selective fungicides. 2nd ed. Gustav Ficher Verlag, Jena, Germany. 595 p.
- Maouni, A., A. Lamarti, A. Douira et A. Badoc. 2001. Effet de dérivés calciques sur le développement de moisissures lors de la conservation des poires. Bull. Soc. Pharm. Bordeaux 140 : 71-80.
- Maouni, A., A. Lamarti, A. Douira et A. Badoc. 2002. Étude de la résistance d’Alternaria alternata et Penicillium expansum aux fongicides lors de la conservation des poires. Bull. Soc. Pharm. Bordeaux 141 : 61-72.
- Paternelle, M.C. et C. Lhoutellier. 2002. Index phytosanitaire ACT. Association de coordination technique agricole, Paris, France. 788 p.
- Prusky, D. 1985. Development, persistence, survival, and strategies for control of thiabendazole-resistant strains of Penicillium expansum on pome fruits. Phytopathology 75 : 877-882.
- Ramdani, A. 1989. Les pourritures à Penicillium expansum Link ex. Thom des pommes et des poires dans une station frigorifique de la région de Meknès : Problèmes et remèdes. Mémoire de 3e cycle en Agronomie, option phytopathologie. I.A.V. Hassan II. 112 p.
- Rosenberger, D.A. et F.W. Meyer. 1979. Benomyl-tolerant Penicillium expansum in apple packinghouses in eastern New York. Plant Dis. Rep. 63 : 37-40.
- Selmaoui, K. 1999. Étude d’un complexe fongique responsable de la pourriture des pommes en conservation. Application de quelques moyens de lutte chimique. Thèse de doctorat en phytopathologie. Faculté des Sciences de Kénitra, Maroc. 175 p.
- Selmaoui, K. et A. Douira. 2003. Effet in vitro des sels de calcium sur le développement et la colonisation des pommes en conservation par un complexe fongique. Al Awamia 109-110 : 159-174.
- Selmaoui, K., A. Boubaker et A. Douira. 1997. Effet in vitro et in vivo de quelques fongicides sur le développement de la pourriture des pommes en conservation due à Alternaria alternata tenuis Nees. Al Awamia 96 : 9-19.
- Wicks, T. 1977. Tolerance to benzimidazole fungicides in blue mold (Penicillium expansum) on pears. Plant Dis. Rep. 61 : 447-449.
List of figures
Figure 1
Efficacité du CaCl2 sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation; 1A : CaCl2 2%, 1B : 4% et 1C : 6%.
Espèces de champignons : Rs : Rhizopus stolonifer, Pe : Penicillium expansum, An : Aspergillus niger, Af : Aspergillus fumigatus, Aa : Alternaria alternata, Ch : Cladosporium herbarum, Fox : Fusarium oxysporum, Sc : Saccharomyces cerevisiae, Mf : Monilia fructigena, Cm : Cryptosporiopsis malicorticis, Sp : Spilocaea pomi, Tr : Trichothecium roseum.
Pour une même température, les pourcentages d’inhibition ayant la même lettre ne diffèrent pas significativement au seuil de 5 %.
Figure 2
Efficacité du bénomyl (A) et de l’association bénomyl–CaCl2 (B) sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation.
Figure 3
Efficacité du thiabendazole (A) et de l’association thiabendazole-CaCl2 (B) sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation.
Figure 4
Efficacité de l’azoxystrobine (A) et de l’association azoxystrobine-CaCl2 (B) sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation.
Figure 5
Efficacité du pyriméthanil (A) et de l’association pyriméthanil–CaCl2 sur le développement de pourriture causée par 12 espèces fongiques sur des pommes en conservation.
List of tables
Tableau 1
Efficacité in vitro du CaCl2 sur le développement des trois stades du cycle de vie de 12 espèces de champignons responsables de la pourriture des pommes en conservation
|
Champignons étudiés1 |
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Croissance mycélienne (mm)2 |
|||||||||||
CaCl2 |
|
|||||||||||
% |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
2 |
15,3b |
12,8b |
10,3b |
11,5b |
10,8b |
9,7b |
9,8b |
8,5b |
10,0c |
12,6b |
10,5b |
13,8b |
4 |
50,0a |
48,0a |
50,6a |
46,9a |
54,0a |
46,2a |
47,7a |
45,6a |
50,4a |
45,0a |
46,8a |
46,5a |
6 |
48,6a |
48,5a |
47,9a |
45,3a |
43,0b |
44,5a |
48,6a |
43,2a |
42,8b |
46,3a |
45,5a |
48,0a |
|
Germination conidienne (%)2 |
|||||||||||
CaCl2 |
|
|||||||||||
% |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
2 |
20,3c |
20,4c |
19,7c |
16,8c |
12,6c |
18,5c |
13,4c |
12,4c |
17,6c |
15,4c |
14,6c |
18,8c |
4 |
50,5a |
52,5a |
55,6a |
51,0a |
50,6a |
58,8a |
56,3a |
50,0a |
52,2a |
56,3a |
54,6a |
49,0a |
6 |
46,6b |
42,5b |
45,9b |
44,8b |
38,8b |
43,3b |
40,6b |
38,4b |
38,5b |
44,3b |
42,6b |
45,4b |
|
Sporulation (spores mL-1)2 |
|||||||||||
CaCl2 |
|
|||||||||||
% |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
2 |
30,8c |
30,5c |
28,4c |
29,5c |
25,5c |
25,8c |
26,4c |
24,3c |
27,7c |
28,3c |
27,0c |
28,5c |
4 |
50,0b |
50,0b |
58,1b |
50,0b |
52,3b |
52,6b |
58,1b |
50,0b |
52,1b |
51,0b |
53,0b |
46,3b |
6 |
70,3a |
68,3a |
69,5a |
53,8a |
46,9a |
52,5a |
63,3a |
64,6a |
65,5a |
68,8a |
65,5a |
70,2a |
Espèces de champignons : Rs : Rhizopus stolonifer, Pe : Penicillium expansum, An : Aspergillus niger, Af : Aspergillus fumigatus, Aa : Alternaria alternata, Ch : Cladosporium herbarum, Fox : Fusarium oxysporum, Sc : Saccharomyces cerevisiae, Mf : Monilia fructigena, Cm : Cryptosporiopsis malicorticis, Sp : Spilocaea pomi, Tr : Trichothecium roseum.
Sur une même colonne, deux résultats (moyenne des pourcentages d’inhibition) suivis de la même lettre ne différent pas significativement au seuil de 5 % (test Duncan’s Multiple Range).
Tableau 2
Efficacité in vitro du CaCl2 (4 %) associé avec le bénomyl, le thiabendazole, l’azoxystrobine et le pryriméthanil sur les trois étapes du cycle de vie des champignons responsables de la pourriture des pommes
|
Champignons1 |
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Croissance mycélienne (mm)2 |
|||||||||||
Traitements |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
CaCl2 |
48,5d |
49,0e |
52,4c |
49,5d |
56,6c |
46,4b |
48,2d |
46,4c |
50,8d |
47,6d |
47,5d |
49,4b |
Bénomyl (B) |
35,4e |
32,0f |
98,5a |
86,3b |
21,6f |
26,3d |
19,4f |
18,3e |
28,2e |
23,5f |
30,4e |
27,7c |
B + CaCl2 |
60,0c |
55,6d |
100a |
96,5a |
20,0e |
36,2c |
28,8e |
30,5d |
32,4e |
36,0e |
40,5d |
44,3b |
Thiabendazole (T) |
12,6f |
69,6c |
90,4b |
98,4a |
30,4d |
26,6d |
32,0e |
20,5e |
60,8c |
31,0e |
31,4e |
36,2d |
T + CaCl2 |
55,0c |
75,0b |
93,9b |
94,2a |
35,6d |
36,4c |
44,5d |
32,6d |
26,0d |
64,5c |
51,4c |
45,0b |
Azoxystrobine (A) |
95,6a |
98,4a |
12,6e |
20,2e |
98,5a |
98,6a |
97,4a |
21,3e |
97,8a |
98,5a |
99,0ab |
96,0ab |
A + CaCl2 |
96,0a |
100a |
20,4d |
36,5c |
98,9a |
100a |
100a |
44,5c |
96,4a |
100a |
98,0a |
95,5a |
Pyriméthanil (P) |
83,5b |
82,0b |
92,0b |
91,0a |
56,0c |
96,5a |
56,4c |
82,6b |
83,2b |
86,0b |
97,0ab |
93,2ab |
P + CaCl2 |
84,6b |
80,0b |
96,5a |
92,0a |
64,3b |
94,6a |
64,0b |
91,9a |
95,5a |
94,8a |
100a |
99,5a |
|
Germination des spores (%)2 |
|||||||||||
Traitements |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
CaCl2 |
52,4d |
52,6b |
53,4b |
54,5c |
50,5c |
57,6c |
56,2c |
50,4c |
52,6c |
57,5b |
53,8c |
48,0c |
Bénomyl (B) |
36,6f |
32,6c |
96,2a |
99,6a |
35,0d |
24,0f |
20,6e |
24,2e |
25,5f |
22,6e |
36,5e |
34,4d |
B + CaCl2 |
44,0e |
91,6a |
92,2ab |
100a |
71,6b |
61,5c |
54,4c |
63,8a |
48,2d |
33,0d |
64,6b |
56,0b |
Thiabendazole (T) |
20,4j |
32,5c |
93,4ab |
94,7ab |
3,9e |
36,5e |
38,6d |
10,0f |
38,4e |
31,2d |
24,6f |
24,7e |
T + CaCl2 |
55,6d |
37,8c |
100a |
100a |
7,6e |
45,4d |
54,0c |
20,4e |
68,6b |
44,0c |
36,0e |
38,2d |
Azoxystrobine (A) |
98,0a |
97,5a |
18,0d |
20,4d |
99,7a |
98,8a |
99,5a |
12,4f |
90,4ab |
96,3a |
89,9a |
96,4a |
A + CaCl2 |
89,4b |
93,0a |
28,3cd |
24,0d |
98,9a |
94,2a |
100a |
33,0d |
96,4a |
100a |
96,9a |
100a |
Pyriméthanil (P) |
70,0c |
35,0c |
30,5c |
30,6bc |
78,5b |
79,4b |
68,6b |
58,4a |
46,5d |
40,3c |
43,0d |
57,5b |
P + CaCl2 |
83,2bc |
36,9c |
34,4c |
86,0b |
90,2ab |
72,6bc |
64,0b |
56,9b |
66,2b |
54,0b |
63,2b |
58,0b |
|
Sporulation (spores mL-1)2 |
|||||||||||
Traitements |
Rs |
Pe |
An |
Af |
Aa |
Ch |
Fox |
Sc |
Mf |
Cm |
Sp |
Tr |
CaCl2 |
48,8e |
49,3d |
56,6e |
51,6d |
50,8c |
55,4c |
56,2c |
51,6c |
54,0c |
49,3d |
51,2e |
48,5d |
Bénomyl (B) |
41,4f |
48,0d |
94,4a |
96,2a |
31,0e |
24,2f |
18,4f |
26,0e |
32,5f |
26,4e |
33,6f |
30,3e |
B + CaCl2 |
56,0d |
61,0cd |
91,2a |
94,4ab |
50,6c |
43,9d |
45,0d |
37,0d |
53,2c |
63,0b |
64,2d |
66,0c |
Thiabendazole (T) |
11,6h |
25,6e |
90,6b |
98,0a |
10,9e |
31,0e |
29,2e |
12,4j |
38,4e |
24,4e |
34,6j |
32,3e |
T + CaCl2 |
55,9d |
83,0b |
94,3a |
100a |
44,6d |
24,9e |
54,7c |
36,6d |
26,0j |
54,2c |
63,9d |
66,8c |
Azoxystrobine (A) |
35,4j |
99,5a |
10,0j |
11,6f |
99,8a |
17,5j |
98,9a |
22,4f |
16,0h |
96,2a |
97,5a |
98,7a |
A + CaCl2 |
64,2c |
100a |
21,0f |
16,4e |
96,5a |
98,2a |
99,5a |
34,0c |
41,2d |
96,4a |
98,5a |
99,0a |
Pyriméthanil (P) |
80,0b |
68,5d |
69,2d |
70,0c |
76,6b |
94,2ab |
92,7b |
79,0b |
88,0b |
94,1a |
78,0c |
83,2b |
P + CaCl2 |
90,4a |
73,9c |
71,5c |
84,1b |
94,0a |
92,4b |
95,0a |
86,6a |
90,9a |
96,7a |
86,0b |
93,2ab |
Espèces de champignons : Rs : Rhizopus stolonifer, Pe : Penicillium expansum, An : Aspergillus niger, Af : Aspergillus fumigatus, Aa : Alternaria alternata, Ch : Cladosporium herbarum, Fox : Fusarium oxysporum, Sc : Saccharomyces cerevisiae, Mf : Monilia fructigena, Cm : Cryptosporiopsis malicorticis, Sp : Spilocaea pomi, Tr : Trichothecium roseum.
Sur une même colonne, deux résultats (moyenne des pourcentages d’inhibition) suivis de la même lettre ne différent pas significativement au seuil de 5 % (test Duncan’s Multiple Range).