Abstracts
Résumé
L’ajustement osmotique, les pigments photosynthétiques et les changements d’activités des antioxydants enzymatiques ont été évalués chez dix génotypes de blé dur (Triticum durum) soumis à des conditions de stress hydrique. Les plantules de blé ont germé en hydroponie, en chambre de culture. Le stress hydrique a été appliqué aux quatrième et cinquième stades de la feuille par l’ajout d’une solution de polyéthylène glycol (PEG 6000) (-0,49 MPa). Le potentiel osmotique ainsi que la teneur en chlorophylle totale (Chl a+b) et en caroténoïdes (Car) ont été déterminés. Des analyses électrophorétiques ont été effectuées pour trois enzymes antioxydantes, soit la superoxyde dismutase (SOD), la guaïacol peroxydase (GPOX) et la catalase (CAT), en utilisant l’électrophorèse sur gel de polyacrylamide (PAGE) en conditions natives. Les résultats obtenus montrent une réduction du potentiel osmotique foliaire et une diminution de Chl a+b et Car sous l’effet du stress hydrique. Toutefois, il existe des différences significatives entre les génotypes étudiés en réponse au traitement imposé. PAGE a permis de montrer une augmentation dans l’intensité des enzymes étudiées et une apparition d’isoformes supplémentaires, dont une de CAT et trois de SOD, en conditions de stress. Ces différences dans les réponses au stress hydrique pourraient être des indices utiles et fiables pour la sélection de génotypes tolérants de blé dur.
Mots-clés :
- accumulation d’osmolytes,
- chlorophylles,
- déficit hydrique,
- isozymes,
- peroxydation lipidique,
- stress oxydatif
Abstract
Osmotic adjustment, photosynthetic pigments and changes in antioxidant enzyme activities were evaluated in ten durum wheat (Triticum durum) genotypes under water stress conditions. The wheat seedlings germinated in hydroponic conditions in a growth chamber. Water deficit was performed at the fourth and fifth leaf stages using a polyethylene glycol (PEG 6000) solution (-0.49 MPa). Osmotic potential as well as total chlorophyll (Chl a+b) and carotenoid (Car) contents were investigated. Electrophoretic analyses were performed for three antioxidant enzymes: superoxide dismutase (SOD), guaiacol peroxidase (GPOX) and catalase (CAT) using native polyacrylamide gel electrophoresis (PAGE). The results obtained show a reduction in leaf osmotic potential and a decrease in Chl a+b and Car contents under water stress conditions. However, there are significant differences between the genotypes studied in their response to the treatment. PAGE showed an increased intensity in the enzymes studied and the appearance of additional isoforms, including one CAT and three SOD, under stress conditions. These differences in water stress response could be useful and reliable indices for the selection of tolerant durum wheat genotypes.
Keywords:
- chlorophylls,
- isozymes,
- lipid peroxidation,
- osmolyte accumulation,
- oxidative stress,
- water deficit
Article body
Introduction
Parmi les contraintes abiotiques, la sécheresse est l’un des principaux facteurs de stress qui prévaut sur les hauts plateaux de l’Est algérien, caractérisés par un climat de type méditerranéen, où le blé dur (Triticum durum) est généralement cultivé. Ces régions se caractérisent par des précipitations variables allant de 250 à 500 mm, dont 70 % sont enregistrées pendant la saison froide d’octobre à février (Chennafi et al. 2006). Le manque de précipitations au cours du cycle de la plante combiné à la succession des années de sécheresse ont entraîné la raréfaction des ressources hydriques dans ces régions. Cette sècheresse est responsable d’une grande partie des pertes de productivité dues à la diminution de la photosynthèse, à la sénescence accélérée des feuilles et à la réduction de la durée de remplissage des grains (Belkharchouche et al. 2015; Bouchemal et al. 2017).
Par conséquent, il est extrêmement important de connaître les indicateurs de base qui peuvent caractériser la tolérance des plantes face au stress hydrique. L’ajustement osmotique en matière d’accumulation de solutés compatibles est considéré comme une réponse d’adaptation physiologique importante pour les plantes résistantes à la sécheresse (Morgan 1984). Ces solutés de faible poids moléculaire (proline, glycine bétaïne et sucres solubles) facilitent l’extraction de l’eau des sols secs et le maintien de la turgescence cellulaire, ainsi que les échanges gazeux et la croissance dans des environnements très secs (HongBo et al. 2006). L’ajustement osmotique permet également une protection des membranes et des systèmes enzymatiques (Santarius 1973). Un autre paramètre physiologique indicateur, relatif à l’état de santé de la plante, est la teneur en pigments photosynthétiques (Shah et al. 2011). Le stress hydrique entrave considérablement le processus de la photosynthèse en altérant l’ultrastructure des organites et la concentration des divers pigments et métabolites impliqués dans ce processus (Batra et al. 2014); il entraîne également une forte baisse de la teneur en chlorophylle a (Chl a), en chlorophylle b (Chl b) et en chlorophylle totale (Chl a+b). Cette diminution est due principalement aux dommages causés aux chloroplastes par les espèces réactives d’oxygène (ROS). En effet, le stress hydrique conduit généralement à un stress oxydatif dû à la fermeture des stomates (Ozkur et al. 2009), ce qui entraîne une réduction excessive de la chaîne d’électrons photosynthétiques et la formation accrue des ROS dans les chloroplastes et les mitochondries (Asada 1999). Les ROS générées par le stress hydrique, telles que l’ion superoxyde, le peroxyde d’hydrogène et le radical hydroxyle, sont hautement réactives et peuvent perturber le métabolisme de la plante par la peroxydation des lipides, des protéines et des acides nucléiques (Ashraf 2009). Pour contrer les dommages causés par le stress oxydatif, les plantes ont développé des mécanismes de protection, comme la synthèse de pigments protecteurs tels que les caroténoïdes (Car) (Efeoğlu et al. 2009), et l’accumulation d’enzymes antioxydantes telles que les superoxides dismutases (SOD), les guaïacols peroxydases (GPOX) et les catalases (CAT) (Reddy et al. 2004). Les Car, comme le ß-carotène et les xanthophylles, sont des antioxydants non enzymatiques qui interagissent avec les ROS, notamment l’oxygène singulet (1O2), et peuvent ainsi empêcher l’oxydation de plusieurs substrats biologiques, dont les acides gras polyinsaturés des systèmes membranaires, et stabiliser les complexes photosynthétiques (Adams et al. 1999; Liu et al. 2011). Les SOD jouent un rôle important dans la tolérance au stress oxydatif. Elles constituent une première ligne de défense contre les effets toxiques des niveaux élevés de ROS en convertissant le radical O2.– en H2O2 (Gill et Tuteja 2010). Les CAT catalysent la dismutation du peroxyde d’oxygène (H2O2) en eau et en oxygène, tandis que les GPOX décomposent l’H2O2 par l’oxydation de co-substrats tels que les composés phénoliques ou les antioxydants (Blokhina et al. 2003). Ce travail consiste à étudier les effets de la réduction des apports en eau sur dix génotypes de blé dur par l’analyse du potentiel osmotique, des pigments photosynthétiques et de l’activité des enzymes antioxydantes.
Matériel et méthodes
Matériel végétal
Le blé dur (Triticum durum Desf.), appartenant à la famille des poacées, a été choisi en raison de son utilisation en laboratoire. En effet, il fait l’objet de plusieurs recherches, notamment en ce qui concerne l’impact des stress environnementaux ou encore l’amélioration variétale. Les variétés étudiées ont été choisies de manière à avoir un ensemble de cultivars ayant des différences importantes concernant leurs caractéristiques agronomiques de productivité et de tolérance. Les graines des écotypes étudiés, d’origine locale et introduite, ont été obtenues auprès de l’Institut technique des grandes cultures (ITGC) de Constantine (Tableau 1). L’étude a été menée au Laboratoire de génétique, biochimie et biotechnologies végétales, à l’Université des Frères Mentouri Constantine, dans la ville de Constantine, en Algérie.
Méthodes
Conditions de culture
Des graines de blé dur conservées à 4 °C et dans l’obscurité ont été triées puis mises à hydrater pendant une nuit à température ambiante. Elles ont ensuite été stérilisées dans une solution d’hypochlorite de calcium à 1 % pendant 10 min, puis rincées plusieurs fois à l’eau déminéralisée et enfin déposées sur du papier Whatman humide dans des boîtes de Pétri. Ces dernières ont été placées dans une chambre de culture à l’obscurité et à une température de 25 °C. Quand les premières racines ont atteint une longueur de 2-3 cm, les plantules ont été repiquées sur le milieu nutritif hydroponique de Broughton et Dilworth (1971) (milieu BD) enrichi en macro- et oligoéléments. La culture s’est déroulée en salle climatisée sous conditions contrôlées : une luminosité de 16 h de lumière/8 h d’obscurité avec un rayonnement efficace de 150 µmol m-2 s-1, une température de 23 ± 0,5 °C et une humidité relative de 65 ± 5 %.
Tableau 1
Liste des dix génotypes étudiés définis par leur pédigrée, leur origine, leur comportement vis-à-vis de la sècheresse et leur acronyme
Application du stress et échantillonnage
Après un mois de culture, les plantules de blé dur ont été traitées avec une solution de polyéthylène glycol (PEG 6000) à 20 %, correspondant à un potentiel osmotique de -0,49 MPa. Le traitement consistait en l’ajout de 5 mL de PEG à la solution nutritive à toutes les 72 h. Dans le cas du contrôle, le milieu BD était renouvelé sans ajout de PEG (0 MPa). La concentration de PEG et la durée du traitement ont été déterminées à la suite de plusieurs essais préliminaires. Trois réplicats de deux plantules ont été réalisés pour chaque traitement, chacune étant placée dans un pot contenant 0,5 L du milieu. Après 10 j d’application de PEG 6000, un échantillonnage a été effectué sur les feuilles des plantes témoins et des plantes stressées, puis elles ont été réparties en trois lots pour la suite des expérimentations.
Le premier lot était destiné à l’étude du taux de chl a, de chl b et des Car; les feuilles de blé dur ont été pesées immédiatement après la récolte (~0,5 g) à raison d’une feuille par plantule, puis placées dans des tubes à essai contenant de l’acétone (85 %). Les feuilles du deuxième lot étaient placées dans des tubes Eppendorf de 1,5 mL à raison d’une feuille par plantule, puis congelées à -20 °C pour l’étude du potentiel osmotique. Enfin, le dernier lot était destiné à l’analyse électrophorétique des isoenzymes antioxydantes. Les feuilles récoltées (une feuille de chacune des deux plantules) ont été pesées immédiatement, puis placées dans des tubes Eppendorf de 2 mL et plongées directement dans l’azote liquide. Les échantillons ont ensuite été congelés à -80 °C jusqu’à leur utilisation.
Mesure du potentiel osmotique
Le potentiel osmotique a été déterminé selon le protocole décrit par Levy et al. (2006). Les échantillons de feuilles des plantes témoins et des plantes stressées ont été placés dans des tubes Eppendorf, puis congelés à -20 °C pendant une nuit. Après décongélation, les feuilles ont été écrasées avec un piston Pellet Eppendorf. L’osmolalité de l’extrait a ensuite été mesurée à l’aide d’un osmomètre à tension de vapeur (VAPRO® modèle 5600). Le solvant de l’échantillon étant l’eau, l’osmolalité mesurée était égale à l’osmolarité de l’échantillon. Le potentiel osmotique (méga pascals) a été déterminé en se basant sur la formule de Van’t Hoff :
Mesure du taux des chlorophylles et des caroténoïdes
L’extraction des pigments a été faite selon la méthode d’Arnon (1949). Les échantillons de feuilles (0,5 g) ont été broyés dans 10 mL d’acétone à 85 %. Les débris cellulaires ont ensuite été éliminés après une centrifugation de 3000 rpm pendant 10 min et le surnageant a été récupéré. L’absorbance des échantillons a été déterminée à 645, 663 et 470 nm au spectrophotomètre UV-visible, modèle BioMate 3. Les teneurs en pigments ont été calculées en µg.mL-1 selon les équations suivantes (Lichtenthaler et Wellburn 1983) :
Électrophorèse monodimensionnelle en conditions natives (PAGE)
L’extraction des CAT a été réalisée selon le protocole décrit par Pérez et Lira (2005). Les feuilles de blé dur (~500 mg) ont été broyées dans l’azote liquide jusqu’à l’obtention d’une poudre fine, qui a été récupérée dans des tubes Eppendorf de 2 mL. Un tampon d’extraction (1 mL) [Tris-HCl 0,5 M (pH 7,5), DTT 5 mM, MgCl2 1 mM, PMSF 10 µM PVP insoluble 2 % et glycérol 12,5 %] a été ajouté au matériel végétal broyé. L’ensemble a ensuite été vortexé, puis centrifugé (15 min, 13 000 g, 4 °C). Le culot obtenu a été resuspendu dans le même tampon + Triton-X 100 à 2 %. Après une incubation de 15 min à 30 °C, l’homogénat a été centrifugé une deuxième fois (15 min, 13 000 g, 4 °C). Le surnageant a ensuite été récupéré et placé dans de nouveaux tubes conservés à 4 °C. L’extraction des GPOX et des SOD a été réalisée d’après une méthode adaptée de Valizadeh et al. (2011) citée par Naderi et al. (2014). Un tampon d’extraction (1 mL) [Tris-HCl 50 mM (pH 7,5), saccharose 5 %, acide ascorbique 50 mM, métabisulfite de sodium 20 mM, PEG 6000 (2 %) et 2-mercaptoethanol 0,1 %] a été ajouté dans des tubes de 2 mL contenant 500 mg de matériel végétal frais broyé. L’ensemble a ensuite été vortexé, puis centrifugé (10 min, 12 000 g, 4 °C). Le surnageant obtenu a été transféré dans de nouveaux tubes conservés à 4 °C. Les extraits enzymatiques obtenus ont été utilisés directement pour l’analyse en PAGE.
Les différents extraits enzymatiques ont été soumis à PAGE selon le système de Laemmli (1970), sans ajout de SDS. Les isoformes de CAT ont été séparées sur un gel non dénaturant de 7 % suivant le protocole de Pérez et Lira (2005) avec quelques modifications. Les isoenzymes de SOD et de GPOX ont été séparées sur un gel non dénaturant de 10 % et de 7,5 %, respectivement, selon la méthode décrite par Naderi et al. (2014). Le gel a été préparé avec le tampon de Poulik (1957) cité par Wendel et Weeden (1989). Dans chaque échantillon à analyser, 3 µL du tampon d’extraction approprié contenant des traces de bleu de bromophénol, utilisé comme marqueur de migration, ont été ajoutés. Les échantillons ont ensuite été vortexés puis déposés dans les puits.
Le tampon d’électrophorèse préparé pour la migration des CAT était composé de tris-glycine (pH 8,3) sans urée et sans SDS. Celui des SOD et des GPOX (pH 8,8) contenait du Tris 32 mM, Na2EDTA 0,1 mM et de l’acide borique 0,6 mM. La migration a été effectuée dans une cuve d’électrophorèse verticale H-Vertigel 2 de dimensions 20 x 20 cm (Apelex) à un voltage constant (70 V) et une température de 4 °C.
La révélation de l’activité des CAT a été effectuée selon la méthode de Woodbury et al. (1971), citée par Fath et al. (2002). Le gel a d’abord été immergé dans l’eau distillée pendant 15 min. Après ce lavage, il a été incubé dans l’H2O2 à 0,03 % pendant 5 min sous agitation douce, puis lavé délicatement dans de l’eau distillée afin d’éliminer les résidus d’H2O2. L’activité des CAT a été révélée dans l’obscurité en trempant le gel dans une solution contenant du chlorure ferrique à 1 % (w/v) et du ferricyanure de potassium à 1 % (w/v). Les bandes claires (achromatiques) dans un gel bleu-vert traduisaient la présence de CAT dans le gel. Lorsque le contraste maximal a été atteint, la réaction a été arrêtée en rinçant le gel plusieurs fois avec de l’eau distillée. L’activité des SOD a été révélée en trempant le gel dans une solution de Tris-HCL (50 mM, pH 8,0) contenant 2 mg Riboflavine, 1 mg EDTA et 10 mg NBT, pour un volume final de 50 mL (Wendel et Weeden 1989). Après une incubation de 30 min à l’obscurité et sous agitation, le gel a été examiné à la lumière blanche. Les zones de l’activité SOD apparaissaient comme des bandes achromatiques sur un gel bleu foncé. Le gel a ensuite été lavé abondamment à l’eau distillée. La révélation de l’activité des GPOX a été réalisée selon la méthode de Baaziz (1989) avec quelques modifications. Le gel a été trempé dans une solution de guaïacol 0,12 M préparée dans un tampon acétate (0,1 M; pH 5,0) pendant 5 min sous agitation douce. La réaction des peroxydases avec le guaïacol a ensuite été déclenchée par l’addition de 1 mL de H2O2 (1 %). Le gel a ensuite été incubé à 40 °C jusqu’à l’apparition de zones de couleur rouge brique témoignant de la présence de l’activité peroxydase, puis lavé à l’eau distillée et fixé dans une solution de méthanol-H2O-acide acétique (5:5:1) (v/v/v). Les gels ont ensuite été observés à l’aide d’un scanner.
Analyse statistique
Les expériences ont été répétées trois fois dans les mêmes conditions. Les données du potentiel osmotique et des pigments photosynthétiques étaient représentées par les moyennes des réplicats biologiques pour chaque traitement, puis elles ont été soumises à une analyse de variance à un facteur à l’aide du logiciel XLSTAT 2016-Windows. Le test de Newman-Keuls a servi à évaluer les différences significatives entre les plantes témoins et les plantes stressées au seuil de signification de 5 %. Les moyennes ont été exprimées en moyenne ± SE.
Résultats et discussion
Détermination du potentiel osmotique
Les potentiels osmotiques variaient entre -0,95 MPa chez DK et -1,42 MPa chez AGY avant l’installation du déficit hydrique (Fig. 1). Le traitement au PEG 6000 a entraîné une diminution significative (p < 0,05) du potentiel osmotique chez toutes les plantes de blé dur, avec des valeurs qui oscillaient entre -2,02 MPa chez BEN et -2,69 MPa chez OZ. Les génotypes OZ, DK, AGY et BEL avaient tendance à présenter les valeurs les plus basses. Cette diminution peut s’expliquer par une accumulation des solutés dans le cytosol qui permet la rétention de l’eau et le maintien du potentiel hydrique à son niveau le plus bas.
L’adaptation des plantes au stress hydrique est complexe et est affectée par des mécanismes de tolérance inhérents et des facteurs environnementaux externes ou par leurs interactions. L’ajustement osmotique est une réponse physiologique précoce des plantes au stress hydrique qui permet aux cellules de rester turgescentes à des potentiels hydriques très bas, grâce à une accumulation active de solutés (Zwiazek et Blake 1990). Les plantes peuvent ainsi garder leurs stomates ouverts afin de poursuivre les échanges gazeux et les échanges de vapeur d’eau qui sont nécessaires à la réalisation de la photosynthèse et de la transpiration (Clifford et al. 1998). Les résultats de la présente étude indiquent une diminution du potentiel osmotique foliaire du blé dur consécutive à l’application du PEG 6000. Cette chute du potentiel osmotique a été attribuée par certains auteurs (Bajji et al. 2001; Slama et al. 2005) à l’augmentation de la concentration des solutés dans la cellule. Chez les céréales, les plus importants solutés sont les sucres solubles et la proline. Ces derniers protègent la cellule en équilibrant la résistance osmotique du cytosol avec celle de la vacuole et de l’environnement extérieur (Gadallah 1999). De plus, ces solutés peuvent interagir avec des macromolécules cellulaires telles que les enzymes antioxydantes, stabilisant ainsi leur structure et leur fonction (Sairam et al. 2002).
Figure 1
Potentiel osmotique des feuilles de dix génotypes de blé sous conditions de stress hydrique
T = plante témoin; S = plante stressée. Les données représentent la moyenne de trois répétitions ± SE. Les différentes lettres indiquent des différences significatives par rapport au témoin selon le test de Newman-Keuls à p < 0,05.
Détermination de la teneur en chlorophylles et en caroténoïdes
En condition de stress, on observe une diminution significative de la teneur en Chl a+b (Fig. 2; p < 0,05). En comparant les variétés étudiées, les pertes de chlorophylle les plus élevées sont observées chez les génotypes BEN, VIT et W, estimées à 37 %, 34,3 % et 30 %, respectivement. Parallèlement à cette diminution dans les teneurs en pigments chlorophylliens totaux, une baisse significative de la teneur en Car a également été enregistrée chez tous les génotypes de blé dur (Fig. 3; p < 0,05). Cette diminution est plus marquée chez les génotypes VIT, BEN et COL, ce qui suggère que les dommages oxydatifs causés par l’accumulation des ROS y sont plus élevés comparativement aux autres génotypes.
Figure 2
Teneur en chlorophylles totales (Chl a+b) des feuilles de dix génotypes de blé sous conditions de stress hydrique
T = plante témoin; S = plante stressée. Les données représentent la moyenne de trois répétitions ± SE. Les différentes lettres indiquent des différences significatives par rapport au témoin selon le test de Newman-Keuls à p < 0,05.
Figure 3
Teneur en caroténoïdes (Car) des feuilles de dix génotypes de blé sous conditions de stress hydrique
T = plante témoin; S = plante stressée. Les données représentent la moyenne de trois répétitions ± SE. Les différentes lettres indiquent des différences significatives par rapport au témoin selon le test de Newman-Keuls à p < 0,05.
La teneur en chlorophylle a été utilisée dans plusieurs études pour détecter les différences génotypiques en réponse au stress hydrique chez le blé (Bousba etal. 2013b; Khayatnezhad et al. 2011; Paknejad et al. 2007). La diminution du taux de Chl a+b en conditions de stress hydrique est due en grande partie aux dommages causés aux chloroplastes par les ROS tels que l’O2- et l’H2O2, ce qui peut conduire à une peroxydation lipidique et, par conséquent, à la destruction de la chlorophylle (Smirnoff 1993). Selon Mascher etal. (2005), la diminution des pigments chlorophylliens est due à la fermeture des stomates et au manque de CO2 qui sont associés à une production accentuée de ROS. Outre les dommages causés à la chlorophylle, le stress hydrique réduit également la concentration des Car (Kiani etal. 2008), essentiellement par la production accentuée de ROS dans les thylakoïdes (Reddy etal. 2004). Des résultats similaires ont été obtenus chez de nombreuses espèces, tels que le riz (Oryza sativa L.) (Cha-Um et al. 2010), le blé tendre (Triticum aestivum) (Hammad et Ali 2014; Khalilzadeh et al. 2016) et le blé dur (Chahbar et Belkhodja 2016), en réponse au stress hydrique. Les Car jouent un rôle très important dans la tolérance à la sècheresse, en dissipant l’excès d’énergie sous forme de chaleur et en protégeant la plante des dommages oxydatifs (Gill et Tuteja 2010). Cependant, elles sont très sensibles à la destruction oxydative des membranes photosynthétiques causées par l’accumulation de ROS générées pendant le stress hydrique. D’après Paleg et Aspinall (1981), les pigments photosynthétiques et la proline sont tous deux synthétisés à partir du même substrat, soit le glutamate. Par conséquent, une augmentation de la photosynthèse de la proline entraîne une diminution de la synthèse des pigments photosynthétiques sous déficit hydrique.
Analyse du profil électrophorétique des enzymes SOD, CAT et GPOX
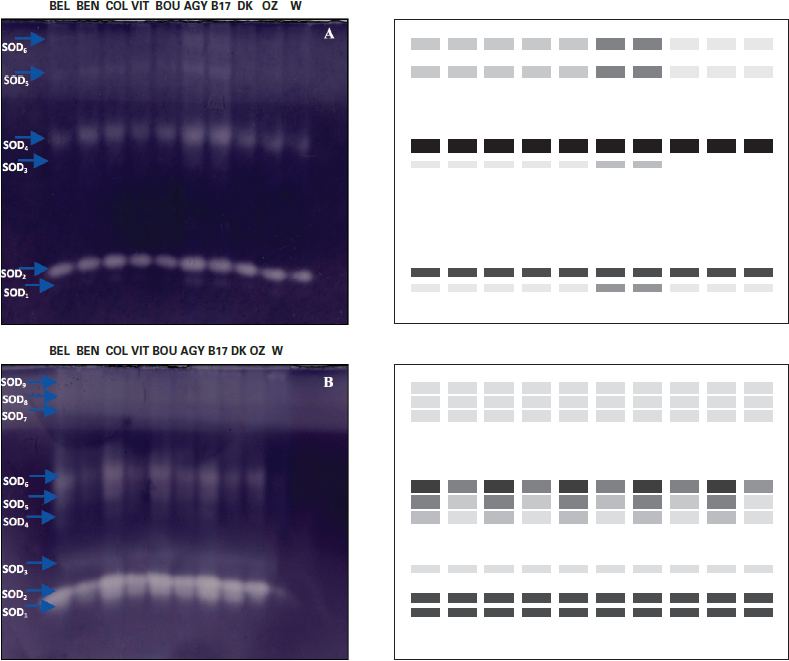
Le profil électrophorétique des SOD des dix génotypes étudiés (Fig. 4) montre l’existence de trois zones de migration chez les plantes témoins, chacune étant représentée par deux bandes (isozymes) d’intensité différente à l’exception des génotypes DK, OZ et W, chez lesquels on note la présence d’une seule bande dans la deuxième zone de migration.
Chez les plantes stressées, quatre zones de migration ont été détectées, avec l’apparition d’une nouvelle zone de migration et de deux nouvelles bandes dans les zones 1 et 2 témoignant de l’effet du stress hydrique sur la synthèse des SOD. Au moins neuf isozymes distincts ont été détectés sur le gel, où l’intensité des bandes différait d’une variété à l’autre. Des résultats similaires ont été rapportés par Huseynova et al. (2014) qui ont décelé jusqu’à quatre zones de migration des SOD chez le blé tendre sous conditions de stress hydrique.
Figure 4
Zymogramme de l’activité de la superoxyde dismutase (SOD) chez les feuilles de blé dur
Les résultats obtenus par la séparation des isoenzymes de CAT sont présentés à la figure 5. Une seule zone de migration a été détectée chez les plantes témoins et stressées avec une faible mobilité électrophorétique, ce qui correspond aux données de la littérature (Huseynova et al. 2015; Nabizadeh et al. 2015). Chez les plantes témoins, la zone d’activité enzymatique était représentée par deux bandes, dont une majeure. On note l’absence de la deuxième bande chez les génotypes W, B17, AGY, BEN et BEL, mais cette seconde bande apparaît dans les conditions de stress hydrique. Un changement quantitatif a pu être mis en évidence chez les plantes stressées par l’apparition d’une troisième bande, ce qui signifie que le stress hydrique a un effet sur la synthèse de cette nouvelle isoenzyme. On note aussi une augmentation de l’intensité des bandes qui varie d’une variété à l’autre, reflétant ainsi l’augmentation de l’activité d’enzyme en conditions de stress. Ces résultats sont similaires à ceux de Naderi et al. (2014) qui ont rapporté une augmentation de l’activité des CAT dans des bandes plus intenses en conditions de stress hydrique modéré et sévère chez le blé tendre. Des travaux de Huseynova et al. (2015) sur le blé dur ont mis en évidence l’effet du stress hydrique sur l’activité des CAT en décelant la synthèse de deux nouvelles isoformes, CAT2 et CAT3, en condition de stress hydrique.
Figure 5
Zymogramme de l’activité de la catalase (CAT) chez les feuilles de blé dur
Le profil électrophorétique des GPOX des dix génotypes du groupe témoin (Fig. 6) montre la présence de deux zones de migration : une de migration lente, représentée par une à deux bandes selon le génotype, et l’autre à migration rapide, représentée par une seule bande. Une absence totale de l’activité enzymatique a été observée chez la variété Beliouni. Une dégradation des extraits protéiques en cours de migration est cependant peu probable. Le même profil apparaît aussi bien pour les plantes témoins que pour les plantes stressées, structuré par deux zones de migrations. Cependant, une augmentation dans l’intensité des bandes est observée chez les plantes traitées avec le PEG 6000, indiquant ainsi une augmentation de l’activité des GPOX sous l’effet du stress.
Figure 6
Zymogramme de l’activité de la guaïacol peroxydase (GPOX) des feuilles de blé dur
L’étude de l’influence du stress hydrique sur le métabolisme de trois systèmes enzymatiques, les SOD, les GPOX et les CAT, a montré que la réponse à cet aléa différait d’une variété à l’autre. Les modifications d’activités observées sont complexes et impliquent de nombreuses isozymes subissant des variations qualitatives ou quantitatives individuelles. Plusieurs études ont été réalisées sur les corrélations entre la résistance au stress hydrique et l’activité accrue des enzymes du système antioxydant. Weng et al. (2015) ont conclu que les plantes qui ont une forte tolérance à la sécheresse exprimaient une abondance d’isozymes de SOD, CAT et GPOX en conditions de stress hydrique. Ces enzymes existent sous plusieurs isoformes et parfois sous différents types n’ayant pas la même localisation cellulaire. Ainsi, chez les plantes supérieures, les peroxydases présentent de très nombreuses isoformes encodées par des familles multigéniques (Yoshida et al. 2003). D’après les résultats de Baaziz et al. (2006), trois formes de POX sont présentes chez les céréales : des formes solubles et des formes liées à la paroi de façon covalente ou ionique. Les aspects quantitatifs et qualitatifs de ces POX peuvent être utilisés comme marqueurs de tolérance des plantes à plusieurs contraintes abiotiques. Les SOD sont classées par leurs cofacteurs métalliques en trois types connus, le cuivre/zinc (Cu/Zn-SOD), le manganèse (Mn-SOD) et le fer (Fe-SOD), localisés dans différents compartiments cellulaires (Mittler 2002). Les travaux de Huseynova et al. (2014) sur le blé dur ont montré que la contribution la plus importante à l’augmentation de l’activité des SOD en conditions de stress hydrique était assurée par la Mn-SOD qui est présente dans les mitochondries. Naderi et al. (2014) ont également rapporté que l’activité des isozymes de SOD était plus intense à la suite d’un traitement au PEG 6000 chez le blé tendre. Les CAT sont des enzymes impliquées dans la réponse au stress hydrique par élimination de l’H2O2 produit par la photorespiration dans les peroxysomes (Noctor et al. 2000). Dans notre étude, une augmentation de l’intensité des bandes de CAT avec l’apparition d’une nouvelle bande dans les plantes stressées indique une augmentation de l’activité de cette enzyme. L’expression prolongée d’isoenzymes de CAT en conditions de stress hydrique réduit efficacement les dégâts pouvant être causés par H2O2 dans les cellules (Weng et al. 2015). Nos résultats sont cohérents avec les travaux rapportant l’augmentation de l’activité des CAT en réponse au stress osmotique dans les plantules de blé.
Les résultats obtenus lors de cette étude montrent que tous les génotypes de blé dur présentent une aptitude à tolérer le stress hydrique par une baisse du potentiel osmotique, indiquant une accumulation de solutés qui permettraient probablement le maintien de la turgescence cellulaire. Les dommages oxydatifs causés aux membranes cellulaires à la suite de la contrainte hydrique font diminuer la teneur en chl a+b et en Car. Les activités accrues des enzymes antioxydantes (SOD, GPOX et CAT) agissent comme un système de contrôle des ROS et fournissent ainsi une protection contre le stress oxydatif. Nos résultats suggèrent que la présence de plusieurs enzymes exerçant la même fonction catalytique est une caractéristique très importante qui étend la capacité d’adaptation au stress hydrique. L’existence d’une variation infraspécifique chez le blé dur en ce qui concerne les traits étudiés peut être utilisée pour la sélection de génotypes tolérants à la sècheresse
Appendices
Remerciements
Ce travail a été financé par le ministère de l’Enseignement Supérieur et de la Recherche Scientifique du Gouvernement de la République Algérienne Démocratique et Populaire. Les auteurs sont très reconnaissants envers le Dr. Abdelkader Benbelkacem, directeur de recherche à l’Institut National de la Recherche Agronomique en Algérie – Constantine (INRAA), pour la fourniture des semences de blé dur et la collecte des données.
Références
- Adams I., W.W., B. Demmig-Adams, B.A. Logan, D.H. Barker et C.B. Osmond. 1999. Rapid changes in xanthophyll cycle-dependent energy dissipation and photosystem II efficiency in two vines, Stephania japonica and Smilax australis, growing in the understory of an open Eucalyptus forest. Plant Cell Environ. 22 : 125-136. doi:10.1046/j.1365-3040.1999.00369.x
- Arnon, D.I. 1949. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris. Plant Physiol. 24 : 1-15.
- Asada, K. 1999. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons. Annu. Rev. Plant Physiol. Plant Mol. Biol. 50 : 601-639. doi:10.1146/annurev.arplant.50.1.601.
- Ashraf, M. 2009. Biotechnological approach of improving plant salt tolerance using antioxidants as markers. Biotechnol. Adv. 27 : 84-93. doi:10.1016/j.biotechadv. 2008.09.003
- Baaziz, M. 1989. The activity and preliminary characterization of peroxidases in leaves of cultivars of date palm, Phoenix dactylifera L. New Phytol. 111 : 403-411. doi:10.1111/j.1469-8137.1989.tb00703.x
- Baaziz, M., N. Qacif, K. Bendiab et A. Aouad. 2006. Les peroxydases des plantes : Aspect théorique et applications pratiques. Pages 17-21 dans Société Marocaine de Biochimie et Biologie Moléculaire (éd.), Compte-rendu du 2e Congrès International de Biochimie, Agadir, Maroc.
- Bajji, M., S. Lutts et J.-M. Kinet. 2001. Water deficit effects on solute contribution to osmotic adjustment as a function of leaf ageing in three durum wheat (Triticum durum Desf.) cultivars performing differently in arid conditions. Plant Sci. 160 : 669-681.
- Batra, N.G., V. Sharma et N. Kumari. 2014. Drought-induced changes in chlorophyll fluorescence, photosynthetic pigments, and thylakoid membrane proteins of Vigna radiata. J. Plant Interact. 9 : 712-721.
- Belkharchouche, H., A. Benbelkacem, H. Bouzerzour et A. Benmahammed. 2015. Flag leaf and awns ablation and spike shading effects on spike yield and kernel weight of durum wheat (Triticum turgidum L. var. durum) under rainfed conditions. Adv. Environ. Biol. 9 : 184-191.
- Blokhina, O., E. Virolainen et K.V. Fagerstedt. 2003. Antioxidants, oxidative damage and oxygen deprivation stress: A review. Ann. Bot. 91 : 179-194.
- Bouchemal, K., R. Bouldjadj, M.N. Belbekri, N. Ykhlef et A. Djekoun. 2017. Differences in antioxidant enzyme activities and oxidative markers in ten wheat (Triticum durum Desf.) genotypes in response to drought, heat and paraquat stress. Arch. Agron. Soil Sci. 63 : 710-722. doi:10.1080/03650340.2016.1235267
- Bousba, R., M. Baum, A. Jighly, A. Djekoune, S. Lababidi, A. Benbelkacem, M. Labhilili, F. Gaboun et N. Ykhlef. 2013a. Association analysis of genotypic and phenotypic traits using SSR marker in durum wheat. Online Int. Interdiscip. Res. J. 3 : 60-79.
- Bousba, R., A. Djekoun, S. Duraa et N. Ykhlef. 2013b. Caractérisation moléculaire et association marqueur SSR phénotype pour la tolérance au stress hydrique chez le blé dur (Triticum durum Desf.). Eur. Sci. J. 9 : 186-201.
- Broughton, W.J. et M.J. Dilworth. 1971. Control of leghaemoglobin synthesis in snake beans. Biochem J. 125 : 1075-1080. doi:10.1042/bj1251075
- Chahbar, S. et M. Belkhodja. 2016. Water deficit effects on osmolyts traits in five durum wheat varieties (Triticum durum). Int. J. Innovation Appl. Stud. 17 : 757-767.
- Cha-Um, S., S. Yooyongwech et K. Supaibulwatana. 2010. Water deficit stress in the reproductive stage of four indica rice (Oryza sativa L.) genotypes. Pak. J. Bot. 42 : 3387-3398.
- Chennafi, H., A. Aidaoui, H. Bouzerzour et A. Saci. 2006. Yield response of durum wheat (Triticum durum Desf.) cultivar Waha to deficit irrigation under semi arid growth conditions. Asian J. Plant Sci. 5 : 854-860.
- Clifford, S.C., S.K. Arndt, J.E. Corlett, S. Joshi, N. Sankhla, M. Popp et H.G. Jones. 1998. The role of solute accumulation, osmotic adjustment and changes in cell wall elasticity in drought tolerance in Ziziphus mauritiana (Lamk.). J. Exp. Bot. 49 : 967-977. doi:10.1093/jxb/49.323.967
- Efeoğlu, B., Y. Ekmekçi et N. Çiçek. 2009. Physiological responses of three maize cultivars to drought stress and recovery. S. Afr. J. Bot. 75 : 34-42. doi:10.1016/ j.sajb.2008.06.005
- Fath, A., P. Bethke, V. Beligni et R. Jones. 2002. Active oxygen and cell death in cereal aleurone cells. J. Exp. Bot. 53 : 1273-1282.
- Gadallah, M.A.A. 1999. Effects of proline and glycinebetaine on Vicia faba responses to salt stress. Biol. Plant. 42 : 249-257. doi:10.1023/A:1002164719609
- Gill, S.S. et N. Tuteja. 2010. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiol. Biochem. 48 : 909-930. doi:10.1016/ j.plaphy.2010.08.016
- Hammad, S.A.R. et O.A.M. Ali. 2014. Physiological and biochemical studies on drought tolerance of wheat plants by application of amino acids and yeast extract. Ann. Agric. Sci. 59 : 133-145. doi:10.1016/j.aoas.2014.06.018.
- Hongbo, S., L. Zongsuo et S. Mingan. 2006. Osmotic regulation of 10 wheat (Triticum aestivum L.) genotypes at soil water deficits. Colloids Surf. B. 47 : 132-139. doi:10.1016/ j.colsurfb.2005.11.028
- Huseynova, I.M., D.R. Aliyeva et J.A. Aliyev. 2014. Subcellular localization and responses of superoxide dismutase isoforms in local wheat varieties subjected to continuous soil drought. Plant Physiol. Biochem. 81 : 54-60. doi:10.1016/j.plaphy.2014.01.018
- Huseynova, I.M., D.R. Aliyeva, A.C. Mammadov et J.A. Aliyev. 2015. Hydrogen peroxide generation and antioxidant enzyme activities in the leaves and roots of wheat cultivars subjected to long-term soil drought stress. Photosyn. Res. 125 : 279-289. doi:10.1007/s11120-015-0160-7
- Kacem, N.S., S. Mauro, Y. Muhovski, F. Delporte, J. Renaut, A. Djekoun et B. Watillon. 2016. Diagonal two-dimensional electrophoresis (D-2DE): A new approach to study the effect of osmotic stress induced by polyethylene glycol in durum wheat (Triticum durum Desf.). Mol. Biol. Rep. 43 : 897-909. doi:10.1007/s11033-016-4028-5
- Khalilzadeh, R., R.S. Sharifi et J. Jalilian. 2016. Antioxidant status and physiological responses of wheat (Triticum aestivum L.) to cycocel application and bio fertilizers under water limitation condition. J. Plant Interact. 11 : 130-137. doi:10.1080/17429145.2016.1221150
- Khayatnezhad, M., R. Gholamin, S.J. Somarin et R.Z. Mahmoodabad. 2011. Scrutiny of hexaploid and tetraploid (Triticum durum) wheat’s genotypes to some physiological responses in drought stress. Middle-East J. Sci. Res. 7 : 12-16.
- Kiani, S.P., P. Maury, A. Sarrafi et P. Grieu. 2008. QTL analysis of chlorophyll fluorescence parameters in sunflower (Helianthus annuus L.) under well-watered and water-stressed conditions. Plant Sci. 175 : 565-573. doi:10.1016/ j.plantsci.2008.06.002
- Laemmli, U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227 : 680-685. doi:10.1038/227680a0
- Larbi, A. 2004. Relative water content (RWC) and leaf senescence as screening tools for drought tolerance in wheat. Pages 193-196 dans Cantero-Martinez, C. et D. Gabina (éds.), Mediterranean rainfed agriculture: Strategies for sustainability. Séminaires Méditerranéens no 60. Centre international de hautes études agronomiques méditerranéennes, Paris, France.
- Levy, D., E. Fogelman, Y. Itzhak, Q. Ma, D.W. Turner et W. Cowling. 2006. Osmotic adjustment in leaves of Brassica oilseeds in response to water deficit. Can. J. Plant Sci. 86 : 389-397. doi:10.4141/P05-105
- Lichtenthaler, H.K. et A.R. Wellburn. 1983. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochem. Soc. Trans. 11 : 591-592. doi:10.1042/bst0110591
- Liu, C., Y. Liu, K. Guo, D. Fan, G. Li, Y. Zheng, L. Yu et R. Yang. 2011. Effect of drought on pigments, osmotic adjustment and antioxidant enzymes in six woody plant species in karst habitats of southwestern China. Environ. Exp. Bot. 71 : 174-183. doi:10.1016/j.envexpbot.2010.11.012
- Mascher, R., E. Nagy, B. Lippmann, S. Hörnlein, S. Fischer, W. Scheiding, A. Neagoe et H. Bergmann. 2005. Improvement of tolerance to paraquat and drought in barley (Hordeum vulgare L.) by exogenous 2-aminoethanol: effects on superoxide dismutase activity and chloroplast ultrastructure. Plant Sci. 168 : 691-698. doi:10.1016/ j.plantsci.2004.09.036
- Mittler, R. 2002. Oxidative stress, antioxidants and stress tolerance. Trends Plant Sci. 7 : 405-410. doi:10.1016/S1360-1385(02)02312-9
- Morgan, J.M. 1984. Osmoregulation and water stress in higher plants. Annu. Rev. Plant Physiol. 35 : 299-319. doi:10.1146/annurev.pp.35.060184.001503
- Nabizadeh, H., M. Valizadeh, M. Norouzi, M. Toorchi et M.B. Vajovi. 2015. Effect of different levels of NaCl salinity on antioxidant enzyme’s activity in seedling of different wheat cultivars. Biol. Forum 7 : 180-186.
- Naderi, R., M. Valizadeh, M. Toorchi et M.R. Shakiba. 2014. Antioxidant enzyme changes in response to osmotic stress in wheat (Triticum aestivum L.) seedling. Acta Biol. 58 : 95-101.
- Noctor, G., S. Veljovic-Jovanovic, et C.H. Foyer. 2000. Peroxide processing in photosynthesis: antioxidant coupling and redox signalling. Philos. Trans. R. Soc. Lond. Ser. B. 355 : 1465-1475.
- Ozkur, O., F. Ozdemir, M. Bor et I. Turkan. 2009. Physiochemical and antioxidant responses of the perennial xerophyte Capparis ovata Desf. to drought. Environ. Exp. Bot. 66 : 487-492. doi:10.1016/j.envexpbot.2009.04.003
- Paknejad, F., M. Nasri, H.R.T. Moghadam, H. Zahedi et M.J. Alahmadi. 2007. Effects of drought stress on chlorophyll fluorescence parameters, chlorophyll content and grain yield of wheat cultivars. J. Biol. Sci. 6 : 841-847.
- Paleg, L.G. et D. Aspinall. 1981. The physiology and biochemistry of drought resistance in plants. Academic Press, Sidney, Australia.
- Pérez, F.J. et W. Lira. 2005. Possible role of catalase in post-dormancy bud break in grapevines. J. Plant Physiol. 162 : 301-308. doi:10.1016/j.jplph.2004.07.011
- Poulik, M.D. 1957. Starch gel electrophoresis in a discontinuous system of buffers. Nature 180 : 1477-1479. doi:10.1038/1801477a0
- Reddy, A.R., K.V. Chaitanya et M. Vivekanandan. 2004. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. J. Plant Physiol. 161 : 1189-1202. doi:10.1016/j.jplph.2004.01.013
- Sairam, R.K., K.V. Rao et G.C. Srivastava. 2002. Differential response of wheat genotypes to long term salinity stress in relation to oxidative stress, antioxidant activity and osmolyte concentration. Plant Sci. 163 : 1037-1046. doi:10.1016/S0168-9452(02)00278-9
- Salmi, M., L. Haddad, A. Oulmi, A. Benmahammed et A. Benbelkacem. 2015. Variabilité phénotypique et sélection des caractères agronomiques du blé dur (Triticum durum Desf.) sous conditions semi-arides. Eur. Sci. J. 11 : 99-111.
- Santarius, K.A. 1973. The protective effect of sugars on chloroplast membranes during temperature and water stress and its relationship to frost, desiccation and heat resistance. Planta 113 : 105-114. doi:10.1007/BF00388196
- Shah, A.R., T.M. Khan, H.A. Sadaquat et A.A. Chatha. 2011. Alterations in leaf pigments in cotton (Gossypium hirsutum) genotypes subjected to drought stress conditions. Int. J. Agric. Biol. 13 : 902-908.
- Slama, A., M.B. Salem, M.B. Naceur et E. Zid. 2005. Les céréales en Tunisie : production, effet de la sécheresse et mécanismes de résistance. Sci. Chang. Planet. 16 : 225-229.
- Smirnoff, N. 1993. The role of active oxygen in the response of plants to water deficit and desiccation. New Phytol. 125 : 27-58. doi:10.1111/j.1469-8137.1993.tb03863.x
- Valizadeh, M., M. Mohayeji, N. Yasinzadeh, S. Nasrullazadeh et M. Moghaddam. 2011. Genetic diversity of synthetic alfalfa generations and cultivars using tetrasomic inherited allozyme markers. J. Agric. Sci. Technol. 13 : 425-430.
- Wendel, J.F. et N.F. Weeden. 1989. Visualization and interpretation of plant isozymes. Pages 5-45 dans Soltis, D.E. et P.S. Soltis (éds.), Isozymes in plant biology. Chapman and Hall, London, UK. doi:10.1007/978-94-009-1840-5_2
- Weng, M., L. Cui, F. Liu, M. Zhang, L. Shan, S. Yang et V. Deng. 2015. Effects of drought stress on antioxidant enzymes in seedlings of different wheat genotypes. Pak. J. Bot. 47 : 49-56.
- Woodbury, W., A.K. Spencer et M.A. Stahmann 1971. An improved procedure using ferricyanide for detecting catalase isozymes. Anal. Biochem. 44 : 301-305. doi:10.1016/0003-2697(71)90375-7
- Yoshida, K., P. Kaothien, T. Matsui, A. Kawaoka, et A. Shinmyo. 2003. Molecular biology and application of plant peroxidase genes. Appl. Microbiol. Biotechnol. 60 : 665-670. doi:10.1007/s00253-002-1157-7
- Zwiazek, J.J. et T.J. Blake. 1990. Effects of preconditioning on carbohydrate and amino acid composition of osmotically stressed black spruce (Picea mariana) cuttings. Can. J. For. Res. 20 : 108-112. doi:10.1139/x90-015
List of figures
Figure 1
Potentiel osmotique des feuilles de dix génotypes de blé sous conditions de stress hydrique
Figure 2
Teneur en chlorophylles totales (Chl a+b) des feuilles de dix génotypes de blé sous conditions de stress hydrique
Figure 3
Teneur en caroténoïdes (Car) des feuilles de dix génotypes de blé sous conditions de stress hydrique
Figure 4
Zymogramme de l’activité de la superoxyde dismutase (SOD) chez les feuilles de blé dur
Figure 5
Zymogramme de l’activité de la catalase (CAT) chez les feuilles de blé dur
Figure 6
Zymogramme de l’activité de la guaïacol peroxydase (GPOX) des feuilles de blé dur
List of tables
Tableau 1
Liste des dix génotypes étudiés définis par leur pédigrée, leur origine, leur comportement vis-à-vis de la sècheresse et leur acronyme