Abstracts
Résumé
La mobilisation des réserves lipidiques, stockées sous forme de triglycérides dans le tissu adipeux, relève de l’activation de la lipolyse dans l’adipocyte. Les travaux des 30 dernières années ont établi le rôle essentiel joué par la voie de l’AMP cyclique et la lipase hormono-sensible dans le contrôle de la lipolyse. Les catécholamines et l’insuline sont les agents hormonaux essentiels impliqués dans le contrôle de ce processus dans l’adipocyte humain. Nous rapportons la découverte d’un nouveau mécanisme de contrôle de la lipolyse qui implique les peptides natriurétiques d’origine cardiaque et la voie du GMP cyclique. Ces peptides, qui participent à la gestion de l’homéostasie de l’eau et du sel, agissent également sur l’adipocyte. Ils sont doués de propriétés lipolytiques et leur mécanisme d’action a été établi. De plus, nous montrons leur implication dans le contrôle physiologique de la mobilisation des lipides chez l’homme pendant la pratique d’une activité physique.
Summary
Human fat cell lipolysis was considered until recently to be an exclusive cAMP/protein-kinase A (PKA)-regulated metabolic pathway under the control of catecholamines and insulin. Moreover, exercise-induced lipid mobilization in humans was considered to mainly depend on catecholamine action and interplay between fat cell β- and α2-adrenergic receptors controlling adenylyl cyclase activity and cAMP production. We have recently demonstrated that natriuretic peptides stimulate lipolysis and contribute to the regulation of lipid mobilization in humans. Atrial natriuretic peptide (ANP) and brain natriuretic peptide (BNP) stimulate lipolysis in human isolated fat cells. Activation of the adipocyte plasma membrane type A guanylyl cyclase receptor (NPR-A), increase in intracellular guanosine 3’,5’-cyclic monophosphate (cyclic GMP) levels and activation of hormone-sensitive lipase mediate the action of ANP. ANP does not modulate cAMP production and PKA activity. Increment of cGMP induces the phosphorylation of hormone-sensitive lipase and perilipin A via the activation of a cGMP dependent protein kinase-I (cGK-I). Plasma concentrations of glycerol and non-esterified fatty acids are increased by i.v. infusion of ANP in humans. Physiological relevance of the ANP-dependent pathway was demonstrated in young subjects performing physical exercise. ANP plays a role in conjunction with catecholamines in the control of exercise-induced lipid mobilization. This pathway becomes of major importance when subjects are submitted to chronic treatment with a β-blocker. Oral β-adrenoceptor blockade suppresses the β-adrenergic component of catecholamine action in fat cells and potentiates exercise-induced ANP release by the heart. These findings may have several implications whenever natriuretic peptide secretion is altered such as in subjects with left ventricular dysfunction, congestive heart failure and obesity.
Article body
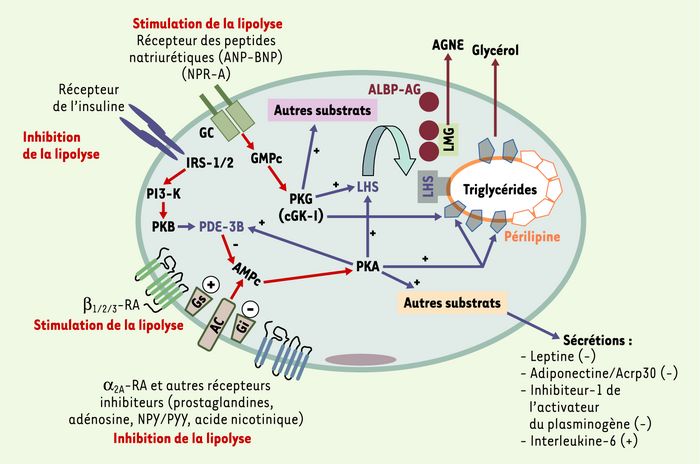
Les mécanismes de régulation de la lipolyse dans l’adipocyte humain semblaient être bien établis [1]. Les caractéristiques structurales de la lipase hormono-sensible (LHS), enzyme limitante du processus lipolytique, les partenaires protéiques intervenant dans le complexe lipolytique et les mécanismes d’activation de l’enzyme ont été bien définis [2] (Figure 1). L’activation de la LHS est sous le contrôle de l’AMP cyclique (AMPc) et de la protéine kinase A (PKA) qui phosphoryle l’enzyme. L’activation de la LHS, enzyme limitante du processus lipolytique, conduit à l’hydrolyse des tri- et diglycérides de l’adipocyte. L’hydrolyse terminale des monoglycérides est assurée par une lipase des monoglycérides, enzyme abondante et non réglée par les hormones, dont l’activation conduit à la libération par l’adipocyte d’acides gras non estérifiés (AGNE) et de glycérol [2, 3].
Figure 1
Contrôle de la lipolyse dans l’adipocyte humain.
Les récepteurs β- et α2A-adrénergiques (RA) sont couplés positivement ou négativement à l’adénylyl cyclase et à la production d’AMPc par des protéines G hétérotrimériques (Gs et Gi). La stimulation des récepteurs β1/2- ou α2A-adrénergiques active les protéines Gs ou Gi, respectivement. L’AMPc produit par l’activation de l’adénylyl cyclase active la protéine kinase A (PKA) qui va stimuler la phosphorylation des périlipines et de la lipase hormono-sensible (LHS). La PKA phosphoryle également diverses autres protéines-cibles de l’adipocyte (non représentées dans le schéma). Les éléments (récepteur insuline, IRS-1/2, PI3-kinase [PI3-K] et PKB/Akt) impliqués dans la transduction du signal insulinique et l’activation de la phosphodiestérase de type 3B (PDE-3B), qui hydrolyse l’AMPc, sont représentés. Cette voie exerce des effets modulateurs puissants sur la lipolyse adrénergique. Les peptides natriurétiques stimulent l’activité guanylyl cyclase (GC) du récepteur NPR-A des peptides natriurétiques, induisent une augmentation des taux de GMPc, l’activation d’une protéine kinase G (PKG, cGK-I) puis la phosphorylation et l’activation de la périlipine et de la LHS. La LHS activée hydrolyse les tri- et les diglycérides. Les monoglycérides sont hydrolysés par une lipase des monoglycérides (LMG). L’activité lipolytique de l’adipocyte humain est sous le contrôle permanent des voies pro-lipolytiques (β-adrénergiques, peptides natriurétiques) et antilipolytiques (insuline, α2-adrénergiques, adénosine, prostaglandines, neuropeptide Y et peptide YY). Le système nerveux sympathique contrôle également (positivement ou négativement) la production de protéines sécrétées par l’adipocyte (telles que la leptine, l’adiponectine/Acrp30, l’interleukine-6 ou l’inhibiteur-1 de l’activateur du plasminogène [plasminogen activator inhibitor-1]). ALBP-AG représente la protéine de liaison des acides gras qui va influencer l’exportation des acides gras non estérifiés (AGNE) vers le compartiment extracellulaire. Les flèches de couleur bleue indiquent les effets apparaissant au-delà de l’activation des kinases. + : stimulation ; - : inhibition.
Les voies classiques de régulation de la lipolyse chez l’homme
Dans l’adipocyte humain, les taux d’AMPc sont essentiellement contrôlés par les catécholamines et l’insuline. Les catécholamines, via l’activation de récepteurs β1/2- et α2-adrénergiques, couplés respectivement à des protéines G de type Gs ou Gi, contrôlent finement l’activité de l’adénylyl cyclase et la production d’AMPc [4]. L’insuline intervient dans la gestion des taux intracellulaires d’AMPc en assurant la dégradation du second messager par l’activation de la phosphodiestérase (PDE) de type PDE-3B, majoritaire dans l’adipocyte. Les voies de signalisation de l’insuline sont bien identifiées [5]. Les éléments intervenant en cascade dans la genèse des effets antilipolytiques de l’insuline sont les récepteurs insuliniques de la membrane plasmique et leurs substrats majeurs, les protéines IRS-1 et -2 (insulin receptor substrate-1, -2), la phosphatidyl-inositol-3 kinase (PI3-K), la protéine kinase B/Akt et la PDE-3B qui assure la dégradation de l’AMPc.
La stimulation des récepteurs β3-adrénergiques, faiblement exprimés dans l’adipocyte humain, mais très abondants dans l’adipocyte de rongeur, provoque une activation simultanée de la PKA et de la voie des MAP-kinases (ERK1/2). Cet effet original, qui implique une protéine Gi, est spécifique du β3-récepteur. Il est susceptible d’intervenir dans la modulation des effets lipolytiques des β3-agonistes [6]. Un tel effet n’a pas été démontré jusqu’ici dans l’adipocyte humain. Le facteur de nécrose tumorale (TNF-α), doué de propriétés lipolytiques limitées, stimule également la voie des MAP-kinases (ERK1/2) dans les adipocytes de rongeurs et dans les adipocytes humains issus de précurseurs adipocytaires et différenciés in vitro [7]. L’activation des MAP-kinases est associée à une augmentation des taux intracellulaires d’AMPc et à une phosphorylation de la sérine (Ser600) de la LHS [8, 9].
L’implication des peptides natriurétiques
Notre recherche de nouvelles voies de régulation de la lipolyse et de la mobilisation des lipides s’est orientée vers des facteurs susceptibles d’être libérés dans des situations physiologiques connues pour promouvoir la mobilisation des lipides. La pratique d’une activité physique représente la situation physiologique idéale. Elle entraîne une activation du système nerveux orthosympathique et une libération de noradrénaline, une sécrétion d’adrénaline par la médullosurrénale et une inhibition concomitante de la sécrétion d’insuline. Ces partenaires hormonaux ont été considérés jusqu’ici comme étant les déterminants de la mobilisation des lipides induite par l’exercice physique [10]. Cependant, parallèlement à l’activation du système orthosympathique et à la libération des catécholamines médullo-surrénaliennes, et, selon l’intensité et la durée de l’exercice physique, le coeur libère également des peptides natriurétiques. Les peptides natriurétiques, ANP (atrial natriuretic peptide) et BNP (brain natriuretic peptide), représentent une famille d’hormones peptidiques d’origine cardiaque connues pour moduler la pression artérielle et le volume sanguin en exerçant des effets directs sur le rein et le système vasculaire. Leurs effets cellulaires débutent par la liaison à trois types de récepteurs membranaires NPR-A, NPR-B et NPR-C, les deux premiers étant doués d’une activité guanylyl cyclase [11]. Dans un premier temps, nous avons découvert que ces peptides exerçaient une action spécifique sur la lipolyse in vitro, puis nous avons mis en évidence un effet sur la mobilisation des lipides in vivo.
Effets des peptides natriurétiques
Effets in vitro
Les peptides natriurétiques exercent un puissant effet lipolytique sur l’adipocyte humain in vitro. Cet effet est équivalent à celui de l’agoniste β-adrénergique de référence, l’isoprénaline. L’ANP, le BNP et le CNP (C-type natriuretic peptide) stimulent la lipolyse selon l’ordre de potentialité suivant : ANP>BNP>>CNP (Figure 2A). Des études de liaison de l’ANP marqué à l’iode 125 sur des membranes plasmiques ont révélé la présence de récepteurs des peptides natriurétiques de type NPR-A et NPR-C dans l’adipocyte humain. L’effet des peptides natriurétiques est sans incidence sur les taux d’AMPc intracellulaire ou l’activation de la PKA et est insensible à toute modulation de l’activité des systèmes inhibiteurs de l’adénylyl cyclase. De plus, ces peptides n’ont aucun effet sur l’activité de la PDE-3B, enzyme qui dégrade l’AMPc [12]. En fait, la stimulation du récepteur NPR-A, doté d’une activité guanylyl cyclase intrinsèque, est associée à une augmentation importante et soutenue des taux intracellulaires de GMP cyclique (GMPc). Cette production de GMPc est suivie de l’activation d’une protéine kinase dépendant du GMPc (PKG) de type cGK-I que nous avons identifiée dans l’adipocyte humain. Cette activation est associée à la phosphorylation de la périlipine A, protéine enveloppant la gouttelette lipidique et élément important du dispositif lipolytique, et de la LHS ; ces deux événements précèdent l’activation de la lipolyse [13]. Il est à remarquer que l’insuline n’a aucune incidence sur les effets lipolytiques de l’ANP puisque les actions antilipolytiques de l’insuline sont exercées par le contrôle des taux d’AMPc et que ce second messager n’intervient pas dans les mécanismes d’action de l’ANP [14]. Cette observation souligne que les effets lipolytiques des peptides natriurétiques ne sont pas modulables par la seule hormone douée de propriétés antilipolytiques. Tout dysfonctionnement dans les mécanismes de production des peptides natriurétiques sera susceptible de promouvoir une intense mobilisation des lipides qui n’est pas influencée par le seul mécanisme antilipolytique majeur. Notons que cette nouvelle voie lipolytique n’est fonctionnelle que dans l’adipocyte de l’homme et des primates ; les adipocytes des rongeurs, du chien, du cobaye ou du lapin répondent peu ou ne répondent pas aux peptides natriurétiques par une réponse lipolytique [15].
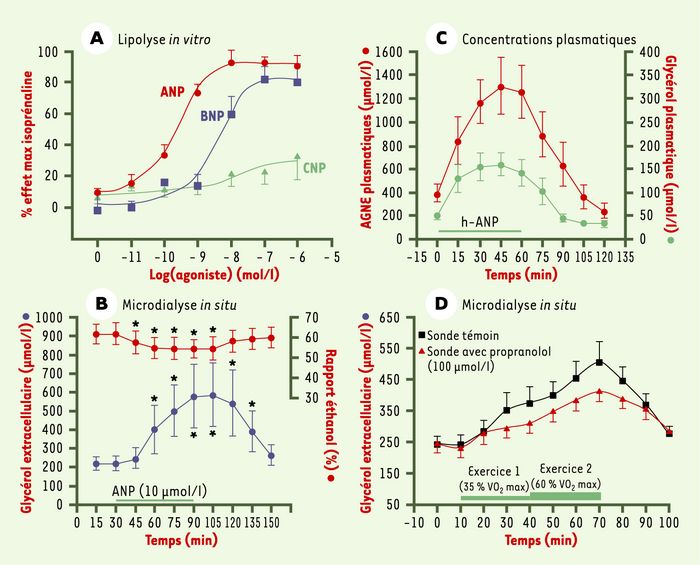
Figure 2
Effets des peptides natriurétiques sur la lipolyse in vitro et la régulation de la mobilisation des lipides.
A. Comparaison des effets lipolytiques des peptides natriurétiques (ANP, BNP et CNP) sur des adipocytes isolés humains. La lipolyse est exprimée en pourcentage de l’effet maximal de l’isoprénaline. Les peptides natriurétiques exercent un puissant effet lipolytique, leur effet maximal est similaire à celui de l’isoprénaline. L’ordre relatif de potentialité lipolytique est le suivant : ANP>BNP>>CNP [12]. B. Effet d’une administration d’ANP (10 µmol/l) dans une sonde de microdialyse in situ implantée dans le tissu adipeux sous-cutané abdominal humain. Variations des concentrations de glycérol extracellulaire et du flux sanguin local (évalué par l’évolution de la valeur du rapport des concentrations d’éthanol dans le dialysat et le perfusat de la sonde de microdialyse). L’administration d’ANP provoque une augmentation de la concentration de glycérol extracellulaire et une vasodilatation [12] (les valeurs sont les moyennes ± erreur standard à la moyenne ; * significativement différent de la valeur témoin ; p< 0,01). C. Effet d’une administration intraveineuse d’ANP humain (hANP à 50 ng/min/kg) sur les concentrations plasmatiques de glycérol et d’acides gras non estérifiés (AGNE). L’administration i.v. d’hANP provoque une puissante mobilisation des lipides chez l’homme [17]. D. Étude de la mobilisation des lipides (augmentation de la concentration de glycérol extracellulaire) dans le tissu adipeux sous-cutané abdominal humain à l’aide de la microdialyse in situ pendant deux séquences d’exercice effectuées à 35 % ou 60 % de la consommation maximale d’oxygène (VO2 max)(sonde témoin) chez des sujets sains non obèses. L’administration d’un β-bloquant (perfusion (2,5 µl/min) dans la sonde de microdialyse d’une solution de propranolol à 100 µmol/l) ne supprime que très partiellement la mobilisation lipidique induite par l’exercice physique alors qu’elle supprime totalement les effets d’un agoniste β-adrénergique administré localement. La mobilisation lipidique résistant au β-bloquant est due aux peptides natriurétiques [18].
Effets in vivo
Les études in vivo fondées sur l’utilisation de la microdialyse in situ [16] ont confirmé les résultats obtenus in vitro. La perfusion d’ANP dans une sonde de microdialyse implantée dans le tissu adipeux sous-cutané abdominal chez des sujets sains provoque une stimulation nette de la lipolyse (Figure 2B). De plus, l’administration intraveineuse d’une dose pharmacologique d’ANP humain provoque une augmentation spectaculaire des concentrations plasmatiques de glycérol et d’AGNE (Figure 2C). Cet effet sur la mobilisation des lipides est indépendant de la faible activation du système nerveux sympathique provoquée par l’administration du peptide [17].
À l’aide de la technique de microdialyse in situ, nous avons démontré l’implication physiologique de cette voie en étudiant la régulation de la mobilisation des lipides dans le tissu adipeux sous-cutané abdominal chez des sujets sains et non obèses pratiquant un exercice d’endurance. Un β-bloquant, administré localement dans une sonde de microdialyse, ne supprime que très partiellement la mobilisation lipidique induite par l’exercice physique (Figure 2D). Le même type d’effet est observé lorsque le sujet reçoit au préalable un traitement oral avec un β-bloquant, et, paradoxalement, on observe même une amélioration de la mobilisation des lipides pendant l’exercice. L’analyse détaillée des variations concomitantes des concentrations plasmatiques d’ANP, de glycérol et de GMPc interstitiels dans ces diverses conditions expérimentales nous permet de proposer que la mobilisation lipidique induite par l’exercice, résistante à un traitement local ou oral par un β-bloquant, dépend de la libération de peptides natriurétiques par le coeur [18].
Conclusions et perspectives
Durant la pratique d’un exercice physique soutenu chez l’homme - outre les effets bien connus des catécholamines dans le contrôle de la mobilisation des lipides - les peptides natriurétiques jouent un rôle notable dans ce processus au sein du tissu adipeux sous-cutané. Chez le sujet sous traitement par les β-bloquants, dont le tissu adipeux ne répond plus aux catécholamines, et qui présente des concentrations plasmatiques de peptides natriurétiques (BNP et ANP) élevées, cette voie revêt une importance particulière. Il sera essentiel d’étudier des effets métaboliques éventuels de ces peptides dans divers états pathologiques connus pour être associés à des concentrations plasmatiques élevées d’ANP et de BNP (insuffisance cardiaque, syndromes obstructifs pulmonaires, certains types de cancers). Il sera également nécessaire de rechercher une implication éventuelle de cette nouvelle voie de mobilisation des lipides dans la genèse de certains états cachectiques rencontrés chez des patients porteurs de ces maladies. Des dérèglements de cette voie métabolique sont également susceptibles d’intervenir dans la physiopathologie du syndrome métabolique (encore appelé syndrome X) de l’obèse et des désordres cardiovasculaires qui lui sont associés [19]. On ignore actuellement s’il existe un rétrocontrôle de la production de ces hormones cardiaques par des produits de la lipolyse ou des sécrétions de l’adipocyte contrôlées par ces peptides.
Appendices
Références
- 1. Lafontan M, Langin D. Régulation neuro-humorale de la lipolyse : aspects physiologiques et physiopathologiques. Med Sci(Paris) 1998 ; 14 : 865-76.
- 2. Holm C, Osterlund T, Laurell H, et al. Molecular mechanisms regulating hormone-sensitive lipase and lipolysis. Annu Rev Nutr 2000 ; 20 : 365-93.
- 3. Langin D, Lafontan M. Lipolysis and lipid mobilization in human adipose tissue. In : Bray GA, Bouchard C, eds. Handbook of obesity. Etiology and pathophysiology, 2nd ed. New York : Marcel Dekker Inc, 2004 : 515-32.
- 4. Langin D, Lucas S, Lafontan M. Millenium fat-cell lipolysis reveals unsuspected novel tracks. Hormon Metab Res 2000 ; 32 : 443-52.
- 5. Capeau J. Voies de signalisation de l’insuline : mécanismes affectés dans l’insulino-résistance. Med Sci(Paris) 2003 ; 19 : 834-9.
- 6. Soeder KJ, Snedden SK, Cao W, et al. The β3-adrenergic receptor activates mitogen activated protein kinase in adipocytes through a Gi-dependent mechanism. J Biol Chem 1999 ; 274 : 12017-22.
- 7. Ryden M, Dicker A, van Harmelen V, et al. Mapping of early signaling events in tumor necrosis-alpha-mediated lipolysis in human fat cells. J Biol Chem 2002 ; 277 : 1085-91.
- 8. Zhang HH, Halbleib M, Ahmad F, et al. Tumor necrosis factor-α∈stimulates lipolysis in differentiated human adipocytes through activation of extracellular signal-related kinase and elevation of intracellular cAMP. Diabetes 2002 ; 51 : 2929-35.
- 9. Greenberg AS, Shen WJ, Muliro K, et al. Stimulation of lipolysis and hormone-sensitive lipase via the extracellular signal-regulated kinase pathway. J Biol Chem 2001 ; 276 : 45456-61.
- 10. Horowitz JF. Fatty acid mobilization from adipose tissue during exercise. Trends Endocrinol Metab 2003 ; 14 : 386-92.
- 11. Kuhn M. Structure, regulation, and function of mammalian membrane guanylyl cyclase receptors, with a focus on guanylyl cyclase-A. Circ Res 2003 ; 93 : 700-9.
- 12. Sengenes C, Berlan M, de Glisezinski I, et al. Natriuretic peptides : a new lipolytic pathway in human adipocytes. FASEB J 2000 ; 14 : 1345-51.
- 13. Sengenes C, Bouloumié A, Hauner H, et al. Involvement of a cGMP-dependent pathway in natriuretic peptide-mediated hormone-sensitive lipase phosphorylation in human adipocytes. J Biol Chem 2003 ; 278 : 48617-26.
- 14. Moro C, Galitzky J, Sengenes C, et al. Functional and pharmacological characterization of the natriuretic peptide-dependent lipolytic pathway in human fat cells. J Pharmacol Exp Ther 2004 ; 308 : 984-92.
- 15. Sengenes C, Zakaroff-Girard A, Moulin A, et al. Natriuretic peptide-dependent lipolysis in fat cells is a primate specificity. Am J Physiol 2002 ; 283 : R257-65.
- 16. Lafontan M, Arner P. Application of in situ microdialysis to measure metabolic and vascular responses in adipose tissue. Trends Pharmacol Sci 1996 ; 17 : 309-13.
- 17. Galitzky J, Sengenes C, Thalamas C, et al. The lipid mobilizing effect of atrial natriuretic peptides is unrelated to sympathetic nervous system activation or obesity in young men. J Lipid Res 2001 ; 42 : 536-44.
- 18. Moro C, Crampes F, Sengenes C, et al. Atrial natriuretic peptide contributes to the physiological control of lipid mobilization in humans. FASEB J 2004 ; 18 : 908-10.
- 19. Wang TJ, Larson MG, Levy D, et al. Impact of obesity on plasma natriuretic peptide levels. Circulation 2004 ; 109 : 594-600.
List of figures
Figure 1
Contrôle de la lipolyse dans l’adipocyte humain.
Les récepteurs β- et α2A-adrénergiques (RA) sont couplés positivement ou négativement à l’adénylyl cyclase et à la production d’AMPc par des protéines G hétérotrimériques (Gs et Gi). La stimulation des récepteurs β1/2- ou α2A-adrénergiques active les protéines Gs ou Gi, respectivement. L’AMPc produit par l’activation de l’adénylyl cyclase active la protéine kinase A (PKA) qui va stimuler la phosphorylation des périlipines et de la lipase hormono-sensible (LHS). La PKA phosphoryle également diverses autres protéines-cibles de l’adipocyte (non représentées dans le schéma). Les éléments (récepteur insuline, IRS-1/2, PI3-kinase [PI3-K] et PKB/Akt) impliqués dans la transduction du signal insulinique et l’activation de la phosphodiestérase de type 3B (PDE-3B), qui hydrolyse l’AMPc, sont représentés. Cette voie exerce des effets modulateurs puissants sur la lipolyse adrénergique. Les peptides natriurétiques stimulent l’activité guanylyl cyclase (GC) du récepteur NPR-A des peptides natriurétiques, induisent une augmentation des taux de GMPc, l’activation d’une protéine kinase G (PKG, cGK-I) puis la phosphorylation et l’activation de la périlipine et de la LHS. La LHS activée hydrolyse les tri- et les diglycérides. Les monoglycérides sont hydrolysés par une lipase des monoglycérides (LMG). L’activité lipolytique de l’adipocyte humain est sous le contrôle permanent des voies pro-lipolytiques (β-adrénergiques, peptides natriurétiques) et antilipolytiques (insuline, α2-adrénergiques, adénosine, prostaglandines, neuropeptide Y et peptide YY). Le système nerveux sympathique contrôle également (positivement ou négativement) la production de protéines sécrétées par l’adipocyte (telles que la leptine, l’adiponectine/Acrp30, l’interleukine-6 ou l’inhibiteur-1 de l’activateur du plasminogène [plasminogen activator inhibitor-1]). ALBP-AG représente la protéine de liaison des acides gras qui va influencer l’exportation des acides gras non estérifiés (AGNE) vers le compartiment extracellulaire. Les flèches de couleur bleue indiquent les effets apparaissant au-delà de l’activation des kinases. + : stimulation ; - : inhibition.
Figure 2
Effets des peptides natriurétiques sur la lipolyse in vitro et la régulation de la mobilisation des lipides.
A. Comparaison des effets lipolytiques des peptides natriurétiques (ANP, BNP et CNP) sur des adipocytes isolés humains. La lipolyse est exprimée en pourcentage de l’effet maximal de l’isoprénaline. Les peptides natriurétiques exercent un puissant effet lipolytique, leur effet maximal est similaire à celui de l’isoprénaline. L’ordre relatif de potentialité lipolytique est le suivant : ANP>BNP>>CNP [12]. B. Effet d’une administration d’ANP (10 µmol/l) dans une sonde de microdialyse in situ implantée dans le tissu adipeux sous-cutané abdominal humain. Variations des concentrations de glycérol extracellulaire et du flux sanguin local (évalué par l’évolution de la valeur du rapport des concentrations d’éthanol dans le dialysat et le perfusat de la sonde de microdialyse). L’administration d’ANP provoque une augmentation de la concentration de glycérol extracellulaire et une vasodilatation [12] (les valeurs sont les moyennes ± erreur standard à la moyenne ; * significativement différent de la valeur témoin ; p< 0,01). C. Effet d’une administration intraveineuse d’ANP humain (hANP à 50 ng/min/kg) sur les concentrations plasmatiques de glycérol et d’acides gras non estérifiés (AGNE). L’administration i.v. d’hANP provoque une puissante mobilisation des lipides chez l’homme [17]. D. Étude de la mobilisation des lipides (augmentation de la concentration de glycérol extracellulaire) dans le tissu adipeux sous-cutané abdominal humain à l’aide de la microdialyse in situ pendant deux séquences d’exercice effectuées à 35 % ou 60 % de la consommation maximale d’oxygène (VO2 max)(sonde témoin) chez des sujets sains non obèses. L’administration d’un β-bloquant (perfusion (2,5 µl/min) dans la sonde de microdialyse d’une solution de propranolol à 100 µmol/l) ne supprime que très partiellement la mobilisation lipidique induite par l’exercice physique alors qu’elle supprime totalement les effets d’un agoniste β-adrénergique administré localement. La mobilisation lipidique résistant au β-bloquant est due aux peptides natriurétiques [18].