Article body
Les chimiokines sont une famille de peptides de 8 à 14 kDa libérés par les lymphocytes en réponse à un stimulus. L’étude fonctionnelle des chimiokines a commencé en 1987 avec l’identification de l’interleukine-8 (IL-8) [1], et a montré que ces molécules contrôlent notamment le chimiotactisme des leucocytes durant l’inflammation [2]. Ces actions sont assurées par l’activation de récepteurs à sept domaines transmembranaires couplés aux protéines G. La position de deux cystéines amino-terminales (contiguës ou non) dans la structure de la chimiokine définit la famille du ligand (CCL, CXCL, CX3CL) et le type de récepteur qui le reconnaît (CCR, CXCR, CX3CR). Un des membres de la famille CXCL, identifié chez la souris dans une lignée de cellules stromales de la moelle osseuse, a été pour cette raison appelé SDF1 (stromal-cell derived factor 1). Outre son puissant pouvoir attractif sur les lymphocytes [3], SDF1 intervient, via son récepteur CXCR4, aux stades précoces de la lymphopoïèse des cellules B et lors de la colonisation de la moelle osseuse par des cellules hématopoïétiques multipotentes [4].
Outre leur fonction dans l’hématopoïèse, le récepteur CXCR4 et son ligand SDF1 ont récemment été mis en cause dans d’autres processus impliquant des migrations cellulaires. Dans le système nerveux central, le couple SDF1-CXCR4 contrôle la migration des cellules granulaires du cervelet [5] et du gyrus denté [6]. Un autre aspect de la migration cellulaire dirigée est la formation de métastases cancéreuses. Il est maintenant admis que l’essaimage de cellules métastatiques ne se fait pas de façon aléatoire, mais bien vers des sites privilégiés pour chaque type de cancer [7]. Les cellules de cancer du sein, par exemple, essaiment préférentiellement au niveau des poumons et de la moelle osseuse, après un passage obligé dans les ganglions lymphatiques. On a récemment montré que l’expression du gène cxcr4 par les cellules malignes de cancer du sein coïncide avec leur potentiel invasif, et que les sites préférentiels d’implantation de métastases expriment fortement le gène sdf1. De plus, l’administration d’anticorps bloquant la fonction du récepteur CXCR4 diminue drastiquement l’apparition de ces métastases dans un modèle murin de tumeur du sein [8].
Le déterminisme du comportement migratoire est difficile à étudier directement dans la cellule cancéreuse, compte tenu des difficultés qu’il y a à repérer l’émergence de ce comportement. L’utilisation d’autres modèles, plus simples et mieux définis, pourrait permettre d’étudier plus commodément les mécanismes fondamentaux mis en jeu, et leur contrôle génétique. Parmi ces modèles, le poisson-zèbre combine une série d’avantages pour l’étude génétique du développement (mutagenèse à grande échelle, transgenèse, séquençage du génome, systèmes d’inactivation et d’expression ectopique). Deux articles parus en 2002 démontrent le rôle crucial du couple SDF1-CXCR4 dans la migration des cellules primordiales germinales (CPG) chez cet organisme [9, 10]. Les CPG naissent de façon aléatoire dans différentes parties du corps, puis s’agrègent avant de migrer vers la future gonade. L’inactivation de l’un ou l’autre des deux gènes, sdf1 ou cxcr4, provoque une dispersion anormale des CPG, qui ne sont pas correctement dirigées. Ce résultat est à rapprocher des similitudes démontrées chez le poulet entre migration des cellules germinales et mouvements leucocytaires [11].
Un troisième article, publié par notre groupe, démontre le rôle de SDF1-CXCR4 dans un tout autre système de migration cellulaire, la mise en place de la ligne latérale du poisson-zèbre ((→) m/s 2003, n°5, p.575). La ligne latérale est un système mécanosensoriel, présent à la surface du corps des poissons et des amphibiens, formé d’un ensemble d’organes sensoriels individualisés, les neuromastes. Ce système permet au poisson de percevoir les mouvements de l’eau environnante, lui conférant une véritable forme de «toucher à distance» dans un milieu dans lequel la visibilité est faible. Une ébauche de ce système est mise en place durant l’embryogenèse par un primordium dérivé d’une placode céphalique, qui migre selon un trajet stéréotypé le long des flancs du poisson (Figure 1A). Ce primordium dépose à intervalles réguliers 6 à 8 groupes de cellules qui se différencient chacun en un neuromaste (Figure 1B).
Figure 1
La ligne latérale postérieure chez le poisson-zèbre.
A. Trajet du primordium de la ligne latérale postérieure (pointillé rouge). B. La ligne latérale embryonnaire est complète à 48 h de développement et comprend 6 à 8 neuromastes (indiqués en bleu) sur sa branche postérieure (L1 à L6-7).
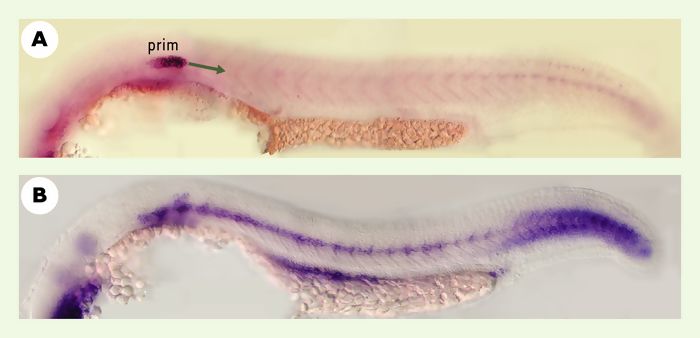
Notre étude a montré que le gène sdf1a, qui code pour l’homologue de SDF1, est exprimé dans une bande de cellules préfigurant exactement le trajet que suit le primordium (Figure 2B), alors que le gène cxcr4b, codant pour l’homologue du récepteur CXCR4, est exprimé dans le primordium (Figure2A). De plus, l’expression de cxcr4b décroît dans les cellules qui vont être déposées et formeront un neuromaste. Enfin, l’inactivation de l’un ou l’autre des deux gènes, cxcr4b ou sdf1a, inhibe la migration du primordium et abolit la formation des neuromastes [12].
Figure 2
Profils d’expression de crxcr4b et sfd1a.
A. Le gène cxcr4b est exprimé dans le primordium de la ligne latérale (prim) dès le début de sa migration à 25 h. B. Expression de sdf1a au même moment, le long du trajet que va suivre le primordium.
La grande simplicité, la définition et l’accessibilité du système de la ligne latérale du poisson-zèbre en font un modèle de choix pour l’étude de l’interaction SDF1-CXCR4. Il pourrait permettre de mieux comprendre le processus de migration lui-même. Alors que dans le cas du chimiotactisme des lymphocytes, SDF1 paraît jouer un rôle attractif, dans le cas du primordium de la ligne latérale, il ne semble pas être question de gradient attirant les cellules par chimiotactisme. Dans notre modèle, SDF1-CXCR4 est nécessaire au guidage des cellules, et aussi probablement au démarrage du mouvement cellulaire, peut-être en intervenant dans la différenciation des cellules. S’agit-il de deux modes d’action différents, ou bien doit-on réexaminer l’action de SDF1 sur les lymphocytes à la lumière de ces résultats récents ? En dehors de son intérêt pour l’approfondissement de nos connaissances, ce système pourrait également permettre le criblage in vivo rapide et efficace de molécules antagonistes. Cela est d’autant plus intéressant que CXCR4 est un corécepteur majeur du VIH-1 in vivo, nécessaire à l’entrée du virus dans sa cellule hôte CD4+ [13]. Les inhibiteurs du récepteur CXCR4 pourraient donc devenir de nouveaux outils thérapeutiques majeurs.
Appendices
Références
- 1. Yoshimura T, Matsushima K, Tanaka S, et al. Purification of a human monocyte derived neutrophil chemotactic factor that has peptide sequence similarity to other host defense cytokines. Proc Natl Acad Sci USA 1987 ; 84 : 9233-7.
- 2. Murphy PM. Chemokine receptors : structure, function and role in microbial pathogenesis. Growth Factor Rev 1996 ; 7 : 47-64.
- 3. Bleul CC, Fuhlbrigge RC, Casasnovas JM, Aiuti A, Springer TA. A highly efficacious lymphocyte chemoattractant, stromal-cell derived factor 1 (SDF1). J Exp Med 1996 ; 184 : 1101-9.
- 4. Nagasawa T, Hirota S, Tachibana K, et al. Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1. Nature 382 : 635-8.
- 5. Zou YR, Kottman AH, Kuroda M, Taniuchi I, Littman DR. Function of the chemokine receptor CXCR4 in haematopoiesis and in cerebellar development. Nature 1998 ; 393 : 595-9.
- 6. Bagri A, Gurney T, He X, et al. The chemokine SDF1 regulates migration of dentate granule cells. Development 2002 ; 129 : 4249-60.
- 7. Moore MAS. The role of chemoattraction in cancer metastases. BioEssays 2001 ; 23 : 674-6.
- 8. Müller A, Homey B, Soto H, et al. Involvement of chemokine receptors in breast cancer metastasis Nature 2001 ; 410 : 50-6.
- 9. Doitsidou M, Reichman-Fried M, Stebler J, et al. Guidance of primordial germ-cell migration by the chemokine SDF-1. Cell 2002 ; 111 : 647-59.
- 10. Knaut H, Werz C, Geisler R, Nüsslein-Volhard C. Tübingen 2000 screen consortium. A zebrafish homologue of the chemokine receptor CXCR4 is a germ-cell guidance receptor. Nature 2003 ; 421 : 279-82.
- 11. Kuwana T, Rogulska T. Migratory mechanisms of chick primordial germ cells toward gonadal anlage. Cell Mol Biol 1999 ; 45 : 725-36.
- 12. David NB, Sapède D, Saint-Etienne L, et al. Molecular basis of cell migration in the fish lateral line: role of the chemokine receptor CXCR4 and of its ligand, SDF1. Proc Natl Acad Sci USA 2002 ; 99 : 16297-302.
- 13. Bleul CC, Farzan M, Choe H, et al. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature 1996 ; 382 : 829-33.
List of figures
Figure 1
La ligne latérale postérieure chez le poisson-zèbre.
Figure 2
Profils d’expression de crxcr4b et sfd1a.