Abstracts
Résumé
Pin1 est une peptidyl-prolyl isomérase (PPIase) catalysant l’isomérisation cis/trans de certains liens peptidiques précédant une proline. L’impact d’une telle modification peut représenter un changement structural important et impliquer une modulation des propriétés d’une protéine. Pin1 est impliquée à différents stades du cycle cellulaire et est nécessaire à l’entrée en mitose. Parmi les cibles de Pin1, plusieurs protéines comme p53, Cdc25C, Myt1 et Wee1 sont associées au cycle cellulaire, d’autres comme Rpb1 et Spt5 sont impliquées dans la transcription. Une autre cible de Pin1, la protéine tau, joue un rôle déterminant dans la pathogénie de la maladie d’Alzheimer. Le rôle précis de l’interaction de Pin1 avec ses cibles reste encore méconnu. Cependant, un nouveau mécanisme semble émerger, dans lequel Pin1 jouerait un rôle de modulateur de la déphosphorylation de certaines protéines par des phosphatases trans-spécifiques
Abstract
Peptidyl-prolyl isomerases (PPIases) are chaperone enzymes which alter the peptide bond between a given amino acid and a proline, changing it from the cis to the trans conformation and vice versa. This modification can cause dramatic structural modifications which can affect the properties of targeted proteins. The ubiquitous PPIase Pin1, conserved from yeast to human, has been shown to be necessary for entry into mitosis. The yeast homologue, Ess1, is essential for cell survival. Pin1 possesses a WW domain which specificaly recognizes pSer-Pro and pThr-Pro motifs in which the first amino acid is phosphorylated. Pin1 binds to many proteins implicated in cell cycle regulation (e.g. p53, Myt1, Wee1, and Cdc25C). Pin1 also targets tau, a protein forming part of the neuronal cytoskeleton which is hyperphosphorylated in patients suffering from Alzheimer’s disease (AD). Pin1 could, therefore, be involved in the pathogenesis of AD. Furthermore, Pin1 also binds two proteins involved in transcription: Rpb1, the largest subunit of RNA polymerase II and Spt5, a regulator of the elongation of transcription. Both these proteins possess domains rich in S/T-P motifs which can be targeted by Pin1 when phosphorylated. Recent studies show that Pin1 modulates the dephosphorylation of some proteins by allowing trans-specific phosphatases to recognize their target after isomerization. This unexpected role might allow protein regulation via peptidyl-prolyl isomerase activity.
Article body
Au sein de la cellule, de multiples protéines sont impliquées dans le repliement correct de leurs congénères. Le rôle de ces chaperons moléculaires est nécessaire au bon fonctionnement de la cellule. Les protéines de choc thermique constituent sans aucun doute le groupe de protéines chaperons ayant fait l’objet du plus grand nombre d’études [1]. Moins connues, les enzymes de la famille des disulfure isomérases catalysent la formation et la rupture des ponts disulfures entre les résidus cystéines d’une chaîne polypeptidique, permettant aux protéines d’acquérir une structure tridimensionnelle précise dont dépendra leur activité [2].
Une autre famille de protéines chaperons regroupe les peptidyl-prolyl isomérases (PPIases), enzymes ubiquitaires impliquées dans le repliement et la translocation des protéines, ainsi que dans la transduction de signaux [3]. Ces enzymes catalysent la conversion, naturellement lente, du lien peptidique précédant une proline d’une conformation cis à une conformation trans ou inversement. En raison de l’encombrement stérique engendré par les chaînes latérales des acides aminés et du caractère partiel de liaison double existant entre le carbone et l’azote qui entrave leur rotation libre, les liens peptidiques adoptent naturellement une conformation trans, énergétiquement plus favorable (Figure 1A). Toutefois, la liaison peptidique impliquant une proline fait exception à cette règle, étant donné que le résidu prolyl forme un cycle pyrrolidine intégré à la chaîne peptidique. Ainsi, près de 7 % des liaisons impliquant une proline sont sous forme cis [3]. Comme le changement d’une conformation cis↔trans s’accompagne d’une modification de l’angle de la chaîne peptidique dans l’espace (Figure 1B), l’isomérisation du lien peptidyl-prolyl entraîne des répercussions non négligeables sur la structure tridimensionnelle de la protéine, et peut ainsi modifier ses propriétés. Les rôles biologiques précis des peptidyl-prolyl isomérases restent toutefois mal compris, bien qu’on ne cesse de leur découvrir de nouveaux substrats, eux-mêmes impliqués dans une grande variété de processus cellulaires.
Figure 1
Changement conformationnel catalysé par les peptidyl-prolyl isomérases.
A. Dans les protéines, la liaison peptidique se retrouve presque exclusivement en conformation trans. L’encombrement stérique des chaînes latérales des acides aminés (R) explique en partie cette préférence. Le caractère de liaison double de la liaison carbone-azote, causé par la délocalisation électronique du groupement carbonyle et donc à la formation d’un hybride de résonance, explique pourquoi la liaison est figée dans une des deux conformations. La liaison peptidique ne permettant pas de rotation libre, le passage d’une conformation à l’autre ne se fait que très lentement. B. Les peptidyl-prolyl isomérases (PPIases) provoquent une isomérisation du lien peptidyl-prolyl d’une conformation cis à trans, et inversement, ce qui aboutit à un changement d’orientation de la chaîne peptidique dans l’espace.
La première activité peptidyl-prolyl isomérase fut mise en évidence en 1984 par G. Fisher et al. [4]. À ce jour, trois familles de PPIases ont été découvertes, mais elles ne partagent aucune similitude, tant au niveau de leur séquence primaire que de leur structure tridimensionnelle [1]. Les cyclophilines, qui forment la première famille, tirent leur nom de l’affinité que possède la ciclophiline A (prototype de cette famille) pour la ciclosporine A, un polypeptide cyclique immunosuppresseur bien connu en thérapeutique. Les cyclophilines ont été conservées, au cours de l’évolution, de la bactérie à l’être humain. Les PPIases possédant une affinité pour le FK506, un autre immunosuppresseur, font partie de la deuxième famille, les FK506-binding proteins (FKBP).
À l’origine, on croyait que l’effet immunosuppresseur de la ciclosporine A et du FK506 était dû à leur inhibition de l’activité peptidyl-prolyl isomérase des cyclophilines et des FKBP. En réalité, c’est le complexe inhibiteur-PPIase qui possède un effet immunosuppresseur. Il inhibe la calcineurine, une phosphatase impliquée dans la transduction du signal qui mène à la production d’interleukine-2, stimulatrice de la prolifération des lymphocytes T.
Malgré leur grande conservation au cours de l’évolution, les cyclophilines et les FKBP ne sont pas essentielles à la vie cellulaire [5]. La seule PPIase essentielle à la survie de la levure Saccharomyces cerevisiae est la protéine Ess1 (Essential1), qui fait partie de la famille des parvulines [6]. Le prototype de cette troisième famille de PPIases, la parvuline (du latin parvulus signifiant «tout petit»), a été isolé chez Escherichia coli [7]. Les parvulines ne sont ni sensibles à la ciclosporine A, ni au FK506, mais peuvent être inhibées de façon irréversible par la juglone, une naphthoquinone isolée des feuilles et de la coque des fruits du noyer [8]. À l’instar de Ess1, son homologue humain, baptisé Pin1, est essentiel à la progression du cycle cellulaire et interagit avec de nombreuses phosphoprotéines impliquées dans différents processus cellulaires.
Structure, régulation et expression de Pin1
Pin1 (peptidyl-prolyl cis/trans isomerase NIMA-interacting 1) a été isolée en 1996, lors d’un criblage en double hybride ayant pour objectif de découvrir les partenaires d’interaction de la protéine kinase NIMA (never in mitosis A) d’Aspergillus nidulans, impliquée dans la stimulation de l’entrée en mitose. Pin1 est une protéine nucléaire de 163 acides aminés (18 kDa) co-localisée en interphase avec les granulations nucléaires (speckles) riches en facteurs d’épissage [9]. L’implication de Pin1 dans le déroulement du cycle cellulaire a été mise en évidence par l’observation selon laquelle des cellules HeLa exprimant l’ARN antisens de Pin1 présentent des phénotypes mitotiques précoces (condensation des chromosomes, fragmentation de la membrane nucléaire, formation du fuseau mitotique), mais ne peuvent plus sortir de mitose et meurent inéluctablement par apoptose. À l’inverse, les cellules surexprimant Pin1 sont bloquées à la transition G2/M.
Pin1 possède deux domaines distincts reliés par une région charnière flexible: un domaine amino-terminal de type WW et un domaine carboxy-terminal porteur de l’activité peptidyl-prolyl isomérase (Figure 2). Les domaines WW sont des modules de reconnaissance et de liaison de motifs comprenant des résidus proline. Ils tirent leur nom de la présence dans leur séquence primaire de deux tryptophanes conservés, essentiels à leur activité de liaison. Les domaines WW du groupe IV, dont fait partie le domaine de Pin1, reconnaissent spécifiquement des motifs phosphoséryl-prolyl (pS-P) et phosphothréonyl-prolyl (pT-P) [10, 11]. La phosphorylation de la sérine et de la thréonine augmente d’environ 300 fois l’affinité de Pin1 pour ces motifs, comparativement aux mêmes motifs formés de résidus non phosphorylés [12]. In vitro, Pin1 catalyse la conversion cis/trans des liens pS-P et pT-P sans nécessiter d’apport d’énergie et se lierait préférentiellement à ces motifs lorsqu’ils sont encadrés par des résidus hydrophobes ou une arginine [12]. Pin1 ne reconnaît donc pas systématiquement tous les motifs pS/pT-P d’une séquence protéique mais plutôt ce motif au sein d’un environnement précis. Cette restriction pourrait aussi découler de l’accessibilité des motifs pS/pT-P qui est tributaire de la conformation tridimensionnelle de la protéine. Par exemple, bien que les protéines Cdc25C et tau soient phosphorylées sur plus d’une douzaine de motifs S/T-P en mitose, Pin1 n’en lie que deux sur Cdc25C et qu’un seul sur tau [11]. Ainsi, les prolyl isomérisations potentielles sur les protéines cibles visent donc des sites phosphorylés bien précis pour mener à un effet spécifique.
Figure 2
Représentation schématique de la peptidyl-prolyl isomérase Pin1.
Pin1 est une protéine nucléaire de 163 acides aminés possédant deux domaines reliés entre eux par une région charnière flexible et non structurée. Le domaine WW à l’extrémité amino-terminale de la protéine renferme deux résidus tryptophane conservés, indispensables à la fixation de Pin1 à ses substrats. Le domaine PPIase est situé à l’extrémité carboxy-terminale de la protéine.
Plusieurs protéines aux rôles variés ont été identifiées comme cibles de Pin1 (Tableau I) [9, 12-24]. Toutefois, un changement structural étant difficile à mettre en évidence, il n’est pas encore certain que Pin1 exerce une activité PPIase sur chacune d’elles. Une des premières méthodes utilisées pour mettre en évidence une activité d’isomérisation cis/trans de Pin1 sur une de ses cibles a consisté à digérer Cdc25C avec des protéases sensibles aux changements de conformation causés par l’isomérisation cis/trans de liens peptidyl-proline (par exemple, chymotrypsine A, subtilisine) et à comparer les profils de digestion obtenus avant et après incubation avec Pin1 [25]. Cependant, ces observations découlent d’une technique indirecte. La preuve irréfutable d’une activité de prolyl isomérisation de Pin1 sur une protéine cible ne pourrait être obtenue que par résolution de la structure tridimensionnelle de cette protéine, approche pouvant s’avérer laborieuse.
Tableau I
Protéines cibles de Pin1 et leurs fonctions.
Outre son activité prolyl isomérase, le rôle de Pin1 pourrait se limiter simplement à la liaison de son domaine WW sur ses cibles, sans catalyser une isomérisation. Cette association simple contribuerait à masquer certains sites sur des protéines et ainsi à moduler leur activité ou leur liaison à d’autres partenaires (Figure 3). Une observation faite par l’équipe de W.G. Dunphy vient appuyer cette hypothèse [26]. En effet, la phosphorylation de la phosphatase Cdc25C par des CDK (cyclin-dependant kinases) est stimulée par une petite sous-unité, appelée CKS (cyclin-dependent kinase subunit), qui donne une spécificité de reconnaissance à la kinase en se liant à Cdc25C. Pin1 abolirait complètement cette stimulation en entrant en compétition avec CKS sur un même site de Cdc25C. L’effet antagoniste de Pin1 est, dans ce cas précis, attribuable à son domaine WW et non pas à son activité PPIase. Ainsi, Pin1 serait capable de régler la liaison de CKS et, par là même, la phosphorylation de Cdc25C. De façon similaire, la simple liaison de Pin1 à NFAT, un facteur de transcription, inhibe sa déphosphorylation par la calcineurine en bloquant son accès à NFAT [17].
Figure 3
Effets potentiels de la peptidyl-prolyl isomérase Pin1 sur ses protéines cibles.
A. La liaison de Pin1 à la protéine inhibe son activité. B. La liaison de Pin1 à la protéine empêche la liaison de celle-ci à une autre protéine. C. Un changement structural provoqué par Pin1 peut augmenter ou diminuer l’activité de la protéine, permettre ou inhiber sa liaison à d’autres protéines.
Par ailleurs, Pin1 semble elle-même être réglée par la phosphorylation au cours du cycle cellulaire. La phosphorylation de la sérine 16 de Pin1 inhiberait sa liaison à ses différents substrats [27]. Pin1 non phosphorylée sur la sérine 16 serait donc la forme catalytiquement active de l’enzyme, capable de se lier à ses cibles. Étant donné le rôle de Pin1 au cours de la mitose, ceci rendrait compte de l’augmentation observée de la forme non phosphorylée active de Pin1 à cet instant, bien que la quantité totale de Pin1 demeure stable tout au cours du cycle cellulaire [13].
Du cycle cellulaire à la maladie d’Alzheimer
Le premier rôle attribué à Pin1 a concerné son implication dans la progression du cycle cellulaire. La déplétion de Pin1 induit un arrêt de la mitose ainsi que l’apoptose, tandis que les cellules surexprimant Pin1 sont bloquées à la transition G2/M [9]. Pin1 semble aussi être requise pour le bon fonctionnement du point de contrôle de la réplication de l’ADN chez Xenopus laevis [13]. De plus, la liaison de Pin1 à plusieurs protéines mitotiques phosphorylées a été démontrée, mais la fonction de ces liaisons reste incertaine [13]: masquage de sites de reconnaissance ? Inhibition de fonction ? Changements structuraux par isomérisation ? Malgré ces incertitudes, l’expression de Pin1 est d’une façon certaine étroitement liée à la division cellulaire, puisqu’on la retrouve dans les tissus normaux en division cellulaire active et très peu dans les tissus différenciés [18].
L’activité PPIase de Pin1 a déjà été vérifiée sur deux de ses cibles: la phosphatase Cdc25C et tau, une protéine associée aux microtubules [25, 28]. Cette découverte a permis de mettre en évidence un nouveau type de régulation de la déphosphorylation. En effet, la prolyl isomérisation de certaines liaisons pS/pT-P sur Cdc25C et sur tau par Pin1 rendent celles-ci plus sensibles à la déphosphorylation par une autre phosphatase, la PP2A, qui déphosphoryle les résidus du motif en conformation trans. PP2A est donc la première phosphatase pour laquelle une préférence pour un isomère d’une liaison peptidyl-prolyl est démontrée. L’activité prolyl isomérase de Pin1 réglerait ainsi négativement Cdc25C en stimulant sa déphosphorylation. La forme non phosphorylée et inactive de Cdc25C ne pourrait donc plus activer Cdk1 (Cdc2), qui est la kinase majeure responsable de la cascade de phosphorylation menant à la mitose, ce qui expliquerait pourquoi la surexpression de Pin1 mène à l’arrêt du cycle cellulaire lors de la transition G2/M.
Afin de déterminer l’importance physiologique de Pin1, des souris transgéniques Pin1–/– ont été produites. Compte tenu des effets délétères de la déplétion de Pin1 dans les cellules en culture, on s’attendrait à ce que les souris Pin1–/–soient fortement affectées. De façon surprenante, la délétion de Pin1 n’est pas létale [29], ce qui pourrait être expliqué par la présence d’autres PPIases pouvant pallier son absence [30]. Les souris transgéniques Pin1–/– sont toutefois atteintes d’anomalies diverses liées à des problèmes de prolifération cellulaire, dont une diminution du poids corporel et des atrophies testiculaires et rétiniennes [20]. Ces anomalies étant également caractéristiques des souris déficientes en cycline D1, il a été suggéré que Pin1 interviendrait aussi dans la régulation positive de cette cycline, cruciale dans la transition G1/S du cycle cellulaire. De fait, il a récemment été démontré que Pin1 joue un rôle critique dans la régulation de la cycline D1 [18, 20]: par sa liaison à deux facteurs de transcription, c-Jun et la β-caténine, Pin1 stimule l’expression du gène de la cycline D1. De plus, en se liant directement à la cycline D1, Pin1 permet sa stabilisation post-traductionnelle et son accumulation dans le noyau.
Puisque la surexpression de la cycline D1 joue un rôle clé dans l’oncogenèse en contribuant à la transformation cellulaire [18], ces observations apportent un éclairage nouveau sur les conséquences de la surexpression de Pin1 observée dans plusieurs cancers, dont celui du sein. Pin1 est majoritairement phosphorylée (forme inactive) dans les tissus mammaires sains, contrairement aux tissus mammaires cancéreux où la forme surexprimée de Pin1 est principalement non phosphorylée (forme catalytiquement active) [18]. Le niveau élevé d’expression de la forme active de Pin1 serait donc associé à une expression élevée de cycline D1 dans les cancers du sein et, par conséquent, à une transformation cellulaire.
Une contradiction existe cependant entre les résultats des expérimentations de surexpression in vivo de Pin1 et les modèles de cellules cancéreuses surexprimant naturellement la protéine. Alors que Pin1 empêche l’entrée en mitose des cellules transfectées, la même protéine surexprimée naturellement dans les cellules cancéreuses semble promouvoir leur réplication. Ce paradoxe apparent pourrait s’expliquer si la surexpression dans les cellules transfectées est supérieure à celle d’une cellule cancéreuse. Pin1 pourrait alors avoir un effet pro-mitotique lorsqu’elle est modérément surexprimée, et un effet anti-mitotique toxique lorsqu’elle est exprimée en trop grande quantité.
Récemment, deux groupes de chercheurs ont démontré l’importance de Pin1 dans la régulation du cycle cellulaire. L’activité prolyl isomérase de Pin1 serait en effet cruciale à l’activation de p53 [38, 39]. Cette protéine joue le rôle de «chien de garde» veillant à la non-prolifération de cellules affectées par une cassure d’ADN et pouvant potentiellement s’avérer cancéreuses. Trois acides aminés phospho-accepteurs (Ser 33, Thr 81 et Ser 315) de p53 sont requis pour l’interaction avec Pin1. Par ailleurs, les domaines WW et PPIase de Pin1 sont tous deux nécessaires à l’activation de p53. La prolyl isomérisation de p53 pourrait induire une modification structurale qui activerait sa fonction de facteur de transcription. Le rôle protecteur de p53 serait ainsi tributaire de l’activité de Pin1.
Tau, une autre protéine reconnue par Pin1, semble être impliquée dans la pathogénie de la maladie d’Alzheimer ((→) m/s 2002, n°6-7, p.727). Dans les neurones de personnes atteintes, on observe la formation d’enchevêtrements de neurofibrilles constitués d’une forme hyperphosphorylée de la protéine tau [31]. Ces enchevêtrements sont corrélés aux pertes cognitives et mnésiques des patients atteints de la maladie d’Alzheimer [32]. En effet, la protéine tau sous forme hyperphosphorylée est incapable d’accomplir sa fonction essentielle qui est de stabiliser les microtubules servant au transport des molécules dans le neurone [33, 34]. Or, un groupe de chercheurs a récemment démontré que Pin1 pouvait isomériser la protéine tau phosphorylée et la rendre susceptible à la déphosphorylation par la PP2A, rétablissant ainsi sa fonctionnalité [28]. Dans la maladie d’Alzheimer, l’hyperphosphorylation de tau (et de nombreuses autres protéines normalement phosphorylées durant la mitose) provoquerait une déplétion intracellulaire de Pin1 soluble, ce qui induirait la mort neuronale [15]. Ainsi, Pin1 régulariserait la fonction de phosphoprotéines comme tau dans un neurone normal, mais l’équilibre entre Pin1 et ces phosphoprotéines serait rompu dans le développement de la maladie d’Alzheimer, ce qui mènerait à la séquestration de Pin1 dans une fraction insoluble non fonctionnelle [40]. L’implication de Pin1 dans l’étiologie de la maladie d’Alzheimer fait aujourd’hui l’objet de recherches et pourrait constituer une voie intéressante dans le développement éventuel d’un traitement.
Pin1 comme régulateur transcriptionnel
La majorité des protéines reconnues par Pin1 sont des phosphoprotéines impliquées dans la mitose. Toutefois, quelques protéines phosphorylées en interphase se sont avérées être des cibles de Pin1. Outre la kinase Wee1, nous avons démontré que Rpb1, la plus grande sous-unité de l’ARN polymérase II, ainsi que Spt5, la plus grande sous-unité du facteur DSIF (DRB-sensitivity inducing factor) se lient à Pin1 en interphase [23, 24]. Rpb1 et Spt5 sont deux protéines impliquées dans la machinerie de transcription. Elles possèdent toutes deux des domaines composés d’un très grand nombre de motifs S-P et T-P.
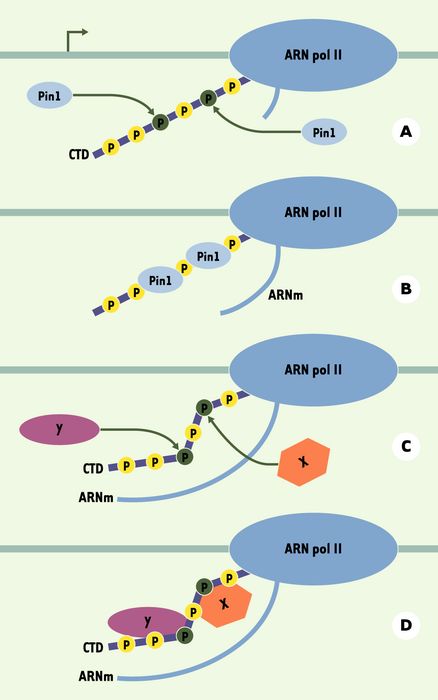
Le domaine carboxy-terminal (CTD) de Rpb1 est formé de 52 répétitions de l’heptapeptide YSPTSPS chez les mammifères [35] (Figure 4). Celui-ci est hyperphosphorylé lors de l’élongation de la transcription et joue un rôle capital dans l’expression des gènes en servant de plate-forme d’assemblage pour différents facteurs intervenant au cours de la transcription. La liaison de Ess1 au CTD phosphorylé a également été démontrée dans la levure [36]. Pin1 pourrait ainsi jouer un rôle important dans la régulation de la transcription. On peut spéculer sur l’impact d’un changement structural du CTD phosphorylé provoqué par Pin1 sur le recrutement d’autres facteurs (d’épissage, de clivage, de polyadénylation) ou encore sur la susceptibilité du CTD vis-à-vis d’autres enzymes de modification (kinases, phosphatases, ubiquitine ligases) (Figure 5).
Figure 4
Rpb1 et Spt5 possèdent des domaines carboxy-terminaux (CTD) semblables, riches en motifs S-P et T-P, reconnus par Pin1.
Le CTD de Rpb1 est composé de 52 répétitions de la séquence consensus YSPTSPS pouvant être phosphorylée par différentes kinases. Les domaines CTR1 (C-terminal repeat) et CTR2 de Spt5 sont composés de répétitions de deux séquences consensus pouvant elles aussi être phosphorylées.
Figure 5
La prolyl isomérisation du domaine carboxy-terminal (CTD) de Rpb1 pourrait aboutir à une modulation de ses propriétés.
A. La peptidyl-prolyl isomérase Pin1 reconnaît certains motifs sur le CTD phosphorylé de la plus grande sous-unité de l’ARN polymérase II. B. Pin1 se fixe à ces motifs et effectue une prolyl isomérisation de certains liens pS-P ou pT-P du CTD, induisant un changement structural. C et D. Les changements structuraux du CTD produits par la fixation de Pin1 pourraient permettre la liaison de certaines protéines (X et Y). Les protéines (X et Y) candidates à la fixation au CTD après son remodelage peuvent être des phosphatases, des facteurs d’épissage, des facteurs de maturation des ARNm (coiffage, polyadénylation, clivage), des kinases, des ubiquitine ligases.
La protéine Spt5 interagit elle aussi avec Pin1 [24]. Spt5 est un régulateur de l’élongation de la transcription et possède deux domaines, CTR1 (C-terminal repeat 1) et CTR2, riches en motifs S-P et T-P pouvant être phosphorylés par la kinase Cdk9 [24] (Figure 4). L’interaction de Pin1 avec le CTR1 et le CTR2 phosphorylés pourrait jouer un rôle dans la déphosphorylation subséquente de Spt5 par une phosphatase trans spécifique. Pin1 pourrait ainsi participer au recyclage de Spt5 sous forme non phosphorylée, ou bien encore moduler l’activité de Spt5 lors du processus transcriptionnel, en contrôlant ses propriétés de liaison.
Conclusions
Bien que la phosphorylation des protéines soit considérée comme un élément majeur de la modulation de leurs fonctions, il semble maintenant que cette phosphorylation ne soit parfois qu’une étape menant à l’action d’autres enzymes de modification possédant des domaines de reconnaissance de motifs phosphorylés. Pin1 possède à la fois une activité prolyl isomérase et un domaine WW reconnaissant des sites phosphorylés précis. La prolyl isomérisation de phosphoprotéines par Pin1 pourrait donc représenter un mode de régulation précis et efficace. L’étude de l’implication de Pin1 dans différents processus cellulaires ne fait que commencer, mais elle nous a déjà surpris à bien des égards en révélant l’existence de nouveaux mécanismes de régulation de l’activité cellulaire jusqu’ici insoupçonnés.
La modulation de la susceptibilité à la déphosphorylation des protéines par des phosphatases trans spécifiques semble constituer une piste fort intéressante. L’effet antagoniste de Pin1 sur la phosphorylation des régulateurs mitotiques Cdc25C, Myt1 et Wee1 par la Cdk1/cycline B [26], ainsi que l’effet pro-mitotique de la déplétion intracellulaire de Pin1 suggèrent que Pin1 stimulerait la déphosphorylation de protéines ayant un rôle clé dans la régulation du cycle cellulaire, tant au niveau du contrôle de la réplication que du contrôle de la transition G2/M et de la sortie de la mitose [37]. La progression du cycle cellulaire, qui implique la régulation étroite de la cycline D1 par Pin1, constitue également une voie de recherche prometteuse pouvant mener à une meilleure compréhension du processus d’oncogenèse et à la découverte de nouvelles thérapies contre le cancer. Malgré les nombreuses avancées sur la compréhension du rôle de Pin1, de nombreuses questions demeurent en suspens. Récemment, la découverte de l’implication de Pin1 dans la régulation de l’activité de p53 a démontré l’importance de la prolyl isomérisation de phosphoprotéines dans la modulation de leur activité et l’impact considérable et probablement sous-estimé de celle-ci sur la physiologie cellulaire.
Appendices
Remerciements
Les auteurs tiennent à remercier Olivier Bensaude, Andrew Coughlan, Marie-Françoise Dubois et Benoît Palancade pour la lecture critique du manuscrit.
Références
- 1. Gething MJ. Guidebook to molecular chaperones and protein-folding catalysts. Oxford : Sambrook and Tooze Publication. Oxford University Press, 1997 : 554 p.
- 2. Ferrari DM, Söling HD. The protein disulphide-isomerase family: unravelling a string of folds. Biochem J 1999 ; 339: 1-10.
- 3. Schmid FX. Prolyl isomerase: enzymatic catalysis of slow protein-folding reactions. Annu Rev Biophys Biomol Struct 1993; 22 : 123-43.
- 4. Fischer G, Bang H, Mech C. Detection of enzyme catalysis for cis-trans isomerization of peptide bonds using proline containing peptides as substrates. Biochem Biomed Acta 1984 ; 43 : 1101-12.
- 5. Dolinski K, Muir S, Cardenas M, Heitman J. All cyclophilins and FK506 binding proteins are, individually and collectively, dispensable for viability in Saccharomyces cerevisiae. Proc Natl Acad Sci USA 1997 ; 94 : 13093-8.
- 6. Hanes SD, Shank PR, Bostian KA. Sequence and mutational analysis of ESS1, a gene essential for growth in Saccharomyces cerevisiae. Yeast 1989 ; 5 : 55-72.
- 7. Rahfeld JU, Rucknagel KP, Schelbert B, et al. Confirmation of the existence of a third family among peptidyl-prolyl cis/trans isomerases. Amino acid sequence and recombinant production of parvulin. FEBS Lett 1994 ; 352 : 180-4.
- 8. Hennig L, Christner C, Kipping M, et al. Selective inactivation of parvulin-like peptidyl-prolyl cis/trans isomerases by juglone. Biochemistry 1998; 37 : 5953-60.
- 9. Lu KP, Hanes SD, Hunter T. A human peptidyl-prolyl isomerase essential for regulation of mitosis. Nature 1996 ; 380 : 544-7.
- 10. Lu PJ, Zhou XZ, Shen M, Lu KP. Function of WW domains as phosphoserine- or phosphothreonine-binding modules. Science 1999 ; 283 : 1325-8.
- 11. Verdecia MA, Bowman ME, Lu KP, Hunter T, Noel JP. Structural basis for phosphoserine-proline recognition by group IV WW domains. Nat Struct Biol 2000 ; 7 : 639-43.
- 12. Yaffe MB, Schutkowski M, Shen M, et al. Sequence-specific and phosphorylation-dependent proline isomerization : a potential mitotic regulatory mechanism. Science 1997 ; 278 : 1957-60.
- 13. Shen M, Stukenberg PT, Kirschner MW, Lu KP. The essential mitotic peptidyl-prolyl isomerase Pin1 binds and regulates mitosis-specific phosphoproteins. Genes Dev 1998 ; 12 : 706-20.
- 14. Crenshaw DG, Yang J, Means AR, Kornbluth S. The mitotic peptidyl-prolyl isomerase, Pin1, interacts with Cdc25 and Plx1. Embo J 1998 ; 17 : 1315-27.
- 15. Lu PJ, Wulf G, Zhou XZ, Davies P, Lu KP. The prolyl isomerase Pin1 restores the function of Alzheimer-associated phosphorylated tau protein. Nature 1999 ; 399 : 784-8.
- 16. Pathan N, Aime-Sempe C, Kitada S, Haldar S, Reed JC. Microtubule-targeting drugs induce Bcl-2 phosphorylation and association with Pin1. Neoplasia 2001 ; 3 : 70-9.
- 17. Liu W, Youn HD, Zhou XZ, Lu KP, Liu JO. Binding and regulation of the transcription factor NFAT by the peptidyl prolyl cis-trans isomerase Pin1. FEBS Lett 2001 ; 496 : 105-8.
- 18. Wulf GM, Ryo A, Wulf GG, et al. Pin1 is overexpressed in breast cancer and cooperates with Ras signaling in increasing the transcriptional activity of c-Jun towards cyclin D1. EMBO J 2001 ; 20 : 3459-72.
- 19. Ryo A, Nakamura M, Wulf G, Liou YC, Lu KP. Pin1 regulates turnover and subcellular localization of beta-catenin by inhibiting its interaction with APC. Nat Cell Biol 2001 ; 3 : 793-801.
- 20. Liou YC, Ryo A, Huang HK, et al. Loss of Pin1 function in the mouse causes phenotypes resembling cyclin D1-null phenotypes. Proc Natl Acad Sci USA 2002 ; 99 : 1335-40.
- 21. Kamimoto T, Zama T, Aoki R, Muro Y, Hagiwara M. Identification of a novel kinesin-related protein, KRMP1, as a target for mitotic peptidyl-prolyl isomerase Pin1. J Biol Chem 2001 ; 276 : 37520-8.
- 22. He J, Lau AG, Yaffe MB, Hall RA. Phosphorylation and cell cycle-dependent regulation of Na+/H+ exchanger regulatory factor-1 by Cdc2 kinase. J Biol Chem 2001 ; 276 : 41559-65.
- 23. Albert A, Lavoie S, Vincent M. A hyperphosphorylated form of RNA polymerase II is the major interphase antigen of the phosphoprotein antibody MPM-2 and interacts with the peptidyl-prolyl isomerase Pin1. J Cell Sci 1999 ; 112 : 2493-500.
- 24. Lavoie SB, Albert AL, Handa H, Vincent M, Bensaude O. The peptidyl-prolyl isomerase Pin1 interacts with hSpt5 phosphorylated by Cdk9. J Mol Biol 2001 ; 312 : 675-85.
- 25. Stukenberg PT, Kirschner MW. Pin1 acts catalytically to promote a conformational change in Cdc25. Mol Cell 2001 ; 7 : 1071-83.
- 26. Patra D, Wang SX, Kumagai A, Dunphy WG. The xenopus Suc1/Cks protein promotes the phosphorylation of G(2)/M regulators. J Biol Chem 1999 ; 274 : 36839-42.
- 27. Lu PJ, Zhou XZ, Liou YC, Noel JP, Lu KP. Critical role of WW domain phosphorylation in regulating phosphoserine binding activity and Pin1 function. J Biol Chem 2002 ; 277 : 2381-4.
- 28. Zhou XZ, Kops O, Werner A, et al. Pin1-dependent prolyl isomerization regulates dephosphorylation of Cdc25C and tau proteins. Mol Cell 2000 ; 6 : 873-83.
- 29. Fujimori F, Takahashi K, Uchida C, Uchida T. Mice lacking Pin1 develop normally, but are defective in entering cell cycle from G(0) arrest. Biochem Biophys Res Commun 1999 ; 265 : 658-63.
- 30. Fujimori F, Gunji W, Kikuchi J, et al. Crosstalk of prolyl isomerases, Pin1/Ess1, and cyclophilin A. Biochem Biophys Res Commun 2001 ; 289 : 181-90.
- 31. Iqbal K, Alonso AC, Gong CX, et al. Mechanisms of neurofibrillary degeneration and the formation of neurofibrillary tangles. J Neural Tansm 1998 ; 53 (suppl) : 169-80.
- 32. Spillantini MG, Goedert M. Tau protein pathology in neurogenerative diseases. Trends Neurosci 1998 ; 21 : 428-33.
- 33. Bramblett GT, Goedert M, Jakes R, et al. Abnormal tau phosphorylation at Ser396 in Alzheimer's disease recapitulates development and contributes to reduced microtubule binding. Neuron 1993 ; 10 : 1089-99.
- 34. Mandelkow E, Song YH, Schweers O, Marx A, Mandelkow EM. On the structure of microtubules, tau, and paired helical filaments. Neurobiol Aging 1995 ; 16 : 347-54.
- 35. Bensaude O, Bellier S, Dubois MF. Le domaine carboxy-terminal (CTD) de l'ARN polymérase II : un pivot du métabolisme des ARN messagers en général et du VIH en particulier. Med Sci 1998 ; 14 : 167-74.
- 36. Morris DP, Phatnani HP, Greenleaf AL. Phospho-carboxyl-terminal domain binding and the role of a prolyl isomerase in pre-mRNA 3'-end formation. J Biol Chem 1999 ; 274 : 31583-7.
- 37. Winkler KE, Swenson KI, Kornbluth S, Means AR. Requirement of the prolyl isomerase Pin1 for the replication checkpoint. Science 2000 ; 287 : 1644-7.
- 38. Zacchi P, Gostissa M, UchidaT, et al. The prolyl isomerase Pin1 reveals a mechanism to control p53 functions after genotoxic insults.Nature 2002; 419: 853-7.
- 39. Zheng H, You H, Zhou XZ, et al.The prolyl isomerase Pin1 is a regulator of p53 in genotoxic response.Nature 2002; 419: 849-53.
- 40. Lu KP, Liou YC, Vincent I. Proline-directed phosphorylation and isomerization in mitotic regulation and in Alzheimer’s Disease. BioEssays 2003 ; 25 : 174-81.
List of figures
Figure 1
Changement conformationnel catalysé par les peptidyl-prolyl isomérases.
A. Dans les protéines, la liaison peptidique se retrouve presque exclusivement en conformation trans. L’encombrement stérique des chaînes latérales des acides aminés (R) explique en partie cette préférence. Le caractère de liaison double de la liaison carbone-azote, causé par la délocalisation électronique du groupement carbonyle et donc à la formation d’un hybride de résonance, explique pourquoi la liaison est figée dans une des deux conformations. La liaison peptidique ne permettant pas de rotation libre, le passage d’une conformation à l’autre ne se fait que très lentement. B. Les peptidyl-prolyl isomérases (PPIases) provoquent une isomérisation du lien peptidyl-prolyl d’une conformation cis à trans, et inversement, ce qui aboutit à un changement d’orientation de la chaîne peptidique dans l’espace.
Figure 2
Représentation schématique de la peptidyl-prolyl isomérase Pin1.
Pin1 est une protéine nucléaire de 163 acides aminés possédant deux domaines reliés entre eux par une région charnière flexible et non structurée. Le domaine WW à l’extrémité amino-terminale de la protéine renferme deux résidus tryptophane conservés, indispensables à la fixation de Pin1 à ses substrats. Le domaine PPIase est situé à l’extrémité carboxy-terminale de la protéine.
Figure 3
Effets potentiels de la peptidyl-prolyl isomérase Pin1 sur ses protéines cibles.
Figure 4
Rpb1 et Spt5 possèdent des domaines carboxy-terminaux (CTD) semblables, riches en motifs S-P et T-P, reconnus par Pin1.
Figure 5
La prolyl isomérisation du domaine carboxy-terminal (CTD) de Rpb1 pourrait aboutir à une modulation de ses propriétés.
A. La peptidyl-prolyl isomérase Pin1 reconnaît certains motifs sur le CTD phosphorylé de la plus grande sous-unité de l’ARN polymérase II. B. Pin1 se fixe à ces motifs et effectue une prolyl isomérisation de certains liens pS-P ou pT-P du CTD, induisant un changement structural. C et D. Les changements structuraux du CTD produits par la fixation de Pin1 pourraient permettre la liaison de certaines protéines (X et Y). Les protéines (X et Y) candidates à la fixation au CTD après son remodelage peuvent être des phosphatases, des facteurs d’épissage, des facteurs de maturation des ARNm (coiffage, polyadénylation, clivage), des kinases, des ubiquitine ligases.
List of tables
Tableau I
Protéines cibles de Pin1 et leurs fonctions.