Article body
Le moustique Culex pipiens est présent en zones tropicales et tempérées. Sa nuisance due aux piqûres et aux maladies qu’il véhicule (filariose, fièvre du Nil…) a poussé l’homme à le combattre activement dans de nombreux pays à l’aide d’insecticides. Au cours des dernières décennies, Culex pipiens a développé des résistances à une grande variété d’insecticides (DDT, pyréthrinoïdes, carbamates, organophosphorés, toxines de Bacillus sphaericus, etc.).
La résistance aux insecticides organophosphorés (OP) représente un excellent modèle d’étude de l’adaptation à un nouvel environnement. Ces insecticides inhibent l’acétylcholinestérase, enzyme responsable de l’hydrolyse de l’acétylcholine dans les synapses cholinergiques (Figure 1). Cette inhibition prolonge la durée de l’influx nerveux, ce qui conduit rapidement à la mort du moustique. Développer une résistance à ces toxiques implique donc de supprimer ou de diminuer l’inhibition de l’acétylcholinestérase des synapses. L’étude des différents phénotypes de résistance et des changements génétiques qui leur sont associés permet d’appréhender finement comment se fait cette adaptation et comment elle se modifie au cours du temps [1].
Figure 1
Rôle de l’acétylcholinestérase1 (AChE1) dans la transmission synaptique.
A. Situation d’un moustique sensible sans insecticides. L’AChE1 dégrade l’excès d’acétylcholine dans la synapse. B. Situation d’un moustique sensible en présence d’insecticides (OP). Les insecticides inhibent l’AChE1 qui ne dégrade plus suffisamment l’acétylcholine, ce qui conduit à un prolongement toxique de l’influx nerveux. C. Situation d’un moustique résistant en présence d’insecticides. Les OP n’inhibent plus l’AChE1 modifiée. En revanche, l’acétylcholine est moins bien dégradée par l’enzyme mutée que par l’enzyme sauvage, ce qui conduit à une transmission du signal non optimale.
Il est important de comprendre que le moustique ne mute pas pour résister aux insecticides ! De très nom- breuses mutations préexistent dans les immenses populations de moustiques. Lorsque des insecticides sont présents dans l’environnement, les moustiques qui ont des mutations favorables à leur survie se reproduisent et les transmettent ainsi à leurs descendants, alors que les moustiques sensibles aux toxiques meurent. Les mutations conférant aux moustiques la capacité de résister aux OP ne sont pas engendrées, mais sélectionnées par le milieu. Plus simplement, la fréquence des moustiques porteurs de ces mutations augmente dans un environnement toxique.
Les gènes impliqués dans la résistance aux OP chez Culex pipiens
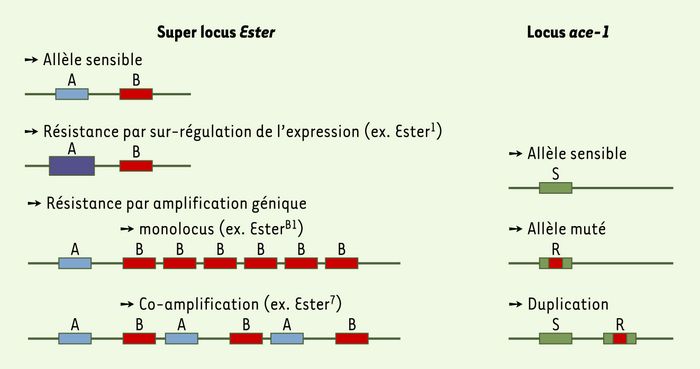
Seuls trois locus sont responsables de résistances majeures, Est-2, Est-3 et ace-1 (Figure 2). Est-2 et Est-3 forment un super locus (désigné par Ester) car ils sont très proches dans le génome; ces gènes codent pour des estérases qui piègent ou métabolisent les insecticides avant qu’ils puissent inhiber l’acétylcholinestérase des synapses. Dans les cas de résistance, ces estérases sont produites en excès grâce à un processus d’amplification du nombre de copies des gènes qui les codent dans le génome ou une augmentation de leur expression. Certains allèles de résistance comportent jusqu’à 50 copies d’Ester, alors que l’allèle sensible ne comporte qu’une seule copie [2]. Le gène ace-1 code pour la cible des insecticides OP, l’acétylcholinestérase1 (AChE1). Dans les cas de résistance, cette cible est mutée, ce qui réduit son affinité pour les OP.
Figure 2
Gènes impliqués dans la résistance aux OP chez Culex pipiens.
Est-2 et Est-3, super locus Ester, codent pour les estérases A et B qui piègent les insecticides. Dans les cas de résistance, ces estérases sont produites en excès grâce à un processus d’amplification du nombre de copies des gènes qui les codent dans le génome ou de sur-régulation de leur expression. Le gène ace-1 code pour la cible des insecticides, l’acétylcholinestérase1 (AChE1). Dans les cas de résistance, cette cible est mutée, ce qui réduit son affinité pour les OP.
On connaît une dizaine d’allèles de résistance au locus Ester et seulement deux au locus ace-1, ce qui indique que le nombre d’événements indépendants aboutissant à des mutations (amplification ou mutation ponctuelle) est en fait très faible. Cependant, les Culex pipiens résistants, sélectionnés par des insecticides ou des pesticides utilisés en agriculture, sont disséminés sur toute la planète. Souvent, la résistance apparaît en un point localisé puis se répand rapidement parce que les moustiques sont transportés passivement par bateau ou par avion. L’expansion géographique de la résistance est indiscutablement liée à l’activité humaine [3].
Le fait de résister est coûteux, les moustiques résistants ne sont pas en grande forme. Dans les cas de résistance par amplification d’estérases, leur métabolisme de base doit être perturbé. Dans les cas de mutation de l’AChE1, certes l’enzyme fixe moins bien l’insecticide, mais également son substrat naturel (l’acétylcholine), ce qui conduit à une transmission du signal nerveux plus approximative (Figure 1). Dans un environnement sans insecticides, les moustiques résistants meurent plus jeunes que les moustiques dépourvus de mutations, se développent plus lentement, sont plus fréquemment capturés par des prédateurs, sont plus sensibles aux infections par des bactéries endocellulaires de type Wolbachia. Si les moustiques sauvages et mutés sont mis en compétition, les seconds perdent dans toutes les conditions testées. Évidemment, en présence d’insecticides, ils s’en sortent quand même car ce sont les seuls à survivre.
Le coût de la résistance se modifie avec le temps, certains allèles Ester moins coûteux en remplacent d’autres [4]. Un nouvel allèle dans lequel ace-1 est dupliqué, comportant une forme mutée et une forme sauvage, est apparu dans certaines populations et tend à se répandre [5].
Une avancée certaine dans la compréhension de la résistance via la modification de l’acétylcholinestérase
Le gène codant pour l’AChE1 modifiée était jusqu’à présent inconnu chez les moustiques. En effet, l’homologue du gène de Drosophila melanogaster trouvé chez Culex pipiens n’intervenait pas dans la résistance (pas de mutations identifiées dans les souches résistantes et pas de ségrégation du gène avec la résistance lors des croisements [6]). Nous avons récemment montré, en utilisant la séquence du génome d’Anopheles gambiae, qu’il existe deux gènes chez les moustiques, ace-1 et ace-2, codant pour deux acétylcholinestérases distinctes (53% de similitude dans la séquence primaire) dont les fonctions diffèrent selon les espèces [7]. Le gène que nous avons cloné (ace-1) est la cible des insecticides organophosphorés (et carbamates) chez les moustiques (et probablement chez une grande partie des insectes) et a été perdu chez la drosophile qui n’a plus que le gène ace-2. Ces deux gènes divergent fortement au niveau nucléotidique, ce qui explique les nombreux échecs des stratégies utilisées auparavant pour identifier ce deuxième gène d’acétylcholinesterase (ace-1), et qui se fondaient sur l’homologie du seul gène existant chez la drosophile (ace-2).
Nous avons cloné et caractérisé ace-1 chez Culex pipiens à la fois dans des souches sensibles et résistantes aux insecticides [8]. Une seule substitution de l’acide aminé glycine en sérine en position 119 (G119S) est responsable de la résistance dans la plupart des souches testées, quelle que soit leur origine géographique. La modélisation de la structure de l’AChE1 de moustique montre que la position 119 est très proche du site catalytique de l’enzyme. La substitution de la glycine par une sérine provoque un encombrement stérique plus important, qui réduirait l’accessibilité du site actif aux insecticides. Cette substitution s’est produite indépendamment dans les formes tropicale et tempérée de C. pipiens. Nous avons également identifié cette même mutation dans une population d’Anopheles gambiae résistante de Côte d’Ivoire, alors que ce mode de résistance était inconnu chez ce moustique jusqu’à présent.
La découverte du gène ace-1 va permettre de caractériser la résistance chez les moustiques, mais également chez d’autres insectes (pucerons, sauterelles…) qui utilisent ace-1 pour produire l’essentiel de leur AChE dans les synapses. En effet, l’homologue du gène ace-2 de drosophile cloné chez ces insectes n’est pas impliqué dans la résistance.
Enfin, la plupart des insecticides utilisés aujourd’hui ont pour cible l’AChE1. Peu de produits nouveaux sont développés et mis sur le marché, ce qui explique les difficultés croissantes dans la gestion des problèmes de résistance aux insecticides. Un parallèle peut être fait avec les résistances aux antibiotiques qui accroissent le pouvoir pathogène de bactéries dont la nuisance était précédemment contrôlée. C’est pourquoi il est important de trouver de nouvelles molécules capables de maîtriser ces populations résistantes… au moins pour un temps. La découverte et la connaissance approfondie d’ace-1 devraient nous aider à relever ce défi.
Appendices
Références
- 1. Raymond M, Berticat C, Weill M, Pasteur N, Chevillon C. Insecticide resistance in the mosquito Culex pipiens: what have we learned about adaptation? Genetica 2001; 112/113: 287-96.
- 2. Weill M, Berticat C, Raymond M, Chevillon C. Quantitative PCR to estimate the number of amplified esterase genes in insecticide resistant mosquitoes. Anal Biochem 2000; 285: 267-70.
- 3. Raymond M, Callaghan A, Fort P, Pasteur N. Worldwide migration of amplified insecticide resistance genes in mosquitoes. Nature 1991; 350: 151-3.
- 4. Guillemaud T, Lenormand T, Bourguet D, Chevillon C, Pasteur N, Raymond M. Evolution of resistance in Culex pipiens: allele replacement and changing environment. Evolution 1998; 52: 430-40.
- 5. Lenormand T, Guillemaud T, Bourguet D, Raymond M. Appearance and sweep of a gene duplication: adaptive response and potential for a new function in the mosquito Culex pipiens. Evolution 1998; 52: 1705-12.
- 6. Malcolm CA, Bourguet D, Ascolillo A, et al. A sex-linked Ace gene, not linked to insensitive acetylcholinesterase mediated insecticide resistance in Culex pipiens. Insect Mol Biol 1998; 7: 107-20.
- 7. Weill M, Fort P, Berthomieu A, Dubois MP, Pasteur N, Raymond M. A novel acetylcholinesterase gene in mosquitoes codes for the insecticide target and is non-homologous to the ace gene in Drosophila. Proc Soc Lond Biol Sci 2002; 269: 2007-16.
- 8. Weill M, Lutfalla G, Mogensen K, et al. Insecticide resistance in mosquito vectors. Nature 2003; 423: 136-7.
List of figures
Figure 1
Rôle de l’acétylcholinestérase1 (AChE1) dans la transmission synaptique.
A. Situation d’un moustique sensible sans insecticides. L’AChE1 dégrade l’excès d’acétylcholine dans la synapse. B. Situation d’un moustique sensible en présence d’insecticides (OP). Les insecticides inhibent l’AChE1 qui ne dégrade plus suffisamment l’acétylcholine, ce qui conduit à un prolongement toxique de l’influx nerveux. C. Situation d’un moustique résistant en présence d’insecticides. Les OP n’inhibent plus l’AChE1 modifiée. En revanche, l’acétylcholine est moins bien dégradée par l’enzyme mutée que par l’enzyme sauvage, ce qui conduit à une transmission du signal non optimale.
Figure 2
Gènes impliqués dans la résistance aux OP chez Culex pipiens.
Est-2 et Est-3, super locus Ester, codent pour les estérases A et B qui piègent les insecticides. Dans les cas de résistance, ces estérases sont produites en excès grâce à un processus d’amplification du nombre de copies des gènes qui les codent dans le génome ou de sur-régulation de leur expression. Le gène ace-1 code pour la cible des insecticides, l’acétylcholinestérase1 (AChE1). Dans les cas de résistance, cette cible est mutée, ce qui réduit son affinité pour les OP.