Article body
Il y aurait dans le génome humain environ 20 000 pseudogènes [1]. Copies non fonctionnelles et plus ou moins fidèles de gènes, on les a considérés comme des reliquats ou des fossiles abandonnés par l’évolution. Résultats le plus souvent d’une duplication, parfois d’une rétrotransposition, ils font partie des familles géniques, et l’évaluation des différences avec le(s) gène(s) fonctionnel(s) les rendait utiles dans des études de phylogénie. On a aussi montré que leur similitude avec les gènes fonctionnels pouvait être à l’origine de réarrangements et de conversions géniques, surtout quand gène et pseudogène restaient voisins, ce qui n’est pas toujours le cas. La délocalisation vers un autre chromosome n’est, en effet, pas exceptionnelle. Mis à part ces fonctions indirectes, les pseudogènes ne semblaient pas avoir de fonction définie. La transcription des pseudogènes semblait peu probable ; un certain nombre de transcrits ont cependant été identifiés, parfois des épissages alternatifs, ce que peut expliquer soit le maintien des séquences régulatrices, soit l’utilisation d’un autre promoteur de voisinage. Du fait de mutations de la séquence codante, la traduction en une protéine n’était pas possible.
Le dogme de la non-fonctionnalité de ces pseudogènes se trouvait cependant partiellement remis en question par l’identification de ces transcrits, et de fait, le rôle fonctionnel d’un pseudogène vient d’être mis en évidence grâce au travail collaboratif de plusieurs équipes japonaises et américaines [2]. Cette découverte, disent les auteurs, se fit par hasard au cours d’une expérience d’expression transgénique chez la souris du gène sex-lethal de la drosophile. Des anomalies phénotypiques étaient en effet observables dans une des lignées. La majorité des hétérozygotes mouraient dans les deux jours suivant la naissance, les survivants présentant un important défaut de croissance et des déformations osseuses avec trouble de minéralisation évoquant les anomalies de l’osteogenesis imperfecta. Une dilatation polykystique rénale se développait progressivement, accompagnée de lésions cutanées. Ce syndrome, constant dans une lignée, ne s’observait dans aucune autre, malgré une expression du transgène confirmée dans toutes les lignées. Cette singularité fit évoquer l’invalidation d’un gène murin provoquée par le site d’insertion du transgène de drosophile.
En sélectionnant les animaux chez lesquels le phénotype était le moins grave, la lignée put être maintenue, le phénotype des homozygotes n’était pas plus sévère que celui des hétérozygotes. Les auteurs formulèrent alors l’hypothèse selon laquelle la régulation du gène muté serait soumise à un phénomène d’empreinte parentale, hypothèse confirmée par l’étude comparée du croisement mâle hétérozygote x femelle sauvage (99/108 animaux atteints) et mâle sauvage x femelle hétérozygote (3/96 animaux atteints). Le gène concerné fut ensuite identifié grâce à une banque de cosmides, puis une banque de BAC, préparées à partir de l’ADN génomique d’une souris hétérozygote, et localisé par hybridation fluorescente in situ. Les auteurs identifièrent ainsi un pseudogène makorin1-p1, situé sur le chromosome 5, qui se présentait typiquement comme une version tronquée du gène Makorin1 - situé lui sur le chromosome 6 - et qui, dans le cas présent, était inactivé par insertion d’un transgène [3]. Bien que pseudogène, Makorin1-p1 est habituellement transcrit en une séquence d’environ 700 pb correspondant à l’extrémité 5’ de Makorin1. Ce dernier gène présente deux transcrits de longueur inégale par suite d’un épissage alternatif, la séquence codante étant la même dans les deux cas. L’expression des deux transcrits est cependant différente, en particulier au niveau du rein. Chez les animaux hétérozygotes, on notait une réduction notable d’expression du pseudogène Makorin1-p1, mais aussi de la forme courte de Makorin1, ce qui conférait au pseudogène un rôle dans le niveau d’expression du gène Makorin1.
L’étape suivante était logiquement une étude du mode d’interaction entre gène et pseudogène. Comment ce dernier contrôlait-il la stabilité du gène? Les auteurs ont pu montrer, par expression de plasmide, que Makorin1 est exprimé au bout de 16 heures, puis que le signal disparaît à 32 heures, sans doute par dégradation de l’ARN. Une coexpression du pseudogène prévient cette dégradation, surtout celle de la forme courte. Cette protection nécessiterait l’extrémité 5’ du gène; une construction qui a amputé cette extrémité s’avère stable, avec ou sans le pseudogène. L’hypothèse selon laquelle la région 5’ contiendrait un élément en cis impliqué dans la régulation de la stabilité, permettant une régulation en trans par le pseudogène, a été alors confirmée dans plusieurs expériences. Un gène de fusion Makorin/ Katanin, comportant cette extrémité 5’, était, comme Makorin1, sensible au sauvetage par le pseudogène. Dans des cellules P19, par ailleurs, une surexpression du pseudogène stabilisait l’expression de la forme courte du gène. Pour explorer des conditions plus physiologiques, enfin, les auteurs ont mesuré la demi-vie des ARNm dans les cellules P19 en présence d’actinomycine D, et ont constaté une corrélation très stricte entre la stabilité du pseudogène et celle de la forme courte du gène.
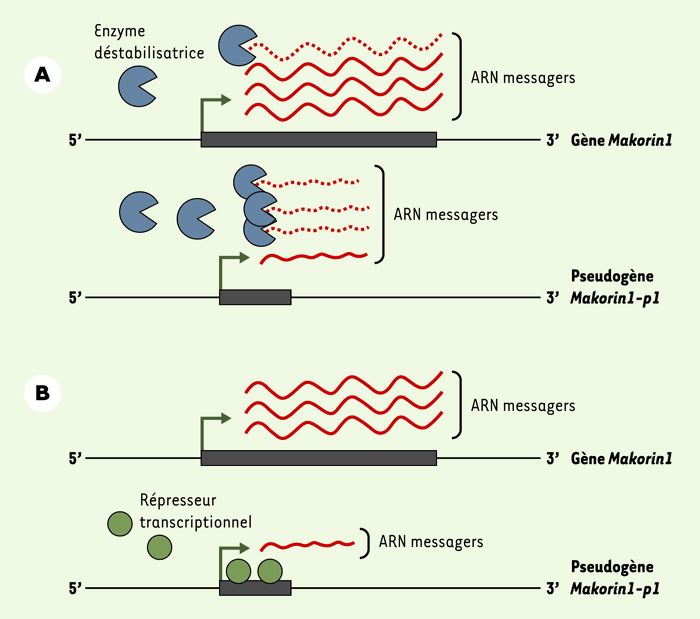
L’ensemble de ces observations met donc en évidence un mécanisme jusqu’à présent non décrit de régulation d’un gène de structure, Makorin1, par le transcrit d’un pseudogène non codant, Makorin1-p1 qui en est issu. Cette protection a été reproduite de façon non équivoque dans différentes constructions et lignées cellulaires et a pu faire employer le terme de «complicité» entre gène et pseudogène [4]. Ce pourrait être un phénomène général dont le mécanisme enzymatique n’est pas encore élucidé. Les auteurs [2] proposent une hypothèse, le commentateur [4] en ajoute une autre qui est complémentaire. Si la protection s’exerce au niveau de l’ARN, on peut faire l’hypothèse de l’existence en 5’ du gène - et du pseudogène - d’un site de reconnaissance reconnu en trans par un facteur de déstabilisation. L’expression de Makorin1-p1 représenterait une compétition directe et assurerait la titration de ce facteur, empêchant ainsi la déstabilisation de Makorin1 (Figure 1A). La forme longue de Makorin1 est alors protégée par une région non traduite différente et plus longue. Mais on peut aussi supposer une protection s’exerçant au niveau de l’ADN. Un répresseur de la transcription, présent en quantité limitée, serait alors l’objet de la compétition. Fixé au pseudogène, il ne serait plus disponible pour se lier au gène (Figure 1B). La duplication originelle de Makorin1 a ici été le départ d’une évolution bidirectionnelle, dont chaque élément a gardé une fonction. Un mécanisme du même ordre pourra-t-il être invoqué pour expliquer d’autres phénomènes génétiques, ceux , par exemple, dont la pénétration semble incomplète ?
Figure 1
Comment le pseudogène Makorin1-p1 contrôle-t-il l’expression du gène Makorin1 ?
Deux possibilités sont envisagées. A. Au niveau de l’ARN, il y aurait compétition pour une protéine déstabilisatrice - peut-être une enzyme - qui se fixerait à la séquence de 700pb en 5’ de l’ARN. B. Au niveau de l’ADN, le même type de compétition s’exercerait vis-à-vis d’un répresseur.
Appendices
Références
- 1. Mighell AJ, Smith NR, Robinson PA, Markham AF. Vertebrate pseudogenes. FEBS Lett 2000; 468: 109-14.
- 2. Hirotsune S, Yoshida N, Chen A, et al. An expressed pseudogene regulates the messenger-RNA stability of its homologous coding gene. Nature 2003; 423: 91-6.
- 3. Gray TA, Hernandez H, Carey AH, et al. The ancient source of a distinct gene family encoding proteins featuring RING and C3H zinc-finger motifs with abundant expression in developing brain and nervous system. Genomics 2000; 66: 76-86.
- 4. Lee JT. Complicity of gene and pseudogene. Nature 2003; 423: 26-8.
List of figures
Figure 1
Comment le pseudogène Makorin1-p1 contrôle-t-il l’expression du gène Makorin1 ?