Article body
Le poids est relativement stable malgré une grande variabilité des apports alimentaires et des efforts physiques. Afin de garder constante l’homéostasie énergétique, l’hypothalamus contrôle la prise alimentaire et la dépense énergétique selon les informations reçues des tissus périphériques (en particulier via la leptine). L’AMP-activated protein kinase (AMPK), constituée de trois sous-unités (une sous-unité catalytique α1 ou α2, deux sous-unités régulatrices β et γ), est une enzyme ubiquitaire dont l’activité dépend de l’état énergétique cellulaire. Ainsi, en cas de carence énergétique, l’activité de l’enzyme augmente, ce qui inhibe les voies métaboliques consommatrices d’énergie (afin de ne pas gaspiller l’énergie disponible) et active les voies productrices d’énergie (afin de restaurer un état énergétique satisfaisant). L’activation de l’AMPK réduit l’activité de l’acétyl-CoA carboxylase, ce qui réduit la production de malonyl-CoA intracellulaire et permet d’activer l’oxydation intra-mitochondriale des acides gras tout en favorisant leur oxydation. L’AMPK participe donc aux fonctions mitochondriales en orientant les acides gras disponibles vers la mitochondrie. Les actions métaboliques de l’AMPK semblent relayées par la sous-unité catalytique α2 [1].
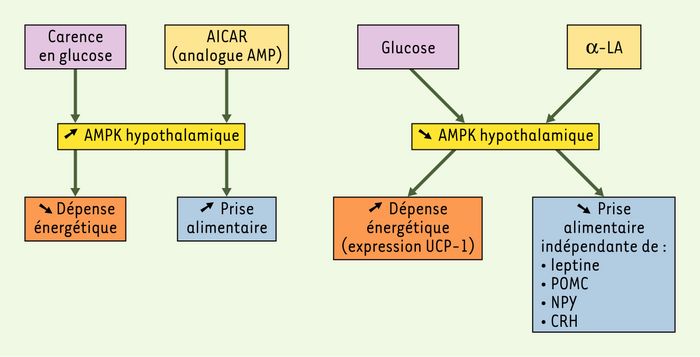
L’AMPK est exprimée dans le cerveau mais sa fonction exacte y est encore mal connue. Afin de comprendre les fonctions de l’AMPK intracérébrale et son éventuel rôle dans le contrôle de la prise alimentaire, M.S. Kim et al. ont étudié les effets de l’acide α-lipoïque (α-LA), un acide gras particulier, à chaîne courte, cofacteur essentiel des enzymes de la respiration mitochondriale (Figure 1) [2]. L’α-LA réduit la prise alimentaire chez le rat Sprague-Dawley quelle que soit sa voie d’administration (orale, intrapéritonéale ou intracérébro-ventriculaire). Cet effet est dépendant de la dose. L’α-LA réduit le poids et la masse grasse intraviscérale des rats génétiquement obèses (rats Otsuka, Long-Evans, Tokushima, Fatty ou rats OLETF) et améliore leurs paramètres métaboliques. L’effet anorexigène du α-LA est réversible à l’arrêt de son administration, suggérant que cet effet n’est pas dépendant d’un éventuel effet toxique de l’acide gras. De plus, l’α-LA augmente la dépense énergétique (mesurée par calorimétrie indirecte) et augmente l’expression de la protéine découplante UCP-1 dans le tissu adipeux brun. Ainsi, l’α-LA semble réduire le poids en diminuant la prise alimentaire mais également en stimulant la dépense calorique journalière. Ces effets, mêmes s’ils apparaissent similaires à ceux observés après l’administration de leptine, sont indépendants de la voie de signalisation de la leptine. En effet, l’α-LA conserve son action chez les souris obèses déficientes en leptine ou en son récepteur. De plus, à l’inverse de ce qui est observé pour la leptine, l’administration intrapéritonéale d’α-LA ne s’accompagne pas d’une diminution d’expression hypothalamique du neuropeptide Y (NPY), de la pro-opiomélanocortine (POMC) ou de la corticotropin releasing hormone (CRH). Quel est donc le médiateur hypothalamique des effets de l’α-LA ? L’injection intrapéritonéale d’α-LA réduit l’activité de l’AMPK hypothalamique et plus particulièrement l’activité relayée par la sous-unité catalytique α2 dans le noyau arqué sans affecter l’AMPK-α2 du noyau paraventriculaire ou de l’aire hypothalamique latérale. Les effets pondéraux de l’α-LA sont bien secondaires à une réduction de l’activité de l’AMPK-α2 puisque les effets de l’α-LA sur la prise alimentaire sont abolis lors de la co-injection intracérébro-ventriculaire d’α-LA et d’un activateur de l’AMPK (dénommé AICAR) ou lors de l’injection intrapéritonéale d’α-LA chez des rats exprimant dans l’hypothalamus une forme constitutivement active d’AMPK.
Figure 1
Fonctions de l’AMPC-activated protein kinase hypothalamique (AMPK).
α-LA : acide α-lipoïque ; AICAR : 5-amino-imidazole 4-carboxamide 1-β-D ribofuranoside ; CRH : corticotropin releasing hormone ; NPY : neuropeptide Y ; POMC : pro-opiomélanocortine ; UCP-1 : uncoupling protein-1.
L’activité de l’AMPK-α2 hypothalamique est contrôlée par l’acide gras α-LA. Qu’en est-il pour le glucose, autre substrat énergétique majeur ? L’injection intracérébro-ventriculaire de glucose (5 mg) chez des rats à jeun depuis 24 heures réduit l’activité de l’AMPK-α2. À l’inverse, l’injection intrapéritonéale de 2-désoxyglucose (qui inhibe l’utilisation du glucose intracellulaire, mimant ainsi une carence en glucose) chez des rats nourris augmente malgré tout leur prise alimentaire via une augmentation de l’activité de l’AMPK-α2 hypothalamique. L’effet du 2-désoxyglucose n’était plus retrouvé chez des rats exprimant un dominant négatif de l’AMPK dans l’hypothalamus.
L’ensemble de ces données montre que l’AMPK hypothalamique participe à la régulation de la prise alimentaire et de la dépense énergétique et que des substrats aussi divers que certains acides gras (comme l’α-LA) et le glucose modulent l’activité de cette enzyme. Globalement, l’α-LA et le glucose réduisent l’activité de l’AMPK-α2 hypothalamique alors que la carence en glucose active l’enzyme, confirmant que l’AMPK-α2 est bien un régulateur énergétique à l’échelon de l’hypothalamus. Les conséquences des modifications d’activité de l’AMPK-α2 sont considérables, touchant la prise alimentaire et la dépense énergétique (même si les mécanismes exacts de leur régulation sont encore inconnus). De plus, contrairement à l’article publié par l’équipe de B.B. Kahn [3] quelques mois auparavant, et qui suggérait que les effets centraux de la leptine sont relayés par l’AMPK, l’article de M.S. Kim et al. démontre clairement que la régulation de l’AMPK hypothalamique est indépendante des principaux régulateurs hypothalamiques connus de la machinerie énergétique et de la prise alimentaire (leptine, POMC, CRH, NPY), suggérant que l’inhibition de l’AMPK pourrait être une nouvelle voie thérapeutique dans la prise en charge de l’obésité.
Appendices
Références
- 1. Kim MS, Park JY, Namkoong C, et al. Anti-obesity effects of α-lipoic acid mediated by suppression of hypothalamic AMP-activated protein kinase. Nat Med 2004 ; 10 : 727-33.
- 2. Viollet B, Andreelli F, Jorgensen SB, et al. The AMP-activated protein kinase alpha2 catalytic subunit controls whole-body insulin sensitivity. J Clin Invest 2003 ; 111 : 91-8.
- 3. Minokoshi Y, Alquier T, Furukawa N, et al. AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus. Nature 2004 ; 428 : 569-74.
List of figures
Figure 1
Fonctions de l’AMPC-activated protein kinase hypothalamique (AMPK).