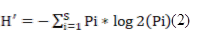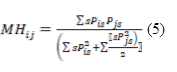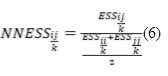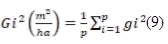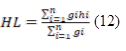Résumés
Résumé
Connaître les mesures classiques de la diversité floristique est crucial pour étayer les stratégies de conservation des ressources végétales des forêts dégradées. La présente étude vise premièrement à apprécier les paramètres de diversité spécifique et structurale de la flore ligneuse des îlots forestiers du massif montagneux de Lubero et deuxièmement, à déterminer son état de conservation afin de proposer des mesures appropriées pour sa gestion durable. Un échantillonnage stratifié par grappe a été effectué pour les inventaires forestiers. À cet effet, 297 placeaux de 50 m2 chacun ont été matérialisés dans dix îlots forestiers. Les indices de diversité spécifique ont été calculés et les paramètres dendrométriques ont été déterminés. L’entropie de Renyi a été calculée pour comparer la diversité alpha des espèces ligneuses entre les îlots forestiers. Le test rang de Kruskal-Wallis et l’analyse de variance ont permis de comparer les paramètres de diversité structurale entre les peuplements ligneux. Au total, 104 espèces ligneuses (86 genres et 45 familles) ont été recensées. La richesse spécifique des îlots forestiers varie entre 11 et 78. L’indice de diversité de Shannon-Wiener est très variable (1,98 à 4,03 bits) et l’équitabilité de Pielou est assez élevée (0,83 à 0,94). Des différences hautement significatives de densité (degré de liberté ddl=9, chi-square = 93.1316, P<0,0001), de diamètre moyen (ddl=9, statistique F =23.163, P<0,0001), de surface terrière (ddl=9, statistique F =53.568, P<0,0001) et de hauteur de Lorey moyenne (ddl=9, statistique F =208.454 ; P<0,0001) des espèces ligneuses ont été notées entre les îlots forestiers. Du point de vue de la conservation, 87 espèces ligneuses sont rapportées sur la liste rouge de l’Union internationale pour la conservation de la nature (UICN). Les espèces ligneuses déclarées « Vulnérables », « Quasi menacées » et « En danger » méritent une attention particulière des décideurs politiques et des gestionnaires forestiers.
Mots-clés :
- conservation,
- distance écologique,
- ressources ligneuses,
- forêts de montagnes,
- reliques forestières,
- indices de diversité,
- Lubero,
- variabilité structurale
Abstract
Knowledge of floristic diversity's classical measures is crucial to support conservation strategies of plant resources in degraded forests. The present study aims firstly to assess the parameters of specific and structural diversity of the woody flora of the forest patches of Lubero and secondly, to determine its state of conservation in order to suggest appropriate measures for its sustainable management. A stratified cluster sampling has been used for the forest inventories. To this end, 297 plots of 50 m 2 each have been marked out in ten forest patches. Specific diversity indices have been calculated and dendrometric parameters have been determined. Renyi entropy has been calculated to compare the alpha diversity of woody species between the different forest patches. The Kruskal-Wallis rank test and analysis of variance have been used to compare structural diversity parameters between woody stands. A total of 104 woody species (86 genera and 45 families) have been identified. The species richness of the forest patches nowadays varies between 11 and 78. The Shannon diversity index is highly variable (1.98 to 4.03 bits) and the Pielou equitability is fairly high (0.83 to 0.94). Highly significant differences in density (degree of freedom ddl=9, chi-square = 93.1316, P<0.0001), mean diameter (ddl=9, F-statistic =23. 163, P<0.0001), basal area (ddl=9, F-statistic =53.568, P<0.0001) and mean Lorey height (ddl=9, F-statistic =208.454; P<0.0001) of woody species were noted between forest patches. In terms of conservation, 87 woody species are on the International Union for Conservation of Nature (IUCN)'s red list. Woody species declared ‘ Vulnerable’, ‘Near Threatened’ and ‘Endangered’ deserve special attention from policy-makers and forest managers.
Keywords:
- conservation,
- ecological distance,
- wood resources,
- mountain forests,
- forest relics,
- diversity indices,
- Lubero,
- structural variability
Corps de l’article
Introduction
L’une des préoccupations environnementales majeures auxquelles font face actuellement les pays du bassin du Congo est la dégradation des écosystèmes forestiers naturels (Mégevand et al., 2013 ; Eba’a Atyi et al., 2022). En 2020, la République Démocratique du Congo (R.D. Congo), qui contient près des deux tiers du couvert forestier tropical du bassin du Congo (Tchatchou et al., 2015), fut classée au deuxième rang des pays du monde les plus touchés par la destruction de la forêt vierge tropicale, après le Brésil (Global Forest Watch, 2021). Dans la zone nord-est de la R.D. Congo et précisément dans la région du massif montagneux de Lubero, le paysage forestier est au creuset de la déforestation croissante et alarmante dont les principaux moteurs sont l’agriculture, l’exploitation du bois pour des besoins énergétiques et artisanaux, l’installation humaine et le surpâturage (Vyakuno, 2006 ; Musumba et al., 2019 ; Lubala, 2022). En effet, depuis 1987, avec un taux de déforestation annuel de 2,2 %, le massif montagneux de Lubero a perdu environ 70,4 % de son couvert forestier (Ndavaro et al., 2021). L’un des corollaires majeurs de ce phénomène de déforestation est la fragmentation du manteau forestier qui recouvrait jadis la quasi-totalité du massif montagneux de Lubero en plusieurs portions d’écosystèmes boisés ou îlots forestiers (Vyakuno, 2006 ; Ndavaro et al., 2021). Ces fragments forestiers projettent dans l’ensemble du milieu une matrice paysagère fortement anthropisée intégrant plusieurs types de mosaïques résultant de l’écrémage des formations forestières pour de multiples formes d’occupations et/ou d’utilisations des terres (Musumba et Katcho, 2019 ; Ndavaro et al., 2021). À bien d’endroits, ces écosystèmes forestiers résiduels ne cessent d’enregistrer d’importantes et remarquables pertes en ressources végétales ligneuses qui, pourtant, ont une valeur aussi bien écologique que socio-économique et culturelle pour les populations locales (Musumba et al., 2019 ; Lubala, 2022 ; Ndavaro et al., 2023).
Dans le contexte actuel, la mise en œuvre des stratégies de conservation et de gestion durable des ressources végétales ligneuses des îlots forestiers du massif montagneux de Lubero pose de réelles difficultés à cause de plusieurs facteurs. Parmi ces facteurs, il y a sans doute l’écart des connaissances sur l’état actuel de conservation du potentiel ligneux des îlots forestiers du massif montagneux de Lubero. À cela s’ajoute l’absence des connaissances biologiques et écologiques sur les essences forestières, en particulier les données d’inventaires forestiers relatives à la diversité taxonomique, spécifique (richesse spécifique, diversité intra-habitat et extra-habitat) et structurale (densité, surface terrière, diamètre et hauteur) des ressources ligneuses de ces écosystèmes forestiers naturels. En effet, disposer de ces connaissances bio-écologiques est crucial, car elles fournissent des informations objectives pour évaluer les potentiels des formations forestières, telles que la couverture des forêts et leur état de conservation (Bogaert et Mahamane, 2005 ; Imani et al., 2016a). Ces connaissances fournissent également des bases techniques nécessaires pour orienter les actions de conservation du patrimoine forestier menacé (Adjonou et al., 2016 ; Oumar et al., 2021). Bien plus, l’intérêt de l’étude des paramètres de diversité spécifique et structurale des communautés végétales réside dans le fait qu’ils apportent un éclaircissement complémentaire dans l’analyse des affinités floristiques entre différentes portions forestières d’une même matrice paysagère soumise aux perturbations anthropiques (Lisingo et al., 2015). Plus particulièrement, les paramètres de diversité structurale des espèces végétales ligneuses facilitent la compréhension des processus écologiques et du fonctionnement complexe des écosystèmes forestiers en cours de fragmentation (Ostertag et al., 2014 ; Blanchard, 2016 ; Miabangana, 2020).
Par ailleurs, l’étude de la variabilité des paramètres de diversité spécifique et structurale entre différents écosystèmes forestiers est nécessaire, en particulier lorsque la topographie locale est hétérogène ou très accidentée (Miabangana et Malaisse, 2020). En effet, l’analyse de la variabilité de la diversité spécifique et structurale entre les synusies ligneuses de différentes mosaïques forestières permet d’appréhender l’hétérogénéité et la distance écologiques entre ces dernières (Lisingo, 2016 ; Nsangua et al., 2018). Elle permet également de disposer des indicateurs floristiques et phytosociologiques des stations forestières pauvres ou dégradées ainsi que des indicateurs précis de gestion (Imani et al., 2016a). D’autres auteurs (Parmentier et al., 2011 ; Lisingo et al., 2015) mentionnent que les comparaisons floristiques entre plusieurs blocs forestiers à partir des données quantitatives d’inventaires augmentent la précision et la fiabilité de l’estimation de la diversité des arbres des forêts et, de ce fait, garantissent la bonne gestion des ressources forestières.
C’est en se basant sur les considérations théoriques et techniques sus-évoquées que la présente étude a été réalisée. Elle vise premièrement à apprécier les paramètres de diversité spécifique et structurale de la flore ligneuse des îlots forestiers du massif montagneux de Lubero et, secondement, à déterminer son état actuel de conservation dans le but de proposer des mesures appropriées pour sa gestion durable. L’intérêt principal de cette étude est de documenter les bases techniques nécessaires pour la conservation de la flore ligneuse des îlots forestiers du massif montagneux de Lubero afin de contribuer au bien-être économique et socio-culturel durable des populations locales vivant dans et autour de ces îlots forestiers.
Matériel et méthodes
Milieu d’étude
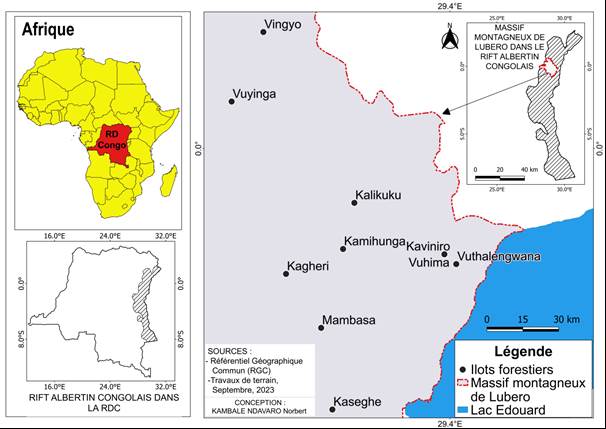
L’étude a été menée dans le massif montagneux de Lubero, situé au nord-est de la R.D. Congo. Cette région a pour limite, au nord, l’Équateur, c’est-à-dire la latitude 0°, à l’ouest, la longitude 29° O, au sud, la latitude 1° S et, à l’est, la longitude 30° E (Vyakuno, 2006). L’altitude varie de 900 à 3117 m au-dessus du niveau de la mer. Les moyennes thermiques et pluviométriques varient avec l’altitude : 25 à 20° Celsius et 2183 à 1700 mm de 900 à 1400 m ; 20 à 17° C et 1700 à 1300 mm de 1400 à 2000 m ; et 17 à 15° C et 1330 à 1110 mm de 2000 à 3117 m (Sys, 1992 ; Vyakuno, 2006). Les sols se répartissent en trois principaux groupes : les kaolisols, les sols bruns tropicaux et les sols récents (Leclercq, 1969 ; Vyakuno, 2006). Sur le plan phytogéographique, la zone d’étude appartient au centre régional d'endémisme afromontagnard (White, 1983) et occupe une superficie de 9049,5 km2 (Vyakuno, 2006). La végétation est majoritairement constituée des formations forestières afromontagnardes fortement fragmentées sous l’effet de la pression anthropique (Vyakuno, 2006 ; Ndavaro et al., 2021 ; Ndavaro et al., 2023). Elles ne subsistent actuellement qu’à travers dix principaux îlots forestiers résiduels (figure 1).
Figure 1
Localisation des sites d’étude dans le massif montagneux de Lubero / Location of the study sites in the Lubero mountain massif
Échantillonnage et collecte des données
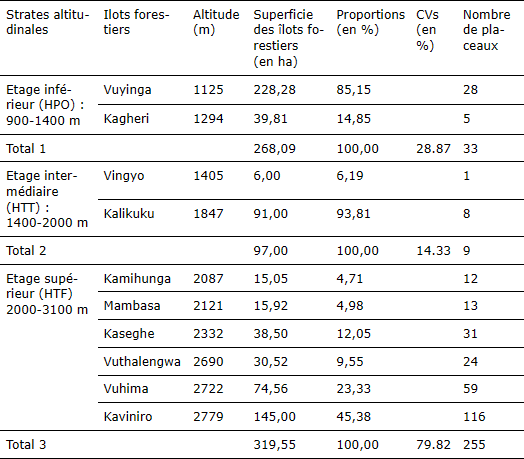
Dans chaque îlot forestier, l’inventaire floristique a été réalisé suivant la méthode d’échantillonnage stratifié par grappe. À cet effet, les trois niveaux altitudinaux de la zone d’étude (900-1400, 1400-2000, 2000-3117 m) (Sys, 1992 ; Vyakuna, 2006) ont correspondu aux trois différentes strates d’inventaire. Les placeaux de 50 m x 50 m ont été installés aléatoirement dans les îlots forestiers investigués. Le nombre de placeaux d’échantillonnage a été proportionnel aux dimensions de chaque îlot forestier. Comme recommandé par plusieurs auteurs (Verrue, 2001 ; Picard, 2006 ; Claessens et al., 2017), ce nombre a été déterminé sur la base du coefficient de variation de la richesse spécifique (CVs) du peuplement estimé pour chaque strate, dans la phase de préinventaire sur 20 placettes de 1000 m2 chacune, suivant la formule 1 ci-après :
Figure
Où n est le nombre de placeaux à installer ; CVs est le coefficient de variation (%) de la richesse spécifique du peuplement d’une strate d’inventaire ; et e indiquant l’erreur d’échantillonnage souhaitée (5 %). Le tableau 1 présente le nombre de placeaux d’échantillonnage par îlot forestier.
Tableau 1
Nombre de placeaux d’échantillonnage par site d’étude / Number of sample plots per study site
HPO = Haut Plateau Occidental ; HTT = Hautes Terres Tièdes ; HTF = Hautes Terres Fraîches ; CVs = Coefficient de Variation de la richesse spécifique.
Ainsi, un total de 297 placeaux d’inventaire a été retenu. Seuls les arbres ayant un diamètre à hauteur de la poitrine d’homme (dbh ou diamètre à 1,30 m de hauteur du sol) ≥ 10 cm ont été pris en compte dans les inventaires floristiques (Imani et al., 2016a ; Imani et al., 2021). Les diamètres de ces arbres ont été mesurés à l’aide d’un dbh mètre et leurs hauteurs ont été prises à l’aide d’un Vertex Laser Geo 360. La nomenclature systématique adoptée a été celle de Lebrun et Stork (1991-2015) et du groupe de la classification phylogénétique des angiospermes (The Angiosperm Phylogeny Group et al., 2016). La liste des plantes [1] et les bases de données taxonomiques en ligne Tropicos [2], World Flora Online [3] et Plants of World Online [4] ont été utilisées pour vérifier les noms scientifiques des espèces ligneuses recensées ainsi que pour éviter le problème des synonymies taxonomiques. Les échantillons des espèces ligneuses recensées (herbiers) ont été déposés à l’Herbarium privé de l’Université Catholique du Graben de Butembo (R.D. Congo). Le statut de conservation des espèces ligneuses a été établi à partir de la base de données de l'Union internationale pour la conservation de la nature (UICN)[5].
Calculs et analyses statistiques des données
La diversité floristique des espèces ligneuses des îlots forestiers de la zone d’étude a été appréciée en calculant les paramètres suivants :
La richesse spécifique (S) a été estimée par îlot forestier à l’aide de l’indice non-paramétrique ACE (Abundance-based Coverage Estimator) (Colwell, 2006).
L’indice de diversité de Shannon-Wiener (H′) (Shannon et Wiener, 1963) a été estimé à l’aide de la formule 2 suivante :
Figure
Où pi = l’abondance proportionnelle ou le pourcentage d’abondance d’une espèce présente dans un peuplement (pi = ni/N où ni = le nombre d’individus dénombrés pour une espèce présente et N = le nombre total d’individus dénombrés, toutes espèces confondues) ; S = le nombre total ou cardinal de la liste d’espèces présentes dans un peuplement.
L’indice d’équitabilité de Pielou (J) ou indice d’équirépartition (E) (Pielou, 1966) a été calculé (formule 3) sur base de l’expression mathématique suivante :
Figure
Où H′ est l’indice de Shannon ; Log2 est le logarithme en base 2 et S est le nombre d'espèces présentes dans le peuplement étudié.
Le profil de diversité de Renyi (H𝞪) (Renyi, 1961) a été calculé pour dresser le profil de diversité alpha des différents îlots forestiers. La formule 4 utilisée pour calculer l’entropie de Renyi est la suivante :
Figure
Avec Pi = proportion de chaque espèce ; Hα est calculé pour différentes valeurs α (0 ; 0.25 ; 0,5 ; 1 ; 2 ; 4 ; 8 ; et ∞) bien entendu, pour qu’alpha soit égal à 1 et ∞, cette formule ne peut directement être utilisée. La valeur du profil de diversité à :
-
𝞪 = 0 correspond à la richesse spécifique de l’îlot forestier considéré.
-
𝞪 = 1 correspond à l’indice de diversité de Shannon de l’îlot forestier considéré.
-
𝞪 = 2 correspond au logarithme de la réciproque de l’indice de diversité de Simpson spécifique.
-
𝞪 = ∞ correspond à la proportion des espèces les plus abondantes de l’îlot forestier considéré. Ce qui donne une idée de l’équitabilité des individus par espèce.
La similarité floristique entre îlots forestiers a été évaluée par le biais des indices de Morisita-Horn (MH) (Morisita, 1959 ; Horn, 1966) et la New version of the Normalized Expected Species Shared (NNESS) (Trueblood et al., 1994). L’indice de MH correspond au rapport de la probabilité que deux individus tirés au hasard dans deux échantillons appartenant à la même espèce sur la probabilité que deux individus tirés au hasard dans le même échantillon appartiennent à la même espèce. Son expression mathématique (formule 5) est la suivante :
Figure
Où P is et P js sont les fréquences de l’espèce s dans les relevés i et j, respectivement ; s indiquant que les sommes se prennent sur toutes les espèces. La valeur de MH est comprise entre 0 (communautés dissemblables) et 1 (similarité maximale). Ainsi la dissimilarité de MH : Diss_MH = 1 - MH. NNESS est une généralisation de MH permettant de mieux tenir compte des espèces rares. Elle s’obtient par la formule 6 suivante :
Figure
Où ESSij/k est le nombre attendu d’espèces partagées entre deux communautés i et j, lors d’un tirage aléatoire de k individus dans chacune de ces deux communautés. Cet indice présente l’avantage qu’en jouant sur la valeur de k (1, 2, 10… k ≤ Ni) il permet de mettre plus ou moins de poids sur les espèces rares et de visualiser l’effet des espèces rares dans la variation floristique. Notons que MH = NNESS pour k = 1. Dans cette étude, plusieurs itérations ont été effectuées afin de déterminer automatiquement la valeur de k pour laquelle l’indice NNESS n’est ni sensible aux espèces abondantes ni aux espèces rares. On en déduit la dissimilarité de NNESS : Diss_NNESS = 1 – NNESS. La distance écologique selon l’indice de Morisita-Horn a servi à réaliser une classification hiérarchique des îlots forestiers en vue de les regrouper en éco-groupes. Nous entendons ici par « éco-groupe » un ensemble d’îlots forestiers de compositions spécifiques ligneuses assez similaires.
La densité moyenne des arbres a été d’abord estimée au niveau de chaque placeau « i » par :
Npl i = ni/S, n i étant le nombre total d’arbres au niveau d’un placeau de superficie S = 2500 m2. Ainsi la densité moyenne de l’îlot forestier (Nif) a été donnée par la formule 7 :
Figure
p étant le nombre total des placeaux inventoriés dans l’îlot forestier considéré et Npl i indiquant la densité moyenne des arbres au niveau d’un placeau i.
La surface terrière (G) a été calculée sur base de l’expression mathématique de la formule 8 suivante :
Figure
Où S = 2500 m2 ; di est le diamètre d’un arbre i mesuré au sein du placeau. Au niveau de l’îlot forestier, la surface terrière (G) est estimée par la formule 9 ci-dessous :
Figure
Le diamètre moyen (DBH moyen) a été calculé pour chaque placeau i sur base de la formule 10 suivante :
Figure
Où di est le diamètre d’un arbre i mesuré au sein du placeau et n le nombre total d’arbres du placeau. Au niveau de l’îlot forestier, le diamètre moyen (D if) a été estimé par la formule 11 :
Figure
La hauteur de Lorey (HL) des arbres a été calculée sur base de la formule 12 suivante :
Figure
Où hi est la hauteur totale de l’arbre i mesurée sur le terrain et gi est sa surface terrière (gi = Πdi²/4).
Pour tester la variabilité de la diversité structurale entre les peuplements des îlots forestiers, le test rang de Kruskal-Wallis a été effectué pour le cas de densité des arbres par îlot forestier tandis que l’analyse de variance (ANOVA) a été effectuée dans les cas de la surface terrière, du diamètre moyen, et de la hauteur de Lorey. Les comparaisons multiples des densités médianes des différents îlots forestiers ont été effectuées à l’aide du test de Kruskal sous le package agricolae (De Mendiburu, 2021) tandis que le test de HSD de Turkey a été utilisé pour la comparaison multiple des moyennes des surfaces terrières, des diamètres moyens, et des hauteurs de Lorey entre îlots forestiers, le seuil de significativité étant de 5 %. Tous les calculs et les tests statistiques ont été faits avec le logiciel R 4.1.5 (R Core Team, 2021).
Résultats
Diversité spécifique de la flore ligneuse des îlots forestiers
Au total, 104 morpho-espèces réparties dans 86 genres et 45 familles ont été recensées sur une superficie de 63,75 ha au sein des dix îlots forestiers investigués. La liste complète des espèces inventoriées par îlot forestier avec mention de leurs familles et densités est fournie dans le tableau en Annexe 1. En effet, le plus grand nombre d’espèces a été enregistré dans l’îlot Vuyinga (78 espèces). À l’opposé, Vingyo est l’îlot le moins riche en espèces ligneuses (11 espèces). À l’exception de Vuyinga dont l’indice de diversité de Shannon-Wiener est 4,03 bits, cet indice varie entre 1,98 et 2,87 bits pour tous les autres îlots forestiers investigués. Cela montre que les peuplements ligneux des îlots forestiers de la zone d’étude ont une diversité botanique généralement faible. L’indice d’équitabilité de Pielou varie de 0,83 à 0,94 traduisant qu’il n’existe pas de dominance de quelques espèces ligneuses sur les autres au sein des îlots forestiers étudiés. L’indice de diversité de Shannon-Wiener, couplé avec son indice d’équitabilité, montrent que Vuyinga est non seulement l’îlot le plus riche en espèces ligneuses, mais aussi celui présentant la plus forte diversité floristique alpha (tableau 2). Cependant, l’entropie de Renyi qui combine à la fois la richesse spécifique, l’indice de Shannon-Wiener, l’indice de Simpson et l’indice de Berger-Parker (la dominance des espèces les plus abondantes) suggère qu’il n’y a pas de possibilité de confirmer la suprématie de l’îlot Vuyinga, en termes de diversité alpha, sur les autres îlots forestiers (figure 2). Toutefois, l’entropie de Renyi montre clairement que les îlots forestiers Mambasa et Kaviniro, très proches en diversité alpha, sont les moins diversifiés du massif montagneux de Lubero.
Tableau 2
Diversité spécifique par îlot forestier / Specific diversity by forest patch
Figure 2
Profil de diversité de Renyi des îlots forestiers / Rényi diversity profile of forest patches
Distance écologique entre îlots forestiers selon leurs compositions en espèces ligneuses
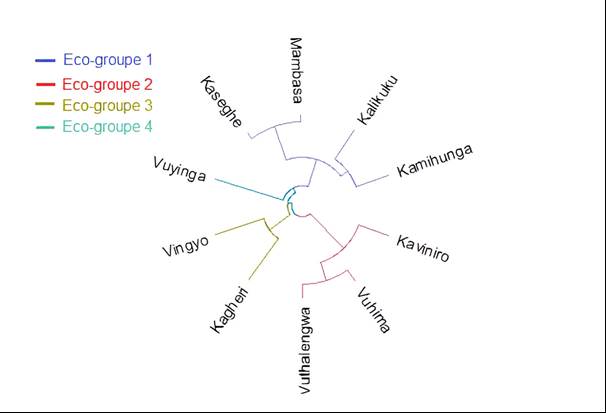
D’un point de vue général, l’indice de dissimilarité de NNESS et celui de Morisita-Horn (accent sur les espèces abondantes) s’accordent à indiquer des dissimilitudes considérables (prédominance de valeurs allant de 0,7 à 1) dans la composition spécifique des communautés ligneuses des divers îlots forestiers pris par pair (tableau 3). En effet, la distanciation écologique est plus poussée entre les pairs Vuhima et Vingyo (NNESS=1 ; MH=1), Vuhima et Vuyinga (NNESS=0,988 ; MH=0,993), alors que les plus fortes similitudes sont observées entre les pairs Mambasa et Kaseghe (NNESS=0,106 ; MH=0,089), Kamihunga et Kaseghe (NNESS=0,168 ; MH=0,285), Kaviniro et Vuthalengwa (NNESS=0,249 ; MH=0,236). La classification hiérarchique ascendante basée sur la distance de Morisita-Horn a permis d’identifier quatre groupes écologiques d’îlots forestiers en tenant compte de leur composition spécifique ligneuse. Le premier comprend les îlots Kamihunga, Kalikuku, Mambasa et Kaseghe. Quant au second, il réunit les îlots Vuthalengwa, Vuhima et Kavinirole alors que le troisième groupe est formé par les îlots Kagheri et Vingyo. Enfin, le quatrième groupe est constitué uniquement de l’îlot Vuyinga (figure 3).
Tableau 3
Distance écologique inter-îlots basée sur les indices de Morisita-Horn et de NNESS / Inter-patches ecological distance based on Morisita-Horn and NNESS indices
Figure 3
Dendrogramme de la catégorisation écologique des îlots forestiers selon l’indice de similarité de Morisita-Horn / Dendrogram of the ecological categorisation of forest patches according to the Morisita-Horn similarity index
Diversité structurale de la flore ligneuse des îlots forestiers
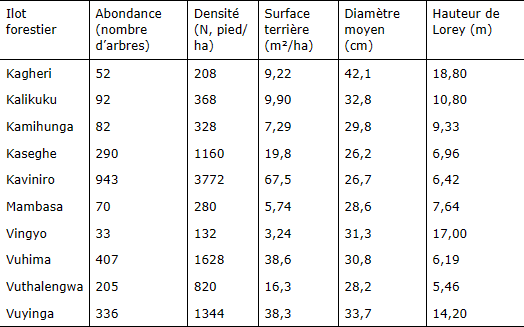
Les îlots forestiers Kaviniro, Vuhima, Vuyinga et Kaseghe sont les plus boisés (plus fortes densités totales et surface terrière totale) (tableau 4). Pourtant, les pieds d’arbres de ces îlots ne sont ni les plus grands en diamètre ni les plus grands en hauteur. Les grands pieds en diamètre sont beaucoup plus observés dans les îlots forestiers Kagheri (DBH moyen = 42,1 cm), Vuyinga (DBH moyen = 33,7 cm), Kalikuku (DBH moyen = 32,8 cm), Vingyo (DBH moyen = 31,3 cm) et Vuhima (DBH moyen = 30,8 cm). Par ailleurs, les arbres les plus grands en hauteur sont beaucoup plus présents dans les îlots forestiers Kagheri (HL = 18,8 m), Vingyo (HL = 17,0 m) et Vuyinga (HL= 14,2 m). Le test rang de Kruskal-Wallis indique que la densité médiane varie de manière hautement significative entre îlots forestiers (degré de liberté ddl=9, chi-square = 93.1316, P<0,0001) (figure 4). De plus, le test de comparaisons multiples de Kruskal-Wallis précise qu’il n’y a aucune différence significative de densité médiane entre les îlots forestiers Vuyinga, Kalikuku et Vingyo qui présentent les plus fortes densités moyennes. L’analyse de la variance de type II révèle une différence hautement significative de surface terrière moyenne (ddl=9, statistique F =53.568, P<0,0001) entre les îlots forestiers. Il en est de même pour le DBH moyen (ddl=9, F- statistique F =23.163, P<0,0001) et la hauteur de Lorey moyenne (ddl=9, statistique F =208.454 ; P<0,0001). Le test post hoc HSD de Turkey montre que la surface terrière moyenne est significativement plus élevée dans l’îlot forestier Vingyo que dans tous les autres îlots de la zone d’étude. Par contre aucune différence significative n’a été notée entre la surface terrière moyenne des îlots Kagheri et Vuyinga, d’une part, et des îlots Kaviniro, Kaseghe et Mambasa, d’autre part. Quant à la moyenne des diamètres moyens, une différence significative a été observée entre l’îlot Kagheri et tous les autres. Mais il n’a été observé aucune différence significative entre les moyennes des diamètres moyens par placeau des îlots Kamihunga, Kaviniro, Kaseghe et Vuthalengwa, d’une part, et les îlots Vingyo, Vuhima, Mambasa, d’autre part. Enfin, le test post hoc HSD de Turkey indique que les moyennes de hauteur de Lorey par placeau sont significativement plus fortes dans l’îlot Vuyinga que dans tous les autres îlots forestiers étudiés. Mais il n’existe aucune différence significative de hauteurs de Lorey moyennes par placeau entre les îlots Vuhima et Kagheri.
Tableau 4
Abondance, densité, surface terrière, diamètre moyen et hauteur moyenne de Lorey des espèces ligneuses par îlot forestier / Abundance, density, basal area, mean diameter and mean Lorey height of woody species per forest patch
Figure 4
Variation : a) de la densité, b) de la surface terrière, c) du diamètre moyen et d) de la hauteur moyenne de Lorey des espèces ligneuses entre îlots forestiers / Variation in: a) density, b) basal area, c) mean diameter and d) mean Lorey height of woody species between forest patches
État actuel de conservation de la flore ligneuse des îlots forestiers
Au plan international, sur l'ensemble des espèces ligneuses recensées, 84 espèces (80,8 %) sont reportées sur la liste rouge de l’UICN (voir la liste en Annexe 1). Parmi ces espèces, 72 sont classées avec le statut de conservation de « Préoccupations mineures » (LC), 07 espèces (Entandrophragma utile (Dawe & Sprague) Sprague, Grewia louisii R. Wilczek, Guarea thompsonii Sprague & Hutch., Harungana montana Spirlet emend P. Bamps, Khaya anthotheca (Welw.) C. DC., Parinari excelsa Sabine, Prunus Africana (Hook. f.) Kalkman) sont classées « Vulnérables » (VU), 04 espèces (Beilschmiedia louisii Robyns & R. wilczek, Guarea cedrata (A. Chev.) Pellegr, Milicia excelsa (Welw.) C.C. Berg, Mitragyna stipulosa (DC.) Kuntze) sont « Quasi menacées » et 01 espèce (Prioria balsamifera (Vermoesen) Breteler) est déclarée « En danger ». La figure 5 met en évidence la forte pression anthropique sur les ressources ligneuses du massif montagneux de Lubero.
Figure 5
Illustration des menaces anthropiques sur la flore ligneuse des formations forestières du massif montagneux de Lubero : cas de l’îlot forestier de Vingyo / Deforestation in the Vingyo forest patche in the Lubero mountain massif. Photo by Ndavaro (2023)
Légende : UICN = Union Internationale pour la Conservation de la Nature ; LC = Préoccupations mineures ; VU = Vulnérable ; NT = Quasi menacé ; EN = En danger ; NE = Non évalué ; - = absence de l’espèce dans le site d’étude.
Discussion
Diversité spécifique de la flore ligneuse des îlots forestiers
Les résultats issus des inventaires forestiers mettent en évidence une flore ligneuse taxonomiquement riche (104 espèces réparties en 86 genres et 45 familles) dans les îlots forestiers étudiés. Cependant, cette diversité taxonomique est relativement faible comparativement à celles d’autres blocs forestiers d’altitude du Rift Albertin congolais, notamment au parc national de Kahuzi-Biega (212 espèces regroupées en 66 familles et 161 genres) (Imani et al., 2016a) et dans la réserve naturelle d’Itombwe (123 espèces appartenant à 51 familles et 99 genres) (Imani et al., 2021). Cette situation pourrait s’expliquer par le fait que l’ensemble des îlots forestiers de la zone d’étude couvre une aire géographique plus petite (684,64 ha au total) que chacun de deux blocs forestiers évoqués ci-haut, recouvrant respectivement environ 60 000 et 57 320 ha d’espace de terre (Bulambo, 2020 ; Isumbisho et al., 2021). Cela est d’autant plus vrai que plusieurs études (Raherilalao, 2001 ; Cagnolo et al., 2006 ; Kallimanis et al., 2008 ; He et Hubbell, 2011 ; Storch et al., 2012 ; Axelsen et al., 2013 ; He et Hubbell, 2013 ; Vollenweider et al., 2023), basées sur les théories classiques de biogéographie des îles (MacArthur et Wilson, 2001), attestent une diminution significative du nombre d’espèces parallèlement à la réduction de la taille de l’habitat forestier. Par ailleurs, la faible diversité taxonomique ligneuse des îlots forestiers en étude ici résulterait de l’intensité des menaces anthropiques sur les ressources ligneuses qui est plus forte dans les écosystèmes forestiers du massif montagneux de Lubero (Ndavaro et al., 2021) que dans ceux du parc national de Kahuzi-Biega et de la réserve naturelle d’Itombwe, qui sont tous deux des aires protégées inscrites sur le catalogue du Patrimoine forestier mondial de l’UNESCO (Howard et Bertzky, 2020).
La plupart des espèces ligneuses identifiées dans la florule globale des sites d’étude caractérisent également les étages montagnards d’autres massifs forestiers d’altitude, aussi bien de la R.D. Congo (Imani et al., 2016a) que d’autres régions d’Afrique Centrale (Bouxin, 1977 ; Ayambal et al., 2019 ; Mpouam et al., 2020). Ainsi, du point de vue phytogéographique, ces espèces afromontagnardes partagées entre plusieurs zones d’altitude du continent africain correspondent à ce que White (1983) qualifie d’espèces à distribution continentale, et plus précisément de pluri-régionales africaines. La faible diversité spécifique globale mise en évidence par les valeurs de l’indice de Shannon-Wiener, dont la plupart varient de 1,98 à 2,87 bits, corrobore les conclusions de certaines études (Guitet et al., 2015 ; Lisingo, 2016) qui soulignent le fait que les écosystèmes forestiers de montagnes sont relativement pauvres en espèces d’arbres et faiblement diversifiés par rapport à ceux des plaines. Cette situation pourrait s’expliquer par les faibles précipitations annuelles (950 à 1200 mm) qui caractérisent les îlots forestiers des hautes terres de la zone d’étude (Vyakuno, 2006) comparativement aux forêts tropicales des basses terres de la cuvette centrale congolaise où la diversité spécifique élevée d’arbres est souvent associée à une pluviométrie abondante dont la moyenne annuelle est estimée à 1700 mm (Lisingo, 2016). Selon Vyakuno (2006), la pluviosité peu élevée qui caractérise la zone d’étude est due à l’effet de foehn provoqué par les vents soufflant dans le couloir formé par l’infléchissement du relief montagneux. D’autres facteurs environnementaux de nature pédologique, topographique et microclimatique, spécifiques à chaque secteur, pourraient aussi expliquer la différence de la richesse spécifique observée (Zhang et al., 2016a ; Zhong et al., 2019 ; Kabré et al., 2020). À cela s’ajoutent la fréquence et l’intensité des pressions anthropiques sur les ressources ligneuses : exploitation forestière incontrôlée, agriculture itinérante sur brûlis, surpâturage, coupe abusive, feux divers (Bondé et al., 2013 ; Jiagho et al., 2016 ; Tegegne et al., 2016 ; Ndavaro et al., 2021 ; Ndavaro et al., 2023).
Par ailleurs, les résultats relatifs à la diversité spécifique mentionnent l’îlot forestier de Vuyinga comme étant non seulement le plus riche en espèces ligneuses, mais aussi celui présentant la plus forte diversité spécifique. Cela pourrait s’expliquer par le fait qu’en plus d’être l’îlot forestier le plus étendu (228,28 ha), Vuyinga est une forêt sacrée protégée par les communautés locales (Ndavaro et al., 2024). En effet, certaines études ethnoécologiques et ethnobotaniques portant sur les ressources forestières d’Afrique tropicale mentionnent les forêts sacrées parmi les stratégies locales de conservation de la faune et de la flore forestières (Adou Yao et al., 2013 ; Adjahossou et al., 2016 ; Soumah et al., 2018). Le faible nombre d’espèces ligneuses enregistré dans l’îlot forestier de Vingyo serait dû à son étendue plus petite (6 ha) par rapport à celles d’autres îlots forestiers de la zone d’étude. De ce fait, les résultats relatifs à la diversité spécifique des îlots forestiers Vuyinga et Vingyo s’accorderaient avec la théorie biogéographique des îles qui établit un lien étroit entre le nombre d’espèces dans une île donnée et la superficie de cette dernière (MacArthur et Wilson, 2001). Toutefois, une telle conclusion est à prendre avec des pincettes et nécessite une étude plus poussée prenant en compte les étendues de tous les autres îlots forestiers de la zone d’étude. Cela est d’autant plus évident que les résultats relatifs au profil de diversité de Renyi n’ont pas permis de confirmer la suprématie de l’îlot Vuyinga, qui est le plus étendu, sur les autres îlots forestiers en termes de diversité alpha.
Distance écologique entre îlots forestiers
Des dissimilarités considérables dans la composition spécifique des communautés ligneuses de divers îlots forestiers pris par pair ont été mises en évidence dans la présente étude. En effet, pour 82,22 % des 45 pairs d’îlots forestiers évalués, la dissimilarité en termes d’espèces ligneuses selon l’indice de Morisita-Horn est supérieure ou égale 0,5. Cela pourrait être lié au fait que les îlots forestiers investigués se situent à différents étages altitudinaux. En effet, plusieurs études (Cui et Zheng, 2016 ; Zhang et al., 2016b ; Wani et al., 2023) mentionnent l’altitude comme étant un facteur responsable de l’hétérogénéité dans la composition floristique à l’échelle aussi bien mondiale que régionale et locale. De plus, ce résultat sous-entend une intercommunication difficile entre la plupart des îlots forestiers en raison de l’isolement devenu problématique pour la dissémination (échanges inter-îlots de semences d’espèces ligneuses) des espèces d’un îlot à l’autre. Ceci pourrait justifier la faible diversité spécifique observée pour la majorité des îlots forestiers comme le soulignent MacArthur et Wilson (2001).
Diversité structurale de la flore ligneuse des îlots forestiers
Les mesures de la diversité structurale relatives au diamètre moyen et à la hauteur des espèces ligneuses inventoriées dans les sites d’étude s’inscrivent dans les limites des valeurs des paramètres structuraux des arbres des forêts de versant de la dorsale Congo-Nil (diamètre moyen : 0 – 40 cm, hauteur moyenne : 0-25 m) (Pierlot, 1966 ; Vyakuno, 2006). Ces mesures sont relativement similaires à celles obtenues chez les espèces ligneuses inventoriées dans d’autres forêts de montagnes de la R.D. Congo (Imani et al., 2016a, 2016b, 2017). En outre, toutes ces mesures de diversité structurale varient chacune de façon significative entre les îlots forestiers. Les densités et surfaces terrières les plus élevées ont été enregistrées pour les espèces des îlots forestiers Kaviniro, Vuhima, Vuyinga et Kaseghe. Contrairement aux îlots forestiers Kaseghe et Vuhima, le plus grand nombre de pieds d’arbres enregistré dans Vuyinga et Kaviniro résulterait des grandes étendues de leurs superficies. Cependant, les quatre îlots forestiers ayant les densités et les surfaces terrières d’arbres les plus élevées ne sont ni ceux fournis en arbres de plus grand diamètre ni ceux fournis en arbres de plus grande hauteur. On peut en déduire qu’il s’agit là des formations forestières secondaires résultant des régénérations issues des exploitations incontrôlées.
D’un autre côté, la présence des grands pieds d’arbres en diamètre au sein des îlots forestiers Kagheri, Vuyinga, Kalikuku, Vingyo et Vuhima, ainsi qu’en hauteur dans ceux de Kagheri, Vingyo et Vuyinga, suggère que ces forêts reliques regorgent des essences aux attributs structuraux remarquables qui leur confèrent une valeur socio-économique importante pour le bien-être des populations locales. Par ailleurs, cela traduirait des efforts locaux de conservation fournis par les propriétaires de ces écosystèmes forestiers résiduels. Cela est d’autant plus vrai que la gestion des îlots forestiers de Kagheri et de Kalikuku, qui regorgent des essences indigènes et de valeur (Lutumba et al., 2021), a été confiée, depuis près d’une décennie, aux communautés religieuses des Sœurs de la compagnie de Marie et des Pères missionnaires de l’ordre de Sainte Croix de Jésus, alors que celui de Vuyinga est une forêt sacrée pour les communautés riveraines (Mukulumanya et al., 2014 ; Kirereka et al., 2022). Toutefois, ce présupposé effort de conservation locale n’expliquerait pas le cas précis de l’îlot forestier de Vingyo qui, tout en regorgeant des pieds d’arbres de diamètre et de hauteur plus grands (31,3 cm et 17 m), fait partie des îlots forestiers les moins denses. Cette situation résulterait de la plus petite étendue de sa superficie (6 ha) qui est une conséquence des fortes pressions anthropiques exercées sur les écosystèmes forestiers tropicaux en général (Vyakuno, 2006 ; Musumba et al., 2019 ; Ndavaro et al., 2021), et cet écosystème forestier de la zone d’étude en particulier. Aussi, la faible densité moyenne (208 pieds/ha), le diamètre moyen élevé (42,1 cm) et la hauteur de Lorey moyenne élevée (18,8 m) des arbres de l’îlot forestier de Kagheri pourraient sous-entendre des communautés d’arbres vieillissantes dans ce site.
Enfin, une variabilité significative des attributs structuraux entre les peuplements ligneux des divers îlots forestiers a été mise en évidence par cette étude. Cette variabilité d’attributs structuraux pourrait être due soit aux écarts entre les superficies des îlots forestiers soit à l’effet des facteurs environnementaux : (i) gradients d’altitude, (ii) pluviométrie, (iii) température, (iv) luminosité, (v) propriétés édaphiques (MacArthur et Wilson, 2001 ; Charahabil et Akpo, 2018 ; Mseddia et al., 2021) et des actions anthropiques comme l’exploitation forestière, l’agriculture, le surpâturage) (Ndavaro et al., 2021). Dans ce dernier cas, il y a lieu de constater que certains îlots forestiers sont marqués par la destruction des ligneux et leur remplacement par des cultures vivrières (pommes de terre, maïs, choux, haricots, petits pois, carottes, oignons, et cetera) et des pâturages (Musumba et al., 2019 ; Musumba et Katcho, 2019).
Implications pour la conservation de la flore ligneuse des îlots forestiers
Du point de vue de conservation, 87 espèces ligneuses reportées dans cette étude sont listées sur la liste rouge de l’UICN au niveau mondial, dont 74 ont un statut de préoccupations mineures (LC). Ainsi, on peut déduire que le potentiel forestier ligneux de la zone d’étude n’est pas particulièrement menacé à l’échelle mondiale. Cependant, sur le plan local, les pressions anthropiques actuelles qui pèsent sur les formations forestières (exploitation incontrôlée des arbres, agriculture, surpâturage, établissement humain, exploitation forestière) (Vyakuno, 2006 ; Ndavaro et al., 2021 ; Ndavaro et al., 2023) pourraient laisser croire à une menace réelle sur les ressources végétales ligneuses de ces îlots forestiers. Ainsi, il est donc important et urgent de procéder à l’évaluation du statut de conservation à l’échelle nationale (R.D. Congo) selon l’UICN de toutes les espèces ligneuses inventoriées dans le cadre de la présente étude. Par ailleurs, les espèces déclarées « Vulnérables » (VU), « Quasi menacées » (NT) et « En danger » (En) sur la liste rouge de l’UICN à l’échelle mondiale méritent une attention particulière des décideurs politiques et des gestionnaires des forêts. Des mesures urgentes de conservation doivent être prises pour empêcher leur progressive disparition. En effet, en plus de la promotion de la régénération naturelle de ces espèces menacées, celles-ci peuvent faire l’objet de domestication ou de plantation (agroforesterie/agroécologie), afin d’améliorer leur statut de conservation tout au moins au niveau local (Dicko, 2017). À cet effet, les aspects scientifiques de base sur la biologie de la reproduction végétale, les variations génétiques intraspécifiques, le suivi de la régénération in situ et les stratégies locales de conservation des ressources végétales (Ewédjè et al., 2015 ; Adjahossou et al., 2016 ; Sèwadé et al., 2016 ; Dicko, 2017 ; Ewédjè et al., 2017) doivent être pris en compte dans les recherches fondamentales. Bien plus, pour que les ressources ligneuses des îlots forestiers de la zone d’étude contribuent de façon durable au développement socio-économique et culturel des populations locales, il est nécessaire que leur prélèvement se fasse en tenant compte des mesures d’exploitation forestière à impact réduit et que les bénéficiaires directs soient sensibilisés sur le caractère unitaire du patrimoine forestier de la zone d’étude. Enfin, il est important de déterminer le diamètre minimal d’exploitabilité des principales essences commercialisables et de procéder non seulement à l’enrichissement des peuplements ligneux des îlots forestiers, mais aussi à la mise en œuvre de mesures restrictives concernant l’exploitation des espèces ligneuses déclarées menacées.
Conclusion
Cette étude a permis de contribuer à l’amélioration de connaissance de la diversité spécifique et structurale de la flore ligneuse des îlots forestiers du massif montagneux de Lubero. Cette flore ligneuse se différencie d’une diversité spécifique généralement faible en dépit d’une diversité taxonomique élevée enregistrée pour le compte de la florule globale de tous les sites d’étude. Aussi, en termes de diversité alpha, la suprématie d’un quelconque îlot forestier sur d’autres n’a pu être confirmée. Bien plus, des similitudes considérables ainsi que des distanciations écologiques très poussées, basées sur la composition spécifique, existent entre les îlots forestiers pris deux à deux. En ce qui concerne la diversité structurale, la densité moyenne, le diamètre moyen, la surface terrière moyenne et la hauteur de Lorey d’espèces d’arbres sont relativement faibles et varient suivant les îlots forestiers. Enfin, les informations recueillies de cette étude ont permis de faire le diagnostic de l’état actuel de conservation de la flore ligneuse de la zone d’étude. Elles soulignent l’urgente nécessité pour les décideurs politiques et les gestionnaires des forêts de prendre des mesures appropriées de conservation et de gestion durable des espèces ligneuses déclarées « Vulnérables » (7 espèces), « Quasi menacées » (4 espèces) et « En danger » (1 espèce).
Parties annexes
Annexe
Annexe 1. Espèces ligneuses inventoriées par îlot forestier avec mention de leurs familles, statuts de conservation à l’échelle mondiale selon l’UICN et densités
Tableau
Légende : UICN = Union Internationale pour la Conservation de la Nature ; LC = Préoccupations mineures ; VU = Vulnérable ; NT = Quasi menacé ; EN = En danger ; NE = Non évalué ; - = absence de l’espèce dans le site d’étude.
Remerciements
Les travaux d’inventaires forestiers ont bénéficié du soutien financier du Centre d'appui pour le développement intégral en milieu rural (CADIMR/RDC) et de Son Excellence Monseigneur Sikuli Paluku Melchisédech, évêque du diocèse de Butembo-Beni. Les auteurs remercient sincèrement le Botaniste Kambere Mbangi et le Forestier Muhindo Bweya, pour l’aide apportée à la réalisation des inventaires forestiers et l’identification des espèces.
Notes
-
[1]
Pour plus d’informations, voir le site de The Plant List, [En ligne], URL : http://www.theplantlist.org/
-
[2]
Pour plus d’informations, voir le site de Tropicos, [En ligne], URL : https://www.tropicos.org/home
-
[3]
Pour plus d’informations, voir le site de The World Flora Online (WFO), [En ligne], URL : http://www.worldfloraonline.org
-
[4]
Pour plus d’informations, voir le site de Plants of the World Online, [En ligne], URL : https://powo.science.kew.org
-
[5]
Pour plus d’informations, voir le site de l’UICN, [En ligne], URL : http://www.iucnredlist.org/
Bibliographie
- Adjahossou, S. G. C., G. N. Gouwakinnou, D. T. Houehaou, A. I. Sode, A. S. Yaoitcha, M. R. B. Houinato et B. Sinsin, 2016, Efficacité des aires protégées dans la conservation d’habitats favorables prioritaires de ligneux de valeur au Bénin, Bois et Forêts des Tropiques, 328, pp. 67-76.
- Adjonou, K., A. R. Radji, A. D. Kokutse et K. Kokou, 2016, Considération des caractéristiques structurales comme indicateurs écologiques d’aménagement forestier au Togo (Afrique de l’Ouest), VertigO. La revue électronique en sciences de l’environnement, 16, 1, [En ligne], URL : https://journals.openedition.org/vertigo/17004
- Adou Yao, C., K. Kpangui, K. Kouao, L. Adou, B. Vroh et K. N’Guessan, 2013, Diversité floristique et valeur de la forêt sacrée Bokasso (Est de la Côte d’Ivoire) pour la conservation, VertigO. La revue électronique en sciences de l'environnement, 13, 1, [En ligne], URL : https://journals.openedition.org/vertigo/13500
- Axelsen, J. B., U. Roll, L. Stone et A. Solow, 2013, Species–area relationships always overestimate extinction rates from habitat loss: comment, Ecology , 94, 3, pp. 761-763.
- Ayambal, J. A., A. N. Fuashi et E. A. Orock, 2019, Tree Composition and Ecological Structure of Akak Forest Area, Environment and Natural Resources Research , 9, 4, pp. 23-44.
- Blanchard, E., 2016, Diversité structurale des forêts denses humides de la Province Nord de Nouvelle Calédonie : de l’arbre au paysage, Thèse de doc. Unique, Université de Montpellier, France, 267 p.
- Bogaert, J., A. Mahamane, 2005, Ecologie du paysage : cibler la configuration et l’échelle spatiale, Annales des Sciences Agronomiques du Bénin, 7, 1, pp. 39-68.
- Bondé, L., O. Ouédraogo, F. Kagembèga et J. I. Boussin, 2013, Impact des gradients topographique et anthropique sur la diversité des formations ligneuses soudaniennes, Bois et Forêts des Tropiques, 318, 4, pp. 15-52.
- Bouxin, G., 1977, Structure de la strate arborescente dans un site de la forêt de montagne du Rwanda (Arfique centrale), Vegetatio, 33, pp. 65-78.
- Bulambo, A. K., 2020, The Protection of the Gorilla ( Gorilla beringei graueri ) from Itombwe in the Democratic Republic of the Congo (DRC): A case for reconciling environmental and property rights, US-China Law Review , 17, 1, pp. 1-8.
- Cagnolo, L., M. Cabido et G. Valladares, 2006, Plant species richness in the Chaco Serrano Woodland from central Argentina: Ecological traits and habitat fragmentation effects, Biological Conservation , 132, 4, pp. 510-519.
- Charahabil, M. M., L. E. Akpo, 2018, Effet des facteurs environnementaux sur la structuration de la flore ligneuse du Karthala (Grande-Comore, Océan indien). VertigO. La revue électronique en sciences de l'environnement, 18, 1, [En ligne], URL : https://id.erudit.org/iderudit/1058440ar
- Claessens, L., S. Petit et P. Lejeune, 2017, Inventaires forestiers d’aménagement : retour de formation, Forêt.Nature, 144, pp. 40-50.
- Colwell, R. K., 2006, EstimateS: Statistical Estimation of Species Richness and Shared Species from Samples. Version 8.0.
- Cui, W., X. X. Zheng, 2016, Spatial Heterogeneity in Tree Diversity and Forest Structure of Evergreen Broadleaf Forests in Southern China along an Altitudinal Gradient, Forests , 7, 12, pp. 1-12.
- De Mendiburu, F., 2021, Agricolae: Statistical Procedures for Agricultural Research. R Package Version 1.3-5.
- Dicko, A., 2017, Ethnobotanique, structure et phénologie de Lophira lanceolata Tiegh. ex Keay (Ochnaceae) au Bénin : Implications pour sa conservation et sa gestion durable, Thèse de doc. Unique, Département de Monitoring et Conservation de la Biodiversité, Université de Parakou, Parakou, Bénin, 192 p.
- Eba’a Atyi, R., F. Hil Hiol, G. Lescuyer, P. Mayaux, P. Defourny, N. Bayol, F. Saracco, D. Pokem, R. Sufo Kankeu et R. Nasi, 2022, The Forest of the Congo Basin : State of the Forests 2021 , CIFOR, Bogor (Indonesia), 420 p.
- Ewédjè, E. B. K., A. Ahanchede, O. J. Hardy et A. C. Ley, 2015, Reproductive biology of Pentadesma butyracea (Clusiaceae), source of a valuable non timber forest product in Benin, Plant Ecology and Evolution , 148, 2, pp. 213-228.
- Ewédjè, E. B. K., A. Ahanchédé et O. J. Hardy, 2017, Breeding system, gene dispersal and small-scale spatial genetic structure of a threatened food tree species, Pentadesma butyracea (Clusiaceae) in Benin, Conservation Genetics , 18 , pp. 799–811.
- Global Forest Watch, 2021, Global primary forest loss. Washington, World Resources Institute.
- Guitet, S., O. Brunaux, J. J. De Granville, S. Gonzalez et C. Richard-Hansen, 2015, Catalogue des habitats forestiers de Guyane, Guyane, Direction de l’Environnement, de l’Aménagement et du Logement (DEAL), 120 p.
- He, F., S. Hubbell, 2011, Species–area relationships always overestimate extinction rates from habitat loss, Nature , 473 , pp. 368-371.
- He, F., S. Hubbell, 2013, Estimating extinction from species–area relationships: why the numbers do not add up, Ecology , 94, 9, pp. 1905-1912.
- Horn, H. S., 1966, Measurement of "Overlap" in Comparative Ecological Studies, The American Naturalist , 100, 914, pp. 419-424.
- Howard, P. C. N., B. Bertzky, 2020, Le patrimoine mondial naturel en Afrique : avancées et perspectives. Programme BIOPAMA, Bureau régional de l’UICN pour l’Afrique orientale et australe (ESARO), Nairobi, Ouagadougou, Bureau régional de l’UICN pour l’Afrique de l’Ouest et Centrale (PACO), 85 p.
- Imani, M. G., L. Zapfack, B. Riera, I. J. C. Mwanga Mwanga, F. Bulonvu et F. Boyemba, 2016a, Variabilité structurale des peuplements d’arbres en forêt de montagne du Parc National de Kahuzi-Biega et ses environs, RD Congo, European Scientific Journal, 12, 23, pp. 88-111.
- Imani, M. G., L. Zapfack, M. J. D. Mangambu, P. Penedimanja, I. J. C. Mwanga Mwanga, F. Boyemba et C. Amani, 2016b, Caractérisations structurale, floristique et biomasse ligneuse du peuplement à Hagenia abyssinica du Parc National de Kahuzi-Biega (Rift Albertin, RDC), European Scientific Journal, 12, 15, pp. 189-209.
- Imani, M. G., F. Boyemba, S. Lewis, L. L. Nabahungu, K. Calders, L. Zapfack, B. Riera, C. Balegamire et A. Cuni-Sanchez, 2017, Heightdiameter allometry and above ground biomass in tropical montane forests: Insights from the Albertine Rift in Africa, PloS ONE , 12, 6, pp. 1-20.
- Imani, M. G., J. Kalume, R. Marchant, K. Calders, R. Batumike, F. Bulonvu et A. Cuni-Sanchez, 2021, Tree diversity and carbon stocks in the Itombwe Mountains of eastern DR Congo, bioTROPICA , 53, 6, pp. 1594-1605.
- Isumbisho, P. M., J. D. M. Makoso, R. Manirakiza et M. Lennert, 2021, Problem of access to land and natural resources for indigenous Batwa in the outskirts of the Kahuzi-Biega National Park (PNKB) in the East of the D R. Congo, International Journal of Tropical Geology, Geography and Ecology , 45, 3, pp. 397-416.
- Jiagho, E. R., L. Zapfack, L. P. R. Kabelong Banoho, M. Tsayem-Demaze, J. Corbonnois et P. Tchawa, 2016, Diversité de la flore ligneuse à la périphérie du Parc national de Waza (Cameroun). VertigO. La revue électronique en sciences de l'environnement, 16, 1, [En ligne], URL : http://journals.openedition.org/vertigo/17249
- Kabré, B., M. Belem/Ouédraogo, B. Lankoandé et A. Ouédraogo, 2020, Variabilité démographique de Saba senegalensis (A. DC.) Pichon suivant le gradient climatique au Burkina Faso, Bois et Forêts des Tropiques, 345, 3, pp. 73-83.
- Kallimanis, A. S., A. D. Mazaris, J. Tzanopoulos, J. M. Halley, J. D. Pantis et S. P. Sgardelis, 2008, How does habitat diversity affect the species–area relationship? Blobal Ecology and Biogeography, 17, 4, pp. 532-538.
- Kirereka, R. M., C. K. Kitonda, M. K. Kyana et E. K. Muhesi, 2022, Attitude de la population riveraine face à la conservation communautaire : Cas de la réserve forestière de Kalikuku, Nord Kivu, République Démocratique du Congo, International Journal of Innovation and Applied Studies, 35, 4, pp. 551-558.
- Lebrun, J. P., A. L. Stork, 1991-1997, Enumération des plantes à fleurs d’Afrique tropicale, Genève, Conservatoire du jardin botanique de Genève I, II, III, IV, 249, 257, 341 et 712 p.
- Leclercq, J., 1969, Cartes des sols et de la végétation du Congo, du Rwanda et du Burundi. 26. Nord-Kivu et région du lac Edouard. A. Sols. Carte de reconnaissance de la région de Beni-Lubero-N. Échelle : 1/200 000, Bruxelles, Institut Géographique Militaire, Publication de l’INEAC, 14 p.
- Lisingo, J., G. Dauby, O. Hardy, F. Boyemba, J. R. Makana et L. Ndjele, 2015, Structures spatiales de la richesse spécifique dans quelques blocs forestiers du nord-est du bassin congolais : implication pour la diversité régionale et la conservation, Revue internationale de Géologie, de Géographie et d’Ecologie Tropicales, 39, 2, pp. 169-184.
- Lisingo, J., 2016, Organisation spatiale de la diversité spécifique d’arbres en forêt tropicale dans le bassin nord-est de la Cuvette Centrale Congolaise, Thèse de doc. Unique, Université de Kisangani, R.D. Congo, 168 p.
- Lubala, G. C., 2022, Impact des Facteurs Abiotiques sur la Croissance d’Arbres de Reboisement dans la Lutte Contre le Réchauffement Climatique à Beni/Lubero, Multidisciplinary Research Academic Journal, 7, 1, pp. 67-83.
- Lutumba, S. A., K. Zhang, K. E. Muhesi, C. J. A. Kouassi et M. M. Mukombe, 2021, Influence of Spatial Distribution on the Regeneration of Piptadeniastrum africanum and Ocotea usambaernsis in Kalikuku, Lubero, North Kivu, Democratic Republic of Congo, Open Journal of Ecology , 11 , pp. 527-539.
- MacArthur, R. H., E. O. Wilson, 2001, The Theory of Island Biogeography , Princeton, Reprint edition of 1967, Princeton University Press, 224 p.
- Magurran, A. E., 2021, Measuring biological diversity, Current Biology , 31, 19, pp. 1174-1177.
- Mégevand, C., A. Mosnier, J. Mourticq, K. Sanders, N. Doetinchem et C. Streck, 2013, Dynamique de la déforestation dans le bassin du Congo. Réconcilier la croissance économique et la protection de la forêt, Washington, Document de la Banque Mondiale (Environnement et développement durable), 179 p.
- Miabangana, E. S., 2020, Structure, composition et diversité floristiques de la forêt de la Djoumouna (République du Congo), European Scientific Journal, 16, 12, pp. 179-203.
- Miabangana, E. S., F. Malaisse, 2020, Structure, composition et diversité floristiques de l’île forestière Loufézou dans le Plateau des Cataractes (République du Congo), Revue Internationale de Géologie, de Géographie et d'Ecologie Tropicales, 44, 2, pp. 205-220.
- Morisita, M., 1959, Measuring of interspecific association and similarity between communities. Memoirs of the Faculty of Science , Kyushu University, Series E (Biology), 3, pp. 65-80.
- Mpouam, A. R., 2020, État des lieux de l’exploitation de Prunus africana (Hook.f.) Kalkman (Rosaceae) dans la région de l’Adamaoua, Cameroun, International Journal of Biological and Chemical Sciences, 16, 4, pp. 1507-1521.
- Mseddia, K., A. Alghamdib, M. Abdelgadirb, S. Sharawyb, M. Chaieba et T. Miller, 2021, Phytodiversity distribution in relation to altitudinal gradient in Salma Mountains – Saudi Arabia, Global Ecology and Conservation , 27, pp. 1-13.
- Mukulumanya, M., C. Vermeulen, A. Kalinda et M. Mate, 2014, La gestion communautaire des ressources naturelles à l’Est de la R.D.Congo : expérience de l’UGADEC, Parcs et Réserves, 68, 4, pp. 11-15.
- Musumba, T. P., K. Katcho, 2019, Assessing Forest Cover Change and Deforestation Hot-Spots in the North Kivu Province, DR-Congo Using Remote Sensing and GIS, American Journal of Geographic Information System , 8, 2, pp. 39-54.
- Musumba, T. P., K. Malengera et K. Katcho, 2019, Key Factors Driving Deforestation in North-Kivu Province, Eastern DR-Congo Using GIS and Remote Sensing, American Journal of Geographic Information System , 8, 1, pp. 11-25.
- Ndavaro, N. K., R. Dramani, K. G. Mulondi, W. M. Sahani, S. S. H. Biaou et A. K. Natta, 2021, Dynamique spatio-temporelle de l’occupation du sol et du couvert forestier dans les Hautes Terres Fraîches de Lubero (R.D. Congo), Revue Internationale de Géologie, de Géographie et d’Écologie Tropicales, 45, 4, pp. 641-658.
- Ndavaro, N. K., R. Dramani, A. D. M. T. Hegbe, M. W. Sahani, H. S. S. Biaou et A. K. Natta, 2023, Uses of Oldeania alpina (K. Schum.) Stapleton (Poaceae) and local perceptions of its spatio-temporal dynamics in Lubero cool highlands region (DR Congo), Ethnobotany Research and Applications , 25, 7, pp. 1-20.
- Ndavaro, K. N., A. D. M. T. Hegbe, R. Dramani, A. Dicko, W. M. Sahani et A. K. Natta, 2024, Effect of age, gender and formal education on endogenous knowledge of woody plants in communities bordering forest patches of the Lubero Mountain Massif (DR Congo), Ethnobotany Research and Applications , 28, pp. 1–21.
- Nsangua, B. M., H. N. Nseya, F. B. Boyemba, R. L. Katusi, F. M. Mbayo et L. M. Mbuyu, 2018, Etude De La Variabilite Structurale Et Floristique Des Forets Sur Terre Ferme En Chefferie De Bahema-Boga (Province De L’ituri, RDC), European Scientific Journal, 14, 30, pp. 500-519.
- Ostertag, R., F. Inman-Narahari, S. Cordell, C. P. Giardina et L. Sack, 2014, Forest Structure in Low-Diversity Tropical Forests: A Study of Hawaiian Wet and Dry Forests, PLoS One , 9, pp. 1-8.
- Oumar, A., F. Choula, O. Wamba Fotsop, R. J. Priso et V. D. Taffouo, 2021. Paramètres de structure, état phénologique de Triplochiton scleroxylon K. Schum. et diversité spécifique des essences accompagnatrices dans la forêt du Sud-Est Cameroun, International Journal of Biological and Chemical Sciences, 15, 2, pp. 707-727.
- Parmentier, I., R. J. Harrigan, W. Buermann, E. T. A. Mitchard, S. Saatchi, Y. Malhi, F. Bongers, W. D. Hawthorne, M. E. Leal, S. L. Lewis, L. Nusbaumer, D. Sheil, M. S. M. Sosef, K. Affum-Baffoe, A. Bakayoko, G. B. Chuyong, C. Chatelain, J. A. Comiskey, G. Dauby, J. L. Doucet, S. Fauset, L. Gautier, J. F. Gillet, D. Kenfack, F. N. Kouame, E. K. Kouassi, L. A. Kouka, M. P. E. Parren, K. S. H. Peh, J. M. Reitsma, B. Senterre, B. Sonke, T. C. H. Sunderland, M. D. Swaine, M. G. P. Tchouto, D. Thomas, J. L. C. H. Van Valkenburg et O. J. Hardy, 2011, Predicting alpha diversity of African rain forests: models based on climate and satellite-derived data do not perform better than a purely spatial model, Journal of Biogeography , 38, 6, pp. 1164-1176.
- Picard, N., 2006, Méthode d’inventaire forestier. Projet de développement rural participatif dans le moyen Atlas central (projet Khenifra), Report, Cirad 00147247, 42 p.
- Pielou, E. C., 1966, The measurement of diversity in different types of biological collections, Journal of Theoretical Biology , 13, pp. 131-144..
- Pierlot, R., 1966, Structure et composition des forêts denses d’Afrique centrale, spécialement celles du Kivu, Bruxelles, ARSOM, Classe des Sciences naturelles et médicales-N.S.-XVI-4., 367 p.
- R Core Team, 2021, R: A language and environment for statistical computing, Vienna (Austria), R Foundation for Statistical Computing. Retrieved from.
- Raherilalao, M. J., 2001, Effets de la fragmentation de la forêt sur les oiseaux autour du parc national de Ranomafana (Madagascar), Revue d’Ecologie (Terre et Vie), 56, pp. 389-406.
- Renyi, A., 1961, On Measures of Entropy and Information, 547-561, Proceedings of the Fourth Berkeley Symposium on Mathematical Statistics and Probability, Volume 1 : Contribution to the Theory of Statisctics, Berkeley (California), University of California Press.
- Sèwadé, C. A., F. Aihou, A. B. Fandohan, T. D. Houéhanou et M. Houinato, 2016, Diversité, priorité pastorale et de conservation des ligneux fourragers des terres de parcours en zone soudano-guinéenne du Bénin, Biotechnologei, Agriculture, Société et Environnement, 20, pp. 113-129.
- Shannon, C. E., W. Wiener, 1963, The Mathematical Theory of Communication , Urbana, University of Illinois Press, 125 p.
- Soumah, F. S., D. Kaniewski et K. Kokou, 2018, Les forêts sacrées de Guinée : entre écologie et conservation, Comptes Rendus Biologies, 341, pp. 433-443.
- Storch, D., P. Keil et W. Jetz, 2012, Universal species–area and endemics–area relationships at continental scales, Nature , 488 , pp. 78-81.
- Sys, C., 1992, Les zones agro-écologiques comme base d’un aménagement rationnel des sols du Nord-Kivu (Zaïre). Bulletin des Séances. Académie Royale des Sciences d’Outre-Mer, 38, 2, pp. 225-243.
- Tchatchou, B., D. J. Sonwa, S. Ifo et A. M. Tiani, 2015, Déforestation et dégradation des forêts dans le bassin du Congo : Etat des lieux, causes actuelles et perspectives. Papier occasionnel 120, Bogor, Center for International Forestry Research (CIFOR), 47 p.
- Tegegne, Y. T., M. Lindner, K. Fobissie et M. Kanninen, 2016, Evolution of drivers of deforestation and forest degradation in the Congo Bassin forests: Exploring possible policy options to address forest loss, Land Use Policy , 51, pp. 312-324.
- The Angiosperm Phylogeny Group, M. W., Chase, M. J. M. Christenhusz, M. F., Fay, J. W. Byng, W. S. Judd, D. E. Soltis, et al. 2016. An Update of the Angiosperm Phylogeny Group Classification for the Orders and Families of Flowering Plants: APG IV. Botanical Journal of the Linnean Society , 181, pp. 1–20.
- Trueblood, D. D., E. D. Gallagher et D. M. Gould, 1994, Three stages of seasonal succession on the Savin Hill Cove mudflat, Boston Harbor, Limnology and Oceanography , 39, 6, pp. 1440-1454.
- Verrue, V., 2001, Les inventaires de gestion dans les plantations résineuses, Gembloux, Note Technique Forestière de Gembloux 2, 12 p.
- Vollenweider, P., G. Hildbrand, D. De Masi, K. Gavazov, V. Zufferey, A. Buttler et G. V. Arx, 2023, Above- and below-ground responses to experimental climate forcing in two forb species from montane wooded pastures in Switzerland, Functional Ecology , 37, 2, pp. 432-446.
- Vyakuno, K., 2006, Pression anthropique et aménagement rationnel des hautes terres de Lubero en R.D.C. Rapports entre société et milieu physique dans une montagne équatoriale, Thèse de Doc. Unique, Université de Toulouse II-Le Mirail, France, 485 p.
- Wani, Z. A., V. S. Negi, J. A. Bhat, K. V. Satish, A. Kumar, S. Khan, R. Dhyani, S. Siddiqui, R. N. Al-Qthanin et S. Pant, 2023, Elevation, aspect, and habitat heterogeneity determine plant diversity and compositional patterns in the Kashmir Himalaya, Frontiers in Forests and Global Change, 6, 1019277.
- White, F., 1983, The vegetation of Africa: a descriptive memoir to accompany the Unesco/AETFAT/UNSO vegetation map of Africa, Paris, Natural Resources Research, 20, UNESCO, 356 p.
- Zhang, C., X. Li, L. Chen, G. Xie, C. Liu et S. Pei, 2016a, Effects of topographical and edaphic factors on tree community structure and diversity of subtropical mountain forests in the Lower Lancang River Basin, Forests , 7, 222.
- Zhang, W., D. Huang, R. Wang, J. Liu et N. Du, 2016b, Altitudinal patterns of species diversity and phylogenetic diversity across temperate mountain forests of northern China, PLoS One , 11, e0159995.
- Zhong, Q., S. Zhang, H. Chen, T. Li, C. Zhang, X. Xu, Z. Mao, G. Gong, O. Deng, L. Deng, Y. Zhang, Y. Pu et L. Wang, 2019, The influence of climate, topography, parent material and vegetation on soil nitrogen fractions, Catena , 175, pp. 329-338.
Liste des figures
Figure 1
Localisation des sites d’étude dans le massif montagneux de Lubero / Location of the study sites in the Lubero mountain massif
Figure
Figure
Figure
Figure
Figure
Figure
Figure
Figure
Figure
Figure
Figure
Figure
Figure 2
Profil de diversité de Renyi des îlots forestiers / Rényi diversity profile of forest patches
Tableau 3
Distance écologique inter-îlots basée sur les indices de Morisita-Horn et de NNESS / Inter-patches ecological distance based on Morisita-Horn and NNESS indices
Figure 3
Dendrogramme de la catégorisation écologique des îlots forestiers selon l’indice de similarité de Morisita-Horn / Dendrogram of the ecological categorisation of forest patches according to the Morisita-Horn similarity index
Figure 4
Variation : a) de la densité, b) de la surface terrière, c) du diamètre moyen et d) de la hauteur moyenne de Lorey des espèces ligneuses entre îlots forestiers / Variation in: a) density, b) basal area, c) mean diameter and d) mean Lorey height of woody species between forest patches
Figure 5
Illustration des menaces anthropiques sur la flore ligneuse des formations forestières du massif montagneux de Lubero : cas de l’îlot forestier de Vingyo / Deforestation in the Vingyo forest patche in the Lubero mountain massif. Photo by Ndavaro (2023)
Liste des tableaux
Tableau 1
Nombre de placeaux d’échantillonnage par site d’étude / Number of sample plots per study site
Tableau 2
Diversité spécifique par îlot forestier / Specific diversity by forest patch
Tableau 4
Abondance, densité, surface terrière, diamètre moyen et hauteur moyenne de Lorey des espèces ligneuses par îlot forestier / Abundance, density, basal area, mean diameter and mean Lorey height of woody species per forest patch
Tableau