Résumés
Résumé
Les pesticides sont des substances chimiques et naturelles destinées à détruire, combattre ou repousser les organismes indésirables ou nuisibles qui causent des dommages aux cultures et produits agricoles. Leur utilisation permet aussi d’entretenir les espaces publics et les voies ferrées. Ces utilisations multiples des pesticides expliquent leur présence dans divers compartiments environnementaux comme l’eau, les sols et l’air. Cette présence dans l’environnement a des conséquences néfastes sur les êtres vivants, en particulier chez l’Homme où l’exposition aux pesticides peut causer des maladies neurodégénératives, congénitales et divers types de cancer. Il est donc nécessaire de contrôler les sources d’émission, réduire leurs transferts dans l’environnement et traiter les milieux d’exposition contaminés à l’aide de procédés d’épuration efficaces comme les procédés d’oxydation avancée (POA). Dans cette revue de synthèse bibliographique, l’accent est mis sur les différents paramètres opératoires qui influencent l’efficacité des procédés électrochimiques, photochimiques et électro-photochimiques dans le traitement des eaux contaminées par les pesticides. De manière globale, l’efficacité des POA est influencée par la nature de l’effluent à traiter (synthétique ou réel), le pH, et le temps de traitement. Les procédés électrochimiques sont influencés par la nature des électrodes et la densité du courant appliquée. Les procédés photochimiques comme la photocatalyse sont influencés par la nature et la concentration du photocatalyseur et par la longueur d’onde de la source lumineuse. Les procédés électro-photochimiques comme l’électro-photocatalyse sont influencés par la nature de la photo-anode. Cette revue de littérature a permis de montrer l’efficacité de POA pour la dégradation totale et la minéralisation partielle de l’atrazine en concentration initiale identique (C0 = 0,1 mM).
Mots-clés :
- Électro-photochimique,
- pesticides,
- procédés d’oxydation avancée,
- toxicité
Abstract
Pesticides are chemical substances intended to eliminate undesirable and harmful organisms that cause damage to crops and agricultural products. They also help maintain roads and public areas. These uses and emission sources, associated with transfer pathways such as erosion and runoff, explain the presence of pesticides in various environmental compartments. The presence of pesticides in the environment is a source of toxicity to many organisms, particularly to humans who may undergo neurodegenerative and congenital diseases and various forms of cancer. Therefore, it is necessary to control the emission sources, to reduce the transfer of pesticides into the environment and to treat contaminated media using efficient processes such as advanced oxidation processes (AOPs). This review focuses on the various operating parameters that influence the effectiveness of electrochemical, photochemical and electro-photochemical processes during the treatment of water contaminated by pesticides. Generally, the effectiveness of AOPs is influenced by the nature of influent (synthetic or real), the pH and the treatment time. Electrochemical processes are influenced by the nature of the electrodes and current density applied. Photochemical processes such as photocatalytic processes are influenced by the light source, the nature and concentration of the photocatalyst. The electro-photochemical processes such as electro-photocatalysis are influenced by the nature of the photo-anode. This review has shown the effectiveness of AOPs for the total degradation and the partial mineralization of atrazine when considering an identical initial concentration (C0 = 0.1 mM).
Keywords:
- Advanced oxidation processes,
- electro-photochemical,
- pesticides,
- toxicity
Corps de l’article
1. Introduction
La population mondiale est estimée aujourd’hui à 7,2 milliards de personnes et d’ici 2050 à 9,6 milliards (GERLAND et al., 2014), ce qui entraînera une hausse très importante des besoins alimentaires. Pour satisfaire cette hausse, l’utilisation des pesticides présente une solution efficace (COOPER et DOBSON, 2007), car ils protègent les cultures contre les insectes ravageurs, les agents pathogènes et les adventices qui sont à l’origine de pertes de production agricole (PIMENTEL, 2009).
Ainsi, le marché de la vente et de la consommation mondiale des pesticides ne cesse d’augmenter (DROGUI et LAFRANCE, 2012). En 2011, le marché mondial des importations de pesticides représentait 300 milliards $ US et celui des exportations 280 milliards $ US (FAO, 2014). Les pays comme la Chine, les États-Unis, la France, le Japon, l’Inde et le Brésil figurent parmi les plus grands producteurs et consommateurs de pesticides dans le monde. Les herbicides sont les composés les plus utilisés en agriculture, mais aussi pour l’entretien des jardins, des terrains de golf (BLANCHOUD et al., 2007) et des voies ferrées (BÖRJESSON et al., 2004; RAMWELL et al., 2004; SCHWEINSBERG et al., 1999). Parmi les herbicides les plus utilisés, on peut citer le glyphosate, le S-métolachlore, l’atrazine, le diuron et le 2,4-D (acide 2,4-Dichlorophénoxyacétique) qui, dans leurs modes d’action, inhibent la photosynthèse des plantes (DUKE, 1990).
Cependant, l’utilisation abusive des pesticides peut être à l’origine du développement de formes de résistance chez les adventices (DÉLYE et al., 2013; DEVINE, 1997; POWLES et MATTHEWS, 1992) et chez les insectes (HARRIS et al., 2010; TIRELLO et al., 2012). À la suite de cette utilisation abusive, le lessivage des terres agricoles entraîne les résidus de pesticides et leurs sous-produits de dégradation dans diverses matrices environnementales comme les eaux de surface (ENSMINGER et al., 2013), les eaux souterraines (LAMERS et al., 2011) et les sédiments de rivière (KURANCHIE et al., 2012).
Cette présence de pesticides dans l’environnement a des impacts sur la santé publique. D’après EDDLESTON et al. (2002) l’Organisation mondiale pour la santé (OMS) estime qu’il y a chaque année trois millions de cas d'empoisonnement et 220 000 morts causés par les pesticides. Les pesticides peuvent également être la source de maladies dégénératives (GAUTHIER et al., 2001; HANCOCK et al., 2008) et provoquer la naissance de prématurés (RINSKY et al., 2012). Par ailleurs, l’utilisation des pesticides constitue une source de toxicité chez les organismes aquatiques (ANNETT et al., 2014).
Au regard des conséquences environnementales et sanitaires liées à l’utilisation des pesticides, la mise en oeuvre de techniques efficaces de dépollution pour le traitement des eaux et autres matrices environnementales contaminées par les pesticides s’avère nécessaire. Dans le traitement des eaux, on peut citer des exemples comme la dégradation du chlorpyrifos (GHANEM et al., 2007b) et de l’atrazine par boues activées; l’adsorption du glyphosate (HU et al., 2011), du S-métolachlore (OTERO et l., 2014), du 2,4-D et du carbofuran (GUPTA et al., 2006) sur charbon actif; la chloration et l’ozonation du S-métolachlore (HLADIK et al., 2008; HLADIK et al., 2005), du glyphosate (BROSILLON et al., 2006) et du diuron (ACERO et al., 2007). Cependant, le procédé sur charbon actif ne permet pas la dégradation des pesticides car les molécules sont adsorbées à la surface. Le rendement de la dégradation des pesticides par boues activées est faible, et ce malgré un temps de traitement de plusieurs jours (GHANEM et al., 2007b). Par ailleurs, la dégradation des polluants organiques par des oxydants chimiques comme le chlore et l’ozone implique des risques lors du transport et du stockage de ces réactifs chimiques, des risques de formation de sous-produits toxiques et cancérigènes en présence de la matière organique dans l’eau comme les trihalomethanes avec le chlore (FLORENTIN et al., 2011) ou les bromates avec l’ozone (VON GUNTEN et HOIGNE, 1994). Pour toutes ces raisons, depuis quelques années, les procédés d’oxydation avancée (POA) sont développés et appliqués pour la dégradation et la minéralisation des pesticides en dioxyde de carbone et molécules d’eau.
Le but de cette revue de littérature est de réaliser une synthèse des récentes publications sur les procédés électrochimiques, photochimiques et électro-photochimiques utilisés pour dégrader les pesticides dans l’eau. Spécifiquement, les objectifs sont de : i) montrer la présence des pesticides dans les eaux de surface destinées à la production d’eau potable, et dans les eaux usées; ii) énumérer les conséquences des pesticides sur les êtres vivants; iii) décrire les principes et applications de divers POA utilisés pour dégrader les pesticides dans l’eau; iv) faire une étude comparative de l’efficacité des POA sur un pesticide (cas de l’atrazine).
2. Présence des pesticides dans l’eau : cas du Canada
De nombreuses études menées dans divers pays dans le monde révèlent la présence des pesticides dans l’air (AULAGNIER et al., 2008); l’eau de surface (WILLIAMS et al., 2014), l’eau souterraine (VAN STEMPVOORT et al., 2014), l’eau potable (SEGURA et al., 2011) et les eaux usées (GHANEM et al., 2007a). Le tableau 1 donne un résumé des concentrations dans l’eau en atrazine, en métolachlore et en glyphosate dans certains pays. Bien que l’atrazine soit interdit au sein de l’Union Européenne, il figure toujours parmi les pesticides les plus souvent détectés dans l’eau en France (SOES, 2013), en Espagne (HILDEBRANDT et al., 2008) et en Suisse (MORASCH, 2013) comme le montre le tableau 1. Cette section de la revue aborde la présence de pesticides dans les eaux de surface (en Ontario et au Québec) et dans les eaux souterraines au Québec.
Tableau 1
Présence et quantification des pesticides dans l’eau de certains pays
Presence and quantification of pesticides in water of some countries
2.1 Eaux de surface
En Ontario, un programme de surveillance de la contamination des eaux de surface par des pesticides très utilisés dans cette province (insecticides du groupe des carbamates et le fongicide métalaxyl), a été mené entre 2007 et 2010 (STRUGER et al., 2016). La région étudiée (environ 7 500 km2) est située dans le sud de l’Ontario, au sud du Grand Lac Ontario, incluant plusieurs de ses tributaires ainsi que la rivière Niagara. Les échantillonnages ont pris en compte à la fois des périodes de basses eaux et des périodes d’importants événements pluvieux. Les résultats ont montré que les composés les plus fréquemment détectés dans les eaux ont été le carbaryl, le métalaxyl et le pirimicarbe : en 2008, ces trois pesticides ont été détectés dans plus de 50 % des échantillons d’eau prélevés. Des concentrations notables en carbaryl (jusqu’à 1 µg∙L-1) ont été associées à des conditions de forte pluviométrie, alors que les concentrations les plus élevées en métalaxyl (1,3 µg∙L-1) ont été corrélées avec les conditions de basses eaux. Ceci a été attribué au fait que les pertes en carbaryl proviendraient du ruissellement de surface des champs cultivés lors des événements pluvieux, alors que celles en métalaxyl étaient probablement attribuables à la dérive éolienne notamment lors des applications aux champs.
Au Québec, les herbicides comme l’atrazine, le glyphosate, le S-métolachlore, et leurs produits de dégradation, figurent parmi les pesticides les plus souvent détectés dans les eaux des rivières. D’après GIROUX (2010), la fréquence de détection de ces herbicides est généralement supérieure à 80 % dans quatre rivières situées en zones agricoles. Il s’agit de la rivière des Hurons (bassin versant de 338 km2), la rivière Chibouet (bassin versant de 166 km2), la rivière Saint-Régis (bassin versant de 92 km2) et la rivière Saint-Zéphirin (bassin versant de 77 km2). En se référant aux résultats des échantillons d’eau prélevés et analysés (GIROUX, 2010; GIROUX et PELLETIER, 2012), les figures 1a, 1b et 1c représentent les concentrations maximales annuelles en atrazine, en métolachlore et en glyphosate. Des pics de concentration sont enregistrés habituellement en juin ou en début juillet suite aux applications dans les champs et aux événements pluvieux (GIROUX, 2010).
Figure 1
Variations des concentrations maximales annuelles des herbicides dans quatre rivières du Québec (Canada)
Variation of maximum annual concentrations of herbicides in four rivers in Quebec (Canada)
De manière générale, les pics de concentration en glyphosate et S-métolachlore dans les quatre rivières sont inférieurs aux critères sur la qualité de l’eau, alors que les pics de concentration en atrazine dépassent occasionnellement le critère sur la qualité de l’eau servant à évaluer le risque d’effet sur les organismes aquatiques. D’après GIROUX (2010), le critère de la vie aquatique chronique (CVAC) fixe les concentrations en atrazine, métolachlore et glyphosate respectivement à 1,8, 8,0 et 65 µg∙L-1. Dans la rivière Saint-Zéphirin, la concentration en atrazine est croissante dans le temps. On observe une hausse de 86 % entre 2005 et 2010. Dans la rivière Chibouet la concentration en atrazine augmente de 2006 à 2008 : cette concentration est supérieure à 6 µg∙L-1. Par la suite et entre 2008 et 2010 on observe une baisse jusqu’à 2,1 µg∙L-1. Dans la rivière des Hurons, on constate une hausse de la concentration d’atrazine (77 %) de 2006 à 2007, puis une baisse progressive de cette concentration de 2008 à 2010.
Les observations faites dans les rivières Saint-Zéphirin et Chibouet sont attribuées au fait que celles-ci sont situées dans des zones de forte production de maïs et soya (GIROUX et PELLETIER, 2012). Les diminutions des concentrations en atrazine et métolachlore observées dans les rivières Chibouet et des Hurons peuvent être liées à la baisse de la surface agricole par rapport à 2005. Par exemple, la superficie cultivée du bassin versant de la rivière des Hurons est passée de 75 % en 2005 à 65 % en 2010 de la superficie totale du bassin versant (GIROUX, 2010; GIROUX et PELLETIER, 2012).
L’application au Québec, comme dans plusieurs autres pays, de mesures de mitigation visant la diminution de la contamination des eaux de surface par les pesticides agricoles s’avère être essentielle. Parmi ces mesures, l’implantation de pratiques de gestion bénéfiques d’ordre structurel, telle que la présence de bandes riveraines végétalisées, permet de réduire jusqu’à 90-95 % la charge ou des concentrations en atrazine et métolachlore exportées par ruissellement de surface (CARON et al., 2012; CARON et al., 2010; LAFRANCE et al., 2013). De telles mesures diminuent ainsi les concentrations retrouvées dans les cours d’eau.
2.2 Eaux souterraines
Les eaux souterraines ont un potentiel de valorisation important pour des utilisations municipales et industrielles (mise en bouteille). Cependant, cette ressource peut être impactée par les pesticides. Le transfert des pesticides vers les eaux souterraines dépend de nombreuses propriétés chimiques et physiques du sol, incluant la composition du sol, sa texture, sa structure, sa porosité et sa conductivité hydraulique (NOVAK et al., 2003).
Au Canada, les travaux de WOUDNEH et al. (2009) menés en Colombie Britanique entre 2003 et 2005, révèlent la présence de 78 pesticides dans les eaux souterraines, avec une prédominance des triazines comme la simazine avec une concentration maximale de 0,09 µg∙L-1 et l’atrazine de concentration maximale 0,01 µg∙L-1. De même, GIROUX et al. (2010) ont analysé en 2005 l’eau de 57 puits du bassin versant de la rivière Châteauguay (Sud-Ouest de Montréal, Québec) durant la période de recharge des nappes d’eau souterraine (23 août au 7 octobre). Cette analyse permet de déceler dans 15 puits, des concentrations maximales de 1,1 μg∙L-1 pour le linuron, 0,47 μg∙L-1 pour le diuron, 0,13 μg∙L-1 pour le métolachlore, 0,03 μg∙L-1 pour l’atrazine et 0,09 μg∙L-1 pour le chlorpyrifos.
La présence de pesticides dans l’eau constitue un risque pour les organismes terrestres et aquatiques. Par exemple, selon le Ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques (2014), l’atrazine est le pesticide qui contribue le plus au risque pour l’environnement (15,9 %) et le plus au risque pour la santé humaine (12,3 %).
3. Toxicité des pesticides
La manipulation, l’exposition et la hausse des concentrations des pesticides dans les écosystèmes aquatiques ont des conséquences néfastes pour l’Homme et pour les espèces terrestres et aquatiques (BOITHIAS et al., 2011).
3.1 Impacts sur l’Homme
KHAN et al. (2009) constatent des symptômes comme fatigue musculaire, étourdissements, maux de tête, vomissements et sensations de brûlure au niveau des voies urinaires chez des agriculteurs ayant manipulé des pesticides. L’exposition aux pesticides peut causer diverses maladies cardiovasculaires (ABDULLAH et al., 2011), neurodégénératives (PARRÓN et al., 2011) comme Alzheimer (GAUTHIER et al., 2001), Parkinson (DHILLON et al., 2008), des maladies congénitales (SHAW et al., 1999) et des insuffisances rénales chroniques (WANIGASURIYA et al., 2007). Les travaux de WEICHENTHAL et al. (2012) montrent que l’exposition à 12 pesticides (alachlore, aldicarbe, carbaryl, chlorpyrifos, diazinon, dicamba, S-éthyl-N,N-dipropylthiocarbamate, imazéthapyr, métolachlore, pendiméthaline, perméthrine, trifluraline) peut être source de divers types de cancer. Le tableau 2 énumère certaines maladies pouvant être dues à l’exposition aux pesticides. D’après la United States Environmental Protection Agency (Agence de protection de l'environnement des États-Unis; US EPA, 2006) une courte durée d'exposition à l’atrazine au-dessus de la valeur maximum de concentration permise pour l’eau potable (MCL) peut causer congestion rénale, hypotension artérielle, perte de poids et dommages aux glandes surrénales. Une exposition à long terme peut engendrer des maladies cardiovasculaires, divers types de cancer, la dégénérescence musculaire et de la rétine (GRAZIANO et al., 2006). De surcroît, l’atrazine est considérée comme un perturbateur endocrinien (CRAGIN et al., 2011; HASS et al., 2012; HAYES et al., 2010).
Tableau 2
Effets de l’exposition aux pesticides sur la santé humaine
Effects of pesticide exposure on human health
3.2 Espèces aquatiques
Les herbicides comme l’atrazine sont plus toxiques pour les micro-organismes phototrophes (DELORENZO et al., 2001). Les travaux de TANG et al. (1997) sur l’exposition à l’atrazine de quatre algues vertes (Chlamydomonas sp., Chlorella sp., Pediastrum sp., et Scenedesmus quadricauda) et quatre diatomées (Cyclotella gamma, C. meneghiniana, Synedra acus, et S. radians) donnent des valeurs de la concentration efficace médiane (EC50) allant de 27,6 à 110,6 µg∙L-1 pour les algues vertes et de 88,7 à 429,7 µg∙L-1 pour les diatomées. La disparition des macrophytes et du phytoplancton est observée après une exposition de quatre jours à 20 µg∙L-1 d’atrazine (SOLOMON et al., 1996). L’étude de la toxicité de l’atrazine (15 µg∙L-1) sur les crustacés Daphnia magna montre une diminution significative de la population après 48 h d’exposition à la lumière du soleil (DETENBECK et al., 1996). Chez les amphibiens, l’exposition des grenouilles léopard à 3 µg∙L-1 d’atrazine influence leur survie, leur masse corporelle et retarde le développement des têtards (KOPRIVNIKAR, 2010). Les travaux de NEUMAN-LEE et JANZEN (2011) montrent l’impact de l’atrazine (anormalies morphologiques externes) sur les oeufs de deux espèces de tortues (Graptemys ouachitensis et G. pseudogeographica), et le fait qu’une exposition des embryons à une faible concentration d’atrazine (0,1 µg∙L-1) réduit leur taux de survie postéclosion.
Au regard de la toxicité des pesticides, il est nécessaire de contrôler les sources d’émission, réduire leurs transferts dans l’environnement et traiter les milieux d’exposition contaminés à l’aide de procédés efficaces comme les procédés d’oxydation avancée (POA).
4. Élimination des pesticides par les procédés d’oxydation avancée
Les procédés d’oxydation avancée génèrent des espèces radicalaires très réactives comme les radicaux hydroxyles (GLAZE et al., 1987). Dans le traitement des eaux, le radical hydroxyle (HO•) est l’oxydant le plus puissant que l’on puisse utiliser (KRAFT et al., 2003). Il dégrade les polluants organiques persistants (POP) ainsi que leurs sous-produits de dégradation (GUINEA et al., 2008; SIEVERS, 2011). Le tableau 3 décrit les conditions opératoires et les résultats obtenus par diverses équipes de recherche à travers le monde lors de l’expérimentation des procédés d’oxydation avancée, mais aussi des procédés chimiques et membranaires qui sont utilisés pour l’élimination des pesticides dans l’eau. Dans la présente revue de littérature, les rendements d’élimination des pesticides dans l’eau, lors de l’application des différents procédés, peuvent se présenter de différentes façons. Le terme « abattement » désignera la diminution ou élimination (en % comparativement à la concentration initiale) de la concentration en composé traité par le procédé. Le terme « dégradation » désignera la dégradation primaire du composé. Il s’agit alors dans ce cas de la disparition de l’identité chimique du composé-parent (dégradation partielle) avec formation de sous-produits de nature organique. En ce sens, l’abattement correspond bien souvent (par défaut) à une telle dégradation primaire. Enfin, la « minéralisation » désignera la dégradation ultime (totale et complète) du composé en constituants inorganiques tels que le CO2 et l’eau.
Tableau 3
Procédés utilisés pour le traitement de l’eau contaminée par les pesticides
Processes used for treating water contaminated with pesticides
a PWP : pure water permeability (perméabilité à l’eau pure); b MWCO : molecular weight cut-off (seuil de coupure de la masse molaire); c BRM : bioréacteur à membrane; d GEM : genetically engineered microorganism (microorganisme génétiquement modifié); e BDD : bore dopé au diamant; f TDS : total dissolved solids (matière dissoute totale); g DAS : dewatered alum sludge (boues d’alun déshydratées); h LAS : liquid alum sludge (boues d’alun liquides)
Dans les sections suivantes (4.1 à 4.3), les différents POA décrits sont classés en trois classes de procédés : procédés électrochimiques, photochimiques et électro-photochimiques. Cette revue de littérature identifiera, pour chacun de ces procédés (selon les informations disponibles) : le principe d’action et de fonctionnement; les applications ciblées et les nuisances traitées; les conditions d’opération optimales pour le traitement de pesticide(s); l’efficacité et rendement; les limites et les lacunes, ainsi que les possibles améliorations pouvant être apportées, le cas échéant. Ceci constituera une partie de la synthèse de la littérature.
4.1 Élimination des pesticides par procédés électrochimiques
La dégradation des pesticides a lieu à la surface des électrodes par application d’un courant électrique, et par action des espèces oxygénées réactives (OH•, O2•-, HO2•-, H2O2, etc.) générées dans la solution.
4.1.1 Procédé d’électro-oxydation
Le procédé se déroule par oxydation directe à la surface des électrodes (COMNINELLIS, 1994) ou indirecte grâce à la production in situ d’oxydant comme le peroxyde d’hydrogène (DROGUI et al., 2001). D’après PANIZZA et CERISOLA (2009), le mécanisme d’action de l’oxydation directe se déroule en deux étapes, à savoir : la décomposition de l’eau en radicaux hydroxyles sur les sites actifs de l’électrode (M) (équation 1), et l’oxydation du polluant « R » par les radicaux hydroxyles adsorbés à la surface de l’électrode (équation 2). L’action des radicaux hydroxyles peut conduire à la minéralisation partielle ou totale du polluant en CO2 et H2O (équation 3).
L’efficacité du procédé dépend de nombreux paramètres comme la nature des électrodes (PANIZZA et CERISOLA, 2009) et leur surtension en oxygène (COMNINELLIS et al., 2008). De nombreux auteurs comme FRONTISTIS et al. (2011) soutiennent que le BDD (diamant dopé au bore) est l’anode la plus efficace pour la dégradation des pesticides. Pour la dégradation du méthamidophos (C0 = 50 mg∙L-1), MARTÍNEZ-HUITLE et al. (2008) obtiennent des taux d’abattement décroissants avec les électrodes dans l’ordre suivant : Si/BDD > Pb/PbO2 > Ti/SnO2. Par la suite, ces auteurs constatent que l’efficacité des électrodes Pb/PbO2 et Ti/SnO2 décroit lorsque la densité du courant passe de 10 à 20 puis à 30 mA∙cm-2. Ce phénomène s’explique par l’activité électrochimique de ces électrodes (Pb/PbO2 et Ti/SnO2) à produire de l’oxygène à de fortes densités de courant. Ce sont des électrodes à faible surtension en oxygène ayant un potentiel d’oxydation autour de 1,9 V (ANGLADA et al., 2009); par rapport au BDD qui est une électrode à forte surtension en oxygène. RABAAOUI et al. (2013), lors de la minéralisation du O-nitrophénol ayant une valeur en carbone organique dissous ([COD]0) de 320 mg∙L-1, obtiennent 96 % avec le BDD contre 52 % avec le PbO2 après 8 h de traitement à pH = 3 avec un courant de densité 60 mA∙cm-2. Ce résultat confirme l’efficacité du BDD.
La densité du courant appliquée est une variable importante qui affecte l’efficacité de l’électro-oxydation. L’augmentation de la densité du courant permet d’accroître la production des radicaux hydroxyles adsorbés à la surface des électrodes (BRILLAS et al., 2007). Ainsi, les travaux de BOYE et al. (2003) sur la minéralisation de l'acide 2,4,5-Trichlorophénoxyacétique (2,4,5-T) donc la concentration en carbone organique total est [COT]0 = 100 mg∙L-1, et avec une anode en platine, montrent un taux de minéralisation allant de 12 % à 28 % après 4 h de traitement, lorsque la densité de courant appliquée augmente de 100 à 450 mA∙cm-2. De même, les travaux de BRILLAS et al. (2007) pour la minéralisation de 150 mL du 2,4-Dichlorophénoxy-propionique acide (2,4-DP) ([COT]0 = 100 mg∙L-1) avec l’anode en BDD indiquent, après 4 h de traitement, un taux de minéralisation de 63 %, 82 % et 97 % respectivement avec un courant de densité de 100, 300 et 450 mA∙cm-2. Également, pour la minéralisation du chlorpyrifos ([COD]0 = 450 mg∙L-1) avec l’anode BDD, le taux d’abattement croît de 16 % à 57 % lorsque la densité du courant appliquée évolue de 10 à 50 mA∙cm-2 après 10 h de traitement (SAMET et al., 2010).
La nature de l’électrolyte support est aussi un paramètre à prendre en considération comme le montre ZAVISKA et al. (2011) qui étudient l’effet du NaCl et du Na2SO4 sur la dégradation de 100 µg∙L-1 d’atrazine : le meilleur taux de dégradation de l’atrazine (95 %) est obtenu avec NaCl (1 g∙L-1) en appliquant une intensité de courant de 2 A durant 40 min de traitement avec l’anode Ti/IrO2. ERRAMI et al. (2013) ont expérimenté les effets isolés et combinés des électrolytes NaCl, Na2CO3 et Na2SO4 sur la dégradation du buprofézine (250 mg∙L-1) avec l’anode BDD et une densité de courant de 60 mA∙cm-2, et ont obtenu 80 % de minéralisation avec l’électrolyte NaCl (1 g∙L-1) contre 92 % de minéralisation avec un mélange équimolaire (NaCl + Na2CO3) après 120 min de traitement.
Le pH initial est une variable pouvant affecter l’efficacité de l’électro-oxydation. AQUINO et DE ANDRADE (2009), lors de la dégradation du glyphosate (C0 = 1 000 mg∙L-1), obtiennent 15 % à pH = 11, 26 % à pH = 5 et 32 % à pH = 2 après 4 h de traitement. D’après ces auteurs, à des faibles valeurs de pH, il y a diminution des réactions de dégagement d’oxygène en faveur de l’oxydation du composé organique. Cela peut justifier l’efficacité du procédé d’électro-oxydation à des faibles valeurs de pH.
D’une manière générale, l’électro-oxydation est efficace pour la dégradation des pesticides. Cependant, la formation d’oxygène (équation 4) qui est une réaction parasite du procédé à de fortes densités de courant, peut limiter l’efficacité du procédé d’électro-oxydation (DROGUI et al., 2007). De plus, la forte consommation d’énergie afin d’atteindre une efficacité optimale est un inconvénient pour l’application de ce procédé à l’échelle industrielle. Par exemple, la dégradation d’un mélange d’organophosphorés ayant une demande chimique en oxygène ([DCO]0) de 1 810 mg∙L-1 nécessite 70,6 kWh∙g-1 de DCO durant 6 h à pH = 6, pour une dégradation optimale de 76,2 % (BABU et al., 2011). De même, YATMAZ et UZMAN (2009) ont estimé l’énergie consommée à 6 000 kWh∙kg-1 pour la dégradation du monocrotophos (300 mg∙L-1) pendant 90 min. SIRÉS et al. (2008), pour la minéralisation totale du mécoprop ([COD]0 = 270 mg∙L-1) avec l’anode PbO2, estiment la consommation énergétique à 95, 180 et 246 kWh∙m-3, si l’on applique respectivement des courants d’intensité de 1, 2 et 3 A.
Au regard des limites du procédé d’électro-oxydation, d’autres procédés à faible consommation d’énergie ont été mis au point pour le traitement de polluants organiques comme les pesticides.
4.1.2 Procédé Fenton et électro-Fenton
Le procédé Fenton classique consiste à initier la réaction de décomposition du peroxyde d’hydrogène (H2O2) par les ions ferreux (Fe2+) à pH acide (2,8 à 3) d’après l’équation 5, en vue de générer le radical hydroxyle (OH•) qui est très réactif vis-à-vis des polluants organiques (LIN et LO, 1997). De nos jours, ce procédé est peu utilisé à cause de la forte consommation des réactifs de Fenton (H2O2 et Fe2+) comme l’a montré BARREIRO et al. (2007) pour la dégradation d’une solution aqueuse (150 mL) d’atrazine (37 µM) en utilisant 200 mg∙L-1 de Fe2+ et 10 mM de H2O2. Dans ces conditions, ils obtiennent un taux de dégradation de 21 % après huit jours de traitement. Ce faible taux de dégradation peut être dû à la prédominance des réactions parasites qui consomment les radicaux hydroxyles (équations 6-7). De même, cette forte consommation des réactifs de Fenton génère des boues ferriques qui doivent être enlevées à la fin des essais. De plus avec le procédé Fenton, le taux de minéralisation reste faible, car les acides carboxyliques générés lors de la dégradation des composés organiques interagissent avec les complexes Fe(III), ce qui rend difficile l’action des radicaux hydroxyles (BRILLAS et al., 2009).
Pour accroître la dégradation et la minéralisation des pesticides tout en réduisant la consommation des réactifs de Fenton, un procédé couplant l’électrolyse et la réaction de Fenton a été mis au point : il s’agit de l’électro-Fenton qui permet la régénération in situ (équations 8-9) des réactifs de Fenton (SIRÉS et al., 2014). Ainsi, l’électro-Fenton est très utilisé pour éliminer des composés de groupes chimiques de pesticides comme les acides aryloxycarboxyliques (OTURAN, 2000), les organophosphorés (GUIVARCH et al., 2003) et les carbamates (ABDESSALEM et al., 2010). Ce procédé est également employé pour éliminer l’urée (EDELAHI et al., 2003) ainsi que certains mélanges de pesticides (IKEHATA et EL-DIN, 2006).
L’efficacité de l’électro-Fenton dépend de nombreuses variables et paramètres comme le pH, l’intensité du courant, la nature des électrodes, la concentration du pesticide, la nature de l’électrolyte, le rapport Fe2+/H2O2, la température du milieu et la distance inter-électrodes (OTURAN et al., 2009).
Le pH est le facteur clé du procédé électro-Fenton car la réduction de l’oxygène en peroxyde d’hydrogène se fait en milieu acide, d’où l’efficacité du procédé aux faibles valeurs de pH (QIANG et al., 2002). Pour la dégradation de 400 mg∙L-1 de l’acide 4-Chlorophénoxyacétique (4-CPA) avec une concentration en Fe2+ de 1 mM et un courant d’intensité 100 mA, BOYE et al. (2002) ont obtenu des taux d’abattements décroissants dans l’ordre suivant : pH = 3 > pH =4 > pH = 6 > pH = 2. Ces résultats peuvent s’expliquer par l’activité catalytique du Fe2+. À pH > 5, le Fe(III) commence à précipiter sous la forme de Fe(OH)3, ce qui diminue la quantité du catalyseur (Fe2+) dans le milieu réactionnel (BRILLAS et al., 2009). De plus, à pH > 5 on a la décomposition rapide du H2O2 en oxygène et molécules d’eau (DENG et ENGLEHARDT, 2006). Aussi à des valeurs de pH élevées, la réduction de l’oxygène conduit à la formation des ions hydroxydes et non à du peroxyde d’hydrogène (équation 10), ce qui réduit l’efficacité du procédé électro-Fenton (VENTURA et al., 2002). Par contre en milieux très acides (pH < 2), le Fe2+ réagit avec le H2O2 pour former des complexes stables, limitant ainsi la réaction (NIDHEESH et GANDHIMATHI, 2012). Les travaux de TANG et HUANG (1996) sur la dégradation du 2,4-Dichlorophénol (2,4-DCP) montrent qu’en milieux très acides (pH ≤ 2), le piégeage des radicaux hydroxyles (HO•) par les protons H+ est accéléré.
L’intensité du courant est un paramètre important pour l’efficacité du procédé électro-Fenton car il contrôle la vitesse de production du peroxyde d’hydrogène et le taux de régénération du Fe2+ (SIRÉS et al., 2014). Ainsi, l’augmentation de l’intensité du courant permet d’accroître la formation du peroxyde d’hydrogène et l’électro-régénération du fer ferrique (Fe3+) en fer ferreux (Fe2+), augmentant ainsi la production des radicaux hydroxyles qui dégradent et minéralisent les composés organiques (NIDHEESH et GANDHIMATHI, 2012). Ainsi, SALAZAR et URETA-ZAÑARTU (2012), pour la minéralisation du triadiméfon (50 mg∙L-1) à pH = 3, avec [Fe2+] = 0,1 mM et en présence d’une cathode en carbone vitreux, obtiennent un taux de minéralisation croissant dans l’ordre suivant de densités du courant 4 < 10 < 20 < 28 mA∙cm-2. De même OTURAN et al. (2012) réalisent une dégradation totale de l’atrazine (0,1 mM) après 40 min de traitement avec un courant d’intensité 50 mA, alors qu’avec 500 mA cette dégradation totale est obtenue après seulement 10 min de traitement. Cependant, des courants de fortes intensités peuvent réduire l’efficacité du procédé électro-Fenton (ZHANG et al., 2006). Pour la dégradation de 0,125 mM du piclorame, ÖZCAN et al. (2008) constatent qu’au-dessus de la valeur optimale de l’intensité du courant (300 mA), la réduction de l’oxygène peut conduire à la formation d’eau et cette réaction (équation 11) augmente progressivement avec les fortes intensités. De même, pour la dégradation de 200 mg∙L-1 du 4-Nitrophénol (4-NP) à pH = 5, une étude a montré un taux d’abattement du COD décroissant en fonction de l’intensité du courant dans l’ordre suivant : 1,0 > 0,5 > 1,5 > 2 A et ce, après 60 min de traitement (ZHANG et al., 2007). Ce résultat peut s’expliquer par la réduction et le dégagement de l’hydrogène à la cathode (équation 12), ce qui limite l’électro-régénération du fer ferrique (Fe3+) en fer ferreux (Fe2+), d’où la chute de l’efficacité du procédé électro-Fenton à des fortes intensités de courant.
L’efficacité du procédé électro-Fenton dépend aussi de la nature des électrodes, soit à l’anode et à la cathode (COMNINELLIS et al., 2008). En général, les électrodes à la cathode sont des matériaux à base de carbone qui en raison de leur électronégativité attirent des électrons présents dans la solution, pour assurer l’électro-régénération du fer ferrique (Fe3+) en fer ferreux (Fe2+) et la production du H2O2 par réduction de l’oxygène (équation 8). Les électrodes les plus utilisées à la cathode sont le feutre de carbone, le graphite et le carbone vitreux (NIDHEESH et GANDHIMATHI, 2012). S’agissant des électrodes utilisées à l’anode, elles ont une surtension en oxygène élevée, ce qui permet la production des radicaux hydroxyles adsorbés à la surface de l’électrode (NIDHEESH et GANDHIMATHI, 2012). Les anodes les plus utilisées sont le platine (Pt) en raison de sa bonne conductivité et de sa stabilité chimique même dans les milieux corrosifs (PANIZZA et CERISOLA, 2009) et le BDD (diamant dopé au bore) qui a un potentiel d’oxydation estimé à 2,5 V (BRILLAS et MARTÍNEZ-HUITLE, 2011). La faible capacité d’adsorption des radicaux hydroxyles (HO•) générés à la surface du BDD permet la migration de ces hydroxyles HO• dans la solution à traiter, ce qui accroît la dégradation des polluants organiques comme les pesticides (SIRÉS et al., 2014).
C’est ainsi que lors de la dégradation de 0,2 mM d’atrazine, OTURAN et al. (2012) ont obtenu après 10 h de traitement, une minéralisation de 90 % avec l’anode BDD contre 4,1 % avec l’anode Pt. PIPI et al. (2014), pour dégrader 0,6 mM d’alachlore, confirment la performance du BDD avec une dégradation totale après 120 min contre 320 min avec le Pt.
Le rapport molaire entre les ions ferreux et le peroxyde d’hydrogène (Fe2+/H2O2) influence également l’efficacité pratique du procédé électro-Fenton. Des faibles ou des fortes concentrations en peroxyde d’hydrogène et en Fe2+ peuvent limiter la production des radicaux hydroxyles (POZZA et al., 2005), à cause de la prédominance des réactions parasites (équations 13-14).
L’optimum du rapport Fe2+/H2O2 est spécifique à chaque pesticide, et est fonction des autres paramètres opératoires. Ainsi, pour la dégradation de l’atrazine (139 µM) et du métolachlore (127 µM), PRATAP et LEMLEY (1998) ont testé plusieurs rapports Fe2+/H2O2 (0,04; 0,14; 0,15 et 0,6) pour le métolachlore, et les rapports Fe2+/H2O2 (0,1, 0,2 et 1) pour l’atrazine. La dégradation optimale du métolachlore (99 %) est obtenue avec le rapport Fe2+/H2O2 = 0,14 après 15 min de traitement et celle de l’atrazine (99 %) est obtenue avec le rapport Fe2+/H2O2 = 0,2 après 40 min de traitement. De même ZHANG et al. (2007), utilisant un rapport optimal Fe2+/H2O2 de 0,1, ont obtenu 93,1 % de dégradation du 4-NP (200 mg∙L-1) après 60 min de traitement.
La température du milieu réactionnel est aussi importante, car elle affecte le transfert d’électrons et le transport de la matière, et par conséquent influe sur la régénération du Fe2+ (QIANG et al., 2003). Ainsi, AGLADZE et al. (2007), pour dégrader des polluants organiques dans l’eau ([COD]0 = 148 mg∙L-1), montrent un taux de minéralisation croissant de 31,2 %, 39,2 % et 48 % respectivement avec 20 °C, 30 °C et 40 °C. Toutefois, il est à noter que de fortes températures abaissent la solubilité de l’oxygène (VESILIND, 1996) et accélèrent la décomposition du peroxyde d’hydrogène en dioxygène et molécule d’eau (équation 15), ce qui réduit également l’efficacité du procédé électro-Fenton.
Le procédé électro-Fenton est efficace pour la dégradation des pesticides, mais reste limité par les réactions parasites comme la précipitation du Fe3+ à des valeurs élevées de pH. D’où le traitement de l’eau en milieu acide (pH ≈ 3).
Au final, les procédés électrochimiques sont efficaces pour la dégradation des pesticides et ne nécessitent pas un grand investissement financier (KESRAOUI-ABDESSALEM, 2008). De plus, ils peuvent être couplés aux procédés biologiques (KASTANEK et al., 2007) et même membranaires pour augmenter leurs efficacités.
4.2 Élimination des pesticides par procédés photochimiques
La dégradation des pesticides par procédés photochimiques peut se faire par action directe du rayonnement lumineux (UV ou solaire) sur les pesticides, par action indirecte à travers la photolyse du complexe Fe3+ dans la réaction de Fenton, ou par photoexcitation d’un semi-conducteur dans le procédé de la photocatalyse.
4.2.1 Photolyse de l’ozone
L’ozone est un oxydant chimique ayant un potentiel d’oxydation estimé à 2,07 V (OTURAN et AARON, 2014). En solution aqueuse, l’ozone absorbe les radiations UV avec un maximum d’absorption à 253,7 nm pour la production des radicaux hydroxyles (ZAVISKA et al., 2009) comme le montre l’équation 16.
Cependant, pour de nombreux auteurs, le mécanisme de la photolyse de l’ozone est similaire à celui de la photolyse du peroxyde d’hydrogène car la décomposition de l’ozone sous irradiation UV produit d’abord du H2O2 (PEYTON et GLAZE, 1988) qui subit par la suite une scission homolytique de sa liaison O-O pour produire les radicaux hydroxyles (équations 17-19).
Par ailleurs, à des valeurs de pH ≥ 8, les ions hydroxydes assurent la décomposition de l’ozone en radicaux hydroxyles (VON GUNTEN, 2003). Cette réaction directe de l’ozone avec les ions hydroxydes (équations 20-23) est très lente, comparée à la réaction indirecte de la photolyse de l’ozone qui est rapide.
Les travaux de PRADO et ESPLUGAS (1999) montrent une dégradation totale de l’atrazine (0,07 mM) dans un réacteur de 2,5 L en présence d’une lampe UV (15 W, λ = 254 nm, I = 3,32 µE[Einstein]∙s-1). Dans cette étude, la durée du traitement nécessaire pour cette dégradation totale de l’atrazine varie en fonction de la valeur du pH dans l’ordre suivant : 40 min (pH = 11,2) et 75 min (pH = 4,6). Le résultat obtenu à pH = 11,2 montre les actions cumulées de la réaction directe et indirecte de l’ozone, alors qu’à pH plus faible on a uniquement l’action indirecte de la photolyse de l’ozone.
Le débit ou la dose de l’ozone introduit peut influencer l’efficacité du procédé, car avec des doses élevées par rapport à la concentration du pesticide, le temps de contact devient long, on a la photodissociation de l’ozone en molécule d’oxygène (équation 24). RAJESWARI et KANMANI (2010), lors de la minéralisation du carbendazime (40 mg∙L-1) à pH = 9 avec une lampe UV (125 W, λ = 245 nm), obtiennent un taux de minéralisation croissant pour des doses d’ozone allant de 0,12 à 0,44 g∙h-1 (63 % de minéralisation), mais ce taux minéralisation décroît lorsque la dose d’ozone passe à 0,57 g∙h-1.
La photolyse de l’ozone est efficace pour la dégradation des pesticides. De plus, ce POA peut assurer la désinfection primaire dans une station de production d’eau potable. Cependant, ce procédé est énergivore, il y a risque de formation de bromates en présence de bromures et l’ozone est plus soluble dans l’eau à basses températures (1 370 mg∙L-1 à 0 °C, contre 570 mg∙L-1 à 20 °C).
4.2.2 Procédé photo-Fenton
Il s’agit du procédé de Fenton assisté par la photochimie qui permet de dégrader les composés organiques comme les pesticides (FDIL et al., 2003). Les travaux de PIGNATELLO (1992) montrent qu’à la valeur optimale de pH du procédé (2,8), le fer ferreux se trouve sous forme Fe(OH)2+ (équation 25). Ce complexe [Fe(OH)(H2O)5]2+ absorbe la lumière, ce qui permet son excitation photochimique et la production des radicaux hydroxyles, mais aussi la régénération in situ du Fe2+ (PIGNATELLO et SUN, 1995) comme le montre l’équation 26.
Lorsqu’on applique une lumière de longueur d’onde inférieure à 360 nm (UVC), les hauts photons énergétiques peuvent également réaliser la photolyse du peroxyde d’hydrogène en radicaux hydroxyles, d’après l’équation 27, ce qui accélère l’élimination du pesticide (PIGNATELLO et al., 1999).
En plus du pH, l’efficacité du procédé photo-Fenton dépend de nombreux paramètres opératoires comme la longueur d’onde de la lumière, la concentration du pesticide et le rapport molaire [Fe2+]/[H2O2]. HUSTON et PIGNATELLO (1999) ont dégradé un mélange équimolaire (C0 = 0,2 mM) de pesticides avec une lampe fluorescente noire (14 W, λ = 300-400 nm, 1,2 × 1019 photons∙L-1∙s-1), un rapport [Fe2+]/[H2O2] = 0,005. Après 30 min de traitement, ils obtiennent 100 % de dégradation pour l’atrazine, le métolachlore, le piclorame, le dicamba, le carbofuran, l’alachlore et 94,3 % pour le malathion. Pour la minéralisation d’un mélange équimolaire (C0 = 0,05 mM) de pesticides (chlortoluron, carbofurane et bentazone) avec une lampe à faible pression vapeur de mercure (12 W, λ = 253,7 nm) et un rapport [Fe2+]/[H2O2] = 0,01, ABDESSALEM et al. (2010) obtiennent un taux de 93 % après 420 min de traitement.
Le procédé photo-Fenton peut aussi être réalisé par rayonnement solaire, ce qui permet de réduire le coût de l’énergie lors du traitement. À l’aide de capteurs solaires de type concentrateurs à segments paraboliques ayant une puissance de 30 W∙m-2 et d’un rapport [Fe2+]/[H2O2] = 0,02, JIMÉNEZ et al. (2011) obtiennent 100 % de dégradation d’atrazine (C0 = 90 mg∙L-1) et de 2,4-D (C0 = 50 mg∙L-1) après 33 min de traitement. ZAPATA et al. (2009), avec un pilote solaire (30 W∙m-2) et un rapport [Fe2+]/[H2O2] = 0,02 ont effectué la minéralisation d’un mélange de pesticides de concentration totale 200 mg∙L-1 et ont obtenu un taux de minéralisation globale de 75 % après 125 min.
Le procédé photo-Fenton est efficace pour la dégradation des pesticides car il y a apport supplémentaire de radicaux hydroxyles par la photo-réduction du Fe(III). Cependant, ce procédé reste limité par l’ajustement du pH de l’eau avant et après traitement, l’utilisation des quantités importantes de H2O2 et la durée de vie des lampes.
4.2.3 Procédé photocatalytique hétérogène
Le procédé photocatalytique hétérogène utilise des oxydes ou semi-conducteurs stables, peu coûteux, et surtout réutilisables. Les résidus issus (CO2 et H2O) de la dégradation complète des composés organiques par photocalyse sont sans danger pour l’environnement (CHEN et al., 2000; HERRMANN et al., 2007). Le mécanisme d’action de la photocatalyse implique la photo-excitation d’un semi-conducteur (SC) par absorption de la lumière, avec passage des électrons de la bande de valence (BV) vers la bande de conduction (BC) et formation d’une paire électron/trou dans la BV () permettant la réaction avec le polluant en phase adsorbée (HERRMANN, 1999). Au cours de cette réaction, on assiste également à la recombinaison des électrons/trous qui libère de la chaleur. D’une manière générale, les équations 28 à 31 présentent les réactions ayant lieu au cours de ce procédé (HERRMANN, 2010).
L’efficacité de la photocatalyse dépend de nombreux paramètres comme la nature et la concentration du photocatalyseur, l’intensité de la lumière et sa longueur d’onde, le pH et la température du milieu réactionnel (AHMED et al., 2011). Plusieurs semi-conducteurs comme le ZnO, Fe2O3, WO3, CdS, ZnS, et autres ont été testés comme photocatalyseurs, mais le TiO2 reste le photocatayseur le plus utilisé, car il est peu coûteux, photostable, biologiquement et chimiquement inerte (FUJISHIMA et al., 2000; HOFFMANN et al., 1995). De plus, le dioxyde de titane est un minerai d’oxyde naturel dont les trois principales phases utilisées en photocalyse sont l’anatase, le rutile et la brookite. Le TiO2 possède un rendement quantique élevé sous sa forme anatase qui est le semi-conducteur le plus performant en photocalyse hétérogène. Cependant, la forme anatase du TiO2 ne peut être active que pour des longueurs d’ondes inférieures à 380 nm : c’est pourquoi le mélange de cristaux d’anatase et de rutile permet d’avoir une meilleure photoactivité par rapport à l’anatase pur. De nombreuses expériences attestent que le matériau Degussa (Evonik Industries AG) P-25 TiO2 (80 % d’anatase et 20 % de rutile) est le photocatalyseur TiO2 le plus efficace (AHMED et al., 2011; WONG et CHU, 2003). Cela s’explique par le couplage intime entre les particules d’anatase et de rutile qui permettent le transfert d’électrons du rutile vers l’anatase, limitant ainsi la recombinaison des charges pour une excellente efficacité photocatalytique (HURUM et al., 2004).
Le dioxyde de titane peut être dopé avec des particules métalliques comme le platine (Pt) : ainsi, KATSUMATA et al. (2009) pour dégrader le diuron (10 mg∙L-1) à l’aide d’une lampe à xénon (990 W), obtiennent 80 % de dégradation avec le Pt-TiO2 contre 20 % avec du P-25 TiO2 après 120 min de traitement. Ce résultat avec le Pt-TiO2 s’explique par le transfert des électrons vers le Pt, ce qui augmente les lacunes à l’interface Pt-TiO2, réduisant ainsi la recombinaison des paires électrons/trous, d’où la bonne dégradation obtenue avec Pt-TiO2. On peut aussi réaliser le dopage chimique du dioxyde de titane avec des éléments comme l’azote (YANG et GAO, 2004), le carbone (NOWORYTA et AUGUSTYNSKI, 2004) ou le soufre (OHNO et al., 2004). Cela permet de promouvoir la photoréponse du TiO2 dans le visible. JIAN et al. (2013), pour dégrader 20 mg∙L-1 du 2,4-Dichlorophénol (2,4-DCP) avec une lampe à vapeur de mercure (40 W, λmax = 365 nm), obtiennent après 50 min de traitement une dégradation de 99,4 % avec le Na2Ti6O13/TiO2 produit à 600 °C, contre 77 % avec le TiO2-P25.
La valeur du pH influence l’efficacité du procédé photocatalyse car il a un effet sur les propriétés d’adsorption et de désorption à la surface du photocalyseur. CHEN et RAY (1998) obtiennent une dégradation maximale du 4-Nitrophénol (C0 = 0,14 mM) à pH = 4,3 avec TiO2-P25. SECK et al. (2012), pour la minéralisation du 2,4-D (C0 = 0,53 mM) avec le TiO2 ECT-1023t (89-94 % anatase et 11-6 % rutile), obtiennent un taux de minéralisation de 60 % à pH = 3 et 75 % à pH = 5. Les travaux de CHU et WONG (2004), pour la dégradation du dicamba (C0 = 0,02 mM) avec TiO2-P25 (70 % anatase et 30 % rutile), montrent un taux d’abattement du COT de 76 % à pH = 3,3 contre 87 % à pH = 8,5.
Ces résultats obtenus à différentes valeurs de pH s’expliquent par la surface de la charge du TiO2 : à des valeurs de pH inférieures au point de charge zéro (PZC ≈ 6,25), la surface du TiO2 est chargée positivement, et on assiste à la désorption ou à la répulsion des composés de charges positives (équation 32). Par contre à des valeurs de pH supérieures au PZC, la surface du TiO2 est chargée négativement, et on assiste à la répulsion des composés de charges négatives (équation 33).
Par contre, WONG et CHU (2003) obtiennent avec TiO2-P25 une dégradation optimale d’alachlore (C0 = 22 µM) à pH = 12 : d’après ces auteurs, la présence en concentration élevée des ions hydroxydes favorisent la formation des radicaux hydroxyles (équation 34), d’où l’efficacité du procédé à pH basique. Cette efficacité à pH basique est soutenue par de nombreux auteurs comme CHU et WONG (2004).
Le procédé photocatalytique est efficace pour la dégradation des pesticides, mais reste limité par la durée de vie des lampes : celles-ci peuvent être remplacées par le rayonnement solaire réduisant ainsi le coût de la consommation énergétique (JANIN et al., 2013). On parle ainsi de la photocatalyse solaire pouvant être appliquée pour l’élimination des pesticides et la désinfection de l’eau (RIZZO et al., 2014). PLANTARD et al. (2012) ont dégradé du pyriméthanile (15 mg∙L-1) par photocatalyse solaire (P25-TiO2 = 2 g∙L-1, λ = 315-400 nm, 1 000 W∙m-2) et ont réalisé 100 % de dégradation après 100 h. OLLER et al. (2006) ont montré l’efficacité de la photocatalyse solaire (TiO2 = 0,2 g∙L-1) pour la minéralisation d’un mélange de pesticides et ont obtenu 99,5 % en 401 min pour le méthomyl, 99,3 % en 306 min pour le pyriméthanile et 98,5 % en 208 min pour le diméthoate.
La nature de la source lumineuse doit également être prise en compte. Ainsi YU et al. (2013) ont comparé l’efficacité d’une lampe LED avec une lampe à vapeur de mercure pour la dégradation du 2,4-D et ont constaté que 99 % de l’énergie de la lampe LED est impliqué dans la dégradation contre 95,8 % pour la lampe de mercure, d’où l’intérêt de travailler avec les lampes LED. De même, l’intensité de la lumière joue un rôle clé dans l’efficacité du procédé. YU et al. (2013) constatent une dégradation décroissante du 2,4-D (10 mg∙L-1) en fonction des intensités : 8,55 × 1016 > 3,95 × 1016 > 1,28 × 1016 > 4,9 × 1015 photon∙s-1.
D’une manière générale, les procédés photochimiques sont efficaces pour l’élimination des pesticides. De plus, le rayonnement solaire peut se substituer à la source lumineuse nécessaire à la photolyse directe, à la photolyse des complexes Fe3+, à l’excitation des photocatalyseurs comme le TiO2, ce qui permet de réduire le coût du traitement. Cependant, le procédé photocatalytique reste limité par la recombinaison des paires électrons/trous, le colmatage des filtres lors de la récupération du photocatalyseur après le traitement de l’eau. Pour ces raisons, les photocatalyseurs peuvent être fixés à des supports, et le procédé photocatalytique peut être couplé à l’électrochimie.
4.3 Élimination des pesticides par procédés électro-photochimiques
L’utilisation de ces procédés pour le traitement des eaux usées est sans cesse croissante au sein de nombreuses équipes de recherche, car elle combine les réactions électrochimiques et photochimiques grâce à l’irradiation de la solution à traiter et à la présence d’une photoanode sensible aux UV ou à la lumière solaire (SIRÉS et al., 2014).
4.3.1 Procédé électro-photo-Fenton
Au cours du procédé électro-photo-Fenton, la production des radicaux hydroxyles est faite par voies électrochimiques et par photolyse du complexe [Fe(OH)(H2O)5]2+, de même que la régénération in situ des réactifs de Fenton (équations 5, 8-9, 26). Cela accélère la dégradation des pesticides (BRILLAS et al., 2000). De plus, le procédé électro-photo-Fenton permet la photodécarboxylation des complexes stables de Fe(III) générés avec les acides carboxyliques (BRILLAS, 2014), permettant ainsi la régénération du Fe2+, mais surtout la formation du CO2 (équation 35). L’exemple de la photodécarboxylation est illustré par ZUO et HOIGNE (1992) qui ont montré la photodécarboxylation des complexes Fe(III)-oxalate (équation 36).
MASOMBOON et al. (2010) ont testé divers paramètres comme le pH, l’intensité du courant, la longueur d’onde de la lampe, la concentration du peroxyde d’hydrogène lors de la dégradation du 2,6-Diméthylaniline (1 mM), dans un volume de 5 L. Ils utilisent une anode Ti-IrO2/RuO2, 12 lampes UV (λmax = 360 nm, 140 µW∙cm-2), 1 mM de Fe2+ et 20 mM de H2O2 à pH = 2, avec un courant d’intensité de 2 A. Après 60 min de traitement, la dégradation est de 100 % et après 5 h de traitement alors que la minéralisation est de 56 %. IRMAK et al. (2006) utilisent une lampe UV (15 W, λ = 254 nm, 0,4 µE∙L-1) pour éliminer du 4-Chloro-2-méthylphénol (0,6 M) avec les électrodes en feutre de carbone et Pt, une charge électrique de 150 Coulomb et Fe2+ = 2,4 mM : ils ont obtenu 100 % de dégradation et 42 % de minéralisation après 300 min de traitement. SIRÉS et al. (2007) ont minéralisé 96 % d’acide clofibrique (179 mg∙L-1) durant 6 h de traitement, avec une électrode Pt, en présence d’une lampe noire fluorescente (6 W, λ = 300-420 nm, 140 µW∙cm-2), d’un courant d’intensité de 100 mA et du Fe2+ (1,0 mM). La nature des électrodes influence également l’efficacité du procédé électro-photo-Fenton. BRILLAS et al. (2007) ont testé l’efficacité des électrodes BDD et Pt lors de la minéralisation du 2,4-DP ([COT]0 = 100 mg∙L-1) avec un courant d’intensité 400 mA en présence d’une lampe noire fluorescente (6 W, λ = 300-420 nm, 140 µW∙cm-2) et Fe2+ = 1,0 mM : ils ont obtenu après 4h de traitement 98 % d’abattement avec le BDD et 91 % avec l’électrode Pt.
Pour réduire le coût énergétique du procédé, le rayonnement solaire peut être utilisé comme source lumineuse (ALMEIDA et al., 2011; BRILLAS, 2014). Ainsi, FLOX et al. (2007) ont appliqué l’électro-photo-Fenton par voie solaire pendant 9 h pour la dégradation du mécoprop ([COT]0 = 640 mg∙L-1) à pH = 3, Fe2+ = 0,5 mM, une anode BDD, une densité de courant de 50 mA∙cm-2 et ils obtiennent plus de 96 % de minéralisation avec une consommation énergétique de 46 kWh∙m-3. De même à l’aide de capteurs solaires de type concentrateur à segments paraboliques et dans les conditions optimales (anode BDD, pH = 3,0, I = 5,0 A, Fe2+ = 1,0 mM), GARCIA-SEGURA et al. (2011) ont obtenu après 2 h de traitement 75 % de minéralisation de l’acide 2-Méthyl-4-chlorophénoxyacétique (MCPA) avec [COT]0 = 186 mg∙L-1. Pour l’élimination de l’atrazine (20 mg∙L-1) sous un courant de 100 mA, avec 0,1 mM de Fe2+, pH = 3 et des électrodes en BDD (anode et cathode), GARZA-CAMPOS et al. (2014) ont utilisé un rayonnement solaire moyen de 1150 W∙m-2, pour obtenir 70 % de minéralisation après 300 min et ont estimé le coût énergétique du traitement à 2,31 kWh∙g-1 de COT. Dans cette étude utilisant deux électrodes en BDD, la production du peroxyde d’hydrogène est faite d’après l’équation 37, décrite par (SKOUMAL et al., 2008) lors de la minéralisation du chloroxylénol.
PIPI et al. (2014) ont comparé le coût énergétique de la minéralisation du diuron (0,185 mM) dans un volume de 5 L avec un courant optimal de 150 mA par électro-oxydation (32 % de minéralisation pour 15,3 kWh∙g-1 DOC), par électro-Fenton (59 % de minéralisation pour 8,3 kWh∙g-1 C) et solaire électro-photo-Fenton (70 % de minéralisation pour 7 kWh∙g-1 DOC) après 4 h de traitement.
Le procédé électro-photo-Fenton est très efficace pour la dégradation et la minéralisation des pesticides et présente un faible coût de consommation énergétique. Cependant, ce procédé reste limité par l’ajustement du pH de l’eau avant et après traitement et la durée de vie des lampes.
4.3.2 Procédé électro-photocatalyse
XU et WANG (2001) ont décrit ce procédé comme étant le procédé photocatalytique assisté par l’électrochimie. L’efficacité de ce procédé pour l’élimination des composés organiques a été expérimentée par de nombreux auteurs (AN et ZHOU, 2012; DAGHRIR et al., 2013a; DAGHRIR et al., 2013b; OJANI et al., 2012). Cette efficacité dépend de nombreuses variables et paramètres comme la nature du semi-conducteur photocatalytique ou photo-anode (ZHANG et al., 2009), la densité du courant, l’intensité de la lumière et sa longueur d’onde, le pH et la nature des électrolytes. WANG et al. (2009) ont utilisé un potentiel de 0,6 V, une lampe à vapeur de mercure haute pression (200 W, λmax = 365 nm, 2,5 mW∙cm-2), une anode (nanotube TiO2) et une cathode (Pt), et ils ont obtenu plus de 95 % de dégradation du 4-CP ([15 mg∙L-1]0) après 90 min et une minéralisation de 40 % après 3 h. Les travaux de LIU et al. (2011) comparent l’efficacité de deux photo-anodes (CuInS2-TiO2 NT et TiO2 NT) pour la dégradation du 2,4-D (10 mg∙L-1) avec un potentiel de 0,5 V, une lampe xénon (500 W, λ = 280-2 000 nm, 100 mW∙cm-2) : ils ont observé 100 % dégradation avec le CuInS2-TiO2 NT et 65,2 % avec le TiO2 NT après 160 min de traitement. Le taux de dégradation obtenu avec la photo-anode CuInS2-TiO2 NT s’explique par la réduction de l’énergie de sa bande interdite (band gap) lui permettant d’être photoactive dans le visible par rapport à la photo-anode TiO2 NT.
L’électro-photocatalyse (EPC) est efficace pour la dégradation des pesticides, car le potentiel externe appliqué permet d’éviter la recombinaison des électrons/trous. Ceci amplifie, au niveau de la bande de valence (BV), les réactions d’oxydation directe des pesticides adsorbés à la surface de la photo-anode et la production de OH• par l’oxydation des molécules d’eau et des ions hydroxydes. De plus, les réactions cathodiques sur une électrode comme le graphite ou le carbone vitreux peuvent être mises à profit pour générer des accepteurs d’électrons tels que H2O2 par réduction cathodique de l'oxygène dissous. Ceci permet d'éviter la recombinaison des électrons/trous et, sous irradiation UV (λ ≤ 300 nm), le H2O2 donne des OH• (équation 27), ce qui contribue à améliorer l'efficacité du procédé EPC. Cependant, les limites d’application du procédé EPC sont : la durée de vie des photo-anodes et des lampes, ainsi que la saturation des sites actifs de la photo-anode en présence de forte concentration en polluant.
En somme, l’application des POA dans le traitement de l’eau permet de dégrader et minéraliser les pesticides même en présence de la matière organique. Néanmoins, lors de l’application des procédés d’oxydation avancée, il y a formation dans le milieu réactionnel des réactions parasites très diversifiées qui réduisent l’action des radicaux hydroxyles sur les pesticides comme le piégeage des radicaux hydroxyles par les ions (CO32−, PO42−, SO42). Le tableau 4 indique une synthèse des principaux avantages et inconvénients des différents procédés POA présentés dans cette revue. D’après ce tableau, on constate que la consommation énergétique, le coût et la durée de vie des électrodes et/ou des lampes sont des paramètres à prendre en compte pour l’estimation économique de chaque technologie de POA. Dans le cas des électrodes, il est difficile de pouvoir donner avec exactitude le prix de fabrication du fait des fluctuations des prix de matières premières (titane, platine, tungstène, etc.), et des appareils utilisés pour la synthèse des électrodes. Il en est de même du coût de la consommation énergétique qui peut varier en fonction des saisons et des pays.
Tableau 4
Synthèse des principaux avantages et inconvénients des POA examinés
Synthesis of main advantages and drawbacks of the AOPs reviewed
5. Comparaison chiffrée des performances des POA : cas de l’atrazine
Les applications à l’échelle de banc d’essai au laboratoire des procédés d’oxydation avancée pour la dégradation des pesticides sont nombreuses. Il est important de préciser qu’une synthèse comparative des performances de différents procédés décrits précédemment dans les trois grandes classes des POA n’est pas aisée. En effet, et tel que démontré lors cette revue synthèse, le principe d’action et de fonctionnement, les conditions opératoires et les facteurs déterminant le rendement, les applications ciblées et les nuisances traitées, l’efficacité et le rendement de chacun de ces procédés peuvent demeurer spécifiques selon leur conception. Toutefois et d’après le tableau 3, on constate qu’une dégradation totale des pesticides peut être obtenue dépendamment du POA appliqué, de la nature du pesticide contenu dans l’effluent à traiter et des conditions opératoires imposées lors du traitement.
La comparaison des performances pour cinq procédés (issus des trois classes de POA) a été réalisée ici en utilisant l’atrazine en concentration initiale identique (ou très similaire) comparable pour chacun de ces procédés, soit 0,1 mM. Pour comparer l’efficacité des POA sur la dégradation de l’atrazine (C0 = 0,1 mM) en fonction des paramètres opératoires imposés, on peut citer les travaux de MALPASS et al. (2006) qui ont appliqué l’électro-oxydation (EO) de l’atrazine (C0 = 0,1 mM) avec une densité de courant de 40 mA∙cm-2. Ils obtiennent une minéralisation de 33,2 % après 2 h de traitement. Par contre GRČIĆ et al. (2008), à l’aide d’une lampe à vapeur de mercure (125 W, λ = 254 nm), appliquent la photolyse de l’ozone (4,3 mg∙min-1) pour une dégradation totale de l’atrazine en concentration similaire (C0 = 0,14 mM) et une minéralisation de 52 % après 2 h de traitement. Avec le procédé photo-Fenton (PF), KASSINOS et al. (2009) grâce à un rapport Fe2+/H2O2 = 0,01 et une lampe noire fluorescente (125 W, λ = 315-400 nm, 7 × 10−8 mol photons∙s-1), obtiennent une dégradation totale de l’atrazine en concentration identique (C0 = 0,1 mM) et une minéralisation de 57 % après 2 h de traitement. OTURAN et al. (2012) appliquent le procédé électro-Fenton (EF) avec génération in situ du H2O2 pour dégrader l’atrazine, également en même concentration (C0 = 0,1 mM). Ils obtiennent avec un courant d’intensité 1 000 mA, une minéralisation de 97 % avec l’anode en BDD après 8 h de traitement (soit environ 75 % après 2 h). Ces résultats peuvent être comparés à ceux obtenus par GARZA-CAMPOS et al. (2014) qui appliquent le procédé électro-photo-Fenton par voie solaire (SEPF) pour éliminer l’atrazine en même concentration (C0 = 0,1 mM) à l’aide d’un rayonnement solaire de 1150 W∙m-2, un courant de 100 mA et des électrodes en BDD (anode et cathode). Ils obtiennent 70 % de minéralisation après 5 h de traitement (soit environ 50 % après 2 h).
L’étude comparative du rendement de ces cinq procédés d’oxydation avancée montre une dégradation totale de l’atrazine en concentration initiale identique (C0 = 0,1 mM). Cependant, on constate que le taux de minéralisation (dégradation ultime et complète) varie d’un procédé à l’autre. Ainsi, et après 2 h de traitement, le taux de minéralisation est croissant dans l’ordre suivant : EO (33,2 %) < O3/UV (52 %) < SEPF (≈ 50 %) < PF (57 %) < EF (≈ 75 %). Toutefois, cet ordre de classement de l’efficacité des POA pour la minéralisation de l’atrazine (C0 = 0,1 mM) n’est présentée qu’à titre indicatif (à cause des conditions opératoires différentes entre les POA), et on ne saurait généraliser l’efficacité de POA pour la dégradation des autres pesticides dans cet ordre. Néanmoins, on remarque par ailleurs d’une part que le photo-Fenton requiert davantage de H2O2 par rapport aux procédés électro-Fenton et électro-photo-Fenton. Et, d’autre part, que les procédés électro-Fenton et électro-photo-Fenton requièrent moins de Fe2+ par rapport au procédé photo-Fenton.
6. Perspectives des procédés d’oxydation avancée pour le traitement des pesticides dans l’eau
Les procédés d’oxydation avancée présentent de nombreux atouts, à savoir la faible emprise au sol, les réactifs simples à manipuler, l’absence apparente de pollution secondaire, car la minéralisation des pesticides produit du CO2 et de l’eau. Pour ces raisons, les POA peuvent être couplés au traitement biologique dans une station d’épuration ou intégrés dans une filière de production d’eau potable : cas dans la station de production d’eau potable d’Andijk en Hollande où le procédé H2O2/UV a été installé après l’étape de filtration sur sable et avant l’étape de filtration sur charbon actif granulaire, pour le traitement de 4 000 m3∙h-1. Cela a permis la dégradation d’une large gamme de pesticides et de pertubarteurs endocriens, mais surtout d’assurer une désinfection primaire de l’eau (KRUITHOF et al., 2007). Au niveau du traitement des eaux usées, il est préférable de placer le procédé biologique en amont afin d’éviter une carence en nutriments (cas du phosphore) nécessaires aux bactéries pour éliminer les composés biodégradables, et installer les ouvrages du procédé d’oxydation avancée en aval, après le clarificateur, pour une action efficace des radicaux hydroxyles sur les composés toxiques et réfractaires comme les pesticides. Cependant, la configuration et la durée de vie des électrodes, la production optimale des radicaux hydroxyles à des valeurs de pH en milieu acide (H2O2/Fe2+) ou basique (O3/UV), la récupération de photocatalyseurs après traitement et le rayon d’action des photons émis constituent des problèmes à résoudre lors du traitement de grands volumes d’eau.
Afin de résoudre ces problèmes techniques liés à la mise en oeuvre des procédés d’oxydation avancée au sein d’une station d’épuration, des études d’optimisation plus détaillées des paramètres opératoires doivent être réalisées. Par ailleurs, l’utilisation de l’énergie solaire pourrait aussi réduire davantage le coût de la mise en oeuvre des procédés d’oxydation avancée pour l’élimination des composés organiques comme les pesticides.
7. Conclusion
Les pesticides sont utilisés pour combattre ou repousser les organismes indésirables qui causent des dommages aux produits agricoles. Cependant, le lessivage et le ruissellement des terres cultivées entraînent les pesticides dans les eaux de surface et souterraines. De nombreuses études ont mis en évidence les effets nocifs des pesticides sur les écosystèmes et leur toxicité chez l’Homme. Dans cette revue de littérature, l’accent a été mis sur les procédés d’oxydation avancée utilisés pour dégrader et minéraliser les pesticides dans l’eau à savoir : les procédés électrochimiques, photochimiques et électro-photochimiques. Pour chacune de ces trois classes de procédés, les différents paramètres opératoires qui influencent leur efficacité ont été précisés. Au-delà des conditions intrinsèques aux procédés, il sera également requis de vérifier la variabilité des rendements de traitement en présence de la variabilité d’autres conditions comme la composition des solutions aqueuses à traiter : nature et concentration en composés organiques naturels ou de synthèse (dont les divers contaminants ciblés par le traitement) et inorganiques ; présence de diverses matières organiques naturelles dissoutes et particulaires, etc. Ainsi, la mise en oeuvre des procédés d’oxydation avancée dans une station d’épuration nécessite des études d’optimisation plus détaillées des différents paramètres opératoires à prendre en compte afin d’améliorer les performances épuratoires ceci en fonction de la nature des eaux à traiter.
Parties annexes
Références bibliographiques
- ABDESSALEM A.K., M.A. OTURAN, N. OTURAN, N. BELLAKHAL et M. DACHRAOUI (2010). Treatment of an aqueous pesticides mixture solution by direct and indirect electrochemical advanced oxidation processes. Int. J. Environ. Anal. Chem., 90, 468-477.
- ABDULLAH N.Z., A. ISHAKA, N. SAMSUDDIN, R. MOHD RUS et A.H. MOHAMED (2011). Chronic organophosphate pesticide exposure and coronary artery disease: Finding a bridge. IIUM Research, Invention and Innovation Exhibition (IRIIE), 9-10 février, Kuala Lumpur, Malaisie.
- ACERO J.L., F.J. REAL, J. BENITEZ et M. GONZALEZ (2007). Kinetics of reactions between chlorine or bromine and the herbicides diuron and isoproturon. J. Chem. Technol. Biotechnol., 82, 214-222.
- AGLADZE G.R., G.S. TSURTSUMIA, B.I. JUNG, J.S. KIM et G. GORELISHVILI (2007). Comparative study of chemical and electrochemical Fenton treatment of organic pollutants in wastewater. J. Appl. Electrochem., 37, 985-990.
- AHMED S., M.G. RASUL, R. BROWN et M.A. HASHIB (2011). Influence of parameters on the heterogeneous photocatalytic degradation of pesticides and phenolic contaminants in wastewater: A short review. J. Environ. Manage., 92, 311-330.
- ALAVANJA M.C.R., M. DOSEMECI, C. SAMANIC, J. LUBIN, C.F. LYNCH, C. KNOTT, J. BARKER, J.A. HOPPIN, D.P. SANDLER, J. COBLE, K. THOMAS et A. BLAIR (2004). Pesticides and lung cancer risk in the Agricultural Health Study Cohort. Am. J. Epidemiol., 160, 876-885.
- ALMEIDA L.C., S. GARCIA-SEGURA, N. BOCCHI et E. BRILLAS (2011). Solar photoelectro-Fenton degradation of paracetamol using a flow plant with a Pt/air-diffusion cell coupled with a compound parabolic collector: Process optimization by response surface methodology. Appl. Catal. B-Environ., 103, 21-30.
- AN J. et Q. ZHOU (2012). Degradation of some typical pharmaceuticals and personal care products with copper-plating iron doped Cu2O under visible light irradiation. J. Environ. Sci., 24, 827-833.
- ANDREOTTI G., L.E.B. FREEMAN, L. HOU, J. COBLE, J. RUSIECKI, J.A. HOPPIN, D.T. SILVERMAN et M.C.R. ALAVANJA (2009). Agricultural pesticide use and pancreatic cancer risk in the Agricultural Health Study Cohort. Int. J. Cancer, 124, 2495-2500.
- ANGLADA Á., A. URTIAGA et I. ORTIZ (2009). Contributions of electrochemical oxidation to waste-water treatment: fundamentals and review of applications. J. Chem. Technol. Biotechnol., 84, 1747-1755.
- ANNETT R., H.R. HABIBI et A. HONTELA (2014). Impact of glyphosate and glyphosate-based herbicides on the freshwater environment. J. Appl. Toxicol., 34, 458-479.
- AQUINO NETO S. et A.R. DE ANDRADE (2009). Electrooxidation of glyphosate herbicide at different DSA® compositions: pH, concentration and supporting electrolyte effect. Electrochim. Acta, 54, 2039-2045.
- AULAGNIER F., L. POISSANT, D. BRUNET, C. BEAUVAIS, M. PILOTE, C. DEBLOIS et N. DASSYLVA (2008). Pesticides measured in air and precipitation in the Yamaska Basin (Québec): Occurrence and concentrations in 2004. Sci. Total Environ., 394, 338-348.
- BABU B.R., K.M.S. MEERA et P. VENKATESAN (2011). Removal of pesticides from wastewater by electrochemical methods - A comparative approach. Sustain. Environ. Res., 21 (6), 401-406.
- BALCI B., M.A. OTURAN, N. OTURAN et I. SIRÉS (2009). Decontamination of aqueous glyphosate, (aminomethyl)phosphonic acid, and glufosinate solutions by electro-Fenton-like process with Mn2+ as the catalyst. J. Agr. Food Chem., 57 (11), 4888-4894.
- BAND P.R., Z. ABANTO, J. BERT, B. LANG, R. FANG, R.P. GALLAGHER et N.D. LE (2011). Prostate cancer risk and exposure to pesticides in British Columbia Farmers. The Prostate, 71, 168-183.
- BARAN N., C. MOUVET et P. NÉGREL (2007). Hydrodynamic and geochemical constraints on pesticide concentrations in the groundwater of an agricultural catchment (Brévilles, France). Environ. Pollut., 148, 729-738.
- BARREIRO J.C., M.D. CAPELATO, L. MARTIN-NETO et H.C. BRUUN HANSEN (2007). Oxidative decomposition of atrazine by a Fenton-like reaction in a H2O2/ferrihydrite system. Water Res., 41, 55-62.
- BATTAGLIN W.A., M.T. MEYER, K.M. KUIVILA et J.E. DIETZE (2014). Glyphosate and its degradation product AMPA occur frequently and widely in U.S. soils, surface water, groundwater, and precipitation. J. Am. Water Res. Assoc., 50, 275-290.
- BERRY C., C. LA VECCHIA et P. NICOTERA (2010). Paraquat and Parkinson's disease. Cell Death Differ., 17, 1115-1125.
- BLANCHOUD H., E. MOREAU-GUIGON, F. FARRUGIA, M. CHEVREUIL et J.M. MOUCHEL (2007). Contribution by urban and agricultural pesticide uses to water contamination at the scale of the Marne watershed. Sci. Total Environ., 375, 168-179.
- BOHN T., E. COCCO, L. GOURDOL, C. GUIGNARD et L. HOFFMANN (2011). Determination of atrazine and degradation products in Luxembourgish drinking water: Origin and fate of potential endocrine-disrupting pesticides. Food Addit. Contam. Part A Chem. Anal. Control Expo. Risk Assess., 28 (8), 1041-1054.
- BOITHIAS L., S. SAUVAGE, L. TAGHAVI, G. MERLINA, J.-L. PROBST et J.M. SÁNCHEZ PÉREZ (2011). Occurrence of metolachlor and trifluralin losses in the Save river agricultural catchment during floods. J. Hazard. Mater., 196, 210-219.
- BONNER M., B. WILLIAMS, J. RUSIECKI, A. BLAIR, L. BEANE FREEMAN, J. HOPPIN, M. DOSEMECI, J. LUBIN, D. SANDLER et M.R. ALAVANJA (2010). Occupational exposure to terbufos and the incidence of cancer in the Agricultural Health Study. Cancer Causes Control, 21, 871-877.
- BÖRJESSON E., L. TORSTENSSON et J. STENSTRÖM (2004). The fate of imazapyr in a Swedish railway embankment. Pest Manage. Sci., 60, 544-549.
- BOTTA F., N. FAUCHON, H. BLANCHOUD, M. CHEVREUIL et B. GUERY (2012). Phyt’Eaux Cités: Application and validation of a programme to reduce surface water contamination with urban pesticides. Chemosphere, 86, 166-176.
- BOYE B., M.M. DIENG et E. BRILLAS (2002). Degradation of herbicide 4-chlorophenoxyacetic acid by advanced electrochemical oxidation methods. Environ. Sci. Technol., 36, 3030-3035.
- BOYE B., M. MORIÈME DIENG et E. BRILLAS (2003). Anodic oxidation, electro-Fenton and photoelectro-Fenton treatments of 2,4,5-trichlorophenoxyacetic acid. J. Electroanal. Chem., 557, 135-146.
- BRILLAS E. (2014). A review on the degradation of organic pollutants in waters by UV photoelectro-Fenton and solar photoelectro-Fenton. J. Braz. Chem. Soc., 25, 393-417.
- BRILLAS E., M.Á. BAÑOS, M. SKOUMAL, P.L. CABOT, J.A. GARRIDO et R.M. RODRÍGUEZ (2007). Degradation of the herbicide 2,4-DP by anodic oxidation, electro-Fenton and photoelectro-Fenton using platinum and boron-doped diamond anodes. Chemosphere, 68, 199-209.
- BRILLAS E., J.C. CALPE et J. CASADO (2000). Mineralization of 2,4-D by advanced electrochemical oxidation processes. Water Res., 34, 2253-2262.
- BRILLAS E. et C.A. MARTÍNEZ-HUITLE (2011). Synthetic Diamond Films: Preparation, Electrochemistry, Characterization, and Applications. John Wiley & Sons, Hoboken, New Jersey, États-Unis, 680 p.
- BRILLAS E., I. SIRÉS et M.A. OTURAN (2009). Electro-Fenton process and related electrochemical technologies based on Fenton’s reaction chemistry. Chem. Rev., 109, 6570-6631.
- BROSILLON S., D. WOLBERT, M. LEMASLE, P. ROCHE et A. MEHRSHEIKH (2006). Chlorination kinetics of glyphosate and its by-products: Modeling approach. Water Res., 40, 2113-2124.
- BYER J.D., J. STRUGER, E. SVERKO, P. KLAWUNN et A. TODD (2011). Spatial and seasonal variations in atrazine and metolachlor surface water concentrations in Ontario (Canada) using ELISA. Chemosphere, 82, 1155-1160.
- CAO X. et W. HARRIS (2010). Properties of dairy-manure-derived biochar pertinent to its potential use in remediation. Bioresour. Technol., 101, 5222-5228.
- CARON E., P. LAFRANCE et J.-C. AUCLAIR (2012). Temporal evolution of atrazine and metolachlor concentrations exported in runoff and subsurface water with vegetated filter strips. Agron. Sustain. Dev., 32, 935-943.
- CARON E., P. LAFRANCE, J.-C. AUCLAIR et M. DUCHEMIN (2010). Impact of grass and grass with poplar buffer strips on atrazine and metolachlor losses in surface runoff and subsurface infiltration from agricultural plots. J. Environ. Qual., 39 (2), 617-629.
- CHAUDHRY M., J. FEBIN PRABHU DASS, D. SELVAKUMAR et N.S. KUMAR (2013). In-silico study of acetylcholinesterase inhibition by organophosphate pesticides. Int. J. Pharma. Inf. J. Biotechnol. Biother., 4, B788-B802.
- CHEN D. et A.K. RAY (1998). Photodegradation kinetics of 4-nitrophenol in TiO2 suspension. Water Res., 32, 3223-3234.
- CHEN D., M. SIVAKUMAR et A.K. RAY (2000). Heterogeneous photocatalysis in environmental remediation. Dev. Chem. Eng. Mineral Process, 8, 505-550.
- CHU W. et C.C. WONG (2004). The photocatalytic degradation of dicamba in TiO2 suspensions with the help of hydrogen peroxide by different near UV irradiations. Water Res., 38, 1037-1043.
- COMERTON A.M., R.C. ANDREWS, D.M. BAGLEY et C. HAO (2008). The rejection of endocrine disrupting and pharmaceutically active compounds by NF and RO membranes as a function of compound and water matrix properties. J. Membr. Sci., 313, 323-335.
- COMNINELLIS C. (1994). Electrocatalysis in the electrochemical conversion/combustion of organic pollutants for waste water treatment. Electrochim. Acta, 39, 1857-1862.
- COMNINELLIS C., A. KAPALKA, S. MALATO, S.A. PARSONS, I. POULIOS et D. MANTZAVINOS (2008). Advanced oxidation processes for water treatment: advances and trends for R&D. J. Chem. Technol. Biotechnol., 83, 769-776.
- COOPER J. et H. DOBSON (2007). The benefits of pesticides to mankind and the environment. Crop Protect., 26, 1337-1348.
- CRAGIN L.A., J.S. KESNER, A.M. BACHAND, D.B. BARR, J.W. MEADOWS, E.F. KRIEG et J.S. REIF (2011). Menstrual cycle characteristics and reproductive hormone levels in women exposed to atrazine in drinking water. Environ. Res., 111, 1293-1301.
- CROWE A.S., N. LECLERC, J. STRUGER et S. BROWN (2011). Application of a glyphosate-based herbicide to Phragmites australis: Impact on groundwater and near-shore lake water at a beach on Georgian Bay. J. Great Lakes Res., 37, 616-624.
- DAGHRIR R., P. DROGUI, A. DIMBOUKOU-MPIRA et M.A. EL KHAKANI (2013a). Photoelectrocatalytic degradation of carbamazepine using Ti/TiO2 nanostructured electrodes deposited by means of a pulsed laser deposition process. Chemosphere, 93, 2756-2766.
- DAGHRIR R., P. DROGUI et M.A. EL KHAKANI (2013b). Photoelectrocatalytic oxidation of chlortetracycline using Ti/TiO2 photo-anode with simultaneous H2O2 production. Electrochim. Acta, 87, 18-31.
- DANESHVAR A., K. ABOULFADL, L. VIGLINO, R. BROSÉUS, S. SAUVÉ, A.-S. MADOUX-HUMERY, G.A. WEYHENMEYER et M. PRÉVOST (2012). Evaluating pharmaceuticals and caffeine as indicators of fecal contamination in drinking water sources of the Greater Montreal region. Chemosphere, 88, 131-139.
- DAVIS A.M., P.J. THORBURN, S.E. LEWIS, Z.T. BAINBRIDGE, S.J. ATTARD, R. MILLA et J.E. BRODIE (2013). Environmental impacts of irrigated sugarcane production: Herbicide run-off dynamics from farms and associated drainage systems. Agr. Ecosyst. Environ., 180, 123-135.
- DELORENZO M.E., G.I. SCOTT et P.E. ROSS (2001). Toxicity of pesticides to aquatic microorganisms: A review. Environ. Toxicol. Chem., 20, 84-98.
- DÉLYE C., M. JASIENIUK et V. LE CORRE (2013). Deciphering the evolution of herbicide resistance in weeds. Trends Genet., 29, 649-658.
- DENG Y. et J.D. ENGLEHARDT (2006). Treatment of landfill leachate by the Fenton process. Water Res., 40, 3683-3694.
- DETENBECK N.E., R. HERMANUTZ, K. ALLEN et M.C. SWIFT (1996). Fate and effects of the herbicide atrazine in flow-through wetland mesocosms. Environ. Toxicol. Chem., 15, 937-946.
- DEVINE M.D. (1997). Mechanisms of resistance to acetyl-coenzyme A carboxylase inhibitors: A review. Pestic. Sci., 51, 259-264.
- DHILLON A.S., G.L. TARBUTTON, J.L. LEVIN, G.M. PLOTKIN, L.K. LOWRY, J.T. NALBONE et S. SHEPHERD (2008). Pesticide/environmental exposures and Parkinson's disease in East Texas. J. Agromed., 13, 37-48.
- DIMOU A.D., V.A. SAKKAS et T.A. ALBANIS (2005). Metolachlor photodegradation study in aqueous media under natural and simulated solar irradiation. J. Agr. Food Chem., 53, 694-701.
- DORES E.G.C., C. SPADOTTO, O.S. WEBER, L. CARBO, A. VECCHIATO et A. PINTO (2009). Environmental behaviour of metolachlor and diuron in a tropical soil in the central region of Brazil. Water Air Soil Poll., 197, 175-183.
- DROGUI P., J.-F. BLAIS et G. MERCIER (2007). Review of electrochemical technologies for environmental applications. Recent Pat. Eng., 1, 257-272.
- DROGUI P., S. ELMALEH, M. RUMEAU, C. BERNARD et A. RAMBAUD (2001). Hydrogen peroxide production by water electrolysis: Application to disinfection. J. Appl. Electrochem., 31, 877-882.
- DROGUI P. et P. LAFRANCE (2012). Pesticides and sustainable agriculture. Dans: Farming for Food and Water Security. LICHTFOUSE E. (Éditeur), Sustainable Agriculture Series, Vol. 10, Springer, Pays-Bas, Chap. 2, pp. 23-55.
- DUKE S.O. (1990). Overview of herbicide mechanisms of action. Environ. Health Persp., 87, 263-271.
- ECHAVIA G.R.M., F. MATZUSAWA et N. NEGISHI (2009). Photocatalytic degradation of organophosphate and phosphonoglycine pesticides using TiO2 immobilized on silica gel. Chemosphere, 76 (5), 595-600.
- EDDLESTON M., L. KARALLIEDDE, N. BUCKLEY, R. FERNANDO, G. HUTCHINSON, G. ISBISTER, F. KONRADSEN, D. MURRAY, J.C. PIOLA, N. SENANAYAKE, R. SHERIFF, S. SINGH, S.B. SIWACH et L. SMIT (2002). Pesticide poisoning in the developing world - a minimum pesticides list. The Lancet, 360, 1163-1167.
- EDELAHI M., N. OTURAN, M. OTURAN, Y. PADELLEC, A. BERMOND et K. EL KACEMI (2003). Degradation of diuron by the electro-Fenton process. Environ. Chem. Lett., 1, 233-236.
- ENSMINGER M., R. BUDD, K. KELLEY et K. GOH (2013). Pesticide occurrence and aquatic benchmark exceedances in urban surface waters and sediments in three urban areas of California, USA, 2008-2011. Environ. Monit. Assess., 185, 3697-3710.
- ERRAMI M., R. SALGHI, M. ZOUGAGH, A. ZARROUK, E. BAZZI, A. CHAKIR, H. ZARROK, B. HAMMOUTI et L. BAZZI (2013). Electrochemical degradation of buprofezin insecticide in aqueous solutions by anodic oxidation at boron-doped diamond electrode. Res. Chem. Intermed., 39, 505-516.
- FDIL F., J. AARON, N. OTURAN, A. CHAOUCH et M. OTURAN (2003). Dégradation photochimique d'herbicides chlorophénoxyalcanoïques en milieux aqueux. Rev. Sci. Eau, 16 (1), 123-142.
- FLEMING L., J.B. MANN, J. BEAN, T. BRIGGLE et J.R. SANCHEZ-RAMOS (1994). Parkinson's disease and brain levels of organochlorine pesticides. Ann. Neurol., 36 (1), 100-103.
- FLORENTIN A., A. HAUTEMANIÈRE et P. HARTEMANN (2011). Health effects of disinfection by-products in chlorinated swimming pools. Int. J. Hyg. Envir. Heal., 214, 461-469.
- FLOX C., J.A. GARRIDO, R.M. RODRÍGUEZ, P.-L. CABOT, F. CENTELLAS, C. ARIAS et E. BRILLAS (2007). Mineralization of herbicide mecoprop by photoelectro-Fenton with UVA and solar light. Catal. Today, 129, 29-36.
- FOCAZIO M.J., D.W. KOLPIN, K.K. BARNES, E.T. FURLONG, M.T. MEYER, S.D. ZAUGG, L.B. BARBER et M.E. THURMAN (2008). A national reconnaissance for pharmaceuticals and other organic wastewater contaminants in the United States — II) Untreated drinking water sources. Sci. Total Environ., 402 (2-3), 201-216.
- FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS (2014). FAOSTAT database on resources. http://faostat3.fao.org/download/R/RT/E (consultation novembre-décembre 2014).
- FRONTISTIS Z., C. BREBOU, D. VENIERI, D. MANTZAVINOS et A. KATSAOUNIS (2011). BDD anodic oxidation as tertiary wastewater treatment for the removal of emerging micro-pollutants, pathogens and organic matter. J. Chem. Technol. Biot., 86, 1233-1236.
- FUJISHIMA A., T.N. RAO et D.A. TRYK (2000). Titanium dioxide photocatalysis. J. Photoch. Photobio. C, 1, 1-21.
- GAMMON D.W., C.N. ALDOUS, W.C. CARR, J.R. SANBORN et K.F. PFEIFER (2005). A risk assessment of atrazine use in California: Human health and ecological aspects. Pest Manag. Sci., 61, 331-355.
- GARCIA-SEGURA S., L.C. ALMEIDA, N. BOCCHI et E. BRILLAS (2011). Solar photoelectro-Fenton degradation of the herbicide 4-chloro-2-methylphenoxyacetic acid optimized by response surface methodology. J. Hazard. Mater., 194, 109-118.
- GARDNER M., V. JONES, S. COMBER, M.D. SCRIMSHAW, T. COELLO-GARCIA, E. CARTMELL, J. LESTER et B. ELLOR (2013). Performance of UK wastewater treatment works with respect to trace contaminants. Sci. Total Environ., 456-457, 359-369.
- GARZA-CAMPOS B.R., J.L. GUZMÁN-MAR, L.H. REYES, E. BRILLAS, A. HERNÁNDEZ-RAMÍREZ et E.J. RUIZ-RUIZ (2014). Coupling of solar photoelectro-Fenton with a BDD anode and solar heterogeneous photocatalysis for the mineralization of the herbicide atrazine. Chemosphere, 97, 26-33.
- GAUTHIER E., I. FORTIER, F. COURCHESNE, P. PEPIN, J. MORTIMER et D. GAUVREAU (2001). Environmental pesticide exposure as a risk factor for Alzheimer's disease: A case-control study. Environ. Res., 86, 37-45.
- GENG Y., J. MA, R. JIA, L. XUE, C. TAO, C. LI, X. MA et Y. LIN (2013). Impact of long-term atrazine use on groundwater safety in Jilin Province, China. J. Integr. Agr., 12, 305-313.
- GERLAND P., A.E. RAFTERY, H. ŠEVČÍKOVÁ, N. LI, D. GU, T. SPOORENBERG, L. ALKEMA, B.K. FOSDICK, J. CHUNN, N. LALIC, G. BAY, T. BUETTNER, G.K. HEILIG et J. WILMOTH (2014). World population stabilization unlikely this century. Science, 346, 234-237.
- GHANEM A., P. BADOS, A.R. ESTAUN, L.F. DE ALENCASTRO, S. TAIBI, J. EINHORN et C. MOUGIN (2007a). Concentrations and specific loads of glyphosate, diuron, atrazine, nonylphenol and metabolites thereof in French urban sewage sludge. Chemosphere, 69, 1368-1373.^
- GHANEM A., M. ORFI et M. SHAMMA (2007b). Biodegradation of chlorphyrifos by Klebsiella sp. isolated from an activated sludge sample of waste water treatment plant in Damascus. Folia Microbiol. (Praha), 52 (4), 423-427.
- GHOSHDASTIDAR A. et A. TONG (2013). Treatment of 2,4-D, mecoprop, and dicamba using membrane bioreactor technology. Environ. Sci. Pollut. R., 20, 5188-5197.
- GIROUX I. (2010). Présence de pesticides dans l’eau au Québec - bilan dans quatre cours d’eau de zones en culture de maïs et de soya en 2005, 2006 et 2007 et dans des réseaux de distribution d’eau potable. Ministère du Développement durable, de l’Environnement et des Parcs, Direction du suivi de l’état de l’environnement, Québec, Canada, 78 p.
- GIROUX I. et L. PELLETIER (2012). Présence de pesticides dans l’eau au Québec - bilan dans quatre cours d’eau de zones en culture de maïs et de soya en 2008, 2009 et 2010. Ministère du Développement durable, de l’Environnement et des Parcs, Direction du suivi de l’état de l’environnement, Québec, Canada, 46 p.
- GIROUX I., N. ROY et C. LAMONTAGNE (2010). Présence de pesticides dans l’eau souterraine en milieu agricole : étude pilote du bassin versant de la rivière Châteauguay. Can. Water. Resour. J., 35, 527-542.
- GLAZE W.H., J.-W. KANG et D.H. CHAPIN (1987). The chemistry of water treatment processes involving ozone, hydrogen peroxide and ultraviolet radiation. Ozone-Sci. Eng., 9, 335-352.
- GRAZIANO N., M.J. MCGUIRE, A. ROBERSON, C. ADAMS, H. JIANG et N. BLUTE (2006). 2004 National Atrazine Occurrence Monitoring Program using the Abraxis ELISA method. Environ. Sci. Technol., 40, 1163-1171.
- GRČIČ I., N. KOPRIVANAC, D. VUJEVI et S. PAPI (2008). Removal of atrazine from simulated groundwater by AOTs. J. Adv. Oxid. Technol., 11, 91-96.
- GUINEA E., C. ARIAS, P.L. CABOT, J.A. GARRIDO, R.M. RODRÍGUEZ, F. CENTELLAS et E. BRILLAS (2008). Mineralization of salicylic acid in acidic aqueous medium by electrochemical advanced oxidation processes using platinum and boron-doped diamond as anode and cathodically generated hydrogen peroxide. Water Res., 42, 499-511.
- GUIVARCH E., N. OTURAN et M.A. OTURAN (2003). Removal of organophosphorus pesticides from water by electrogenerated Fenton's reagent. Environ. Chem. Lett., 1, 165-168.
- GUPTA V.K., I. ALI, SUHAS et V.K. SAINI (2006). Adsorption of 2,4-D and carbofuran pesticides using fertilizer and steel industry wastes. J. Colloid Interf. Sci., 299, 556-563.
- GUZZELLA L., F. POZZONI et G. GIULIANO (2006). Herbicide contamination of surficial groundwater in Northern Italy. Environ. Pollut., 142, 344-353.
- HANCOCK D.B., E.R. MARTIN, G.M. MAYHEW, J.M. STAJICH, R. JEWETT, M.A. STACY, B.L. SCOTT, J.M. VANCE et W.K. SCOTT (2008). Pesticide exposure and risk of Parkinson's disease: A family-based case-control study. BMC Neurol., 8, 6.
- HARRIS A.F., S. RAJATILEKA et H. RANSON (2010). Pyrethroid resistance in Aedes aegypti from Grand Cayman. Am. J. Trop. Med. Hyg., 83, 277-284.
- HASS U., J. BOBERG, S. CHRISTIANSEN, P.R. JACOBSEN, A.M. VINGGAARD, C. TAXVIG, M.E. POULSEN, S.S. HERRMANN, B.H. JENSEN, A. PETERSEN, L.H. CLEMMENSEN et M. AXELSTAD (2012). Adverse effects on sexual development in rat offspring after low dose exposure to a mixture of endocrine disrupting pesticides. Reprod. Toxicol., 34, 261-274.
- HAYES T.B., V. KHOURY, A. NARAYAN, M. NAZIR, A. PARK, T. BROWN, L. ADAME, E. CHAN, D. BUCHHOLZ, T. STUEVE et S. GALLIPEAU (2010). Atrazine induces complete feminization and chemical castration in male African clawed frogs (Xenopus laevis). Proc. Natl. Acad. Sci. USA, 107, 4612-4617.
- HERRMANN J.-M. (1999). Heterogeneous photocatalysis: fundamentals and applications to the removal of various types of aqueous pollutants. Catal. Today, 53, 115-129.
- HERRMANN J.-M., J. DISDIER, P. PICHAT, S. MALATO et J. BLANCO (1998). TiO2-based solar photocatalytic detoxification of water containing organic pollutants. Case studies of 2,4-dichlorophenoxyaceticacid (2,4-D) and of benzofuran. Appl. Catal. B-Environ., 17, 15-23.
- HERRMANN J.M. (2010). Environmental photocatalysis: Perspectives for China. Sci. China Chem., 53, 1831-1843.
- HERRMANN J.M., C. DUCHAMP, M. KARKMAZ, B.T. HOAI, H. LACHHEB, E. PUZENAT et C. UILLARD (2007). Environmental green chemistry as defined by photocatalysis. J. Hazard. Mater., 146, 624-629.
- HILDEBRANDT A., M. GUILLAMÓN, S. LACORTE, R. TAULER et D. BARCELÓ (2008). Impact of pesticides used in agriculture and vineyards to surface and groundwater quality (North Spain). Water Res., 42, 3315-3326.
- HLADIK M.L., E.J. BOUWER et A.L. ROBERTS (2008). Neutral degradates of chloroacetamide herbicides: Occurrence in drinking water and removal during conventional water treatment. Water Res., 42, 4905-4914.
- HLADIK M.L., A.L. ROBERTS et E.J. BOUWER (2005). Removal of neutral chloroacetamide herbicide degradates during simulated unit processes for drinking water treatment. Water Res., 39, 5033-5044.
- HOFFMANN M.R., S.T. MARTIN, W. CHOI et D.W. BAHNEMANN (1995). Environmental applications of semiconductor photocatalysis. Chem. Rev., 95, 69-96.
- HU Y.S., Y.Q. ZHAO et B. SOROHAN (2011). Removal of glyphosate from aqueous environment by adsorption using water industrial residual. Desalination, 271, 150-156.
- HUNTSCHA S., H. SINGER, S. CANONICA, R.P. SCHWARZENBACH et K. FENNER (2008). Input dynamics and fate in surface water of the herbicide metolachlor and of its highly mobile transformation product metolachlor ESA. Environ. Sci. Technol., 42, 5507-5513.
- HURUM D.C., K.A. GRAY, T. RAJH et M.C. THURNAUER (2004). Photoinitiated reactions of 2,4,6 TCP on Degussa P25 formulation TiO2: Wavelength-sensitive decomposition. J. Phys. Chem. B, 108, 16483-16487.
- HUSTON P.L. et J.J. PIGNATELLO (1999). Degradation of selected pesticide active ingredients and commercial formulations in water by the photo-assisted Fenton reaction. Water Res., 33, 1238-1246.
- IBÁÑEZ M., Ó.J. POZO, J.V. SANCHO, F.J. LÓPEZ et F. HERNÁNDEZ (2005). Residue determination of glyphosate, glufosinate and aminomethylphosphonic acid in water and soil samples by liquid chromatography coupled to electrospray tandem mass spectrometry. J. Chromatogr. A, 1081, 145-155.
- IKEHATA K. et M.G. EL-DIN (2006). Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type advanced oxidation processes: a review. J. Environ. Eng. Sci., 5, 81-135.
- IMFELD G., M. LEFRANCQ, E. MAILLARD et S. PAYRAUDEAU (2013). Transport and attenuation of dissolved glyphosate and AMPA in a stormwater wetland. Chemosphere, 90, 1333-1339.
- IRMAK S., H.I. YAVUZ et O. ERBATUR (2006). Degradation of 4-chloro-2-methylphenol in aqueous solution by electro-Fenton and photoelectro-Fenton processes. Appl. Catal. B-Environ., 63, 243-248.
- JANIN T., V. GOETZ, S. BROSILLON et G. PLANTARD (2013). Solar photocatalytic mineralization of 2,4-dichlorophenol and mixtures of pesticides: Kinetic model of mineralization. Sol. Energy, 87 (1), 127-135.
- JIAN Z., S. HUANG et Y. ZHANG (2013). Photocatalytic degradation of 2,4-Dichlorophenol using nanosized Na2Ti6O13/TiO2 heterostructure particles. Int. J. Photoenergy, 2013, 7 p.
- JIMÉNEZ M., I. OLLER, M.I. MALDONADO, S. MALATO, A. HERNÁNDEZ-RAMÍREZ, A. ZAPATA et J.M. PERALTA-HERNÁNDEZ (2011). Solar photo-Fenton degradation of herbicides partially dissolved in water. Catal. Today, 161, 214-220.
- KASSINOS D., N. VARNAVA, C. MICHAEL et P. PIERA (2009). Homogeneous oxidation of aqueous solutions of atrazine and fenitrothion through dark and photo-Fenton reactions. Chemosphere, 74, 866-872.
- KASTANEK F., Y. MALETEROVA et P. KASTANEK (2007). Combination of advanced oxidation and/or reductive dehalogenation and biodegradation for the decontamination of waters contaminated with chlorinated organic compounds. Sep. Sci. Technol., 42, 1613-1625.
- KATSUMATA H., M. SADA, Y. NAKAOKA, S. KANECO, T. SUZUKI et K. OHTA (2009). Photocatalytic degradation of diuron in aqueous solution by platinized TiO2. J. Hazard. Mater., 171, 1081-1087.
- KESRAOUI-ABDESSALEM A. (2008). Dégradation des pesticides chlortoluron, carbofurane et bentazone en milieux aqueux par les procédés d'oxydation avancée. Thèse de Doctorat, Univ. Paris-Est, France, 122 p.
- KHAN D.A., S. SHABBIR, M. MAJID, T.A. NAQVI et F.A. KHAN (2009). Risk assessment of pesticide exposure on health of Pakistani tobacco farmers. J. Expo. Sci. Env. Epid., 20, 196-204.
- KÖCK-SCHULMEYER M., M. VILLAGRASA, M. LÓPEZ DE ALDA, R. CÉSPEDES-SÁNCHEZ, F. VENTURA et D. BARCELÓ (2013). Occurrence and behavior of pesticides in wastewater treatment plants and their environmental impact. Sci. Total Environ., 458-460, 466-476.
- KOPRIVNIKAR J. (2010). Interactions of environmental stressors impact survival and development of parasitized larval amphibians. Ecol. Appl., 20, 2263-2272.
- KRAFT A., M. STADELMANN et M. BLASCHKE (2003). Anodic oxidation with doped diamond electrodes: A new advanced oxidation process. J. Hazard. Mater., 103, 247-261.
- KRUITHOF J.C., P.C. KAMP et B.J. MARTIJN (2007). UV/H2O2 treatment: A practical solution for organic contaminant control and primary disinfection. Ozone-Sci. Eng., 29, 273-280.
- KURANCHIE M., Harriet, S.M. ATIEMO, L.M.N.-D. PALM, S. BLANKSON-ARTHUR, A.O. TUTU et P. FOSU (2012). Determination of organochlorine pesticide residue in sediment and water from the Densu River basin, Ghana. Chemosphere, 86, 286-292.
- KURT-KARAKUS P.B., T.F. BIDLEMAN, D.C.G. MUIR, S.J. CAGAMPAN, J. STRUGER, E. SVERKO, J.M. SMALL et L.M. JANTUNEN (2008). Chiral current-use herbicides in Ontario streams. Environ. Sci. Technol., 42, 8452-8458.
- LAFRANCE P., E. CARON et C. BERNARD (2013). Impact of grass filter strips length on exported dissolved masses of metolachlor, atrazine and deethylatrazine: A four-season study under natural rain conditions. Soil Use. Manage., 29, 87-97.
- LAMERS M., M. ANYUSHEVA, N. LA, V.V. NGUYEN et T. STRECK (2011). Pesticide pollution in surface- and groundwater by paddy rice cultivation: A case study from Northern Vietnam. CLEAN-Soil Air Water, 39 (4), 356-361.
- LEE W.J., A. BLAIR, J.A. HOPPIN, J.H. LUBIN, J.A. RUSIECKI, D.P. SANDLER, M. DOSEMECI et M.C.R. ALAVANJA (2004a). Cancer incidence among pesticide applicators exposed to chlorpyrifos in the Agricultural Health Study. J. Natl. Cancer Inst., 96, 1781-1789.
- LEE W.J., J.A. HOPPIN, A. BLAIR, J.H. LUBIN, M. DOSEMECI, D.P. SANDLER et M.C.R. ALAVANJA (2004b). Cancer incidence among pesticide applicators exposed to alachlor in the Agricultural Health Study. Am. J. Epidemiol., 159, 373-380.
- LEE W.J., D.P. SANDLER, A. BLAIR, C. SAMANIC, A.J. CROSS et M.C.R. ALAVANJA (2007). Pesticide use and colorectal cancer risk in the Agricultural Health Study. Int. J. Cancer, 121, 339-346.
- LIN S.H. et C.C. LO (1997). Fenton process for treatment of desizing wastewater. Water Res., 31, 2050-2056.
- LIU C. et X. HUANG (2008). Enhanced atrazine removal using membrane bioreactor bioaugmented with genetically engineered microorganism. Front. Environ. Sci. Eng. China, 2, 452-460.
- LIU R., Y. LIU, C. LIU, S. LUO, Y. TENG, L. YANG, R. YANG et Q. CAI (2011). Enhanced photoelectrocatalytic degradation of 2,4-dichlorophenoxyacetic acid by CuInS2 nanoparticles deposition onto TiO2 nanotube arrays. J. Alloy. Compd., 509 (5), 2434-2440.
- MAKELARSKI J.A., P.A. ROMITTI, C.M. ROCHELEAU, T.L. BURNS, P.A. STEWART, M.A. WATERS, C.C. LAWSON, E.M. BELL, S. LIN, G.M. SHAW, R.S. OLNEY et NATIONAL BIRTH DEFECTS PREVENTION study (2014). Maternal periconceptional occupational pesticide exposure and neural tube defects. Birth Defects Res. A Clin. Mol. Teratol., 100, 877-886.
- MALPASS G.R.P., D. MIWA, A.C.P. MIWA, S.A.S. MACHADO et A.J. MOTHEO (2007). Photo-assisted electrochemical oxidation of atrazine on a commercial Ti/Ru0.3Ti0.7O2 DSA electrode. Environ. Sci. Technol., 40, 7120-7125.
- MALPASS G.R.P., D.W. MIWA, S.A.S. MACHADO, P. OLIVI et A.J. MOTHEO (2006). Oxidation of the pesticide atrazine at DSA® electrodes. J. Hazard. Mater., 137, 565-572.
- MARTÍNEZ-HUITLE C.A., A. DE BATTISTI, S. FERRO, S. REYNA, M. CERRO-LÓPEZ et M.A. QUIRO (2008). Removal of the pesticide methamidophos from aqueous solutions by electrooxidation using Pb/PbO2, Ti/SnO2, and Si/BDD electrodes. Environ. Sci. Technol., 42, 6929-6935.
- MASOMBOON N., C. RATANATAMSKUL et M.-C. LU (2010). Mineralization of 2,6-dimethylaniline by photoelectro-Fenton process. Appl. Catal. A-Gen., 384, 128-135.
- MINISTÈRE DU DÉVELOPPEMENT DURABLE, DE L'ENVIRONNEMENT ET DE LA LUTTE CONTRE LES CHANGEMENTS CLIMATIQUES (2014). Bilan des ventes de pesticides au Québec - Année 2011. Direction des politiques agricoles et des pesticides, Québec, Canada, 71 p.
- MECO G., V. BONIFATI, N. VANACORE et E. FABRIZIO (1994). Parkinsonism after chronic exposure to the fungicide maneb (manganese ethylene-bis-dithiocarbamate). Scand. J. Work Environ. Health, 20 (4), 301-305.
- MILLARD C.B. et C.A. BROOMFIELD (1995). Anticholinesterases: Medical applications of neurochemical principles. J. Neurochem., 64, 1909-1918.
- MIRANDA-CONTRERAS L., R. GÓMEZ-PÉREZ, G. ROJAS, I. CRUZ, L. BERRUETA, S. SALMEN, M. COLMENARES, A. BARRETO, A. BALZA, A. ZAVALA, Y. MORALES, Y. MOLINA, L. VALERI, C.A. CONTRERAS et J.A. OSUNA (2013). Occupational exposure to organophosphate and carbamate pesticides affects sperm chromatin integrity and reproductive hormone levels among Venezuelan farm workers. J. Occup. Health, 55, 195-203.
- MORASCH B. (2013). Occurrence and dynamics of micropollutants in a karst aquifer. Environ. Pollut., 173, 133-137.
- MREMA E.J., F.M. RUBINO, G. BRAMBILLA, A. MORETTO, A.M. TSATSAKIS et C. COLOSIO (2013). Persistent organochlorinated pesticides and mechanisms of their toxicity. Toxicology, 307, 74-88.
- MULTIGNER L., J.R. NDONG, A. GIUSTI, M. ROMANA, H. DELACROIX-MAILLARD, S. CORDIER, B. JÉGOU, J.P. THOME et P. BLANCHET (2010). Chlordecone exposure and risk of prostate cancer. J. Clin. Oncol., 28, 3457-3462.
- NEUMAN-LEE L.A. et F.J. JANZEN (2011). Atrazine exposure impacts behavior and survivorship of neonatal turtles. Herpetologica, 67, 23-31.
- NIDHEESH P.V. et R. GANDHIMATHI (2012). Trends in electro-Fenton process for water and wastewater treatment: An overview. Desalination, 299, 1-15.
- NOVAK S.M., O. BANTON et M. SCHIAVON (2003). Modelling metolachlor exports in subsurface drainage water from two structured soils under maize (eastern France). J. Hydrol., 270, 295-308.
- NOWORYTA K. et J. AUGUSTYNSKI (2004). Spectral photoresponses of carbon-doped TiO2 film electrodes. Electrochem. Solid-State Lett., 7 (6), E31-E33.
- OHNO T., M. AKIYOSHI, T. UMEBAYASHI, K. ASAI, T. MITSUI et M. MATSUMURA (2004). Preparation of S-doped TiO2 photocatalysts and their photocatalytic activities under visible light. Appl. Catal. A-Gen., 265, 115-121.
- OJANI R., J.-B. RAOOF et E. ZAREI (2012). Electrochemical monitoring of photoelectrocatalytic degradation of 3,4-Dichlorophenol using TiO2 thin film modified graphite electrode. J. Chin. Chem. Soc., 59, 917-922.
- OLIVA A., A. SPIRA et L. MULTIGNER (2001). Contribution of environmental factors to the risk of male infertility. Hum. Reprod., 16, 1768-1776.
- OLLER I., W. GERNJAK, M.I. MALDONADO, L.A. PÉREZ-ESTRADA, J.A. SÁNCHEZ-PÉREZ et S. MALATO (2006). Solar photocatalytic degradation of some hazardous water-soluble pesticides at pilot-plant scale. J. Hazard. Mater., 138, 507-517.
- ORMAD M.P., N. MIGUEL, A. CLAVER, J.M. MATESANZ et J.L. OVELLEIRO (2008). Pesticides removal in the process of drinking water production. Chemosphere, 71, 97-106.
- OTERO R., D. ESQUIVEL, M.A. ULIBARRI, F.J. ROMERO-SALGUERO, P. VAN DER VOORT et J.M. FERNÁNDEZ (2014). Mesoporous phenolic resin and mesoporous carbon for the removal of S-metolachlor and bentazon herbicides. Chem. Eng. J., 251, 92-101.
- OTURAN M.A. (2000). An ecologically effective water treatment technique using electrochemically generated hydroxyl radicals for in situ destruction of organic pollutants: Application to herbicide 2,4-D. J. Appl. Electrochem., 30, 475-482.
- OTURAN M.A. et J.-J. AARON (2014). Advanced oxidation processes in water/wastewater treatment: Principles and applications. A Review. Crit. Rev. Env. Sci. Tec., 44, 2577-2641.
- OTURAN N., E. BRILLAS et M. OTURAN (2012). Unprecedented total mineralization of atrazine and cyanuric acid by anodic oxidation and electro-Fenton with a boron-doped diamond anode. Environ. Chem. Lett., 10, 165-170.
- OTURAN N., I. SIRÉS, M.A. OTURAN et E. BRILLAS (2009). Degradation of pesticides in aqueous medium by electro-Fenton and related methods. A review. J. Environ. Eng. Manage., 19, 235-255.
- ÖZCAN A., Y. ŞAHIN, A.S. KOPARAL et M.A. OTURAN (2008). Degradation of picloram by the electro-Fenton process. J. Hazard. Mater., 153, 718-727.
- PANIZZA M. et G. CERISOLA (2009). Direct and mediated anodic oxidation of organic pollutants. Chem. Rev., 109, 6541-6569.
- PARRÓN T., M. REQUENA, A.F. HERNÁNDEZ et R. ALARCÓN (2011). Association between environmental exposure to pesticides and neurodegenerative diseases. Toxicol. Appl. Pharmacol., 256, 379-385.
- PEYTON G.R. et W.H. GLAZE (1988). Destruction of pollutants in water with ozone in combination with ultraviolet radiation. 3. Photolysis of aqueous ozone. Environ. Sci. Technol., 22, 761-767.
- PIGNATELLO J.J. (1992). Dark and photoassisted iron(3+)-catalyzed degradation of chlorophenoxy herbicides by hydrogen peroxide. Environ. Sci. Technol., 26, 944-951.
- PIGNATELLO J.J., D. LIU et P. HUSTON (1999). Evidence for an additional oxidant in the photoassisted Fenton reaction. Environ. Sci. Technol., 33, 1832-1839.
- PIGNATELLO J.J. et Y. SUN (1995). Complete oxidation of metolachlor and methyl parathion in water by the photoassisted Fenton reaction. Water Res., 29, 1837-1844.
- PIMENTEL D. (2009). Pesticides and pest control. Dans : Integrated Pest Management: Innovation-Development Process. PESHIN R. et A.K. DHAWAN (Éditeurs), Vol. 1, Springer, Pays-Bas, Chap. 3, pp. 83-87.
- PIPI A.R.F., A.R. DE ANDRADE, E. BRILLAS et I. SIRÉS (2014). Total removal of alachlor from water by electrochemical processes. Sep. Purif. Technol., 132, 674-683.
- PLANTARD G., T. JANIN, V. GOETZ et S. BROSILLON (2012). Solar photocatalysis treatment of phytosanitary refuses: Efficiency of industrial photocatalysts. Appl. Catal. B-Environ., 115-116, 38-44.
- POTTER T.L., M.A. MOHAMED et H. ALI (2006). Solid-phase extraction combined with high-performance liquid chromatography−atmospheric pressure chemical ionization−mass spectrometry analysis of pesticides in water: Method performance and application in a reconnaissance survey of residues in drinking water in Greater Cairo, Egypt. J. Agr. Food Chem., 55, 204-210.
- POWLES S. et J. MATTHEWS (1992). Multiple herbicide resistance in annual ryegrass (Lolium rigidum): A driving force for the adoption of integrated weed management. Dans: Resistance ’91: Achievements and Developments in Combating Pesticide Resistance. DENHOLM I., A. DEVONSHIRE et D. HOLLOMON (Éditeurs), Springer, Pays-Bas, Chap. 7, pp. 75-87.
- POZZA A., P. FERRANTELLI, C. MERLI et E. PETRUCCI (2005). Oxidation efficiency in the electro-Fenton process. J. Appl. Electrochem., 35, 391-398.
- PRADO J. et S. ESPLUGAS (1999). Comparison of different advanced oxidation processes involving ozone to eliminate atrazine. Ozone-Sci. Eng., 21, 39-52.
- PRATAP K. et A.T. LEMLEY (1998). Fenton electrochemical treatment of aqueous atrazine and metolachlor. J. Agr. Food Chem., 46, 3285-3291.
- PURDUE M.P., J.A. HOPPIN, A. BLAIR, M. DOSEMECI et M.C.R. ALAVANJA (2007). Occupational exposure to organochlorine insecticides and cancer incidence in the Agricultural Health Study. Int. J. Cancer, 120, 642-649.
- QIANG Z., J.-H. CHANG et C.-P. HUANG (2002). Electrochemical generation of hydrogen peroxide from dissolved oxygen in acidic solutions. Water Res., 36, 85-94.
- QIANG Z., J.-H. CHANG et C.-P. HUANG (2003). Electrochemical regeneration of Fe2+ in Fenton oxidation processes. Water Res., 37, 1308-1319.
- RABAAOUI N., M.E.K. SAAD, Y. MOUSSAOUI, M.S. ALLAGUI, A. BEDOUI et E. ELALOUI (2013). Anodic oxidation of o-nitrophenol on BDD electrode: Variable effects and mechanisms of degradation. J. Hazard. Mater., 250-251, 447-453.
- RAJESWARI R. et S. KANMANI (2010). Comparative study on photocatalytic oxidation and photolytic ozonation for the degradation of pesticide wastewaters. Desalin. Water Treat., 19, 301-306.
- RAMWELL C.T., A.I.J. HEATHER et A.J. SHEPHERD (2004). Herbicide loss following application to a railway. Pest Manag. Sci., 60, 556-564.
- REILLY T.J., K.L. SMALLING, J.L. ORLANDO et K.M. KUIVILA (2012). Occurrence of boscalid and other selected fungicides in surface water and groundwater in three targeted use areas in the United States. Chemosphere, 89, 228-234.
- RICHARD S., S. MOSLEMI, H. SIPAHUTAR, N. BENACHOUR et G.-E. SERALINI (2005). Differential effects of glyphosate and roundup on human placental cells and aromatase. Environ. Health Persp., 716-720.
- RINSKY J.L., C. HOPENHAYN, V. GOLLA, S. BROWNING et H.M. BUSH (2012). Atrazine exposure in public drinking water and preterm birth. Public Health Rep., 127 (1), 72-80.
- RIZZO L., A. DELLA SALA, A. FIORENTINO et G. LI PUMA (2014). Disinfection of urban wastewater by solar driven and UV lamp - TiO2 photocatalysis: Effect on a multi drug resistant Escherichia coli strain. Water Res., 53, 145-152.
- ROMITTI P.A., A.M. HERRING, L.K. DENNIS et D.L. WONG-GIBBONS (2007). Meta-analysis: Pesticides and orofacial clefts. Cleft Palate Craniofac. J., 44, 358-365.
- RUIZ-TOLEDO J., R. CASTRO, N. RIVERO-PÉREZ, R. BELLO-MENDOZA et D. SÁNCHEZ (2014). Occurrence of glyphosate in water bodies derived from intensive agriculture in a tropical region of Southern Mexico. Bull. Environ. Contam. Toxicol., 93, 289-293.
- RUSIECKI J.A., A. BACCARELLI, V. BOLLATI, L. TARANTINI, L.E. MOORE et E.C. BONEFELD-JORGENSEN (2008). Global DNA hypomethylation is associated with high serum-persistent organic pollutants in Greenlandic Inuit. Environ. Health Persp., 116, 1547-1552.
- SABIN G.P., O.D. PRESTES, M.B. ADAIME et R. ZANELLA (2009). Multiresidue determination of pesticides in drinking water by gas chromatography-mass spectrometry after solid-phase extraction. J. Braz. Chem. Soc., 20, 918-925.
- SAITÚA H., F. GIANNINI et A.P. PADILLA (2012). Drinking water obtaining by nanofiltration from waters contaminated with glyphosate formulations: Process evaluation by means of toxicity tests and studies on operating parameters. J. Hazard. Mater., 227-228, 204-210.
- SAKKAS V.A., I.M. ARABATZIS, I.K. KONSTANTINOU, A.D. DIMOU, T.A. ALBANIS et P. FALARAS (2004). Metolachlor photocatalytic degradation using TiO2 photocatalysts. Appl. Catal. B-Environ., 49, 195-205.
- SALAZAR R. et M.S. URETA-ZAÑARTU (2012). Mineralization of triadimefon fungicide in water by electro-Fenton and photo electro-Fenton. Water Air Soil Poll., 223, 4199-4207.
- SAMANIC C., J. RUSIECKI, M. DOSEMECI, L. HOU, J.A. HOPPIN, D.P. SANDLER, J. LUBIN, A. BLAIR et M.C.R. ALAVANJA (2006). Cancer incidence among pesticide applicators exposed to dicamba in the agricultural health study. Environ. Health Persp., 114, 1521-1526.
- SAMET Y., L. AGENGUI et R. ABDELHÉDI (2010). Anodic oxidation of chlorpyrifos in aqueous solution at lead dioxide electrodes. J. Electroanal. Chem., 650, 152-158.
- SANCHÍS J., L. KANTIANI, M. LLORCA, F. RUBIO, A. GINEBREDA, J. FRAILE, T. GARRIDO et M. FARRÉ (2012). Determination of glyphosate in groundwater samples using an ultrasensitive immunoassay and confirmation by on-line solid-phase extraction followed by liquid chromatography coupled to tandem mass spectrometry. Anal. Bioanal. Chem., 402, 2335-2345.
- SCHLOTMAN K.E. (2014). An epigenetic look at atrazine toxicity: An analysis of microRNA-126 expression in developing zebrafish exposed to the herbicide atrazine. J. Purdue. Under. Res., 4, 8.
- SCHWEINSBERG F., W. ABKE, K. RIETH, U. ROHMANN et N. ZULLEI-SEIBERT (1999). Herbicide use on railway tracks for safety reasons in Germany? Toxicol. Lett., 107 (1-3), 201-205.
- SCRIBNER E.A., W.A. BATTAGLIN, R.J. GILLIOM et M.T. MEYER (2007). Concentrations of glyphosate, its degradation product, aminomethylphosphonic acid, and glufosinate in ground-and surface-water, rainfall, and soil samples collected in the United States, 2001-06. Scientific Investigations Report 2007-5122. US Geological Survey, US Department of the Interior, Reston, Virginia, États-Unis, 121 p.
- SECK E.I., J.M. DOÑA-RODRÍGUEZ, C. FERNÁNDEZ-RODRÍGUEZ, O.M. GONZÁLEZ-DÍAZ, J. ARAÑA et J. PÉREZ-PEÑA (2012). Photocatalytic removal of 2,4-dichlorophenoxyacetic acid by using sol–gel synthesized nanocrystalline and commercial TiO2: Operational parameters optimization and toxicity studies. Appl. Catal. B-Environ., 125, 28-34.
- SEGURA P.A., S.L. MACLEOD, P. LEMOINE, S. SAUVÉ et C. GAGNON (2011). Quantification of carbamazepine and atrazine and screening of suspect organic contaminants in surface and drinking waters. Chemosphere, 84, 1085-1094.
- SERVICE DE L'OBSERVATION ET DES STATISTIQUES (SOeS) DU MINISTÈRE DE L’ENVIRONNEMENT, DE L’ÉNERGIE ET DE LA MER. (2013). Les pesticides dans les cours d'eau français en 2013. http://www.statistiques.developpement-durable.gouv.fr/ (consultation le 15 décembre 2014).
- SHAW G.M., C.R. WASSERMAN, C.D. O'MALLEY, V. NELSON et R.J. JACKSON (1999). Maternal pesticide exposure from multiple sources and selected congenital anomalies. Epidemiology, 10, 60-66.
- SIEVERS M. (2011). Advanced oxidation processes. Dans: Treatise on Water Science. WILDERER P. (Éditeur), Vol. 4, Elsevier, Amsterdam, Pays-Bas, Chap. 13, pp 377-408.
- SILVA M., A. DOS SANTOS BATISTA, S. BORRELY, V. SILVA et A. TEIXEIRA (2014). Photolysis of atrazine in aqueous solution: Role of process variables and reactive oxygen species. Environ. Sci. Pollut. Res., 21, 12135-12142.
- SINGH N. (2009). Adsorption of herbicides on coal fly ash from aqueous solutions. J. Hazard. Mater., 168, 233-237.
- SIRÉS I., C. ARIAS, P.L. CABOT, F. CENTELLAS, J.A. GARRIDO, R.M. RODRÍGUEZ et E. BRILLAS (2007). Degradation of clofibric acid in acidic aqueous medium by electro-Fenton and photoelectro-Fenton. Chemosphere, 66, 1660-1669.
- SIRÉS I., E. BRILLAS, G. CERISOLA et M. PANIZZA (2008). Comparative depollution of mecoprop aqueous solutions by electrochemical incineration using BDD and PbO2 as high oxidation power anodes. J. Electroanal. Chem., 613, 151-159.
- SIRÉS I., E. BRILLAS, M. OTURAN, M. RODRIGO et M. PANIZZA (2014). Electrochemical advanced oxidation processes: today and tomorrow. A review. Environ. Sci. Pollut. Res., 21, 8336-8367.
- SKOUMAL M., C. ARIAS, P.L. CABOT, F. CENTELLAS, J.A. GARRIDO, R.M. RODRÍGUEZ et E. BRILLAS (2008). Mineralization of the biocide chloroxylenol by electrochemical advanced oxidation processes. Chemosphere, 71, 1718-1729.
- SOLOMON K.R., D.B. BAKER, R.P. RICHARDS, K.R. DIXON, S.J. KLAINE, T.W. LA POINT, R.J. KENDALL, C.P. WEISSKOPF, J.M. GIDDINGS, J.P. GIESY, L.W. HALL et W.M. WILLIAMS (1996). Ecological risk assessment of atrazine in North American surface waters. Environ. Toxicol. Chem., 15, 31-76.
- SONG C., A. KANTHASAMY, H. JIN, V. ANANTHARAM et A.G. KANTHASAMY (2011). Paraquat induces epigenetic changes by promoting histone acetylation in cell culture models of dopaminergic degeneration. Neurotoxicology, 32, 586-595.
- SOUZA D.R.d., A.G. TROVÓ, N.R. ANTONIOSI FILHO, M.A.A. SILVA et A.E.H. MACHADO (2013). Degradation of the commercial herbicide glyphosate by photo-fenton process: evaluation of kinetic parameters and toxicity. J. Braz. Chem. Soc., 24, 1451-1460.
- STEENLAND K., A.M. MORA, D.B. BARR, J. JUNCOS, N. ROMAN et C. WESSELING (2014). Organochlorine chemicals and neurodegeneration among elderly subjects in Costa Rica. Environ. Res., 134, 205-209.
- STRUGER J., J. GRABUSKI, S. CAGAMPAN, E. SVERKO et C. MARVIN (2016). Occurrence and distribution of carbamate pesticides and metalaxyl in Southern Ontario surface waters 2007-2010. Bull. Environ. Contam. Toxicol., 96 (4), 423-31.
- STRUGER J., D. THOMPSON, B. STAZNIK, P. MARTIN, T. MCDANIEL et C. MARVIN (2008). Occurrence of glyphosate in surface waters of Southern Ontario. Bull. Environ. Contam. Toxicol., 80, 378-384.
- TANG J.-X., D.K. HOAGLAND et D.B. SIEGFRIED (1997). Differential toxicity of atrazine to selected freshwater algae. Bull. Environ. Contam. Toxicol., 59, 631-637.
- TANG W.Z. et C.P. HUANG (1996). 2,4-Dichlorophenol oxidation kinetics by Fenton's reagent. Environ. Technol., 17, 1371-1378.
- TEÓFILO R.F., E.L. REIS, C. REIS, G.A.d. SILVA, J.F. PAIVA et L.T. KUBOTA (2008). Glyphosate determination in soil, water and vegetables using DPV optimized by response surface methodology. Portug. Electrochim. Acta, 26, 325-337.
- TEXIER I., C. GIANNOTTI, S. MALATO, C. RICHTER et J. DELAIRE (1999). Solar photodegradation of pesticides in water by sodium decatungstate. Catal. Today, 54, 297-307.
- TIRELLO P., A. POZZEBON et C. DUSO (2012). Resistance to chlorpyriphos in the predatory mite Kampimodromus aberrans. Exp. Appl. Acarol., 56, 1-8.
- US Environmental Protection Agency (2006). Decision documents for atrazine. US EPA EPA-HQ-OPP-2003-0367. http://www.epa.gov/pesticides/reregistration/atrazine/ (consultation le 11 février 2015).
- VAN DER BRUGGEN B., J. SCHAEP, W. MAES, D. WILMS et C. VANDECASTEELE (1998). Nanofiltration as a treatment method for the removal of pesticides from ground waters. Desalination, 117, 139-147.
- VAN STEMPVOORT D.R., J.W. ROY, S.J. BROWN et G. BICKERTON (2014). Residues of the herbicide glyphosate in riparian groundwater in urban catchments. Chemosphere, 95, 455-463.
- VENTURA A., G. JACQUET, A. BERMOND et V. CAMEL (2002). Electrochemical generation of the Fenton's reagent: Application to atrazine degradation. Water Res., 36, 3517-3522.
- VESILIND P. (1996). Introduction to Environment Engineering. PWS Publishing Company, Boston, États-Unis, 468 p.
- VIDAL-DORSCH D.E., S.M. BAY, K. MARUYA, S.A. SNYDER, R.A. TRENHOLM et B.J. VANDERFORD (2012). Contaminants of emerging concern in municipal wastewater effluents and marine receiving water. Environ. Toxicol. Chem., 31, 2674-2682.
- VON GUNTEN U. (2003). Ozonation of drinking water: Part I. Oxidation kinetics and product formation. Water Res., 37, 1443-1467.
- VON GUNTEN U. et J. HOIGNE (1994). Bromate formation during ozonization of bromide-containing waters: interaction of ozone and hydroxyl radical reactions. Environ. Sci. Technol., 28, 1234-1242.
- WADDELL B., S. ZAHM, D. BARIS, D. WEISENBURGER, F. HOLMES, L. BURMEISTER, K. CANTOR et A. BLAIR (2001). Agricultural use of organophosphate pesticides and the risk of non-Hodgkin's lymphoma among male farmers (United States). Cancer Causes Control, 12, 509-517.
- WANG X., S. ZHOU A, X. DING, G. ZHU et J. GUO (2010). Effect of triazophos, fipronil and their mixture on miRNA expression in adult zebrafish. J. Environ. Sci. Health. B, 45, 648-657.
- WANG N., X. LI, Y. WANG, X. QUAN et G. CHEN (2009). Evaluation of bias potential enhanced photocatalytic degradation of 4-chlorophenol with TiO2 nanotube fabricated by anodic oxidation method. Chem. Eng. J., 146, 30-35.
- WANIGASURIYA K.P., R.J. PEIRIS-JOHN, R. WICKREMASINGHE et A. HITTARAGE (2007). Chronic renal failure in North Central Province of Sri Lanka: An environmentally induced disease. Trans. R. Soc. Trop. Med. Hyg., 101, 1013-1017.
- WEICHENTHAL S., C. MOASE et P. CHAN (2012). A review of pesticide exposure and cancer incidence in the Agricultural Health Study cohort. Ciência & Saúde Coletiva, 17, 255-270.
- WHORTON D., R. KRAUSS, S. MARSHALL et T. MILBY (1977). Infertility in male pesticide workers. The Lancet, 310, 1259-1261.
- WILLIAMS W.M., J. GIDDINGS, J. PURDY, K. SOLOMON et J. GIESY (2014). Exposures of aquatic organisms to the organophosphorus insecticide, chlorpyrifos resulting from use in the United States. Dans: Ecological Risk Assessment for Chlorpyrifos in Terrestrial and Aquatic Systems in the United States. GIESY J.P. et K. R. SOLOMON (Éditeurs), Vol. 231, Springer International Publishing, New York, États-Unis, Chap. 4, pp. 77-117.
- WOLF A., A. BERGMANN, R.-D. WILKEN, X. GAO, Y. BI, H. CHEN et C. SCHÜTH (2013). Occurrence and distribution of organic trace substances in waters from the Three Gorges Reservoir, China. Environ. Sci. Pollut. Res., 20, 7124-7139.
- WONG C.C. et W. CHU (2003). The direct photolysis and photocatalytic degradation of alachlor at different TiO2 and UV sources. Chemosphere, 50, 981-987.
- WOUDNEH M.B., Z. OU, M. SEKELA, T. TUOMINEN et M. GLEDHILL (2009). Pesticide multiresidues in waters of the Lower Fraser Valley, British Columbia, Canada. Part II. Groundwater. J. Environ. Qual., 38, 948-954.
- XU W. et Y. WANG (2001). Photoelectrochemical degradation of pentachlorophenol on TiO2 film electrode. Chinese J. Process. Eng., 1, 45-49.
- YANG S. et L. GAO (2004). New method to prepare nitrogen-doped titanium dioxide and its photocatalytic activities irradiated by visible light. J. Am. Ceram. Soc., 87, 1803-1805.
- YATMAZ H.C. et Y. UZMAN (2009). Degradation of pesticide monochrotophos from aqueous solutions by electrochemical methods. Int. J. Electrochem. Sc., 4, 614-626.
- YOLA M.L., T. EREN et N. ATAR (2014). A novel efficient photocatalyst based on TiO2 nanoparticles involved boron enrichment waste for photocatalytic degradation of atrazine. Chem. Eng. J., 250, 288-294.
- YU L., G. ACHARI et C.H. LANGFORD (2013). LED-based photocatalytic treatment of pesticides and chlorophenols. J. Environ. Eng., 139, 1146-1151.
- ZAPATA A., T. VELEGRAKI, J.A. SÁNCHEZ-PÉREZ, D. MANTZAVINOS, M.I. MALDONADO et S. MALATO (2009). Solar photo-Fenton treatment of pesticides in water: Effect of iron concentration on degradation and assessment of ecotoxicity and biodegradability. Appl. Catal. B-Environ., 88, 448-454.
- ZAVISKA F., P. DROGUI, G. MERCIER et J.-F. BLAIS (2009). Procédés d’oxydation avancée dans le traitement des eaux et des effluents industriels: Application à la dégradation des polluants réfractaires. Rev. Sci. Eau, 22, 535-564.
- ZAVISKA F., P. DROGUI, J.-F. BLAIS, G. MERCIER et P. LAFRANCE (2011). Experimental design methodology applied to electrochemical oxidation of the herbicide atrazine using Ti/IrO2 and Ti/SnO2 circular anode electrodes. J. Hazard. Mater., 185, 1499-1507.
- ZHANG H., G. CHEN et D.W. BAHNEMANN (2009). Photoelectrocatalytic materials for environmental applications. J. Mater. Chem., 19, 5089-5121.
- ZHANG H., D. ZHANG et J. ZHOU (2006). Removal of COD from landfill leachate by electro-Fenton method. J. Hazard. Mater., 135, 106-111.
- ZHANG H., C. FEI, D. ZHANG et F. TANG (2007). Degradation of 4-nitrophenol in aqueous medium by electro-Fenton method. J. Hazard. Mater., 145, 227-232.
- ZUO Y. et J. HOIGNE (1992). Formation of hydrogen peroxide and depletion of oxalic acid in atmospheric water by photolysis of iron(III)-oxalato complexes. Environ. Sci. Technol., 26, 1014-1022.
Liste des figures
Figure 1
Variations des concentrations maximales annuelles des herbicides dans quatre rivières du Québec (Canada)
Variation of maximum annual concentrations of herbicides in four rivers in Quebec (Canada)
Liste des tableaux
Tableau 1
Présence et quantification des pesticides dans l’eau de certains pays
Presence and quantification of pesticides in water of some countries
Tableau 2
Effets de l’exposition aux pesticides sur la santé humaine
Effects of pesticide exposure on human health
Tableau 3
Procédés utilisés pour le traitement de l’eau contaminée par les pesticides
Processes used for treating water contaminated with pesticides
a PWP : pure water permeability (perméabilité à l’eau pure); b MWCO : molecular weight cut-off (seuil de coupure de la masse molaire); c BRM : bioréacteur à membrane; d GEM : genetically engineered microorganism (microorganisme génétiquement modifié); e BDD : bore dopé au diamant; f TDS : total dissolved solids (matière dissoute totale); g DAS : dewatered alum sludge (boues d’alun déshydratées); h LAS : liquid alum sludge (boues d’alun liquides)
Tableau 4
Synthèse des principaux avantages et inconvénients des POA examinés
Synthesis of main advantages and drawbacks of the AOPs reviewed



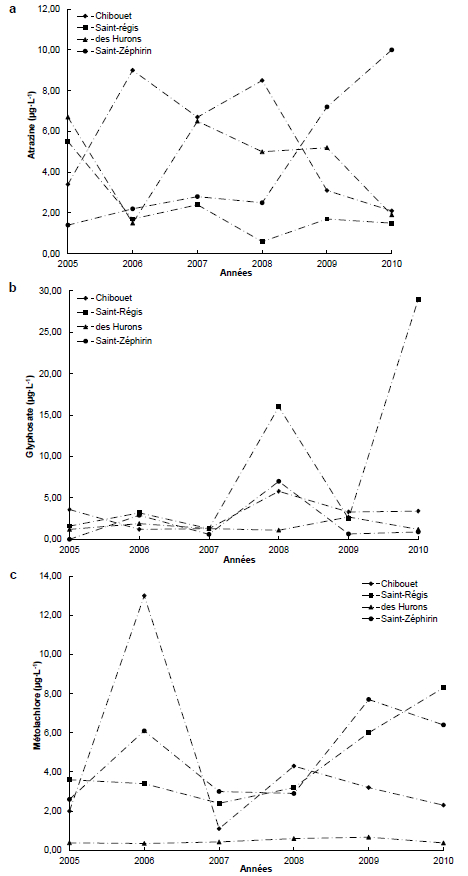


 10.7202/705501ar
10.7202/705501ar