Résumés
Résumé
L’objectif de la présente étude consiste, d’une part, tester les performances d’un filtre à sable pour diminuer la charge organique des margines diluées à 50 % avec des eaux usées urbaines et, d’autre part, compléter le traitement par l’utilisation d’un mélange de plantes aquatiques composé de Phragmites australis, Typha latifolia et Arundo donax sous un régime d’écoulement vertical.
Le pilote expérimental est composé d’un filtre à sable suivi d’un système planté. Le filtre à sable est rempli sur une épaisseur de 50 cm de sable et 10 cm de gravier en haut et en bas du pot. L’alimentation (4 cm•j‑1) se fait en bâchée avec une fréquence régulière de trois fois par semaine. Afin d’améliorer le processus de dégradation dans le filtre à sable, les margines ont été diluées avec des eaux usées urbaines à 50 %. La deuxième étape de traitement se compose d’un bac de capacité (1x1x1 m3) rempli sur une épaisseur de 20 cm de gravier et 60 cm de sol. Le bac est planté d’une combinaison de trois plantes : Phragmites australis, Typha latifolia et Arundo donax avec une densité de huit plants•m‑2 pour chaque plante. L’alimentation du bac se fait par des margines précédemment prétraitées en bâchée de 20 L avec une fréquence régulière de deux fois par semaine.
Les résultats ont montré que le filtre à sable assure une neutralisation du pH qui passe de 4,79 à 7,68. L’enrichissement du sable par les micro-organismes permet d’avoir une minéralisation importante de la matière organique. Après dix semaines d’expérimentation, aucun signe de colmatage n’a été signalé, le taux de réduction des MES, de la DCO totale, de la DCO dissoute et des composés phénoliques est d’environ 70 %, 79 %, 76 % et 81 % respectivement. Le traitement subséquent par le mélange des trois plantes montre une augmentation du pH et de la conductivité électrique et une élimination importante de la DCO totale (99,7 %), de la DCO dissoute (99,5 %), des MES (94 %) et des polyphénols (95 %).
À la lumière des résultats trouvés, on conclut que le traitement des margines par la combinaison de deux systèmes (filtre à sable et lit planté) permet une élimination importante de la charge organique des margines.
Mots-clés :
- margines,
- filtre à sable,
- lit planté,
- matière organique,
- composés phénoliques
Abstract
The objective of this study consisted of testing the potential of a sand filter to decrease the organic pollutants in olive mill wastewater (OMW) diluted to 50% with domestic wastewater, and to polish the treatment by using a mixture of aquatic plants: Phragmites australis, Typha latifolia and Arundo donax. The experimental pilot consists of a sand filter followed by a planted system. The sand filter is filled with 50 cm of sand and 10 cm of gravel at the top and the bottom of the filter. The feed (4 cm•j‑1) is done sequentially according to a one-day wet / three days dry cycle. In order to activate the degradation processes in the sand filter, OMW are diluted to 50% with domestic wastewater. The second step of the treatment consists of a tank (1x1x1 m3) filled with 20 cm of gravel and 60 cm of soil planted with a mixture of aquatic plants at a density of 8 young plants•m‑2 for each plant and irrigated two times in the week by 20 L of pre-filtered OMW.
The results show that the sand filter ensures a neutralization of the OMW pH, which passes from 4.79 to 7.68. The enrichment of the sand by the micro-organisms ensures an important mineralization of the organic matter. After ten weeks of operation of this system without clogging sign, the rate of abatement of the TSS, total COD, dissolved COD and phenolic compounds was about 70%, 79%, 76% and 81% respectively. Completion of the treatment by the mixture of three plants shows an increase in the pH, electric conductivity and a significant elimination of the total COD (99,7%), dissolved COD (99,5%), TSS (94%) and polyphenols (95%).
With regard to OMW treatment efficiency, the treatment of the OMW by the combination of two systems (sand filter and planted system) results in a significant removal of the organic load of the OMW.
Keywords:
- olive mill wastewater,
- sand filter,
- aquatic plants,
- organic matter,
- phenolic compounds
Corps de l’article
1. Introduction
Le patrimoine oléicole mondial compte actuellement environ 750 millions de pieds d’olivier cultivés sur une superficie de 9,23 millions d’hectares. Les pays méditerranéens comptent 715 millions d’oliviers sur une superficie d’environ 8,16 millions d’hectares, soit 95 % du patrimoine oléicole mondial (DPV/MADRPM 1998).
Au Maroc, la superficie implantée en olivier s’élève à 550 000 ha, soit 5,6 % de la superficie mondiale (DPV/MAEE 1999/2000). Le Maroc occupe ainsi le sixième rang après l’Espagne, l’Italie, la Tunisie, la Turquie et la Grèce (IOM 2003, 2004).
La trituration des olives laisse, en plus de sa production principale qui est l’huile, deux résidus, l’un solide (les grignons), et l’autre liquide (les margines). La production mondiale des résidus liquides est estimée à 8,4 millions de mètres cubes (NEFZAOUI 1987). Au Maroc, la production annuelle des résidus liquides est estimée à 250 000 mètres cubes (IOM 2003, 2004).
L’industrie d’extraction d’huile d’olive pose de sérieux problèmes environnementaux. Les effluents des huileries d’olive ne subissent aucun traitement et sont souvent déversés dans les égouts d’assainissement, stockés dans des bassins d’évaporation ou épandus directement sur le sol. Il en résulte un impact négatif sur l’environnement qui se traduit par le colmatage des sols, la pollution des eaux superficielles et souterraines et le dégagement d’odeurs nauséabondes.
Ces problèmes environnementaux sont attribués à la richesse des effluents en matières organiques (GALLI et al., 1997) et en particulier en polyphénols qui sont responsables de l’effet phytotoxique (SAYADI et al., 2000; ZENJARI et al., 2006). Ces considérations ont conduit plusieurs chercheurs aux échelles nationale et internationale à trouver des applications pour le traitement et la valorisation des effluents des huileries d’olive : procédés physiques (ACHAK et al., 2008; AL-MALLAH et al., 2000), procédés thermiques (DI GIACOMO et al., 1991; VITOLO et al., 1999), floculation et clarification (FLOURI et al., 1996), adsorption (ACHAK et al., 2009a), compostage (AIT-BADDI et al., 2004; PAREDES et al., 2000) et infiltration-percolation (ACHAK et al., 2009b; SAADI et al., 2007; SANTI et al., 2008; SAYADI et al., 2000).
Le traitement par infiltration-percolation en utilisant le sol comme substrat est souvent appliqué à des eaux usées urbaines par plusieurs chercheurs. Peu de travaux ont été consacrés au traitement par infiltration-percolation des effluents de l’industrie oléicole (margines) qui sont un déchet très concentré en polyphénols et en matières organiques (CAMURATI et al., 1984).
L’infiltration-percolation est un traitement biologique par cultures bactériennes fixées sur un support fin qui permet la rétention des MES par filtration sur la plage d’infiltration, la décomposition de la matière organique par des micro-organismes édaphiques ou allochtones (OUAZZANI, 1998) et l’élimination des formes d’azote par minéralisation et oxydation biologique.
Une nouvelle technologie extensive fondée sur l’utilisation de communautés végétales aquatiques a été exploitée avec succès par plusieurs auteurs pour le traitement de plusieurs types d’effluents : effluent de laiterie (BOUTIN et al., 1996), d’abattoir (RIVERA et al., 1997), domestique (MANDI et al., 1996) et effluent de tannerie (TIGLYENE et al., 2005). Malgré les nombreuses études consacrées au traitement des effluents industriels par les plantes aquatiques, peu de travaux se sont intéressés à tester ces plantes à épurer les effluents de l’industrie oléicole (margines).
Les plantes aquatiques testées sont aussi bien libres ou flottants telles que Lemna et Eichhornia (MANDI et al., 1992; MANDI et al., 1993; RADOUX et KEMP, 1992; REETA et al., 2004) qu’enracinées ou hélophytes telles qu’Arundo, Typha, Phragmites et Juncus (ABISSY et MANDI, 1999; CIRIA et al., 2005; MANDI et al., 1998).
La base du traitement par les hélophytes enracinées repose particulièrement sur le fait que :
Ce sont pour la plupart des plantes à rhizome horizontal et vertical qui fournissent un support pour la croissance des bactéries et pour la filtration des substances particulaires (Gesberget al., 1986). Le rhizome assure aussi avec les racines une forte perméabilité du sol et une grande surface de contact entre sol-eau usée (Radoux et kemp, 1988).
Ils sont capables de concentrer les métaux lourds, d’absorber plus de nutriments que leurs besoins et de neutraliser les pH extrêmes (ABBISY 2000; HADAD et al., 2006);
Ils ont l’aptitude de transmettre de l’oxygène des feuilles à travers les tiges dans la rhizosphère (BRIX, 1993; BIDDLESTONE et al., 1991).
Les systèmes plantés ont plusieurs avantages : ils sont moins coûteux à construire et à exploiter, peuvent être construits sur le site de production des eaux usées, nécessitent peu d’équipements mécanisés et sont moins sensibles aux variations de la charge polluante (BRIX, 1993).
L’objectif de la présente étude est pour, d’une part, tester les performances d’un filtre à sable à diminuer la charge organique des margines diluées avec des eaux usées urbaines à 50 % et, d’autre part, compléter le traitement par l’utilisation d’un lit planté par Phragmites australis, Typha latifolia et Arundo donax en mettant en évidence les potentialités épuratoires de cette mixture à épurer les margines prétraitées.
2. Matériels et méthodes
L’expérience est réalisée dans la ville de Marrakech caractérisée par un climat aride à semi-aride avec une pluviométrie moyenne de 240 mm•an‑1. La température moyenne varie entre un minimum de 5 °C et un maximum de 45 °C.
Le pilote expérimental (filière) est composé de deux systèmes en série (Figure 1) :
Six pots de capacité 120 L et de diamètre 50 cm, chaque pot est rempli sur une épaisseur de 50 cm de sable (texture sableuse) et 10 cm de gravier en haut et en bas du pot. L’alimentation du système se fait par des margines diluées avec des eaux usées urbaines à 50 % en bâchée de 5 L•j‑1 (4 cm•j‑1) avec une fréquence régulière de trois fois par semaine (un jour d’alimentation et deux jours de repos). Le choix du pourcentage de dilution (50 %) est basé sur une étude préalable du pH et de la quantité d’oxygène consommée au cinquième jour dans les différents mélanges ajustés à pH neutre, à 20 °C et à l’obscurité à l’aide d’un DBO-mètre (Achaket al., 2009b). L’écoulement des margines se fait en percolation à travers le substrat (sable), l’eau percolée est récupérée au moyen d’un drain placé à la base de chaque pot.
Un bac de capacité (1x1x1 m3) remplis sur une épaisseur de 20 cm de gravier et 60 cm de sol. Le bac est planté d’une combinaison de trois hélophytes : Phragmites australis, Typha latifolia et Arundo donax avec une densité de huit plants•m‑2 pour chaque plante. Les hélophytes sont des plantes dont les racines se développent dans un substrat gorgé d’eau alors que leur système reproducteur et végétatif reste hors de l’eau. L’alimentation du système se fait par des margines précédemment prétraitées en bâchée de 20 L avec une fréquence régulière de deux fois par semaine. Ce mode d’alimentation choisi permet de maintenir les conditions aérobies et d’éviter le colmatage du système. L’écoulement se fait en percolation à travers le substrat (sol), l’eau percolée est récupérée au moyen d’un drain placé à la base du bac.
Figure 1
Dispositif expérimental.
Experimental design.
Le bac a été irrigué dans un premier temps par une eau de puits pendant un mois, ensuite par des dilutions croissantes des margines prétraitées 10 % (juin), 25 % (juin), 50 % (juillet), 75 % (juillet) et 100 % (août 2006). Les dilutions ont été effectuées pour permettre aux jeunes pousses des plantes de s’adapter et de s’accroître au début de l’expérience.
Le matériel utilisé est un mélange de trois plantes : Typha latifolia, Phragmites australis et Arundo donax qui appartiennent à la famille des graminées. Les jeunes pousses de plantes ont été prélevées dans une zone marécageuse située à proximité de la ville de Marrakech.
Le sable utilisé pour le prétraitement provient de la plage d’El Jadida (192 km de Marrakech), il a une texture sableuse [(argile+limon : 0,03 %; sable (0,34 % sable très grossier; 17,87 % sable grossier; 66,49 % sable moyen; 13,85 % sable fin et 0,32 sable très fin)].
Le sol utilisé dans le bac à macrophytes provient du jardin de la faculté, il a une texture sableuse [(argile+limon : 2 %; sable (38,1 % sable très grossier; 16,84 % sable grossier; 23,58 % sable moyen; 11,87 % sable fin et 6,95 sable très fin)].
Le gravier utilisé a une dimension 5 mm<d<10 mm. Il a été utilisé pour éviter la compensation du sol au fond du bac qui peut causer des conditions d’asphyxie des racines par excès d’eau.
Les principales caractéristiques physico-chimiques des substrats utilisés (sable, sol) indiquent qu’ils ont un pH alcalin et une teneur élevée en matière organique et en phosphore total dans le cas du sol (Tableau 1).
Tableau 1
Caractéristiques physico-chimiques des substrats utilisés (moyenne (3) ± écart-type).
Physical-chemical characteristics of the substrates used (mean (3) ± standard deviation).
L’expérience a été menée durant une année s’étalant du mois d’août 2006 au mois de juillet 2007. Tout au long de cette période d’étude, le fonctionnement du pilote expérimental a été contrôlé par la mesure des paramètres physico-chimiques.
Les prélèvements sont effectués sur des échantillons à l’entrée du filtre à sable (margines diluées avec des eaux usées urbaines), des échantillons moyens, du volume total d’eau de percolation, à la sortie de six pots et des échantillons à la sortie du lit planté. Ces échantillons ont fait l’objet d’une mesure des MES, de la DCO totale et dissoute, des polyphénols, du pH et de la conductivité électrique.
2.1 Paramètres analysés et méthodes de dosage utilisées
2.1.1 Cas des margines
Le potentiel d’hydrogène (pH) a été mesuré par un pH-mètre type 716 DMS Titrino. La conductivité électrique (CE) a été mesurée à l’aide d’un conductivimètre de type TWT. Les matières en suspension (MES) sont déterminées par filtration sur des membranes à 0,45 µm de diamètre de pore. La teneur en MES est déterminée par différence de poids du filtre avant et après filtration et séchage à 105 °C pendant deux heures (AFNOR T 90-105) (1983). La demande chimique en oxygène (DCO) a été déterminée selon la méthode standard (APHA, 1992) par une oxydation de la matière organique contenue dans l’échantillon à 150 °C par un excès de bichromate de potassium en milieu acide et en présence de sulfate d’argent. L’excès de bichromate de potassium est dosé par colorimétrie à 620 nm. L’azote Kjeldahl (NTK) est déterminé par la minéralisation des échantillons dans l’acide sulfurique de l’azote organique en présence d’un catalyseur (K2SO4, sélénium). L’azote ammoniacal (NH4+) est dosé par la méthode colorimétrique au bleu d’indophénol, selon la norme AFNOR T90-016 (1983). Elle repose sur le fait qu’en milieu alcalin et en présence de nitropussiate de sodium, qui agit comme catalyseur, une réaction s’effectue entre les ions ammoniums, le phénol et l’hypochlorite pour donner un complexe bleu d’indophénols susceptible d’être dosé par spectrophotométrie à 630 nm. Les nitrites (NO2-) sont dosés selon la méthode AFNOR T90-013 (1983) qui est une méthode colorimétrique basée sur la diazotation des nitrites par le sulfanilamide en présence de N-naphtyléthyléne diamine. La réaction donne un complexe de couleur rose au spectrophotomètre à 537 nm. Le dosage des nitrates (NO3-) se ramène à celui des nitrites après leur réduction par passage dans une colonne de cadmium-cuivre (Rodier, 1984). Le phosphore total (PT) est mesuré après minéralisation en milieu acide et en présence de persulfate de potassium suivi d’une analyse des orthophosphates. Les orthophosphates (PO43-) sont déterminés par une mesure colorimétrique du complexe phosphomolybdique formé (AFNOR T90-023) (1983). Les polyphénols totaux ont été dosés selon la méthode élaborée par MACHEIX et al. (1990). En présence de polyphénols, le mélange d’acide phosphotungstique (H2PW12O40) et le réactif de Folin (H3PW12O40) est réduit en oxyde bleu tungstène (W8O23), la coloration présente un maximum d’absorption à 760 nm. Les résultats sont exprimés en équivalent acide catéchique utilisé dans la gamme étalon. Les fractions phénoliques des margines ont été identifiées par chromatographie liquide à haute pression (HPLC). Ces analyses ont été réalisées grâce à un détecteur UV (280 nm) et une colonne C-18 (4,6 x 250 mm). Vingt µl d’extrait ont été injectés et élués par gradient de solvant (phases mobiles : H2O+H3PO4 (0,1 %), Acétonitrile/Eau (7/3) durant 60 mn avec un débit de 0,8 mL•min‑1).
Le sodium (Na+), le potassium (K+) et le calcium (Ca2+) ont été dosés par spectrométrie à flamme (appareil type Jenway PFP7).
2.1.2 Cas des substrats (sable, sol)
Le pH est mesuré par un pH-mètre type 716 DMS Titrino selon la méthode décrite par AUBERT (1978), la conductivité électrique (CE) est mesurée à l’aide d’un conductivimètre de type TWT (AUBERT, 1978), la matière sèche totale est déterminée selon la méthode de SIERRA et al. (2001), la matière sèche fixe est déterminée par calcination à 600 °C pendant quatre heures. Le carbone organique est déterminé par la méthode d’ANNE décrite par AUBERT (1978) par oxydation dans un milieu sulfurique en présence d’un excès du bichromate de potassium, ce dernier est titré par une solution de sel de mohr en présence de diphénylamine dont la couleur passe du bleu foncé au bleu vert. L’azote Kjeldahl (NTK) est déterminé selon la méthode de Kjeldahl décrite par AUBERT (1978) et dont le principe de dosage est le même que celui cité pour la détermination de NTK des margines. L’azote ammoniacal (NH4+) est déterminé par la méthode AFNOR T90-16 (1983) sans minéralisation et l’azote nitrique (NO3-) est dosé après la distillation de l’azote ammoniacal par l’ajout d’alliage de Dewarda (AUBERT, 1978). Le phosphore total (PT) est déterminé selon AFNOR T90-023 (1983). Il consiste en une minéralisation en milieu acide, à chaud et en présence de persulfate de potassium d’une prise d’essai du sol à analyser. Les formes organiques et combinées du phosphore sont transformées en orthophosphates solubles. Les orthophosphates libérés sont dosés selon la méthode déjà décrite pour les margines (AFNOR T90-023) (1983). Le dosage des sels (chlorures, Na+, K+ et Ca2+) s’effectue sur l’extrait aqueux de la pâte saturée. Les méthodes de dosage sont décrites par AUBERT (1978) : Na+, K+ et Ca2+ s’effectue par spectrométrie de flamme, les chlorures par volumétrie.
La rétention réelle ou absolue est calculée à partir de la charge des eaux à l’entrée et à la sortie du bac selon l’équation suivante :
Charge à l’entrée (g) : concentration (g•L‑1) x volume des margines brutes apporté au bac (L).
Charge à la sortie (g) : concentration (g•L‑1) x volume restitué à la sortie du bac (L).
3. Résultats et discussion
3.1 Prétraitement des margines par le filtre à sable
3.1.1 Caractérisation physico-chimique des margines diluées
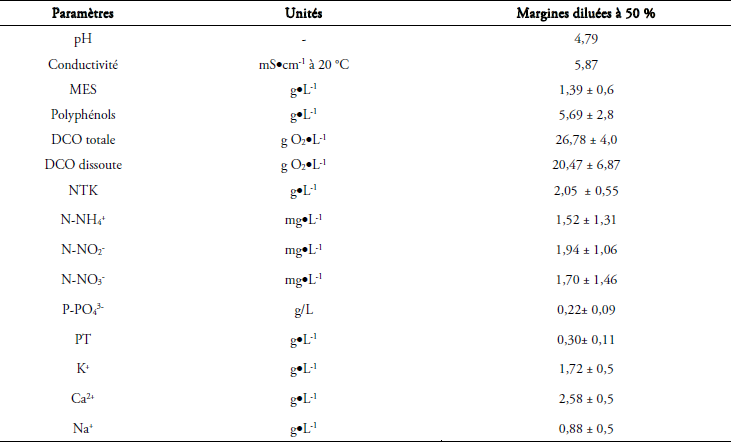
L’analyse du tableau 2 montre que les margines diluées avec les eaux usées urbaines ont un pH très acide (4,79), cette faible valeur rend le traitement biologique des margines brutes très difficile vu les conditions de développement des micro-organismes (KHOUFI et al., 2000). Ces effluents ont une teneur très élevée en MES (1,39 ± 0,6 g•L‑1) et une conductivité élevée (5,87 mS•cm‑1), conséquence de l’utilisation de salage pratiquée pour conserver les olives jusqu’à trituration. En effet, en plus de leur richesse naturelle en ions K+ (1,72 ± 0,5 g•L‑1), Ca2+ (2,58 ± 0,5 g•L‑1) et Na+ (0,88 ± 0,5 g•L‑1), l’ajout du sel commercial aux olives pour minimiser le développement des micro-organismes confère aux margines une conductivité électrique élevée. La matière polluante exprimée en matière de demande chimique en oxygène (DCO totale, DCO dissoute) et de polyphénols est de l’ordre de 26,78 ± 4,0 g•L‑1, 20,47 ± 6,87 g•L‑1 et 5,69 ± 2,8 g•L‑1 respectivement. Ces valeurs élevées montrent que les margines ont besoin d’un taux élevé en oxygène pour l’oxydation de la matière organique. La concentration des polyphénols trouvée est dans la fourchette [0,4-7,1 g•L‑1] rapportée par DI GIOVACCHINO et al. (1988) pour des margines de centrifugation.
Tableau 2
Caractéristiques physico-chimique des margines diluées (nombre d'échantillons = 51).
Physical-chemical characteristics of diluted olive mill wastewater (number of samples = 51).
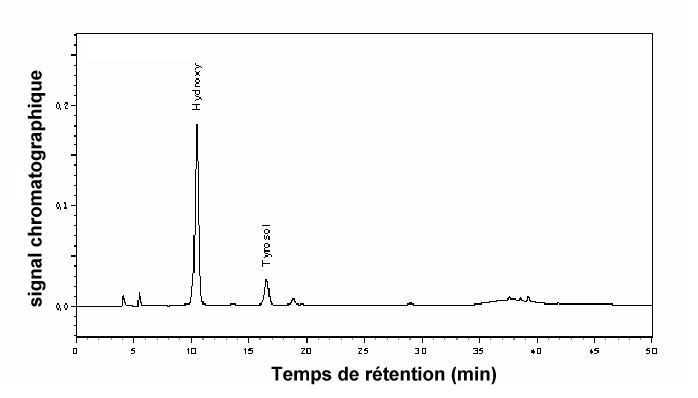
L’analyse des chromatogrammes HPLC (Figure 2) montre que les composés phénoliques majeurs présents dans les margines brutes sont l’hydroxytyrosol (0,27 g•L‑1) et le tyrosol (0,06 g•L‑1). Ceci confirme les résultats de ALLOUCHE et al. (2004) qui ont montré qu’un extrait des margines brutes est composé essentiellement de ces deux composés.
Figure 2
Analyse de HPLC de l'extrait phénolique des margines brutes.
HPLC chromatogram of the phenolic compounds from raw olive mill effluent.
Les teneurs en phosphore total et en NTK sont respectivement de 0,3 ± 0,11 g•L‑1 et 2,05 ± 0,55 g•L‑1, ces valeurs sont proches de celles rapportées par PAREDES et al. (2005). En effet, les teneurs en éléments fertilisants varient d’une compagnie oléicole à l’autre et dépendent également de l’utilisation des engrais. Ainsi, les margines représentent une source d’éléments nutritifs qui pourrait remplacer les fertilisants artificiels.
3.1.2 Pouvoir épurateur du filtre à sable
Les résultats des analyses physico-chimiques des margines brutes et prétraitées montrent que ces dernières subissent des changements après leur infiltration à travers le sable (Tableau 3).
Tableau 3
Taux d'abattement des margines brutes après prétraitement par le filtre à sable.
Percentage of abatement of raw olive mill wastewater after pre-treatment by the sand filer.
Évolution du pH : l’épuration des margines par le filtre à sable entraîne une augmentation de leur pH par trois unités, celui-ci passe de 4,79 à 7,68. La même constatation a été faite par MEKKI et al. (2007) qui ont obtenu une augmentation du pH de trois unités après épandage des margines sur un sol. L’augmentation du pH pourrait être le résultat du piégeage des acides organiques responsables du pH acide des margines, du pouvoir tampon du sable (8,75) et son aptitude à s’opposer à la variation du pH.
Évolution de la conductivité électrique : la conductivité électrique des margines représentant leur degré d’ionisation diminue significativement après leur infiltration à travers le sable étudié. Elle augmente de 5,87 à 7,36 mS•cm‑1, cette augmentation est liée au lessivage des minéraux du sable et à la minéralisation de la matière organique.
Évolution des matières en suspension : la concentration des MES passe de 1,39 ± 0,6 g•L‑1 à 0,36 ± 0,15 g•L‑1, ce qui donne un abattement très important (70 %). Cet abattement est dû principalement à des processus physiques (filtration et sédimentation) et au tamisage au niveau du massif filtrant.
Évolution de la matière organique : l’analyse de la DCO montre que la teneur en matière organique des margines diminue significativement après leur passage à travers le sable. En effet, la DCO totale passe de 26,78 ± 4,0 g•L‑1 à 5,25 ± 1,30 g•L‑1 avec un abattement de 79 % et la DCO dissoute passe de 20,47 ± 6,87 g•L‑1 à 4,88 ± 1,22 g•L‑1 avec un abattement de 76 %. Ces résultats sont proches de ceux rapportés par ZENJARI et NEJMDDINE (2001) utilisant un traitement par les microorganismes du sol.
L’élimination de la DCO totale fait intervenir des phénomènes physiques de sédimentation et de filtration de la forme particulaire, et des phénomènes biologiques de dégradation et de décomposition de la matière organique particulaire et dissoute associés à la flore bactérienne.
La forte réduction de la DCO dissoute (76 %) indique qu’une bonne assimilation bactérienne prend place dans le filtre à sable. Ceci est probablement lié à une meilleure oxygénation de ce dernier permettant aux bactéries aérobies de proliférer et d’assurer en conséquence une meilleure minéralisation ou oxydation de la matière organique.
Les composés phénoliques confèrent aux margines un pouvoir antimicrobien (RANALLI, 1991) rendant difficile leur traitement par voie biologique. Pour avoir un abattement de ces composés par un système de traitement tel que l’infiltration-percolation, nous avons pensé de diluer les margines par des eaux usées urbaines afin de réduire la toxicité de ces composés. Une réduction nette de la teneur en polyphénols a été enregistrée au cours du passage des margines par le filtre à sable. Le taux des composés phénoliques à la sortie du système atteint 0,6 ± 0,15 g•L‑1 avec un rendement épuratoire de l’ordre de 81 %. L’abattement des polyphénols dans le filtre à sable peut être expliqué par la polymérisation et/ou la bioconversion des composés monomériques (tyrosol et hydroxytyrosol) au cours du traitement (DHOUBI et al., 2006; SAYADI et ALLOUZ 1995) et par le changement du pH des margines traitées. DOMMERGUES (1971) a montré que la dégradation des composés phénoliques par les bactéries peut être accélérée par une élévation du pH et/ou une amélioration de l’aération. En effet l’augmentation du pH des margines après leur application sur le sable entraîne la transformation des phénols en phénates avec formation des ions C6H5O- (MACHEIX et al., 1990). Ces derniers sont bien retenus par les cations du sable tels que les oxydes d’aluminium et de fer, les carbonates de calcium et les silicates.
3.2 Traitement des margines par la filière complète
Les analyses du traitement des margines par la filière (filtre à sable suivi du lit planté) ont été effectuées sur :
des margines diluées à l’entrée du filtre à sable (Entrée).
des margines à la sortie du Lit Planté (Sortant LP).
3.2.1 Comportements physiologiques des plantes
Des symptômes physiologiques au niveau des plantes ont été observés :
À une dilution de 25 % on constate un dessèchement des extrémités de quelques feuilles de trois plantes.
À une dilution de 50 % on a un dessèchement total des feuilles de Typha latifolia et Phragmites australis.
À une dilution de 75 % de nouvelles jeunes pousses d’Arundo donax et de Phragmites australis sont apparues.
Les jeunes pousses de Typha latifolia n’ont commencé à pousser qu’après six mois d’irrigation.
3.2.2 Fonctionnement hydraulique du lit planté
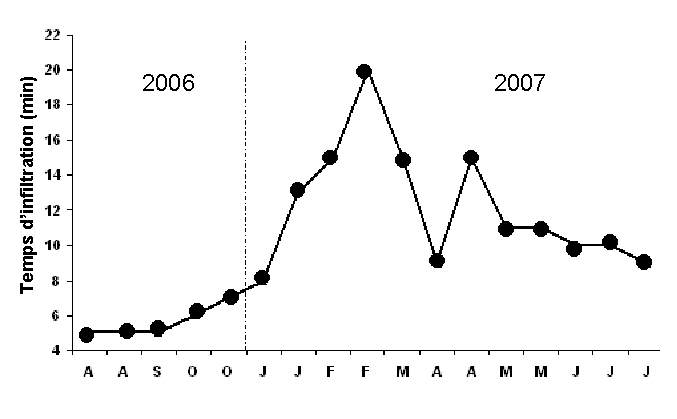
La figure 3 présente l’évolution temporelle du temps d’infiltration ou temps de séjour de la lame d’eau apportée chaque trois jours dans le lit planté durant la période d’expérimentation. Pour cette fréquence d’alimentation du système, le temps d’infiltration fluctue selon les saisons et les conditions climatiques.
Figure 3
Évolution temporelle du temps d'infiltration de la lame d'eau dans le lit planté.
Temporal changes of olive mill wastewater infiltration times in the planted system.
Le temps de séjour varie de 10 min en été au double en hiver (20 min), ceci est probablement lié aux conditions climatiques du site expérimental : à temps chaud (T° moyenne estivale varie de 24 à 30 °C), l’humidité du substrat est réduite et la viscosité de l’eau est faible au point que l’eau s’infiltre rapidement. Par contre, au temps frais et pluvieux (T° moyenne hivernale varie de 11 à 16 °C), le substrat a un taux d’humidité élevé, ce qui fait que la lame d’eau met plus de temps pour percoler. Le développement important du système racinaire et rhizomateux de trois plantes qui entraîne l’augmentation de la conductivité hydraulique du système peut aussi agir sur les variations du temps de séjour.
Au vu des résultats trouvés, aucun signe de colmatage n’a été détecté, cela peut être expliqué, d’une part, par le rôle mécanique des plantes utilisées, essentiellement les roseaux. Le développement dense des tiges de roseaux qui partent des noeuds des rhizomes (tiges souterraines) et viennent percer la couche de dépôts superficiels, crée des cheminements qui se prolongent jusqu’à l’ensemble du système racinaire, et de là à la couche drainante des filtres, évitant ainsi le colmatage. D’autre part, par l’alternance de phases d’infiltration et de dessèchement de trois jours adoptée qui permet de gérer l’aération de la zone non saturée et de minimiser le colmatage du filtre grâce à la minéralisation, pendant les phases de repos, de la matière organique accumulée. Les périodes d’assèchement permettent au sol de se ressuyer et de rétablir ainsi sa capacité d’infiltration.
3.2.3 Évolution du potentiel hydrogène : pH
L’analyse de la figure 4a montre que le pH des margines brutes à l’entrée de la filière varie entre 4,2 et 5,7. Le pH des margines traitées à la sortie de la filière augmente de deux à trois unités. Il varie entre 7 et 8,9 avec une valeur moyenne de 8,09. L’augmentation du pH à la sortie de la filière peut être expliquée par le pouvoir tampon du sol (pH = 8,45) et son aptitude à s’opposer à la variation du pH.
Figure 4
Évolution temporelle du pH (a), de la conductivité électrique (b) et des MES (c) des margines à l'entrée du filtre à sable (Entrée) et à la sortie du lit planté (sortant LP).
Temporal changes in pH (a), in conductivity (b) and in TSS (c) of the olive mill wastewater at the input to the sand filter and the output from planted system.
Les travaux de TIGLYENE et al. (2005) ont rapporté une augmentation de pH de deux à trois unités à la sortie d’un lit planté de Phragmites australis à écoulement vertical. FINLAYSON et CHIK (1983) ont obtenu une augmentation du pH seulement de 0,5 unité pour un lit de gravier à écoulement vertical planté de Typha, Phragmites et Scirpus. Par contre, TANNER et al. (1995) ont observé une légère diminution du pH qui passe de 7,2 dans les eaux usées brutes à environ 6,6 à 7 dans les eaux usées traitées par un lit de gravier de Schoenoplectus Validus à écoulement sous la surface.
3.2.4 Évolution de la conductivité électrique : CE
La conductivité électrique des margines à la sortie de la filière est constamment supérieure à celle de l’entrée de la filière (Figure 4b). Cette augmentation est plus accentuée durant mai à juillet, par contre durant la période août-septembre la différence de conductivité entre l’entrée et la sortie de la filière est faible. Ce comportement peut être expliqué par le début d’adaptation et de développement des plantes. La conductivité électrique moyenne des margines brutes est de 5,8 mS•cm‑1, celle des margines traitées par la filière est de 8,8 mS•cm‑1.
Les travaux de ABISSY et MANDI (1999), FINLAYSON et CHICK (1983) et TIGLYENE et al. (2005) ont montré une augmentation de la conductivité électrique des eaux usées traitées par des plantations de Typha, Phragmites et Roseau. Selon FINLAYSON et CHICK (1983) cette augmentation est liée au phénomène d’évapotranspiration de la végétation qui tend à concentrer d’avantage l’effluent. RANJANI et al. (1996) ont associé cette augmentation au lessivage des minéraux du sol et à la minéralisation de la matière organique. Dans notre cas, il est très probable que les trois processus combinés interviennent. RIVERA et al. (1997) ont montré qu’il n’y a aucune tendance dans le changement de la conductivité électrique. TANNER et al. (1995) ont constaté qu’il y a une réduction de la conductivité avec l’augmentation du temps de séjour des eaux usées dans un lit à gravier planté de Schoenoplectus validus.
3.2.5 Élimination de la charge organique
L’évolution au cours de la période d’étude des MES à l’entrée et à la sortie de la filière de traitement est représentée par la figure 5. Les margines brutes présentent une concentration importante en MES qui fluctue entre un minimum de 0,55 g•L‑1 et un maximum de 2 g•L‑1 avec une moyenne de 1,39 ± 0,6 g•L‑1.
La concentration en MES à la sortie de la filière est très faible en comparaison avec celle des margines brutes. Ces eaux sont donc de qualité nettement meilleure. Leur charge en MES oscille autour d’une moyenne de 0,37 ± 0,04 g•L‑1 (Figure 4c).
L’ensemble des résultats obtenus en matière de flux (rétention réelle) permet de conclure que l’élimination des MES est très importante dès le démarrage de l’expérience avec une moyenne d’abattement de l’ordre de 94 % (Tableau 4). Cette élimination peut être expliquée principalement par des processus physiques (sédimentation et filtration). Les systèmes à écoulement vertical sont alimentés en surface et l’effluent percole verticalement à travers le substrat. L’effluent subit alors une première étape de filtration permettant une rétention physique des matières en suspension à la surface. On observe ainsi une accumulation de boues qui devront être évacuées de temps en temps de lit planté.
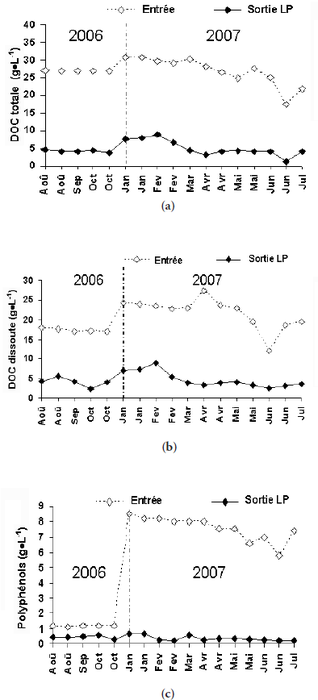
La concentration en DCO totale à l’entrée et à la sortie de la filière est représentée par la figure 5a. Les margines brutes présentent une charge importante en DCO totale qui fluctue entre un minimum de 17 g•L‑1 et un maximum de 31 g•L‑1 avec une moyenne de 27 ± 4,0 g•L‑1. À la sortie de la filière, la concentration en DCO varie de 1,06 g•L‑1 à 9 g•L‑1 avec une valeur moyenne de 8 g•L‑1.
La concentration en DCO dissoute à l’entrée et à la sortie de la filière est représentée par la figure 5b. Les margines brutes présentent une concentration importante en DCO dissoute qui fluctue entre un minimum de 17 g•L‑1 et un maximum de 27,34 g•L‑1 avec une moyenne de 20,47 ± 6,87 g•L‑1. À la sortie de la filière, la concentration en DCO varie de 2,38 g•L‑1 à 9 g•L‑1 avec une valeur moyenne de 4,55 g•L‑1.
Figure 5
Évolution temporelle de la DCO totale (a), de la DCO dissoute (b) des polyphénols (c) des margines à l'entrée du filtre à sable (Entrée) et à la sortie du lit planté (sortant LP).
Temporal changes in total COD (a), in dissolved COD (b) and in phenolic compounds (c) in the olive mill wastewater at the input to the sand filter and at the output from the planted system.
L’expression des résultats obtenus en matière de flux montre une élimination presque totale de la DCO dissoute (99,5 %) et de la DCO totale (99,7 %) (Tableau 4). Cet important abattement peut être dû à la faible quantité d’eau restituée obtenue qui est lié essentiellement à la transpiration des plantes. En conséquent, la plus grande partie des polluants organiques est retenue dans le lit planté, ce qui va diminuer la concentration des solutés dans l’effluent d’eau usée traitée. Cependant, ce processus n’explique pas le mécanisme de dégradation de ces polluants dans le système surtout avec un temps de séjour très faible (10 à 20 min) et qui ne permet jamais aux bactéries aérobies de proliférer et d’assurer une meilleure minéralisation ou oxydation de la matière organique.
La combinaison de trois différentes hélophytes est un processus qui peut jouer un rôle dans l’élimination de la DCO totale et la DCO dissoute. Ce processus peut être divisé en cinq domaines différents. La phytoextraction qui consiste à extraire du sol des polluants et de les concentrer dans les parties aériennes ou racinaires, et qui sont ensuite récoltées. La phytodégradation qui emploie ces hélophytes en association avec des micro-organismes pour dégrader les polluants organiques du sol. La rhizofiltration qui permet d’utiliser les racines des plantes pour adsorber et absorber les métaux des eaux contaminées. La phytostabilisation qui consiste à se servir des plantes afin de réduire la biodisponibilité des polluants. La phytovolatilisation, enfin, les utilise pour volatiliser les polluants (VAVASSEUR et al., 2003). Ajoutons à cela que l’épuration par les plantes provoque la perte, par évaporation, de 80 % de l’eau. Cependant, ce processus restera un facteur mineur d’abattement des polluants organiques vu le faible temps de séjour qui ne permet pas aux processus bactériens d’avoir un effet aussi complet.
Le pouvoir épurateur du sol est considéré le processus le plus probable de transformation des polluants organiques. Le sol occupe donc une position centrale dans la régulation des pollutions avec un double rôle d’épuration et de stockage des polluants. Il va pouvoir participer à leur élimination, diminuer ou retarder leurs impacts. La rétention d’une molécule organique par le sol est le résultat global d’un ensemble de phénomènes, impliquant des interactions avec les constituants organiques et minéraux des sols (BARTHESE et SZNKNECT, 2009). De même, la persistance est la résultante d’un ensemble de processus de dissipation, physico-chimique et biologique, qui font diminuer la concentration du polluant en fonction de cinétiques caractéristiques du polluant et du milieu (BARTHESE et SZNKNECT 2009).
3.2.6 Élimination des composés phénoliques
La figure 5c montre l’évolution temporelle des polyphénols à l’entrée et à la sortie de la filière. La concentration en polyphénols des margines brutes fluctue énormément entre un minimum de 1,19 g•L‑1 et un maximum de 8,5 g•L‑1. Celle à la sortie du lit planté est relativement constante et oscille autour d’une moyenne de 0,4 g•L‑1.
L’élimination moyenne des polyphénols est très importante, elle est de l’ordre de 95 % (Tableau 4). L’élimination des composés phénoliques par la filière subit l’action des processus similaires d’élimination des polluants. Ces processus incluent la dégradation bactérienne aérobie et anaérobie, l’adsorption par la végétation, la volatilisation ainsi que le stockage dans le sol.
Tableau 4
Rétention réelle des MES, de la DCO totale et dissoute et des polyphénols de la filière (août 2006-juillet 2007).
Evolution of removal yield of TSS, total COD, dissolved COD and phenolic compounds of the system (August 2006 - July 2007).
Des travaux conduits par O’KEEFFE et al. (1982) et MILLER et O’KEEFFE (1983) ont montré que les plantes aquatiques ont la capacité d’adsorber, de transférer et de métaboliser plusieurs types de composés phénoliques. Selon OUESLATI et al. (1998), la dégradation des composés phénoliques pourrait être expliquée par la superposition de trois processus. Le premier est dû à l’intervention de l’oxygène de l’air. Le deuxième mécanisme est la métabolisation ou/et l’évaporation des phénols par la plante. Le troisième processus est dû à l’apport supplémentaire d’oxygène des racines. Les mécanismes de diffusion de l’oxygène par les racines ont été décrits par plusieurs auteurs. BRIX (1993) a montré que certaines espèces (Eichhornia crassipes et Pistia stratiotes) peuvent libérer par leurs racines des quantités notables d’oxygène. Les études préliminaires faites par ROY et HANNINEN (1994) ont montré que les racines de Eichhornia crassipes jouent un rôle très important dans l’élimination des phénols. Les oxydases phénoliques provenues des cellules racinaires peuvent oxyder les phénols en d’autres composés phénoliques. En plus, l’utilisation d’une mixture de trois différentes plantes avec une densité de 8 plants•m‑2 pour chaque plante favorise beaucoup mieux le phénomène de dégradation des polyphénols. D‘après Brix (1996), les tiges et les feuilles des macrophytes qui plongent dans la couche d’eau libre fournissent une immense surface pour la formation de biofilms. En effet, les tissus de ces plantes sont colonisés par de nombreuses communautés de bactéries et de protozoaires. De plus, les racines et les rhizomes qui sont enfouis dans le sol fournissent un substrat pour la croissance des micro-organismes.
D’autres auteurs ont attribué la dégradation des phénols à une métabolisation dans le tissu végétal de la plante pour synthétiser des acides aminés et des peptides accompagnée d’une évaporation partielle (SIEDEL et al., 1967a et 1967b). MULLER (1992) a expliqué cette dégradation par la rupture des positions ortho et méta qui conduit à des molécules plus simples lors des opérations d’oxydation.
4. Conclusion
La présente étude a été réalisée dans le but de tester l’élimination de la matière organique des margines diluées avec des eaux usées urbaines par la combinaison d’un filtre à sable et un lit planté.
L’analyse physico-chimique des margines étudiées montre qu’il s’agit d’un effluent très acide (pH = 4,79), fortement chargé en matière de DCO totale (26,78 g•L‑1), DCO dissoute (20,47 g•L‑1) et en polyphénols (5,69 g•L‑1). L’analyse des chromatogrammes HPLC montre que les composés phénoliques majeurs présents dans les margines sont l’hydroxytyrosol (0,27 g•L‑1) et le tyrosol (0,06 g•L‑1).
Le prétraitement des margines par le filtre à sable a assuré une augmentation du pH par trois unités suite au pouvoir tampon du sable et son pouvoir à s’opposer à la variation du pH. Une élimination importante des matières en suspension et de la charge organique (MES : 70 %; DCO totale : 79 %; DCO dissoute : 76 %; polyphénols : 81 %). L’élimination de la DCO indique qu’une bonne assimilation bactérienne prend place dans le filtre à sable. L’abattement des polyphénols est expliqué par la polymérisation et/ou la bioconversion de tyrosol et de l’hydroxytyrosol.
Le traitement par la combinaison d’un filtre à sable et un lit planté a assuré une élimination importante de la charge organique. Il fournit des eaux épurées avec une charge organique réduite par rapport à celle des eaux usées brutes malgré le temps de séjour très court. L’élimination des MES par le système est de l’ordre de 94 %, l’abattement des polyphénols est toujours supérieur à 80 % dès le démarrage de l’expérience. Dans le cas de l’élimination de la DCO, la combinaison de deux systèmes a montré une importance majeure dans la dégradation de la matière organique. En effet, l’abattement de la DCO totale et dissoute est de l’ordre 99,7 % et 99,5 % respectivement. Cet important abattement est assuré en premier lieu par une évapotranspiration des plantes aquatiques étudiées et par une dégradation des polluants organiques à l’aide des micro-organismes des sols. La matière organique dégradée est transformée en nourriture mise progressivement à la disposition des plantes.
Les résultats obtenus dans cette étude permettent de confirmer la performance épuratoire de la combinaison d’un filtre à sable et un lit planté à traiter les rejets de l’industrie oléicole (margines). En effet, l’alimentation par intermittence adoptée au système assure une meilleure aération du sol. En conséquence, l’utilisation d’un substrat de nature grossière (97 % sable) en présence des hélophytes réduit le risque de colmatage. La combinaison de deux systèmes pourrait être utilisée pour l’abattement de la matière organique et des polyphénols qui connaissent un abattement très important pendant toute la période de l’expérimentation.
Parties annexes
Remerciements
Ce travail a été réalisé dans le cadre des projets de recherche : PROTARS II contrat N° 21/34, 2005-2010. MEDINDUS contract INCO-CT-2004, 509159. et a bénificié du soutien du Pôle de compétences Eau et Environnement (PC2E).
Références bibliographiques
- ABISSY M. (2000). Potentialités des plantes hélophytiques dans le traitement des eaux usées et possibilité de valorisation agricole des eaux épurées sous climat aride. Thèse de doctorat, Université Cadi Ayyad, Faculté des sciences Semlalia, Marrakech, Maroc, 200 p.
- ABISSY M. et L. MANDI (1999). Comparative study of wastewater purification efficiencies of two emergent helophytes: Typha latifolia and Juncus subulatus under arid climate. Water Sci. Technol., 39, 123-126.
- ACHAK M., N. OUAZZANI, A. YAACOUBI et L. MANDI (2008). Caractérisation des margines issues d’une huilerie moderne et essais de leur traitement par coagulation-floculation par la chaux et le sulfate d’aluminium. Rev. Sci. Eau, 21, 53-57.
- ACHAK M., A. HAFIDI, N. OUAZZANI, S. SAYADI et L. MANDI (2009a). Low cost bio-sorbent “banana peel” for the removal of phenolic compounds from olive mill wastewater: kinetic and equilibrium studies. J. Hazardous Mater., 166, 117–125.
- ACHAK M., N, OUAZZANI, L. MANDI (2009b). Traitement des margines d’une huilerie moderne par infiltration-percolation sur un filtre à sable. Rev. Sci. Eau, 22, 421-433.
- AFNOR (1983). Recueil de normes françaises : eau, méthodes d’essai, 2e édition, Paris, 624 p.
- AIT BADDI G., M. HAFIDI, V. GILARD, P. RAMOS et H. HAMDI (2004). Characterization of fulvic acids by elemental and spectroscopic (FTIR and 13C-NMR) analyses during composting of olive mill wastes plus straw. Bioresour. Technol., 93, 285-290.
- ALLOUCHE N., I. FKI et S. SAYADI (2004). Toward a high yield recovery of antioxidants and purified hydroxytyrosol from olive mill wastewaters, J. Agric. Food Chem., 52, 267-273.
- AL-MALLAH K., M.O.J. AZZAM et N.I. ABU-LAILM (2000). Olive mill effluent (OME) wastewater post-treatment using actived clay. Sep. Pur. Technol., 20, 225-234.
- APHA (1992). American Public Health Association 1992. Standard methods for analysis of waste and waste water. APHA Pub., Washington, DC.
- AUBERT G. (1978). Méthodes d’analyse des sols. Éditions C.R.D.P., Marseille, 360 p.
- BARTHESE V. et S. SZENKNECT (2009). Les méthodes de traçage pour étudier la migration des polluants dans les sols industriels. CLEFS CEA, 57, 61-65.
- BIDDLESTONE A.J., K.R. GRAY et G.D. JOB (1991). Treatment of dairy farm wastewater in engineered reed systems. Proc. Biochem., 26, 265-268.
- BOUTIN C., A. LIENRD et D. ESSER (1996). Development of a new generation of reed-bed filters in France: First-results. Dans : Proceedings of 5th International Conference on Wetlands Systems for Water Pollution Control, vol. 2, Vienne, Autriche, 15-19 septembre, 8 p.
- BRIX H. (1993). Macrophyte-mediated oxygen transfer in wetlands: Transport mechanisms and rates. Reprint from constructed wetlands far water quality improvement, G.A. Moshiri (éditeur), Lewis Publishers. Boca Raton, Ann Arbor, London, Tokyo.
- BRIX H., B.K. SORRELL et H.H. SCHIERUP (1996). Gas fluxes achieved by in situ convective flow in Phragmites australis. Aquat. Bot., 54, 151-163.
- CAMURATI F., A. LANZANI, A. ARPINO, C. RUFFO et E. FEDELI (1984). Le acque di vegetazione della lavorazione delle olive: tecnologie ed economie di recupero di sottoprodotti. Riv. Ital. Sostanze Grasse, 61, 283- 292.
- CIRIA M.P., M.L. SOLANO et P. SORIANO (2005). Role of macrophyte Typha latifolia in a constructed wetland for wastewater treatment and assessment of its potential as a biomass fuel. Biosys. Eng., 92, 535–544.
- DHOUBI A., F. ALOUI, N. HAMAD et S. SAYADI (2006). Pilot-plant treatment of olive mill waterwaters by Phanerochaete chrysosporium coupled to anaerobic digestion and ultrafiltration. Proc. Biochem., 41, 159-167.
- DI GIACOMO G., V. BRANDANI et G. DELRE (1991). Evaporation of olive oil mill vegetation waters. Desalination, 81, 249-59.
- DI GIOVACCHINO L., A. MASCOLO et L. SEGUETTI (1988). Sulle caracteristiche telle delle acque di vegetazione delle olive. Riv. Ital. Sostanze Grasse, LXV, 71-587.
- DOMMERGUES Y. (1971). Interrelations sans caractères symbiotique entre la végétation et la microflore du sol : « l’effet litière » la vie dans les sols : aspects nouveaux, études expérimentales. Gauthier-Villars (éditeur), Paris, 423-471.
- DPV/MADRPM (1998). Commercialisation et transformation des olives. Division des projets de Mise en Valeur et de l’Industrie Agricole. Direction de la Production 29 Végétale. Effect of waste waters from olive oil extraction plants of the bacterial of soil. Chemosphere, 15, 659-664.
- DPV/MAEE (1999/2000). Dans : Matin du Sahara et du Maghreb. Direction de la Production Végétale, Ministère de l’Agriculture, de l’Équipement et de l’Environnement, Département de l’Agriculture.
- FINLAYSON C.M. et A.J. CHICK (1983). Testing the potential of aquatic plants to treat abattoir effluent. Water Res., 17, 415-422.
- FLOURI F., D. SOTIRCHOS, S. IOANNIDOU et C. BALIS (1996). Decolorization of olive oil mill liquid wastes by chemical and biological means. Int. Biodeter. Biodegrad., 38, 189-192.
- GALLI E., L. PASSETI, F. FIORELLI et U. TOMATI (1997). Olive-mill waste water composting. Microbiological aspect. Waste Manage. Res., 15, 323-330.
- GESBERG R.M., B.V. ELKINS, S.R. LYON et C.R. GOLDMAN (1986). Role of aquatic plants in wastewater treatment by artificial wetlands. Water Res., 20, 363-368.
- HADAD H.R., M.A. MAINE et C.A. BONETTO (2006). Macrophyte growth in a pilot-scale constructed wetland for industrial wastewater treatment. Chemosphere, 63, 1744-1753.
- IOM (2003/2004). Industrie oléicole au Maroc et son impact sur l’environnement : Propositions d’actions de lutte contre la pollution générée par les huileries d’olives, cas de la province de Taounate, Maroc, 14 p.
- KHOUFI S., F. ALOUI et S. SAYADI (2000). Anaerobic digestion of olive mill wastewater after Ca(OH)2 pretreatment and reuse adapted. Dans : Proceedings of the International Conference on Wastewater Treatment and Reuse Adapted to Mediterranean Area (WATRAMA), 85-89.
- MACHEIX J.J., A. FLAURIET et J.A. BILLOT (1990). Fruit phenolics. CRC Press Inc., Boca Raton, FL, USA, 378 p.
- MANDI L., J. DARLEY, J. BARBE et B. BALEUX (1992). Essais d’épuration des eaux usées de Marrakech par le Jacinthe d’eau (charge organique, bactérienne et parasitologique). Rev. Sci. Eau, 5, 313-333.
- MANDI L., N. OUAZZANI, K. BOUHOUM et A. BOUSSAID (1993). Wastewater treatment by stabilisation ponds with and without macrophytes under arid climate. Water Sci. Technol., 28, 177-181.
- MANDI L., K. BOUHOUM, S. ASMAMA et J. SCHWARTZBORD (1996). Wastewater treatment by reed-beds: an experimental approach, Water Res., 30, 2009-2016.
- MANDI L., K. BOUHOUM et N. OUAZZANI (1998). Application of constructed wetlands for domestic wastewater treatment in an arid alimate. Water Sci. Technol., 38, 429-434.
- MEKKI A., A. DHOUIB et S. SAYADI (2007). Polyphénols dynamics and phytotoxicity in a soil amended by olive mill wastewaters. J. Environ. Manage., 84, 134-140.
- MILLER T.W. et D.H. O’KEEFFE (1983). Fate of phenols in water-uptake and metabolism by the water hyacinth. Dans : Monsanto Environmental Health. Meeting September, St. Louis, MO., U.S.A.
- MULLER R. (1992). Bacterial degradation of xenobiotics. Dans : Microbial Control of Pollution, Society for General Microbiology, symposium 48, J.C. fryet al. (Éditeurs.), pp. 35-57.
- NEFZAOUI A. (1987). Contribution à la rentabilité de l’oléiculture par la valorisation optimale des sous-produits. Dans : Séminaire sur l’Économie de l’Olivier. Tunis, 20-22 janvier. Science et Technique, Olivae N° 19.
- O’KEEFFE D.H., S.R. BRUMMET et T.W. MILLER (1982). Aquatic fate of phenols-uptake and metabolism by the water hyacinth. Dans : 3rd Annual Meeting, Society of Environmental Technology and Chemistry, 14-17 novembre 1982, Arlington, VA, USA.
- OUAZZANI N. (1998). Traitement extensif des eaux usées sous climat aride en vue d’une réutilisation en agriculture. Thèse de doctorat, Faculté des Sciences Semlalia, Université Cadi Ayyad, Marrakech, 223 p.
- OUESLATI M.A., M. HADDAD et G. BLAKE (1998). Élimination du phénol par deux plantes aquatiques : Juncus fontanesii (Gay) et Lemna minor L. Rev. Sci. Eau, 4, 555-568.
- PAREDES C., J. CEGARRAB, M.P. BERNALB et A. ROIGB (2005). Influence of olive mill wastewater in composting and impact of the compost on a Swiss chard crop and soil properties. Environ. Int., 31, 305-312.
- PAREDES C., A. ROIG, M.P. BERNAL, M.A. SANCHEZ MONEDERO et J. CEGARRA (2000). Evolution of organic matter and nitrogen during co-composting of olive mill wastewater with solid organic wastes. Biol. Fertil. Soils, 32, 222-227.
- RADOUX M. et D. KEMP (1988). Épuration comparée des eaux usées domestiques par trois plantations hélophytiques et par un lagunage à microphytes sous un même climat tempéré. Acta Oecologia Applic., 9, 25-38.
- RADOUX M. et D. KEMP (1992). Rôle de la fréquence des prélèvements de la biomasse produite sur les capacités épuratrices de Lemna minor L. Rev. Sci. Eau, 5, 55-66.
- RANALLI A. (1991). L’effluent des huileries d’olive : Propositions en vue de son épuration. Références aux normes italiennes en la matière. Première partie. Olivae, 37, 30-39.
- RANJANI K ., C.H. KNEIDINGER, R. RIOS, N. SALINAS, G. SOTO et C. DURAN-DE-BAZUA (1996). Treatment of maize processing industry wastewater by constructed wetlands. Dans : Proceedings of 5th International Conference on Wetlands Systems for Water Pollution Control, vol. 1, Vienne, Autriche, 15-19 septembre, 9 p.
- REETA D., A. SOOKNAH et C. WILKIE (2004). Nutrient removal by floating aquatic macrophytes cultured in anaerobically digested flushed dairy manure wastewater. Ecol. Eng., 22, 27–42.
- RIVERA F., A. WARREN, C.R. CURDS, E. ROBLES, A. GUTIERREZ, E. GALLEGOS et A. CALDERON (1997). The application of the root zone method for the treatment and reuse of high strength abattoir waste in Mexico. Water Sci. Technol., 35, 271-278.
- RODIER J. (1984). L’analyse de l’eau : eaux naturelles, eaux résiduaires, eau de mer. 7e édition, DUNOD, BORDAS (Éditeurs), Paris, 1365 p.
- ROY S. et O.HANNINEN (1994). Pentachlorophenol: uptake/elimination kinetics and metabolism in an aquatic plant, Eichhornia crassipes. Environ. Toxicol. Chem., 13, 763-773.
- SAADI I., Y. LAORY, M. RAVIV et S. MEDINA (2007). Land spreading of olive mill wastewater: Effect on soil microbial activity and potential phytotoxicity, Chemosphere, 66, 75-83.
- SANTI C.A., S. CORTES, L.P. D’ACQUI, E. SPARVOLI et B. PUSHPARAJ (2008). Reduction of organic pollutants in olive mill wastewater by using different mineral substrates as adsorbents. Bioresour. Technol., 99, 1945-1951.
- SAYADI S., N. ALLOUCHE, M. JAOUA et F. ALOUI (2000). Detrimental effects of high molecularmass polyphenols on olive mill wastewater biotreatment. Proc. Biochem., 35, 725-735.
- SAYADI S. et R. ELLOUZ (1995). Roles of lignin peroxidise and manganese peroxidise from Phanerochaete chrysosporium in the decolorization of olive mill wastewaters. Appl. Environ. Microbiol., 61, 1098-1103.
- SIEDEL K., F. SCHEFFER, R. KICKUTH et E. SCHLIMME (1967a). Mixotrophie bei Scirpus lacustris. L. Naturwissenschaften, 54, p 176.
- SIEDEL K., F. SCHEFFER, R. KICKUTH et E. SCHLIMME (1967b). Aufnahme und umwandlung organicher stoffe durch die flechtbinse. Gas Wasserfach, 6, 138-139.
- SIERRA J., E. MARTI, G. MONTSERRAT, R. CRUANAS et A. GARAU M (2001). Characterisation and evolution of a soil affected by olive oil mill wastewater disposal. Sci. Total Environ., 279, 207-214.
- TANNER C.C., J.S. CLAYTON et M.P. UPSDELL (1995). Effect of loading rate and planting on treatment of dairy farm wastewater in constructed wetlands. I. Removal of oxygen demand, suspended solids and faecal coliforms. Water Res., 29, 17-26.
- TIGLYENE S., L. MANDI et A. JAOUAD (2005). Enlèvement du chrome par infiltration verticale sur lits de Phragmites australis (Cav.) Steudel. Rev. Sci. Eau, 18, 177-198.
- VAVASSEUR A., PELTIER G. et J. BOURGUIGNON (2003). Biodépollution, bioremediation des plantes pour nettoyer les sols et les eaux. Dir. Sci. Vivant CLEFS CEA, 48, 85-88.
- VITOLO S., L. PETARCA et B. BRESCI (1999). Treatment of olive oil industry wastes, Bioresour. Technol., 67, 129-137.
- ZENJARI B., H. EL HAJJOUJI, G. AIT BADDI, J.R. BAILLY, J.C. REVEL, A. NEJMEDDINE et M. HAFIDI (2006). Reduction of toxic compounds during the composting of olive mill wastewater straw mixture. J. Hazardous Mater., A138, 433-437.
- ZENJARI B. et A. NEJMEDDINE (2001). Impact of spreading olive mill wastewater on soil characteristics: laboratory experiments. Agronomy, 21, 749-755.
Liste des figures
Figure 1
Dispositif expérimental.
Experimental design.
Figure 2
Analyse de HPLC de l'extrait phénolique des margines brutes.
HPLC chromatogram of the phenolic compounds from raw olive mill effluent.
Figure 3
Évolution temporelle du temps d'infiltration de la lame d'eau dans le lit planté.
Temporal changes of olive mill wastewater infiltration times in the planted system.
Figure 4
Évolution temporelle du pH (a), de la conductivité électrique (b) et des MES (c) des margines à l'entrée du filtre à sable (Entrée) et à la sortie du lit planté (sortant LP).
Temporal changes in pH (a), in conductivity (b) and in TSS (c) of the olive mill wastewater at the input to the sand filter and the output from planted system.
Figure 5
Évolution temporelle de la DCO totale (a), de la DCO dissoute (b) des polyphénols (c) des margines à l'entrée du filtre à sable (Entrée) et à la sortie du lit planté (sortant LP).
Temporal changes in total COD (a), in dissolved COD (b) and in phenolic compounds (c) in the olive mill wastewater at the input to the sand filter and at the output from the planted system.
Liste des tableaux
Tableau 1
Caractéristiques physico-chimiques des substrats utilisés (moyenne (3) ± écart-type).
Physical-chemical characteristics of the substrates used (mean (3) ± standard deviation).
Tableau 2
Caractéristiques physico-chimique des margines diluées (nombre d'échantillons = 51).
Physical-chemical characteristics of diluted olive mill wastewater (number of samples = 51).
Tableau 3
Taux d'abattement des margines brutes après prétraitement par le filtre à sable.
Percentage of abatement of raw olive mill wastewater after pre-treatment by the sand filer.
Tableau 4
Rétention réelle des MES, de la DCO totale et dissoute et des polyphénols de la filière (août 2006-juillet 2007).
Evolution of removal yield of TSS, total COD, dissolved COD and phenolic compounds of the system (August 2006 - July 2007).