Résumés
Résumé
L’évaluation globale des résultats d’analyses physico-chimiques de certaines sources d’eaux d’alimentation, situées dans le bassin versant de l’oued Nil dans la ville de Jijel, met en évidence un profil de concentration du plomb et du cadmium qui dépasse de loin les normes requises. Dans l’objectif d’étudier les effets sous-jacents de la concentration la plus élevée détectée de ces deux métaux sur les biomarqueurs du stress oxydant, quatre lots de rats mâles adultes ont été exposés, via l’eau de boisson, à des concentrations ×0, ×1, ×10 et ×100 les concentrations environnementales du plomb et du cadmium, détectées dans les échantillons de l’eau analysée, pendant quatre semaines. L’évaluation toxicologique a montré une réponse biochimique caractérisée par une augmentation hautement significative des taux cytosoliques et mitochondriaux de la superoxyde dismutase chez les rats exposés aux concentrations ×10 et ×100 du mélange plomb-cadmium par rapport aux rats exposés à la concentration ×0. Les résultats de notre étude indiquent une diminution très significative de l’activité de la catalase dans les cytosols et les mitochondries pour le niveau d’exposition ×1 et hautement significative pour les niveaux d’exposition ×10 et ×100. La diminution du glutathion réduit dans les cytosols pour les niveaux d’exposition ×10 et ×100 traduit l’altération des mécanismes des défenses non enzymatiques. Une atteinte très sévère des membranes biologiques dans les mitochondries et les cytosols est objectivée par une augmentation des taux du malondialdéhyde pour tous les niveaux d’exposition de ×1 à ×100.
Mots-clés :
- Oued Nil,
- plomb,
- cadmium,
- eaux d’alimentation,
- stress oxydant
Abstract
Physico-chemical analyses of water collected in the Nile wadi catchment in the city of Jigel, Algeria, revealed concentrations of cadmium and lead that far exceeded drinking water standards. To study the effects of the highest detected concentration on oxidative stress biomarkers, drinking water containing a mixture of lead and cadmium at the concentrations detected in the field (and at concentrations 10x and 100x higher) was given to four groups of adult male rats over a period of four weeks. The toxicological evaluation showed a biochemical response characterized by a highly significant increase in the cytosolic and mitochondrial concentrations of superoxide dismutase, a very significant decrease in cytosolic and mitochondrial catalase, a highly significant decrease in the levels of cytosolic reduced glutathion (reflecting a deterioration of non-enzymatic mechanisms of defence against oxidative stress), and a significant increase in cytosolic and mitochondrial concentrations of malondialdehyde (suggesting a severe attack on the biological membranes of the mitochondria and other organelles).
Keywords:
- Nile wadi basin,
- lead,
- cadmium,
- drinking water,
- oxidative stress
Corps de l’article
1. Introduction
La contamination des milieux aquatiques par les métaux est une préoccupation environnementale majeure qui suscite un grand intérêt ces dernières années et préoccupe toutes les régions soucieuses de maintenir leur patrimoine hydrique à un haut degré de qualité (ZHANG et al., 1999). Les métaux sont naturellement présents à l’état de trace dans les eaux naturelles, mais avec l’avènement de l’ère industrielle, les activités humaines sont devenues une source importante d’émission des métaux les concentrant dans l’air, l’eau et les sols (JADHAV et al., 2007). Les métaux représentent des risques de contamination de la faune et de la flore provoquée par leur persistance dans l’environnement et leur capacité à s’accumuler dans le biote. Le cadmium et le plomb sont deux métaux non essentiels, extrêmement toxiques, largement distribués dans l’environnement et l’exposition à ces deux éléments est encore un problème majeur de santé publique. Ils font partie des trois métaux classés comme polluants prioritaires de l’eau par la Communauté Économique Européenne (CEE) et l’Organisation Mondiale de la Santé (OMS) (HARTE et al., 1991). Une attention toute particulière est actuellement portée à la contamination des sources d’eaux par ces deux métaux. Les analyses physico-chimiques de l’eau peuvent révéler les concentrations des métaux dans l’eau, mais sont insuffisantes pour évaluer la toxicité de ces concentrations sur les organismes et l’impact sur l’environnement. L’utilisation des marqueurs du stress oxydant pour l’évaluation des risques de cette contamination est une approche importante en toxicologie (LAGADIC, 1999). Afin d’élucider les effets de la pollution métallique sur les organismes vivants, l’étude des biomarqueurs cellulaires et physiologiques a attiré beaucoup d’intérêt et représente actuellement une nouvelle approche largement utilisée (LAGADIC, 1999). Le principe sous-jacent de cette approche est l’analyse de la réponse biochimique et physiologique à un toxique au niveau subcellulaire, avant qu’il soit apparent à des niveaux d’organisation biologique plus élevés (REES, 1993). Les effets sur les marqueurs cellulaires du stress oxydant se traduisent par la génération des espèces réactives de l’oxygène (ROS) qui seraient responsables à leur tour d’apoptose et de mutation génique (JORIS, 2005; VALCO et al., 2006). Certaines études (STOHS et BAGHI, 1995; TOPPI et GABBRIELI,1999) ont fait remarquer l’implication des métaux dans la genèse des ROS responsables de dommages oxydatifs. Ces changements pourraient présenter un grand risque pour la reproduction et la survie des organismes exposés (FATIH FIDAN et al., 2008).
Le bassin versant de l’oued Nil est situé au sud de la ville de Jijel (nord-est de l’Algérie), est drainé par l’oued Nil et ses effluents et a une grande importance pour l’approvisionnement en eau d’irrigation et en eau de boisson pour les populations de cette ville. Il existe de nombreux forages et puits à usage collectif creusés à différents points de ce bassin, situé à proximité d’une zone de forte activité urbaine, agricole et d’anciennes activités minières. Dans la présente étude, le premier objectif vise à constater l’état de contamination de certaines sources d’eaux de boisson situées dans le bassin versant de l’oued Nil par le plomb et le cadmium et d’évaluer, dans le deuxième objectif, l’état d’oxydation des mitochondries et des cytosols hépatiques de rats exposés par le biais de l’eau de boisson aux concentrations environnementales détectées du mélange plomb et cadmium pendant une période de quatre semaines. Ainsi, le taux du malondialdéhyde (MDA), la concentration du glutathion réduit (GSH) et le statut de deux enzymes antioxydants (la superoxyde dismutase (SOD) et la catalase (CAT)) ont été étudiés.
2. Matériel et méthodes
2.1 Zone d’étude
Le bassin versant de l’oued Nil fait partie des zones humides de la wilaya de Jijel (dans l’est algérien) et s’étend à une vingtaine de kilomètres au sud-est de la ville (Figure 1). Il occupe une superficie de 268 km2, subdivisée en deux sous-bassins versants de 148 km2 et de 120 km2. Ce bassin est drainé par l’oued Nil et ses deux effluents, l’oued Boukhara et Sayoud. Avec un débit annuel de 230 millions de mètres cubes à l’embouchure, l’oued Nil est un des oueds les plus importants de la région de Jijel (LEHTIHET, 1983). Ce bassin bénéficie d’un climat tempéré avec un hiver doux de forte pluviométrie, caractéristique des zones méditerranéennes.
Figure 1
La wilaya de Jijel, d’après le Bureau National d’Études pour le Développement Rural (2005)
The wilaya of Jijel, according to the National Office of Studies for Rural Development (2005)
Deux régions de ce bassin ont été retenues dans la présente étude. Une région en aval du bassin, Rhedjla, région agricole entièrement maraîchère, caractérisée par un marécage résultant de l’écoulement de l’oued de Tacift fortement pollué. Plusieurs puits à usage collectif, pour l’irrigation ainsi que pour l’alimentation en eau de boisson, sont creusés à différents points de cette région. Le deuxième site retenu, la plaine de l’oued Nil, se situe en amont de Rhedjla, siège d’une activité agricole massive et de plusieurs forages alimentant la ville en eau de boisson. Plusieurs puits et eaux de sources, dans cette plaine, sont fortement exploités par les populations de cette ville.
2.1.1 Échantillonnage
Quatre stations, dans le bassin versant de l’oued Nil, ont été sélectionnées pour évaluer la qualité de l’eau de boisson consommée par la population de la ville de Jijel. Trois échantillons ont été prélevés, le 7 avril 2007, à partir de forages (ON34) (S1) et de l’eau de source de Bachelot (S2), situés dans la plaine de l’oued Nil et de deux puits à usage collectif fortement exploités (S3 et S4), situés dans la région de Rhedjla. Les échantillons sont collectés dans des flacons en verre de 250 mL ayant subi, au préalable, un nettoyage minutieux suivant la méthode ultra-propre décrite par QUÉMERAIS et COSSA (1997). Les flacons ont été transportés au laboratoire, dans une glacière portable et réfrigérée (à 4 °C). Tous les échantillons sont acidifiés par 2 mL d’acide nitrique (HNO3 65 %) pour 100 mL d’eau à analyser, afin de ramener le pH de l’échantillon inférieur à deux. Après acidification, tous les échantillons sont filtrés au travers de membranes filtrantes Whatman 0,45 µm avec un appareillage de filtration en verre (filtration sous vide). Les filtrats ont été récupérés dans des flacons propres et conservés à 4 °C avant analyse.
2.1.2 Prétraitement des échantillons
Les échantillons d’eau destinés aux dosages du plomb et du cadmium par absorption atomique avec flamme (FSAA) sont prétraités suivant la méthode ISO 82 88 – 1986 CE qui consiste à concentrer les métaux en solution aqueuse. Pour chaque 100 mL d’eau à analyser, 5 mL d’acide chlorhydrique ont été ajoutés. Le mélange est évaporé avec un évaporateur rotatif (Evaporator E100, Hei dolph) sans le porter à ébullition jusqu’à un volume de 15 à 20 mL. Après refroidissement, la solution est filtrée et le volume final est ajusté à 100 mL avec de l’eau distillée.
2.1.3 Méthodes d’analyse
Le dosage de la fraction totale du cadmium et du plomb contenu dans nos échantillons a été réalisé par l’absorption atomique avec flamme (FAAS) à l’aide d’un spectromètre atomique SAA6200. Une lampe à cathode creuse spécifique pour chaque métal a été utilisée avec un étalonnage externe. Pour chaque métal, des solutions standards à 1 000 mg•L-1 de cadmium et de plomb ont été diluées pour établir les droites de calibrations. Les gammes de concentrations choisies correspondent aux concentrations les plus couramment rencontrées dans les échantillons d’eau de boisson. Ces standards ont été préparés de façon identique aux échantillons et des blancs analytiques sont systématiquement passés au début de chaque mesure.
2.2 Analyse des marqueurs du stress oxydant
2.2.1 Traitement des animaux
Le modèle animal choisi est le rat albinos Wistar, provenant de l’institut Pasteur d’Alger (Algérie). Les animaux sont répartis en quatre lots de huit rats chacun, avec nourriture (croquettes : UAR) et eau à volonté, pesant environ 200 à 220 g au début de traitement. Ils sont pesés en moyenne une fois par semaine et le volume d’eau consommé est mesuré chaque jour. L’ensemble des animaux est acclimaté pendant deux semaines aux conditions d’hébergement, avec un entretien deux fois par semaine. L’animalerie est maintenue à une température ambiante (22-25 °C), une hygrométrie de 60 % et un cycle jour nuit 12h-12h.
Les animaux sont coexposés à des concentrations de 0, 1, 10 et 100 fois les concentrations environnementales les plus élevées en chlorure de cadmium et en nitrate de plomb pendant quatre semaines. Les rats d’expérimentation ont bu environ 30 mL d’eau par jour, l’équivalent environ de 1,05 µL du chlorure de cadmium et 3,45 µL du nitrate de plomb par jour ×0, ×1, ×10 et ×100. Les animaux ont été sacrifiés par décapitation.
2.2.2 Isolement des mitochondries de foie
Après le sacrifice, les foies ont été immédiatement prélevés et plongés dans un tampon d’isolement TSE (250 mM sucrose, 50 mM tris, 5 mM EGTA (Ethylene Glycol bis(-aminoethyl ether)-N,N,N’,N’-Tetraacetic Acid), pH 7,2 à 4 °C). Pour chaque foie, 10 g ont été découpés, abondamment lavés avec le TSE et broyés dans un broyeur de DOUNCE (KONTES Glass company, New Jersey USA) avec 30 mL de TSE. Les homogénats ont été centrifugés à 1 770 rpm pendant 10 minutes à 4 °C par une centrifugeuse Sigma model 6 k 15. Les surnageants ont été centrifugés à 9 600 rpm à 4 °C pendant 10 minutes. Les culots ainsi obtenus ont été remis en suspension dans 30 mL du TSE, puis centrifugés à 9 600 rpm à 4 °C pendant 10 minutes. Les deuxièmes culots ont été suspendus dans 15 mL du tampon TSE (250 mM sucrose, 50 mM tris, pH 7,2 à 4 °C) et centrifugés à 4 °C pendant 10 minutes à 9 600 rpm. Le culot final constitué de mitochondries est subdivisé en deux fractions égales : la première est récupérée dans 200 µL du TSE et constitue la suspension mitochondriale et la seconde dans 200 µL de la solution hypotonique (25 mM KH2PO4; 5 mM Mgcl2, pH 7,2) pour préparer la matrice mitochondriale qui sert à l’étude enzymatique (RUSTIN et al., 1994).
2.2.2.1 Dosage des protéines
La concentration des protéines mitochondriales a été déterminée selon la méthode décrite par LOWRY et al. (1951); sur une aliquote de mitochondries, l’absorbance est mesurée par spectrophotomètre à la longueur d’onde 700 nm.
2.2.2.2 Préparation des échantillons
La fraction mitochondriale a été soumise à une série de six à huit congélation-décongélation répétées avec broyage vigoureux, effectué dans un mortier après chaque décongélation, afin d’éclater les mitochondries et libérer les enzymes mitochondriales. Après une centrifugation de 10 minutes de ce mélange à 9 600 rpm à 4 °C, le surnageant obtenu a été utilisé comme source d’enzymes mitochondriales pour l’évaluation de l’activité enzymatique mitochondriale (SOD mito, CAT mito, etc.). Si les phases de congélation-décongélation peuvent induire un stress oxydant pour les mitochondries, nous avons appliqué le même protocole aux différents lots de rats, permettant ainsi une analyse comparative de nos résultats.
Pour la préparation de la fraction cytosolique, 1 g du foie a été prélevé et directement plongé dans trois volumes de tampon phosphate (0,1 M à pH 7,4) contenant du KCl 1,17 %. Après découpage en morceaux fins et homogénéisation à l’aide du broyeur de DOUNCE, l’homogénat est centrifugé à 800 rpm pendant 15 minutes à 4 °C pour éliminer les débris nucléaires; le surnageant est ensuite centrifugé à 9 600 rpm pendant 45 minutes à 4 °C. Le surnageant final est utilisé comme source d’enzymes cytosoliques (IQBAL et al., 2003).
2.2.3 Mesure de la péroxydation lipidique
Les structures lipidiques sont la première cible des ROS, en particulier membranaires, soumises à une peroxydation lipidique. Les lipoperoxydes qui échappent à la détoxification conduisent à des aldéhydes toxiques, dont le plus connu est le malondialdéhyde (MDA), qui résulte de la coupure, induite par les radicaux libres, des acides gras polyinsaturés possédant au moins trois doubles liaisons. La toxicité des aldéhydes est liée à leur forte réactivité vis-à-vis des protéines et des acides nucléiques. La mesure du MDA se révèle donc un excellent marqueur pour étudier l’effet des substances toxiques et permet d’évaluer leur éventuelle toxicité.
La péroxydation lipidique dans les mitochondries hépatiques a été estimée par la mesure d’acide thiobarbiturique (TBARS), exprimée en matière d’équivalents en malondialdéhyde (MAD) (LIGERET et al., 2004; OKHAWA et al., 1979).
2.2.4 Mesure du glutathion
Le glutathion ou γ-L-glutamyl-L-cystéinglycine est un tripeptide dont la concentration cellulaire peut atteindre dans certaines cellules animales 5 mM. Grâce à son groupement SH libre, le glutathion constitue le principal antioxydant propre à la cellule. Il peut en effet non seulement réduire H2O2 en eau et des peroxydes de types ROOH en alcools, mais également interagir directement avec les ROS formés par l’oxydation des vitamines E et C, baissant ainsi les niveaux de peroxydation lipidique.
Pour évaluer le taux du glutathion, un gramme du foie est découpé, homogénéisé avec trois volumes de l’acide trichloracétique (TCA) (5 %) à l’aide d’un broyeur de DOUNCE, puis centrifugé à 2 000 rpm. Une aliquote de 50 µL du surnageant est ensuite diluée dans 10 mL de tampon phosphate (0,1 M, pH = 8). À 3 mL du mélange de dilution, nous avons additionné 20 µL DTNB (acide 5, 5’-Dithiobis 2-nitrobenzoïque acid) (0,1 M). Après 15 minutes d’incubation, la lecture de la densité optique est effectuée à 412 nm contre un blanc préparé dans les mêmes conditions avec le TCA (5 %) (Ellman, 1959).
Les concentrations ont été exprimées en millimoles de glutathion par gramme de foie. Elles sont déduites à partir d’une gamme étalon de glutathion préparée dans les mêmes conditions que le dosage.
2.2.5 Mesure de l’activité de la catalase
Les catalases sont responsables de la dégradation d’H2O2 en H2O et O2, empêchant donc cette molécule de participer à la réaction de Fenton. Elles sont localisées dans le peroxysome des cellules de nombreux types tissulaires, mais sont particulièrement abondantes dans le foie et les globules rouges.
L’activité enzymatique de la catalase a été déterminée par la méthode basée sur la mesure de la disparition du peroxyde d’hydrogène du fait de l’activité de cette enzyme (CLAIRBORNE, 1985), par la préparation dans une cuve de mesure en quartz, une solution substrat composée de 1 mL de tampon phosphate (KH2PO4, 0,1 M, pH 7,4), 0,950 mL de H2O2 (0,019 M), 0,025 mL de la source enzymatique (matrice mitochondriale ou fraction cytosolique). La réaction est suivie par l’enregistrement de l’absorbance à 560 nm chaque minute pendant deux minutes. L’activité enzymatique est exprimée en UI•mg-1 de protéine.
2.2.6 Mesure de l’activité de la superoxyde dismutase (SOD)
Les SODs sont capables d’éliminer l’anion superoxyde, première espèce toxique formée à partir de l’oxygène, par une réaction de dismutation. Elles assurent ainsi la première ligne de défense enzymatique contre le stress oxydant comme le montre la réaction :
L’activité de la superoxyde dismutase a été mesurée dans le surnageant des mitochondries et des cytosols par la mesure de la capacité de l’enzyme à inhiber la réduction du nitrobleu-tétrazolium (NBT) par l’anion superoxyde produit suite à la photoréaction de l’oxygène et de la riboflavine en présence d’un donneur d’électron comme la méthionine (BEAUCHAMP et FRIDOVICH, 1971). Cinq µL de la source enzymatique ont été ajoutés à 2 mL du mélange réactionnel (cyanide de sodium 2•10-5 M; solution du NBT 1, 76•10-4 M, EDTA 6, 6•10-3 M; riboflavine 2•10-6 M; méthionine 10-2 M), puis le mélange a été irradié avec une lampe de 15 Watts pendant 10 minutes. L’absorbance a été mesurée à 560 nm et les valeurs ont été exprimées en UI•mg-1 de protéines.
2.3 Analyse statistique des résultats
Les résultats sont présentés sous forme de moyennes associées aux écarts-types. Nous nous sommes servis, dans un premier temps, d’analyses de variance pour comparer les moyennes des concentrations en plomb et en cadmium et les variations des marqueurs cellulaires du stress oxydant entre les lots de rats soumis à des concentrations différentes en métaux. Lorsqu’une différence significative était observée, nous avons eu recours au test post-hoc de type Scheffé pour identifier les différences entre les sites dans l’analyse de terrain et entre les lots dans les tests écotoxicologiques, ce test permettant de comparer chacun des sites et des lots aux deux pour déterminer s’ils diffèrent entre eux. Le niveau de signification adopté est égal ou supérieur à 0,05.
3. Résultats et discussion
3.1 Résultats d’analyses du plomb et du cadmium
Les concentrations moyennes du plomb et du cadmium de chaque site sont rassemblées dans le tableau 1.
Tableau 1
Concentrations moyennes en plomb et en cadmium (µg•L‑1) contenues dans les eaux des sites retenus. Les résultats sont exprimés en moyenne ± écart-type. S1 : Forage de l’oued Nil (ON 34); S2 : Source de Bachelot; S3 : Puits collectif 1; S4 : Puits collectif 2.
Average cadmium and lead concentrations (µg•L-1) contained in water of the selected sites. The results are expressed as means ± standard deviation. S1: Drilling of the Nil wadi (ON 34); S2: Source of Bachelot; S3: Collective well 1; S4: Collective well 2.
Les résultats obtenus soulignent que tous les sites retenus ont été fortement chargés en plomb et dépassent de loin les valeurs admissibles préconisées par l’O.M.S et les normes algériennes (NA) (Tableau 2). Les concentrations maximales du plomb ont été enregistrées au niveau des sites un et trois, avec des concentrations de 83 µg•L-1 et 80 µg•L-1 respectivement. Les eaux du site deux et du site quatre montrent également des concentrations très élevées en plomb. L’ANOVA montre une différence significative entre les quatre sites retenus (p< 0,05).
Tableau 2
Normes pour les maxima admissibles ou recommandés des concentrations du plomb et cadmium dans l’eau potable (µg•L-1).
Standards for maximum acceptable or recommended concentrations of lead and cadmium (µg•L-1) in drinking water.
1Limite recommandée par l’AWWA (American Waterworks Association) : Si la concentration excède la valeur recommandée, une autre eau ou un autre traitement doit être envisagé.
2Limite imposée par l’AWWA : Si la concentration excède la valeur imposée, une utilisation non alimentaire doit être choisie, pour cette eau par les autorités compétentes, car elle représente un danger pour la santé du consommateur. Normes algériennes : NA 6360-1992. CEE : Communauté Économique Européenne.
1Limit recommended by the AWWA (American Waterworks Association): If the concentration exceeds the recommended value, another water or another treatment must be considered.
2Limit imposed by the AWWA: If the concentration exceeds the specified value, a non-food use must be selected for this water by the proper authorities, because it represents a danger to the health of the consumer. Algerian standards: NA 6360-1992. CEE: European Economic Community. Algerian standards: NA 6360-1992.
L’ensemble des résultats obtenus souligne également des teneurs fortement élevées en cadmium total dans tous les sites de prélèvements qui dépassent de loin la concentration maximale admissible (CMA) recommandée par l’OMS pour le cadmium dans les eaux d’alimentation et les normes algériennes. En comparant deux à deux les sites échantillonnés, les profils de concentrations entre les sites S1-S2 (p< 0,01), S1-S3 (p< 0,001), S2-S3 (p< 0,001), S2-S4 (p< 0,001) et S3-S4 (p< 0,001) montrent des différences significatives. En revanche, seule la différence des sites S1-S4 n’est pas significative.
3.2 Résultats d’études toxicologiques
3.2.1 Variations des taux du MDA
Comme le montre la figure 2a, la coexposition des rats via l’eau de boisson à un mélange de différentes concentrations du plomb et du cadmium cause une augmentation significative dans le niveau du MDA cytosolique chez les rats de tous les lots (p< 0,001), à l’exception des lots (×10, ×100), où les différences ne sont pas statistiquement significatives. Des augmentations également significatives ont été observées dans le niveau du MDA mitochondrial chez les rats des lots (×0, ×1) (p= 0,05), (×0, ×10), (×0, ×100), (×1, ×100) et (×10, ×100) (p< 0,001). Seules les variations entre les lots (×1, ×10) ne montrent pas de différence significative (figure 2b).
Figure 2
Effets du mélange du plomb et du cadmium sur le MDA cytosolique (a) et mitochondrial (nmoles•mg-1 du foie (b)). Les résultats sont exprimés en moyenne ± écart-type, n=8 dans chaque groupe. Test Scheffé : (ns) désigne un effet non significatif (p> 0,05), (*) désigne un effet significatif (p< 0,05).
Effects of a lead-cadmium mixture on the cytosolic (a) and mitochondrial MDA (b) (nmoles•mg-1 of liver). The results are expressed as means ± standard deviation, n=8 in each group. Scheffé Test: (ns) indicates a non significant effect (p>0.05), (*) indicates a significant effect (p< 0.05).
3.2.2 Variations des taux de glutathion hépatique
Comme le montre la figure 3, les niveaux du GSH hépatique ont montré une baisse hautement significative (p< 0,001) chez les rats des lots (×0, ×1), (×0, ×10), (×0, ×100). Le même effet est observé entre les rats des lots (×1, ×100), mais avec un (p = 0,03). Néanmoins, les variations du GSH ne montrent aucune variation significative entre les rats des lots (×1, ×10) et (×10, ×100).
Figure 3
Effets du mélange plomb-cadmium sur le GSH hépatique (nmoles•g-1 de foie). Les résultats sont exprimés en moyenne ± écart-type, n = 8 dans chaque groupe. Test Scheffé : (ns) désigne un effet non significatif (p > 0,05), (*) effet significatif (p < 0,05).
Effects of the lead-cadmium mixture on hepatic GSH (nmoles•g-1 of liver). The results are expressed in means ± standard deviation, n=8 in each group. Scheffé Test: (ns) indicates a non significant effect (p> 0.05), (*) indicates a significant effect (p< 0.05).
3.2.3 Variations de l’activité de la catalase
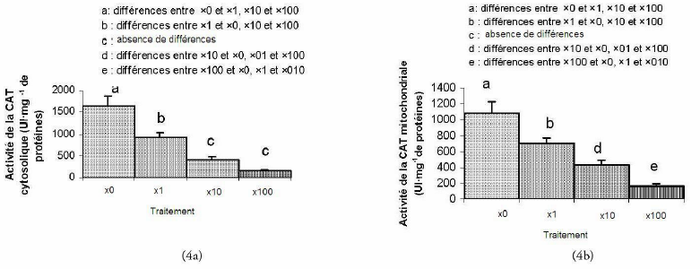
Sur les quatre lots étudiés, les variations de l’activité de la CAT cytosolique et mitochondriale entre les rats de chaque deux lots montrent des différences significatives. Seules les variations de la CAT cytosolique entre les lots (×10, ×100) ne sont pas significativement différentes (figures 4a et 4b).
Figure 4
Effets du mélange du plomb et du cadmium sur l’activité de la catalase cytosolique (a) et mitochondriale (b) (UI•mg-1 de protéines). Les résultats sont exprimés en moyenne ± écart -type, n = 8 dans chaque groupe. Test Scheffé (*) désigne un effet significatif (p < 0,05).
Effects of a lead-cadmium mixture on the activity of cytosolic (a) and mitochondrial catalase (b) (IU•mg-1 of proteins). The results are expressed in means ± standard deviation, n=8 in each group. Scheffé Test: (*) indicates a significant effect (p< 0.05).
3.2.4 Variations de l’activité de la superoxyde dismutase (SOD)
Sur la période d’étude investiguée, l’activité de la SOD cytosolique et mitochondriale a augmenté très significativement (p < 0,001) entre les rats de tous les lots (figures 5a et 5b).
Figure 5
Effets du mélange plomb - cadmium sur l’activité de la superoxyde dismutase cytosolique (a) et mitochondriale (b) (UI•mg-1 de protéines). Test Scheffé : (ns) désigne un effet non significatif (p > 0,05), (*) désigne un effet significatif (p < 0,05).
Effects of a lead-cadmium mixture on the activity of cytosolic (a) and mitochondrial superoxide dismutase (b) (IU•mg-1 of proteins). The results are expressed in means ± standard deviation, n=8 in each group. Scheffé Test: (*) indicates a significant effect (p< 0.05)
3.3 Discussion
3.3.1 Concentrations du plomb et du cadmium
L’évaluation globale des présents résultats met en évidence un profil de concentration très élevé dans les quatre sites retenus pour les deux métaux cibles de l’étude, le plomb et le cadmium. Ceci traduit une contamination alarmante des sources d’eau de la ville de Jijel, dont les teneurs dépassent les normes préconisées par l’OMS en Europe (OMS, 2004) fixées à 50 µg•L-1 pour le plomb et à 5 µg•L-1 pour le cadmium et les normes algériennes fixées à 50 µg•L-1 pour le plomb et à 10 µg•L-1 pour le cadmium (norme 6360-1992 pour le plomb et le cadmium). Concernant le plomb, il est à signaler que les concentrations détectées respectent les normes internationales de l’OMS fixées à 100 µg•L-1 dans les quatre sites retenus. Toutefois, par comparaison aux normes algériennes, le taux de dépassement du plomb atteint 65 % pour la valeur moyenne du site un et 35 % du site quatre. Les concentrations du cadmium ont révélé également un dépassement très élevé estimé à 91 % au niveau du site trois et à 73 % au site quatre. Sur la base de la Dose Hebdomadaire Tolérable (DHT) par unité du poids corporel calculée par l’OMS pour les deux métaux (25 µg•kg-1 pour le plomb et 7 µg•kg-1 pour le cadmium), les niveaux de contamination attestés dans la présente étude présentent des risques majeurs pour la santé publique dont particulièrement les personnes les plus sensibles (jeunes enfants, femmes enceintes et personnes âgées). Les concentrations des tests écotoxicologiques ont été établies en adoptant un facteur d’incertitude de 100, 10 pour tenir compte des populations sensibles et 10 pour le temps de l’étude. Par ailleurs, le temps d’exposition représente un paramètre clé dans l’aggravation de la toxicité où l’impact réel d’une telle contamination ne peut se mesurer dans l’immédiat, mais peut être décalé dans le temps. La faune et la flore locales qui ne sont pas adaptées pour vivre en la présence des concentrations élevées en métaux peuvent ainsi être mises en danger. Avec l’existence du phénomène de bioaccumulation, des essais écotoxicologiques chroniques sont nécessaires pour bien estimer les risques réels de cette contamination sur la santé environnementale locale.
Dans le cas du plomb, les concentrations figurant dans cette étude sont situées dans la fourchette des concentrations rapportées par le ministère de l’Aménagement du territoire marocain (Rapport national MEDPOL, 2005). Dans une étude portant sur 3 000 prélèvements d’eau des nappes phréatiques de Casablanca, Tanger, Oujda et autres, il a été relevé des concentrations très variables oscillant entre 6,5 et 123 µg•L-1. Les niveaux élevés du cadmium détectés dans cette étude ont été également rapportés dans une autre étude de School of Pure and Applied Natural Sciences, de l’Université de Kalmar (LAVERGREN ET AL., 2008) portant sur les eaux souterraines du Degerhamn, dans le sud-ouest de l’île d’Oland en Suède, avec des concentrations allant de 0,011 µg•L-1 à 19,80 µg•L-1, selon les profondeurs et les stations. Les mêmes tendances ont été signalées aussi bien en Afrique qu’aux États-Unis, où les concentrations en cadmium des eaux souterraines du sud nigérien atteignent 20 µg•L-1 (ASUBIOJO et al., 1997) avec des maximums de 225 µg•L-1, d’après une analyse d’échantillons de 180 sites couvrant dix régions des États-Unis (YANG et RAUCKMAN, 1987). Les teneurs naturelles en plomb et en cadmium dans les eaux souterraines sont généralement très basses en dehors des zones minières ou exposées à des rejets anthropiques. La zone ciblée par notre investigation et d’après l’étude de AFALFIZ et al. (1998), est un véritable gisement naturel de roches métamorphiques, riche en plomb et en zinc. Ces résultats laissent penser, en absence d’informations concernant les valeurs précises en plomb et en cadmium du fond géochimique naturel de la région, que ces teneurs élevées sont pour l’essentiel d’origine naturelle. Néanmoins, ces concentrations élevées apparaissent, fort probablement, influencées par la présence d’autres sources anthropiques susceptibles d’accentuer la contamination, notamment les ruissellements et les infiltrations de dépôts résiduaires d’une ancienne mine des métaux précieux (or et argent) et de marbre, abandonnée en 1993, située au niveau de la source de l’oued Nil à Ain Tizi (montagnes de Chahna) en aval des sites retenus. Ces terrils miniers abandonnés laissent de grandes masses de déchets fortement chargées en métaux. La nature très perméable des sols autour de l’oued Nil facilite considérablement le processus d’infiltration de ces métaux vers les eaux souterraines du bassin. Des études récentes (CIDU et al., 2009; RAZOWSKA, 2001), ont également mis l’accent sur la contribution des activités minières dans l’enrichissement des eaux souterraines en métaux. Aussi, l’intensification des activités agricoles dans le bassin de l’oued Nil, ainsi que l’usage exagéré des engrais chimiques, en particulier les engrais phosphatés et des pesticides par les agriculteurs de la région, constituent des sources anthropiques non négligeables dans l’enrichissement des eaux souterraines en métaux. Ainsi, la localisation de la quasi-totalité des puits collectifs de Redjla et les forages de l’oued Nil au sein des champs agricoles augmentent les risques de la contamination par infiltration et diffusion. De même, les élevages intensifs de bovins et de volailles sur l’ensemble des terrasses alluviales de l’oued Nil sont probablement responsables des transferts des métaux contenus dans ses déjections vers les cours d’eau. Indirectement, l’utilisation des terres peut influencer la concentration de métaux dans les eaux de surface et souterraines, en accroissant la mobilité des métaux, d’origine humaine ou géologique, présents dans les sols du bassin. La surexploitation des eaux des puits de la région de Rhedjla à des fins d’irrigation et de consommation humaine peut également altérer le milieu chimique du sol et accroître la mobilité des métaux d’origine géologique. Plusieurs cas similaires ont été illustrés dans le monde et l’exemple des puits tubulaires du Bangladesh reste le plus spectaculaire. Les rejets d’eaux usées sur les terrasses situées au nord du bassin et les lixiviats de l’ancienne décharge publique au niveau de l’oued Boukhara, un des affluents les plus importants de l’oued Nil, sont d’autres sources probables de cette contamination. Des études (GRAY et al., 1974; RUGGE et al., 1995) ont montré les dangers liés à la présence des décharges publiques à proximité des sources d’eau. De façon globale, l’évaluation des concentrations des métaux présents à l’état de trace dans l’eau reste une opération délicate et se heurte en permanence à des risques de contamination. Néanmoins, l’ensemble des mesures prises lors de la réalisation de notre travail nous a permis de minimiser ces risques.
3.3.2 Réponse des marqueurs cellulaires du stress oxydant
La présente étude a été menée pour élucider les effets des concentrations détectées du plomb et du cadmium dans l’eau de boisson par l’utilisation des biomarqueurs du stress oxydant, et d’évaluer les risques de cette contamination sur un modèle de mitochondries et de cytosols hépatiques, par coexposition subchronique, de quatre semaines, des rats aux concentrations détectées (×1), mais aussi à des concentrations plus élevées (×10 et ×100) et la comparaison avec des rats témoins (×0). Le choix des concentrations a été en accord avec les concentrations détectées dans l’eau avec la prise en compte des autres sources de contamination. La coexposition des rats à différentes concentrations d’une mixture plomb – cadmium provoque une grave altération du statut redox des cellules hépatiques attestées dans la présente étude par un déséquilibre entre la génération de ROS et la production d’antioxydants. Il a été observé une augmentation significative des concentrations cytosolique et mitochondriale du MDA, une baisse du GSH hépatique total et un déséquilibre dans les systèmes de défense antioxydante, marqués par une augmentation de l’activité enzymatique de la SOD et une diminution de celle de la CAT. Bien que les mécanismes biochimiques responsables de la toxicité du plomb et du cadmium ne sont pas encore entièrement connus, l’un des principaux concepts relatifs à cette toxicité serait attribué à leur capacité à générer des ROS (JORIS, 2005). La production excessive du MDA enregistrée dans la présente étude est certainement une fraction importante de l’action prooxydante exercée par ces deux métaux. Par ailleurs, le rôle du plomb et du cadmium dans la surproduction du MDA a été signalé par certains auteurs (LOPEZ et al., 2006; MOREIRA et al., 2001; STOHS et BAGHI, 1995; VALCO et al., 2006). Ces deux métaux toxiques ont une affinité particulière pour les groupements SH du glutathion réduit (NIGAM et al., 1999), ce qui peut déséquilibrer la balance désulfure cellulaire. En effet, dans une étude récente (WANG et FOWLER, 2008), il a été montré une diminution significative du taux du GSH au niveau des cellules rénales des rats exposés à un mélange de métaux. Un autre aspect très important de la toxicité du plomb et du cadmium serait lié à l’altération des enzymes antioxydantes, objectivé par une augmentation dans l’activité de la SOD et une diminution dans celle de la CAT. En effet, les SOD agissent par voie catalytique, un excès de production de l’anion superoxyde conduit à une augmentation de la concentration cellulaire en SOD (SILVESTRE, 2005). La liaison des cations métalliques aux enzymes pourrait également altérer leur activité, non seulement en inhibant, mais aussi en stimulant la fonction catalytique de l’enzyme. Plusieurs auteurs (FOWLER et al., 2004; MASSO et al., 2007) ont pu mettre en évidence une réponse similaire de la SOD face aux contaminants métalliques. Néanmoins, des réponses très variables de la CAT ont été décrites chez les animaux exposés au plomb et au cadmium (GURER et ERCAN, 2000; PATRA et al., 2001) en fonction de la dose et la durée d’exposition. La CAT catalyse la réaction de détoxification d’H2O2 par dismutation en eau et en oxygène et agit en synergie avec la SOD (TOPPI et GABBRIELI, 1999). Toutefois, une production accrue du peroxyde d’hydrogène peut excéder les capacités antioxydantes de cette enzyme, se traduisant par une inhibition de leur activité (ATLI et al., 2006).4.
Conclusion
La présente étude a révélé une forte contamination par le plomb et le cadmium des eaux souterraines du bassin de l’oued Nil. En l’absence des sources industrielles dans la région, la forte contribution du fond pédogéochimique et la présence de plusieurs autres sources anthropiques, notamment les effluents de l’ancienne mine de Chahna et les effluents agricoles et domestiques, seraient responsables des niveaux élevés de cette contamination. L’étude montre également l’implication des métaux plomb et cadmium dans la génération d’un état de stress oxydant, caractérisé par une surproduction du MDA, une diminution significative du GSH cellulaire et une altération des enzymes SOD et CAT.
Parties annexes
5. Références bibliographiques
- AFALFIZ A., B. GUY. et B. SEMOURD (1998). Étude métallogénique des indices minéralisés à Fe, Pb, Zn, Cu, Ba, Ag dans les métacarbonates du socle métamorphique de la région de Taher (Jijel) Algérie. Mém. Serv. Géol. Alg., 9, 57-76.
- ASUBIOJO O.I., N.A. NKONOA, A.O. OGUNSUAB, A.F. OLUWOLEl, N.I. WARDD, O.A. AKANLEE et N.M. SPYR (1997). Trace elements in drinking and groundwater samples in Southern Nigeria. Sci. Total Environ., 208, l-8.
- ATLI G.A., O. ALPTEKINl, S. TUKE et M. CANLI (2006).Response of catalase activity to Ag+, Cd2+, Cr6+, Cu2+ and Zn2+ in five tissues of freshwater fish Oreochromis niloticus. Comp. Biochem. Physiol. C., 143, 218-224.
- BEAUCHAMP C. et I. FRIDOVICH (1971). Assay of superoxide dismutase. Anal. Biochem., 4, 276-287.
- CIDU R., R. BIDDAU et L. FANFANI (2009). Impact of past mining activity on the quality of groundwater in SW Sardinia (Italy). J. Geochem. Explor., 100, 125-132.
- CLAIBORNE A. (1985). Catalase activity. Dans : CRC Handbook of methods for oxygen radical research. GREENWALD R.A. (Éditeur), CRC Press, Boca Raton, FL, USA, pp. 283-284.
- ELLMAN G. (1959). Plasma antioxydants. Arch. Biochem. Biophys., 82, 70-77.
- FATIH FIDAN A., L. HAKKI CIGERCI, M. KONUK, I KUCUKKURT, R. ASLAN et Y. DUNDAR (2008). Determination of some heavy metal levels and oxidative status in Carassius carassius L., 1758 from Eber Lake, Environ. Monit. Assess., 147, 35-41.
- FOWLER B.A., M.H. WHITTAKER, M. LIPSKY, G. WANG, et X.W. CHEN (2004). Oxidative stress induced by lead, cadmium and arsenic mixtures: 30-days, 90-days, and 180-days drinking water studies in rats: an overview. Biometals, 17, 567–568.
- GRAY D.A., J.D. MATHER et I.B. HARRISON (1974). Review of groundwater pollution from waste disposal sites in England and Wales, with provisional guidelines for future site selection. Quat. J. Eng. Geol. Hydrol., 7, 181-196.
- GURER H. et N. ERCAN (2000). Can antioxidants be bene?cial in the treatment of lead poisoning? Free Radic. Biol. Med., 29, 927-45.
- HARTE J., C. HOLDERN, R. SCHNEIDE et C. SHIRLEY (1991). Toxics A to Z guide to everyday pollution hazards. University of California Press. Oxford, England, 478 p.
- IQBAL M., S.D. SHARMA, Y. OKAZAKI, M. JUJISAWA et S. OKADA (2003). Dietary supplementation of curcumin enhanced antioxidant and phase II metabolizing enzymes in ddY malE mice: Possible role in protection against chemical carcinogenesis and toxicocity. Pharmacol. Toxicol., 92, 33-38.
- JADHAV S.S., S.N. SARKAR, G.C. RAM et H.C. TRIPATHI (2007). Immunosuppressive effect of subchronic exposure to a mixture of eight heavy metals, found as groundwater contaminants in different areas of India, through drinking water in male rats. Arch. Environ. Contam. Toxicol., 53, 450-458.
- JORIS M.A. (2005). Études biochimiques et génétiques de la réponse adaptative de mollusques face aux contaminations métalliques et au stress oxydant. Thèse de doctorat, Univ. de Bordeaux I, France, 265 p.
- LAGADIC L. (1999). Biomarkers in invertebrates: Evaluating the effects of chemicals on populations and communities from biochemical and physiological changes of individuals. Dans : Biomarkers: A Pragmatic Basis for Remediation of Severe Pollution in Eastern Europe. D.B. PEAKALL, C.H. WALKER et P. MIGULA (Éditeurs) Kluwer Acad. Publ., London, UK, pp. 153-175.
- LAVERGREN U., M.E. ASTRÖM, H. FALK, B. BERGBÄCK (2008). Metal dispersion in groundwater in an area with natural and processed blackshale – Nationwide perspective and comparison with acid sulfate soils. Appl. Geochem., 24, 359-369.
- LEHTIHET A. (1983). Étude hydrogéologique de la plaine alluviale de l’oued Nil (région de Jijel). Mémoire d’ingénieur d’État en hydrogéologie, Univ. Houari Boumédiene-Alger, Algérie, pp. 60-65.
- LIGERET H., S. BARTHELEMY, R. ZINI, J.P. TILLEMENT, S. LABIDALLE et D. MORIN (2004). Effect of curcumin and curcumin derivatives on mitochondrial permeability transition pore. Free Radic. Biol. Med., 36, 919-929.
- LOPEZ E., C.M.J. AACE, M.J. OSET-GASQUE, S. CANADAS et M.P. GONZALEZ (2006). Cadmium induced reactive oxygen species generation and lipid peroxidation in cortical neurons in culture. Free Radic. Biol. Med., 40, 940-951.
- LOWRY O., N. ROSEBROUGH, A. FARR et R. RANDALL (1951). Protein measurement with the folin phenol reagent. J. Biol. Chem., 193, 265-275.
- MASSO E.L., L. CORREDOR et M.T. ANTONIO (2007). Oxidative damage in liver after perinatal intoxication with lead and/or cadmium. J. Trace Elem. Med. Biol., 21, 210-216.
- MOREIRA G.E., G.I. ROSA, S.B. BARROS, V.C. VASSILEIFF et I. VASSILEIFF (2001). Antioxidant defence in rat brain regions after developmental lead exposure. Toxicol., 169, 145-51.
- NIGAM D., G.S. SHUKLA et A.K. AGARWAL (1999). Glutathione depletion and oxidative damage in mitochondria following exposure to cadmium in rat liver and kidney. Toxicol. Lett., 106, 151-7.
- OKHAWA H., N. OHISHI et K. YAGI (1979). Assay of lipid peroxides in animal tissue by thiobarbituric reaction. Anal. Biochem., 95, 351-358.
- OMS (2004). Directive de qualité de l’eau de boisson : 3e édition. Vol 1 : recommandations OMS. Genève, 11 p.
- PATRA R.C., D. SWARUP et S.K. DWIVEDI (2001). Antioxidant effects of a-tocopherol, ascorbic acid and L-methionine on lead induced oxidative stress to the liver, kidney and brain in rats. Toxicol., 162, 81-8.
- QUEMERAIS B. et D. COSSA (1997). Procedures for sampling and analysis of mercury in natural water. Environment Canada-Quebec region, Environmental Conservation, St. Lawrence Centre, Scientific and Technical Report, ST-31E, 34 p.
- Rapport national MEDPOL (2005). Rapport relatif au plomb et cadmium. Ministère de l’Aménagement du territoire, de l’Eau et de l’Environnement. Direction de la surveillance et de la prévention des risques, 7130, Royaume du Maroc, 23 p.
- YANG, R.S.H. et e.j. rauckman (1987). Toxicological studies of chemical mixtures of environmental concern at the National Toxicology Program: Health effects of groundwater contaminants. Toxicol., 47, 15-34.
- RAZOWSKA L. (2001). Changes of groundwater chemistry caused by the ?ooding of ironmines (Czestochowa Region, Southern Poland). J. Hydrol., 244, 17-32.
- REES T.J. (1993). Glutathione-S-transferase as a biological marker of aquatic contamination. Thèse de Doctorat, Univ. Portsmouth, U.K in collaboration with the Water Research Center, Henley, UK. August, pp. 44-50.
- RÜGGE K., P.L. BJERG et T.H CHRISTENSEN (1995). Distribution of organic compounds from municipal solid waste in groundwater downgradient of a landfill (Grindsted, Denmark). Environ. Sci. Technol., 29, 1395-1400.
- RUSTIN P., D. CHRETI, T. BOURGERON, B. GERARD, A.G. ROTIG, G.M. SAUDUBRAY et A. MUNNICH (1994). Biochemical and molecular investigation in respiratory chain deficiencies. Clin. Chim. Acta., 228, 35-51.
- SILVESTRE F. (2005). Réponse à un stress environnemental induit par le cadmium chez un crustacé euryhalin : Ericheir sinensis. Approche intégrative incluant une analyse de protéine. Thèse de doctorat, Univ. Notre-Dame de la Paix, France, 72 p.
- STOHS S.J. et D. BAGHI (1995). Oxidative mechanisms in the toxicity of metal ions. Free Radic. Biol. Med., 18, 21-36.
- TOPPI D.S. et R. GABBRIELI (1999). Response to cadmium in higher plants. Environ. Exp. Bot., 41, 105-130.
- VALCO M., J.C. PIHODES, J. MONCOL, M. IZATOVIC et M. MAZUR (2006). Free radicals, metals and antioxidants in oxidative stress induced cancer. Chem.-Biol. Interact., 160, 1-40.
- WANG G. et B.A. FOWLER (2008). Roles of biomarkers in evaluating interactions among mixtures of lead, cadmium and arsenic. Toxicol. Appl. Pharmac., 233, 92-99.
- ZHANG H., D. MA, Q. DIE et X. CHEN (1999). An approach to studying heavy metal pollution caused by modern city development in Nanjinga, China. Environ. Geol., 38, 223-228.
Liste des figures
Figure 1
La wilaya de Jijel, d’après le Bureau National d’Études pour le Développement Rural (2005)
The wilaya of Jijel, according to the National Office of Studies for Rural Development (2005)
Figure 2
Effets du mélange du plomb et du cadmium sur le MDA cytosolique (a) et mitochondrial (nmoles•mg-1 du foie (b)). Les résultats sont exprimés en moyenne ± écart-type, n=8 dans chaque groupe. Test Scheffé : (ns) désigne un effet non significatif (p> 0,05), (*) désigne un effet significatif (p< 0,05).
Effects of a lead-cadmium mixture on the cytosolic (a) and mitochondrial MDA (b) (nmoles•mg-1 of liver). The results are expressed as means ± standard deviation, n=8 in each group. Scheffé Test: (ns) indicates a non significant effect (p>0.05), (*) indicates a significant effect (p< 0.05).
Figure 3
Effets du mélange plomb-cadmium sur le GSH hépatique (nmoles•g-1 de foie). Les résultats sont exprimés en moyenne ± écart-type, n = 8 dans chaque groupe. Test Scheffé : (ns) désigne un effet non significatif (p > 0,05), (*) effet significatif (p < 0,05).
Effects of the lead-cadmium mixture on hepatic GSH (nmoles•g-1 of liver). The results are expressed in means ± standard deviation, n=8 in each group. Scheffé Test: (ns) indicates a non significant effect (p> 0.05), (*) indicates a significant effect (p< 0.05).
Figure 4
Effets du mélange du plomb et du cadmium sur l’activité de la catalase cytosolique (a) et mitochondriale (b) (UI•mg-1 de protéines). Les résultats sont exprimés en moyenne ± écart -type, n = 8 dans chaque groupe. Test Scheffé (*) désigne un effet significatif (p < 0,05).
Effects of a lead-cadmium mixture on the activity of cytosolic (a) and mitochondrial catalase (b) (IU•mg-1 of proteins). The results are expressed in means ± standard deviation, n=8 in each group. Scheffé Test: (*) indicates a significant effect (p< 0.05).
Figure 5
Effets du mélange plomb - cadmium sur l’activité de la superoxyde dismutase cytosolique (a) et mitochondriale (b) (UI•mg-1 de protéines). Test Scheffé : (ns) désigne un effet non significatif (p > 0,05), (*) désigne un effet significatif (p < 0,05).
Effects of a lead-cadmium mixture on the activity of cytosolic (a) and mitochondrial superoxide dismutase (b) (IU•mg-1 of proteins). The results are expressed in means ± standard deviation, n=8 in each group. Scheffé Test: (*) indicates a significant effect (p< 0.05)
Liste des tableaux
Tableau 1
Concentrations moyennes en plomb et en cadmium (µg•L‑1) contenues dans les eaux des sites retenus. Les résultats sont exprimés en moyenne ± écart-type. S1 : Forage de l’oued Nil (ON 34); S2 : Source de Bachelot; S3 : Puits collectif 1; S4 : Puits collectif 2.
Average cadmium and lead concentrations (µg•L-1) contained in water of the selected sites. The results are expressed as means ± standard deviation. S1: Drilling of the Nil wadi (ON 34); S2: Source of Bachelot; S3: Collective well 1; S4: Collective well 2.
Tableau 2
Normes pour les maxima admissibles ou recommandés des concentrations du plomb et cadmium dans l’eau potable (µg•L-1).
Standards for maximum acceptable or recommended concentrations of lead and cadmium (µg•L-1) in drinking water.
1Limite recommandée par l’AWWA (American Waterworks Association) : Si la concentration excède la valeur recommandée, une autre eau ou un autre traitement doit être envisagé.
2Limite imposée par l’AWWA : Si la concentration excède la valeur imposée, une utilisation non alimentaire doit être choisie, pour cette eau par les autorités compétentes, car elle représente un danger pour la santé du consommateur. Normes algériennes : NA 6360-1992. CEE : Communauté Économique Européenne.
1Limit recommended by the AWWA (American Waterworks Association): If the concentration exceeds the recommended value, another water or another treatment must be considered.
2Limit imposed by the AWWA: If the concentration exceeds the specified value, a non-food use must be selected for this water by the proper authorities, because it represents a danger to the health of the consumer. Algerian standards: NA 6360-1992. CEE: European Economic Community. Algerian standards: NA 6360-1992.