Résumés
Résumé
Les résultats d’un programme de recherche écosystémique, mené dans le Parc Marin Saguenay–Saint-Laurent, sont résumés pour comprendre les processus fondamentaux responsables de l’existence de ce site traditionnel d’alimentation des baleines, découvert par les baleiniers basques il y a 450 ans. Un ensemble de processus pérennes maintient les proies des baleines agrégées à la tête du chenal principal du plateau continental de l’est du Canada. Quel est-il ?
Cette région est le site de la plus riche agrégation de krill documentée à ce jour pour le nord-ouest Atlantique. Les mécanismes responsables sont le pompage, la rétention et la concentration du krill adulte provenant du golfe du Saint‑Laurent par l’énergique circulation estuarienne du Saint‑Laurent. Les courants de marée remontant le long des talus des chenaux et des bancs sous-marins interagissent avec le comportement vertical du krill adulte et le concentrent. Ce processus est plus intense à la tête des chenaux où l’« upwelling » d’origine tidale (remontée d’eau profonde due à la marée) est amplifié. Il est rehaussé par endroits par l’« upwelling » côtier dû au vent. La circulation moyenne transporte les riches essaims de krill le long des rebords des bassins. À l’embouchure de l’estuaire, le krill, concentré à la marge de la grande gyre cyclonique (tourbillon anti-horaire) d’Anticosti, est injecté dans l’estuaire maritime du côté nord, lorsque les conditions de circulation sont favorables. L’étroit courant de talus remontant l’estuaire l’emporte alors vers la zone d’agrégation de krill du parc marin. Des poissons pélagiques fourragers, tel le capelan, se concentrent aussi à la tête du chenal et à l’entrée du fjord sous l’action de l’« upwelling », des courants de marée et des fronts, qui aussi concentrent et augmentent la disponibilité de leurs proies. Ils contribuent à nourrir les baleines et les oiseaux marins.
Des caractéristiques océanographiques spéciales, rarement réunies ailleurs, se combinent dans le parc marin pour créer ce site d’alimentation des baleines. Les pressions anthropiques et les changements climatiques sont les principales menaces à sa préservation pour les prochains siècles.
Mots clés:
- site d’alimentation des baleines,
- habitat critique,
- tête de chenal,
- canyon,
- « upwelling »,
- courants,
- estuaire
Abstract
The results from an ecosystem research program are summarized. It was conducted in the Saguenay–St. Lawrence Marine Park to understand the basic processes responsible for the existence of this traditional whale feeding ground, discovered by the Basques whalers 450 years ago. Persistent processes maintain aggregated whale preys at the head of the main deep-water channel of eastern Canada continental shelf. What are they?
This site is the richest krill aggregation yet documented in the northwest Atlantic. The mechanisms responsible are the pumping, retention and concentration of adult krill from the Gulf of St. Lawrence, by the strong estuarine circulation of the St. Lawrence. Tidal currents upwelling along channels and bank slopes combine with adult krill vertical behavior and concentrate it. This process is more intense at the head of the channels where tidal upwelling is amplified. It is locally enhanced by wind-driven coastal upwelling. The mean circulation transports the rich krill patches along the slopes of the basins. At the mouth of the estuary, the concentrated krill at the margin of the large cyclonic Anticosti gyre (counterclockwise) is injected into the lower estuary on the northern side, under favorable circulation conditions. The narrow slope current flowing upstream along the estuary then imports it towards the Marine Park krill aggregation zone. Pelagic forage fish such as capelin also aggregate at the channel head and entrance of the fjord under the action of the tidal upwelling currents and fronts, which also concentrate and enhance the availability of their preys. They contribute to the feeding of whales and sea birds.
Special oceanographic features, seldom found elsewhere, combine in the Marine Park to generate this whale feeding ground. Anthropogenic pressures and climate change are the main threats to its preservation for the next centuries.
Keywords:
- whale feeding ground,
- critical habitat,
- ecosystem hot spot,
- channel head,
- canyon,
- upwelling,
- currents,
- estuary
Corps de l’article
1. Introduction
Cet article est une synthèse des connaissances océano-graphiques sur le système qui est à la base du fonctionnement du Parc Marin Saguenay–Saint-Laurent (PMSSL) comme site privilégié pour l’alimentation des baleines du nord-ouest Atlantique. Connu des européens depuis plus de 450 ans, alors que les Basques y pratiquaient la chasse à la baleine franche dont ils extrayaient la précieuse huile à des sites sur la Côte-Nord et à l’île aux Basques, où les fours utilisés alors sont encore visibles aujourd’hui, le site d’alimentation des baleines à la tête du chenal Laurentien est, depuis dix ans, classé parmi les habitats uniques à conserver pour la protection des écosystèmes marins au Canada et, en particulier, des baleines (GOUVERNEMENT DU CANADA, 1997; TURGEON, 1994). Qu’est-ce qui maintient ce système en opération depuis si longtemps ?
Cette question, à laquelle est consacré le présent article, n’est pas simplement un fascinant objet de curiosité scientifique justifiant des efforts de recherche particuliers pour percer ce mystère; elle identifie un besoin de compréhension du fonctionnement de cet habitat, qu’il est primordial de combler pour remplir adéquatement la mission de conservation et de protection par les gestionnaires mandatés, Parcs Canada et Pêches et Océans Canada, en se fondant sur de solides connaissances scientifiques. Sans ce savoir, les prises de décisions de planification et de gestion peuvent devenir ardues, artificielles, voire même inadéquates, pour rencontrer les objectifs poursuivis à long, moyen et court termes.
1.1 L’écosystème à grande échelle du PMSSL
Le PMSSL n’est pas un système fermé, isolé et autosuffisant. Il fait partie d’un grand écosystème estuarien qui s’étend depuis la zone Atlantique canadienne jusqu’à l’extrémité des Grands Lacs (Figure 1) sur le continent (EL-SABH et SILVERBERG, 1990; KOUTITONSKY et BUGDEN, 1991; THERRIAULT, 1991). Les forts débits d’eau douce entrant dans ce système entraînent une circulation estuarienne en deux couches, où les eaux de plus faibles salinité et densité de la couche supérieure sont ultimement évacuées vers l’Atlantique, et, inversement, celles de salinité et densité plus élevées pénètrent en profondeur depuis l’Atlantique, jusqu’à plus de 1 000 km en amont de la marge continentale, jusqu’au début de l’estuaire fluvial à l’est de l’île d’Orléans (BOURGAULT et KOUTITONSKY, 1999; EL-SABH, 1979; INGRAM et EL-SABH, 1990). Ce grand estuaire, de la taille d’une mer intérieure, draine un bassin versant de 1,3 x 106 km2, s’étendant de la zone tempérée à la zone boréale. Il est par conséquent fortement marqué par les saisons, incluant un refroidissement hivernal jusqu’à plus de 100 m de profondeur, une période de glace, des crues printanières marquées, des étiages estival et hivernal ainsi que des crues secondaires automnales occasionnelles (BOURGAULT et KOUTITONSKY, 1999; KOUTITONSKY et BUGDEN, 1991). Ce forçage climatique à grande échelle imprime un net patron annuel dans le fonctionnement de l’écosystème à travers toute la chaîne trophique pélagique, du phytoplancton aux mammifères marins (BAILEY et al., 1977; DE LAFONTAINE et al., 1991; JOHNSTON et al., 2005; LAVIGUEUR et al., 1993; LE FOUEST et al., 2005; THERRIAULT et LEVASSEUR, 1985). C’est dans ce contexte écosystémique que s’inscrivent les processus responsables de l’existence et des variabilités spatiale et temporelle du site d’alimentation traditionnel des baleines du PMSSL (Figure 2).
Figure 1
Localisation du grand écosystème dont fait partie le PMSSL dans l’est du Canada, incluant le grand bassin de drainage du Saint-Laurent, l’étendue de la nappe intermédiaire froide (CIL) dans le nord-ouest Atlantique, le « hot spot » traditionnel d’alimentation des baleines du PMSSL à la tête du chenal principal du plateau continental de l’est du Canada, où le krill et le capelan s’agrègent.
Location of the large marine ecosystem (LME) to which belongs the Saguenay–St. Lawrence Marine Park (SSLMP), including the large St. Lawrence drainage basin, the extent of the cold intermediate layer (CIL) in the Northwest Atlantic, the “hot spot” of the traditional whale feeding ground of the SSLMP at the head of the main channel of Eastern Canada continental shelf, where krill and capelin aggregate.
Figure 2
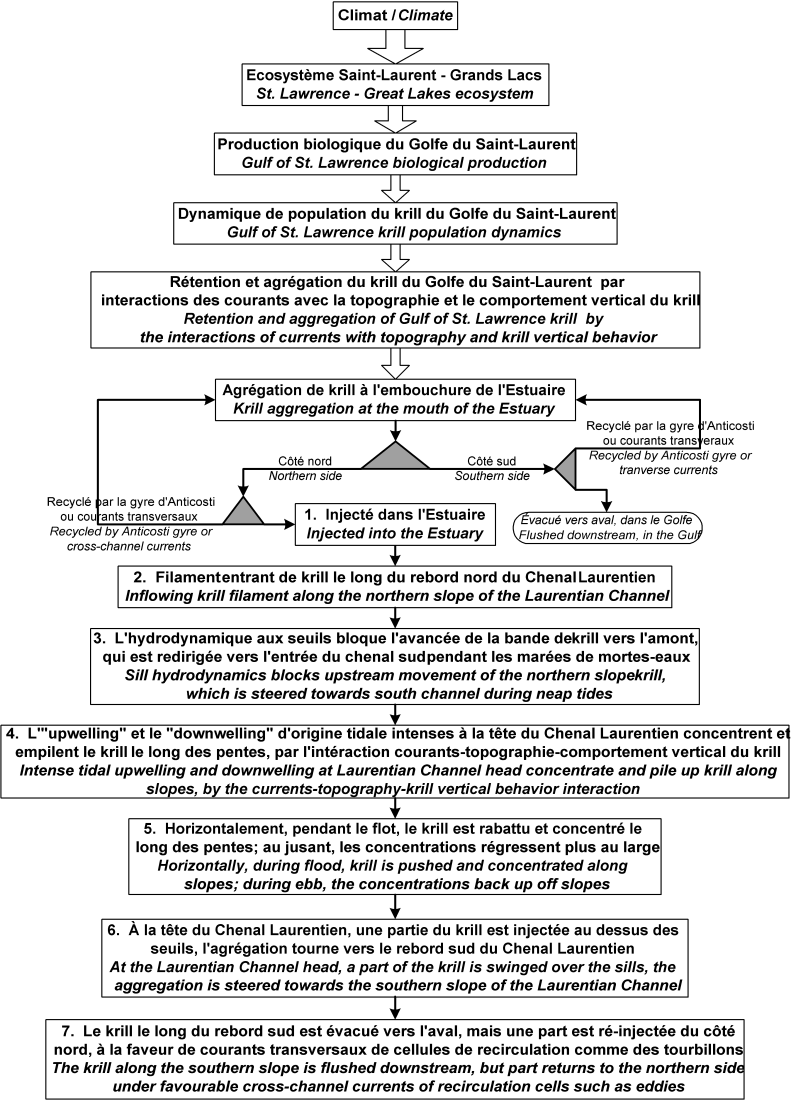
Schéma de la structure hiérarchique des processus écosystémiques et océanographiques responsables de la formation, du maintien et de la variabilité de l’agrégation de krill du site traditionnel d’alimentation des baleines du PMSSL.
Schematic of the hierarchical structure of the ecosystem and oceanographic processes responsible for the formation, persistence and variability of the krill aggregation at the traditional whale feeding ground of the SSLMP.
Le « bloom » printanier (prolifération massive du phyto-plancton) qui démarre immédiatement après la fonte des glaces en avril dans le golfe du Saint-Laurent, en exploitant les éléments nutritifs remis en disponibilité dans la couche photique par le profond mélange vertical encouru depuis l’automne précédent, initie la ponte des espèces zooplanctoniques herbivores dominantes de copépodes et d’euphausides (krill) ayant complété leur diapause (baisse de l’intensité des activités métaboliques) hivernale (DE LAFONTAINE et al., 1991; LE FOUEST et al., 2005; MAUCHLINE, 1980; PLOURDE et RUNGE, 1993; PLOURDE et al., 2001; PLOURDE et THERRIAULT, 2004; ZAKARDJIAN et al., 2003). Ceci amorce le processus de production biologique conduisant à la formation des agrégations de zooplancton et, éventuellement, de leurs prédateurs, poissons pélagiques ou baleines planctivores et piscivores (DE LAFONTAINE et al., 1991; PLOURDE et al., 2001; RUNGE et SIMARD 1990; RUNGE et al., 1999; THERRIAULT, 1991). Ce processus se prolonge dans l’estuaire un à deux mois plus tard, après que le lessivage du bassin hydrographique par la fonte des neiges et la crue printanière se soient complétés, que la turbidité ait diminué et que la couche photique estivale se soit approfondie (THERRIAULT et LEVASSEUR, 1985; THERRIAULT et al., 1990). D’autres pulsions secondaires, de production nouvelle par l’enrichissement de la couche de surface en éléments nutritifs, provenant des nappes profondes sous la couche photique, se produisent au cours de l’été et de l’automne, notamment dans l’estuaire maritime, qui bénéficie de la remise en disponibilité d’éléments nutritifs par le fréquent mélange associé à l’« upwelling » d’origine tidale et sa dynamique frontale à la tête du chenal Laurentien (BOURGAULT et al., 2001; INGRAM, 1983; MERTZ et GRATTON, 1990; SAUCIER et CHASSÉ, 2000; THERRIAULT et LACROIX, 1976; THERRIAULT et al., 1990). L’intensité de ce processus de production primaire et secondaire aux ramifications écosystémiques multiples (p. ex. SAVENKOFF et al., 2004) ainsi que sa synchronisation spatiale et temporelle (p. ex. RINGUETTE et al., 2002; RUNGE et al., 1999) détermineront le succès des cohortes d’organismes fourragers qui alimenteront ultérieurement les sites d’alimentation intensive des baleines, principalement l’année suivante, pour ce qui est du krill, et plus tard, pour les petits poissons pélagiques.
Cette production primaire annuelle et son transfert au niveau secondaire, si intenses et efficaces soient-ils, ne seraient d’aucune utilité pour les prédateurs supérieurs dans la région si le zooplancton n’était pas retenu dans le système. Ceci est particulièrement pertinent pour un système estuarien, tel le Saint-Laurent, dont la circulation générale cyclonique évacue une part importante de ses eaux vers l’Atlantique via la moitié sud-ouest du détroit de Cabot (KOUTITONSKY et BUGDEN, 1991; SAUCIER et al., 2003). Plus important encore pour plusieurs prédateurs, en particulier les baleines à fanons, est le besoin essentiel que ce zooplancton ne soit pas dispersé et inexploitable, mais plutôt concentré dans des lieux et temps prévisibles, où ils peuvent s’alimenter efficacement (ACEVEDO-GUTIÉRREZ et al., 2002; BRODIE et al., 1978; CROLL et al., 2005; KAWAMURA, 1980; MACAULAY et al., 1995; NEMOTO, 1970; SIMARD et LAVOIE, 1999; SIMARD et al., 2003). Conséquemment, deux processus distincts mais interreliés sont impliqués dans la détermination des sites d’alimentation des baleines à fanon : la production et l’accumulation de la biomasse fourragère. La production peut s’opérer sur de grandes échelles spatiales (p. ex. HARVEY et DEVINE, 2007) comme tout le golfe du Saint-Laurent, alors que l’accumulation s’effectue en des sites particuliers du système qui peuvent être, soit très locaux et de courte durée (quelques jours à quelques semaines), soit persistants ou ayant un taux élevé de récurrence dans une même région aux échelles mensuelle, annuelle ou pluriannuelle. Une production défaillante une année peut avoir des conséquences néfastes à grande échelle (p. ex. HARVEY et DEVINE, 2007), mais celle-ci peut, dans certains cas, être compensée par une accumulation soutenue et persistante à des sites privilégiés par leurs caractéristiques océanographiques particulières, qu’on pourrait qualifier de « point chaud » de l’écosystème ou régions d’échanges trophiques intensifs vers les prédateurs supérieurs. Le présent article s’applique à démontrer que cette qualité distingue le site d’alimentation des grandes baleines du PMSSL, à partir des connaissances acquises par un programme de recherche écosystémique multidisciplinaire initié au milieu des années 1990, allant de la physique des eaux aux baleines.
1.2 Composantes structurantes de l’habitat du PMSSL
1.2.1 Topographie
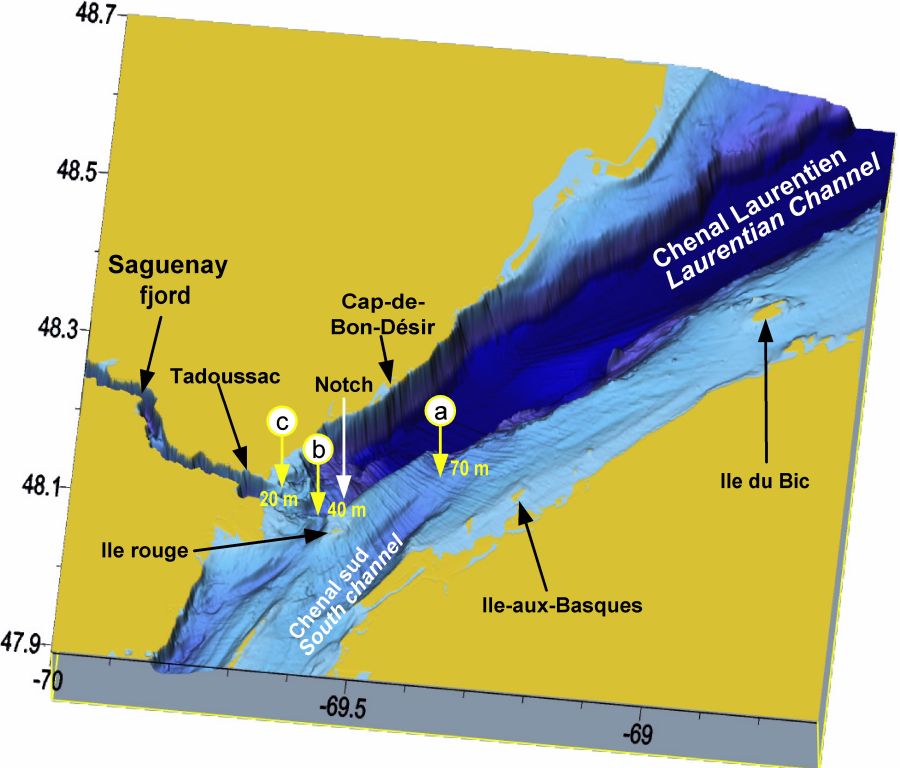
Le site d’alimentation intensive des grandes baleines du PMSSL n’est pas situé dans une région quelconque du système Saint-Laurent, mais à un endroit bien particulier, la tête du chenal principal qui marque le plateau continental dans l’est du Canada et qui importe les eaux salées de l’Atlantique sur 1 240 km, le chenal Laurentien (Figures 1 et 3). La topographie particulière du bassin à cet endroit est la donne fondamentale pour la localisation du site d’alimentation des grandes baleines dans le PMSSL, parce qu’elle est à la base des processus responsables de la concentration et de la rétention du krill dans la région. Si le chenal Laurentien était prolongé plus en amont, l’agrégation de krill et le site d’alimentation des baleines le seraient également. Cette région est aussi à la confluence du fjord du Saguenay, où des hauts fonds forment un seuil qui empêche la communication libre entre les deux bassins en profondeur, sauf par un étroit chenal (Figure 3). Dans ce chenal profond de 20 m, le seuil du Saguenay est un des trois seuils bordant la tête du chenal Laurentien. Ensemble, ces structures jouent un rôle important sur l’agrégation de krill et la concentration de poissons fourragers par leur contrôle de l’hydrodynamique des échanges entre les bassins. Le deuxième seuil, plus profond (40 m) et plus large, où le chenal Laurentien atteint sa limite amont, sépare l’estuaire maritime de l’estuaire moyen (BRUNEL, 1970). Il est à l’extrémité d’une cuvette profonde de 130 m prolongeant le chenal vers l’amont, qui est très fréquentée par l’industrie d’observation des baleines et qu’on appelle le « Notch ». Cette cuvette est bordée par l’île Rouge et son grand banc au sud et les hauts fonds au nord. Le troisième seuil, plus profond encore (70 m), est situé quelques 15 km en aval, dans le chenal sud, à environ 5 km de sa jonction avec le chenal Laurentien, à l’extrémité aval du long banc de l’île Rouge, dans une région appelée « falaise sud » par les bateliers (Figure 3).
Figure 3
La tête du chenal Laurentien (profondeur = ~ 300 m) dans l’estuaire du Saint-Laurent montrant les caractéristiques bathymétriques du bassin et les trois seuils contrôlant les échanges entre le chenal Laurentien et les bassins adjacents. Seuil a = 70 m, seuil b = 40 m, seuil c = 20 m de profondeur.
The head of the Laurentian Channel (depth = ~ 300 m) in the St. Lawrence Estuary showing the basin bathymetric features, and the three sills controlling the exchanges between the Laurentian Channel and the adjacent basins. Sill a = 70 m, sill b = 40 m, sill c = 20 m depth.
1.2.2 Masses d’eau
On distingue trois types de masses d’eau à la tête du chenal Laurentien pendant la période estivale d’alimentation intensive des baleines : 1) les eaux estuariennes superficielles de mélange, relativement chaudes et peu salées, originant de l’amont dans l’estuaire moyen et le Saguenay, chevauchant 2) une nappe intermédiaire froide de quelque 30 à 150 m, nommée CIL (Cold Intermediate Layer), issue principalement du refroidissement hivernal dans le nord-est du golfe et en partie d’entrées nord-atlantiques dans cette région via le détroit de Belle‑Isle (Figure 1), qui recouvre 3) une nappe profonde plus chaude originant de l’Atlantique (BANKS, 1966; BUGDEN, 1991; GALBRAITH, 2006; GILBERT et PETTIGREW, 1997; GILBERT et al., 2005; LAVOIE et al., 1996; SAUCIER et al., 2003; SMITH et al., 2006). Un gradient vertical très net caractérise donc l’habitat pélagique et structure les communautés d’organismes, dont l’adaptation à un segment particulier de ce gradient de plusieurs variables montre une plasticité plus ou moins grande, selon les espèces et leur capacité d’acclimatation à moyen et court termes, notamment au long du cycle annuel.
Ce large gradient d’habitat inclut une communauté tempérée-boréale à boréo-arctique, adaptée aux eaux froides (< ~ 2 °C), qui comprend des espèces fourragères clés du site d’alimentation des baleines du PMSSL, en particulier l’espèce de krill boréo-arctique dominante, Thysanoessa raschi, et le poisson-fourrager circumpolaire, le capelan, Mallotus villosus (BAILEY et al., 1977; BRUNEL et BOSSÉ, 2000; CARSCADDEN et VILHJÁLMSSON, 2002; DESCROIX et al., 2005; DUNBAR, 1964; PLOURDE et al., 2002; RUNGE et SIMARD, 1990; SIMARD et al., 1986a). Ces espèces sont étroitement associées à l’écosystème de la nappe intermédiaire froide, dont la limite ouest en amont dans l’estuaire se situe dans la région de la tête du chenal Laurentien (Figure 1).
1.2.3 Circulation, « upwelling » et fronts
À la tête du chenal Laurentien, des remontées de la nappe intermédiaire froide jusqu’en surface sont engendrées par le déplacement semi-diurne de la masse d’eau du chenal Laurentien, qui remonte pendant le flot contre l’obstacle que constituent les seuils à la tête du chenal, avec une intensité qui fluctue avec le cycle semi-mensuel de vives‑eaux / mortes‑eaux des marées (SAUCIER et CHASSÉ, 2000; SERVICE HYDROGRAPHIQUE CANADIEN, 1997; THERRIAULT et LACROIX, 1976). Cet « upwelling » d’origine tidale engendre une marée interne, dont l’amplitude peut dépasser 100 m (THERRIAULT et LACROIX, 1976), qui se propage vers l’aval dans le chenal Laurentien (FORRESTER, 1974; MERTZ et GRATTON, 1990; SAUCIER et CHASSÉ, 2000). L’insertion des eaux froides de la CIL à travers celles de surface ou sub-superficielles se traduit par la création de fronts au pourtour tridimensionnel de la masse d’eau froide, qui se mélangent localement avec les eaux estuariennes, ce qui contribue ainsi à son érosion (BOURGAULT et al., 2001, 2005; GILBERT et PETTIGREW, 1997; INGRAM, 1976, 1985; PÊCHES ET OCÉANS CANADA, 1997; SAUCIER et CHASSÉ, 2000; SMITH et al., 2006). Des fronts particulièrement marqués sont ceux du Saguenay lors de la subduction de la masse d’eau d’« upwelling » dans le fjord au flot, suivi par son retrait et l’injection du panache saumâtre du fjord dans l’estuaire au jusant (INGRAM, 1979, 1985; INGRAM et EL-SABH, 1990; SAUCIER et CHASSÉ, 2000). Une part de ces eaux de mélange est évacuée par le courant sortant de l’estuaire du côté sud, lui aussi délimité au nord par une structure frontale longitudinale (INGRAM et EL-SABH, 1990), particulièrement lors des « upwellings » intenses en vives‑eaux (GRATTON et al., 1988; INGRAM, 1985; SAUCIER et CHASSÉ, 2000). Un gradient transversal des masses d’eau et de la circulation moyenne marque donc la tête du chenal Laurentien, comme le reste de ce large estuaire, les eaux entrant du côté nord, plus intensivement au voisinage du rebord du chenal, et sortant du côté sud selon un patron cyclonique (p. ex. EL-SABH, 1979; KOUTITONSKY et BUGDEN, 1991; LAVOIE et al., 2000; SAUCIER et CHASSÉ, 2000). Ce gradient est renforcé par les vents dominants d’ouest, créant un empilement du côté sud et un « upwelling » du côté nord. Des circulations transversales et des tourbillons se manifestent à l’occasion, favorisant alors les échanges entre les deux côtés du chenal (INGRAM et EL-SABH, 1990; KOUTITONSKY et BUGDEN, 1991; LAVOIE et al., 2000; LIE et EL-SABH, 1983; MERTZ et GRATTON, 1990).
Cette spécificité topographique et océanographique de la tête du chenal Laurentien, à l’intérieur du grand écosystème marin du Saint-Laurent, que les recherches des dernières décennies ont permis de mettre à jour, définit le cadre de référence du site traditionnel d’alimentation des grands rorquals dans le PMSSL. Les prochaines sections résument notre compréhension actuelle de l’action conjuguée de ces facteurs dans la mise en place d’un site d’alimentation exceptionnel des baleines persistant dans cette région de l’estuaire du Saint‑Laurent depuis des siècles (Figure 2).
2. Méthodes
Mettre en évidence des processus océanographiques complexes comme ceux décrits ci-dessus, caractérisés par un haut niveau de variabilité dans l’espace et dans le temps, requiert des moyens d’échantillonnages à haute résolution permettant de résoudre les structures tridimensionnelles des propriétés physiques et biologiques des masses d’eau et suivre leurs fluctuations dans le temps, notamment au cours du cycle de marée dans un estuaire. Les seuls moyens actuellement disponibles pour répondre à ce besoin et pénétrer instantanément la masse d’eau, depuis la surface jusqu’au fond, et en fournir des mesures en temps réel, sont les technologies d’acoustique sous-marine. La méthodologie acoustique pour détecter, identifier et estimer les biomasses de poisson et de zooplancton (SIMMONDS et MCLENNAN, 2005) ainsi que la mesure de la structure des courants par courantométrie à effet Doppler, ont donc été couplées aux relevés océanographiques traditionnels (plongées de sondes de température, salinité, échantillons d’eau à plusieurs profondeurs, etc.) et à des pêches de validation, avec des engins appropriés pour les divers types d’organismes ciblés, afin d’acquérir les banques d’observations nécessaires pour adéquatement aborder la compréhension des processus régissant le fonctionnement de ce site d’alimentation des baleines. Les détails de ces méthodes et du matériel utilisé sont fournis dans SIMARD et LAVOIE (1999) et SIMARD et al. (2002, 2003). Ces méthodes fournissent une vue quasi synoptique de la structure tridimensionnelle correspondant à la période des observations (Figure 4). Cependant, pour en comprendre la dynamique dans le temps et l’espace, il faut combiner ces observations à une modélisation de l’hydrodynamique à l’aide de modèles numériques tridimensionnels à haute résolution, tels ceux développés pour l’estuaire et le golfe du Saint-Laurent (SAUCIER et CHASSÉ, 2000; SAUCIER et al., 2003). Nous avons donc utilisé ces modèles pour interpréter les observations et pour simuler les processus d’agrégation, dispersion et advection du krill en y introduisant un modèle biologique de comportement du krill sur le plan vertical. Les détails de ces méthodes sont fournis dans LAVOIE et al. (2000) et SOURISSEAU et al. (2006, 2008).
Figure 4
Cartes de distribution de la biomasse de krill et de capelan à la tête du chenal Laurentien en juillet 1994 à partir d’une série de sections relevées par hydroacoustique multifréquence et schéma de la circulation hydrodynamique tridimensionnelle impliquée dans la formation de l’agrégation de krill, contenant environ 100 000 t lors de ce relevé ; noter (en jaune) le courant d’import entrant le long du talus nord et celui d’export sortant du côté sud, le courant traversant vers le chenal sud en mortes‑eaux, dû au blocage aux seuils amonts, les courants d’« upwelling » et de « downwelling » (en rouge) (détails dans SIMARD et LAVOIE 1999; LAVOIE et al., 2000; SIMARD et al., 2002).
Maps of the krill and capelin biomasses at the head of the Laurentian Channel in July 1994 from a series of multi-frequency hydroacoustic cross-sections and schematic representation of three-dimensional circulation patterns involved in the formation of the krill aggregation, which amounted to 100,000 t during this survey; note (in yellow) the import current flowing upstream along the northern slope and the export current flowing downstream along the southern slope, the cross-channel current directed towards the southern channel as a result of the blocking at the upstream sills during neap tides, and the tidal upwelling and downwelling currents (in red) (details in SIMARD et LAVOIE 1999; LAVOIE et al., 2000; SIMARD et al., 2002).
3. Résultats et discussion
3.1 Le krill âgé de deux ans
Parmi les cinq espèces de krill (euphausiacés) qu’on rencontre dans le Saint-Laurent (BRUNEL et al., 1998), deux espèces seulement composent l’essentiel de la biomasse qui s’accumule à la tête du chenal Laurentien : Thysanoessa raschi et Meganyctiphanes norvegica (DESCROIX et al., 2005; SIMARD et LAVOIE, 1999; SIMARD et al., 1986a,b). Occasionnellement, l’espèce Thysanoessa inermis est présente en faible nombre. SAMEOTO (1976) et SIMARD et al. (1986a) ont montré que ces deux espèces se partageaient l’habitat pélagique dans l’estuaire maritime pendant le jour en fonction de la température et de la profondeur ; T. raschi préférant les températures de 0 à 2 °C, qu’on rencontre aux profondeurs inter-médiaires, et M. norvegica, préférant les températures légèrement plus chaudes (2 à 5 °C) des eaux atlantiques sous‑jacentes.
Une caractéristique singulière des euphausides dans la région du PMSSL est leur grande taille, correspondant essentiellement à la cohorte de deuxième année pour les deux espèces (SIMARD et LAVOIE, 1999; SIMARD et al., 1986b). Pour expliquer la quasi-absence locale des individus de la première année, qu’on retrouve en plus grande abondance dans l’ouest du golfe du Saint-Laurent (BERKES, 1976), un processus de sélection spatiale doit être invoqué.
3.2 Le tri spatial du krill, genèse d’une hypothèse
Dans son travail sur l’écologie des euphausides du système Saint-Laurent, BERKES (1976) a jeté les premiers jalons de ce processus de dispersion spatiale. Il observe que les larves des trois espèces, dont la distribution adulte est centrée dans l’ouest du golfe et l’estuaire maritime, se concentrent sur le plateau madelinien dans le sud du golfe. Il invoque alors la circulation estuarienne en deux couches du golfe, combinée avec l’écologie du développement de l’oeuf à l’adulte (l’ontogénie), pour expliquer cette différence de distribution entre les adultes et les larves. Les larves, étant sous l’influence du courant de surface sortant, seraient transportées sur le plateau madelinien alors que les adultes, qui se maintiennent en profondeur le jour et effectuent des migrations verticales circadiennes en surface la nuit (LACROIX, 1961) depuis que leurs appendices natatoires se sont développés (âge > ~ 4-6 mois), seraient transportés dans la direction opposée par le courant remontant le chenal Laurentien vers l’ouest. Cette première hypothèse de fonctionnement, selon un estuaire simple à deux dimensions, définissant la production de krill de l’estuaire maritime et du golfe du Saint-Laurent dans un système interconnecté, où la circulation estuarienne stratifiée en deux couches, vers l’aval en surface et vers l’amont en profondeur, est responsable d’un tri des individus en fonction de leur âge, selon qu’ils habitent près de la surface ou plutôt en profondeur, s’est avérée bien fondée, non seulement pour le krill mais aussi pour plusieurs autres espèces de zooplancton (DESCROIX et al., 2005; PLOURDE et al., 2002; RUNGE et SIMARD, 1990; ZAKARDJIAN et al., 1999, 2003).
3.3 L’organisation spatiale du krill
Des travaux pionniers de l’utilisation d’échosondeurs à hautes fréquences pour détecter les petits organismes dans la colonne d’eau, comme le macrozooplancton et le micronecton de quelque 1 cm à plus de 20 cm, ont montré que des couches acoustiques denses à 120 kHz, composées en grande part de krill, se retrouvaient dans le nord-ouest du golfe et l’estuaire maritime, au nord de la péninsule gaspésienne, et dans le chenal Anticosti, au nord de l’île du même nom (SAMEOTO, 1976). Confirmant les observations ponctuelles de BERKES (1976) avec des filets à plancton, ces observations sont les premières à montrer que le krill est agrégé en couches à des profondeurs intermédiaires, et que ces couches montrent des régions de forte densité, où des échantillons ont révélé des concentrations atteignant plus de 67 ind.•m‑3, soit 4,5 t•km‑3 en poids humide, et plus encore par endroits, notamment le long de la péninsule gaspésienne à l’embouchure de l’estuaire maritime (SAMEOTO, 1980, 1983).
Des observations acoustiques, réalisées dans la moitié amont de l’estuaire maritime en 1982, ont permis de mettre en évidence que les couches acoustiques de krill se concentraient le long du rebord du chenal Laurentien, principalement du côté nord, et que les agrégations les plus denses étaient situées aux environs des Escoumins et à la tête du chenal Laurentien (SIMARD et al., 1986a). Des mesures complémentaires de suivi des migrations verticales des couches acoustiques de krill, réalisées pendant cette même période (SIMARD et al., 2006a), ont permis de constater que la profondeur du fond où les couches disparaissaient en s’approchant de la côte depuis le large, correspondait à la profondeur où se trouvait le dessus des couches de krill sur le plan vertical pendant le jour. Ces observations ont permis de formuler une hypothèse pour expliquer la formation d’agrégations de krill à la tête du chenal Laurentien dans l’estuaire maritime et le long de la Côte-Nord. Elle implique le comportement des organismes combiné à la circulation hydrodynamique tridimensionnelle. Elle fait appel au fait que les organismes évitent un niveau donné de lumière, appelé niveau barrière (qui varie selon les espèces), qui les pousse à se réfugier des prédateurs visuels dans l’obscurité des profondeurs pendant le jour. Lorsque les courants amènent les organismes à remonter le long d’une pente bathymétrique, comme les rebords d’un chenal ou d’un banc sous-marin, lorsqu’ils atteignent le niveau de la barrière de lumière qu’ils évitent, ils combattent le courant vertical en nageant vers le bas. Ainsi, ils finissent par s’accumuler le long de la structure topographique, au voisinage de la profondeur du fond, jusqu’où pénètre la barrière de lumière pendant le jour (cf. RUNGE et SIMARD, 1990; SIMARD et al., 1986a,b). L’accumulation préférentielle le long de la Côte‑Nord est alors expliquée par l’« upwelling » dû aux vents dominants d’ouest, qui entraînent un courant en profondeur dirigé vers la Côte‑Nord, que renforce l’effet Coriolis sur le courant remontant en profondeur vers l’amont de ce côté de l’estuaire. Parce que la circulation résiduelle estuarienne suit une structure cyclonique à la tête du chenal Laurentien, l’agrégation de krill vire d’une direction vers l’amont du côté nord à une direction vers l’aval du côté sud, avec une intensité variant en fonction de la marée (cf. Figure 10 dans SIMARD et al. (1986a).
Cette seconde contribution au mécanisme de formation et de maintien de l’agrégation de krill du PMSSL fait intervenir un couplage de composantes biologiques et physiques, mais il reste encore plusieurs inconnues pour comprendre le fonctionnement précis d’approvisionnement en krill et sa dynamique de concentration et de dispersion dans le PMSSL à diverses échelles spatio-temporelles, notamment sous l’influence de la marée.
3.4 Hydrodynamique de l’agrégation du krill
Des missions océanographiques et acoustiques répétées au cours des étés 1994-95 (Figure 4) ont permis de mieux cerner les processus océanographiques régissant le site d’alimentation intensive des baleines du PMSSL et de mesurer sa richesse par rapport aux agrégations de krill connues dans le monde (LAVOIE et al., 2000; SIMARD et LAVOIE, 1999). Ces travaux ont montré que le PMSSL renfermait la plus riche agrégation de krill du nord-ouest Atlantique, pouvant contenir jusqu’à 100 000 t de krill dans une petite région de seulement 1 319 km2 à la tête du chenal Laurentien, avec des densités atteignant 73 t•km-2 (SIMARD et LAVOIE, 1999). Environ la moitié de cette biomasse avait des densités volumiques de plus de 5 t•km-3, suffisamment élevées pour être exploitables efficacement par les baleines (MACAULAY et al., 1995; NEMOTO, 1970). Les noyaux les plus denses de l’agrégation avaient une forme allongée dans l’axe du chenal et une taille de quelque 10 km2, représentant ainsi une biomasse locale minimale de 100 t, pouvant nourrir plusieurs rorquals pendant plusieurs jours. Des travaux récents proposent un nouveau facteur de conversion des valeurs acoustiques en biomasse de krill (DEMER et al., 2008). Son utilisation augmenterait par un facteur 1,3 les valeurs de biomasse mentionnées ci-dessus. La grande productivité de l’estuaire maritime en phytoplancton et petit zooplancton permet de supporter une telle biomasse de krill (voir SIMARD et al., 1986b).
L’agrégation et ses noyaux se déforment et se déplacent sous l’action des courants de marée et la variation de leur intensité au cours du cycle semi-mensuel. On a observé qu’en période de mortes‑eaux, le coeur de l’agrégation avait tendance à se situer au niveau du Cap-de-Bon-Désir au large du seuil a (Figures 3 et 4), alors qu’en vives‑eaux, l’agrégation était allongée plus en amont (LAVOIE et al., 2000). L’analyse a révélé que ces variations étaient reliées à l’hydrodynamique tidale aux trois seuils, à la tête du chenal (Figure 3). Les volumes d’eau de la nappe de profondeur où le krill est concentré, qui passent au‑dessus des seuils, varient avec le cycle semi-mensuel de marée. En période de vives‑eaux, l’eau est puisée plus profondément, en réponse aux courants plus forts, et plus d’eau est transportée vers l’amont au-dessus des seuils b et c (Figure 3), ce qui fait avancer l’agrégation, alors qu’en période de mortes‑eaux, le courant est trop faible pour puiser efficacement dans les eaux profondes de la couche de krill et ces eaux sont « bloquées » à l’amont. Le courant dans la couche de krill tourne alors vers le seuil a du chenal sud (Figures 3 et 4). Plus profond que les seuils amont b et c, il permet le pompage de la couche de krill malgré le faible courant de mortes‑eaux, créant ainsi un coeur d’agrégation plus en aval (Figure 4). L’effet du cycle saisonnier sur la stratification de la masse d’eau et la variation du débit d’eau douce sur cette dynamique de pompage est un élément qui mérite une investigation approfondie.
La biomasse totale de l’agrégation de krill du PMSSL peut varier rapidement par un facteur de deux à trois en quelques jours (SIMARD et al., 1999). Comme il s’agit de variations de milliers de tonnes, ça ne peut pas être dû à la consommation par les rorquals ou d’autres prédateurs. Le couplage avec les résultats d’un modèle hydrodynamique a montré que la circulation était responsable de ces fluctuations, le krill étant échangé avec les régions voisines, particulièrement le chenal Laurentien en aval de l’île du Bic (Figure 3) (LAVOIE et al., 2000). Des courants transversaux à différentes profondeurs, où le krill peut se trouver au cours du cycle circadien, contribuent à retenir une partie du krill dans la région, et la circulation cyclonique compense en moyenne les pertes le long du rebord sud du chenal par un import le long du talus nord (Figure 5). Pendant les périodes de raréfaction, le krill n’est plus concentré qu’en quelques noyaux (LAVOIE et al., 2000), ce qui pourrait expliquer la concentration de tous les rorquals bleus présents, consommateurs stricts de krill, dans un même petit secteur pendant plusieurs jours, tel qu’il fut observé en août 1994.
Figure 5
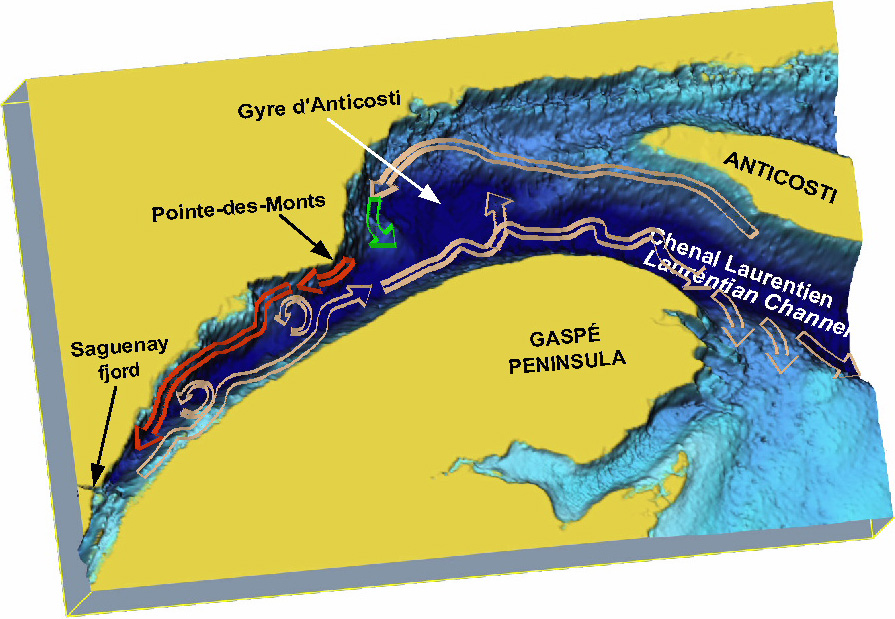
Schéma de la circulation moyenne et des courants de talus impliqués dans le transport à grande échelle du krill dans le nord-ouest du golfe et l’estuaire maritime du Saint-Laurent. Le vecteur rouge est le courant d’import qui alimente l’agrégation de krill du PMSSL. Le vecteur vert représente le mode de circulation à l’embouchure de l’estuaire lorsque la circulation dans ce secteur de la gyre d’Anticosti est fortement orientée vers la péninsule gaspésienne et qu’il n’y a pas d’injection de krill dans l’estuaire (voir Figure 6). Les méandres dans les vecteurs représentent une caractéristique d’échelle moyenne inhérente à ces courants, qui présentent occasionnellement des tourbillons de méso-échelle, comme illustrés.
Schematic representation of the mean circulation and slope currents involved in the large-scale transport of krill in the Northwestern Gulf and Lower St. Lawrence Estuary. The red vector is the import current feeding the SSLMP krill aggregation. The green vector represents the circulation mode at the mouth of the Estuary when that limb of the Anticosti gyre circulation is strongly oriented towards the Gaspé Peninsula and there is no krill injection into the Estuary (see Figure 6). The meanders in the vectors represent the inherent meso-scale characteristic of these flows, which occasionally present meso-scale eddies as illustrated.
Le mécanisme de concentration du krill le long des structures topographiques, par l’action des courants de marée remontant les talus au flot et amenant le krill à se concentrer sous la barrière de lumière, a été démontré le long du banc de l’île Rouge par COTTÉ et SIMARD (2005). Ces riches « barres » de krill qui se forment le long du banc pendant le flot sont déportées ensuite dans le chenal pendant le jusant, où elles persisteront tant que les mécanismes de dispersion ne les auront pas dissoutes. Ce puissant mécanisme de concentration du krill, qui se répète à chaque cycle semi-diurne de la marée, agit partout le long des pentes, notamment celles des longs chenaux qui marquent le golfe (p. ex. Figure 6, cf. SOURISSEAU et al., 2006). Il est augmenté à la tête du chenal Laurentien par un processus d’empilement des couches de krill par les forts « upwellings » et « downwellings » (plongée des eaux en profondeur) répétés (LAVOIE et al., 2000). Le krill qui a été remonté vers la surface pendant le flot s’est mélangé avec des eaux de remontée plus denses que celles où il se trouvait. Pendant le fort « downwelling » du jusant, il est entraîné avec la masse d’eau dense dans laquelle il se trouve, jusqu’à des profondeurs plus grandes que celles où il était initialement. Il s’insère alors en dessous du reste du krill, qui a moins subi la remontée au flot, créant ainsi un empilement des couches de krill sur des profondeurs pouvant atteindre 200 m (cf. LAVOIE et al., 2000).
Figure 6
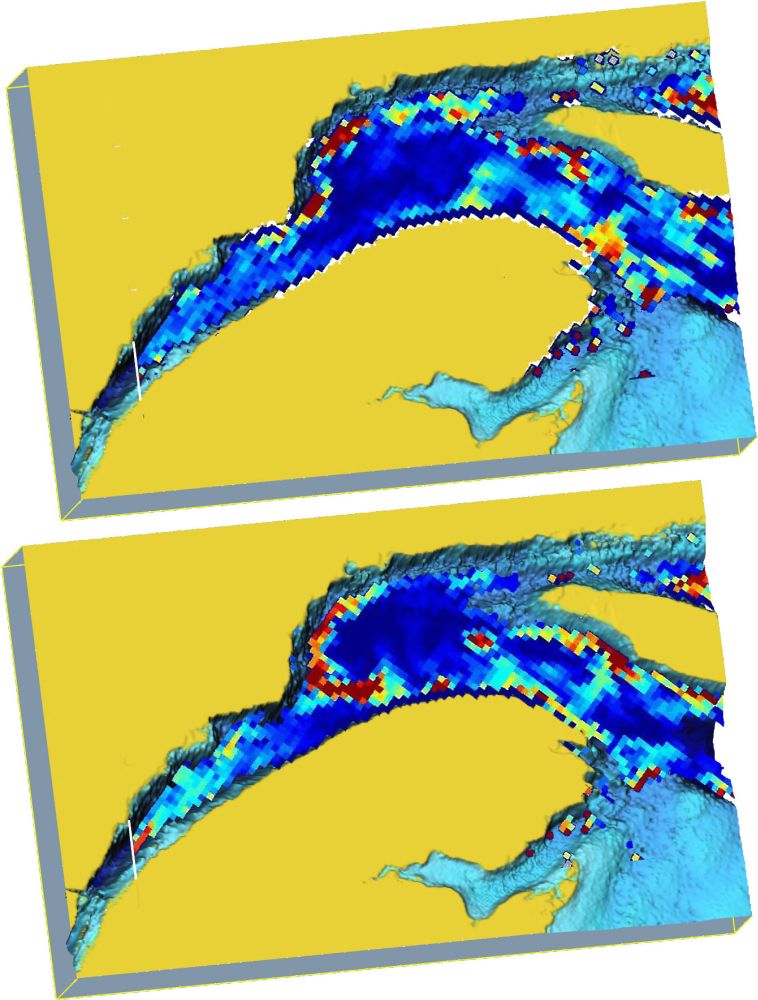
Exemples des deux types de conditions à l’embouchure de l’estuaire où le krill est soit injecté dans l’estuaire (en haut) ou soit recirculé dans la gyre d’Anticosti (en bas), d’après les simulations de SOURISSEAU et al. (2006). Les couleurs des cellules du modèle indiquent les densités relatives de krill intégrées verticalement selon une palette augmentant du bleu (faible) au rouge (élevé).
Examples of the two types of conditions at the mouth of the estuary when the krill is either injected into the Estuary (top) or recirculated in the Anticosti gyre (bottom), from SOURISSEAU et al. (2006) simulations. The model cell colors indicate the relative krill densities integrated vertically according to a palette increasing from blue to red.
Avec ces nouveaux travaux, nos connaissances sur le pro-cessus d’agrégation du krill se sont enrichies. On a démontré le fort lien entre l’agrégation et la circulation de courants moyens et de marées, qui agissent dans un système d’import / export selon un parcours cyclonique régissant l’abondance globale de l’agrégation, mais qui aussi concentrent et empilent le krill dans la région. Cela densifie ainsi l’agrégation et augmente le taux de rétention local du krill, lequel bénéficierait aussi d’échanges transversaux au cours du cycle de marée. On a également mis en évidence le rôle des trois seuils du bassin dans le contrôle de l’agrégation et la localisation de son centre de densité dans le chenal Laurentien. Si on comprend mieux maintenant le processus d’agrégation à l’échelle locale, le processus source à grande échelle reste cependant encore flou.
3.5 Modélisation de l’agrégation du krill à l’échelle du golfe
Pour cerner les éléments directeurs du couplage à grande échelle avec le krill du golfe du Saint-Laurent, des simulations numériques ont été réalisées (SOURISSEAU et al., 2006). Un modèle de comportement vertical du krill face à la lumière a été couplé au modèle de circulation tridimensionnel du golfe et de l’estuaire du Saint-Laurent (SAUCIER et al., 2003), afin de comprendre la dynamique d’agrégation et de dispersion du krill à l’échelle de tout le système et les facteurs déterminant l’approvisionnement de l’agrégation du PMSSL. Ces simulations ont confirmé que le premier processus d’agrégation provient de l’interaction des courants de marée avec les rebords des chenaux, discuté précédemment et démontré par COTTÉ et SIMARD (2005). Les concentrations qui se forment le long de ces structures bathymétriques sont ensuite prises en charge par la circulation moyenne régionale pour former des agrégations à des sites récurrents d’année en année, notamment dans le nord-ouest du golfe, entre l’île d’Anticosti et l’embouchure de l’estuaire, au pourtour du bassin de la grande gyre d’Anticosti (p. ex. Figure 6). C’est là que s’approvisionne l’agrégation de krill du PMSSL.
L’étude du transport du krill, à travers la section à l’embouchure de l’estuaire, a montré que le krill doit pénétrer dans l’estuaire par le côté nord, à la faveur d’épisodes où la gyre est moins intense et le courant côtier est entrant dans les nappes intermédiaire et profonde où se trouve le krill (Figures 5 et 6). La condition supplémentaire qui doit être remplie est qu’une agrégation soit présente du côté nord dans les eaux entrantes, ce qui n’est pas toujours le cas selon les trois années simulées par SOURISSEAU et al. (2006). Ce passage franchi, le krill « injecté » est alors pompé le long de la Côte‑Nord par la circulation résiduelle cyclonique, jusqu’à la tête du chenal Laurentien. Autrement, il est soit ramené dans le courant entrant après avoir recirculé dans la gyre, ou sous l’effet de courants transversaux vers le nord un peu plus en aval de celle-ci (Figure 5), soit transporté vers l’aval et piégé dans le bassin au bout de la péninsule gaspésienne vers l’est, soit évacué plus en aval vers l’Atlantique (Figures 2, 5 et 6).
À long terme, ce système de circulation entraîne une concentration progressive du krill dans l’estuaire, qui a varié d’un facteur deux à quatre annuellement lors des trois années simulées. L’import de la CIL dans l’estuaire, plus faible en automne et en hiver et marqué d’un pic printanier, imprime des fluctuations dans le taux de concentration. Cependant, la relation n’est pas toujours nette parce que les deux composantes mentionnées plus haut, transport entrant dans l’estuaire et présence de krill dans la zone source, doivent se conjuguer. La dépendance de ce système de circulation à l’embouchure de l’estuaire à la vigueur du courant de Gaspé, aux débits d’eau douce, aux marées semi-mensuelles, au forçage dû au vent et à l’« upwelling » à la pointe des Monts sur la Côte-Nord, implique des fluctuations à méso-échelle non négligeables (SMITH et al., 2006; SOURISSEAU et al., 2006).
3.6 Structure transversale du courant dans l’estuaire
Les résultats des simulations ont montré que le choix des paramètres du modèle biologique de migrations verticales circadiennes du krill était crucial pour la rétention et la concentration du krill dans l’estuaire. Le courant moyen dans la nappe de surface évacuant les organismes qui s’y trouvent vers l’Atlantique, le krill doit y passer moins de 4 h en moyenne pendant la nuit pour ne pas être évacué de l’estuaire (SOURISSEAU et al., 2006; ZAKARDJIAN et al., 1999). Comme la durée des nuits aux latitudes du Saint-Laurent est toujours plus grande que 4 h et qu’on observe du krill dans la nappe de surface du coucher au lever du soleil, d’autres éléments sont nécessaires pour expliquer comment le krill se concentre dans l’estuaire. Sur une base individuelle, le krill qui migre la nuit dans la nappe de surface pour s’y alimenter pourrait n’y séjourner que le temps requis pour la prise de nourriture avant de retourner en profondeur pour digérer, comme suggéré par SIMARD et al. (1986b).
Pour vérifier cette hypothèse, une mission intensive a été réalisée pour comprendre la dynamique fine des migrations verticales circadiennes du krill dans l’estuaire (SOURISSEAU et al., 2008). Des instruments ont aussi été mouillés pour suivre ces migrations pendant plusieurs mois au cours de deux années. Les résultats ont confirmé cette hypothèse de prise de nourriture rapide (< ~ 1-3 h) dans la nappe de surface et du retour d’une partie du krill en profondeur pendant la nuit, lui permettant ainsi d’échapper à l’évacuation vers l’aval. Ce krill soumis au courant moyen vers l’amont de la couche de profondeur de la circulation estuarienne en deux couches, est retenu dans le système et aura tendance à se concentrer à l’amont. Cependant, comme les travaux ont aussi montré que la plus grande part de la biomasse totale de krill est présente dans la nappe de surface la nuit, une fraction plus importante du krill a de fortes chances d’être graduellement évacuée vers l’aval. Les simulations effectuées avec le courant sur toute la section à l’embouchure de l’estuaire et une distribution verticale du krill, tel qu’il est observé au cours du cycle de migration circadienne, confirment qu’en moyenne le krill tendrait à être évacué vers l’aval (SOURISSEAU et al., 2008). Par contre, lorsqu’on utilise le courant sur la partie nord seulement, alors on obtient un transport moyen du krill vers l’amont. L’entrée du krill par le côté nord est donc essentielle pour la genèse de l’agrégation de krill du PMSSL (Figures 2, 5 et 6).
Ces travaux montrent donc : 1) qu’une part du krill s’affranchit de l’effet d’évacuation vers l’aval en ne séjournant que très peu de temps dans la nappe de surface pour s’y alimenter la nuit et 2) que la structure transversale de la circulation estuarienne de l’estuaire, avec le courant entrant le long du rebord nord du chenal, est essentielle pour importer le krill concentré dans la gyre vers l’estuaire maritime ; un courant uniforme du nord au sud exporterait le krill. L’import à partir de la source dans le golfe se ferait donc par un étroit courant de talus le long du côté nord du chenal où le krill se concentre. Le monitorage de ce courant et son contenu en krill permettrait de suivre l’approvisionnement de l’agrégation de krill du PMSSL.
3.7 Autres composantes de l’écosystème
D’autres espèces de zooplancton sont aussi présentes dans les couches de krill qu’on détecte par acoustique. Les plus abondantes sont les copépodes du genre Calanus sp., dont les tailles adultes sont seulement de quelque 2 à 9 mm (cf. PLOURDE et al., 2002; RUNGE et SIMARD, 1990). D’autres de plus grande taille et plus rares, mais parfois d’abondance notable, sont les Chaetognathes, les amphipodes hypérides, dont l’espèce Themisto libellula associée à la CIL, ainsi que plusieurs autres espèces de méso- et macro‑zooplancton (p. ex. DESCROIX et al., 2005; HARVEY et DEVINE, 2007). Bien que les baleines s’alimentant dans les couches riches en biomasse zooplanctonique dans le PMSSL ciblent vraisemblablement le krill, la « maille » formée par le tapis interne de leurs fanons étant adaptée pour retenir ces plus grandes tailles d’organismes zooplanctoniques, une part de ce zooplancton auxiliaire des couches de krill contribue sans doute à leur diète. La baleine noire, Eubalaena glacialis et la baleine boréale, Balaena mysticetus, qui fréquentaient le Saint-Laurent aux siècles derniers, sont deux espèces dont le système de filtration est adapté pour exploiter efficacement les copépodes. On sait que les Calanus sp. sont abondants dans le nord-ouest du système Saint-Laurent (p. ex. HARVEY et DEVINE, 2007) et que leur comportement de migrations verticales circadiennes de la larve à l’adulte ressemble à celui du krill, ce qui favorise un système de rétention et de concentration vers l’ouest comme pour le krill (PLOURDE et al., 2002; RUNGE et SIMARD, 1990; ZAKARDJIAN et al., 2003).
Cet abondant zooplancton concentré dans l’ouest du système favorise la présence d’autres prédateurs planctivores tels les poissons pélagiques, notamment le capelan, l’espèce fourragère principale du nord-ouest Atlantique, ainsi que le lançon, le hareng (dont un stock vient frayer dans le PMSSL le printemps et l’automne, cf. MUNRO et al., 1998) et le maquereau. On sait depuis les années 1970 que le capelan est présent en été et en hiver à la tête du chenal Laurentien, notamment sur les hauts fonds à l’entrée du Saguenay (cf. SIMARD et al., 2002). La biomasse maximale rencontrée lors des relevés acoustiques de 1994 et 1995 a été estimée à 4 500 t, soit environ 20 fois moins que la biomasse maximale de krill (SIMARD et al., 1999, 2002). Ces petits poissons fourragers, dont s’alimentent plusieurs espèces de mammifères marins, forment des agrégations en couches et des bancs près de la surface et en profondeur, notamment sur les hauts fonds à la tête et au pourtour du chenal Laurentien, et sont souvent trappés dans les systèmes frontaux (MARCHAND et al., 1999; MÉNARD, 1998; SIMARD et al., 2002). Lors du flot, les courants les rabattent le long des talus, en particulier dans le « Notch » au seuil b (Figures 2 et 3), avant de les repousser au‑dessus des seuils et des hauts fonds (Figure 7). C’est aussi pendant le flot que les rorquals s’alignent le plus le long du rebord du chenal (p. ex. MICHAUD et GIARD, 1998), vraisemblablement en réponse à ce rabattage par les courants (SIMARD et al., 2002). La biomasse de capelan présente dans la région après le frai (qui survient en mai et où le pic annuel de biomasse doit être atteint) est très variable selon les estimations acoustiques réalisées (SIMARD et al., 2002). Des échanges rapides avec les régions avoisinantes, notamment à l’amont, en particulier le bassin d’entrée du Saguenay, contribuent à ces fluctuations. Des cellules de rétention tidales par les courants et le comportement du capelan ont été invoquées pour expliquer sa persistance sur les hauts fonds à la tête du chenal. L’« upwelling » d’origine tidale y apporte une abondance de proies zooplanctoniques, dont la détectabilité par ces prédateurs visuels est rehaussée par l’élévation du zooplancton vers la surface à chaque marée (SIMARD et al., 2002). Cette localisation du capelan sur les hauts fonds est ainsi avantageuse pour leur alimentation (cf. MÉNARD, 1998).
Figure 7
Illustration de la concentration du capelan sur les pourtours de la tête du chenal Laurentien pendant le flot alors que les courants sont vers l’amont sur presque toute la masse d’eau et accélérés dans les régions des seuils. Le schéma tridimensionnel indique, en rouge, le capelan rabattu sur les talus par les courants remontant la pente. Les échogrammes montrent avec une palette augmentant du bleu au rouge : le capelan concentré dans le « Notch », qui est énergiquement repoussé au-dessus du seuil a, par les forts courants de flot, passant alors rapidement de 125 m à 30 m de profondeur ; une agrégation frontale dans l’entrée du Saguenay, lors de la subduction des eaux d’« upwelling » de la couche intermédiaire froide (CIL) dans le fjord ; et les couches acoustiques le long de la pointe est du banc de l’île Rouge, dans lesquelles s’alimentait un rorqual commun, suivi à l’aide d’une balise électronique enregistrant ses plongées (détails dans SIMARD et al. 2002).
Illustration of the capelin concentration at the edges of the Laurentian channel head during flood, when currents are upstream over most of the water mass and are accelerating in the sill areas. The three-dimensional scheme indicates, in red, capelin pushed towards the slopes by the upwelling currents. The echograms show, with a palette increasing from blue to red: the concentrated capelin in the “Notch” that is strongly pushed over sill a by flood currents, moving from 125 m to 30 m depths; a frontal aggregation in the Saguenay entrance during the subduction of the upwelled cold intermediate layer (CIL) waters into the fjord; and acoustic scattering layers along the eastern tip of Ile Rouge bank, where a tracked tagged fin whale was feeding as indicated by the recorded dives (details in SIMARD et al. 2002).
Le processus d’agrégation du zooplancton dans le PMSSL à la tête du chenal Laurentien est à la source d’un réseau trophique où les baleines puisent, soit directement en s’alimentant du krill, soit par l’intermédiaire des poissons fourragers, principalement le capelan, mais aussi en partie le lançon qu’on retrouve à l’occasion. Le petit rorqual, qui peut exploiter des zones de faibles profondeurs, contrairement aux grands rorquals, semble bien adapté à s’alimenter sur ces hauts fonds à la tête du chenal Laurentien, notamment dans les régions frontales et près de la côte, où le capelan est plus abondant et où on retrouve ce rorqual le plus souvent. Le béluga utilise aussi intensivement cette région, où le capelan est abondant. Les plus grands rorquals, tels le rorqual commun et le rorqual à bosse, préfèrent se maintenir en plus grande profondeur à la tête du chenal Laurentien, et se concentrer au pourtour du talus lorsque les organismes y sont rabattus pendant le flot (Figure 7). Les oiseaux marins tirent eux aussi profit de cette dynamique frontale et de l’« upwelling » à la tête du chenal Laurentien et l’embouchure du Saguenay, comme en témoignent les denses agrégations de goélands s’alimentant intensivement qu’on y observe dans les barres frontales sur les hauts fonds.
3.8 Généralisation aux autres lieux d’alimentation des baleines à fanons
Que nous enseignent ces connaissances des processus responsables du maintien du site traditionnel d’alimentation des baleines dans le PMSSL pour d’autres sites ? D’abord, comme les facteurs actifs décrits pour cet écosystème se retrouvent dans tous les écosystèmes marins, il est prévisible que ces autres sites soient aussi sous l’influence d’une chaîne de processus régissant la production et l’accumulation de la biomasse d’espèces fourragères, imbriquées selon un continuum d’échelles spatiales et temporelles (p. ex. Figure 2). Pour déterminer les sites persistants, où la biomasse de krill a une grande probabilité de s’accumuler, les simulations à l’échelle du golfe (SOURISSEAU et al., 2006) et les démonstrations par des mesures intensives sur le terrain (p. ex. COTTÉ et SIMARD 2005; LAVOIE et al., 2000), illustrent clairement que le contrôle est exercé par l’interaction des courants profonds avec la topographie et le comportement d’évitement de la lumière par le krill. Conséquemment, il n’est pas étonnant de retrouver des agrégations de biomasse le long des marges des plateaux continentaux, des têtes de chenaux ou des canyons, ainsi que dans les bassins profonds sculptés dans ces plateaux (p. ex. BENOIT et al., 2008; COCHRANE et al., 2000; KULKA et al., 1982; MACKAS et al., 1997; SIMARD et MACKAS, 1989), qui souvent correspondent à de fortes densités de baleines (p. ex. BAUMGARTNER et al., 2003; CROLL et al., 2005; KENNEY et al., 1995; KINGSLEY et REEVES, 1998; MELLINGER et al., 2007; PALKA 2006). Le PMSSL est un exemple de ces sites, où notre compréhension actuelle des mécanismes en cause nous permet maintenant de mieux cibler les facteurs clés pour suivre et appréhender l’évolution de ce point chaud de l’écosystème régional dans le temps et l’espace.
4. Conclusion et perspectives
Le PMSSL renferme un important point chaud du grand écosystème du Saint-Laurent, où plusieurs processus physiques et biologiques se combinent pour y maintenir un site pérenne unique pour l’alimentation des baleines du nord-ouest de l’Atlantique. Ce point chaud est contrôlé par un ensemble de facteurs agissant depuis les grandes échelles climatiques jusqu’aux petites échelles des processus frontaux et d’« upwellings » d’origine tidale, incluant la circulation estuarienne et son forçage par les débits d’eau douce (Figure 2). Bien que les travaux de la dernière décennie nous aient permis de mieux comprendre pourquoi ce point chaud apprécié des baleines se maintient à ce site depuis des siècles et quels mécanismes océanographiques en étaient la cause, plusieurs questions restent sans réponses. Des efforts de recherche soutenus permettront de combler ces lacunes et de suivre l’évolution future de ce système d’importances écologique et économique considérables.
Parmi ces besoins d’information plus complète, la question de la mécanique de l’approvisionnement de l’agrégation de krill du PMSSL et son fonctionnement précis au cours du cycle annuel, en relation avec les changements dans la circulation estuarienne en deux couches, fait partie de celles à résoudre en priorité afin de mieux cerner les facteurs qui la contrôlent, dans l’objectif de pouvoir en établir le monitorage automatique et prévoir les fluctuations d’abondance et, ultimement, expliquer les chutes de fréquentation par les baleines. Associé à cette question est le degré de dépendance de l’import de krill aux débits d’eau douce du Saint-Laurent ainsi qu’à la stratification de la colonne d’eau, deux composantes fortement reliées au climat et susceptibles d’être modifiées par l’actuel réchauffement global planétaire. Une autre composante interreliée est le comportement de migration verticale du krill pendant l’hiver, une période fortement sous‑échantillonnée, et l’effet de la modification par le couvert de glace de la lumière in situ qui dirige ces migrations. Comment le krill se distribue sur le plan vertical au cours du cycle de 24 h lors des longues nuits d’hiver est au coeur de la dynamique d’importation, de rétention et d’exportation du krill.
D’autres questions à répondre à moyen terme sont celles de la dynamique des populations de krill, les fluctuations interannuelles (qui ont varié d’un facteur 14 au cours des 13 dernières années, HARVEY et DEVINE, 2007) et la relation avec la production primaire de l’écosystème ; l’interrelation entre l’abondance globale des agrégations de krill du golfe et de l’estuaire et leur fréquentation par les rorquals ; l’effet des changements climatiques sur le réchauffement attendu de la CIL et l’abondance et la répartition de l’espèce T. raschi et son remplacement éventuel par d’autres espèces ; l’énigme de l’origine exacte du capelan à la tête du chenal : est-ce un entraînement comme le krill ou une migration active des jeunes depuis le golfe où se trouve leur pouponnière (cf. SIMARD et al., 2002)? ; la relation de l’agrégation de krill avec diminution de l’O2 dissous au fond à la tête du chenal Laurentien (GILBERT et al., 2005) ; la dynamique du front du Saguenay, issue de la subduction de la CIL dans le bassin d’entrée à Tadoussac pendant le flot, et sa relation avec les agrégations de proies des bélugas, des petits rorquals et des oiseaux marins.
Depuis dix ans, la création du PMSSL a fourni des moyens de protéger une partie de ce « hot spot » de l’écosystème du Saint‑Laurent et du nord-ouest de l’Atlantique, où près de 500 000 visiteurs viennent admirer les plus grands animaux de la planète lors de leur migration annuelle, qui s’alimentent et refont leurs réserves de graisses, dont dépend le succès de leur reproduction. La création de l’éventuelle zone de protection marine (ZPM) « Estuaire du Saint‑Laurent » permettra d’étendre la zone protégée pour englober tout le point chaud et sa périphérie. La documentation détaillée du fonctionnement exact de cette zone d’importance écologique et biologique (ZIEB) sera essentielle pour fonder les mesures de protection sur une base scientifique solide, afin de gérer les activités anthropiques éventuellement menaçantes et comprendre les fluctuations naturelles, dans un contexte de changements climatiques accélérés et de pressions économiques croissantes.
Parties annexes
Remerciements
Ces travaux ont été réalisés grâce à l’appui de plusieurs partenaires, principalement l’Institut Maurice-Lamontagne de Pêches et Océans Canada (MPO), la Chaire du MPO en acoustique marine appliquée à l’écosystème et aux mammifères marins à l’Institut des sciences de la mer de Rimouski (ISMER) de l’Université du Québec à Rimouski, le PMSSL de Parcs Canada, le Conseil de recherches en sciences naturelles et génie du Canada (CRSNG), le Fonds québécois de la recherche sur la nature et la technologie (FQRNT). Plusieurs collaborateurs, collègues, étudiants et stagiaires, ont contribué au succès de ces travaux, particulièrement Nathalie Roy, Diane Lavoie, François Saucier, Marc Sourisseau, Michael Kingsley, Jacques Gagné, Yves Gratton, Jérome Benoit, Yves Samson, Sylvain Chartrand, Daniel Thibault, Jean-Guy Rondeau, Cédric Cotté, Nadia Ménard et Caroline Marchand. Merci à Denis Gilbert et un réviseur anonyme pour leurs contributions à l’amélioration du manuscrit.
Références
- ACEVEDO-GUTIÉRREZ A., D.A. CROLL et B.R. TERSHY (2002). High feeding cost limits dive time in the largest whales. J. Exp. Biol., 205, 1747-1753.
- BAILEY R.F.J., K.W. ABLE et W.C. LEGGETT (1977). Seasonal and vertical distribution and growth of juvenile and adult capelin (Mallotus villosus) in the St. Lawrence estuary and western Gulf of St. Lawrence. J. Fish. Res. Board Can., 34, 2030‑2040.
- BANKS R.E. (1966). The cold layer in the Gulf of St. Lawrence. J. Geophys. Res., 71, 1603-1610.
- BAUMGARTNER M.F., T.V.N. COLE, P.J. CLAPHAM et B.R. MATE (2003). North Atlantic right whale habitat in the lower Bay of Fundy and on the SW Scotian Shelf during 1999–2001. Mar. Ecol. Prog. Ser., 264, 137‑154.
- BENOIT D., Y. SIMARD et L. FORTIER (2008). Hydro-acoustic detection of large winter aggregations of Arctic cod (Boreogadus saida) at depth in ice-covered Franklin Bay (Beaufort Sea). J. Geophys. Res., 113, C06S90, .
- BERKES F. (1976). Ecology of euphausiids in the Gulf of St. Lawrence. J. Fish. Res. Board Can., 33, 1894-1905.
- BOURGAULT D., D.E. KELLEY et P.S. GALBRAITH (2005). Interfacial solitary wave run-up in the St. Lawrence Estuary. J. Mar. Res., 63, 1001-1015.
- BOURGAULT D. et V.G. KOUTITONSKY (1999). Real‑time monitoring of the freshwater discharge at the head of the St. Lawrence Estuary. Atmos. Ocean., 37, 203‑220.
- BOURGAULT D., F.J. SAUCIER et C.A. LIN (2001). Shear instability in the St. Lawrence Estuary, Canada: A comparison of fine-scale observations and estuarine circulation model results. J. Geophys. Res., 106, 9393-9409.
- BRODIE P.F., D.D. SAMEOTO et R.W. SHELDON (1978). Population densities of euphausiids off Nova Scotia as indicated by net samples, whale stomach contents, and sonar. Limnol. Oceanogr., 23, 1264-1267.
- BRUNEL P. (1970). Les grandes divisions du Saint‑Laurent : 3e commentaire. Revue Geogr. Montréal, 24, 291-294.
- BRUNEL P., L. BOSSÉ et G. LAMARCHE (1998). Catalogue des invertébrés marins de l’estuaire et du golfe du Saint‑Laurent. Publ. spéc. can. sci. halieut. aquat., No 126, 405 p.
- BUDGEN G.L. (1991). Changes in the temperature‑salinity characteristics of the deeper waters of the Gulf of St. Lawrence over the past several decades. Dans : The Gulf of St. Lawrence: Small Ocean or Big Estuary?Therriault, J.C. (Éditeur). Can. Spec. Publ. Fish. Aquat. Sci., 113, pp. 139‑147.
- CARSCADDEN J.E. et H. VILHJÁLMSSON (2002). Capelin - what are they good for? Introduction. ICES J. Mar. Sci., 59, 863-869.
- COCHRANE N.A., D.D. SAMEOTO et A.W. HERMAN (2000). Scotian shelf euphausiid and silver hake population changes during 1984-1996 measured by multi-frequency acoustics. ICES J. Mar. Sci., 57, 122-132.
- COTTÉ C. et Y. SIMARD (2005). The formation of rich krill patches under tidal forcing at whale feeding ground hot spots in the St. Lawrence Estuary. Mar. Ecol. Progr. Ser., 288, 199-210.
- CROLL D.A., B. MARINOVIC, S. BENSON, F.P. CHAVEZ, N. BLACK, R. TERNULLO et B.R. TERSHY (2005). From wind to whales: trophic links in a coastal upwelling system. Mar. Ecol. Prog. Ser., 289, 117-130.
- DE LAFONTAINE Y., S. DEMERS et J. RUNGE (1991). Pelagic food web interactions and productivity in the Gulf of St. Lawrence: A perspective. Dans : The Gulf of St. Lawrence: small ocean or big estuary?Therriault, J.C. (Éditeur). Can. Spec. Publ. Fish. Aquat. Sci., 113, pp. 99-123.
- DEMER D., A.M. COSSIO, J. RENFREE et C.S. REISS (2008). CCAMLR 2000 revisited. CCAMLR Sci., (sous presse).
- DESCROIX A., M. HARVEY, S. ROY et P. GALBRAITH (2005). Macrozooplankton community patterns driven by water circulation in the St. Lawrence marine system, Canada. Mar. Ecol. Prog. Ser., 302, 103-119.
- DUNBAR M.J. (1964). Serial atlas of the marine environment. Folio 6, Euphausids and pelagic amphipods: distribution in North Atlantic and Arctic waters. American Geographical Society, New York, NY, USA.
- EL-SABH M.I. (1979). The lower St. Lawrence Estuary as a physical oceanographic system. Nat. Can., 106, 55-73.
- EL-SABH M.I. et N. SILVERBERG (Éditeurs) (1990). Oceanography of a large-scale estuarine system: the St. Lawrence. Coastal Estuarine Stud. No. 39. Springer-Verlag, New York, NY, USA, 434 p.
- FORRESTER W.D. 1974. Internal tides in the St. Lawrence Estuary. J. Mar. Res., 32, 55-66.
- GALBRAITH P.S. (2006). Winter water masses in the Gulf of St. Lawrence. J. Geophys. Res., 111, C06022, .
- GILBERT D. et B. PETTIGREW (1997). Interannual variability (1948-1994) of the CIL core temperature in the Gulf of St. Lawrence. Can. J. Fish. Aquat. Sci., 54, 57-67.
- GILBERT D., B. SUNDBY, C. GOBEIL, A. MUCCI et G.H. TREMBLAY (2005). A seventy-two-year record of diminishing deep-water oxygen in the St. Lawrence Estuary: The northwest Atlantic connection. Limnol. Oceanogr., 50, 1654-1666.
- GOUVERNEMENT DU CANADA (1997). Loi sur le parc marin du Saguenay–Saint-Laurent. Chapitre 37, sanctionnée le 10 décembre 1997.
- GRATTON Y., G. MERTZ et J.A. GAGNÉ (1988.) Satellite observations of tidal upwelling and mixing in the St. Lawrence Estuary. J. Geophys. Res., 93, 6947-6954.
- HARVEY M. et L. DEVINE (2007). Conditions océanogra-phiques dans l’estuaire et le golfe du Saint‑Laurent en 2006 : zooplancton. Pêches et Océans Canada, Secrétariat canadien de consultation scientifique. Doc. rech. 2007/049. disponible à http://www.dfo-mpo.gv.ca/csas.
- INGRAM R.G. (1976). Characteristics of a tide-induced estuarine front. J. Geophys. Res., 81, 1951-1959.
- INGRAM R.G. (1979). Water mass modification in the St. Lawrence Estuary. Nat. Can., 106, 45-54.
- INGRAM R.G. (1983). Vertical mixing at the head of the Laurentian trough. Nat. Can., 112, 31-38.
- INGRAM R.G. (1985). Frontal characteristics at the head of the Laurentian trough. Nat. Can., 112, 31-38.
- INGRAM R.G. et M.I. EL-SABH (1990). Fronts and mesoscale features in the St. Lawrence Estuary. Dans : Oceanography of a Large-Scale Estuarine System: The St. Lawrence. EL‑SABH, M.I. et N. SILVERBERG (Éditeurs). Coastal Estuarine Stud. No. 39, Springer-Verlag, New York, NY, USA, pp. 71-93.
- JOHNSTON D.W., A.S. FRIEDLAENDER, L.G. TORRES et D.M. LAVIGNE (2005). Variation in sea ice cover on the east coast of Canada from 1969 to 2002: climate variability and implications for harp and hooded seals. Clim. Res., 29, 209-222.
- KAWAMURA A. (1980). A review of food of balaenopterid whales. Sci. Rep. Whales Res. Inst. Tokyo, 32, 155-197.
- KENNEY R.D., H.E. WINN et M.C. MACAULAY (1995). Cetaceans in the Great South Channel, 1979-1989: Right whale (Eubalaena glacialis). Cont. Shelf Res., 15, 385-414.
- KINGSLEY M.C.S. et R.R. REEVES (1998). Aerial surveys of cetaceans in the Gulf of St. Lawrence in 1995 and 1996. Can. J. Zool., 76, 1529-1550.
- KOUTITONSKY V.G. et G.L. BUDGEN (1991). The physical oceanography of the Gulf of St. Lawrence: A review with emphasis on the synoptic variability of the motion. Dans : The Gulf of St. Lawrence: Small Ocean or Big Estuary? THERRIAULT, J.C, (Éditeur). Can. Spec. Publ. Fish. Aquat. Sci., 113, pp. 57-90.
- KULKA D.W., S. COREY et T.D. ILES (1982). Community structure and biomass of euphausiids in the Bay of Fundy. Can. J. Fish. Aquat. Sci., 39, 326-334.
- LACROIX G. (1961). Les migrations verticales journalières des euphausides à l’entrée de la baie des Chaleurs. Nat. Can., 88, 257-317.
- LAVIGUEUR L., M.O. HAMMIL et S. ASSELIN (1993). Distribution et biologie des phoques et autres mammifères marins dans la région du parc marin du Saguenay. Rapp. man. Can. Sci. Halieut. Aquat. No 2220, 40 pp.
- LAVOIE D., Y. SIMARD, J. BENOIT, P. LAROUCHE et B. THIBEAULT (1996). Distribution des masses d’eau à la tête du Laurentien dans l’estuaire du Saint-Laurent aux étés 1994 et 1995. Rapp. tech. Can. Hydrogr. Sci. Océan., No 176, 126 pp.
- LAVOIE D., Y. SIMARD et F.J. SAUCIER (2000). Aggrega-tion and dispersion of krill at channel heads and shelf edges: the dynamics in the Saguenay–St. Lawrence Marine Park. Can. J. Fish. Aquat. Sci., 57, 1853-1869.
- LE FOUEST V., B. ZAKARDJIAN, F.J. SAUCIER et M. STARR (2005). Seasonal versus synoptic variability in planktonic production in a high-latitude marginal sea: The Gulf of St. Lawrence (Canada). J. Geophys. Res., 110, C09012, .
- LIE H. J. et M.I. EL-SABH (1983). Formation of eddies and transverse currents in a two-layer channel of variable bottom with application to the lower St. Lawrence Estuary. J. Phys. Oceanogr., 13, 1063-1075.
- MACAULAY M.C., K.F. WISHNER et K.L. DALY (1995). Acoustic scattering from zooplankton and micronekton in relation to a whale feeding site near Georges Bank and Cape Cod. Cont. Shelf. Res., 15, 509-537.
- MACKAS D.L., R. KIESER, M. SAUNDERS, D.R. YELLAND, R.M. BROWN et D.F. MOORE (1997). Aggregation of euphausiids and Pacific hake (Merluccius productus) along the outer continental shelf off Vancouver Island. Can. J. Fish. Aquat. Sci., 54, 2080-2096.
- MARCHAND C., Y. SIMARD et Y. GRATTON (1999). Concentration of capelin in tidal upwelling fronts at the head of the Laurentian channel in the St. Lawrence Estuary. Can. J. Fish. Aquat. Sci., 56, 1832-1848.
- MAUCHLINE J. (1980). The biology of mysids and euphausiids. Adv. Mar. Biol., 18, 1-681.
- MELLINGER D.K, S.L. NIEUKIRK, H. MATSUMOTO, S.L. HEIMLICH, R.P. DZIAK, J. HAXEL et M. FOWLER (2007). Seasonal occurrence of North Atlantic right whale (Eubalaena glacialis) vocalizations at two sites on the Scotian Shelf. Mar. Mamm. Sci., 23, 856-867.
- MÉNARD N. (1998). Répartition spatiale et structure des bancs de poissons pélagiques dans une aire d’alimentation des cétacés de l’estuaire du Saint-Laurent. Mémoire de Maîtrise, Univ. Laval, Québec, Canada, 123 p.
- MERTZ G. et Y. GRATTON (1990). Topographic waves and topographically induced motion in the St. Lawrence Estuary. Dans : Oceanography of a Large-Scale Estuarine System: The St. Lawrence. EL-SABH, M.I. et N. SILVERBERG (Éditeurs), Coastal Estuarine Stud. 39, Springer-Verlag, New York, NY, USA, pp. 94-108.
- MICHAUD R. et J. GIARD (1998). Les rorquals communs et les activités d’observation en mer des cétacés dans l’estuaire maritime du Saint-Laurent en 1994‑1996. 2 : Évaluation de l’impact des activités d’observation en mer sur le comportement des rorquals communs. Rapport final à Parcs Canada, Ottawa. GREMM, 108 de la Cale Sèche, Tadoussac, Québec, Canada G0T 2A0.
- MUNRO J., D. GAUTHIER et J.-A. GAGNÉ (1998). Description d’une frayère de hareng (Clupea harengus L.) à l’île aux Lièvres, dans l’estuaire moyen du Saint-Laurent. Rapp. Tech. Can. Sci. Halieut. Aquat., No 2239, 34 p.
- NEMOTO T. (1970). Feeding pattern of baleen whales in the ocean. Dans : Marine food chains. STEELE, J.H. (Éditeur). University of California Press, Berkeley, USA, pp. 241‑252.
- PALKA D.L. (2006). Summer abundance estimates of cetaceans in US North Atlantic navy operating areas. NOAA, National Marine Fisheries Service, Northeast Fisheries Science Center Reference Document 06-03.
- PÊCHES ET OCÉANS CANADA (1997). Atlas des courants de marée : Estuaire du Saint-Laurent du Cap de Bon-Désir à Trois-Rivières. Pêches et Océans Canada, Ottawa, Ont., 108 p.
- PLOURDE J. et J.-C. THERRIAULT (2004). Climate variability and vertical advection of nitrates in the Gulf of St. Lawrence, Canada. Mar. Ecol. Prog. Ser., 279, 33-43.
- PLOURDE S., J.J. DODSON, J.A. RUNGE et J.‑C. THERRIAULT (2002). Spatial and temporal variations in copepod community structure in the lower St. Lawrence Estuary, Canada. Mar. Ecol. Prog. Ser., 230, 211-224.
- PLOURDE S., P. JOLY, J.A. RUNGE, B. ZAKARDJIAN et J.J. DODSON (2001). Life cycle of Calanus finmarchicus in the Lower St. Lawrence Estuary: The imprint of circulation and late timing of the spring phytoplankton bloom. Can. J. Fish. Aquat. Sci., 58, 647-658.
- PLOURDE S. et J.A. RUNGE (1993). Reproduction of the planktonic copepod Calanus finmarchicus in the lower St. Lawrence Estuary: relation to the cycle of phytoplankton production and evidence for a pump. Mar. Ecol. Prog. Ser., 102, 217-227.
- RINGUETTE M., J.A. RUNGE, M. CASTONGUAY et F. GRÉGOIRE (2002). Atlantic mackerel (Scomber scombrus) recruitment fluctuations in relation to copepod production and juvenile growth. Can. J. Fish. Aquat. Sci., 59, 646-656.
- RUNGE J.A., M. CASTONGUAY, Y. DE LAFONTAINE, M. RINGUETTE et J.-L. BEAULIEU (1999). Covariation in climate, zooplankton biomass and mackerel recruitment in the southern Gulf of St. Lawrence. Fish. Oceanogr., 8, 139-149.
- RUNGE J.A. et Y. SIMARD (1990). Zooplankton of the St. Lawrence Estuary: The imprint of physical processes on its composition and distribution. Dans : Oceanography of a Large-scale Estuarine System: The St. Lawrence. EL‑SABH M.I. et N. SILVERBERG (Éditeurs). Coastal Estuarine Stud. No. 39, Springer-Verlag, NY, USA, pp. 297-320.
- SAMEOTO D.D. (1976). Distribution of sound scattering layers caused by euphausiids and their relationship to chlorophyll A concentrations in the Gulf of St. Lawrence Estuary. J. Fish. Res. Board Can., 33, 681-687.
- SAMEOTO D.D. (1980). Quantitative measurements of euphausiids using a 120 kHz sounder and their in situ orientation. Can. J. Fish. Aquat. Sci., 37, 693-702.
- SAMEOTO D.D. (1983). Euphausiid distribution in acoustic scattering layers and its significance to surface swarms. J. Plankton Res., 5, 129-143.
- SAUCIER F.J. et J. CHASSÉ (2000). Tidal circulation and buoyancy effects in the St. Lawrence Estuary. Atmos. Ocean., 38, 505-556.
- SAUCIER F.J., F. ROY, D. GILBERT, P. PELLERIN et H. RITCHIE (2003). Modelling the formation and circulation processes of water masses and sea ice in the Gulf of St. Lawrence, Canada. J. Geophys. Res. Oceans, 108 (C8): 3269, .
- SAVENKOFF C., M. CASTONGUAY, A.F. VÉZINA, S.P. DESPATIE, D. CHABOT, L. MORISSETTE et M.O. HAMMILL (2004). Inverse modelling of trophic flows through an entire ecosystem: the northern Gulf of St. Lawrence in the mid-1980s. Can. J. Fish. Aquat. Sci., 61, 2194-2214.
- SIMARD Y., R. DE LADURANTAYE et J.-C. THERRIAULT (1986a). Aggregation of euphausiids along a coastal shelf in an upwelling environment. Mar. Ecol. Prog. Ser., 32, 203‑215.
- SIMARD Y., G. LACROIX et L. LEGENDRE (1986b). Diel vertical migrations and nocturnal feeding of a dense coastal krill scattering layer (Thysanoessa raschi and Meganyctiphanes norvegica) in stratified surface waters. Mar. Biol., 91, 93‑105.
- SIMARD Y. et D. LAVOIE (1999). The rich krill aggregation of the Saguenay–St. Lawrence Marine Park: hydroacoustic and geostatistical biomass estimates, structure, variability and significance for whales. Can. J. Fish. Aquat. Sci., 56, 1182-1197.
- SIMARD Y., D. LAVOIE et F.J. SAUCIER (2002). Channel head dynamics: Capelin (Mallotus villosus) aggregation in the tidally-driven upwelling system of the Saguenay–St. Lawrence Marine Park whale feeding ground. Can. J. Fish. Aquat. Sci., 59, 197-210.
- SIMARD Y. et D. MACKAS (1989). Mesoscale aggregations of euphausiid sound scattering layers on the continental shelf of Vancouver Island. Can. J. Fish. Aquat. Sci., 46, 1238-1249.
- SIMARD Y., D. MARCOTTE et K. NARAGHI (2003). Three-dimensional acoustic mapping and simulation of krill distribution in the Saguenay–St. Laurence Marine Park whale feeding ground. Aquat. Living Res., 16, 137‑144.
- SIMMONDS E.J. et D.N. MACLENNAN 2005. Fisheries Acoustics: theory and practice. Blackwell Science, Oxford. 352 p.
- SMITH G.C., F.J. SAUCIER et D. STRAUB (2006). Formation and circulation of the cold intermediate layer in the Gulf of St. Lawrence. J. Geophys. Res., 111, C0611, doi: 10.1029/2005JC003017.
- SOURISSEAU M., Y. SIMARD et F.‑J. SAUCIER (2006). Krill aggregation in the St. Lawrence system, and supply of krill to the whale feeding grounds in the estuary from the Gulf. Mar. Ecol. Progr. Ser., 314, 257-270.
- SOURISSEAU M., Y. SIMARD, Y. et F.-J. SAUCIER (2008). Krill diel vertical migration fine dynamics, nocturnal overturns and their roles for aggregation in stratified flows. Can. J. Fish. Aquat. Sci., 65, 574-587.
- THERRIAULT J.C. (Éditeur) (1991). Le Golfe du Saint‑Laurent : petit océan ou grand estuaire ? Can. Spec. Publ. Fish. Aquat. Sci., 113, 359 p.
- THERRIAULT J.-C. et G. LACROIX (1976). Nutrients, chlorophyll, and internal tides in the St. Lawrence Estuary. J. Fish. Res. Board Can., 33, 2747-2757.
- THERRIAULT J.-C., L. LEGENDRE et S. DEMERS (1990). Oceanography and ecology of phytoplankton in the St. Lawrence Estuary. Dans : Oceanography of a Large-scale Estuarine System: The St. Lawrence. EL-SABH, M.I. et N. SILVERBERG (Éditeurs). Coastal Estuarine Stud., No. 39, Springer-Verlag, NY, USA, pp. 269-295.
- THERRIAULT J.-C. et M. LEVASSEUR (1985). Control of phytoplankton production in the lower St. Lawrence Estuary. Light and freshwater runoff. Nat. Can., 112, 211-222.
- TURGEON L. (1994). Les migrations des baleines franches boréales dans l’estuaire du Saint-Laurent. L’Euskarien, 16, 44-47.
- ZAKARDJIAN B.A., J.A. RUNGE, S. PLOURDE et Y. GRATTON (1999). A biophysical model of the interaction between vertical migration of crustacean zooplankton and circulation in the Lower St. Lawrence Estuary. Can. J. Fish. Aquat. Sci., 56, 2420-2432.
- ZAKARDJIAN B., J. SHENG, J.A. RUNGE, I. MCLAREN, S. PLOURDE, K.R. THOMPSON et Y. GRATTON (2003). Effect of temperature and circulation on the population dynamics of Calanus finmarchicus in the Gulf of St. Lawrence and Scotian Shelf: Study with a coupled, three-dimensional hydrodynamic, stage-based life history model. J. Geophys. Res., 108(C11), 8016, .
Liste des figures
Figure 1
Localisation du grand écosystème dont fait partie le PMSSL dans l’est du Canada, incluant le grand bassin de drainage du Saint-Laurent, l’étendue de la nappe intermédiaire froide (CIL) dans le nord-ouest Atlantique, le « hot spot » traditionnel d’alimentation des baleines du PMSSL à la tête du chenal principal du plateau continental de l’est du Canada, où le krill et le capelan s’agrègent.
Location of the large marine ecosystem (LME) to which belongs the Saguenay–St. Lawrence Marine Park (SSLMP), including the large St. Lawrence drainage basin, the extent of the cold intermediate layer (CIL) in the Northwest Atlantic, the “hot spot” of the traditional whale feeding ground of the SSLMP at the head of the main channel of Eastern Canada continental shelf, where krill and capelin aggregate.
Figure 2
Schéma de la structure hiérarchique des processus écosystémiques et océanographiques responsables de la formation, du maintien et de la variabilité de l’agrégation de krill du site traditionnel d’alimentation des baleines du PMSSL.
Schematic of the hierarchical structure of the ecosystem and oceanographic processes responsible for the formation, persistence and variability of the krill aggregation at the traditional whale feeding ground of the SSLMP.
Figure 3
La tête du chenal Laurentien (profondeur = ~ 300 m) dans l’estuaire du Saint-Laurent montrant les caractéristiques bathymétriques du bassin et les trois seuils contrôlant les échanges entre le chenal Laurentien et les bassins adjacents. Seuil a = 70 m, seuil b = 40 m, seuil c = 20 m de profondeur.
The head of the Laurentian Channel (depth = ~ 300 m) in the St. Lawrence Estuary showing the basin bathymetric features, and the three sills controlling the exchanges between the Laurentian Channel and the adjacent basins. Sill a = 70 m, sill b = 40 m, sill c = 20 m depth.
Figure 4
Cartes de distribution de la biomasse de krill et de capelan à la tête du chenal Laurentien en juillet 1994 à partir d’une série de sections relevées par hydroacoustique multifréquence et schéma de la circulation hydrodynamique tridimensionnelle impliquée dans la formation de l’agrégation de krill, contenant environ 100 000 t lors de ce relevé ; noter (en jaune) le courant d’import entrant le long du talus nord et celui d’export sortant du côté sud, le courant traversant vers le chenal sud en mortes‑eaux, dû au blocage aux seuils amonts, les courants d’« upwelling » et de « downwelling » (en rouge) (détails dans SIMARD et LAVOIE 1999; LAVOIE et al., 2000; SIMARD et al., 2002).
Maps of the krill and capelin biomasses at the head of the Laurentian Channel in July 1994 from a series of multi-frequency hydroacoustic cross-sections and schematic representation of three-dimensional circulation patterns involved in the formation of the krill aggregation, which amounted to 100,000 t during this survey; note (in yellow) the import current flowing upstream along the northern slope and the export current flowing downstream along the southern slope, the cross-channel current directed towards the southern channel as a result of the blocking at the upstream sills during neap tides, and the tidal upwelling and downwelling currents (in red) (details in SIMARD et LAVOIE 1999; LAVOIE et al., 2000; SIMARD et al., 2002).
Figure 5
Schéma de la circulation moyenne et des courants de talus impliqués dans le transport à grande échelle du krill dans le nord-ouest du golfe et l’estuaire maritime du Saint-Laurent. Le vecteur rouge est le courant d’import qui alimente l’agrégation de krill du PMSSL. Le vecteur vert représente le mode de circulation à l’embouchure de l’estuaire lorsque la circulation dans ce secteur de la gyre d’Anticosti est fortement orientée vers la péninsule gaspésienne et qu’il n’y a pas d’injection de krill dans l’estuaire (voir Figure 6). Les méandres dans les vecteurs représentent une caractéristique d’échelle moyenne inhérente à ces courants, qui présentent occasionnellement des tourbillons de méso-échelle, comme illustrés.
Schematic representation of the mean circulation and slope currents involved in the large-scale transport of krill in the Northwestern Gulf and Lower St. Lawrence Estuary. The red vector is the import current feeding the SSLMP krill aggregation. The green vector represents the circulation mode at the mouth of the Estuary when that limb of the Anticosti gyre circulation is strongly oriented towards the Gaspé Peninsula and there is no krill injection into the Estuary (see Figure 6). The meanders in the vectors represent the inherent meso-scale characteristic of these flows, which occasionally present meso-scale eddies as illustrated.
Figure 6
Exemples des deux types de conditions à l’embouchure de l’estuaire où le krill est soit injecté dans l’estuaire (en haut) ou soit recirculé dans la gyre d’Anticosti (en bas), d’après les simulations de SOURISSEAU et al. (2006). Les couleurs des cellules du modèle indiquent les densités relatives de krill intégrées verticalement selon une palette augmentant du bleu (faible) au rouge (élevé).
Examples of the two types of conditions at the mouth of the estuary when the krill is either injected into the Estuary (top) or recirculated in the Anticosti gyre (bottom), from SOURISSEAU et al. (2006) simulations. The model cell colors indicate the relative krill densities integrated vertically according to a palette increasing from blue to red.
Figure 7
Illustration de la concentration du capelan sur les pourtours de la tête du chenal Laurentien pendant le flot alors que les courants sont vers l’amont sur presque toute la masse d’eau et accélérés dans les régions des seuils. Le schéma tridimensionnel indique, en rouge, le capelan rabattu sur les talus par les courants remontant la pente. Les échogrammes montrent avec une palette augmentant du bleu au rouge : le capelan concentré dans le « Notch », qui est énergiquement repoussé au-dessus du seuil a, par les forts courants de flot, passant alors rapidement de 125 m à 30 m de profondeur ; une agrégation frontale dans l’entrée du Saguenay, lors de la subduction des eaux d’« upwelling » de la couche intermédiaire froide (CIL) dans le fjord ; et les couches acoustiques le long de la pointe est du banc de l’île Rouge, dans lesquelles s’alimentait un rorqual commun, suivi à l’aide d’une balise électronique enregistrant ses plongées (détails dans SIMARD et al. 2002).
Illustration of the capelin concentration at the edges of the Laurentian channel head during flood, when currents are upstream over most of the water mass and are accelerating in the sill areas. The three-dimensional scheme indicates, in red, capelin pushed towards the slopes by the upwelling currents. The echograms show, with a palette increasing from blue to red: the concentrated capelin in the “Notch” that is strongly pushed over sill a by flood currents, moving from 125 m to 30 m depths; a frontal aggregation in the Saguenay entrance during the subduction of the upwelled cold intermediate layer (CIL) waters into the fjord; and acoustic scattering layers along the eastern tip of Ile Rouge bank, where a tracked tagged fin whale was feeding as indicated by the recorded dives (details in SIMARD et al. 2002).