Résumés
Résumé
Depuis son introduction en 1990, la microscopie de fluorescence excitée à deux photons (Fluo-2P) s’est peu à peu imposée comme une méthode incontournable d’imagerie de tissus intacts à l’échelle sub-cellulaire. En effet, la caractéristique la plus remarquable de la microscopie multiphotonique est de maintenir une résolution tridimensionnelle micrométrique lors de l’observation en profondeur d’un milieu optiquement diffusant. Combinée aux technologies de protéines-fusion (type GFP), cette approche est aujourd’hui utilisée dans de nombreux domaines, notamment en neurophysiologie. Un autre attrait de ce type d’imagerie réside dans l’utilisation possible d’autres phénomènes optiques non linéaires (c’est-à-dire impliquant l’interaction simultanée de plusieurs photons avec une molécule observée) comme source de contraste. Ainsi, les microscopies par génération de second harmonique (GSH) et par génération de troisième harmonique (GTH) permettent également d’observer des milieux complexes et fournissent des informations complémentaires par rapport à l’imagerie de fluorescence. Certaines structures cellulaires ou tissulaires fournissent, en effet, ce type de réponse optique sans nécessiter de marquage exogène. La microscopie GSH permet, par exemple, de détecter le collagène fibrillaire et la microscopie GTH permet d’observer sans marquage le développement embryonnaire de petits organismes.
Summary
One principal advantage of multiphoton excitation microscopy is that it preserves its three-dimensional micrometer resolution when imaging inside light-scattering samples. For that reason two-photon-excited fluorescence microscopy has become an invaluable tool for cellular imaging in intact tissue, with applications in many fields of physiology. This success has driven increasing interest in other forms of nonlinear microscopy that can provide additional information on cells and tissues, such as second- (SHG) and third- (THG) harmonic generation microscopies. In recent years, significant progress has been made in understanding the contrast mechanisms of these recent methodologies, and high-resolution imaging based on intrinsic sources of signal has been demonstrated in cells and tissues. Harmonic generation exhibits structural rather than chemical specificity and can be obtained from a variety of non-fluorescent samples. SHG is observed specifically in dense, non-centrosymmetric arrangements of polarizable molecules, such as collagen fibrils, myofilaments, and polarized microtubule bundles. SHG imaging is therefore emerging as a novel approach for studying processes such as the physiopathological remodelling of the collagen matrix and myofibrillogenesis in intact tissue. THG does not require a non-centrosymmetric system ; however no signal can be obtained from a homogeneous medium. THG imaging therefore provides maps of sub-micrometer heterogeneities (interfaces, inclusions) in unstained samples, and can be used as a general purpose structural imaging tool. Recent studies showed that this technique can be used to image embryo development in small organisms and to characterize the accumulation of large lipid bodies in specialized cells. SHG and THG microscopy both rely on femtosecond laser technology and are easily combined with two-photon microscopy.
Corps de l’article
Principe de la microscopie non linéaire
Le principe des microscopies multiphotoniques est d’utiliser comme mode de contraste un phénomène impliquant l’interaction simultanée de plusieurs photons (deux ou trois) avec la molécule ou la structure à détecter. Un tel phénomène est possible si l’échantillon est excité par un champ laser suffisamment intense. Dans le cas de la Fluo-2P [1, 2], par exemple, un chromophore est excité par absorption simultanée de deux photons peu énergétiques - c’est-à-dire de grande longueur d’onde - fournis par un laser délivrant des impulsions ultra brèves (100 fs) dans le proche infrarouge (700 à 1200 nm) (Figure 1) plutôt que par absorption d’un photon unique fourni par un laser émettant dans le visible. La substitution d’une excitation de l’échantillon en régime continu par une excitation par un train d’impulsions permet d’appliquer une intensité lumineuse élevée (pendant les impulsions) tout en limitant l’énergie incidente sur l’échantillon. Dans un microscope, le phénomène non linéaire ne se produit de façon efficace qu’au voisinage du foyer de l’objectif où l’intensité est suffisante. La résolution axiale est ainsi liée uniquement au caractère non linéaire de l’excitation et ce « sectionnement optique » permet une résolution tridimensionnelle micrométrique (typiquement 2×0,5×0,5 µm3) intrinsèque. Ce volume d’excitation est alors balayé en deux ou trois dimensions dans l’échantillon pour former une image.
Figure 1
Mécanismes de la fluorescence excitée à deux photons (Fluo-2P), de la génération de second (GSH) et troisième (GTH) harmoniques.
A. Exemple 1 : échantillon excité à 800 nm, produisant un signal GSH à 400 nm et un signal Fluo-2P à 450-580 nm. B. Exemple 2 : échantillon excité à 1200 nm, produisant un signal GTH à 400 nm et un signal GSH à 600 nm.
Intérêt pour l’imagerie en profondeur
Un des principaux facteurs limitant la profondeur d’imagerie en microscopie conventionnelle (plein champ ou confocale) est la diffusion de la lumière visible par les tissus. La diffusion a pour effet de réduire la quantité de lumière détectée en provenance du plan focal et d’augmenter le bruit de fond (notamment la lumière provenant des régions superficielles de l’échantillon), ce qui brouille les images en profondeur. La microscopie multiphotonique permet de repousser cette limite pour deux raisons : (1) les longueurs d’onde d’excitation utilisées se situent dans la fenêtre de transparence des tissus : la lumière infrarouge est moins diffusée et absorbée que la lumière visible et, par conséquent, pénètre mieux dans les tissus ; (2) le caractère non linéaire de l’interaction lumière-tissu limite l’impact de la diffusion et préserve un confinement spatial correct. Il est ainsi possible de maintenir une résolution tridimensionnelle subcellulaire au sein d’un tissu [3]. Selon les propriétés optiques des tissus et le type de contraste utilisé, la profondeur maximale d’imagerie se situe entre 100 et 600 µm. Il est, par exemple, possible de visualiser l’activité neuronale chez un petit rongeur avec une résolution micrométrique jusqu’à environ 500 µm sous la surface du cortex. La microscopie de fluorescence excitée à deux photons est progressivement devenue une technique essentielle d’imagerie intravitale de fluorescence et trouve des applications en neurosciences, biologie du développement, cancérologie, immunologie… [2]. Elle est particulièrement adaptée à l’imagerie du petit animal exprimant des transgènes codant pour des protéines fluorescentes.
Génération de second et troisième harmoniques
Le succès de la microscopie à deux photons a entraîné depuis quelques années un regain d’intérêt pour des formes alternatives de microscopies multiphotoniques, utilisant d’autres phénomènes que la fluorescence comme source de contraste, et fournissant donc des informations différentes. C’est le cas, notamment, de la microscopie CARS ((→) m/s 2006, n° 10, p. 853) et des microscopies GSH et GTH, auxquelles nous nous intéressons ici. Ces techniques partagent certaines des caractéristiques de la microscopie Fluo-2P : l’effet est confiné au voisinage du foyer de l’objectif du fait de la dépendance non linéaire entre l’intensité incidente et l’intensité émise, et l’excitation se fait au moyen d’un train d’impulsions infrarouges focalisées. Ces microscopies sont donc adaptées pour l’observation tridimensionnelle de milieux complexes comme les tissus biologiques.
Cependant, les mécanismes mis en jeu sont très différents. Dans le cas de la Fluo-2P, une molécule présente dans l’échantillon absorbe de l’énergie lumineuse puis en restitue l’essentiel sous forme d’un photon de fluorescence après un temps variable, de l’ordre de la nanoseconde (10-9s). Dans le cas de la génération d’harmoniques, une molécule ou une structure est polarisée par un champ lumineux intense et rayonne un champ « déformé » comportant une composante à la fréquence double (GSH) ou triple (GTH). Le phénomène peut aussi se décrire comme une diffusion non linéaire combinant deux ou trois photons incidents sans qu’il y ait déposition d’énergie dans l’échantillon (voir Figure 1). Un tel processus est instantané (~10-16 s) et la phase de l’onde émise est liée à celle de l’onde incidente. Dans le cas d’un ensemble de molécules, le signal détecté résulte donc de la superposition cohérente des ondes émises par les molécules excitées : les amplitudes s’ajoutent plutôt que les intensités comme dans le cas de la fluorescence. Cette particularité a des conséquences très importantes pour l’imagerie. (1) En premier lieu, ces techniques sont très sensibles à la densité des molécules « harmonophores ». Si N est le nombre de molécules présentes de façon homogène dans le volume d’excitation, le signal GSH ou GTH sera proportionnel à N2 plutôt qu’à N comme dans le cas de la fluorescence. En général, un signal GSH ou GTH ne peut être détecté que pour un nombre N (et donc une densité d’émetteurs) suffisamment important. Par exemple, dans le cas de l’imagerie GSH de membranes marquées [4, 5], le nombre de molécules excitées nécessaire pour produire des signaux GSH et Fluo-2P comparables est de l’ordre de quelques 104. (2) En outre, ces signaux sont exaltés pour certains arrangements moléculaires et annulés pour d’autres (c’est le cas si les ondes rayonnées sont en opposition de phase). Par exemple, la GSH n’est possible que dans un milieu présentant une organisation non centrosymétrique. Il a ainsi été vérifié qu’un ensemble d’harmonophores insérés dans un feuillet d’une bicouche lipidique peut produire un tel signal mais que les mêmes molécules réparties de façon symétrique dans les deux feuillets de la bicouche ne produisent pas de SH [4, 5]. (3) Autre propriété remarquable, les ondes GSH et GTH sont rayonnées dans des directions préférentielles, en général dans la direction du laser incident alors que la fluorescence est en général rayonnée de façon isotrope. Ces techniques sont donc généralement utilisées en transmission, avec quelques exceptions, notamment pour l’imagerie GSH du collagène fibrillaire et l’imagerie de tissus épais (voir plus bas). (4) Enfin, notons qu’il est possible de détecter séparément les émissions de GSH, de GTH et de Fluo-2P et d’enregistrer simultanément deux ou trois images fondées sur ces différents contrastes. En effet, le dispositif expérimental est identique pour les différents modes de contraste (une source laser délivrant des impulsions infrarouges ultra brèves et un microscope à balayage), et les signaux sont distincts spectralement : les signaux harmoniques présentent un spectre étroit centré à la longueur d’onde exactement moitié (GSH) et tiers (GTH) de la longueur d’onde d’excitation alors que les spectres d’émission de Fluo-2P dépendent de la molécule fluorescente excitée et sont généralement plus larges et décalés vers le rouge par rapport à la GSH (Figure 1). En général, l’acquisition de trois images nécessite l’utilisation séquentielle de deux longueurs d’onde d’excitation : ~ 1 200 nm pour l’image GTH (et éventuellement l’image GSH) et ~ 750-900 nm pour l’image Fluo-2P (et éventuellement GSH), les temps d’acquisition étant similaires pour chaque modalité (de l’ordre de 0,01 ms par pixel).
Sources endogènes pour la GSH
En pratique, la GSH peut donc être observée dans des macrostructures denses, constituées de molécules polarisables présentant une asymétrie de la distribution électronique dans l’état excité, et organisées de façon non centrosymétrique à l’échelle du micromètre. Une application de cette technique concerne ainsi l’imagerie fonctionnelle de membranes marquées (non discutée ici) [6]. Par ailleurs, de forts signaux GSH endogènes ont été mis en évidence dès les années 80 dans le collagène fibrillaire [7-13] et, plus récemment, dans les myofilaments [8, 14, 15, 16], les faisceaux polarisés de microtubules [17] ou les granules d’amidon [18]. Le nombre de contraintes nécessaires à l’obtention d’un signal GSH est ici un avantage : les signaux proviennent de structures très spécifiques et en général non visibles en fluorescence. Une application émergente est donc l’utilisation de la microscopie GSH pour observer ces structures sans marquage au sein de tissus intacts.
Imagerie GSH du collagène
Le collagène fibrillaire fournit des signaux de GSH particulièrement élevés permettant de visualiser sa distribution au sein des tissus [8-10, 11-13, 19-22]. Ces images révèlent l’architecture générale des tissus (capsules, interfaces), mais surtout fournissent un nouvel outil pour l’étude de processus physiopathologiques affectant la matrice extracellulaire. Par exemple, la microscopie GSH a permis de mettre en évidence un remodelage du collagène dans des modèles de tumeurs [19]. Il est naturellement possible de combiner la microscopie GSH avec l’observation Fluo-2P de marqueurs présents dans le tissu (par exemple, une protéine fluorescente) ou encore d’espèces fluorescentes endogènes (fluorescence intracellulaire, kératine, élastine…). La Figure 2 présente des exemples d’images combinées GSH/Fluo-2P enregistrées sur des échantillon de tissus épais : biopsie de peau humaine, poumon de souris, artère de rat [22]. Le signal GSH indique la distribution de collagène fibrillaire et le signal de fluorescence révèle d’autres structures tissulaires (notamment les fibres élastiques). Ces images obtenues sans préparation ni marquage illustrent le potentiel de cette nouvelle méthodologie pour l’étude du remodelage de la matrice extracellulaire. Cette approche apparaît particulièrement appropriée à l’étude de processus fibrotiques dans des tissus intacts. Notre équipe mène ainsi des études sur les fibroses pulmonaires et rénales en collaboration avec des physiologistes de l’hôpital Bichat (Inserm U700) et de l’hôpital Tenon (Inserm U702) [23]. Il est à noter que le fort signal GSH est obtenu du fait de l’organisation macromoléculaire du collagène. Sa spécificité est, avant tout, structurale plutôt que biochimique [24]. D’une façon générale, le collagène organisé sous forme de fibrilles (e.g. Col-I) fournit un signal GSH alors que le collagène non fibrillaire (par exemple Col-IV) n’en fournit pas. La microscopie GSH est donc une sonde de la structuration de la matrice collagénique.
Figure 2
Imagerie GSH/Fluo-2P du collagène et de la matrice extracellulaire.
Vert : images GSH. Rouge : Images Fluo-2P. Excitation à 860 nm. Fluo-2P détectée dans la gamme 450-550 nm. Barres d’échelle : A, C 100 µm ; B 25 µm. A. Biopsie de peau humaine observée au niveau de la jonction dermo-épidermique (80 µm sous la surface). Barre d’échelle : 100 µm. B. Alvéoles et bronchioles d’un poumon de souris. Le signal Fluo-2P provient principalement des fibres élastiques et des macrophages. Barre : 25 µm. C. Reconstruction tridimensionnelle d’une paroi artérielle de rat où la GSH révèle la distribution du collagène dans l’adventice et la Fluo-2P la distribution des lames élastiques dans la media (d’après [22]). Barre : 100 µm.
Imagerie GSH des myofilaments
Une deuxième source particulièrement efficace pour la GSH est constituée par l’empilement quasi-cristallin des myofilaments dans les sarcomères. De tels signaux ont notamment été décrits dans le muscle squelettique [8, 14, 16] et les cardiomyocytes [15] de vertébrés (Figure 3) et dans les structures musculaires chez le nématode [8]. Ces images se rapprochent d’images obtenues en microscopie en lumière polarisée. Cependant un intérêt de l’approche GSH est qu’elle permet un sectionnement optique au sein d’un tissu. Une profondeur d’imagerie de quelques centaines de µm a ainsi été décrite dans le cas d’un muscle squelettique de souris [8]. Par ailleurs, l’émission de second harmonique possède elle-même une polarisation qui dépend de l’orientation et de l’organisation des structures émettrices par rapport à la polarisation du faisceau excitateur. Il est donc possible d’effectuer une imagerie GSH résolue en polarisation présentant notamment l’avantage par rapport à l’imagerie en polarisation conventionnelle de fournir une information localisée en trois dimensions. Enfin, notons que l’excellent contraste de ces signaux endogènes permet de mesurer une contraction à l’échelle du sarcomère avec une précision de l’ordre de quelques dizaines de nanomètres [15]. La microscopie GSH des myofilaments constitue ainsi un nouvel outil pour l’étude de processus de myofibrillogenèse et de cicatrisation musculaire [16].
Figure 3
Imagerie GSH de structures musculaires.
A. Cardiomyocytes isolés (oreillette de grenouille) et profil du signal GSH (d’après [15]). Barre d’échelle : 10 µm. B. Tissu musculaire intact (muscle couturier de grenouille). Barre : 20 µm.
Mécanisme de contraste GTH
La microscopie GTH est une technique plus récente [25, 26] dont les applications commencent seulement à voir le jour [27-30]. La génération de troisième harmonique est un processus similaire à la GSH, mais qui n’impose pas de contraintes de non-centrosymétrie : tout milieu polarisable éclairé avec une intensité suffisante peut en principe effectuer du triplage de fréquence. Cependant, une propriété remarquable de la microscopie GTH est qu’aucun signal ne peut être obtenu lorsque le volume d’excitation se trouve dans un milieu homogène et isotrope. Cette propriété est liée au fait qu’un faisceau focalisé subit une inversion progressive de phase au voisinage de son foyer ; si un tel faisceau éclaire un milieu homogène, ce déphasage a pour effet de faire interférer de façon destructive les ondes rayonnées à la fréquence triple dans les différentes parties du volume focal. Ainsi, un signal n’est observé que lorsqu’une interface entre deux milieux différents ou une inclusion sub-micrométrique (par exemple, une vésicule lipidique) se trouve au foyer de l’objectif. La microscopie GTH permet donc d’effectuer une imagerie structurale de cellules et de tissus non marqués, en détectant les variations de susceptibilité non linéaire et d’indice de réfraction.
Une particularité expérimentale de cette technique est que la longueur d’onde d’excitation utilisée se situe généralement dans la gamme 1100-1250 nm plutôt que 750-950 nm comme en microscopie Fluo-2P. Cela est lié au fait que la GTH nécessite une intensité sensiblement plus importante (typiquement 10×) que la Fluo-2P, ce qui impose de se placer dans une plage spectrale où l’absorption (à un ou deux photons) est très limitée, de façon à ne pas endommager l’échantillon (les processus de GSH ou GTH n’impliquent pas de déposition d’énergie dans l’échantillon et sont en principe non invasifs… tout au moins jusqu’à un certain seuil d’intensité où d’autres phénomènes non linéaires parasites peuvent apparaître).
Imagerie GTH d’embryons vivants
Une application tirant parti de la capacité de la microscopie GTH à cartographier les hétérogénéités optiques dans un système complexe est l’imagerie du développement embryonnaire. Il a été montré récemment que la microscopie GTH permet de visualiser la gastrulation de l’embryon de poisson-zèbre [28] ou de drosophile [29] avec une résolution tridimensionnelle micrométrique, sans en perturber le développement. Dans le cas de la drosophile, il est ainsi possible d’observer simultanément les tissus (régions périphériques de l’embryon) et le vitellus (régions internes) (Figure 4A) malgré la forte opacité de la surface du vitellus. Des champs de déplacements et de déformations tissulaires quantitatifs (Figure 4B) peuvent être extraits à partir de l’analyse de telles séquences d’images [29, 31]. Cette approche permet, par exemple, d’obtenir un phénotype dynamique de mutants dont la morphogenèse est altérée (voirFigure 4C-D), sans avoir recours à un marquage fluorescent.
Figure 4
Imagerie dynamique du développement embryonnaire par GTH.
A. Embryon de drosophile vivant observé dans le plan sagittal avant la gastrulation. B. Champ de déplacement des tissus et des structures internes (voir texte) pendant les mouvements morphogénétiques de convergence-extension. Flèche d’échelle : 5 µm/min. (D’après [29]). C. Haut : embryon sauvage observé dans un plan parasagittal permettant de visualiser les tissus latéraux. Bas : image d’un mutant concertina observé dans les mêmes conditions, illustrant l’altération de la morphogenèse dans cette souche. Barres d’échelle A, B, C : 50 µm.
Imagerie GTH des vésicules lipidiques
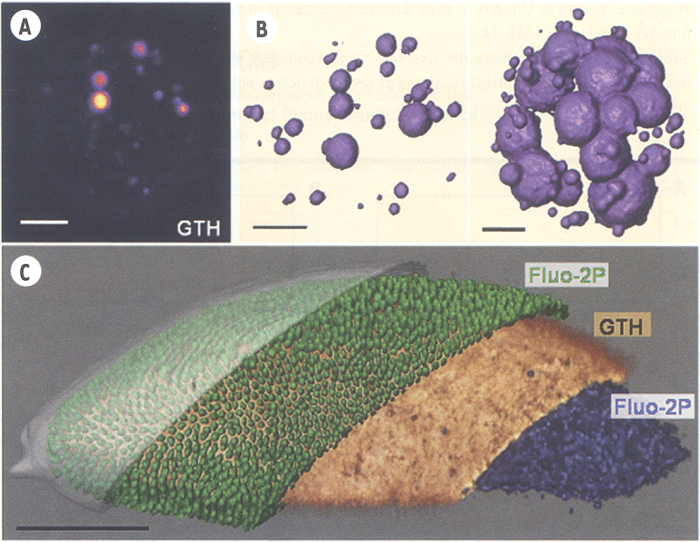
Certaines structures intracellulaires sont des sources de signal particulièrement efficaces pour la microscopie GTH. C’est notamment le cas des « gros » corps lipidiques (≥ 0,3 µm), pour deux raisons. Premièrement, le signal GTH est exalté pour des structures de taille légèrement inférieures au volume focal [32, 33]. Deuxièmement, les propriétés optiques linéaires et non linéaires d’un milieu lipidique sont très différentes de celles d’une solution aqueuse [30]. Une structure lipidique de quelques centaines de nanomètres dans un environnement cytoplasmique constitue donc une inclusion de taille et aux propriétés optiques optimales pour favoriser un contraste par GTH. Notre équipe a montré récemment qu’il est ainsi possible de détecter les corps lipidiques avec une grande spécificité dans les hépatocytes et d’utiliser ce signal pour quantifier le contenu lipidique selon l’état physiologique des cellules [30] (Figure 5A-B). L’embryon précoce de Drosophile est également riche en corps lipidiques de taille ~ 0,5 µm qui sont activement transportés entre les cellules et le vitellus en début de gastrulation. La microscopie GTH permet de suivre individuellement ces vésicules dans l’embryon vivant [30]. Par combinaison avec la microscopie Fluo-2P, il est également possible de visualiser leur distribution dans l’embryon (Figure 5C).
Figure 5
Imagerie GTH des corps lipidiques.
A. Image GTH d’un hépatocyte de rat isolé non marqué. Les corps lipidiques apparaissent comme des points lumineux. Barre : 5 µm. B. Reconstruction 3D de la distribution des corps lipidiques dans un hépatocyte normal (gauche) et provenant d’un foie en régénération (droite). Barres : 5 µm. C. Image GTH/Fluo-2P d’un embryon de drosophile vivant, illustrant la ségrégation des gouttelettes lipidiques entre les cellules en formation et le vitellus à ce stade du développement. Orange : corps lipidiques (GTH, excitation 1 180 nm). Vert : noyaux marqués par GFP (Fluo-2P, exc. 900 nm). Bleu : structures fluorescentes du vitellus (Fluo-2P, exc. 740 nm). Gris : membrane vitelline (Fluo-2P). Barre : 100 µm (d’après [30]).
Possibilité d’imager en épidétection
Comme cela est mentionné plus haut, les ondes GSH et GTH se propagent en général dans la direction du faisceau excitateur, ce qui impose de les détecter en transmission. Ce phénomène limite, en principe, ces techniques à l’observation d’échantillons minces (< 1-3 mm). Cependant, l’observation en épidétection d’échantillons épais est parfois possible car le rayonnement harmonique est fortement diffusé par les tissus ; une fraction significative est ainsi redirigée vers l’objectif et peut être collectée par un système de détection optimisé [30] (Figure 6). Notons également que les fibrilles de collagène produisent un signal SH important vers l’arrière, ce qui permet de les observer très facilement en épidétection.
Figure 6
Rétrodiffusion par les tissus épais du rayonnement émis vers l’avant.
A. Dans un échantillon mince (cellule, monocouche…), le rayonnement GSH ou GTH émis vers l’avant (violet) est nécessairement détecté en transmission. B. Dans un tissu épais (diffusant), le rayonnement est en partie rétrodiffusé vers l’objectif d’excitation et peut être épidétecté à condition qu’il ne soit pas réabsorbé avant de sortir du tissu (croix verte).
Conclusions
Bien qu’encore relativement peu répandues, les microscopies GSH et GTH se combinent très naturellement avec la microscopie Fluo-2P pour l’observation de tissus intacts et fournissent des informations complémentaires. Étant donné leur potentiel dans le cadre de nombreuses études biomédicales, on peut anticiper une diffusion de ces méthodes dans les laboratoires avec l’arrivée de lasers miniaturisés et facilement accordables dans la gamme 700-1 200 nm. Ces techniques gagneront également à être associées avec des techniques d’imagerie spectroscopiques telles que la microscopie CARS.
Parties annexes
Remerciements
Les illustrations présentées dans cet article de synthèse sont le résultat de plusieurs collaborations et nous remercions chaleureusement nos collègues pour de nombreuses discussions et pour nous avoir fourni ces échantillons : E. Farge (Institut Curie/CNRS), B. Moulia (INRA), L. Combettes et T. Tordjmann (Inserm U757/Université Paris XI), G. Godeau et N. Pagès (Université Paris V), C. Hadjur et A. Colonna (L’Oréal), B. Crestani et A. Fabre (Hôpital Bichat/Inserm U700), M. Hernest (École Polytechnique), et P.L. Tharaux (Hôpital Tenon/INSERM U702). Nous remercions également la Délégation Générale pour l’Armement, la Fondation pour la Recherche Médicale, et la région Ile-de-France pour leur soutien financier.
Références
- 1. Denk W, Strickler JH, Webb WW. Two-photon laser scanning fluorescence microscopy. Science 1990 ; 248 : 73-6.
- 2. Zipfel WR, Williams RM, Webb WW. Nonlinear magic : multiphoton microscopy in the biosciences. Nat Biotechnol 2003 ; 21 : 1369-77.
- 3. Helmchen F, Denk W. Deep tissue two-photon microscopy. Nat Methods 2005 ; 2 : 932-40.
- 4. Moreaux L, Sandre O, Blanchard-Desce M, et al. Membrane imaging by simultaneous second-harmonic generation and two-photon microscopy. Opt Lett 2000 ; 25 : 320-2.
- 5. Moreaux L, Sandre O, Charpak S, et al. Coherent scattering in multi-harmonic light microscopy. Biophys J 2001 ; 80 : 1568-74.
- 6. Sacconi L, Dombeck DA, Webb WW. Overcoming photodamage in second-harmonic generation microscopy : real-time optical recording of neuronal action potentials. Proc Nat Acad Sci USA 2006 ; 103 : 3124-9.
- 7. Freund I, Deutsch M, Sprecher A. Optical second-harmonic microscopy, crossed-beam summation and small-angle scattering in rat-tail tendon. Biophys J 1986 ; 50 : 693-712.
- 8. Campagnola PJ, Millard AC, Terasaki M, et al. Three-dimensional high-resolution second-harmonic generation imaging of endogenous structural proteins in biological tissues. Biophys J 2002 ; 82 : 493-508.
- 9. Stoller P, Reiser KM, Celliers PM, et al. Polarization-modulated second harmonic generation in collagen. Biophys J 2002 ; 82 : 3330-42.
- 10. Wang W, Wyckoff JB, Frohlich VC, et al. Single cell behavior in metastatic primary mammary tumors correlated with gene expressions patterns revealed by molecular profiling. Cancer Res 2002 ; 62 : 6278-88.
- 11. Cox G, Kable E, Jones A, et al. Three-dimensional imaging of collagen using second harmonic generation. J Struct Biol 2003 ; 141 : 53-62.
- 12. Williams RM, Zipfel WR, Webb WW. Interpreting second-harmonic generation images of collagen i fibrils. Biophys J 2005 ; 88 : 1377-86.
- 13. Zoumi A, Lu X, Kassab GS, et al. Imaging coronary artery microstructure using second-harmonic and two-photon fluorescence microscopy. Biophys J 2004 ; 87 : 2778-86.
- 14. Both M, Vogel M, Friedrich O, et al. Second harmonic imaging of intrinsic signals in muscle fibers in situ. J Biomed Opt 2004 ; 9 : 882-92.
- 15. Boulesteix T, Beaurepaire E, Sauviat MP, et al. Second-harmonic microscopy of unstained living cardiac myocytes : Measurements of sarcomere length with 20 nm accuracy. Opt Lett 2004 ; 29 : 2031-3.
- 16. Plotnikov SV, Millard AC, Campagnola PJ, et al. Characterization of the myosin-based source for second-harmonic generation from muscle sarcomeres. Biophys J 2006 ; 90 : 693-703.
- 17. Dombeck DA, Kasischke KA, Vishwasrao HD, et al. Uniform polarity microtubule assemblies imaged in native brain tissues by second-harmonic generation microscopy. Proc Nat Acad Sci USA 2003 ; 100 : 7081-6.
- 18. Cox G, Moreno N, Feijo J. Second-harmonic imaging of plant polysaccharides. J Biomed Optics 2005 ; 10 : 02413.
- 19. Brown E, McKee T, diTomaso E, et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second harmonic generation. Nat Med 2003 ; 9 : 796-801.
- 20. Zipfel WR, Williams RM, Christie R, et al. Live tissue intrinsic emission microscopy using multiphoton-excited native fluorescence and second-harmonic generation. Proc Nat Acad Sci USA 2003 ; 100 : 7075-80.
- 21. König K, Riemann I. High-resolution multiphoton tomography of human skin with subcellular spatial resolution and picosecond time resolution. J Biomed Opt 2003 ; 8 : 432-9.
- 22. Boulesteix T, Pena AM, Pagès N, et al. Micrometer-scale ex vivo multiphoton imaging of unstained arterial wall structure. Cytometry A 2006 ; 69 : 20-6.
- 23. Hernest M, Pena AM, Strupler M, et al. Nouvelle approche des fibroses par microscopie multiphotonique avec génération de second harmonique. Med Sci(Paris) 2006 ; 22 (sous presse).
- 24. Pena AM, Boulesteix T, Dartigalongue T, et al. Chiroptical effects in the second harmonic signal of collagens i and iv. J Am Chem Soc 2005 ; 127 : 10314-22.
- 25. Barad Y, Eisenberg H, Horowitz M, et al. Nonlinear scanning laser microscopy by third harmonic generation. Appl Phys Lett 1997 ; 70 : 922-4.
- 26. Squier JA, Müller M, Brakenhoff GJ, et al. Third harmonic generation microscopy. Opt Express 1998 ; 3 : 315-24.
- 27. Oron D, Yelin D, Tal E, et al. Depth-resolved structural imaging by third-harmonic generation microscopy. J Struct Biol 2004 ; 147 : 3-11.
- 28. Sun CK, Chu SW, Chen SY, et al. Higher harmonic generation microscopy for developmental biology. J Struct Biol 2004 ; 147 : 19-30.
- 29. Débarre D, Supatto W, Farge E, et al. Velocimetric third-harmonic generation microscopy : micrometer-scale quantification of morphogenetic movements in unstained embryos. Opt Lett 2004 ; 29 : 2881-3.
- 30. Débarre D, Supatto W, Pena AM, et al. Imaging lipid bodies in cells and tissues using third-harmonic generation microscopy. Nat Methods 2006 ; 3 : 47-53.
- 31. Supatto W, Débarre D, Moulia B, et al.In vivo modulation of morphogenetic movements in Drosophila embryos with femtosecond laser pulses. Proc Nat Acad Sci USA 2005 ; 102 : 1047-52.
- 32. Cheng JX, Xie XS. Green’s function formulation for third harmonic generation microscopy. J Opt Soc Am B 2002 ; 19 : 1604-10.
- 33. Débarre D, Supatto W, Beaurepaire E. Structure sensitivity in third-harmonic generation microscopy. Opt Lett 2005 ; 30 : 2134-6.
Liste des figures
Figure 1
Mécanismes de la fluorescence excitée à deux photons (Fluo-2P), de la génération de second (GSH) et troisième (GTH) harmoniques.
Figure 2
Imagerie GSH/Fluo-2P du collagène et de la matrice extracellulaire.
Vert : images GSH. Rouge : Images Fluo-2P. Excitation à 860 nm. Fluo-2P détectée dans la gamme 450-550 nm. Barres d’échelle : A, C 100 µm ; B 25 µm. A. Biopsie de peau humaine observée au niveau de la jonction dermo-épidermique (80 µm sous la surface). Barre d’échelle : 100 µm. B. Alvéoles et bronchioles d’un poumon de souris. Le signal Fluo-2P provient principalement des fibres élastiques et des macrophages. Barre : 25 µm. C. Reconstruction tridimensionnelle d’une paroi artérielle de rat où la GSH révèle la distribution du collagène dans l’adventice et la Fluo-2P la distribution des lames élastiques dans la media (d’après [22]). Barre : 100 µm.
Figure 3
Imagerie GSH de structures musculaires.
Figure 4
Imagerie dynamique du développement embryonnaire par GTH.
A. Embryon de drosophile vivant observé dans le plan sagittal avant la gastrulation. B. Champ de déplacement des tissus et des structures internes (voir texte) pendant les mouvements morphogénétiques de convergence-extension. Flèche d’échelle : 5 µm/min. (D’après [29]). C. Haut : embryon sauvage observé dans un plan parasagittal permettant de visualiser les tissus latéraux. Bas : image d’un mutant concertina observé dans les mêmes conditions, illustrant l’altération de la morphogenèse dans cette souche. Barres d’échelle A, B, C : 50 µm.
Figure 5
Imagerie GTH des corps lipidiques.
A. Image GTH d’un hépatocyte de rat isolé non marqué. Les corps lipidiques apparaissent comme des points lumineux. Barre : 5 µm. B. Reconstruction 3D de la distribution des corps lipidiques dans un hépatocyte normal (gauche) et provenant d’un foie en régénération (droite). Barres : 5 µm. C. Image GTH/Fluo-2P d’un embryon de drosophile vivant, illustrant la ségrégation des gouttelettes lipidiques entre les cellules en formation et le vitellus à ce stade du développement. Orange : corps lipidiques (GTH, excitation 1 180 nm). Vert : noyaux marqués par GFP (Fluo-2P, exc. 900 nm). Bleu : structures fluorescentes du vitellus (Fluo-2P, exc. 740 nm). Gris : membrane vitelline (Fluo-2P). Barre : 100 µm (d’après [30]).
Figure 6
Rétrodiffusion par les tissus épais du rayonnement émis vers l’avant.
A. Dans un échantillon mince (cellule, monocouche…), le rayonnement GSH ou GTH émis vers l’avant (violet) est nécessairement détecté en transmission. B. Dans un tissu épais (diffusant), le rayonnement est en partie rétrodiffusé vers l’objectif d’excitation et peut être épidétecté à condition qu’il ne soit pas réabsorbé avant de sortir du tissu (croix verte).