Corps de l’article
L’appareil de Golgi, localisé à proximité du centrosome, est formé d’empilements de citernes allongées, connectées latéralement par des tubules. Malgré cette organisation complexe, l’appareil de Golgi est très dynamique et capable de former des tubules et des vésicules durant le processus de sécrétion, ou en réponse à des événements cellulaires spécifiques comme la mitose. Chaque face de l’appareil de Golgi est flanquée d’un réseau tubulo-réticulaire servant de point d’entrée ou de sortie du Golgi (réseau cis-golgien faisant face au réticulum endoplasmique - RE, et réseau trans-golgien orienté vers la membrane plasmique). Les protéines qui atteignent le réseau cis-golgien en provenance du RE peuvent être recyclées vers le RE, ou transportées plus loin à travers les citernes golgiennes où elles pourront être modifiées grâce à l’activité séquentielle d’enzymes présentes dans chacune des citernes individuelles. À leur arrivée dans le réseau trans-golgien, ces protéines sont empaquetées dans des vésicules de transport qui les achemineront vers la membrane plasmique ou les endosomes (Figure 1).
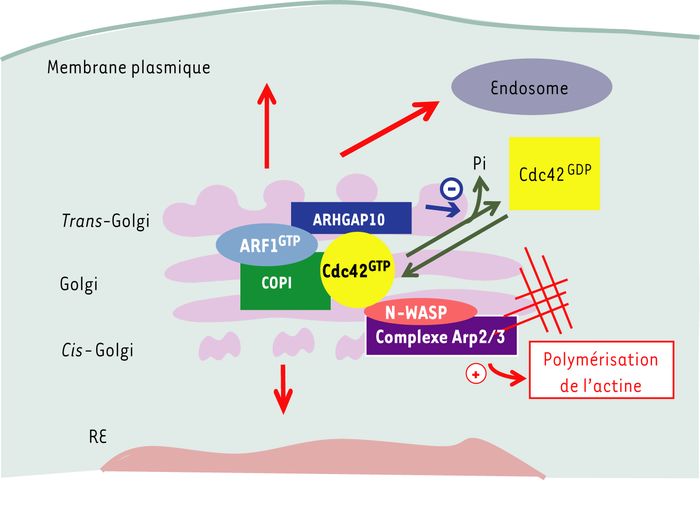
Figure 1
Régulation de la dynamique du cytosquelette d’actine golgien par ARF1.
La petite protéine ARF1 activée par liaison au GTP est localisée sur la face externe de l’appareil de Golgi où elle recrute des protéines effectrices variées incluant les protéines du manteau COPI impliqué dans la formation des vésicules de transport. Sur les membranes golgiennes, COPI interagit avec Cdc42, un des membres de la famille des protéines RHO. Cdc42 peut interagir avec la protéine N-WASP impliquée dans l’activation du complexe nucléateur d’actine Arp2/3. Cette cascade, qui est régulée positivement par ARF1, aboutit à l’assemblage des filaments d’actine au niveau des membranes golgiennes. GTP-ARF1 interagit également avec ARHGAP10, une protéine comportant un domaine RhoGAP capable de stimuler l’hydrolyse du GTP sur Cdc42 pour aboutir à la production de Cdc42-GDP et de phosphate (Pi). Cette double action positive et négative exercée par ARF1 sur l’activité de Cdc42 est probablement nécessaire à la dynamique du cytosquelette d’actine et au fonctionnement de l’appareil de Golgi.
La petite protéine G ARF1 (facteur d’ADP-ribosylation 1), qui est localisée sur la face externe de l’appareil de Golgi, joue un rôle essentiel dans la formation des vésicules qui assurent le transport des protéines à travers et à partir de l’appareil de Golgi [1]. Comme toutes les protéines G, ARF1 existe sous une forme active liée au GTP et sous une forme inactive liée au GDP. Le passage d’une forme à l’autre est régulé par des protéines qui favorisent soit l’hydrolyse du GTP en GDP (protéines GAP, GTPase activating protein), soit le remplacement du GDP par le GTP (facteurs d’échange nucléotidique) [2]. De plus, dans le cas d’ARF1, le cycle nucléotidique est couplé à un cycle d’association-dissociation membranaire : la liaison du GTP catalysée par des facteurs d’échange nucléotidiques spécifiques localisés sur l’appareil de Golgi provoque l’exposition d’une hélice amino-terminale hydrophobe modifiée par un groupement myristate qui permet un ancrage stable d’ARF1-GTP dans la membrane golgienne [1].
À la surface de l’appareil de Golgi, ARF1-GTP interagit avec différents effecteurs, parmi lesquels un complexe de six protéines appelé coatomer qui, avec ARF1-GTP, constitue le composant élémentaire du manteau COPI, ainsi que les complexes adaptateurs AP1, AP3 et AP4, et les protéines GGA1-3 qui s’associent avec la clathrine. Les protéines de manteau déforment les membranes planes des citernes golgiennes pour engendrer des bourgeons, précurseurs des vésicules, et capturent des protéines membranaires pour les incorporer dans les vésicules en formation [3, 4]. Après leur détachement du compartiment donneur, les vésicules de transport perdent leur manteau avant de fusionner avec une membrane accepteuse spécifique. Le cycle d’assemblage-désassemblage des manteaux COPI et clathrine sur les vésicules golgiennes est intimement couplé au cycle GTP/GDP d’ARF1.
Un autre élément essentiel de l’intégrité et de l’organisation de l’appareil de Golgi est le cytosquelette d’actine. L’actine elle-même, ainsi que de nombreuses protéines liant l’actine sont en effet associées aux membranes et aux vésicules golgiennes. Des drogues comme les cytochalasines, qui inhibent la polymérisation des monomères d’actine en filaments, bloquent le transport de la glycoprotéine G du virus de la stomatite vésiculaire (VSV-G) à travers l’appareil de Golgi et affectent la morphologie de l’appareil de Golgi, alors que d’autres drogues ciblant le cytosquelette, comme la latrunculine B et la toxine botulinique C2, inhibent le transport rétrograde du Golgi vers le RE [5]. Bien que son rôle ne soit pas complètement éclairci, ce cytosquelette d’actine semble important pour maintenir l’organisation générale et le positionnement de l’appareil de Golgi et pourrait avoir également une action directe dans le transport en facilitant le détachement des vésicules [6].
La polymérisation et l’organisation des filaments d’actine dans la cellule sont régulées par les petites protéines G de la famille RHO qui compte une vingtaine de membres. Les protéines Rho sont activées (en échangeant leur GDP pour du GTP) en réponse à une grande variété de signaux extracellulaires. Elles jouent un rôle essentiel dans des processus cellulaires variés incluant la migration cellulaire, l’adhérence, la phagocytose, grâce à la régulation de l’activité de nombreuses protéines effectrices contrôlant l’assemblage et l’organisation des filaments d’actine [7]. Récemment, plusieurs membres de cette famille ont également été impliqués dans la régulation du trafic intracellulaire [8]. Ainsi, les protéines Cdc42 et RhoA, qui sont présentes au niveau de l’appareil de Golgi, sont nécessaires au transport et au maintien de l’organisation de cet organite [9-11]. La protéine N-WASP ainsi que le complexe nucléateur d’actine Arp2/3 sont également associés avec l’appareil de Golgi vraisemblablement grâce à l’interaction de N-WASP avec Cdc42-GTP [11, 12]. L’activation du complexe Arp2/3 par Cdc42/N-WASP permettrait la polymérisation de novo de filaments d’actine au niveau du Golgi.
Le recrutement de Cdc42 au niveau du Golgi dépend de son interaction avec une des sous-unités du manteau COPI [13]. Par conséquent, il a été proposé qu’ARF1 pourrait contrôler la polymérisation de l’actine au niveau du Golgi à travers une cascade COPI/Cdc42/N-WASP/Arp2/3 [14] (Figure 1). Les résultats que nous avons obtenus récemment indiquent que les choses sont vraisemblablement plus complexes. En effet, nous avons identifié une nouvelle protéine qui régule l’activité de Cdc42, appelée ARHGAP10, qui est recrutée sur l’appareil de Golgi grâce à son association avec ARF1-GTP [15].
ARHGAP10 est une protéine de 1 957 acides aminés, exprimée de façon ubiquitaire et conservée durant l’évolution [16]. ARHGAP10 comporte trois domaines structuraux : un domaine PDZ (d’après les initiales des protéines PSD-95, Dlg et ZO-1), un domaine PH (pleckstrin homology), ainsi qu’un domaine RhoGAP. Les domaines RhoGAP, qui sont retrouvés dans une large famille de protéines, stimulent l’hydrolyse du GTP des protéines Rho et leur retour sous la forme inactive liée au GDP [17]. Nous avons montré que le domaine RhoGAP d’ARHGAP10 stimule préférentiellement l’hydrolyse du GTP sur Cdc42.
Des expériences d’immunofluorescence indirecte ont révélé qu’ARHGAP10 est associée principalement à l’appareil de Golgi. Cette association dépend de l’interaction d’ARHGAP10 avec ARF1-GTP au niveau d’une région d’une centaine d’acides aminés comprenant le domaine PH. Contrairement à d’autres domaines PH, celui d’ARHGAP10 ne semble pas capable de se lier aux lipides membranaires. Ces observations semblaient indiquer qu’ARHGAP10 contrôle l’activité de Cdc42 au niveau de l’appareil de Golgi en aval d’ARF1.
Afin de caractériser la fonction d’ARHGAP10, nous avons éteint son expression grâce à la technologie des ARN interférents (ARNi). La diminution de l’expression d’ARHGAP10 dans les cellules HeLa s’accompagne d’un étalement cellulaire, d’une réorganisation du cytosquelette d’actine, d’une fragmentation de l’appareil de Golgi et d’une accumulation du complexe Arp2/3 dans la région golgienne : conséquences probables de l’accumulation de Cdc42 sous forme GTP en absence d’ARHGAP10.
Finalement, nous avons montré que l’expression d’un mutant constitutivement actif d’ARF1 induit l’apparition de structures enrichies en filaments d’actine et en complexe Arp2/3, dont la formation nécessite l’activité de Cdc42 et qui sont inhibées par l’expression du domaine RhoGAP d’ARHGAP10.
En conclusion, nos résultats démontrent qu’ARF1 exerce un double contrôle sur la polymérisation de l’actine au niveau de l’appareil de Golgi, positif à travers la cascade COPI/Cdc42/N-WASP/Arp2/3, et négatif en régulant l’activité de Cdc42 à travers ARHGAP10 (Figure 1). La conjonction de ces deux voies de signalisation est probablement nécessaire pour assurer la dynamique du cytosquelette d’actine au niveau de l’appareil de Golgi. Des expériences futures diront si ce cytosquelette d’actine a un rôle structurant au niveau de l’appareil de Golgi et/ou est impliqué dans la formation des vésicules de transport.
Parties annexes
Références
- 1. Chavrier P, Goud B. The role of ARF and rab GTPases in membrane transport. Curr Opin Cell Biol 1999 ; 11 : 466-75.
- 2. Donaldson JG, Jackson CL. Regulators and effectors of the ARF GTPases. Curr Opin Cell Biol 2000 ; 12 : 475-82.
- 3. Antonny B. Contrôle de l’assemblage des manteaux protéiques COPI par les petites protéines G Arf et Sar. Med Sci (Paris) 2002 ; 18 : 1012-6.
- 4. Bonifacino JS, Lippincott-Schwartz J. Coat proteins: shaping membrane transport. Nat Rev Mol Cell Biol 2003 ; 4 : 409-14.
- 5. Stamnes M. Regulating the actin cytoskeleton during vesicular transport. Curr Opin Cell Biol 2002 ; 14 : 428-33.
- 6. Carreno S, Engqvist-Goldstein AE, Zhang CX, et al. Actin dynamics coupled to clathrin-coated vesicle formation at the trans-Golgi network. J Cell Biol 2004 ; 165 : 781-8.
- 7. Etienne-Manneville S, Hall A. Rho GTPases in cell biology. Nature 2002 ; 420 : 629-35.
- 8. Qualmann B, Mellor H. Regulation of endocytic traffic by Rho GTPases. Biochem J 2003 ; 371 : 233-41.
- 9. Camera P, Da Silva JS, Griffiths G, et al. Citron-N is a neuronal Rho-associated protein involved in Golgi organization through actin cytoskeleton regulation. Nat Cell Biol 2003 ; 5 : 1071-8.
- 10. Musch A, Cohen D, Kreitzer G, Rodriguez-Boulan E. Cdc42 regulates the exit of apical and basolateral proteins from the trans-Golgi network. EMBO J 2001 ; 20 : 2171-9.
- 11. Luna A, Matas OB, Martinez-Menarguez JA, et al. Regulation of protein transport from the Golgi complex to the endoplasmic reticulum by CDC42 and N-WASP. Mol Biol Cell 2002 ; 13 : 866-79.
- 12. Matas OB, Martinez-Menarguez JA, Egea G. Association of Cdc42/N-WASP/Arp2/3 signaling pathway with Golgi membranes. Traffic 2004 ; 5 : 838-46.
- 13. Wu WJ, Erickson JW, Lin R, Cerione RA. The gamma-subunit of the coatomer complex binds Cdc42 to mediate transformation. Nature 2000 ; 405 : 800-4.
- 14. Chen JL, Lacomis L, Erdjument-Bromage H, et al. Cytosol-derived proteins are sufficient for Arp2/3 recruitment and ARF/coatomer-dependent actin polymerization on Golgi membranes. FEBS Lett 2004 ; 566 : 281-6.
- 15. Dubois T, Paleotti O, Mironov AA, et al. Golgi-localized GAP for Cdc42 functions downstream of ARF1 to control Arp2/3 complex and F-actin dynamics. Nat Cell Biol 2005 ; 7 : 353-64.
- 16. Basseres DS, Tizzei EV, Duarte AA, et al. ARHGAP10, a novel human gene coding for a potentially cytoskeletal Rho-GTPase activating protein. Biochem Biophys Res Commun 2002 ; 294 : 579-85.
- 17. Bernards A. GAPs galore! A survey of putative Ras superfamily GTPase activating proteins in man and Drosophila. Biochim Biophys Acta 2003 ; 1603 : 47-82.
Liste des figures
Figure 1
Régulation de la dynamique du cytosquelette d’actine golgien par ARF1.
La petite protéine ARF1 activée par liaison au GTP est localisée sur la face externe de l’appareil de Golgi où elle recrute des protéines effectrices variées incluant les protéines du manteau COPI impliqué dans la formation des vésicules de transport. Sur les membranes golgiennes, COPI interagit avec Cdc42, un des membres de la famille des protéines RHO. Cdc42 peut interagir avec la protéine N-WASP impliquée dans l’activation du complexe nucléateur d’actine Arp2/3. Cette cascade, qui est régulée positivement par ARF1, aboutit à l’assemblage des filaments d’actine au niveau des membranes golgiennes. GTP-ARF1 interagit également avec ARHGAP10, une protéine comportant un domaine RhoGAP capable de stimuler l’hydrolyse du GTP sur Cdc42 pour aboutir à la production de Cdc42-GDP et de phosphate (Pi). Cette double action positive et négative exercée par ARF1 sur l’activité de Cdc42 est probablement nécessaire à la dynamique du cytosquelette d’actine et au fonctionnement de l’appareil de Golgi.