Corps de l’article
Cryptococcus neoformans est l’agent de la cryptococcose, une infection opportuniste affectant les malades atteints du sida ou d’autres déficits de l’immunité cellulaire. Elle réalise une infection disséminée, dont la localisation la plus fréquente et la plus grave est une méningo-encéphalite, mortelle dans environ 20 % des cas malgré un traitement antifongique adapté [1]. Alors que l’incidence de la maladie a diminué dans les pays occidentaux avec l’ère de la trithérapie, la cryptococcose reste une cause majeure de méningite en Afrique subsaharienne [2]. La physiopathologie de l’infection reste mal comprise. La porte d’entrée est probablement respiratoire, aboutissant à une primo-infection pulmonaire souvent asymptomatique, puis la levure persisterait dans l’organisme sous une forme latente [3]. À la faveur d’une immunosuppression, la levure serait « réactivée » et, au cours d’un épisode de fongémie, pénétrerait dans le compartiment cérébral à travers la barrière hémato-encéphalique (BHE). Il s’agit d’une barrière anatomique et fonctionnelle normalement étanche aux agents pathogènes, constituée notamment de cellules endothéliales dont une particularité est d’être unies par des jonctions serrées. Les mécanismes précis aboutissant à la constitution de la méningo-encéphalite restent largement méconnus. Il a été longtemps supposé que l’infection du liquide céphalo-rachidien précédait celle du parenchyme cérébral, comme au cours de nombreuses méningites bactériennes. C. neoformans est entouré d’une capsule, ainsi qu’un grand nombre de pathogènes responsables de méningites. Cette capsule polyosidique est son principal facteur de virulence, mais son rôle dans la constitution de l’infection cérébrale est encore obscur.
L’objectif de notre travail était d’étudier les événements les plus précoces aboutissant à la traversée de la BHE, dans un modèle expérimental mis au point au laboratoire. Dans ce modèle, l’inoculation intraveineuse de levures produit une infection disséminée comparable à la cryptococcose humaine (lésions histologiques cérébrales et réponses inflammatoires systémique et cérébrale identiques chez l’homme et chez la souris) [4-6].
Après inoculation des levures et sacrifice des animaux à des temps séquentiels, les organes étaient prélevés, la charge fongique évaluée par culture du broyat, et la morphologie des tissus et des levures analysée par histologie classique, immunofluorescence et microscopie électronique [7].
Nous avons ainsi mis en évidence la présence de levures vivantes dans le cerveau dès 5 minutes après inoculation, les levures étant intravasculaires. C’est à partir de la 6e heure que les premières levures intraparenchymateuses étaient observées, témoignant de la traversée de la BHE. Plus de 96 % des levures ont été observées dans le cortex cérébral sus- et sous-tentoriel dans les 48 premières heures. Seules les levures vivantes étaient capables de traverser la BHE. Aucune levure n’a été visualisée au niveau des plexus choroïdes, contrairement à ce qui est décrit au cours des méningites bactériennes. La dissémination méningée pourrait constituer un événement tardif dans la genèse de la cryptococcose neuroméningée, par extension à partir d’un foyer microkystique cortical.
Le franchissement de la BHE s’accompagnait d’altérations fonctionnelles et anatomiques de cette structure. Sur le plan fonctionnel, l’injection intraveineuse de horse radish peroxydase a permis d’objectiver une fuite extravasculaire du marqueur dès la 6e heure post-inoculation, plus marquée à la 24e heure, traduisant une rupture de la BHE. Sur le plan anatomique, l’intégrité de la structure vasculaire était analysée par un immunomarquage du collagène IV, composant de la membrane basale capillaire, et par microscopie électronique. Tandis qu’aux temps précoces (< 1 h), les membranes basales des capillaires étaient intactes, les capillaires des cerveaux prélevés à 24 et 48 heures révélaient des altérations structurales majeures des cellules endothéliales, avec rupture de la membrane basale capillaire. L’un des mécanismes pourrait être la séquestration des levures dans des capillaires trop fins et la déchirure mécanique de ceux-ci par distorsion mécanique.
La traversée de la BHE s’accompagnait de modifications phénotypiques des levures. Ainsi, les levures observées dans les cerveaux de souris sacrifiées 6 et 24 heures après l’inoculation étaient significativement plus grosses que celles observées dans le cerveau des souris sacrifiées 1 heure après l’inoculation (p < 10- 4). Surtout, des modifications de structure capsulaire associées étaient visualisées grâce à l’utilisation de deux anticorps monoclonaux reconnaissant des structures capsulaires différentes, E1 et CRND-8, se liant respectivement sur 99 % et 1 % des levures inoculées. Ainsi, au cours du temps, les levures visualisées dans le cerveau des souris étaient toutes initialement (1 heure) marquées par l’anticorps E1 uniquement, alors qu’à 6 heures apparaissait un double marquage concentrique, et qu’à 24 et 48 heures toutes les levures étaient uniquement marquées par CRND-8 (Figure 1). Ces modifications, visualisées dans d’autres tissus (rein, muscle strié et myocarde) avec la même cinétique, étaient, dans d’autres organes, plus tardives (poumon) ou absentes (rate, foie). Les cinétiques étant similaires dans des tissus très différents tels que le cerveau et le muscle nous font penser que ce n’est pas l’environnement tissulaire (enzymes, pression de CO2 …) qui est en cause, mais plutôt la structure fenestrée ou non des capillaires. Des expériences complémentaires seront nécessaires pour valider cette hypothèse et décortiquer les mécanismes qui permettent à la levure de changer si rapidement sa capsule, interface cruciale avec les cellules de l’hôte.
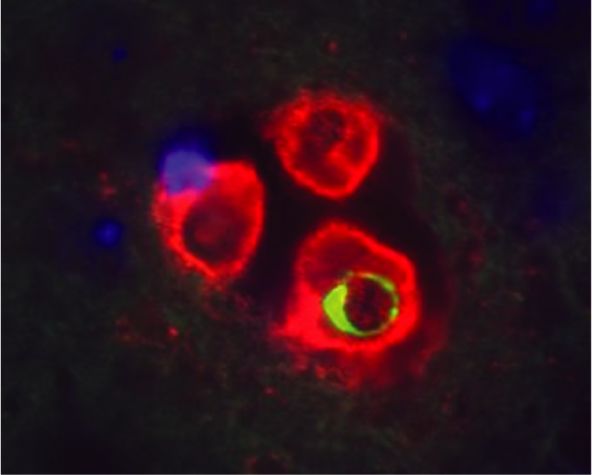
Figure 1
Pseudo-abcès visualisé dans le cerveau d’une souris 24 heures après l’inoculation de Cryptococcus neoformans.
La capsule polyosidique des trois levures est marquée en rouge par l’anticorps monoclonal CRND-8 (couplé au TRITC), qui révèle ici une structure capsulaire nouvelle, inexistante sur les levures injectées initialement, dont la structure caspulaire, non reconnue alors par CRND-8, l’était par l’anticorps monoclonal E1 (ici conjugué au FITC et donnant un halo interne vert sur l’une des levures).
Ces expériences objectivent donc in vivo les modifications précoces de structure capsulaire effectuées par C. neoformans au cours de la traversée de la BHE et de la dissémination. Ce phénomène pourrait participer à l’échappement immunitaire évoqué comme l’un des mécanisme de persistance de la levure dans l’organisme des patients ayant des déficits de l’immunité cellulaire.
Parties annexes
Références
- 1. Lortholary O, Droz C, Sitbon K, et al. Long-term outcome of HIV-associated cryptococcosis at the time of HAART. Results of the multicenter cohort cryptostop. Chicago : 43 rd Interscience Conference on Antimicrobial Agents and Chemotherapy, september 2003 : M-1752.
- 2. French N, Gray K, Watera C, et al. Cryptococcal infection in a cohort of HIV-1-infected Ugandan adults. AIDS 2002 ; 16 : 1031-8.
- 3. Garcia-Hermoso D, Dromer F, Mathoulin-Pelissier S, Janbon G. Are two Cryptococcus neoformans strains epidemiologically linked? J Clin Microbiol 2001 ; 39 : 1402-6.
- 4. Lortholary O, Improvisi L, Nicolas M, et al. Fungemia during murine cryptococcosis sheds some light on pathophysiology. Med Mycol 1999 ; 37 : 169-74.
- 5. Lortholary O, Improvisi L, Rayhane N, et al. Cytokine profiles of AIDS patients are similar to those of mice with disseminated Cryptococcus neoformans infection. Infect Immun 1999 ; 67 : 6314-20.
- 6. Chrétien F, Lortholary O, Kansau I, et al. Pathogenesis of cerebral Cryptococcus neoformans infection after fungemia. J Infect Dis 2002 ; 186 : 522-30.
- 7. Charlier C, Chrétien F, Baudrimont M, et al. Capsule structure changes associated with Cryptococcus neoformans crossing of the blood-brain barrier. Am J Pathol 2005 ; 166 : 421-32.
Liste des figures
Figure 1
Pseudo-abcès visualisé dans le cerveau d’une souris 24 heures après l’inoculation de Cryptococcus neoformans.
La capsule polyosidique des trois levures est marquée en rouge par l’anticorps monoclonal CRND-8 (couplé au TRITC), qui révèle ici une structure capsulaire nouvelle, inexistante sur les levures injectées initialement, dont la structure caspulaire, non reconnue alors par CRND-8, l’était par l’anticorps monoclonal E1 (ici conjugué au FITC et donnant un halo interne vert sur l’une des levures).