Corps de l’article
Le facteur de transcription PXR (pregnane X receptor, NR1I2) coordonne la fonction de détoxication, ensemble de voies métaboliques chargées d’éliminer les molécules lipophiles potentiellement toxiques pour l’organisme [1]. En association avec le récepteur des rétinoïdes RXR, il induit la transcription de gènes cibles en se fixant sur leur promoteur, sur de courtes séquences d’ADN (NRE). Il est exprimé dans le foie, le tube digestif et les reins. Contrairement à la majorité des récepteurs nucléaires « classiques » chargés de reconnaître une hormone endogène en vue de régler une fonction physiologique, ce récepteur semble être dédié à la reconnaissance de molécules toxiques de structures et d’origines diverses. En effet, son domaine de fixation des ligands, à la fois vaste et flexible, lui permet de se lier à des molécules endogènes (stéroïdes, acides biliaires) et exogènes (toxines végétales, polluants, pesticides). Ses gènes cibles englobent les acteurs de la fonction de détoxication : notamment les cytochromes P450 2B6, 2C8 et 3A4, et les transporteurs membranaires MDR-1 et MRP2. Par analogie avec le système immunitaire, PXR peut être assimilé à un récepteur chargé de reconnaître de nombreux agresseurs de nature chimique afin d’induire l’expression des gènes chargés de les inactiver et de les éliminer.
Ce récepteur joue aussi un grand rôle en clinique car il est à l’origine d’interactions médicamenteuses indésirables : modifications des paramètres pharmacocinétiques, augmentation de la clairance ou de la toxicité des traitements co-administrés [2]. En effet, PXR est activé par de nombreux médicaments et il contrôle, par ailleurs, l’expression des enzymes et transporteurs ayant un impact direct sur la biodisponibilité, l’efficacité ou la toxicité de nombreuses molécules thérapeutiques (Tableau I).
Tableau I
Activateurs et gènes cibles du PXR humain.
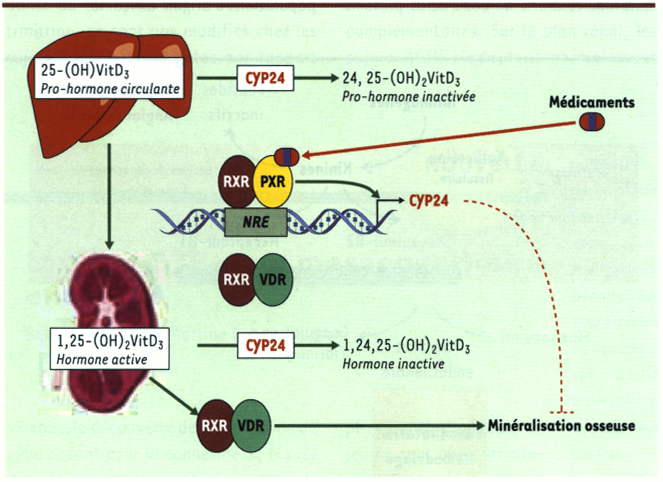
Par ailleurs, l’activation de PXR par certains médicaments semble perturber l’activité biologique de certaines hormones, dont la vitamine D3. En effet, de nombreuses observations cliniques montrent un lien entre la prise prolongée de phénobarbital ou de rifampicine et l’apparition d’ostéomalacie chez des patients [3, 4]. L’ostéomalacie est une forme de déminéralisation osseuse généralisée par insuffisance de minéralisation calcique de la substance osseuse. La conséquence possible est que, même sous des contraintes mécaniques normales, l’os peut fléchir. Les mécanismes moléculaires à l’origine de ces cas d’ostéomalacie restent inexpliqués. Cependant, une caractéristique biochimique commune est la réduction de la concentration de pro-vitamine D3 (25-OH-VitD3) et du calcitriol (ou 1,25-[OH]2VitD3, hormone active) chez ces patients. Or, le calcitriol est essentiel au maintien de l’équilibre phosphocalcique de l’organisme et à la bonne minéralisation des os. En effet, après l’activation de son récepteur, le VDR (vitamin D receptor, NR1I1), le calcitriol stimule l’absorption du calcium et du phosphate dans le duodénum, la réabsorption du calcium et du phosphate par le néphron et, enfin, induit la différenciation des ostéoblastes (cellules chargées de la synthèse de la matrice osseuse) [5]. La concentration circulante de 25-OH-VitD3 et 1,25-(OH)2VitD3 est étroitement contrôlée par le couple calcitriol/VDR qui règle l’expression de la CYP24, enzyme clé du catabolisme de la vitamine D responsable de l’inactivation de la 25-(OH)VitD3 et du calcitriol [6]. Or, il a été récemment observé que la CYP24 est un gène cible du PXR [7, 8]. En effet, la rifampicine et le phénobarbital augmentent le niveau d’expression de l’ARNm de la CYP24 ainsi que son activité enzymatique dans des cultures primaires d’hépatocytes humains. Ces travaux font suite à des observations antérieures montrant, d’une part, que les récepteurs PXR et VDR partagent des gènes cibles (CYP3A4, 2B6 et 2C8), et, d’autre part, qu’ils utilisent les mêmes NRE présents au niveau du promoteur de ces gènes [9]. À l’inverse, l’expression des enzymes de la biosynthèse de la vitamine D3 (c’est-à-dire CYP27A, CYP27B et CYP2R1) ou du VDR restent inchangés. Chez la souris, les agonistes du PXR, comme le PCN ou la dexaméthasone, provoquent in vivo une augmentation de l’ARNm de la CYP24 rénale ainsi que de la concentration de 24,25-dihydroxyvitamine D3 dans le sérum. L’expression ectopique du PXR dans des cellules rénales humaines (HEK293) permet une induction de l’expression de la CYP24 par la rifampicine. Enfin, des études de retard sur gel et de co-transfection transitoire ont montré que les récepteurs PXR et VDR se lient aux mêmes séquences NRE du promoteur de la CYP24 et augmentent la transcription de cette enzyme.
Selon ces nouvelles données, certaines ostéomalacies induites par des médicaments pourraient être dues à l’augmentation de l’expression de la CYP24 provoquée par l’activation du PXR qui se substituerait au VDR. Il s’ensuivrait une accélération incontrôlée de l’inactivation de la vitamine D3 essentielle au maintien de l’équilibre phosphocalcique et à la minéralisation osseuse (Figure 1). Ce mécanisme pourrait expliquer les effets secondaires d’autres médicaments plus actuels tels que les inhibiteurs des protéases virales (VIH), dont certains sont des ligands connus du PXR et provoquent des perturbations du métabolisme osseux. Enfin, ces résultats mettent à jour un nouveau mécanisme de toxicité des médicaments via la perturbation d’une voie de régulation physiologique.
Figure 1
Relations entre pregnane X receptor (PXR) et vitamin D receptor (VDR) influençant l’homéostasie de la vitamine D et la bonne minéralisation des os.
L’activation du PXR par des médicaments tels que la rifampicine ou le phénobarbital provoque la surexpression de la CYP24, enzyme majeure du catabolisme de la vitamine D (1,25-[OH]2VitD3) pouvant provoquer une déficience en vitamine D et une déminéralisation osseuse.
Parties annexes
Références
- 1. Kliewer SA. The nuclear pregnane X receptor regulates xenobiotic detoxification. J Nutr 2003 ; 133 (suppl 7) : S2444-7.
- 2. Moore JT, Kliewer SA. Use of the nuclear receptor PXR to predict drug interactions. Toxicology 2000 ; 153 : 1-10.
- 3. D'Erasmo E, Ragno A, Raejntroph N, Pisani D. Drug-induced osteomalacia. Recenti Prog Med 1998 ; 89 : 529-33.
- 4. Gascon-Barré M. Antiepileptic drugs and bone health. In : Dawson-Hughes B, Holick MF, eds. Nutrition and bone health. Totowa-New Jersey-USA : Humana Press, 2004 : 647-66.
- 5. Carlberg C, Polly P. Gene regulation by vitamin D3. Crit Rev Eukaryot Gene Expr 1998 ; 8 : 19-42.
- 6. Chen KS, DeLuca HF. Cloning of the human 1 alpha,25-dihydroxyvitamin D-3 24-hydroxylase gene promoter and identification of two vitamin D-responsive elements. Biochim Biophys Acta 1995 ; 1263 : 1-9.
- 7. Pascussi JM, Robert A, Nguyen M, et al. Possible involvement of pregnane X receptor-enhanced CYP24 expression in drug-induced osteomalacia. J Clin Invest 2005 ; 115 : 177-86.
- 8. Holick MF. Stay tuned to PXR : an orphan actor that may not be D-structive only to bone. J Clin Invest 2005 ; 115 : 32-4.
- 9. Drocourt L, Ourlin JC, Pascussi JM, et al. Expression of CYP3A4, CYP2B6, and CYP2C9 is regulated by the vitamin D receptor pathway in primary human hepatocytes. J Biol Chem 2002 ; 277 : 25125-32.
Liste des figures
Figure 1
Relations entre pregnane X receptor (PXR) et vitamin D receptor (VDR) influençant l’homéostasie de la vitamine D et la bonne minéralisation des os.
Liste des tableaux
Tableau I
Activateurs et gènes cibles du PXR humain.