Corps de l’article
Le déficit immunitaire combiné sévère (DICS) est une maladie rare, caractérisée par l’absence de lymphocytes T, associée, dans certains cas, à l’absence de cellules NK (natural killer) et/ou de lymphocytes B. Le déficit immunitaire peut être corrigé par une transplantation de cellules souches hématopoïétiques (TCSH) allogénique [1, 2] ou par thérapie génique [3]. L’observation, après greffe, d’une maladie cutanée grave et chronique liée à une infection par papillomavirus humains (HPV, human papillomavirus) chez certains patients greffés pour DICS pose un problème intrigant.
Les HPV ont un tropisme spécifique pour les kératinocytes. Ils sont la cause des verrues planes ou vulgaires, des condylomes génitaux et des papillomes laryngés. Habituellement, les lésions régressent spontanément ou après traitement. Une susceptibilité génétique élective au développement d’une maladie chronique et sévère à HPV a été mise en évidence chez des patients qui développent un tableau clinique particulier, l’épidermodysplasie verruciforme (EV) (Figure 1). Ce syndrome grave, de transmission autosomique récessive, est génétiquement hétérogène. Il est caractérisé par la survenue de verrues disséminées, associées à des lésions mimant le pityriasis versicolor. La progression vers la malignité se produit dans 30 % à 50 % des cas [4]. Deux locus de susceptibilité ont été décrits sur le chromosome 2p21-p24 et sur le chromosome 17q25 et des mutations ont été récemment identifiées dans deux gènes adjacents, EVER1 et EVER2 [5].
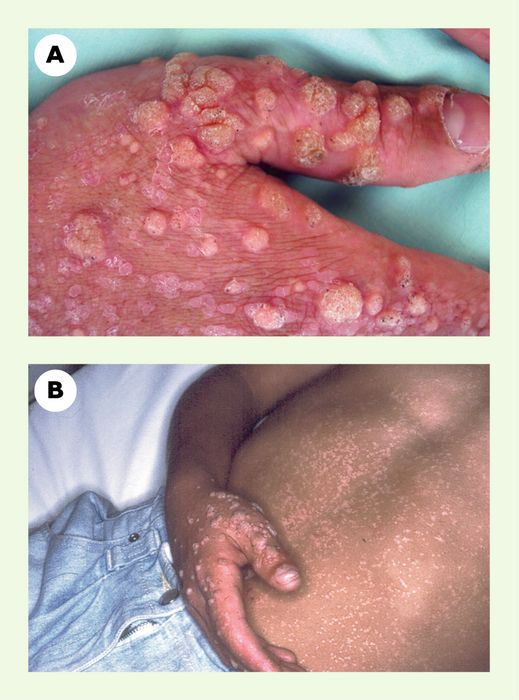
Figure 1
Définition de la maladie à HPV.
A. Verrues vulgaires observées chez neuf patients, en nombre supérieur à 30 et existant depuis plus de deux ans. B. Lésion de type d’épidermodysplasie verruciforme observée chez quatre patients sur neuf, caractérisée par des verrues planes réfractaires au traitement et par des macules hyper- ou hypopigmentées mimant un pityriasis versicolor.
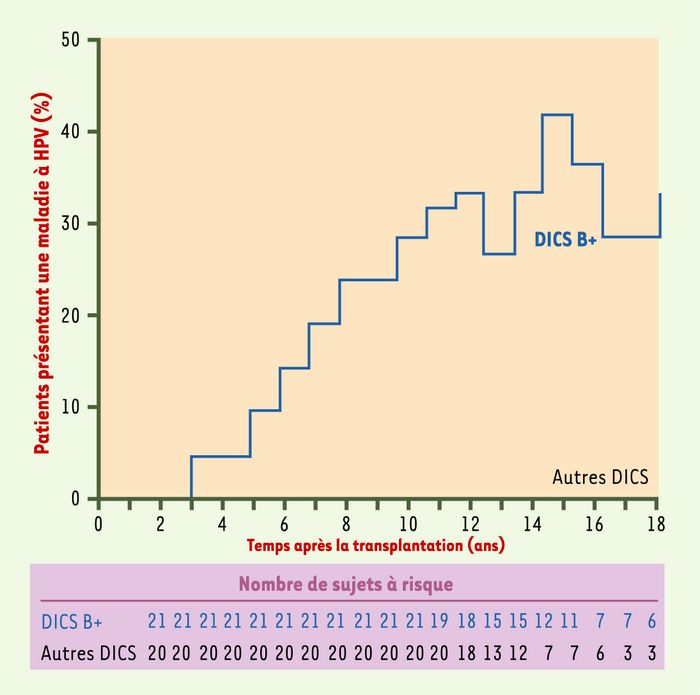
Nous avons observé une incidence élevée (9/41) de maladie à HPV chez des patients greffés pour traiter un DICS [6]. Chez ces patients, la maladie à HPV apparaît entre 3 et 15 ans après la TCSH (médiane : 8 ans), en l’absence de traitement immunosuppresseur (Figure 2). Elle est sévère, progressive et réfractaire aux thérapeutiques usuelles. En outre, on ne peut exclure le développement de cette maladie sévère à HPV chez d’autres patients dans les années à venir. Cette maladie à HPV provoque non seulement un préjudice esthétique, mais aussi un handicap fonctionnel important. De plus, les lésions mimant l’EV, associées à HPV-5 ou HPV-14, telles qu’elles sont observées chez quatre patients, pourraient évoluer vers la malignité. Le traitement de cette maladie est décevant, inefficace ou suivi de récidives. Néanmoins, on a observé une rémission complète chez deux des neuf patients après une seconde TCSH chez un patient ou un traitement local chez le second.
Figure 2
Proportion de patients présentant une maladie à HPV au cours du temps après transplantation de cellules souches hématopoïétiques.
Nous avons donc recherché quel(s) pourrai(en)t être le(s) facteur(s) de risque de survenue de maladie grave à HPV dans ce groupe de patients. Le seul facteur de risque identifié est le type moléculaire à l’origine du DICS. Seuls les patients présentant un DICS avec lymphocytes B présents et cellules NK absentes (DICS B+ NK-) développent une maladie à HPV. Les caractéristiques de la TCSH (compatibilité entre le donneur et le receveur, type de conditionnement) et les événements secondaires à la TCSH (réaction du greffon contre l’hôte, infections) ne semblent pas intervenir sur le risque de survenue de la maladie à HPV. Par ailleurs, à distance de la greffe, ni le type de chimérisme ni la qualité de la reconstitution des immunités T et B ne diffèrent chez les patients atteints de DICS B+ NK-, avec ou sans maladie à HPV. Plusieurs patients présentent une lymphopénie T, affectant en particulier les lymphocytes T CD4+, en particulier les lymphocytes T CD4 naïfs, témoin d’une disparition de la thymopoïèse. Cependant, les infections associées ne sont pas plus fréquentes ou plus sévères dans le groupe présentant une maladie à HPV. Ce résultat est étonnant compte tenu du fait que les lymphocytes T CD4 sont décrits comme étant les principaux effecteurs de l’immunité anti-HPV [7]. Cependant, chez un des patients, une seconde transplantation, indiquée par une insuffisance de reconstitution immunitaire, a conduit à la rémission de la maladie à HPV, suggérant fortement que la qualité des fonctions immunitaires ait, dans ce cas, joué un rôle.
Ainsi, pour quelle raison les patients présentant une forme de DICS B+ NK- semblent-ils être particulièrement susceptibles à l’HPV ? Les neuf patients ayant développé une maladie sévère à HPV présentaient exclusivement un DICS B+ NK- lié à des mutations soit de la chaîne γc commune à différents récepteurs de cytokine, soit de la tyrosine kinase JAK-3 associée à γc [8]. Un déficit quantitatif et qualitatif en cellules NK est plus fréquemment observé chez ces patients que chez les patients atteints d’un autre type de DICS. Or, un déficit NK persistant après TCSH pourrait représenter un déficit de l’immunité anti-HPV. Cette hypothèse est en accord avec l’absence de maladie à HPV observée chez les deux patients présentant un DICS B+ NK- associé à un déficit en IL7-Rα, DICS dont l’immunité NK est normale avant et après TCSH. En revanche, l’immunité NK est similaire chez les patients atteints de DICS B+ NK- après TCSH, qu’ils présentent ou non une maladie à HPV.
Une hypothèse alternative implique une immunité innée dépendante du kératinocyte, cellule hôte de HPV. En effet, les gènes mutés chez les patients présentant une prédisposition héréditaire à l’EV (EVER1 et EVER2) sont exprimés dans cette cellule. De plus, le kératinocyte exprime des récepteurs de cytokine, incluant la chaîne γc et la tyrosine kinase JAK3 associée [9]. Ainsi, les récepteurs de l’interleukine-4 (IL-4) et de l’IL-15 [10] peuvent être détectés à la surface des kératinocytes. L’IL-4 est capable d’activer la libération de cytokines pro-inflammatoires par les kératinocytes [10], tandis que l’IL-15 exerce un rôle anti-apoptotique pour ces cellules [11]. Ainsi, les cytokines dépendantes de γc pourraient jouer un rôle crucial dans la résistance locale aux infections par HPV soit directement par le kératinocyte, soit indirectement par recrutement local des cellules de l’immunité adaptative. Un certain type de DICS pourrait donc avoir une expression extra-hématopoïétique, dont la maladie à HPV serait l’une des premières formes d’expression clinique, des années après une TCSH réussie. Cette infection sévère, qui est observée de façon inattendue et malheureusement parfois dramatique, pointe vers un nouvel effecteur de l’immunité anti-HPV.
Parties annexes
Références
- 1. Fischer A. Primary immunodeficiency diseases : an experimental model for molecular medicine. Lancet 2001 ; 357 : 1863-9.
- 2. Buckley RH, Schiff SE, Schiff RI, et al. Hematopoietic stem-cell transplantation for the treatment of severe combined immunodeficiency. N Engl J Med 1999 ; 340 : 508-16.
- 3. Cavazzana-Calvo M, Hacein-Bey S, de Saint Basile G, et al. Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease. Science 2000 ; 288 : 669-72.
- 4. Harwood CA, Proby CM. Human papillomaviruses and non-melanoma skin cancer. Curr Opin Infect Dis 2002 ; 15 : 101-14.
- 5. Ramoz N, Rueda LA, Bouadjar B, et al. Mutations in two adjacent novel genes are associated with epidermodysplasia verruciformis. Nat Genet 2002 ; 32 : 579-81.
- 6. Laffort C, Le Deist F, Favre M, et al. Severe cutaneous papillomavirus disease after haemopoietic stem-cell transplantation in patients with severe combined immune deficiency caused by common gammac cytokine receptor subunit or JAK-3 deficiency. Lancet 2004 ; 363 : 2051-4.
- 7. Youde SJ, Dunbar PR, Evans EM, et al. Use of fluorogenic histocompatibility leukocyte antigen-A*0201/HPV 16 E7 peptide complexes to isolate rare human cytotoxic T-lymphocyte-recognizing endogenous human papillomavirus antigens. Cancer Res 2000 ; 60 : 365-71.
- 8. Leonard WJ. Cytokines and immunodeficiency diseases. Nat Rev Immunol 2001 ; 1 : 200-8.
- 9. Nishio H, Matsui K, Tsuji H, et al. Immunolocalisation of the janus kinases (JAK)-signal transducers and activators of transcription (STAT) pathway in human epidermis. J Anat 2001 ; 198 : 581-9.
- 10. Junghans V, Jung T, Neumann C. Human keratinocytes constitutively express IL-4 receptor molecules and respond to IL-4 with an increase in B7/BB1 expression. Exp Dermatol 1996 ; 5 : 316-24.
- 11. Ruckert R, Asadullah K, Seifert M, et al. Inhibition of keratinocyte apoptosis by IL-15 : a new parameter in the pathogenesis of psoriasis? J Immunol 2000 ; 165 : 2240-50.
Liste des figures
Figure 1
Définition de la maladie à HPV.
A. Verrues vulgaires observées chez neuf patients, en nombre supérieur à 30 et existant depuis plus de deux ans. B. Lésion de type d’épidermodysplasie verruciforme observée chez quatre patients sur neuf, caractérisée par des verrues planes réfractaires au traitement et par des macules hyper- ou hypopigmentées mimant un pityriasis versicolor.
Figure 2
Proportion de patients présentant une maladie à HPV au cours du temps après transplantation de cellules souches hématopoïétiques.