Résumés
Résumé
Le sulfure d’hydrogène (H2S) est produit dans de nombreux tissus, et notamment dans le cerveau, où il joue un rôle de neuromodulateur. H2S augmente ainsi les réponses mises en jeu par les récepteurs NMDA et facilite l’induction d’une potentialisation à long terme dans l’hippocampe. L’altération de la concentration de l’activateur physiologique de la cystathionine β synthase, enzyme responsable de la synthèse d’H2S dans le cerveau, explique la diminution de la concentration d’H2S dans les cerveaux de sujets atteints de maladie d’Alzheimer. L’hyperproduction d’H2S décrite chez les sujets trisomiques 21 est probablement liée à l’hyperexpression de cette même enzyme, dont le gène est localisé sur le chromosome 21.
Summary
The formation of H2S from cyst(e)ine is catalyzed by three enzymes, cystathionine β synthase, cystathionase, and 3-mercaptopyruvate sulfurtransferase. In the liver, kidney, enterocytes and vascular smooth muscle cells, H2S is principally synthesized by cystathionase. In contrast, it is synthesized by cystathionine β synthase in the brain and partially by 3-mercaptopyruvate sulfurtransferase in cardiac tissue. H2S is catabolized, essentially in mitochondria by thiosulfate reductase. The sulfite generated is then oxidized to sulfate by sulfite oxidase. The amount of thiosulfate excreted in the urine is the best indicator of H2S biosynthesis, together with sulfhemoglobin determination in erythrocytes. H2S acts as a neuromodulator in the brain, increasing responses mediated by NMDA receptors, facilitating the induction of long-term potentialization in the hippocampus. H2S also acts as a vasodilator, acting directly on ATP-dependent potassium channels in vascular smooth muscle cells. The concentration of H2S is abnormally low in the brains of subjects with Alzheimer’s disease, due to changes in the concentration of the physiological activator of cystathionine β synthase. The overproduction of H2S described in subjects with Down’s syndrome probably results from the overproduction of cystathionine β synthase, as the gene encoding this protein is located on chromosome 21.
Corps de l’article
Le sulfure d’hydrogène (H2S) a longtemps été considéré comme une substance toxique. Ce n’est que depuis 1989 que sa production endogène chez l’homme et les mammifères a été mise en évidence, en particulier dans les structures cérébrales [1-3]. Ce fait a suggéré que H2S pouvait avoir un rôle physiologique, comme deux autres gaz, le monoxyde d’azote (NO) et le monoxyde de carbone (CO). Depuis cette date, plusieurs publications ont précisé le mode d’action d’H2S qui est maintenant classé parmi les neuromessagers atypiques [4].
Métabolisme de H2S
Chez les mammifères, H2S peut être formé à partir de cyst(é)ine selon trois voies de biosynthèse, impliquant notamment les enzymes cystathionine β synthase (CBS) et cystathionase (CSE) (Figure 1). L’utilisation d’inhibiteurs spécifiques permet de déterminer pour chaque tissu la voie prépondérante de biosynthèse d’H2S. Pour le foie, la production d’H2S semble majoritairement liée à la CSE [5, 6] ; il en est de même pour les entérocytes [7] et pour le rein [5]. L’inhibition de la CSE ne modifie pas la production d’H2S dans le cerveau [8] ; par ailleurs, le contenu en H2S des cerveaux de souris dont le gène de la CBS a été invalidé [9] est extrêmement abaissé, ce qui indique que la production de H2S dans les différentes parties du cerveau est presque exclusivement contrôlée par la CBS [10].
Figure 1
Biosynthèse d’H2S.
Trois voies de biosynthèse de H2S ont été identifiées. Deux d’entre elles font intervenir des enzymes appartenant à la voie de transsulfuration qui permet la biosynthèse de cystéine à partir d’une méthionine ayant perdu son méthyle au cours d’une réaction de méthylation. Cette voie de transsulfuration implique la condensation de l’homocystéine, produit de déméthylation de la méthionine, avec une molécule de sérine pour former la cystathionine. Celle-ci est ensuite coupée en cystéine et homosérine. Les deux enzymes successivement impliquées dans cette voie sont la cystathionine β synthase (CBS) et la cystathionase (CSE). La réaction de transsulfuration est cytosolique : la CBS produit H2S à partir de cystéine [Cys] alors que la cystathionase produit H2S à partir de la cystine [(Cys)2] produit d’oxydation de la cystéine [5, 25, 26]. La troisième voie de biosynthèse de H2S est à la fois cytosolique et mitochondriale : elle implique une transamination, par l’aminotransférase (AT), de la cystéine en son céto-acide, le 3-mercaptopyruvate, puis la libération de H2S, à partir du 3-mercaptopyruvate, par la 3-mercaptopyruvate sulfurtransferase (MPST) [27-30].
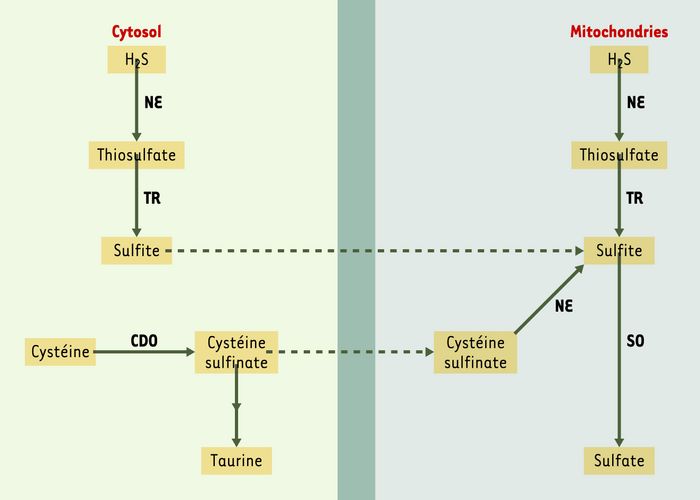
Les voies du catabolisme de l’H2S sont schématisées sur la Figure 2.
Figure 2
Catabolisme d’H2S.
Dans le foie de rat, l’oxydation de H2S en thiosulfate est catalysée par des composés héminiques des métalloprotéines et la ferritine [31, 32]. La principale enzyme du catabolisme du thiosulfate est la thiosulfate réductase (TR), enzyme dont le cofacteur est le glutathion réduit, et la localisation surtout mitochondriale [33]. Les sulfites formés par ce catabolisme sont transformés dans les mitochondries en sulfates par la sulfite oxydase (SO). L’excrétion de thiosulfate dans l’urine constitue le meilleur indicateur de la biosynthèse de H2S ou d’une intoxication accidentelle par H2S [34, 35]. L’origine des sulfites, donc des sulfates, est double : à partir d’H2S d’une part, et à partir du catabolisme de la cystéine par la voie de la cystéine dioxygénase (CDO), d’autre part. NE : non enzymatique.
Actions physiologiques d’H2S
La première démonstration du rôle physiologique d’H2S a été apportée en 1996 [8] et son rôle a été explicité dans des revues récentes [11, 12]. La concentration physiologique d’H2S dans le cerveau est relativement élevée (50 à 160 µM) [1-3]. Des concentrations plus élevées (supérieures à 320 µM) inhibent la transmission synaptique dans l’hippocampe, alors qu’H2S à concentration physiologique facilite l’induction d’une potentialisation à long terme (LTP pour long-term potentiation) quand il est ajouté pendant une stimulation tétanique faible. Grâce à l’utilisation d’un antagoniste des récepteurs NMDA (N-méthyl-D-aspartate), on a pu démontrer que l’induction d’une potentialisation à long terme par H2S nécessitait l’activation des récepteurs NMDA, comme celle induite par la stimulation tétanique. L’effet d’H2S est spécifique et ne peut être obtenu avec un thiol physiologique (cystéine) ou non physiologique (dithiothréitol) [8]. Un rôle physiologique a donc été attribué à H2S dès 1996, comme il l’avait été auparavant aux autres neuromodulateurs gazeux, NO et CO [4]. Le mécanisme d’action a été ensuite précisé sur des cellules neuronales et gliales en culture, où des concentrations physiologiques d’H2S augmentent la production d’AMPc, et dans les oocytes de xénope, où des récepteurs NMDA exprimés à la membrane sont modulés de manière spécifique par H2S [13]. Ces résultats suggèrent un mécanisme selon lequel une protéine kinase A, activée par l’AMPc, phosphorylerait des récepteurs NMDA qui, stimulés, seraient responsables de l’induction d’une potentialisation à long terme dans l’hippocampe. Le mécanisme d’action AMPc-dépendant d’H2S diffère donc de ceux de NO et CO qui sont GMPc-dépendants. La libération de CRH (corticotropin releasing hormone) par l’hypothalamus est inhibée par H2S. Celle-ci a été démontré in vitro sur explants hypothalamiques, mais aussi in vivo chez le rat : la stimulation de la CBS par son activateur physiologique, la S-adénosylméthionine (SAM), injectée par voie intra-péritonéale, accroît la production intracérébrale d’H2S et inhibe la libération dans le plasma de corticostérone après exposition de l’animal au froid [14, 15].
Le contrôle de la biosynthèse intracérébrale d’H2S par la CBS est également assuré par la SAM. Récemment, une diminution très nette (50 % des valeurs normales) de la concentration intracérébrale d’H2S a été observée dans le cerveau de patients atteints de maladie d’Alzheimer [16]. L’activité CBS cérébrale est normale chez ces malades mais la concentration de SAM n’est que de 30 % de celle des sujets témoins. Un autre mécanisme de mise en jeu de la synthèse intracérébrale d’H2S a été décrit : une stimulation neuronale, les ionophores Ca2+ ou le glutamate provoquent un influx de Ca2+ dans les neurones, d’où une activation de la calmoduline. Le complexe calmoduline-Ca2+ se fixe sur une séquence de 19 acides aminés de la CBS. Cette séquence est très conservée dans toutes les protéines pouvant fixer la calmoduline [10]. La biosynthèse intracérébrale d’H2S par la CBS est donc soumise à un double contrôle exercé par la SAM et par le Ca2+.
Un effet de vasorelaxation d’H2S sur les muscles lisses a été observé. Par ailleurs, H2S à faible concentration multiplie par plus de 10 l’effet vasorelaxant de NO [17] sur les tissus aortiques. Alors que NO et CO peuvent être libérés à la fois par les cellules endothéliales et les cellules musculaires lisses des vaisseaux, H2S n’est synthétisé par la cystathionase qu’à partir des cellules musculaires lisses [18]. NO est un modulateur de la production endogène d’H2S dans les cellules musculaires lisses des vaisseaux car il augmente l’expression du gène de la cystathionase et exerce un effet direct de stimulation sur cette activité enzymatique [18]. H2S semble agir directement sur les canaux K+ ATP-dépendants (KATP) des cellules musculaires lisses des vaisseaux, car son effet est totalement inhibé par la glibenclamide, une substance connue pour bloquer l’action du canal KATP [18].
Des interrelations ont pu être mises en évidence entre les neuromodulateurs gazeux, NO et CO et la CBS [19] : NO peut se fixer sur la CBS et inhiber son activité enzymatique. Cependant, les différences d’affinité de NO pour la CBS et sa cible habituelle, une guanylyl cyclase, ne sont pas en faveur d’une fixation de NO sur la CBS à l’état physiologique. A l’inverse, l’affinité de la CBS pour CO est très grande : la CBS est-elle la cible physiologique de CO au niveau cérébral ? Cette question est pour l’heure sans réponse [19].
La CBS est codée par un gène situé sur le chromosome 21 (21q22.3) et l’activité enzymatique de la CBS est augmentée d’environ 1,5 fois dans les fibroblastes des sujets atteints de trisomie 21 par rapport aux témoins [20]. Cette augmentation d’activité induit une diminution du substrat physiologique de la CBS, l’homocystéine, dans le plasma de sujets atteints de trisomie 21 [21]. Le retard mental est progressif dans cette maladie : les trisomiques 21 naîtraient avec une intelligence normale mais celle-ci déclinerait progressivement au cours de la première année. L’hypothèse d’une hyperproduction de H2S [22] chez les trisomiques 21 est confortée par l’observation d’une production de thiosulfate deux à trois fois plus élevée chez ces sujets que chez les sujets témoins [23, 24]. Par ailleurs, la production dans les globules rouges de sulfhémoglobine nécessite à la fois la présence d’H2S et de methémoglobine. La mesure de la sulfhémoglobine dans les globules rouges de trisomiques 21 a donc été utilisée pour vérifier l’hyperproduction d’H2S. La sulfhémoglobine érythrocytaire est très significativement augmentée chez les trisomiques 21 [24].
Conclusions
L’ensemble de ces résultats indique qu’il existe une hyperproduction d’H2S dans la trisomie 21. Des études complémentaires sont nécessaires pour déterminer les effets toxiques possibles de cette hyperproduction chez les sujets atteints de trisomie 21.
Parties annexes
Remerciements
Ce travail a été aidé par un contrat de la Fondation Jérôme Lejeune Paris.
Références
- 1. Goodwin LR, Francom D, Dieken FP, et al. Determination of sulfide in brain tissue by gas dialysis/ion chromatography : Post-mortem studies and two case reports. J Anal Toxicol 1989 ; 13 : 105-9.
- 2. Warenycia MW, Goodwin LR, Benishin CG, et al. Acute hydrogen sulfide poisoning : Demonstration of selective uptake of sulfide by the brainstem by measurement of brain sulfide levels. Biochem Pharmacol 1989 ; 38 : 973-81.
- 3. Savage JC, Gould DH. Determination of sulfides in brain tissue and rumen fluid by ion-interaction reversed-phase high-performance liquid chromatography. J Chromatogr 1990 ; 526 : 540-5.
- 4. Baranano DE, Ferris CD, Snyder SH. Atypical neural messengers. Trends Neurosci 2001 ; 24 : 99-106.
- 5. Stipanuk MH, Beck PW. Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat. Biochem J 1982 ; 206 : 267-77.
- 6. Stipanuk MH, De la Rosa J, Hirschberger LL. Catabolism of cyst(e)ine by rat renal cortical tubules. J Nutr 1990 ; 120 : 450-8.
- 7. Coloso RM, Stipanuk MH. Metabolism of cyst(e)ine in rat enterocytes. J Nutr 1989 ; 119 : 1914-24.
- 8. Abe K, Kimura H. The possible role of hydrogen sulfide as an endogenous neuromodulator. J Neurosci 1996 ; 16 : 1066-71.
- 9. Watanabe M, Osada J, Aratani Y, et al. Mice deficient in cystathionine β-synthase : Animal models for mild and severe homocyst(e)inemia. Proc Natl Acad Sci USA 1995 ; 92 : 1585-9.
- 10. Eto K, Ogasawara M, Umemura K, et al. Hydrogen sulfide is produced in response to neuronal excitation. J Neursci 2002 ; 22 : 3386-91.
- 11. Kimura H. Hydrogen sulfide as a neuromodulator. Mol Neurobiol 2002 ; 26 : 13-9.
- 12. Wang R. Two’s company, three’s a crowd : can H2S be the third endogenous gaseous transmitter. FASEB J 2002 ; 16 : 1792-8.
- 13. Kimura H. Hydrogen sulfide induces cyclic AMP and modulates the NMDA receptor. Biochem Biophys Res Commun 2000 ; 267 : 129-33.
- 14. Dello Russo C, Tringali G, Ragazzoni E, et al. Evidence that hydrogen sulfide can modulate hypothalamo-pituitary-adrenal axis function : in vitro and in vivo studies in the rat. J Neuroendocrinol 2000 ; 12 : 225-33.
- 15. Navarra P, Dello Russo C, Mancuso C, et al. Gaseous neuromodulators in the control of neuroendocrine stress axis. Ann NY Acad Sci 2000 ; 917 : 638-46.
- 16. Eto K, Asada T, Arima K, et al. Brain hydrogen sulfide is severely decreased in Alzheimer’s disease. Biochem Biophys Res Commun 2002 ; 293 : 1485-8.
- 17. Hosoki R, Matsuki N, Kimura H. The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide. Biochem Biophys Res Commun 1997 ; 237 : 527-31.
- 18. Zhao W, Zhang J, Lu Y, Wang R. The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener. EMBO J 2001 ; 20 : 6008-16.
- 19. Taoka S, Banerjee R. Characterization of NO binding to human cystathionine beta-synthase : possible implications of the effects of CO and NO binding to the human enzyme. J Inorg Biochem 2001 ; 87 : 245-51.
- 20. Chadefaux B, Rethore MO, Raoul O, et al. Cystathionine β synthase : Gene dosage effect in trisomy 21. Biochem Biophys Res Commun 1985 ; 128 : 40-4.
- 21. Chadefaux B, Ceballos I, Hamet M, et al. Is absence of atheroma in Down syndrome due to decreased homocysteine levels ? Lancet 1988 ; 2 : 741.
- 22. Kamoun P. Mental retardation in Down syndrome : a hydrogen sulfide hypothesis. Med Hypoth 2001 ; 57 : 389-92.
- 23. Belardinelli MC, Chabli A, Chadefaux B, Kamoun P. Urinary sulfur compounds in Down’s Syndrome. Clin Chem 2001 ; 47 : 1500-1.
- 24. Kamoun P, Belardinelli MC, Chabli A, et al. Endogenous hydrogen sulfide overproduction in Down’s syndrome. Am J Med Genet 2003 ; 116A : 310-1.
- 25. Yamanashi T, Tuboi S. The mechanism of the L-cystine cleavage reaction catalyzed by rat liver gamma-cystathionase. J Biochem 1981 ; 89 : 1913-21.
- 26. Stipanuk MH. Metabolism of sulfur-containing aminoacids. Ann Rev Nutr 1986 ; 6 : 179-209.
- 27. Koj A, Frendo J, Wojczak I. Subcellular distribution and intramitochondrial localization of three sulfurtransferases in rat liver. FEBS Lett 1975 ; 57 : 42-66.
- 28. Ubuka T, Yuasa S, Ishimoto Y, Shimomura M. Desulfuration of L-cysteine through transamination and transsulfuration in rat liver. Physiol Chem Phys 1977 ; 9 : 241-6.
- 29. Ogasawara Y, Isoda S, Tanabe S. Tissue and subcellular distribution of bound and acid-labile sulfur, and the enzymic capacity for sulfide production in the rat. Biol Pharm Bull 1994 ; 17 : 1535-42.
- 30. Nagahara N, Ito T, Kitamura H, Nishino T. Tissue and subcellular distribution of mercaptopyruvate sulfurtransferase in the rat : confocal laser fluorescence and immunoelectron microscopic studies combined with biochemical analysis. Histochem Cell Biol 1998 : 110 ; 243-50.
- 31. Sorbo B. On the formation of thiosulfate from inorganic sulfide by liver tissues and heme compounds. Biochim Biophys Acta 1958 ; 27 : 324-9.
- 32. Ubuka T, Ohta J, Yao WB, et al. L-cysteine metabolism in a mercaptopyruvate pathway and sulfate formation in rat liver mitochondria. Amino Acids 1992 ; 2 : 143-55.
- 33. Westley J. Rhodanese and the sulfane pool. In : Jacoby WB, ed. Enzymatic basis of detoxication, vol. 2. New York : Academic Press, 1980 : 245-62.
- 34. Beauchamp Jr RO, Bus JS, Popp JA, et al. A critical review of the literature on hydrogen sulfide toxicity. Crit Rev Toxicol 1984 ; 13 : 25-97.
- 35. Kangas J, Savolainen H. Urinary thiosulphate as an indicator of exposure to hydrogen sulphide vapour. Clin Chim Acta 1987 ; 164 : 7-10.
Liste des figures
Figure 1
Biosynthèse d’H2S.
Trois voies de biosynthèse de H2S ont été identifiées. Deux d’entre elles font intervenir des enzymes appartenant à la voie de transsulfuration qui permet la biosynthèse de cystéine à partir d’une méthionine ayant perdu son méthyle au cours d’une réaction de méthylation. Cette voie de transsulfuration implique la condensation de l’homocystéine, produit de déméthylation de la méthionine, avec une molécule de sérine pour former la cystathionine. Celle-ci est ensuite coupée en cystéine et homosérine. Les deux enzymes successivement impliquées dans cette voie sont la cystathionine β synthase (CBS) et la cystathionase (CSE). La réaction de transsulfuration est cytosolique : la CBS produit H2S à partir de cystéine [Cys] alors que la cystathionase produit H2S à partir de la cystine [(Cys)2] produit d’oxydation de la cystéine [5, 25, 26]. La troisième voie de biosynthèse de H2S est à la fois cytosolique et mitochondriale : elle implique une transamination, par l’aminotransférase (AT), de la cystéine en son céto-acide, le 3-mercaptopyruvate, puis la libération de H2S, à partir du 3-mercaptopyruvate, par la 3-mercaptopyruvate sulfurtransferase (MPST) [27-30].
Figure 2
Catabolisme d’H2S.
Dans le foie de rat, l’oxydation de H2S en thiosulfate est catalysée par des composés héminiques des métalloprotéines et la ferritine [31, 32]. La principale enzyme du catabolisme du thiosulfate est la thiosulfate réductase (TR), enzyme dont le cofacteur est le glutathion réduit, et la localisation surtout mitochondriale [33]. Les sulfites formés par ce catabolisme sont transformés dans les mitochondries en sulfates par la sulfite oxydase (SO). L’excrétion de thiosulfate dans l’urine constitue le meilleur indicateur de la biosynthèse de H2S ou d’une intoxication accidentelle par H2S [34, 35]. L’origine des sulfites, donc des sulfates, est double : à partir d’H2S d’une part, et à partir du catabolisme de la cystéine par la voie de la cystéine dioxygénase (CDO), d’autre part. NE : non enzymatique.