Corps de l’article
La découverte il y a quelques années d’un lien entre la survenue de certains cancers et l’existence d’anomalies du système de réparation des erreurs de réplication de l’ADN (système MMR, pour mismatch repair) a ouvert de nouveaux horizons dans l’étude de la carcinogenèse chez l’homme [1-3]. Cette déficience conduit à une instabilité nucléotidique de l’ADN affectant essentiellement les séquences répétées microsatellites du génome, sans anomalie chromosomique associée. Les cancers dits MSI-H (microsatellite instability-high) sont fréquents chez l’homme. Ils peuvent être héréditaires, intégrés dans le cadre du syndrome HNPCC (human non polyposis colorectal cancer) dans lequel ils adoptent alors de multiples localisations (côlon, estomac, endomètre, pancréas, voies biliaires, rein, uretères…). Ils restent dans la majorité des cas de survenue sporadique, représentant 15 % environ des cas des cancers du côlon, de l’estomac, du pancréas ou de l’endomètre.
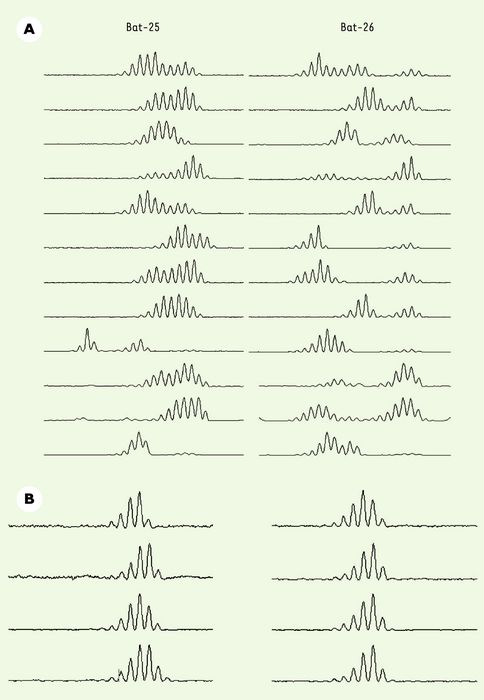
La mise au point de méthodes diagnostiques consensuelles au niveau international, sensibles et spécifiques, permet aujourd’hui de détecter ce phénotype à partir de quantités faibles d’ADN tumoral [4, 5]. Dans un travail récent [6], nous avons utilisé une telle approche diagnostique fondée sur l’utilisation de deux marqueurs microsatellites, Bat-25 et Bat-26, dont l’instabilité génétique est la signature d’une déficience MMR au sein de la cellule. Le raccourcissement allélique de ces microsatellites est observé de manière systématique dans les cancers MSI-H, alors qu’ils sont très monomorphes dans le génome de cellules normales ou tumorales non défectives pour le système MMR. Le criblage systématique d’une série de 603 cas de lymphomes non hodgkiniens (LNH) issus de patients provenant de différents centres hospitaliers français et italiens a été entrepris [6]. Il nous a permis de détecter 12 cas de LNH présentant un phénotype MSI-H dans cette série de tumeurs (Figure 1). L’ensemble de ces cas s’étaient développés chez des patients immunodéprimés, soit au cours d’une infection par le virus HIV de l’immunodéficience acquise (sida), soit après une transplantation d’organe dans un contexte d’immunosuppression iatrogénique au long cours. L’association du phénotype MSI-H à un contexte clinique d’immunosuppression s’est avérée très significative dans la série de cas étudiés, représentant respectivement 2,3 % (3/128) et 8,1 % (9/111) des cas chez des patients atteints de sida ou transplantés. L’émergence clonale MSI-H semble donc être un événement oncogénique dont la survenue n’est possible, au cours de la lymphomagenèse, que lorsqu’elle est favorisée par un déficit immunitaire de l’hôte [6].
Figure 1
Profils obtenus en génotypage fluorescent avec les marqueurs Bat-25 et Bat-26 sur les 12 cas de LNH MSI-H (A) et sur 4 LNH non-MSI (B).
Dans les tumeurs MSI-H, on remarque un raccourcissement allélique de ces deux marqueurs témoignant d’un phénomène d’instabilité des microsatellites. Dans les tumeurs non-MSI, un aspect monomorphe de ces deux marqueurs est observé.
Les lymphomes, comme certains autres types de tumeurs, ont une incidence beaucoup plus élevée chez les patients immunodéprimés que dans la population générale. Ils représentent aujourd’hui la première cause de mortalité chez les malades du sida [7], et une complication majeure du traitement immunosuppresseur chez les patients greffés [8]. Aucun rôle oncogénique direct du VIH ou des substances administrées au long cours chez les patients transplantés n’a été établi jusqu’à aujourd’hui. Aussi, le rôle de virus dont les propriétés transformantes sont connues, comme le virus d’Epstein-Barr (EBV), reste aujourd’hui le seul facteur étiologique pouvant expliquer la fréquence accrue de ces cancers dans un contexte d’immunosuppression. La mise en évidence d’une instabilité génétique de type MSI-H dans les lymphomes de sujets atteints de sida ou transplantés pourrait donc représenter un nouveau mécanisme d’échappement clonal favorisé par l’immunodéficience de l’hôte.
L’analyse des 12 cas de LNH MSI-H nous a permis de démontrer l’existence de mutations affectant des gènes, contenant des répétitions microsatellites codantes, classiquement altérés dans les cancers gastro-intestinaux ou endométriaux présentant un phénotype MSI-H. En revanche, nos premiers résultats indiquent une spécificité tissulaire quant au répertoire des gènes concernés. En effet, si RAD-50 [9], impliqué dans des mécanismes de recombinaison de l’ADN, ainsi que les gènes pro-apoptotiques BAX et CASPASE-5 [10], sont des gènes cibles d’instabilité communs aux différentes localisations tumorales MSI-H (avec toutefois une plus grande incidence dans les lymphomes du sujet immunodéficient que dans les tumeurs gastro-intestinales), un gène comme TGFßRII (codant pour le récepteur de type II du transforming growth factor) ne semble pas être impliqué dans le développement des lymphomes MSI-H, alors qu’il est très fréquemment altéré dans les cancers MSI-H gastro-intestinaux.
Par ailleurs, l’émergence clonale MSI-H dans ces lymphomes n’a été retrouvée associée à la présence de l’EBV que dans la moitié des cas [6]. Ce dernier résultat suggère que l’acquisition d’un phénotype MSI-H dans ces tumeurs s’est faite indépendamment de la présence de cet agent viral. Sur le plan fondamental, les mécanismes favorisant l’émergence d’une instabilité génétique microsatellitaire restent à découvrir puisque l’on ne connaît pas, à ce jour, l’anomalie du système de réparation des mésappariements responsable du phénotype MSI-H de ces lymphomes. Sur le plan clinique, il reste à démontrer sur une plus grande série de patients que les LNH MSI-H pourraient être associés à un pronostic plutôt favorable, comme cela à déjà été observé pour d’autres types de tumeurs présentant ce phénotype [11].
Parties annexes
Remerciements
Ce travail a été en partie financé par l’Association nationale pour la recherche contre le sida (ANRS. Contrat 03/162). Remerciements au Dr VPL pour sa relecture du manuscrit.
Références
- 1. Aaltonen LA, Peltomäki P, Leach FS, et al. Clues to the pathogenesis of familial colorectal cancer. Science 1993 ; 260 : 812-6.
- 2. Thibodeau SN, Bren G, Schaid D. Microsatellite instability in cancer of the proximal colon. Science 1993 ; 260 : 816-9.
- 3. Ionov Y, Peinado M, Malkhosyan S, et al. Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis. Nature 1993 ; 363 : 558-61.
- 4. Boland CR, Thibodeau SN, Hamilton SR, et al. A National cancer institute workshop on microsatellite instability for cancer detection and familial predisposition: Development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res 1998 ; 58 : 5248-57.
- 5. Suraweera N, Duval A, Reperant M, et al. Evaluation of tumor microsatellite instability using five quasimonomorphic monoculceotide repeats and pentaplex PCR. Gastroenterology 2002 ; 123 : 1804-11.
- 6. Duval A, Raphael M, Brennetot C, et al. The mutator pathway is a feature of immunodeficiency-related lymphomas. Proc Natl Acad Sci USA 2004 ; 101 : 5002-7.
- 7. Carbone A. Emerging pathways in the development of AIDS-related lymphomas. Lancet Oncol 2003 ; 4 : 22-9.
- 8. Leblond V, Dedhin N, Mamzer Bruneel MF, et al. Identification of prognostic factors in 61 patients with posttransplantation lymphoproliferative disorders. J Clin Oncol 2001 ; 19 : 772-8.
- 9. Duval A, Rolland S, Compoint A, et al. Evolution of instability at coding and non-coding repeat sequences in human MSI-H colorectal cancers. Hum Mol Genet 2001 ; 10 : 513-8.
- 10. Duval A, Hamelin R. Mutations at coding repeat sequences in mismatch repair deficient human cancers: Toward a new concept of target genes for instability. Cancer Res 2002 ; 62 : 2447-54.
- 11. Lothe RA, Peltomaki P, Meling GI, et al. Genomic instability in colorectal cancer: Relationship to clinicopathological variables and family history. Cancer Res 1993 ; 53 : 5849-52
Liste des figures
Figure 1
Profils obtenus en génotypage fluorescent avec les marqueurs Bat-25 et Bat-26 sur les 12 cas de LNH MSI-H (A) et sur 4 LNH non-MSI (B).