Corps de l’article
Les quantum dots (QD) (boîtes quantiques) sont des cristaux de semi-conducteurs de forme sphérique dont les dimensions ne dépassent pas quelques nanomètres. Depuis 1993, date à laquelle ils ont été synthétisés pour la première fois [1], il a souvent été dit que ces nanoparticules apporteraient une révolution dans l’imagerie bio-médicale. Les QD ont en effet des propriétés optiques hors du commun [2] qui permettent de déplacer certaines limitations inhérentes aux marqueurs fluorescents organiques (fluorescéine, rhodamine, GFP, green fluorescent protein, etc.), comme la faible résistance au photoblanchiment (c’est-à-dire la perte d’émission de fluorescence après une certaine durée d’excitation), ou la difficulté de visualiser simultanément des colorants de couleur différente. Un QD unique peut être visualisé en fluorescence pendant plusieurs minutes, ce qui permet de pousser la détection jusqu’à la visualisation de molécules uniques. Par ailleurs, pour des raisons de confinement quantiques, la longueur d’onde d’émission des QD est directement reliée à leur taille. En effet, la « taille caractéristique » de l’onde associée à l’exciton - responsable de l’émission de fluorescence - créée dans le coeur du QD est plus grande que le QD lui-même. Ainsi, dans le cas de dots formés de CdSe/ZnS, les particules de 2 nm de diamètre émettent dans le bleu (autour de 520 nm) alors que les plus grosses (6 nm) émettent dans le rouge (autour de 620 nm). Avec la même longueur d’onde d’excitation (par exemple, 450 nm), il est ainsi possible avec un seul jeu de filtres de visualiser quatre ou cinq couleurs différentes.
Malgré ces propriétés optiques attrayantes, les QD n’ont été que très peu utilisés comme marqueur fluorescent en biologie. Cela est dû aux difficultés de solubiliser les dots en milieu aqueux tout en conservant trois propriétés essentielles: une bonne fluorescence, une stabilité colloïdale et une faible adsorption non spécifique. Ce n’est que très récemment que ces conditions commencent à être satisfaites simultanément [3-5].
La difficulté vient du fait qu’après leur synthèse (obtenue par injection rapide sous atmosphère contrôlée d’un mélange de diméthyl cadmium, de sélénium et de trioctylphosphine dans une solution d’oxyde de trioctylphosphine chauffée à 350°C [1]), les QD sont recouverts de ligands hydrophobes. Pour les solubiliser dans l’eau, il faut les rendre hydrophiles tout en protégeant leur surface des charges présentes en solution (ces charges détruisent la fluorescence des QD). La stratégie employée jusqu’à présent consistait à échanger les ligands de surface avec des ligands ayant une partie hydrophile. Ces nouveaux ligands se greffent sur la surface du dot pour former une croûte monocouche [6] ou multicouche [7]. Ces méthodes permettent de rendre les dots solubles dans l’eau mais de nombreux problèmes d’adsorption non spécifique et d’agrégation apparaissent lors d’une utilisation in vitro [8]. Par ailleurs, aucune de ces méthodes ne permet d’utiliser les dotsin vivo.
Récemment, nous avons montré qu’en gardant les ligands hydrophobes à la surface des dots, il était possible de les encapsuler au coeur d’une micelle (c’est-à-dire une boule de polymères orientés radialement comme les épines d’un hérisson) de phospholipides composée d’un mélange de n-poly(éthylèneglycol) phosphatidyléthanolamine (PEG-PE) et de phosphatidylcholine (PC) [3]. La stabilité de la micelle est très améliorée par la présence du QD en son coeur, probablement à cause des interactions hydrophobes entre les ligands à la surface du dot et la double chaîne hydrophobe du phospholipide. Sans QD, les micelles se dégradent au bout de quelques jours [9]. Avec QD, elles sont stables pendant plusieurs mois en solution aqueuse. Cette nouvelle méthode d’encapsulation permet d’obtenir rapidement (moins de 5 minutes) des QD-micelles régulières dont la taille, la forme et la structure sont homogènes. La présence d’une couche de PEG dense et orientée vers l’extérieur de la micelle assure une adsorption non spécifique minimale avec les biomolécules. La densité de PEG ainsi que la taille des micelles peuvent être ajustées en fonction des applications. En mélangeant des PEG-PE avec des PEG-PE dont l’extrémité PEG porte un groupe réactif, on obtient des QD-micelles sur lesquelles on peut greffer des protéines ou de l’ADN. Nous avons montré que des QD-micelles sur lesquelles ont été attachées des molécules d’ADN (simple brin) s’accrochent spécifiquement à une séquence complémentaire d’ADN immobilisée dans des billes de 4 % d’agarose mais ne s’accrochent pas lorsque la séquence n’est pas appariée [3].
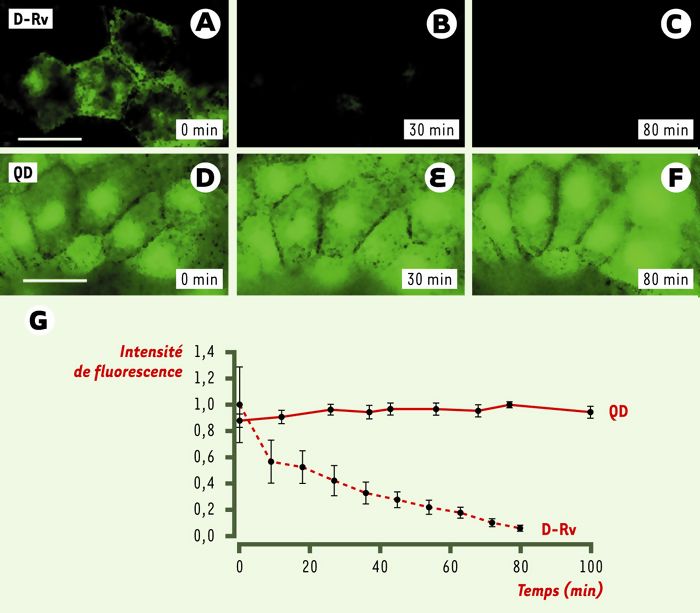
Nous avons ensuite testé la possibilité d’utiliser les QD-micelles comme traceur dans des expériences d’imagerie in vivo. Pour cela, deux critères doivent être remplis: les QD-micelles doivent être neutres d’un point de vue biologique (faible toxicité, absence d’activité biologique) et être stables dans le temps. Nous avons injecté des embryons de xénope à un stade précoce du développement avec des QD-micelles (Figure 1A). L’environnement embryonnaire, par sa sensibilité, est très bien adapté à l’analyse de l’activité biologique et de la toxicité des QD-micelles parce que les modifications qui seraient induites dans les cellules se traduisent en général par des phénotypes biologiques reconnaissables et mesurables. La Figure 1 montre des QD-micelles injectées dans des cellules individuelles d’un embryon à un stade précoce. Il faut souligner plusieurs points importants. (1) Les QD-micelles ne diffusent pas d’une cellule à l’autre: seules les cellules issues de la cellule injectée sont fluorescentes. (2) Les QD-micelles semblent avoir une activité et une toxicité très faibles. Pour des quantités injectées typiques (environ 2.109 QD-micelles/cellule), la lignée cellulaire peut être suivie par fluorescence pendant plusieurs jours, et les embryons traités ont un phénotype identique à celui des embryons qui n’ont pas reçu de QD. L’injection de quantités supérieures de QD (au-delà de 5.109 QD-micelles/cellule) entraîne des anomalies du développement embryonnaire. La cause de cette toxicité est pour l’instant inconnue, mais elle est probablement liée au changement de pression osmotique à l’intérieur de la cellule. (3) Les QD-micelles sont stables in vivo. Après quatre jours de développement embryonnaire, il n’y a pas d’agrégation détectable de QD et leur fluorescence reste stable. (4) Les QD-micelles peuvent être introduits dans tous les types de cellules embryonnaires incluant celles des somites, les neurones et les axones (Figure 1F), l’ectoderme (Figure 1G), la crête neurale (Figure 1H) et l’endoderme (Figure 1I) sans ségrégation visible. (5) La fluorescence des QD peut être observée très tôt pendant le développement (Figure 1B) malgré la pigmentation et la fluorescence intrinsèque importante des cellules. Cela contraste avec le temps limité pendant lequel la GFP, un traceur classique, peut être détectée après l’injection de l’ARN ou de l’ADNc codant pour cette protéine, une fois qu’elle est exprimée à des niveaux détectables in vivo. (6) L’examen d’embryons au stade du têtard montre qu’il est possible de détecter la fluorescence émise par les QD-micelles même dans des régions ayant une fluorescence intrinsèque élevée comme les intestins de l’embryon (Figure 1I). (7) Les QD micelles résistent beaucoup mieux au photoblanchiment que les autres fluorophores in vivo. La Figure 2 compare le photoblanchiment de QD-micelles avec celui du dextran-rhodamine-vert (D-Rv). Les QD-micelles et le D-Rv ont été injectés au même moment dans des embryons au même stade de développement. Après 80 minutes d’illumination constante (à 450 nm) sous le microscope, l’intensité de la fluorescence des QD n’a pas changé alors que celle du D-Rv a été complètement éteinte par photoblanchiment. Des résultats similaires ont été obtenus en comparant la fluorescence des QD-micelles avec celle des GFP membranaires.

Figure 1
Marquage d’embryons de xénope à différents stades du développement avec des quantum dots (QD).
Localisation cellulaire spécifique des QD. A. Schéma donnant la stratégie expérimentale. Des micelles de QD sont injectées dans une cellule d’un embryon de huit cellules. Entre 1,5 et 3 nl d’une suspension de QD (2,3 μm) sont injectés, ce qui correspond à 2.1x109 et 4.2x109 particules injectées dans une cellule. Les embryons sont ensuite cultivés et visualisés à différents stades du développement. B-E. Une image de transmission et une image de fluorescence ont été super-imposées. B. Injection d’une cellule d’un embryon de huit cellules permettant de marquer un seul blastomère. C. Même embryon une heure après. D. Embryon neurula. Ici aussi, une seule cellule d’un embryon à huit cellules a été injecté. F. Marquage intracellulaire d’un axone (flèche) et de somites d’un têtard au stade de développement 40. G. QD localisés dans le noyau pendant les stades mid-blastula. Cette localisation s’atténue plus tard. H. Cellules marquées de la crête neurale migrant dans les branchies. I. Fluorescence des QD observées dans l’estomac de l’embryon. Barres: B-E, H, I: 0,5 mm; F, G: 30 μm. Les images fluorescentes sont obtenues avec le jeu de filtre 41015 Chroma (GFP sauvage, émission passe-haut et une excitation passe-bande de 50 nm de large centrée sur 450 nm) monté sur un microscope Zeiss. Les échantillons sont excités avec une lampe au mercure de 50 W. Les images sont enregistrées avec une caméra couleur digitale (AxioCam HR, Zeiss). Dans ces expériences, les QD ont un diamètre de 3,5 nm, leur coeur est en CdSe, leur croûte en Zn/S. Ces QD absorbent les radiations avec une longueur d’onde < 515 nm et émettent aux alentours de 550 nm.
Figure 2
Comparaison in vivo de la résistance au photoblanchiment des QD et du dextran rhodamine vert (D-Rv).
Les QD et les méthodes d’injection sont similaires à celles utilisées sur la Figure 1. Pour le D-Rv, 1 nl d’une solution à 25 mg/ml a été injecté. A-C. Images consécutives de blastomères injectés avec du D-Rv. D-F. Images consécutives de blastomères injectés avec des QD. Durant chaque expérience, les embryons sont éclairés continûment à 450 nm. G. Représentation graphique de la variation de l’intensité fluorescente d’une cellule de l’embryon injecté avec du D-Rv (pointillés rouges) ou injecté avec des QD (ligne rouge continue). Barre: 30 μm. Le montage optique est similaire à celui décrit sur la Figure 1.
Ces résultats, combinés à ceux présentés récemment [4, 5] semblent ouvrir la voie à l’utilisation des QD comme marqueur fluorescent à la fois in vitro et in vivo.
Parties annexes
Références
- 1. Murray CB, Norris DJ, Bawendi MG. Synthesis and characterization of nearly monodisperse Cde (E = S, Se, Te) semiconductor nanocrystallites. J Am Chem Soc 1993; 115: 8706-15.
- 2. Alivisatos AP. Semiconductor clusters, nanocrystals, and quantum dots. Science 1996; 271: 933-7.
- 3. Dubertret B, Skourides P, Norris DJ, et al. In vivo imaging of quantum dots encapsulated in phospholipid micelles. Science 2002; 298: 1759-62.
- 4. Wu X, Liu H, Liu J, et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots. Nat Biotechnol 2003; 21:41-6.
- 5. Jaiswal JK, Mattoussi H, Mauro JM, Simon SM. Long-term multiple color imaging of live cells using quantum dot bioconjugates. Nat Biotechnol 2003; 21:47-51.
- 6. Chan WCW, Nie SM. Quantum dot bioconjugates for ultrasensitive nonisotopic detection. Science 1998; 281: 2016-8.
- 7. Bruchez M, Moronne M, Gin P, Weiss S, Alivisatos AP. Semiconductor nanocrystals as fluorescent biological labels. Science 1998; 281: 2013-6.
- 8. Dahan M, Laurence T, Pinaud F, et al. Time-gated biological imaging by use of colloidal quantum dots. Optics Lett 2001; 26: 825-7.
- 9. Johnsson M, Hansson P, Edwards K. Spherical micelles and other self-assembled structures in dilute aqueous mixtures of poly(ethylene glycol) lipids. J Phys Chem 2001; 105: 8420-30.
Liste des figures
Figure 1
Marquage d’embryons de xénope à différents stades du développement avec des quantum dots (QD).
Localisation cellulaire spécifique des QD. A. Schéma donnant la stratégie expérimentale. Des micelles de QD sont injectées dans une cellule d’un embryon de huit cellules. Entre 1,5 et 3 nl d’une suspension de QD (2,3 μm) sont injectés, ce qui correspond à 2.1x109 et 4.2x109 particules injectées dans une cellule. Les embryons sont ensuite cultivés et visualisés à différents stades du développement. B-E. Une image de transmission et une image de fluorescence ont été super-imposées. B. Injection d’une cellule d’un embryon de huit cellules permettant de marquer un seul blastomère. C. Même embryon une heure après. D. Embryon neurula. Ici aussi, une seule cellule d’un embryon à huit cellules a été injecté. F. Marquage intracellulaire d’un axone (flèche) et de somites d’un têtard au stade de développement 40. G. QD localisés dans le noyau pendant les stades mid-blastula. Cette localisation s’atténue plus tard. H. Cellules marquées de la crête neurale migrant dans les branchies. I. Fluorescence des QD observées dans l’estomac de l’embryon. Barres: B-E, H, I: 0,5 mm; F, G: 30 μm. Les images fluorescentes sont obtenues avec le jeu de filtre 41015 Chroma (GFP sauvage, émission passe-haut et une excitation passe-bande de 50 nm de large centrée sur 450 nm) monté sur un microscope Zeiss. Les échantillons sont excités avec une lampe au mercure de 50 W. Les images sont enregistrées avec une caméra couleur digitale (AxioCam HR, Zeiss). Dans ces expériences, les QD ont un diamètre de 3,5 nm, leur coeur est en CdSe, leur croûte en Zn/S. Ces QD absorbent les radiations avec une longueur d’onde < 515 nm et émettent aux alentours de 550 nm.
Figure 2
Comparaison in vivo de la résistance au photoblanchiment des QD et du dextran rhodamine vert (D-Rv).
Les QD et les méthodes d’injection sont similaires à celles utilisées sur la Figure 1. Pour le D-Rv, 1 nl d’une solution à 25 mg/ml a été injecté. A-C. Images consécutives de blastomères injectés avec du D-Rv. D-F. Images consécutives de blastomères injectés avec des QD. Durant chaque expérience, les embryons sont éclairés continûment à 450 nm. G. Représentation graphique de la variation de l’intensité fluorescente d’une cellule de l’embryon injecté avec du D-Rv (pointillés rouges) ou injecté avec des QD (ligne rouge continue). Barre: 30 μm. Le montage optique est similaire à celui décrit sur la Figure 1.