Corps de l’article
La superfamille des récepteurs couplés aux protéines G (GPCR) comprend plus de 500 protéines à sept domaines transmembranaires qui, activées par la fixation d’un ligand, recrutent et contrôlent l’activité de protéines G hétérotrimériques intracellulaires [1]. Ces récepteurs transmettent des signaux endogènes (amines biogéniques, peptides, glycoprotéines, lipides, nucléotides, ions, protéases) et exogènes (photons, particules odorantes) [1]. La rhodopsine, activée par les photons et exprimée par les cellules photosensibles de la rétine, constitue, avec le récepteur β2 adrénergique, le GPCR le plus étudié [1]. Un autre signal activateur de ce type de récepteur est la thyrotropine (TSH), une hormone glycoprotéique de 30 kDa, qui contrôle la production des hormones thyroïdiennes par la glande thyroïde. La manière dont des agonistes de taille et de nature aussi diverses sont capables d’activer les GPCR par un mécanisme que l’on peut supposer commun, étant donné leur très grande identité de structure, reste une question centrale non résolue.
On considère actuellement que les GPCR existent sous forme d’un équilibre entre conformation(s) inactive(s) (R) et conformation(s) active(s) (R*) [2]. En l’absence de l’agoniste, la conformation R prédomine, même si la différence énergétique entre les deux conformations est suffisamment faible pour permettre à une fraction des récepteurs d’adopter la conformation R* spontanément (activation constitutive). Les substances agonistes, en se liant préférentiellement à la forme activée R* pour laquelle elles présentent une plus forte affinité, modifieraient l’équilibre en faveur de ces formes. Inversement, la conformation R serait stabilisée par des ligands que l’on appelle agonistes inverses. Les données expérimentales suggèrent que la transition entre les conformations R et R* est caractérisée par une modification relative de la position de certaines des hélices transmembranaires, en particulier les hélices 3, 6 et 7 [3].
En termes d’activation, le récepteur de la TSH (TSHr) possède des caractéristiques particulières: son activité constitutive est relativement importante, et il peut être stimulé par la TSH, mais aussi par les auto-anticorps produits au cours de la maladie de Graves-Basedow, et par des mutations naturelles. Certaines de ces mutations naturelles activatrices ont été décrites dans les boucles extracellulaires de la région à sept domaines transmembranaires (serpentin) [4] et, plus récemment, dans le long segment extracellulaire (ectodomaine) (Figure 1A) [5] qui caractérise le TSHr et les autres récepteurs des hormones glycoprotéiques (hormone lutéinisante ou LH, hormone de la folliculogenèse ou FSH, hormone chorioplacentaire ou HCG). Par ailleurs, la délétion de l’ectodomaine entraîne une augmentation de l’activité intrinsèque du récepteur tronqué par rapport au TSHr intact [6]. L’ensemble de ces observations suggère que l’ectodomaine pourrait exercer une contrainte inhibitrice sur le serpentin spontanément actif du TSHr. Cependant, la mesure de l’activité du récepteur tronqué est techniquement difficile, son expression membranaire étant extrêmement réduite. La fusion du signal d’adressage membranaire de la rhodopsine sur le TSHr tronqué nous a récemment permis d’obtenir une forte expression membranaire de ce récepteur et de montrer que son activation intrinsèque est 5 à 6 fois plus importante que celle du TSHr intact [7]. Ces résultats confirment que l’ectodomaine du TSHr inhibe l’activité intrinsèque du domaine serpentin. En outre, une équipe américaine a récemment montré que l’ectodomaine du récepteur de la LH et de l’HCG interagit avec la 2e boucle extracellulaire pour inhiber le serpentin [8]. Ce mécanisme inhibiteur pourrait donc être une caractéristique générale des récepteurs des hormones glycoprotéiques.
Figure 1
Rôle de l’ectodomaine du récepteur de la TSH dans l’activation induite par les mutations activatrices.
Les valeurs relatives d’activité constitutive sont indiquées sous chaque construction. A. L’augmentation de l’activité constitutive du récepteur de la TSH lorsqu’il est tronqué de son ectodomaine suggère que celui-ci exerce une inhibition sur l’activité intrinsèque de la région des sept domaines transmembranaires. B. Les mutations activatrices des segments intramembranaires ou des boucles intracellulaires activent le récepteur même en l’absence d’ectodomaine. C. En revanche, les mutations affectant les boucles extracellulaires, activatrices dans le récepteur complet, ne le sont plus lorsque l’ectodomaine a été délété. L’activation du récepteur de la TSH nécessiterait ainsi le passage de l’ectodomaine d’une conformation inhibitrice (effet agoniste inverse) vers une conformation activatrice (effet agoniste). Les mutations sont indiquées par une étoile.
Une expression membranaire conservée nous a offert aussi l’opportunité d’évaluer l’effet des mutations activatrices dans le contexte d’un TSHr tronqué de son ectodomaine (Figure 1B). Ainsi, nous avons pu montrer que des mutations ponctuelles du 6e segment transmembranaire (mutation D633A) et de la 3e boucle intracellulaire (mutation A623I) activent le TSHr tronqué avec la même efficacité que le TSHr entier. En revanche, le TSHr tronqué n’est plus activé lorsque les mutations affectent les boucles extracellulaires (mutations ponctuelles I486F et I568T) ou le sommet du 7e segment transmembranaire (délétion del658-661) (Figure 1C) [7]. Par ailleurs, des mutations situées dans un segment de l’ectodomaine (mutations de la sérine 281) sont également activatrices [5]. Ces résultats suggèrent que l’activation du récepteur fait intervenir un module fonctionnel composite formé par les boucles extracellulaires et l’ectodomaine. L’ectodomaine agirait donc à deux niveaux: (1) comme inhibiteur de l’activation intrinsèque du TSHr; et (2) comme un médiateur essentiel dans la transduction intramoléculaire de l’activation induite par certaines mutations activatrices. Cette dernière activité est-elle également requise pour l’activation du TSHr par son ligand naturel? Si tel était le cas, l’ectodomaine associé aux boucles extracellulaires pourrait être considéré comme un module fonctionnel régulateur de l’activation du TSHr. Selon ce modèle, en l’absence d’agoniste, l’ectodomaine agirait comme un agoniste inverse en stabilisant, via des interactions avec les boucles extracellulaires, la conformation R inactive du récepteur. Après liaison de la TSH ou du fait de mutations dans ce module fonctionnel, l’ectodomaine se comporterait comme un agoniste favorisant la (les) conformation(s) R* active(s). L’activation du TSHr nécessiterait ainsi le passage de l’ectodomaine d’une activité agoniste inverse vers une activité agoniste [7].
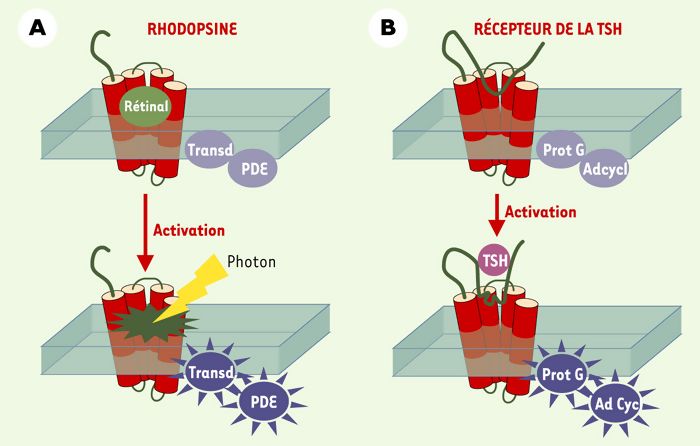
Ce modèle peut-il être étendu aux autres GPCR? Les données tridimensionnelles concernant la rhodopsine indiquent qu’une poche est délimitée au sein des sept hélices transmembranaires pour recevoir le rétinal, son ligand naturel [9, 10]. Ce ligand présente une caractéristique unique parmi tous les ligands des GPCR: il est lié de façon covalente à son récepteur (Figure 2A). Lors de la stimulation lumineuse, le rétinal subit une isomérisation qui entraîne la modification de l’organisation des hélices transmembranaires et l’activation du récepteur. Nous proposons un modèle similaire pour le TSHr (Figure 2), dans lequel l’ectodomaine fonctionnerait lui aussi comme un ligand attaché de façon covalente au reste du récepteur. En l’absence de stimulation, ses interactions avec les boucles extracellulaires inhiberaient l’activité du serpentin. Sous l’effet de la fixation de la TSH (ou du fait de mutations activatrices), l’ectodomaine subirait un changement de conformation aboutissant à la transduction du signal d’activation vers les hélices trans-membranaires.
Figure 2
Modèle d’activation de la rhodopsine et du récepteur de la TSH.
A. La rhodopsine est liée de façon covalente à son ligand, le rétinal. À l’état basal, la rhodopsine liée au rétinal adopte une conformation inactive maintenue par des interactions inhibitrices. Sous l’effet d’un photon lumineux, le rétinal change de conformation (isomérisation) et induit l’activation de la rhodopsine. Transd: transducine; PDE: phosphodiestérase. B. Accroché au serpentin, l’ectodomaine du récepteur de la TSH se comporterait fonctionnellement comme le rétinal. En l’absence de TSH, il contribuerait au maintien du récepteur dans une conformation inactive, probablement par le biais d’interactions inhibitrices avec les boucles extracellulaires du serpentin. Après fixation de la TSH, un changement conformationnel de l’ectodomaine (et de ses interactions avec le serpentin) induirait l’activation du récepteur. Prot G: protéine G; Ad Cycl: adénylate cyclase.
Parties annexes
Références
- 1. Bockaert J. Les récepteurs à sept domaines transmembranaires: physiologie et pathologie de la transduction. Med Sci 1995; 11: 382-94.
- 2. Samama P, Cotecchia S, Costa T, Lefkowitz RJ. A mutation-induced activated state of the beta 2-adrenergic receptor. Extending the ternary complex model. J Biol Chem 1993; 268: 4625-36.
- 3. Han M, Smith SO, Sakmar TP. Constitutive activation of opsin by mutation of methionine 257 on transmembrane helix 6. Biochemistry 1998; 37: 8253-61.
- 4. Duprez L, Parma J, Costagliola S, et al. Constitutive activation of the TSH receptor by spontaneous mutations affecting the N-terminal extracellular domain. FEBS Lett 1997; 409: 469-74.
- 5. Ho SC, Van Sande J, Lefort A, Vassart G, Costagliola S. Effects of mutations involving the highly conserved S281HCC motif in the extracellular domain of the thyrotropin (TSH) receptor on TSH binding and constitutive activity. Endocrinology 2001; 142: 2760-7.
- 6. Zhang M, Tong KP, Fremont V, et al. The extracellular domain suppresses constitutive activity of the transmembrane domain of the human TSH receptor: implications for hormone-receptor interaction and antagonist design. Endocrinology 2000; 141: 3514-7.
- 7. Vlaeminck-Guillem V, Ho SC, Rodien P, Vassart G, Costagliola S. Activation of the cAMP pathway by the TSH receptor involves switching of the ectodomain from a tethered inverse agonist to an agonist. Mol Endocrinol 2002; 16: 736-46.
- 8. Nishi S, Nakabayashi K, Kobilka B, Hsueh AJ. The ectodomain of the luteinizing hormone receptor interacts with exoloop 2 to constrain the transmembrane region: studies using chimeric human and fly receptors. J Biol Chem 2002; 277: 3958-64.
- 9. Schertler GF, Villa C, Henderson R. Projection structure of rhodopsin. Nature 1993; 362: 770-2.
- 10. Unger VM, Hargrave PA, Baldwin JM, Schertler GF. Arrangement of rhodopsin transmembrane alpha-helices. Nature 1997; 389: 203-6.
Liste des figures
Figure 1
Rôle de l’ectodomaine du récepteur de la TSH dans l’activation induite par les mutations activatrices.
Les valeurs relatives d’activité constitutive sont indiquées sous chaque construction. A. L’augmentation de l’activité constitutive du récepteur de la TSH lorsqu’il est tronqué de son ectodomaine suggère que celui-ci exerce une inhibition sur l’activité intrinsèque de la région des sept domaines transmembranaires. B. Les mutations activatrices des segments intramembranaires ou des boucles intracellulaires activent le récepteur même en l’absence d’ectodomaine. C. En revanche, les mutations affectant les boucles extracellulaires, activatrices dans le récepteur complet, ne le sont plus lorsque l’ectodomaine a été délété. L’activation du récepteur de la TSH nécessiterait ainsi le passage de l’ectodomaine d’une conformation inhibitrice (effet agoniste inverse) vers une conformation activatrice (effet agoniste). Les mutations sont indiquées par une étoile.
Figure 2
Modèle d’activation de la rhodopsine et du récepteur de la TSH.
A. La rhodopsine est liée de façon covalente à son ligand, le rétinal. À l’état basal, la rhodopsine liée au rétinal adopte une conformation inactive maintenue par des interactions inhibitrices. Sous l’effet d’un photon lumineux, le rétinal change de conformation (isomérisation) et induit l’activation de la rhodopsine. Transd: transducine; PDE: phosphodiestérase. B. Accroché au serpentin, l’ectodomaine du récepteur de la TSH se comporterait fonctionnellement comme le rétinal. En l’absence de TSH, il contribuerait au maintien du récepteur dans une conformation inactive, probablement par le biais d’interactions inhibitrices avec les boucles extracellulaires du serpentin. Après fixation de la TSH, un changement conformationnel de l’ectodomaine (et de ses interactions avec le serpentin) induirait l’activation du récepteur. Prot G: protéine G; Ad Cycl: adénylate cyclase.