Résumés
Résumé
L’objectif de la présente étude est d’évaluer la distribution de quatre éléments traces métalliques (ETM), cadmium, cuivre, nickel et zinc, dans les différentes parties anatomiques (racines et feuilles) d’une chénopodiacée Spinacia oleracea (L.), en lien avec le niveau de contamination des sédiments où elle pousse, de l’oued Boumerzoug et ses affluents. Localisé dans le Constantinois au nord-est de l’Algérie, l’oued draine un bassin versant de 1 832 km2 avec ses zones urbaines et industrielles. Cette étude inclut 14 stations, 5 situées sur l’oued Boumerzoug et 9 sur ses affluents, sélectionnées en des lieux stratégiques et échantillonnées cinq fois au mois de mai, septembre et décembre 2016, ainsi qu’en mars et juillet 2017. Les teneurs moyennes des ETM des sédiments sont de 0,44 ± 0,30 mg∙kg-1 (masse sèche) pour Cd, 43,61 ± 36,45 mg∙kg-1 (ms) pour Cu, 35,16 ± 9,85 mg∙kg-1 (ms) pour Ni et 181,33 ± 115,12 mg∙kg-1 (ms) pour Zn. Le transfert des ETM a été étudié chez l’épinard S. oleracea dont les différentes parties accumulent différemment les métaux. Les concentrations des ETM dans les sédiments et la chénopodiacée sont très variables aussi bien dans l’espace que dans le temps. Nos résultats montrent que la chénopodiacée séquestre dans ses racines le Cd, le Cu et le Ni, alors que le Zn est transloqué vers les feuilles. La hiérarchie des teneurs moyennes en métaux dans les épinards (Zn > Cu > Ni > Cd) est similaire à celle des sédiments.
Mots-clés:
- éléments traces métalliques,
- sédiment,
- Spinacia oleracea,
- contamination,
- oued Boumerzoug
Abstract
The aim of this study is to assess the distribution of four trace metals (TM): cadmium, copper, nickel and zinc in roots and leaves of a Chenopodiaceae Spinacia oleracea (L.) in relation to the contamination level of the sediments of the Boumerzoug wadi and its tributaries. Located in the Constantinois in Northeast Algeria, the wadi drains a watershed of 1 832 km2 with its urban and industrial areas. A total of 14 stations, 5 in Boumerzoug wadi and 9 in its tributaries, were selected in strategic points and sampled at five occasions in May, September, and December 2016, as well as in March and July 2017. The mean TM levels in the sediments are 0.44 ± 0.30 mg∙kg-1 (dry weight) for Cd, 43.61 ± 36.45 mg∙kg-1 (dw) for Cu, 35.16 ± 9.85 mg∙kg-1 (dw) for Ni and 181.33 ± 115.1 mg∙kg-1 (dw) for Zn. The transfer of trace metals was studied in spinach. The different parts of S. oleracea accumulate trace metals differently. Trace metals concentrations in the sediments and the chenopodiaceae are highly variable both spatially and temporally. Our results indicate that S. oleracea cοncentrates and sequesters Cd, Cu, and Ni in its roots, whereas Zn is translocated to leaves. The hierarchy of mean TM level in spinach (Zn > Cu > Ni > Cd) is similar to that of sediments.
Key words:
- trace metals,
- sediment,
- Spinacia oleracea,
- contamination,
- Boumerzoug wadi
Corps de l’article
1. Introduction
Les milieux aquatiques d’eaux douces, écosystèmes les plus complexes et les plus dynamiques, jouent un rôle essentiel dans la conservation de la biodiversité, le fonctionnement des organismes et les cycles des matières organique et minérale (SAHLI et al., 2012; BARHOUMI et al., 2019). Dans les pays d’Afrique du Nord, en particulier l’Algérie, les eaux de surface, utilisées pour les besoins de l’agriculture, de l’alimentation des populations et de l’industrie, voient leur demande s'accroître sans cesse (FAO et OMS, 2000). Des investissements considérables ont été consacrés à la construction de barrages, notamment dans l’Est du pays. Sous climat semi-aride, ces eaux de surface sont vulnérables et sont souvent de qualité médiocre face aux diverses pollutions. Elles peuvent contenir des quantités non négligeables de matières organiques naturelles (WANG et CHEN 2006), telles que les substances humiques, mais aussi des composés organiques issus de divers rejets polluants ou de pratiques agricoles intensives (EGGLETON et THOMAS, 2004). Parmi les cours d’eau représentatifs dans le Nord-Est algérien, l’oued Rhumel, principal cours d’eau du bassin Kébir-Rhumel, est un écosystème aquatique très important compte tenu de son débit et de son impact économique sur la région de Constantine. Il a suscité un intérêt particulier comme « bassin atelier » pour la recherche sur la qualité écologique et le niveau de contamination organique et métallique (AFRI-MEHENNAOUI et al., 2004; AFRI-MEHENNAOUI, 2006; AFRI-MEHENNAOUI et al., 2009a, 2009b; SAHLI et al., 2011, 2012, 2014; DJEDDI et l., 2018), sur la physicochimie de l’eau (MELGHIT et al., 2015) et la biodiversité algale (KHERIEF NACEREDDINE et al., 2018). Les stratégies de surveillance de l’environnement sont au coeur des préoccupations de groupes d’étude émanant d’instances internationales, à travers de nombreux programmes scientifiques qui assurent le suivi de divers contaminants métalliques et organiques dans l’eau, le sédiment et la matière vivante. Le concept de biosurveillance, aujourd’hui en plein essor, repose sur l’étude des réponses biologiques des organismes exposés aux divers polluants. Les éléments traces métalliques (ETM) font partie des substances chimiques qui constituent un danger pour l'environnement et la santé des êtres vivants, en particulier dans les milieux aquatiques (WU et al., 2013a, 2013b; KHEMIS et al., 2017). Ces éléments, largement utilisés dans les secteurs industriels et agricoles, sont relativement toxiques (BISONE, 2012; CHANG et al., 2014; PRADHAN et KUMAR, 2014). Certains métaux sont purement toxiques pour les êtres vivants en raison de leur capacité de bioaccumulation et de leur persistance dans l'environnement, en particulier dans les sédiments des hydrosystèmes, vu leur faible biodégradation (LARROSE et al., 2010; DIOP, 2014; SAHER et SIDDIQUI, 2016). L'accumulation de résidus métalliques chez les producteurs aquatiques et les micro-organismes affecte les réseaux trophiques et peut provoquer une toxicité à différents niveaux des chaines alimentaires, ce qui accroît la vulnérabilité de la flore et de la faune (YI et al., 2011; MEDEIROS et al., 2012). La détermination des teneurs en ETM chez les êtres vivants et dans le milieu (eau et sédiments) demeure une étape indispensable dans les études écotoxicologiques.
Les plantes aquatiques sont utilisées comme des bio-indicateurs de la contamination métallique de leur environnement immédiat (SAMECKA CYMERMAN et KEMPERS, 2001; ZURAYK et al., 2001; AFRI-MEHENNAOUI et al., 2009a; POLECHOŃSKA et al., 2018; BALDANTONI et al., 2018; HU et al., 2019). À cet effet, la capacité de certaines plantes à accumuler des métaux en fait de bons candidats pour la phytoremédiation des milieux aquatiques et/ou des sols pollués (MAHAR et al., 2016; GHOSH et MANCHANDA, 2019). La contamination peut également affecter les cultures sur des sols pollués. L'exposition humaine par voie orale lors de la consommation des aliments est l'une des principales voies d'exposition aux ETM (KHAN et al., 2013). Spinacia oleracea (L.), appartenant à l'ordre des Caryophyllales, est l'un des légumes verts les plus appréciés pour sa richesse en nutriments essentiels (TANDI et al., 2004). La vitesse de croissance et les taux d'absorption des ETM, relativement élevés, en font une plante de choix pour la caractérisation du transfert des contaminants. Récemment, en raison de ces caractéristiques uniques, S. oleracea et d'autres espèces de l'ordre des Caryophyllales ont été étudiées dans un certain nombre de travaux scientifiques pour observer leurs réactions de croissance et de toxicité aux contaminants métalliques (KOUAKOU et al., 2008; CASIERRA POSADA et al., 2012; SINGH et al., 2013; NAZ et al., 2013; TÓTH et al., 2014; NAZ et al., 2015; KASHIMBO KALALA et al., 2015; TOURE et al., 2015; KUMAR et al., 2016; PANDIT et al., 2017; MUGIVHISA et OLOWOYO, 2017; BOYSAN CANAL et al., 2018; TŐZSÉR et al., 2019). Dans ce contexte nous avons évalué la qualité physico-chimique et le niveau de contamination des sédiments de l’oued Boumerzoug et de ses affluents par quatre métaux (cadmium, cuivre, nickel et zinc) ainsi que leur transfert et leur distribution dans les racines et les feuilles de S. oleracea très fréquente dans le régime alimentaire de la population locale. S. oleracea n’a pas fait l’objet d’études antérieures dans le contexte assez particulier des oueds nord-africains et particulièrement algériens soumis à un régime hydrique fluctuant, marqué par la saisonnalité et un déficit estival très accusé.
2. Matériel et méthodes
2.1. Sites d’étude et localisation des stations
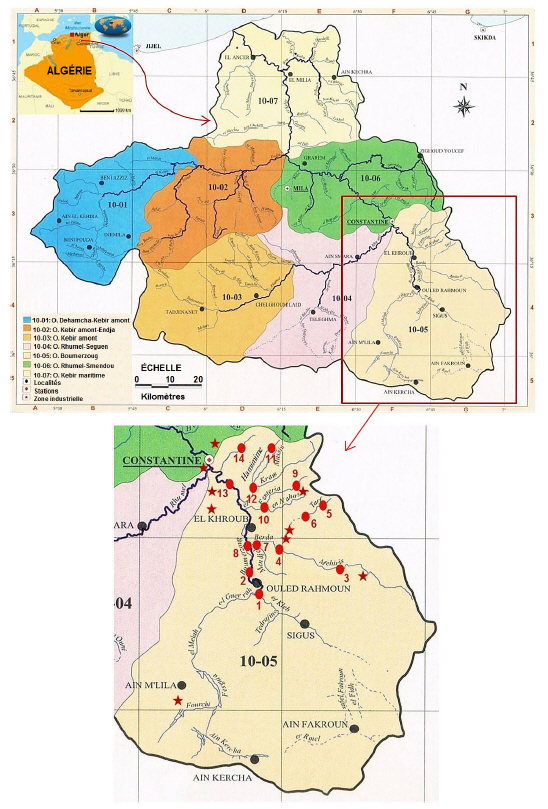
Le sous-bassin du Boumerzoug occupe le sud-est du bassin du Kébir-Rhumel. L’oued Kébir résulte de la jonction de deux cours d’eau importants : l’oued Rhumel et l’oued Endja. Ils alimentent le plus grand barrage d’Algérie, le Béni-Haroun, mis à l’eau en 2003, d’où l’importance de la qualité des cours d’eau qui y convergent. L’oued Boumerzoug, affluent de l’oued Rhumel, situé en amont et au sud de Constantine, troisième ville d’Algérie, draine un bassin versant de 1 832 km2 qui se présente comme une cuvette d’effondrement, dominée par des reliefs en horst isolés et abrupts. Long de 50 km, il naît de la confluence d’oued El Kleb et oued Meleh à environ 25 km au sud de Constantine; il traverse plusieurs agglomérations : Ain Mlila, Ouled Rahmoun, El Guerrah, El Khroub avant d’atteindre le Rhumel à Constantine ville. Le Boumrezoug reçoit plusieurs affluents sur son parcours dont le plus important est l’oued Hamimime. Les unités industrielles du sous-bassin de l’oued Boumerzoug (10-05, Figure 1) sont réparties en plusieurs zones, concentrées autour des grandes agglomérations et le long du cours d’eau. Parmi les multiples industries figurent la production du gaz (NAFTAL), les importantes entreprises nationales de production de matériels agricoles (ENPMA) et de production de machines-outils (ENPMO), la Société nationale de production du tabac et allumettes (SNTA), diverses industries alimentaires, des tanneries, etc. (ABH, 2004).
Figure 1
Site d’étude et localisation des stations de prélèvement dans le sous-bassin Boumerzoug
Study site and location of sampling stations in the Boumerzoug sub-basin
La localisation des stations de prélèvements des échantillons est présentée dans la figure 1 et le tableau 1. Dans cette contribution, nous rapporterons les résultats de 14 stations où S. oleracea est présente sur les berges immergées de l’oued; 5 sont situées sur l’oued Boumerzoug proprement dit et 9 sur ses affluents. Elles ont été sélectionnées en des lieux stratégiques en fonction des observations effectuées sur le terrain (rejets et sources de pollution) afin de déceler une éventuelle contamination métallique.
Tableau 1
Coordonnées géographiques des 14 stations de prélèvement de l’oued Boumerzoug et ses affluents
Geographical coordinates of the 14 sampling stations of the Boumerzoug wadi and its tributaries
2.2. Nature des prélèvements
Cinq séries de prélèvements ont été réalisées en mai, septembre et décembre 2016, mars et juillet 2017. L’échantillon des sédiments doit rendre compte d’une pollution récente et en sédimentologie, il est connu que les métaux se fixent préférentiellement sur la fraction fine, inférieure à 63 µm. Ainsi, les sédiments fins, fraîchement déposés en surface, sont échantillonnés à l’aide d’une cuillère en inox à une profondeur inférieure à 5 cm, sur les berges immergées et les endroits où le courant est faible, en plusieurs points afin d’être représentatifs de la station. Environ 500 g sont collectés dans des pots en polyéthylène, préalablement décontaminés après un séjour de 24 à 48 h dans de l’acide nitrique (5N) puis dans de l’eau déminéralisée (RODIER et al., 2009). Ce traitement a été appliqué à toute la verrerie et récipients utilisés lors des prélèvements, analyses et conservation des échantillons, afin d’éviter toute contamination. Les sédiments sont séchés dans une étuve à une température de 80 °C pendant environ 48 h jusqu’à poids constant. Après refroidissement, les échantillons sont broyés et tamisés à 2 mm et 63 µm.
S. oleracea a été échantillonnée dans les 14 stations, près des berges, aux mêmes endroits que les sédiments. Les plantes prélevées sont lavées in situ dans l’oued afin d’éviter une contamination secondaire par adhésion des particules sédimentaires. Au laboratoire, les deux parties de la plante, racines et feuilles, sont séparées manuellement, bien rincées à l’eau déminéralisée afin d’éliminer les éventuels ETM adsorbés en surface afin que les teneurs déterminées correspondent à celles absorbées par la plante. Les racines et les feuilles sont séchées à l’étuve à 80 °C pendant environ 48 h jusqu’à poids constant, puis pulvérisées.
2.3. Caractérisation des sédiments
Les analyses physico-chimiques des paramètres pH, conductivité électrique (CE), matière organique (MO), calcaire total (CT) sont effectuées sur les sédiments homogénéisés et tamisés sur tamis en inox de mailles de 2 mm. La fraction fine destinée au dosage des métaux est tamisée à 63 µm. Le pH des sédiments a été déterminé selon la norme AFNOR NF T90-008 (AFNOR, 1953). La mesure de la conductivité électrique est déterminée à l’aide d’un conductimètre sur le surnageant obtenu après centrifugation du mélange sédiment/eau déminéralisée, dans un rapport 1/5 (RODIER et al., 2009). La teneur en matières organiques (MO) a été déterminée en utilisant la méthode de la perte au feu selon la norme XP P 94-047 (AFNOR, 1998), le calcaire total au calcimètre de Bernard selon la norme NF ISO 10693 (AFNOR, 1995) et la fraction inférieure à 63 µm selon la méthode décrite par RODIER et al. (2009).
2.4. Dosage des éléments traces métalliques (ETM)
Les teneurs en ETM (Cd, Cu, Ni, Zn) des sédiments ont été déterminées dans la fraction argilo-limoneuse inférieure à 63 µm. Elle constitue la fraction la plus importante quantitativement et la plus réactive (STONE et DROPPO, 1996). La technique d’extraction des ETM des sédiments consiste en une digestion humide à l’eau régale (aqua regia), mélange d’HNO3 (Suprapur 65 %) et d’HCl (Suprapur 37 %) dans les proportions 1V/3V. La technique, inspirée de la norme NF ISO 11466 (AFNOR, 1995), est proposée par le producteur du four micro-ondes BERGHOF MWS-2. La digestion à chaud sous pression de 1 g de sédiment dans 10 mL d’eau régale a été effectuée en trois étapes : étape 1 (puissance 80 %, 140 °C, 5 min), étape 2 (puissance 85 %, 160 °C, 5 min) et étape 3 (puissance 90 %, 175 °C, 20 min). Après refroidissement, le minéralisât est filtré sur papier Whatman 540 et le volume est complété à 50 mL avec de l’eau déminéralisée.
La méthode d’extraction du matériel végétal est celle décrite par PERKIN-ELMER (1996). Un gramme de végétal sec pulvérisé est minéralisé dans 10 mL HNO3 (Suprapur 65 %) pendant une nuit à froid dans un bécher recouvert d’un verre de montre. Le minéralisât est chauffé sur bain de sable jusqu’à apparition de fumées. Après refroidissement, 3 ml d’HClO4 (Suprapur 70 %) sont ajoutés puis chauffés à nouveau et évaporés jusqu'à réduction substantielle du volume de l’acide perchlorique. Le résidu est transféré dans une fiole de 50 mL par filtration sur papier Whatman 540 et complété à 50 mL avec de l’eau déminéralisée. Tous les extraits sont conservés dans des flacons en polypropylène au réfrigérateur à 4 °C jusqu’à leurs analyses. Les dosages du cadmium, du cuivre, du nickel et du zinc sont effectués par spectrométrie d’absorption atomique à flamme (Shimadzu 6800).
L’efficacité du protocole d’extraction des ETM dans les sédiments est vérifiée à l’aide de l’analyse d’un échantillon de référence certifié (sédiment d’un lac canadien : lake sediment LKSD-1 No 1065 provenant de CANMET [Canada Centre for Mineral and Energy Technology]). Pour le matériel végétal, la validité de la méthode a été contrôlée via un échantillon de végétation certifié (poplar leaves : GBW 07604). Les concentrations moyennes en métaux (mg∙kg-1) obtenues dans les échantillons de référence (nombre de répétitions = 3) par rapport aux valeurs certifiées sont rapportées dans le tableau 2.
Tableau 2
Teneurs des éléments traces métalliques (ETM) des échantillons de sédiment (LKSD-1) et de végétation (GBW 07604) de référence
Trace metals levels of reference sediment (LKSD-1) and vegetation (GBW 07604) samples
2.5. Analyses statistiques
En plus des statistiques descriptives, pour le traitement des résultats, nous avons effectué une analyse en composantes principales (ACP), qui est une méthode statistique multivariée de l’analyse des données, basée sur la corrélation entre les variables. Les relations entre les éléments analysés ont été testées en utilisant le coefficient de Pearson avec une signification statistique fixée à p < 0,05 à l’aide du logiciel STATISTICA 10.
3. Résultats et discussion
Les données statistiques des caractéristiques physico-chimiques, des teneurs en ETM des sédiments puis des feuilles et racines de S. oleracea sont présentées dans les tableaux 3 et 4 respectivement où nous rapportons les indicateurs statistiques suivants : minimum, 1er quartile, moyenne, médiane, 3e quartile, maximum et écart-type.
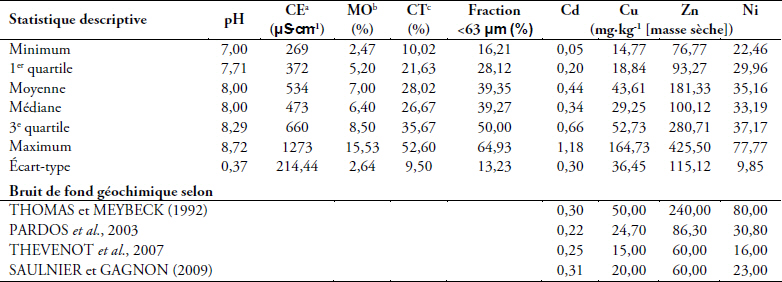
Le tableau 3 montre que le pH des sédiments mesuré à cinq reprises pour les 14 stations oscille entre 7 et 8,72 avec une moyenne de 8. Les valeurs enregistrées indiquent un pH à caractère alcalin tendant parfois vers la neutralité. L’alcalinité reflète la nature des sédiments, dominée par une roche mère calcaire et des sols argilo-limoneux. La conductivité électrique des sédiments de l’oued Boumerzoug et ses affluents présente d’importantes fluctuations spatio-temporelles de 269 à 1 273 µS∙cm-1. Elle reste néanmoins assez conforme à la conductivité des sédiments des eaux douces malgré quelques pics excédant 1 000 µS∙cm-1. Les valeurs traduisent une minéralisation parfois élevée pouvant être attribuée aux rejets industriels et/ou urbains en plus de la présence de sebkhas et de marais salants en amont du sous-bassin dans la région d’Ain M’lila. Les fluctuations temporelles résulteraient de l’influence directe des phénomènes de concentration et de dilution liés au débit et aux conditions climatiques saisonnières. Les teneurs en matière organique (MO), évaluées par la perte au feu à 525 °C, montrent que les sédiments sont chargés en MO et en particules fines qui vont jouer un rôle primordial dans la fixation des éléments traces métalliques (ETM). Pour l’ensemble des prélèvements, elles varient de 2,47 à 15,53 % avec une moyenne de 7 %. MEYBECK et BERTRU (1998) qualifient de très forte la proportion de 10 % de MO dans les sédiments. Les teneurs élevées de MO notamment pour les sédiments prélevés dans les stations à proximité des rejets urbains et/ou industriels et ceux échantillonnés en période d’étiage, sont le résultat de plusieurs facteurs, tel que les apports anthropiques par les effluents et l’intensité de la productivité biologique qui est un facteur non négligeable. Le pourcentage du calcaire total (CT) affiche également des variations sensibles dues en premier lieu à la nature du substrat. La présence de CaCO3 dans les sédiments implique un bon effet de dilution conduisant à une diminution de la toxicité des ETM (TESSIER et al., 1982). Selon SONG et MÜLLER (1999), les sédiments contenant du calcaire ont en général un pH alcalin, car le calcaire neutralise l’acidité produite par la croissance des plantes. Directement visée par la méthode d’échantillonnage, car elle fixe préférentiellement les ETM, la fraction des sédiments inférieure à 63 µm fluctue entre 16 et 65 % et représente en moyenne 39 % des sédiments de surface. Les éléments traces métalliques ont généralement une grande affinité pour les sédiments à granulométrie fine (CROUDACE et CUNDY, 1995). En effet, plus le pourcentage en particules fines est important, plus la capacité du sédiment à adsorber les contaminants est forte. ROMONT et DHAINAUT-COURTOIS (1997) confirment que les micropolluants tels que les ETM se fixent préférentiellement sur les particules fines et sont corrélés avec cette fraction.
Tableau 3
Données statistiques des caractéristiques physicochimiques et des teneurs en éléments traces métalliques (ETM) des sédiments (70 échantillons traités pour chaque paramètre) avec synthèse des bruits de fond géochimique dans le monde
Statistical data of the physicochemical characteristics and trace metals levels of sediments (70 samples processed for each parameter) with a synthesis of backgrounds levels in the world
La contamination en éléments traces métalliques a été évaluée dans les sédiments sur la fraction inférieure à 63 µm. Les résultats obtenus pour l’oued Boumerzoug et ses affluents, consignés dans le tableau 3 et la figure 2, révèlent l’ordre d’abondance suivant : Zn > Cu > Ni > Cd. Les variations spatio-temporelles des concentrations en ETM des sédiments (mg∙kg-1 [ms]) affichent une distribution dissymétrique des valeurs du cadmium, cuivre et zinc, avec une tendance vers les valeurs élevées. Les moyennes sont très influencées par les valeurs atypiques (suspectes et extrêmes) et 75 % des valeurs restent inférieures à 0,66 mg∙kg-1 (ms) pour Cd, à 52,73 mg∙kg-1 (ms) pour Cu et à 280,71 mg∙kg-1 (ms) pour Zn (3e quartile). Les concentrations en nickel oscillent de 22,46 mg∙kg-1 (ms) à 77,77 mg∙kg-1 (ms) avec 75 % de valeurs inférieures à 37,17 mg∙kg-1 (ms) (3e quartile). Pour cet élément, on constate peu de dispersion des teneurs, vu la similarité de la moyenne et la médiane. Ainsi, la moyenne peut être considérée comme peu influencée par les valeurs atypiques.
Figure 2
Variations spatio-temporelles des teneurs en Cd, Cu, Ni et Zn (masse sèche) dans les sédiments, et dans les racines et les feuilles de Spinacia oleracea de l'oued Boumerzoug et ses affluents
Spatial and temporal variations in Cd, Cu, Ni and Zn concentrations (dry weight) in the sediments and in the roots and leaves of Spinacia oleracea of the Boumerzoug wadi and its tributaries
Les teneurs en Cd traduisent une contamination des sédiments dans la mesure où elles dépassent les teneurs considérées comme naturelles (Tableau 3). Ces dernières varient de 0,3 mg∙kg-1 comme teneur naturelle moyenne mondiale (THOMAS et MEYBECK, 1992), 0,22 mg∙kg-1 pour les grands cours d’eau suisses (PARDOS et al., 2003), 0,25 mg∙kg-1 pour le bassin de la Seine (THEVENOT et al., 2007) et 0,31 mg∙kg-1 pour le bassin Saint-Laurent au Canada (SAULNIER et GAGNON, 2009). Malgré sa relative faible présence dans les écosystèmes aquatiques, le cadmium est un élément trace très toxique par effet cumulatif; il agit même à de faibles concentrations. Comparées à des valeurs dites de « références », nos données traduisent une situation normale selon l’AEAP (1990). En effet, 93 % des teneurs sont inférieures à la valeur estimée naturelle (1 ppm). Les stations affichant les teneurs plus élevées (Bm1, Bm2, Meh3, Bm7 en mai et Bm2 en septembre) sont affectées par les rejets domestiques et industriels des villes de Constantine et El Khroub. Selon la classification de l’AEAP (1990), les sédiments de l’oued Boumerzoug se classent d’une manière générale au niveau N1, traduisant une contamination absente ou faible, non susceptible à priori de nuisances. Selon la grille du système d’évaluation de la qualité des cours d’eau (SEQ-EAU, 2003), les sédiments de l’oued Boumerzoug peuvent être qualifiés de « bonne qualité ». Une telle conclusion peut être confirmée par comparaison de nos résultats au seuil d'effet probable (probable effect level [PEL]) du Cd = 3,53 mg∙kg-1, seuil au-delà duquel la concentration en Cd est susceptible de provoquer un effet toxique (SMITH et al., 1996; MACDONALD et al., 2000). Ainsi l’ensemble de nos résultats restent inférieurs à ce seuil. Cependant ce constat soulève la question inquiétante relative, d’une part, à l’effet cocktail des polluants présents simultanément et d’autre part à l’exposition chronique des organismes même à de faibles concentrations de micropolluants dans un écosystème aquatique, qui restent encore peu connus.
Globalement, les teneurs en cuivre reflètent une contamination évidente pour 26 % des échantillons analysés. La moyenne naturelle mondiale étant de l’ordre de 50 mg∙kg-1 (THOMAS et MEYBECK, 1992). PARDOS et al. (2003) proposent une concentration de l’ordre de 27,4 mg∙kg-1 comme bruit de fond pour les grands cours d’eau suisses, alors qu’il est de 15 mg∙kg-1 pour le bassin de la Seine (THEVENOT et al., 2007) et 20 mg∙kg-1 pour le bassin du fleuve Saint-Laurent au Canada (SAULNIER et GAGNON, 2009) (Tableau 3). La contamination est perceptible, induite par les différentes activités industrielles, urbaines et principalement aux rejets diffus non collectés qui gagnent les oueds. En effet, dans les eaux résiduaires urbaines, 60 % du Cu est d’origine domestique dont la source majeure est la corrosion des canalisations (SÖRME et LAGERKVIST, 2002) à laquelle s’ajoutent les eaux de lessivage des sols des berges cultivés et non cultivés. Les teneurs moyennes en Cu (43,61 mg∙kg-1) de l’oued Boumerzoug témoignent d’une situation anormale. En effet, toutes les valeurs sont supérieures à 15 mg∙kg-1, norme suggérée par l’AEAP (1990), conduisant néanmoins à classer les sédiments d’une manière générale au niveau N1, révélant une très faible contamination non susceptible d’entrainer des nuisances. De même, comparativement aux données de la grille du SEQ-EAU (2003), les sédiments de l’oued Boumerzoug seraient de qualité passable et le PEL Cu (197 mg∙kg-1) (SMITH et al., 1996; MACDONALD et al., 2000), n’a jamais été atteint. De ce fait, les sédiments de ce cours d’eau ne présentent apparemment pas de risque toxique pour les organismes aquatiques.
Les teneurs en nickel sont toutes inférieures à la moyenne naturelle mondiale (80 mg∙kg-1) rapportée par THOMAS et MEYBECK (1992). Par ailleurs, MEYBECK et al. (2003) et THEVENOT et al. (2007) suggèrent une concentration naturelle de 25 mg∙kg-1 pour les carbonates et 30 mg∙kg-1 pour les alumino-silicates, substrats prédominants dans le bassin versant Boumerzoug. En effet, 94 % des concentrations déterminées dépassent le seuil de 25 mg∙kg-1, spécifique aux substrats carbonatés. Par analogie, pour les grands cours d’eau suisses la teneur 30,8 mg∙kg-1 est proposée comme bruit de fond par PARDOS et al. (2003), alors qu’il n’est que 16 mg∙kg-1 pour le bassin de la Seine (THEVENOT et al., 2007) et 23 mg∙kg-1 pour le bassin du fleuve Saint-Laurent au Canada (SAULNIER et GAGNON, 2009) (Tableau 3). Le nickel dissous et sous forme particulaire s’introduit dans le milieu aquatique par l’intermédiaire d’effluents et de lixiviats ainsi que par dépôt à partir de l’atmosphère à la suite d’activités anthropiques. Les effluents industriels susceptibles de renfermer du nickel sont surtout au niveau des importantes entreprises nationales de production de matériels agricoles (ENPMA) et de production de machines-outils (ENPMO) qui se trouvent en amont de la confluence Hamimime-Boumerzoug. À ceux-ci s’ajoutent les différents effluents de diverses unités industrielles (NAFTAL, SNVI, unité de production de céramique sanitaire et dalles de sol, etc.) de la zone industrielle du même nom Boumerzoug, le long de l’oued au sud de Constantine. L’AEAP (1990) n’a pas défini de seuil pour le nickel, alors que l’application de la grille du SEQ-EAU (2003) permet de qualifier de « passable » la qualité des sédiments de l’oued Boumerzoug. Le PEL Ni (36 mg∙kg-1) suggéré par (SMITH et al., 1996; MACDONALD et al., 2000) nous amène à considérer que 30 % de nos prélèvements affichent des teneurs supérieures à ce seuil et sont ainsi susceptibles d’être toxiques pour les organismes aquatiques.
Le zinc présente des concentrations relativement élevées dans les sédiments par rapport aux autres éléments (Cd, Cu, Ni); il est naturellement plus fréquent dans la croûte terrestre. Les teneurs déterminées pour les sédiments de l’oued Boumerzoug reflètent une contamination évidente dans 37 % des cas, alors que la situation semble être normale pour 63 % des échantillons prélevés, si on les compare à la moyenne naturelle mondiale qui est de l’ordre de 240 mg∙kg-1 (THOMAS et MEYBECK, 1992) (Tableau 3). Plus récemment, les teneurs naturelles sont revues à la baisse (Tableau 3); elles sont de 86,3 mg∙kg-1 pour les grands cours d’eau suisses (PARDOS et al., 2003), et seulement 60 mg∙kg-1 à la fois pour le bassin de la Seine (THEVENOT et al., 2007) et pour le bassin du Saint-Laurent au Canada (SAULNIER et GAGNON, 2009). Les teneurs moyennes en Zn (181,33 mg∙kg-1) de l’oued Boumerzoug témoignent d’une situation anormale. En effet 40 % des valeurs sont supérieures à la norme 100 mg∙kg-1 AEAP (1990), il ne fait pas de doute que les fortes concentrations du zinc dans les sédiments analysés sont le résultat d'une pollution industrielle et urbaine. Cependant, ces teneurs ne dépassent jamais le seuil (N3), au-delà duquel les sédiments sont considérés contaminés selon les critères de l’AEAP, alors que la grille du SEQ-EAU (2003) permet de qualifier les sédiments de l’oued Boumerzoug de qualité passable. D’après BAIZE (2000), les teneurs élevées en zinc dans le sol peuvent être dues à des anomalies naturelles, entraînant quelques valeurs extrêmes. En effet, ces teneurs en zinc seraient beaucoup plus d’origine géochimique et liées à la fraction limoneuse du sol. La fraction argilo-limoneuse, de 40 % en moyenne, a atteint 65 % dans les sédiments de certaines stations, mais aucune corrélation entre ces deux paramètres n’a été établie. La toxicité du Zn dépend des conditions environnementales et de la nature des biotopes, de sorte que toute évaluation du risque relatif aux effets potentiels de cet élément sur les êtres vivants doit tenir compte de l’écologie locale (OMS, 2001). Les teneurs en Zn ont atteint un pic de 425 mg∙kg-1 (ms) et 86 % d’entre elles restent inférieures au PEL Zn (315 mg∙kg-1) (AEAP, 1990), seuil susceptible de provoquer un effet toxique sur le biote.
Les concentrations en ETM des plantes de S. oleracea (Tableau 4) prélevées dans les mêmes sites que les sédiments permettent de noter une fluctuation spatio-temporelle entre les racines et les feuilles. Ainsi, l’accumulation du Cd s’effectue dans un ordre décroissant en général des racines vers les feuilles (Figure 2). Les teneurs moyennes en Cd varient de 0,21 à 1,17 mg∙kg-1 (ms) dans les racines et de 0,10 à 1,11 mg∙kg-1 (ms) dans les feuilles, résultats deux fois supérieurs à ceux rapportés par KOUAKOU et al. (2008) pour qui les concentrations en Cd dans les feuilles de S. oleracea étaient de l’ordre de 0,12 à 0,41 mg∙kg-1 (ms). Le facteur de bioconcentration (FBC = 1,35) traduit la mobilité et par conséquent la biodisponibilité du Cd. Ce facteur traduit un transfert et une éventuelle concentration de ce polluant métallique du sédiment vers les racines et les feuilles de la plante. Le facteur de translocation (FT) est de l’ordre de 0,89, or, selon DENG et al. (2004) le FT supérieur à 1 signifie une translocation du métal depuis les racines vers les feuilles ce qui n’est pas constaté dans notre cas où le Cd est généralement davantage accumulé dans les racines. Élément non essentiel, le cadmium, très toxique, affecte la croissance et le métabolisme des plantes (DIVAN JUNIOR et al., 2009). Les plantes aquatiques ayant un système racinaire sont beaucoup plus affectées par les ETM contenus dans les sédiments, et par conséquent la bioaccumulation devient plus importante quand les sédiments sont très contaminés par des ETM (BONANNO et LO GUIDICE, 2010).
Tableau 4
Données statistiques des teneurs en éléments traces métalliques (ETM) dans les racines et les feuilles de Spinacia oleracea (70 échantillons traités pour chaque paramètre)
Statistical data of trace metal contents in the roots and leaves of Spinacia oleracea (70 samples processed for each parameter)
Le cuivre, élément essentiel pour la croissance des plantes, est un constituant de nombreuses enzymes des réactions d’oxydoréductions (KABATA-PENDIAS et PENDIAS, 1992). Cependant, il a des effets toxiques lorsque la concentration dépasse 20 mg∙kg-1 (ms) (ALLOWAY, 1995; BORKERT et al., 1998; REEVES, 2002), cas des racines et feuilles de nos échantillons. Nos résultats actuels atteignent des teneurs bien supérieures à celles communiquées par KOUAKOU et al. (2008) pour la même espèce, dont les feuilles renferment 0,34 à 9,18 mg∙kg-1 (ms) de Cu. La répartition du Cu dans les différentes parties de nos échantillons d’épinards est la suivante : racines (12,58-39,44 mg∙kg-1 [ms]) > feuilles (7,39-34,24 mg∙kg-1 [ms]). Ainsi, S. oleracea accumule davantage le cuivre dans ses racines; le facteur de bioconcentration est de l’ordre de 1,05. Ces résultats confortent ceux de SIEDLECKA et al. (2001) et AKSOY et al. (2005a, 2005b) qui concluent que le cuivre tend à s’accumuler au niveau des racines.
Le nickel, élément essentiel pour les plantes, est néanmoins toxique au-dessus de 5 mg∙kg-1 (ALLEN, 1989). À des concentrations élevées, il entraîne une réduction de croissance, une baisse du rendement et il perturbe le métabolisme et la physiologie des plantes (PAPAZOGLOU et al., 2007). La répartition du Ni dans les différentes parties de S. oleracea est : racines (1,37-13,96 mg∙kg-1 [ms]) > feuilles (0,53- 7,74 mg∙kg-1 [ms]). Ainsi, seule la concentration dans les racines peut être considérée comme dangereuse, or elles ne sont pas consommées. Le facteur de bioconcentration (FBC) de l’ordre de 0,11 traduit la faible mobilité et par conséquent la faible biodisponibilité du Ni car il y a presque dix fois plus de Ni dans les sédiments que dans la plante. Nos résultats restent inférieurs aux données rapportées par KOUAKOU et al. (2008) : 11,98 à 41,69 mg∙kg-1 (ms) en Ni dans les feuilles de S. oleracea.
Le zinc joue un rôle métabolique essentiel chez les plantes en tant que composant actif d’un grand nombre d’enzymes (KABATA-PENDIAS et MUKHERJEE, 2007). Chez la plupart des êtres vivants, sa concentration in vivo est régulée; cependant il devient toxique à des concentrations de 500-1 500 mg∙kg-1 (CHANEY, 1989). Contrairement au Cd, Cu et Ni, S. oleracea révèle des teneurs en Zn plus élevées dans les feuilles que dans les racines (Figure 2) selon la répartition : feuilles (140-366 mg∙kg-1 [ms]) et racines (93,39-330 mg∙kg-1 [ms]). Comme pour le Cu, ces résultats excèdent ceux déterminés par KOUAKOU et al. (2008) dans les feuilles de S. oleracea (225,56 à 299,33 mg∙kg-1 [ms]). Il est intéressant de noter que S. oleracea séquestre le Cd, Cu et Ni dans les racines, alors que le Zn est distribué d’une façon importante dans les feuilles. La teneur dans les plantes reflète la quantité disponible dans le sédiment ou sol. Le FBC proche de 1 suggère que la plante entière accumule le Zn et contrairement au Cd et au Ni, il montre une mobilité importante sur la base des quantités transférées dans les parties aériennes de S. oleracea. Le facteur de translocation (FT) du Zn des racines vers les feuilles, partie consommée de la plante, est supérieur à 1. Cette chénopodiacée se comporte comme les légumineuses qui, en général, montrent une translocation élevée du Zn vers la partie aérienne, raison pour laquelle elles sont proposées pour la « biofortification », processus d’amélioration des cultures (BLAIR, 2013; BLAIR et al., 2013).
Au terme de cette étude, il est important de savoir si les teneurs des métaux traces dans les feuilles d’épinards pourraient poser un risque pour la santé humaine. Malgré la toxicité reconnue des éléments traces, il n'existe pas en Algérie de dispositions réglementaires fixant les teneurs limites des ETM dans les fruits et légumes. Toutefois, le Conseil supérieur d’hygiène publique de France (CSHPF, 1996), l’Organisation des Nations Unies pour l'alimentation et l'agriculture et l'Organisation mondiale de la santé (FAO et OMS, 2000) et la Commission européenne (CE, 2001) ont recommandé des concentrations maximales en Cd dans les denrées alimentaires (Tableau 5). Pour Cu, Ni et Zn, nous nous sommes référés aux données compilées et publiées pour S. oleracea par KABATA-PENDIAS et PENDIAS (2001) et TREMEL-SCHAUB et FEIX (2005). Les feuilles d’épinards, très appréciées dans le régime alimentaire local, peuvent contribuer à un apport en cadmium si leur teneur est élevée; or nous constatons qu’elles atteignent cinq fois la concentration maximale recommandée par le CSHPF (1996) et la CE (2001) et jusqu’à 22 fois celle de FAO et OMS (2000) (Tableau 5). Les teneurs du Zn restent comprises dans la fourchette proposée par KABATA-PENDIAS et PENDIAS (2001), alors que celles du Cu et Ni restent inférieures à ces dernières. Le Cu et le Zn peuvent atteindre des teneurs qui excédent celles suggérées par TREMEL-SCHAUB et FEIX (2005). Ainsi, si les épinards sont récoltés sur des sites contaminés, le risque est surtout probable pour le cadmium, élément exclusivement toxique.
Tableau 5
Teneurs moyennes naturelles en éléments traces métalliques (ETM) des feuilles d’épinards : données de la littérature
Natural average trace metal contents of spinach leaves: data from the literature
Afin d'établir des relations entre les quatre ETM dans les racines et feuilles de S. oleracea, en relation avec le niveau de contamination des sédiments de l’oued Boumerzoug et ses affluents, une matrice de corrélation a été réalisée. Selon les coefficients de corrélation de Pearson présentés dans le tableau 6, une corrélation positive très hautement significative existe entre les éléments métalliques Zn, Cu et Ni, alors qu’une corrélation négative a été observée entre le Cu et le Cd des sédiments. Cette observation pourrait suggérer l’origine commune du Cu, Zn et Ni surtout industrielle et urbaine. Le Cd aurait, en plus des origines précitées, une origine agricole; les engrais superphosphates exploités et utilisés en Algérie sont très riches en Cd. Le lessivage diffus du bassin versant agricole drainé par l’oued Boumerzoug et ses affluents contribuerait à un enrichissement en cadmium des sédiments.
Une analyse en composantes principales (ACP) réalisée à partir des données effectuées sur une matrice de données constituée de 70 prélèvements (14 stations/5 campagnes) pour un total de 17 paramètres montre qu’il existe une large relation entre ces variables (Figure 3a). L’ACP résume 68,90 % de l’information totale (facteurs 1 et 2). La première composante F1 apporte 44,01 % de l’information et la deuxième F2, 24,89 % de l’inertie. Cette analyse révélerait que l’axe F1 exprimerait un phénomène de contamination dans le sens positif. Les paramètres contribuant de manière significative à sa formation sont respectivement : Cus (r = 0,9) > Zns (r = 0,61) et dans le sens négatif on trouve le Nis (r = -0,6) > Cds (r = -0,9). Cette forte corrélation reflèterait la source commune du Cu et Zn d’une part puis du Cd et Ni d’autre part, ainsi que leurs comportements similaires dans le sédiment. La matière organique est inversement proportionnelle au pH; en effet, l’oxydation de la matière organique mène vers une diminution du pH. Les teneurs métalliques de S. oleracea en Cd, Cu, Zn et Ni ne présentent aucune corrélation avec les paramètres physico-chimiques des sédiments (Tableau 6). En revanche, il existe des corrélations de ces métaux entre les différentes parties anatomiques de la plante (feuilles et racines). Nous avons constaté qu’il existe une corrélation très hautement significative (r = 0,51) entre le cadmium des feuilles et des racines (Cdf et Cdr) et hautement significative (r = 0,47) entre le cuivre des feuilles et des racines (Cuf et Cur). La projection des stations lors des cinq prélèvements (Figure 3b) montre une certaine similitude entre les stations. Celles qui s’opposent dans le sens positif et négatif de l’axe 2 sont les affluents oueds Fenteria et Mehiris respectivement formés par la contribution de calcaire total dans le sens positif et des teneurs en cadmium et zinc dans le sens négatif. Les points communs entre les stations liées aux conditions du milieu expliqueraient la présence de S. oleracea dans ces dernières.
Figure 3
Analyse en composantes principales (ACP) pour les paramètres des sédiments (s) et Spinacia oleracea (f : feuilles et r : racines) : a) projection des variables (CE : conductivité électrique; MO : matière organique; CT : calcaire total ) sur le plan F1-F2 et b) projection des stations et des prélèvements dans le plan principal de l’ACP
Principal Component Analysis (PCA) for sediment and Spinacia oleracea (leaves and roots) parameters: a) projection of variables on the F1-F2 plane and b) projections of stations and samples in the PCA plan
Tableau 6
Matrice de corrélation de Pearson des paramètres physico-chimiques des sédiments et des éléments traces métalliques (ETM) dans les sédiments et les racines et feuilles de Spinacia oleracea
Pearson correlation matrix of physicochemical parameters of sediments, and of trace metal concentrations in sediments, roots and leaves of Spinacia oleracea
a CE : conductivité électrique; MO : matière organique par la perte au feu; F : fraction des sédiments inférieure à 63 μm; CT : calcaire total; s : sédiments; f : feuilles; r : racines
b Degré de signification des corrélations : *: 0,05 ; **: 0,01 ; *** : 0,001
4. Conclusion
Les résultats de cette étude montrent que les teneurs du Cd, Cu, Ni et Zn révèlent un enrichissement métallique des sédiments de l’oued Boumerzoug et ses affluents, particulièrement par le zinc qui présente ainsi des concentrations relativement élevées dans les sédiments par rapport aux autres éléments, Cd, Cu et Ni qui révèlent néanmoins une contamination de ce compartiment. Ces teneurs peuvent être attribuées à un apport anthropique industriel et urbain auquel s’ajoutent les engrais superphosphates pour le Cd. La hiérarchie des teneurs métalliques des sédiments pour l’ensemble des stations et campagnes de prélèvement, s’établit comme suit : Zn > Cu > Ni > Cd. Le transfert des ETM étudié chez S. oleracea montre que les différentes parties anatomiques les accumulent différemment. Il est intéressant de noter que la chénopodiacée concentre et séquestre dans ses racines, le cadmium, le cuivre et le nickel. Ainsi, les racines semblent constituer une barrière qui réduit le transfert des éléments métalliques vers la partie aérienne, alors que le zinc, métal essentiel, est transloqué vers les feuilles. La hiérarchie des teneurs moyennes en ETM dans les épinards est similaire à celle des sédiments : Zn > Cu > Ni > Cd.
En une décennie, nous constatons une sensible diminution des teneurs moyennes des ETM à la suite du contrôle des effluents industriels et de la collecte et traitement des eaux usées urbaines, se traduisant par une amélioration de la qualité des sédiments. Néanmoins, il reste des efforts à consentir pour une meilleure collecte des eaux usées. La relative amélioration constatée ne nous permet pas de négliger le risque potentiel de la pollution engendrée par la croissance démographique, l’amplification des activités humaines et le développement industriel dans la zone industrielle longeant le cours d’eau. Il s’avère donc, nécessaire de cerner les teneurs en métaux dans les différentes espèces de la ripisylve de l'oued Boumerzoug et ses affluents. De même, la surveillance de la qualité des cultures exploitées sur les berges de l’oued Boumerzoug pourrait contribuer à comprendre les éventuels phénomènes de bioaccumulation et à appréhender les impacts sur la santé des consommateurs.
Parties annexes
Remerciements
Cette étude est réalisée dans le cadre des Projets de Recherche de Formation universitaire (PRFU), sous l’égide du Ministère de l’Enseignement supérieur et de la Recherche scientifique, de la Direction générale de la Recherche scientifique et technologique (DGRST) et de l’Agence Thématique de la Recherche en Sciences de la Nature et de la Vie (ATRSNV) algériens.
Références bibliographiques
- AFRI-MEHENNAOUI F.Z., L. SAHLI et S. MEHENNAOUI (2004). Assessments of sediment trace metal level and biological quality of Rhumel River by using multivariate analysis. Environmetrics, 15, 435-446.
- AFRI-MEHENNAOUI F.Z. (2006). Évaluation du niveau de contamination par les métaux lourds de différents compartiments d’un écosystème aquatique (eau, sédiment, faune macroinvertébrée, macrophyte) de l’oued Rhumel et son affluent le Boumerzoug en zone urbaine (Constantine). Thèse de doctorat, Univ. Mentouri de Constantine, Algérie, 267 p.
- AFRI-MEHENNAOUI F.Z., L. SAHLI et S. MEHENNAOUI (2009a). Évaluation de la contamination par le cadmium, le plomb et le zinc de l’eau, des sédiments de l’oued Rhumel et son affluent le Boumerzoug et leur transport vers une plante semi-aquatique : Rorippa Nastrutium-aquaticum (L.). Sci. Tech. C, 29, 45-55.
- AFRI-MEHENNAOUI F.Z., L. SAHLI, N. ZERIREF et S. MEHENNAOUI (2009b). Niveau de contamination par les éléments traces métalliques (ETM), des sédiments des oueds Rhumel et Sakiet Roum, dans la zone industrielle du complexe de l'Entreprise nationale de matériaux de travaux publics (ENMTP) et à Constantine (Algérie). Actes du Colloque International « Environnement et transports dans des contextes différents », 16-18 février 2009, Ghardaïa, Algérie, pp. 181-187.
- AGENCE DU BASSIN HYDROHRAPHIQUE (ABH) (2004). Le Bassin du Kébir-Rhumel. Les cahiers de l’agence No 2. ABH Constantinois-Seybouse-Mellegue, Ministère des Ressources en Eau, Algérie, 44 p.
- AGENCE DE L’EAU ARTOIS PICARDIE (AEAP) (1990). Annuaire de la qualité des sédiments du Bassin Artois Picardie (1985-1990). AEAP, France.
- AKSOY A., D. DEMIREZEN et F. DUMAN (2005a). Bioaccumulation detection and analyses of heavy metal pollution in Sultan Marsh and its environment. Water Air Soil Pollut., 164, 241-255.
- AKSOY A., F. DUMAN et G. SEZEN (2005b). Heavy metal accumulation and distribution in Narrow-Leaved Cattail (Typha angustifolia) and commonreed (Phragmites australis). J. Freshwater Ecol., 20, 783-785.
- ALLEN S.E. (1989). Chemical analysis of ecological material. 2e édition, Blackwell Scientific Publications, London, Royaume-Uni, 368 p.
- ALLOWAY B.J. (1995). The mobilisation of trace elements in soils. Dans : Contaminated Soils. Third International Conference on the Biogeochemistrry of Trace Elements, 15-19 mai 1995. PROST R. (éd.), Institut national de la recherche agronomique, Paris, France, pp. 133-145.
- ASSOCIATION FRANÇAISE DE NORMALISATION (AFNOR) (1953). Essais des eaux. Mesure électrochimique du pH avec l’électrode de verre. Norme AFNOR NF T90-008, avril 1953, France.
- ASSOCIATION FRANÇAISE DE NORMALISATION (1995). Qualité du sol. Détermination de la teneur en carbonate. Méthode volumétrique. Norme AFNOR NF ISO 10693, juin 1995, France.
- ASSOCIATION FRANÇAISE DE NORMALISATION (1995). Qualité du sol. Extraction des éléments en traces solubles dans l’eau régalé. Norme AFNOR NF ISO 11466, juin 1995, France.
- ASSOCIATION FRANÇAISE DE NORMALISATION (1998). Sols : reconnaissance et essais. Détermination de la teneur pondérale en matières organiques d'un matériau. Méthode par calcination. Norme AFNOR XP P 94-047, décembre 1998, France.
- BAIZE D. (2000). Teneurs totales en « métaux lourds » dans les sols français. Résultats généraux du programme Aspitet. Courrier de l’environnement de l’INRA, 39, 39-54.
- BALDANTONI D., A. BELLINO, G. LOFRANO, G. LIBRALATO, L. PUCCI et M. CAROTENUTO (2018). Biomonitoring of nutrient and toxic element concentrations in the Sarno River through aquatic plants. Ecotoxicol. Environ. Saf., 148, 520-527.
- BARHOUMI B., M.S. BELDEAN-GALEA, A.M. AL-RAWABDEH, C. ROBA, I.M. MARTONOS, R. BĂLC et C. BACIU (2019). Occurrence, distribution and ecological risk of trace metals and organic pollutants in surface sediments from a Southeastern European river (Someşu Mic River, Romania). Sci. Total Environ., 660, 660-676.
- BISONE S. (2012). Décontamination de sols contaminés par du cuivre du zinc et des HAP provenant de déchets métallurgiques. Thèse de doctorat, Institut national de la recherche scientifique, Univ. du Québec, Canada, 254 p.
- BLAIR M.W. (2013). Mineral biofortification strategies for food staples: The example of common bean. J. Agric. Food Chem., 61, 8287-8294.
- BLAIR M.W., P. IZQUIERDO, C. ASTUDILLO et M.A. GRUSAK (2013). A legume biofortification quandary: variability and genetic control of seed coat micronutrient accumulation in common beans. Front. Plant Sci. DOI: 10.3389/fpls.2013.00275
- BONANNO G. et R. LO GIUDICE (2010). Heavy metal bioaccumulation by the organs of Phragmites australis (common reed) and their potential use as contamination indicators. Ecol. Indic., 10, 639-645.
- BORKERT C.M., F.R. COX et M.R. TUCKER (1998). Zinc and copper toxicity in peanut soybean rice and corn in soil mixtures. Commun. Soil Sci. Plant Anal., 29, 2991-3005.
- BOYSAN CANAL S., M.A. BOZKURT et S. KIPÇAK (2018). The effects of organic amendments on cadmium uptake of spinach (Spinacia oleracea L.) and plant growth under cadmium toxicity. Fresenius Environ. Bull., 27, 3174-3179.
- CASIERRA POSADA F., C. ULRICHS et C. PÉREZ (2012). Growth of spinach plants (Spinacia oleracea L.) exposed to excess zinc and manganese. Agron. Colomb., 30, 344-345.
- CHANG C.Y., H.Y. YU, J.J. CHEN, F.B. LI, H.H. ZHANG et C.P. LIU (2014). Accumulation of heavy metals in leaf vegetables from agricultural soils and associated potential health risks in the Pearl River Delta, South China. Environ. Monit. Assess., 168, 1547-1560.
- CHANEY R.L. (1989). Toxic element accumulation in soils and crops: protecting soil fertility and agricultural food chains. Dans : Inorganic contaminants in the vadose zone. BAR-YOSEF B., N.J. BARROW et J. GOLDSHMID (éd.) Springer-Verlag, Berlin, Allemagne, pp.141-158.
- COMMISSION EUROPÉENNE (CE) (2001). Règlement No 466/2001 de la commission du 08 mars 2001 portant fixation de teneurs maximales pour certains contaminants dans les denrées alimentaires. JO L 77 du 16 mars 2001, 26 p.
- CONSEIL SUPÉRIEUR D’HYGIÈNE PUBLIQUE DE FRANCE (CSHPF) (1996). Plomb, cadmium et mercure dans l’alimentation : évaluation et gestion du risque. Tec et Doc Lavoisier, France, 237 p.
- CROUDACE I.W. et A.B. CUNDY (1995). Heavy metal and hydrocarbon pollution in recent sediments from Southampton water, southern England: a geochemical and isotopic study. Environ. Sci. Technol., 29, 1288-1296.
- DENG H., Z.H. YE et M.H. WONG (2004). Accumulation of lead, zinc, copper and cadmium by 12 wetland plant species thriving in metal-contaminated sites in China. Environ. Pollut., 132, 29-40.
- DIOP C. (2014). Étude de la contamination, de la spéciation et de la biodisponibilité des éléments traces métalliques dans les eaux et sédiments côtiers et estuariens au Sénégal : Évaluation de la toxicité potentielle. Thèse de doctorat, Univ. Lille, France, 199 p.
- DIVAN JUNIOR A.M., P.L. DE OLIVEIRA, C.T. PERRY, V.L. ATZ, L.N. AZZARINI ROSTIROLA et M.T. RAYA RODRIGUEZ (2009). Using wild plant species as indicators for the accumulation of emissions from a thermal power plant Candiota South Brazil. Ecol. Indic., 9, 1156-1162.
- DJEDDI H., S. KHERIEF NACEREDDINE, D. KEDDARI et F.Z. AFRI MEHENNAOUI (2018). Teneurs des éléments traces métalliques Cu, Zn et Pb des sédiments du barrage Béni Haroun (Nord-Est de l’Algérie). Eur. Sci. J., 15, 1857-7431.
- EGGLETON J. et K.V. THOMAS (2004). A review of factors affecting the release and bioavailability of contaminants during sediment disturbance events. Environ. Int., 30, 973-980.
- GHOSH A. et N. MANCHANDA (2019). Phytoremediation of heavy metals from water of Yamuna River by Tagetes patula, Bassica scoparia, Portulaca grandiflora. Asian Plant Res. J., 2, 1-14.
- HU C., X. YANG, L. GAO, P. ZHANG, W. LI, J. DONG, C. LI et X. ZHANG (2019). Comparative analysis of heavy metal accumulation and bioindication in three seagrasses: Which species is more suitable as a bioindicator? Sci. Total Environ., 669, 41-48.
- KABATA-PENDIAS A. et H. PENDIAS (1992). Traces elements in soil and plants. 2e édition, CRC Press, Boca Raton (FL), États-Unis, 365 p.
- KABATA-PENDIAS A. et H. PENDIAS (2001). Trace elements in soils and plants. 3e édition, CRC Press, Boca Raton (FL), États-Unis, 413 p.
- KABATA-PENDIAS A. et A.B. MUKHERJEE (2007). Trace elements from soil to human. Springer-Verlag, Berlin, Allemagne, 550 p.
- KASHIMBO KALALA S., L. LUKENS, E. MBIKAYI, P. KAZADI KANYAMA et M. NGOY SHUTCHA (2015). Intoxication alimentaire aux éléments traces métalliques (ETM) de trois espèces maraichères cultivées sur le sol du bord de la rivière Lubumbashi (Lubumbashi-Katanga/RD Congo). Int. J. Innov. Sci. Res., 15, 102-112.
- KHAN M.U., R.N. MALIK et S. MUHAMMAD (2013). Human risk from heavy metal via food crops consumption with wastewater irrigation practices in Pakistan. Chemoshere, 93, 2230-2238.
- KHEMIS I.B., N.B. ARIDH, N. HAMZA, M. M'HETLI et S. SADOK (2017). Heavy metals and minerals contents in pikeperch (Sander lucioperca), carp (Cyprinus carpio) and flathead grey mullet (Mugil cephalus) from Sidi Salem reservoir (Tunisia): health risk assessment related to fish consumption. Environ. Sci. Pollut. Res., 24, 19494-19507.
- KHERIEF NACEREDDINE S., H. DJEDDI, N.Y. BENAYACHE et F.Z. AFRI-MEHENNAOUI (2018). Dynamique des éléments nutritifs et du phytoplancton dans le Barrage Béni-Haroun dans l’est algérien. Eur. Sci. J., 12, 1857-7431.
- KOUAKOU K.J., Y.A. BEKRO, A.E. SIKA, D. BAIZE, D.O. DOGBO, M. BOUNAKHLA, F. ZARHY et P. MACAIGNE (2008). Diagnostic d'une contamination par les éléments traces métalliques de l'épinard (Spinacia oleracea) cultivé sur des sols maraîchers de la ville D’abidjan (Côte d’Ivoire) amendés avec de la fiente de volaille. Eur. J. Sci. Res., 21, 471-487.
- KUMAR V., A. CHOPRA et S. SRIVASTAVA (2016). Assessment of heavy metals in spinach (Spinacia oleracea L.) grown in sewage sludge-amended soil. Commun. Soil Sci. Plant. Anal., 47, 2-16.
- LARROSE A., A. COYNEL, J. SCHÄFER, G. BLANC, L. MASSE et E. MANEUX (2010). Assessing the current state of the Gironde Estuary by mapping priority contaminant distribution and risk potential in surface sediment. Appl. Geochem., 25, 1912-1923.
- MACDONALD D.D., C.G. INGERSOLL et T.A. BERGER (2000). Development and evaluation of consensus based sediment quality guidelines for freshwater ecosystems. Arch. Environ. Con. Tox., 39, 20-31.
- MAHAR A., P. WANG, A. ALI, M.K. AWASTHI, A.H. LAHORI, Q. WANG, R. LI et Z. ZHANG (2016). Challenges and opportunities in the phytoremediation of heavy metals contaminated soils: A review. Ecotoxicol. Environ. Saf., 126, 111-121.
- MEDEIROS R.J., L.M.G. DOS SANTOS, A.S. FREIRE, R.E. SANTELLI, A.M.C. BRAGA, T.M. KRAUSS et S.D.C. JACOB (2012). Determination of inorganic trace elements in edible marine fish from Rio de Janeiro State, Brazil. Food Control, 23, 535-541.
- MELGHIT M., F.Z. AFRI-MEHENNAOUI et L. SAHLI (2015). Impact of wastewaters on the physico-chemical quality of waters: Case study of the Rhumel River, Hammam Grouz and Beni Haroun dams. J. Environ. Sci. Eng. B, 4, 625-630.
- MEYBECK M. et G. BERTRU (1998). Man and river interface: multiple impacts on water and particulates chemistry illustrated by the river Seine basin. Hydrobiologia, 373-374, 1-20.
- MEYBECK M., Y. GUEGUEN, H. DÜRR, C. GROSBOIS, L. LACHARTRE, N. BACQ, S. THERY et A. HOROWITZ (2003). Vers un système expert pour réaliser le bilan de la contamination métallique du réseau hydrographique. Piren Seine : Rapport d’activité 2002, Axe thématique 4 : mécanismes des émissions et transferts de micropolluants, France, 32 p.
- MUGIVHISA L.L. et J.O. OLOWOYO (2017). Accumulation pattern of trace metals in Spinacia oleracea harvested from soil treated with urine in comparison with other soil amendments in Pretoria, South Africa. Int. J. Recycl. Org. Waste Agric., 6, 133-141.
- NAZ A., S. KHAN, M. QASIM, S. KHALID, S. MUHAMMAD et S. TARIQ (2013). Metal toxicity and its bioaccumulation in purslane seedlings grow in controlled environment. Nat. Sci., 5, 573-579.
- NAZ A., S. KHAN, S. MUHAMMAD, S. KHALID, S. ALAM, S. SIDDIQUE, T. AHMED et M. SCHOLZ (2015). Toxicity and bioaccumulation of heavy metals in spinach (Spinacia oleracea) grown in a controlled environment. Int. J. Environ. Res. Public Health, 12, 7400-7416.
- ORGANISATION DES NATIONS UNIES POUR L'ALIMENTATION ET L'AGRICULTURE (FAO) et ORGANISATION MONDIALE DE LA SANTÉ (OMS) (2000). Report on the 32nd session of the Codex Committee on food additives and contaminants. 20-24 mars 2000, Beijing, Chine, FAO et OMS, 72 p.
- ORGANISATION MONDIALE DE LA SANTÉ (OMS) (2001). Environmental health criteria 221. Zinc. OMS, Genève, Suisse, 146 p.
- PANDIT T.K., S.K. NAIK, P.K. PATRA et D.K. DAS (2017). Influence of organic manure and lime on cadmium mobility in soil and uptake by spinach (Spinacia oleracea L.). Commun. Soil Sci. Plant Anal., 21, 419-433.
- PAPAZOGLOU E.G., K.G. SERELIS et D.L. BOURANIS (2007). Impact of high cadmium and nickel soil concentration on selected physiological parameters of Arundo donax L. Eur. J. Soil Biol., 43, 207-215.
- PARDOS M., J. DOMINIK et J.P. HOURIET (2003). Micropolluants dans les sédiments. Métaux et micropolluants organiques dans les matières en suspension et sédiments superficiels des grands cours d’eau suisses. Cahiers de l’environnement, Office Fédéral de l’Environnement, des Forêts et du Paysage, Berne, Suisse, 58 p.
- PERKIN-ELMER (1996). Analytical methods for atomic absorption spectroscopy. The Perkin-Elmer Corporation, Philadelphie (PA), États-Unis, 310 p.
- POLECHOŃSKA L., A. KLINK, M. DAMBIEC et A. RUDECKI (2018). Evaluation of Ceratophyllum demersum as the accumulative bioindicateur for trace metals. Ecol. Indic., 93, 274-281.
- PRADHAN J.K. et S. KUMAR (2014). Informal e-waste recycling: environmental risk assessment of heavy metal contamination in Mandoli industrial area, Delhi, India. Environ. Sci. Pollut. Res., 21, 7913-7928.
- REEVES R.D. (2002). Metal tolerance and metal accumulating plant exploration and exploitation. 9th New Phytologist Symposium, Heavy metals and plants - from ecosystems to biomolecules, septembre-octobre 2002, Philadelphia (PA), États-Unis, pp. 193-229.
- RODIER J., B. LEGUBE, N. MERLET et R. BRUNET (2009). L’analyse de l’eau. Eaux naturelles, eaux résiduaires, eaux de mer. 9e édition, Dunod, Paris, France, 1529 p.
- ROMONT R. et N. DHAINAUT-COURTOIS (1997). Indicateurs écologiques et bioaccumulateurs en milieu marin : Invertébrés benthiques des zones estuariennes et portuaires de la région Nord/Pas-de-Calais. Dans : Contaminated soils. 3rd International conference on the biogeochemistry of trace elements, PROST R. (éd.), Institut national de la recherche agronomique (INRA), Paris, France, 525 p.
- SAHER N.U. et A.S. SIDDIQUI (2016). Comparison of heavy metal contamination during the last decade along the coastal sediment of Pakistan: multiple pollution indices approach. Mar. Pollut. Bull., 105, 403-410.
- SAHLI L., F.Z. AFRI-MEHENNAOUI, M. EL HADEF EL OKKI, C. BLAISE et S. MEHENNAOUI (2011). Spatial and seasonal variations and ecotoxicological significance of sediment trace metal concentrations in Kebir-Rhumel basin (Northeast of Algeria). Water Sci. Technol., 64, 1759-1766.
- SAHLI L., F.Z. AFRI-MEHENNAOUI, M. EL HADEF EL OKKI, J.F FERARD et S. MEHENNAOUI (2012). Assessment of sediment quality and pore water ecotoxicity in Kebir Rhumel basin (NE-Algeria): a combined approach. Water Sci. Technol., 65, 393-401.
- SAHLI L., M. EL HADEF EL OKKI et F.Z. AFRI-MEHENNAOUI (2014). Utilisation d’indices pour l’évaluation de la qualité des sédiments: cas du bassin Boumerzoug (Algérie). Eur. Sci. J., 35, 333-343.
- SAMECKA CYMERMAN A. et A.J. KEMPERS (2001). Bioindication of heavy metals with aquatic macrophytes: the case of a stream polluted with power plant sewages in Poland. J. Toxicol. Environ. Health, 62, 57-67.
- SAULNIER I. et C. GAGNON (2009). Background levels of metals in St. Lawrence River sediments: Implications for sediment quality criteria and environmental management. Integr. Environ. Assess. Manag., 2, 126-141.
- SYSTÈME D'ÉVALUATION DE LA QUALITÉ DE L'EAU (SEQ-EAU) (2003). Grilles d’évaluation SEQ-Eau. Version 2. Ministère de l'Écologie et du Développement Durable, Agences de l’eau, Paris, France, 40 p.
- SIEDLECKA A., A. TUKENDORF, E. SKÓRZYŃSKA-POLIT, W. MAKSYMIEC, M. WÓJCIK, T. BASZYŃSKI et Z. KRUPA (2001). Angiosperms (Asteraceae Convolvulaceae Fabaceae and Poaceae; other than Brassicaceae). Dans : Metals in the Environment. Analysis by biodiversity. PRASAD M.N.V. (éd.), CRC Press, Taylor & Francis Group, New York (NY), États-Unis, Chap. 7, pp. 171-217.
- SINGH J., K. SINGH RAWAT et A. KUMAR (2013). Mobility of cadmium in sewage sludge applied soil and its uptake by radish (Raphanus sativus L.) and spinach (Spinacia oleracea). Int. J. Agric. Food Sci. Technol., 4, 291-296.
- SMITH S.L., D.D MACDONALD, K.A. KEENLEYSIDE, C.G INGERSOLL et J. FIELD (1996). A preliminary evaluation of sediment quality assessment values for freshwater ecosystems. J. Great Lakes Res., 22, 624-638.
- SONG Y. et M. MÜLLER (1999). Sediment-water interactions in anoxic freshwater sediments. Mobility of heavy metals and nutrients. Springer, Berlin, Allemagne, 111 p.
- SÖRME L. et R. LAGERKVIST (2002). Sources of heavy metals in urban wastewater in Stockholm. Sci. Total Environ., 298, 131-145.
- STONE M. et I.G. DROPPO (1996). Distribution of lead, copper and zinc in size-fractionated riverbed sediment in two agricultural catchment of southern Ontario, Canada. Environ. Pollut., 93, 353-362.
- TANDI N.K., J. NYAMANGARA et C. BANGIRA (2004). Environmental and potential health effects of growing leafy vegetables on soil irrigated using sewage sludge and effluent: A case of Zn and Cu. J. Environ. Sci. Health, 39, 461-471.
- TESSIER A., P.G.C. CAMPBELL et M. BISSON (1982). Particulate trace metal speciation in stream sediments and relationships with grain size: Implications for geochemical exploration. J. Geochem. Explor., 16, 77-104.
- THEVENOT D.R., R. MOILLERON, L. LESTEL, M.C. GROMAIRE, V. ROCHER, P. CAMBIER, P. BONTE, J.L. COLIN, C. DE PONTEVES et M. MEYBECK (2007). Critical budget of metal sources and pathways in the Seine River basin (1994-2003) for Cd, Cr, Cu, Hg, Ni, Pb and Zn. Sci. Total Environ., 375, 180-203.
- THOMAS R. et M. MEYBECK (1992). The use of particulate material. Dans : Water quality assessments. A guide to the use of biota sediments and water in environmental monitoring. CHAPMAN D. (éd.), UNESCO, World Health Organisation, United Nations Environment Programme, E & FN Spon, London/New York, Chap. 4, pp. 127-174.
- TÓTH T., M. KOPERNICKÁ, R. STANOVIČ, J. MUSILOVÁ, D. BAJČAN, M. SLÁVIK, L. HARANGOZO et S. ZUPKA (2014). Content of mercury and lead in leaves of spinach (Spinacia oleracea, L.). J. Microbiol. Biotechnol. Food Sci., 3, 298-299.
- TOURE N., K.P. KOUADIO, K.E. YOBOUE et A. YAO KOUAME (2015). Évaluation des métaux traces, pesticides et plastifiants dans les produits maraichers (gombo, corète potagère, épinard et aubergine) dans la vallée du Nieki, Sud-Est de la Cote d’Ivoire. Eur. Sci. J., 11, 183- 196.
- TŐZSÉR D., B. TÓTHMÉRÉSZ, S. HARANGI, E. BARANYAI, G. LAKATOS, Z. FÜLÖP et E. SIMON (2019). Remediation potential of early successional pioneer species Chenopodium album and Tripleurospermum inodorum. Nat. Conserv., 36, 47-69.
- TREMEL-SCHAUB A. et I. FEIX (2005). Contamination des sols : Transferts des sols vers les plantes. Agence de l'Environnement et de la Maîtrise de l'Énergie (ADEME), EDP Sciences, France, 416 p.
- WANG J. et C. CHEN (2006). Biosorption of heavy metals by Saccharomyces cerevisiae: a review. Biotechnol. Adv., 24, 427-451.
- WU H., X. ZHANG, Q. WANG, L. LI, C. JI, X. LIU et X. YIN (2013a). A metabolomic investigation on arsenic-induced toxicological effects in the clam Ruditapes philippinarum under different salinities. Ecotox. Environ. Safe., 90, 1-6.
- WU H., X. LIU, X. ZHANG, C. JI, J. ZHAO et J. YU (2013b). Proteomic and metabolomic responses of clam Ruditapes philippinarum to arsenic exposure under different salinities. Aqua. Toxicol., 136, 91-100.
- YI Y., Z. YANG et S. ZHANG (2011). Ecological risk assessment of heavy metals in sediment and human health risk assessment of heavy metals in fishes in the middle and lower reaches of the Yangtze River basin. Environ. Pollut., 159, 2575-2585.
- ZURAYK R., B. SUKKARIYAH et R. BAALBAKI (2001). Common hydrophytes as bioindicators of nickel, chromium and cadmium pollution. Water Air Soil Pollut., 127, 373-388.
Liste des figures
Figure 1
Site d’étude et localisation des stations de prélèvement dans le sous-bassin Boumerzoug
Study site and location of sampling stations in the Boumerzoug sub-basin
Figure 2
Variations spatio-temporelles des teneurs en Cd, Cu, Ni et Zn (masse sèche) dans les sédiments, et dans les racines et les feuilles de Spinacia oleracea de l'oued Boumerzoug et ses affluents
Spatial and temporal variations in Cd, Cu, Ni and Zn concentrations (dry weight) in the sediments and in the roots and leaves of Spinacia oleracea of the Boumerzoug wadi and its tributaries
Figure 3
Analyse en composantes principales (ACP) pour les paramètres des sédiments (s) et Spinacia oleracea (f : feuilles et r : racines) : a) projection des variables (CE : conductivité électrique; MO : matière organique; CT : calcaire total ) sur le plan F1-F2 et b) projection des stations et des prélèvements dans le plan principal de l’ACP
Principal Component Analysis (PCA) for sediment and Spinacia oleracea (leaves and roots) parameters: a) projection of variables on the F1-F2 plane and b) projections of stations and samples in the PCA plan
Liste des tableaux
Tableau 1
Coordonnées géographiques des 14 stations de prélèvement de l’oued Boumerzoug et ses affluents
Geographical coordinates of the 14 sampling stations of the Boumerzoug wadi and its tributaries
Tableau 2
Teneurs des éléments traces métalliques (ETM) des échantillons de sédiment (LKSD-1) et de végétation (GBW 07604) de référence
Trace metals levels of reference sediment (LKSD-1) and vegetation (GBW 07604) samples
Tableau 3
Données statistiques des caractéristiques physicochimiques et des teneurs en éléments traces métalliques (ETM) des sédiments (70 échantillons traités pour chaque paramètre) avec synthèse des bruits de fond géochimique dans le monde
Statistical data of the physicochemical characteristics and trace metals levels of sediments (70 samples processed for each parameter) with a synthesis of backgrounds levels in the world
Tableau 4
Données statistiques des teneurs en éléments traces métalliques (ETM) dans les racines et les feuilles de Spinacia oleracea (70 échantillons traités pour chaque paramètre)
Statistical data of trace metal contents in the roots and leaves of Spinacia oleracea (70 samples processed for each parameter)
Tableau 5
Teneurs moyennes naturelles en éléments traces métalliques (ETM) des feuilles d’épinards : données de la littérature
Natural average trace metal contents of spinach leaves: data from the literature
Tableau 6
Matrice de corrélation de Pearson des paramètres physico-chimiques des sédiments et des éléments traces métalliques (ETM) dans les sédiments et les racines et feuilles de Spinacia oleracea
Pearson correlation matrix of physicochemical parameters of sediments, and of trace metal concentrations in sediments, roots and leaves of Spinacia oleracea