Résumés
Résumé
L’approvisionnement en eau potable de la ville de Casablanca, capitale économique et industrielle du Maroc, est assuré en grande partie par les eaux du réservoir de stockage Tit Mellil alimenté par les eaux traitées provenant de la retenue de barrage Sidi Mohammed Ben Abdellah (SMBA). Or, les eaux brutes du barrage sont souvent affectées par le phénomène d’eutrophisation qui se manifeste par la prolifération des cyanobactéries qui exercent un impact négatif sur la filière de production d’eau potable. En effet, les analyses physico-chimiques, effectuées sur les eaux brutes et traitées, ont permis de faire un diagnostic. Ce dernier a montré que les caractéristiques des eaux brutes favorisent la prolifération de cyanobactéries. Plusieurs genres toxiques ont été identifiés avec Microcystis et Oscillatoria qui sont producteurs de microcystines. L’évaluation des microcystines dans les eaux brutes et traitées a été réalisée par le test colorimétrique d’inhibition de la protéine phosphatase type 2A (PP2A), sur des extraits préconcentrés des fractions dissoutes et des fractions cellulaires avec un seuil de détection de 1 ng•L-1. Les résultats montrent que les microcystines sont présentes dans tous les échantillons d’eaux traitées, prélevés à l’entrée du réservoir de stockage, pendant la période été-automne de 2006 à 2008. Leurs taux en microcystines dissoutes n’excèdent pas 0,075 µg équivalents MC-LR•L-1. Ces valeurs, bien que positives, sont très inférieures au seuil recommandé par l’Organisation Mondiale de Santé, qui est de 1 µg équivalent MC-LR•L-1 d’eau et sont nettement inférieures à celles des eaux brutes, pour la même période, dont les valeurs ont atteint 1,1 µg équivalent MC-LR•L-1 en octobre 2006. Par ailleurs, une évaluation des concentrations en MC dissoute, à la sortie du réservoir de stockage d’eau potable vers le consommateur, a révélé une nette diminution des teneurs, liée probablement aux effets de la chloration appliquée à ces eaux.
Mots-clés :
- eau potable,
- cyanobactéries,
- microcystines,
- protéine phosphatase 2A,
- chloration
Abstract
The supply of Casablanca city with drinking water is insured mainly by waters from the storage reservoir Tit Mellil, which is fed by the treated waters coming from the Sidi Mohamed Ben Abdellah dam. These waters are often affected by eutrophisation, with the attendant proliferation of cyanobacteria, which exercise a negative impact of the production of drinking water. In fact, the physico-chemical analyses carried out on both raw and treated waters have allowed us to make a diagnosis. This diagnosis reveals that the characteristics of the raw waters favour the proliferation of cyanobacteria. Many types of the cyanobacteria are identified, including Microcystis and Oscillatoria, which are considered to be the most toxic as well as the producers of microcystins (MC). We used a colorimetric protein phosphatase inhibition assay for an evaluation of dissolved and intracellular microcystin levels in raw and treated water with a detection limit of 1 ng•L-1. Tests done on treated water at the entrance of the storage reservoir reveal that dissolved MC are present in all the samples taken during the summer-autumn periods from 2006 to 2008. Their rates do not exceed 0.075 µg equivalent to MC-LR•L-1. Though these values are positive, they are below the threshold recommended by the World Health Organisation, which is 1 µg equivalent to MC-LR•L-1 of water. The amounts of microcystins in the treated waters are clearly less than those in the raw waters for the same periods. These values reached a maximum of 1.1 µg equivalent to MC-LR•L-1 in October 2006. On the other hand, an evaluation of the amounts of dissolved microcystins at the exit of the treated water from the storage reservoir revealed a clear decrease of microcystins concentration; this is probably due to the effects of the chlorination that had been applied to these waters.
Keywords:
- drinking water,
- cyanobacteria,
- microcystins,
- protein phosphatases 2A,
- chlorination
Corps de l’article
1. Introduction
Ces dernières décennies ont vu naître la prise de conscience, par la communauté internationale et par le Maroc en particulier, de l’importance de la gestion durable des ressources en eau. L’importance de cette eau a émergé devant le constat que de nombreux pays souffrent actuellement de pénurie. L’origine de cette pénurie planétaire vient du fait de la dégradation de la qualité de l’eau douce, due à plusieurs facteurs, dont le phénomène d’eutrophisation (HEISLER et al., 2008; SKULBERG et al., 1993). Parmi les principaux symptômes indésirables de cette eutrophisation, on trouve la prolifération massive de phytoplancton dont au moins 46 espèces de cyanobactéries potentiellement toxiques (ERNST et al., 2005). Ces dernières posent d’énormes problèmes au niveau de la production de l’eau potable et exposent l’être humain à plusieurs dangers, par la consommation et l’utilisation de cette eau, si les procédés de traitement ne les éliminent pas efficacement.
Les cyanotoxines attirent de plus en plus l’attention des chercheurs et les cas de contamination, à travers le monde, sont nombreux et diversifiés (CARMICHAEL, 1992, CODD, 2000). Leurs effets sont bien connus, elles peuvent causer une simple irritation de la peau (endotoxines lipopolysaccharidiques [LPS]), comme elles peuvent affecter le système nerveux (neurotoxines, p. ex. anatoxine) et entraîner aussi des lésions du foie (hépatotoxines) (POURIA et al., 1998). Parmi les hépatotoxines figurent les microcystines (MC) qui sont les cyanotoxines les plus étudiées, les mieux connues et les plus fréquemment détectées dans les eaux (DE FIGUEIREDO et al., 2004; ERNST et al., 2009; FRISTACHI et SINCLAIR, 2008; ZHANG et ZHU 2009).
Sur le plan structural, les MC sont des heptapeptides cycliques qui contiennent deux acides aminés, de la série L, variables et deux acides aminés spécifiques de la série D (CARMICHAEL, 1992). Ce sont ces derniers qui attribuent à la MC ses propriétés toxiques (CARMICHAEL, 1994; DAWSON, 1998; TSUJI, 1997). Les microcystines sont nommées en fonction de leurs acides aminés de la série L. En effet, la microcystine-LR (MC-LR) contient de la leucine (L) et de l’arginine (R), tandis que la microcystine-YA (MC-YR) contient de la tyrosine (Y) et de l’alanine (A) (CARMICHAEL, 1992) et, jusqu’à présent, près de 80 variantes de MC ont été identifiées (CODD et al., 2005a; CODD et al., 2005b; DIETRICH et HOEGER, 2005; SANGOLKAR et al., 2006; SIVONEN et JONES 1999). Les deux acides aminés particuliers de la série D sont la N-méthyl-déhydroanaline (Mdha) et un acide aminé peu commun non lié aux structures polaires appelé Adda (RESSOM et al., 1994).
L’activité biologique majeure des MC résulte de leur pouvoir inhibiteur sur des phosphatases 1 et 2A in vitro (ALMEIDA et al., 2006; BOUAÏCHA et al., 2002; HERESZTYN et NICHOLSON, 2001; MACKINTOSH et al., 1990; RAPALA et al., 2002). Cette propriété est d’ailleurs à la base d’un des essais biologiques de dépistage utilisé pour détecter leur présence. La MC-LR, produite comme métabolite secondaire par Microcystis aeruginosa et par d'autres espèces d'algues bleues, comme Anabaena, Anabaenopsis, Nostoc, Microcystis, Oscillatoria et Nodularia, semble être la MC la plus commune à ces genres, et la plus étudiée (CARMICHAEL, 1992; HAIDER et al., 2003). À ce jour, la majorité des travaux sur les MC ont été réalisés en utilisant MC-LR car cette variante est rencontrée dans la plupart des pays qui ont signalé des épisodes de toxicité dans les milieux aquatiques (AN et CARMICHAEL, 1994; CODD 2000).
Les MC tendent à être associées aux cellules cyanobactériennes et peuvent être liées à la membrane ou être présentes à l’état libre à l’intérieur des cellules. Cependant, la libération des toxines survient principalement lorsque les cellules vieillissent, meurent ou libèrent de façon passive leur contenu. Les toxines peuvent parfois être libérées de façon active par de jeunes cellules en cours de croissance (CARMICHAEL, 1992). Leurs concentrations dans l’eau potable font l’objet de normes internationales, établies par l’Organisation Mondiale de la Santé (WHO, 1998). Le seuil correspondant à la concentration maximale acceptable (CMA), est égal à 1 µg équivalents MC-LR.L-1 d’eau potable (OMS, 1998; OMS, 2004). L’hépatotoxicité aiguë des MC chez les humains a été mise en évidence suite à la mort de 76 patients hémodialysés en 1996 au Brésil (CARMICHAEL et al., 2001; JOCHIMSEN et al., 1998) et des milliers de cas de gastro-entérite causées par la présence de cyanobactéries dans l’eau auraient été recensés dans le monde (CODD, 1999). Par ailleurs, plusieurs études révèlent le potentiel cancérigène des MC dans le cas d’une exposition à long terme (ADH, 2006; CARMICHAEL et al., 2001; YU, 1995).
Au Maroc, un état des lieux de la présence de MC dissoute dans l’eau s’impose au niveau des réservoirs d’alimentation en eau potable. Les études effectuées à ce jour consistent seulement à l’évaluation des teneurs en cyanotoxines des efflorescences toxiques et non pas de la fraction de MC soluble dans l’eau. Le présent travail porte alors sur la détection des cyanobactéries et l’évaluation des teneurs en fraction dissoute et intracellulaire des microcystines, dans l’eau brute au niveau de la retenue de barrage SMBA, ainsi que dans l’eau traitée au niveau du réservoir de Tit Mellil destiné au stockage et à la distribution d’eau potable de la ville de Casablanca. La caractérisation des deux sites passe, tout d’abord, par l’évaluation de la qualité physico-chimique des eaux qui ont fait l’objet du présent travail, suivie de l’identification de cyanobactéries potentiellement toxiques, ensuite, l’extraction de leurs toxines intracellulaires. Pour la détection des traces de MC dans l’eau, les échantillons ont été préconcentrés à l’aide d’un système d’extraction sous vide, confectionné à cet effet au laboratoire et basé sur le principe de la chromatographie à phase inversée. L’évaluation des concentrations en MC a été réalisée in vitro par la méthode colorimétrique du microtest d’inhibition de l’activité enzymatique de PP2A. Les résultats vont permettre de dresser un état des lieux concernant les teneurs en MC dissoutes dans l’eau avant et après traitement et stockage, et d’évaluer ainsi l’impact du procédé de traitement. La connaissance du procédé de traitement utilisé s’avère une information pertinente pour une meilleure évaluation du risque pouvant découler de la présence de MC dans l’eau brute.
1. Matériel et méthodes
1.1 Sites d’étude
L’échantillonnage a été effectué au niveau de deux sites : Retenue d’eau de barrage Sidi Mohammed Ben Abdellah (réservoir d’eau brute) et Réservoir de stockage Tit Mellil (eau traitée).
1.1.1 Sous-retenue de barrage Sidi Mohammed Ben Abdellah (réservoir d’eau brute)
La retenue, mise en service en 1974, est construite sur le fleuve Bourégreg, à une vingtaine de kilomètres de la ville de Rabat (Figure 1a). Cette retenue constitue une importante réserve d’eau de 500 millions m3 à la côte normale de 50 m, avec une profondeur moyenne de 17 m (profondeur maximale de 35 m et une superficie de 32 km2, est alimentée par trois rivières, Bou Regreg, Grou et Mechraâ, et sert exclusivement à approvisionner en eau potable la zone côtière entre les villes de Salé et de Casablanca avec un débit moyen est de 440 000 m3•j-1. Cette retenue permet de desservir 30 % de la population casablancaise. Le tableau 1 résume les caractéristiques morphologiques et hydrologiques des eaux brutes de la retenue d’eau de barrage Sidi Mohammed Ben Abdellah (ADH, 2006).
Figure 1
Carte du Maroc représentant les sites de prélèvement (a) Retenue de barrage SMBA (eau brute), (b) Réservoir de stockage de Tit Mellil (eau traitée).
Map of Morocco representing sites of sample (a) of dam SMBA (raw water) (b) storage reservoir of Tit Méllil (treated water).
Tableau 1
Caractéristiques morphologiques, hydrologiques, de l’eau de retenue du barrage Sidi Mohammed Ben Abdellah.
Morphological and hydrological characteristics of the waters of Sidi Mohammed Ben Abdellah dam.
1.1.2 Réservoir de stockage Tit Mellil (eau traitée)
Le réservoir d’eau potable Tit Mellil, côte 96, est un réservoir de 35 000 m3, qui alimente la zone Sidi Bernoussi par voie gravitaire (Figure 1b). Les eaux de ce réservoir sont alimentées par les eaux traitées de Bou Regreg à un débit moyen de 440 000 m3•j-1.
Le procédé utilisé dans le traitement de ces eaux est composé d’un dégrillage suivi d’un tamisage afin d’éliminer les corps flottants et les déchets. Arrivée au niveau du bassin (Tour d'eau brute), l’eau subit une préchloration suivie d’une coagulation par le sulfate d’alumine Al2(SO4)3 associée à une correction du pH (ZIDANE et al., 2010).
Après filtration sur sable, l’opération se termine par la chloration de ces eaux et leur stockage dans des réservoirs avant leur distribution. Il faut signaler que, pendant le stockage, les eaux subissent une chloration le long de la chaîne de distribution. La valeur du chlore résiduel doit être conforme aux normes marocaines d’eau potable (NM 03.7.001) qui sont comprises entre 0,5 à 1,0 mg•L-1 à la production et entre 0,1 et 1 mg•L-1 à la distribution.
1.2 Échantillonnage
Le prélèvement a été effectué mensuellement, entre 2006 et 2008, avec une fréquence plus accentuée pendant les saisons estivales et automnales. Tous les échantillons ont été réalisés en triplicatas.
1.2.1 Retenue de barrage Sidi Mohammed Ben Abdellah
1.2.1.1 Eau
Le prélèvement des eaux au niveau de la retenue de barrage a été effectué en surface et à 50 cm de profondeur. L’échantillonnage a été réalisé à l’aide de bouteilles de type Van Dorn de 8 litres. Les échantillons d’eau destinés à l’analyse physico-chimique ont été conservés dans des bouteilles en PVC et ceux destinés aux analyses de cyanotoxines étaient stockés dans un flacon en verre de 500 mL dont l’intérieur du couvercle était recouvert d’une feuille d’aluminium pour empêcher le contact de l’eau avec le plastique, ce matériau pouvant adsorber les cyanotoxines.
1.2.1.2 Cyanobactéries
L’échantillonnage des cyanobactéries a été effectué le matin, à l’aide de filets à planctons 27 µm de maille. Les échantillons prélevés ont été immédiatement fixés, avec une solution d’iode acidifié (Lugol) à 8 %, et conservés à 4 °C.
1.2.2 Réservoir de Tit Mellil
Les prélèvements de l’eau ont été effectués à l’entrée du réservoir de stockage au niveau de l’adduction de Bourégreg avant le stockage de l’eau et sa distribution. Le chlore résiduel a été neutralisé au moment du prélèvement par un ajout de 100 µL d’une solution de thiosulfate de sodium (Na2S2O3) à 1 % pour empêcher la lyse des cyanobactéries. Tous les échantillons d’eau prélevés ont été immédiatement stockés à 4 °C avant l’analyse dans les 24 h qui suivent les prélèvements.
1.3 Analyses physico-chimiques
La connaissance des caractéristiques physico-chimiques des eaux brutes et des eaux traitées s’avère une information pertinente pour une meilleure évaluation du risque pouvant découler de la présence de cyanotoxines dans l’eau. Puisque l’objectif de la présente étude ne consiste pas à faire un suivi des paramètres physico-chimiques, mais de faire une caractérisation globale de ces eaux brutes ou traitées, et vu que ces paramètres ne connaissaient pas de brusques variations ou de pics durant la période d’étude, une moyenne de chaque paramètre a été calculée à partir des résultats de trois mesures ponctuelles effectuées, à dix jours d’intervalle, au cours du mois d’octobre 2008.
1.3.1 Paramètres physico-chimiques des eaux
La température, la conductivité, l’oxygène dissous et le pH ont été mesurés sur le terrain avec un analyseur portable à affichage numérique type CONSORT (ISO 9001 : 2000). La détermination de chaque paramètre a été réalisée à l’aide d’électrodes spécifiques calibrées et préalablement étalonnées avant chaque prise d’essai. L’évaluation des matières en suspension (MES) a été effectuée par filtration sur une membrane de 110 mm GF/C (Whatman) ayant une porosité de 1,2 μm. Cette mesure a été effectuée par différence de poids après passage à l’étuve (60 °C) pendant 2 h.
1.3.2 Éléments nutritifs
Le zinc et le fer ont été analysés par un spectromètre à émission au plasma (ICP-MS) (marque Perkin Elmer Sciex, modèle Elan DRC II). La détermination des teneurs en nitrates a été effectuée après réduction en nitrites puis diazotation en milieu acide et dosage du composé azoïque par photométrie (RODIER, 1996). La détermination des teneurs en ammonium a été réalisée par minéralisation à l’acide sulfurique puis distillation et colorimétrie au bleu d’indophénol (RODIER, 1996).
Le phosphore total a été dosé par minéralisation en orthophosphates aux acides sulfurique et nitrique. Les teneurs en orthophosphate ont été mesurées par dosage photométrique d’un complexe phosphomolybdique après réduction à l’acide ascorbique (APHA, 1992) et l’oxydabilité au permanganate de potassium a été mesurée par la technique décrite par RODIER (1984).
1.4 Identification
Les genres de cyanobactéries présents dans les échantillons, prélevés à l’aide de filets à planctons et fixés au Lugol, ont été identifiés au microscope optique à l’aide d’ouvrage de systématique (BOURRELY, 1966).
1.5 Extraction de la microcystine
Dans les 24 heures qui suivent les prélèvements, l’extraction a été effectuée selon la méthode décrite par LAWTON et al. (1994).
1.5.1 Ultrafiltration et filtration des échantillons d’eau
Après agitation, l’échantillon de 500 mL a été immédiatement filtré sous vide, sur membrane 110 mm GF/C afin d’éliminer les particules en suspension, ainsi que la plupart des micro-organismes. Le filtre après utilisation a été congelé en vue de l’analyse du potentiel hépatotoxique du contenu intracellulaire. Au filtrat des échantillons chlorés, 100 µL d’une solution de thiosulfate de sodium à 1 % ont été ajoutés, puis le mélange a subi une agitation vigoureuse suivie d’un repos de quelques minutes. L’élimination du chlore a été réalisée par simple filtration. Un ajout du méthanol à 1 % V/V a été fait au filtrat obtenu.
1.5.2 Extraction de la fraction libre ou extracellulaire de microcystines
Les microcystines présentes dans l’eau ont été extraites à l’aide d’un système d’extraction sous vide. Pour atteindre un seuil de détection de 1 ng•L-1, nous avons fait appel à une préconcentration de l’échantillon qui repose sur l’utilisation de la chromatographie à phase inversée à travers des cartouches de capacité de 3 mL remplies de silices greffées par n octadécyle (C18) (J.T. Baker USA).
Tous les essais ont été réalisés en triplicatas. La cartouche a été initialement équilibrée avec 10 mL de méthanol suivi de 10 mL d’eau distillée. Un volume de 500 mL de filtrat a été concentré à travers la colonne d’extraction à un débit constant de 5 mL•min-1. La cartouche a ensuite été rincée avec 10 mL de méthanol à 20 % et séchée durant 10 min. Les microcystines ont été éluées avec 3 mL de méthanol absolu contenant 0,1 % V/V d’acide trifluoroacétique. L’éluat a été évaporé à sec et l’extrait obtenu a été repris dans 100 µL d’éthanol absolu et conservé à -20 °C.
1.5.3 Extraction de la fraction intracellulaire
Après plusieurs cycles de congélation et décongélation du filtre, les toxines ont été extraites, avec 5 mL de méthanol pur, trois fois de suite, pendant une heure à température ambiante. Les extraits ont été réunis et le mélange a été évaporé à sec. Le résidu a été repris dans 250 µL d’éthanol et conservé à -20 °C.
1.5.4 Tests d’inhibition de la protéine phosphatase (PP-2A)
1.5.4.1 Principe de la méthode
La méthode colorimétrique, décrite par AN et CARMICHAEL (1994) a été utilisée dans la présente étude pour l’analyse des MC. Son principe repose sur la transformation, par la protéine phosphatase à sérine et thréonine 2A (PP2A), du paranitrophényl phosphate (pNPP), substrat incolore, en paranitrophénol (pNP), produit coloré en jaune qui présente un maximum d’absorption à 405 nm. En présence de MC, la PP2A est inhibée et l’activité enzymatique est inversement proportionnelle à la concentration en MC dans l’échantillon à doser.
1.5.4.2 Produits et solutions utilisées
1.5.4.2.1 Les solutions tampon, préparées avec de l’eau Milli Q
Tris/HCl (40 mM Tris-HCl, 34 mM MgCl2; 4 mM EDTA) à pH : 8,3; DDT (4 mM), BSA : Sérum Albumine Bovine à 0,5 mg•mL-1)
1.5.4.2.2 Le substrat
Le PNPP : paranitrophénylphosphate, dissodique, 6H2O (sigma), 40 mM dans du tampon Tris/HCl/DDT (Sigma).
1.5.4.2.3 L’enzyme
La protéine phosphatase 2A, catalytic subunit (25 UI), a été préalablement diluée dans une solution tampon Tris/HCl/DDT/BSA à une concentration initiale de 0,2 UI•µL-1. L’enzyme extraite des globules rouges humains provient d’Upstate Biotechnology (Euromedex, France).
1.5.4.2.4 Les étalons MC-LR
100 pg•mL-1 à 600 pg•mL-1 ont été préparés en solution dans du tampon Tris/HCl/DDT à partir d’une solution initiale de MCLR à 200 pg•µL-1 équivalent MCLR de 95 % de pureté provient de Sigma. Les extraits intracellulaires ou extracellulaires des échantillons (10 µL) ont été repris dans un volume 500 µL du tampon Tris/HCl/DDT.
1.5.4.2.5 Protocole expérimental
Le test a été réalisé sur des microplaques microtitrées de 96 puits. Chaque puits renferme 50 µL de solution d’enzyme, 50 µL de solution de substrat et 100 µL de solution de MC-LR de la gamme d’étalonnage ou 100 µL de solution préparée de l’échantillon à doser. Le blanc a été incubé sans enzyme et le contrôle a été incubé sans toxine. L’incubation de l’enzyme et de son substrat a été effectuée à 37 °C. Le mélange réactionnel a été agité pendant 5 min et l’activité enzymatique a été mesurée après 5 et 60 min d’incubation à l’aide d’un lecteur ELISA U-V visible ELX 800-OSI, à une longueur d’onde de 405 nm. Les teneurs des MC dans les extraits des échantillons à doser ont été déterminées à partir de la courbe d’étalonnage. Les extraits ont été testés dans les mêmes conditions opératoires de la gamme d’étalonnage. Les résultats obtenus ont été exprimés en nanogramme équivalent microcystine-LR par litre d’échantillon en tenant compte des étapes de préconcentration faites.
2. Résultats et discussion
2.1 Analyses physico-chimiques
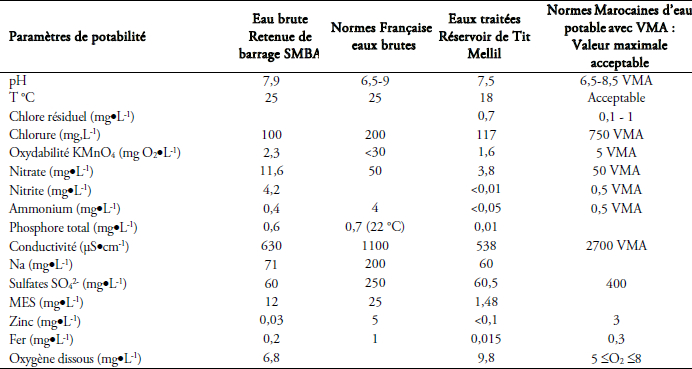
Le diagnostic de ces eaux brutes et traitées passe par leur caractérisation globale, déterminée par le calcul de la moyenne des paramètres physico-chimiques et des éléments nutritifs. Les résultats des analyses effectuées sont résumés au tableau 2. Les valeurs obtenues des eaux traitées (réservoir Tit Mellil) ont été confrontées aux « Normes Marocaines Eau potable NM 03.7.001 ». Celles des eaux brutes ont été confrontées aux « Normes Françaises publiées en 2007 », puisqu’il existe des lacunes concernant les recommandations marocaines pour la qualité de ces eaux destinées à la production de l’eau potable.
Tableau 2
État de la qualité des eaux de retenue du barrage SMBA (eau brute) comparée à la norme française et du réservoir de Tit Mellil (eau traitée) comparée aux normes marocaines d’eau potable NM 03.7.001.
Quality of the waters of the SMBA dam (raw water) compared with the French water quality standards and of the waters of the Tit Mellil reservoir (treated water) compared with the Moroccan drinking water standard NM 03.7.001.
2.1.1 Eau brute
Tous les paramètres respectent les normes, excepté le phosphore total pour lequel une valeur guide limite de 0,03 mg•L-1 a été suggérée par l’OMS. Cette valeur représente un critère pour éviter l’eutrophisation en rivière (KURMAYER et CHRISTIANSEN, 2009). Or, les teneurs trouvées sont 20 fois supérieures à cette valeur guide. Le contrôle de la concentration du phosphore devrait donc s’inscrire comme une mesure à long terme de la gestion du problème de la prolifération de cyanobactéries. Une bonne corrélation, entre le nombre de cyanobactéries, ou la concentration de microcystine-LR et le phosphore total, a été mise en évidence par KOTAK et al. (2000).
Le rapport azote total/phosphore total serait un facteur encore plus important, un rapport inférieur à 29 étant associé à des conditions favorables au développement des cyanobactéries (SMITH, 1986), alors qu’un rapport inférieur à 5 est encore plus clairement associé au nombre de cyanobactéries toxiques (EYNARD et al., 2000). De plus, la production de cyanotoxines semble également être régulée par d’autres facteurs environnementaux. Par exemple, la disponibilité en fer dans le milieu (SEVILLA et al., 2008) et l’intensité de l’irradiation lumineuse (TONK et al., 2005 ) influent sur la transcription de certains gènes impliqués dans la production de MC et donc sur la quantité de toxines produites. En définitive, le patrimoine génétique constitue la base primordiale de la toxinogenèse qui serait régulée en réponse aux facteurs environnementaux (KURMAYER et CHRISTIANSEN, 2009).
2.1.2 Eau traitée
Dans l’eau traitée, les valeurs sont conformes à la Norme Marocaine d’eau potable homologuée NM 03.7.001 avec la somme des rapports : ((NO3)/50 + (NO2)/3) ne dépassant pas 1 et une teneur de 0,1 mg•L-1 de NO2 qui est respectée au départ des installations de traitement. Les teneurs en chlore résiduel de l’ordre de 0,7 mg•L-1 à la production sont conformes aux normes comprises entre 0,5 à 1,0 mg•L-1. Les valeurs du pH sont inférieures à 8. Cette condition est nécessaire pour que la désinfection de l’eau par le chlore soit efficace.
2.2 Identification des genres de cyanobactéries
2.2.1 Eau brute
La recherche de cyanobactéries, dans les prélèvements fixés, a révélé leur présence dans l’eau brute de la retenue de barrage SMBA. L’identification sommaire, au genre, a permis de mettre en évidence la présence des genres suivants : Aphanizomen, Spirulina, Lyngbia, Anabena, Oscillatoria, Microcystis et Chroococcus. La prévalence des cyanobactéries est plus importante en fin d’été et début automne. Les cyanobactéries commencent à être détectées à la fin du mois de juin et leur nombre augmente progressivement pendant les mois de juillet, août et septembre pour atteindre un pic maximum en octobre. Parmi les genres identifiés, Oscillatoria et Microcystis sont considérés par HAIDER et al. (2003) comme les plus toxiques et aussi producteurs de MC. Ces dernières, lorsqu’elles sont relarguées dans l’eau, présentent un danger réel pour la santé publique à travers l’eau de boisson si la toxine n’est pas éliminée en amont par le procédé de traitement (HAIDER et al., 2003). En effet, dans le présent travail, des teneurs variables en MC ont été déterminées dans tous les échantillons analysés d’eau brute où ces genres toxiques ont été identifiés. La détection de MC-LR, associée à la prolifération du genre Microcystis, a été aussi signalée dans de nombreux pays (FROMME et al., 2000; VEZIE et al., 1996; WATANABE et OISHI, 1985). En revanche, nous avons identifié un genre non toxique, Chroococcus. Ce dernier, bien qu’il ne présente pas de risque majeur à la santé, peut toutefois causer des problèmes au niveau des systèmes de filtration de l’eau (LAVOIE et al., 2007).
2.2.2 Eau traitée
La non-détection de microalgues dans les échantillons d’eau traitée est liée probablement à leur prélèvement non réalisé à l’aide de filets à planctons qui permettraient leur concentration ou probablement leur dilution dans la masse d’eau ou encore à leur absence effective du réservoir de stockage. Cette dernière éventualité est en relation probablement avec le processus de traitement. Or, la filière de traitement des eaux brutes de retenue de barrage SMBA utilise un procédé basé sur une coagulation au sulfate d’aluminium (Alun) avec ajustement du pH, une sédimentation et une filtration sur sable avec préchloration et postchloration. D’après HART et al. (1997), le procédé de traitement classique élimine efficacement les cellules cyanobactériennes.
2.3 Quantification des microcystines : Test d’inhibition de PP2A
La courbe d’étalonnage de l’inhibition de l’activité enzymatique de la protéine phosphatase type 2A a été obtenue pour différentes concentrations de MC-LR (Figure 2). Nous avons travaillé avec la gamme de concentration de MC-LR allant de 100 ng•L-1 à 600 ng•L-1, ce qui correspond à des concentrations dans les puits de 50 pg•mL-1 à 300 pg•mL-1. La courbe d’étalonnage est très pointue, pour un dosage fiable, l’inhibition de l’activité de PP2A doit être 50 % pour se situer dans le domaine linéaire de la courbe (Figure 2). Les concentrations moyennes permettant l’inhibition de 50 % de l’activité enzymatique obtenues (CI50) correspond à 236 ng•L-1. La limite de détection de la technique est de 100 ng•L-1 pour les standards et est ramenée à 1 ng•L-1 pour les extraits des échantillons préalablement préconcentrés avec un facteur de 100. Cette technique, qui ne permettait initialement de détecter qu’une concentration de microcystines de l’ordre de 0,1 μg•L-1, a été améliorée par une préconcentration au préalable de l’échantillon (LAMBERT et al., 1994). Ceci a augmenté sa sensibilité comparée avec celles obtenues par d’autres techniques comme le test souris et la méthode du test immuno-enzymatique (ELISA, enzyme-linked immunosorbent assay), à antiticorps polyclonaux (CHU et al., 1990; NAGATA et al., 1995).
Figure 2
Courbe d’étalonnage du % de la PP2A en fonction de la concentration de Microcystine–LR (ng•L-1).
Calibration curve of the % of PP2A according to the concentration of Microcystin–LR (ng•L-1)
2.3.1 Eau brute
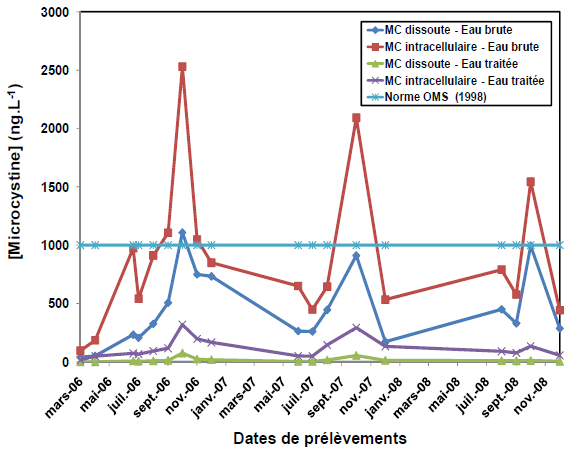
2.3.1.1 Microcystine extracellulaire
La figure 3 représente la concentration en microcystines dissoutes dans l’eau brute dont les teneurs varient de 4 ng•L-1 en mars 2006 à un maximum de 1,1 μg•L-1 enregistré en octobre 2006. Il s’agit cependant des concentrations extracellulaires qui ne représentent qu’une proportion du potentiel toxique et sont cependant corroborées par les analyses effectuées pour déterminer les concentrations intracellulaires de microcystines. Ce résultat est en accord avec celui publié par FROMME et al. (2000) avec une concentration de microcystines libres dans l’eau de l’ordre 0,3 à 12 % de l’ensemble de MC synthétisée par les cyanobactéries.
Figure 3
Variation temporelle de la concentration de microcystines dissoutes et intracellulaires dans l'eau brute et traitée par rapport au seuil recommandé par l’OMS.
Temporal variation of the dissolved and intracellular microcystins concentrations in raw and treated water in comparison with the threshold recommended by the WHO.
2.3.1.2 Microcystine intracellulaire
L’analyse du potentiel toxique de la fraction intracellulaire de l’eau brute (Figure 3) montre des teneurs de 0,05 μg•L-1 en mars 2006 à 2,53 μg•L-1 en octobre de la même année. Cette valeur dépasse de loin la limite de 1 μg•L-1 recommandée par l’OMS (1998). Ce potentiel ne se manifesterait toutefois qu’à la suite d’une mortalité massive et brusque des cyanobactéries, par exemple, consécutive à l’utilisation d’algicides (CARMICHAEL, 1992; JONES et ORR, 1994). La libération des toxines intracellulaires dans l’eau peut aussi découler de la présence de phénomènes biologiques particuliers.
2.3.2 Eau traitée
2.3.2.1 Microcystine intracellulaire
Quoi qu’aucune cellule n’ait été identifiée au niveau des eaux traitées, le potentiel toxique intracellulaire, a été détecté avec un pic au mois d’octobre dont le maximum est de 319 ng•L-1, voir (Figure 3).
2.3.2.2 Microcystine extracellulaire
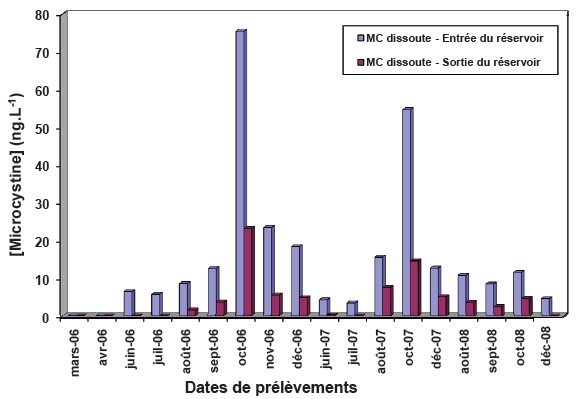
2.3.2.2.1 A l’entrée du réservoir de stockage
Les résultats montrent que les microcystines dissoutes sont présentes dans tous les échantillons d’eau traitée, prélevés à l’entrée du réservoir de stockage, pendant la période été-automne de 2006 à 2008 et leurs taux en microcystines dissoutes n’excèdent pas 0,075 µg équivalents MC-LR•L-1 (Figure 4). Ces valeurs, bien que positives, sont très inférieures au seuil recommandé par l’Organisation Mondiale de Santé, qui est de 1 µg équivalent de MC-LR•L-1 d’eau et sont nettement inférieures à celles des eaux brutes, pour la même période. La diminution de la concentration en MC dissoute est liée probablement au traitement classique appliqué à ces eaux associé à une préchloration et une postchloration.
Figure 4
Variation temporelle de la concentration de microcystines dissoutes dans l'eau traitée à l’entrée et à la sortie du réservoir du stockage.
Temporal variation of dissolved microcystin concentrations in treated water at the entrance and exit of the storage reservoir.
Plusieurs études ont montré que la transformation des MC pourrait donc être a priori une conséquence positive de la chloration (BROOKE et al., 2006; GIJSBERTSEN-ABRAHAMSE et al., 2006; HUANG et al., 2007) et pourrait cependant être à l’origine de la formation de nouveaux sous-produits de la MC, qui pourraient tout autant s’avérer inoffensifs que toxiques (MEREL et al., 2009). La préchloration appliquée à l’eau non traitée, contenant des matières organiques/inorganiques oxydables, génère la formation de sous-produits chlorés (ZIDANE et al., 2010) et réduit la dose disponible pour l'élimination efficace des microcystines (EDWARDS et al., 1991).
2.3.2.2.2 A la sortie du réservoir de stockage
Les teneurs en MC dissoute dans les eaux traitées destinées à la consommation varient de non détectables au seuil de détection 1 ng•L-1 pour atteindre un maximum de 22 ng•L-1, en octobre 2006, très en dessous des normes. L’analyse de ces résultats montre qu’un bref séjour au niveau du réservoir de stockage permet une diminution des concentrations en MC par rapport à celles enregistrées à l’entrée du réservoir (Figure 4), et est en relation probablement avec l’effet de la chloration appliquée à ces eaux depuis la station de traitement jusqu’au consommateur.
3. Conclusion
Dans la présente étude, un état des lieux concernant l’analyse des microcystines, a été établi aussi bien au niveau des eaux brutes de la retenue de barrage SMBA qu’au niveau des eaux traitées du réservoir Tit Mellil alimenté par les eaux de la retenue. La connaissance des caractéristiques physico- chimiques de ces eaux s’avère une information pertinente pour une meilleure évaluation du risque pouvant découler de la présence de MC dans l’eau.
En effet, le diagnostic des eaux brutes par leur caractérisation globale montre des taux respectant les normes avec des critères qui tendent vers l’eutrophisation, constituant ainsi un état favorable à la prolifération des cyanobactéries. Or, l’observation au microscope a permis d’identifier plusieurs genres de cyanobactéries potentiellement toxiques et producteurs de MC. Ces dernières, lorsqu’elles sont relarguées dans l’eau, présentent un danger réel pour la santé publique à travers l’eau de boisson si la toxine n’est pas éliminée en amont par un processus du traitement (HAIDER et al., 2003). L’absence de cyanobactéries dans les échantillons d’eau traitée est due probablement à la nature du traitement appliqué à ces eaux, associant chloration, floculation, sédimentation, et filtration.
L’évaluation par le test à la PP2A de la teneur de MC dissoute au niveau des eaux brutes de la retenue de barrage SMBA révèle la présence de la toxine dans tous les échantillons testés avec une limite de détection de 1 ng•L-1. Les concentrations trouvées varient de quelques nanogrammes enregistrées au début d’été au cours des mois de juin et juillet avec une augmentation progressive pour atteindre un pic en octobre dont le taux maximal correspond à 1,1 µg.L-1 en 2006. Il s’agit cependant de concentrations extracellulaires qui ne représentent qu’une proportion du potentiel toxique et sont cependant corroborées par les analyses effectuées pour déterminer les concentrations intracellulaires de microcystines. L’analyse du potentiel toxique de la fraction intracellulaire de l’eau brute montre des teneurs, qui varient de 0,05 μg•L-1 en mars 2006 à 2,53 μg•L-1 en octobre de la même année, dépassant de loin la limite de 1 μg•L-1 recommandée par l’OMS. Ce potentiel toxique ne se manifesterait toutefois qu’à la suite d’une mortalité massive et brusque des cyanobactéries. Quoique les teneurs en MC dans les eaux brutes soient élevées, les taux sont nettement diminués après traitement pour la même période.
La valeur maximale de MC dissoutes, enregistrée au niveau des eaux traitées à l’entrée du réservoir de stockage, est de 0,075 µg•L-1, marque la présence des MC tout en étant en dessous des normes recommandées par l’OMS. À la sortie du réservoir de stockage, les analyses montrent des taux très faibles qui varient de l’indétectable à un maximum de 0,022 µg•L-1.
La présence donc d’un faible taux résiduel de MC dans les échantillons d’eau traitée est associée probablement à la chloration appliquée à ces eaux depuis la station de traitement jusqu’au consommateur. La transformation des cyanotoxines pourrait donc être a priori une conséquence positive de la chloration, comme en témoignent plusieurs publications (BROOKE et al., 2006; GIJSBERTSEN-ABRAHAMS et al., 2006; HUANG et al., 2007) et pourrait cependant être à l’origine de la formation de nouveaux sous-produits de la MC, qui pourraient tout autant s’avérer inoffensifs que toxiques (MEREL et al., 2009).
En revanche, la préchloration appliquée à l’eau non traitée, contenant des matières organiques/inorganiques oxydables, génère la formation de sous-produits chlorés (ZIDANE et al., 2010), ce qui pourrait réduire la dose disponible pour l'élimination efficace des microcystines.
Or, avant de conclure au bénéfice de la chloration pour l’élimination des MC, les produits issus de la réaction doivent être caractérisés au niveau du réservoir de stockage d’eau potable destinée à la consommation humaine.
Parties annexes
Remerciements
Les auteurs remercient vivement monsieur M. Tijani, professeur d’anglais, pour son aide précieuse dans la traduction.
Références bibliographique
- ADH (2006). Les grands barrages au Maroc. Publication de l’administration de l’hydraulique, Rabat, Maroc, 123 p.
- ALMEIDA V.P.S., K. COGO, S.M. TSAI et D.H. MOON (2006). Colorimetric test for the monitoring of microcystins in cyanobacterial culture and environmental samples from southeast Brazil, Brazil. J. Microbiol., 37, 192-198.
- AN J.S et W.W. CARMICHAEL (1994). Use of a colorimetric protein phosphatase inhibition assay and enzyme linked immunosorbent assay for the study of microcystins and nodularins. Toxicon, 32, 1495-1507.
- APHA (1992). American Public Health Association 1992. Standard methods for analysis of waste and wastewater. APHA. Pub., 18e édition, Washington, DC, États-Unis.
- BOUAÏCHA N., I. MAATOUK, G. VINCENT et Y. LEVI (2002). A colorimetric and fluorometric microplate assay for the detection of microcystin-LR in drinking water without preconcentration, Food Chem. Toxicol., 40, 1677-1683.
- BOURRELY P. (1966). Les algues vertes (I). N. Boubée et Cie, Paris, France, 511 p.
- BROOKE S., G. NEWCOMBE, B. NICHOLSON et G. KLASS (2006). Decrease in toxicity of microcystins LA and LR in drinking water by ozonation. Toxicon, 48, 1054-1059.
- CARMICHAEL W.W., S.M.F.O. AZEVEDO, J.S. AN, R.J.R. MOLICA, E.M. JOCHIMSEN, L. S.AU, K.L. RINEHART, G.R. SHAW et G.K. EAGLESHAM (2001). Human fatalities from cyanobacteria: chemical and biological evidence for cyanotoxins, Environ. Health Persp., 109, 663-668.
- CARMICHAEL W.W. (1994). Un aperçu de la recherche sur les cyanobactéries toxiques aux États-Unis. Dans : Cyanobactéries Toxiques: État Actuel de la Recherche et de la Gestion. Actes d'un atelier international, Adelaide, Australie, 22 au 26 mars. D.Ä. STEFFENSEN et LA COLOMBIE-BRITANNIQUE NICHOLSON (Éditeurs), Australian Centre for Water Quality Research, Salisbury, Australie. pp. 39-44.
- CARMICHAEL W.W. (1992). Cyanobacteria secondary metabolites – The cyanotoxines. J. Appl. Bacteriol., 72, 445-459.
- CHU F.S., X. HUANG et R.D. WEI (1990). Enzyme-linked immunosorbent assay for microcystins in blue green algal blooms. J. Assoc. Off. Anal. Chem., 73, 451-456.
- CODD G.A. (2000). Cyanobacterial toxins, the perception of water quality, and the prioritisation of eutrophication control. Ecol. Eng., 16, 51-60.
- CODD G.A., I. CHORUS et M. BURCH (1999). Design of monitoring programmes. Dans : Toxic Cyanobacteria in Water: A Guide To Their Public Health Consequences, Monitoring And Management. CHORUS I. et J. BARTRAM (Éditeurs), London, New-York, E & FN Spon, pp. 313-328.
- CODD G.A., J. LINDSAY, F.M. YOUNG, L.F. MORRISON et J.S. METCALF (2005a). Harmful cyanobacteria: from mass mortalities to management measures. Dans : Harmful Cyanobacteria. HUISMAN J., H.C.P. MATTHIJS et P.M. VISSER (Éditeurs), Springer, Dordrecht (Pays-Bas), pp. 1-23.
- CODD G.A., L.F. MORRISON et J.S. METCALF (2005b). Cyanobacterial toxins: risk management for health protection. Toxicol. Appl. Pharmacol., 203, 264-272.
- DAWSON R.M. (1998). The toxicology of microcystins. Toxicon, 36, 953-962.
- DE FIGUEIREDO D.R., U.M. AZEITEIRO, S.M. ESTEVES, F.J.M. GONCALVES et M.J. PEREIRA (2004). Microcystin-producing blooms - a serious global public health issue. Ecotoxicol. Environ. Safety, 59, 151-163.
- DIETRICH D. et S. HOEGER (2005). Guidance values for microcystins in water and cyanobacterial supplement products (blue-green algal supplements): a reasonable or misguided approach. Toxicol. Appl. Pharmacol., 203, 273-289.
- EDWARDS C., L.A. LAWTON, K.A. BEATTIE, J.K. FAWELL et G.A. CODD (1991). Separation and characterization of cyanobacterial peptide toxins by photodiode array high-performance liquid chromatography. Br. Phycol. J. (Winter meeting of the Br. Phycol. Soc.), 26, 84-85.
- ERNST, B., L. DIETZ, S.J. HOEGER, et D.R. DIETRICH (2005). Recovery of MC-LR in fish liver tissue. Environ. Toxicol., 20, 449-458.
- ERNST B., S.J. HOEGER, E. O'BRIEN et D.R. DIETRICH (2009). Abundance and toxicity of Planktothrix rubescens in the pre-alpine Lake Ammersee, Germany. Harmful Algae, 8, 329-342.
- EYNARD F., K. MEZ et J.L. WALTHER (2000). Risk of cyanobacterial toxins in Riga waters. Water Res., 34, 2979-2988.
- FRISTACHI A. et J.L. SINCLAIR (2008). Occurrence of cyanobacterial harmful algal blooms work group report. Dans : Cyanobacterial Harmful Algal Blooms: State Of The Art Science And Research Needs. Hudnell, K.H. (Éditeur), Springer, New-York, NY, États-Unis, pp. 45-103.
- FROMME H., A. KÖHLER, R. KRAUSE, et D. FÜHRLING (2000). Occurrence of cyanobacterial toxins - microcystins and anatoxin-a - in Berlin water bodies with implications to human health and regulation. Environ. Toxicol., 15, 120-130.
- GIJSBERTSEN-ABRAHAMSE A.J., W. SCHMIDT, I. CHORUS et S.G.J. HEIJMAN (2006). Removal of cyanotoxins by ultrafiltration and nanofiltration, J. Membr. Sci., 276, 252-259.
- HAIDER S., V. Naithani, P.N. Viswanathan, P. Kakkar (2003). Cyanobacterial toxins: a growing environmental concern. Chemosphere, 52, 1-21.
- HART J., J.K. FAWELL et B. CROLL (1997). The fate of both intra and extracellular toxins during drinking water treatment. Special subject N°18, SS18-1-6, IWSA World Congress, Blackwell Science, Oxford.
- HEISLER J., P.M. GLIBERT, J.M. BURKHOLDER, D.M. ANDERSON, W. COCHLAN, W.C. DENNISON, Q. DORTCH, C.J. GOBLER, C.A. HEIL, E. HUMPHRIES, A. LEWITUS, R. MAGNIEN, H.G MARSHALL, K. SELLNER, D.A. STOCKWELL, D.K. STOECKER et M. SUDDLESON (2008). Eutrophication and harmful algal blooms: a scientific consensus. Harmful Algae, 8, 3-13.
- HERESZTYN T. et B.C. NICHOLSON (2001). Determination of cyanobacterial hepatotoxins directly in water using a protein phosphatase inhibition assay. Water Res., 35, 3049-3056.
- HUANG W.J., B.L. CHENG, et Y.L. CHENG (2007). Adsorption of microcystin-LR by three types of activated carbon. J. Hazar. Mater., 141, 115-122.
- JOCHIMSEN E.M., W.W. CARMICHAEL, J.S. AN, M.D. CARDO, S.T. COOKSON, C.E.M. HOLMES, M.B. ANTUNES, D.A. DE MELO FILHO, T.M. LYRA, V.T. SBINELLI, S.M.F.O. AZEVEDO, et M.D. JARVIS (1998). Liver failure and death after exposure to microcystins at a hemodialysis center in Brazil. N. Eng. J. Med., 338, 873-878.
- JONES G. et P.T. ORR (1994). Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatise inhibition assay. Water Res., 28, 871-876.
- KOTAK B.G., A.K.-Y. LAM, E.E. PREPAS, et S.E. HRUDEY (2000). Role of chemical and physical variable in regulating microcystin-LR concentration in phytoplankton of eutrophic lakes. Can. J. Fish. Aquat. Sci., 57, 1584-1593.
- KURMAYER R. et G. CHRISTIANSEN (2009). The genetic basis of toxin production in cyanobacteria. Fresh Water Rev., 2, 31-50.
- LAMBERT T.W., M.P. BOLET, C.F.B. HOLMES et S.E. HRUDEY (1994). Dosage des hépatotoxines microcystines dans l'eau à des concentrations écologiquement pertinentes avec le dosage biologique protéine phosphatase. Environ. Sci. Technol., 28, 753-755.
- LAVOIE I., I. LAURION et W.F. VINCENT (2007). Les fleurs d’eau de cyanobactéries. Document d’information vulgarisée. INRS rapport No 917, iii, 27 p.
- LAWTON L.A., C. EDWARDS et G.A. CODD (1994). Extraction and high-performance liquid chromatography method for the determination of microcystins in raw and treated waters. Analyst, 199, 1525-1530.
- MacKINTOSH C., K.A. BEATTIE, S. KLUMPP, P. COHEN et G.A. CODD (1990). Cyanobacterial microcystin-LR is a potent and specific inhibitor of protein phosphatases 1 and 2A from both mammals and higher plants. FEBS Lett., 264, 187-192.
- MEREL S., B. LEBOT, M. CLEMENT, R. SEUX et O. THOMAS (2009). MS identification of microcystin-LR chlorination by-products. Chemosphere, 74, 832-839.
- NAGATA S., T. TSUTSUMI, A. HASEGAWA, M.F. WATANABE et Y. UENO (1995). Determination of microcystin in environmental water by highly sensitive immunoassay. Jpn. J. Toxicol. Environ. Health, 41, 10-18.
- NORME MAROCAINE HOMOLOGUÉE NM 03.7.001. Par arrêté conjoint du ministre de l'Équipement et du Transport du ministre de la Santé, du ministre de l’Aménagement du territoire, de l’Eau et de l’Environnement et du ministre de l'Industrie, du Commerce et des Télécommunications
- NORMES FRANÇAISE NOR: SANP0720201A (2007). Arrêté du 11 janvier 2007, relatif aux limites et références de qualité des eaux brutes et des eaux destinées à la consommation humaine mentionnées aux articles R 1321-2, R. 1321-3,R. 1321-7 et R. 1321-38 du code de la santé publique.
- OMS (1998). Guidelines for drinking-water quality. Second edition, addendum to volume 2, Health criteria and other supporting information, Organisation Mondiale de la Santé, Genève.
- OMS (2004). Guidelines for drinking water quality. Third edition, volume 1, Recommendations, Organisation Mondiale de la Santé, Genève.
- POURIA S., A. DE ANDRADE, J. BARBOSA, R.L. CAVALCANTI, V.T.S. BARRETO, C.J. WARD PREISER, G.K. POON et G.A. CODD (1998). Fatal microcystin intoxication in haemodialysis unit in Caruaru, Brazil. The Lancet, 352, 21-26.
- RAPALA J., K. ERKOMAA J. KUKKONEN, K. SIVONEN, et K. LAHTI (2002). Detection of microcystins with protein phosphatase inhibition assay, high-performance liquid chromatography-UV detection and enzyme-linked immunosorbent assay: comparison of methods. Anal. Chim. Acta, 466, 213-231.
- RESSOM R., F.S. SOONG, J. FITZGERALD, L. TURCZYNOWICZ, O. EL SAADI, D. RODER, T. MAYNARD et I. FALCONER (1994). Effets sur la santé de cyanobactéries toxiques (algues bleu-vert). Santé nationale et Conseil de recherches médicales, Australie, Commonwealth Department of Human Services, et la Santé. Australian Government Publishing Service, Canberra, Australie, 108 p.
- RODIER J. (1984). L’analyse de l’eau : eaux naturelles, eaux résiduaires, eau de mer. 7e édition, DUNOD, BORDAS (Éditeur), Paris, France, 1365 p.
- RODIER J., C. BAZIN, P. CHANBON, J.P. BROUTIN, H. CHAMPSAUR et L. RODI (1996). L'analyse de l'eau : eaux naturelles, eaux résiduaires et eaux de mer. 8e édition, Dunod (Éditeur), Paris, France, 1383 p.
- SANGOLKAR L.N., S.S. MASKE et T. CHAKRABARTI (2006). Methods for determining microcystines and microcystin-producing cyanobacteria. Water Res., 40, 3485-3496.
- SEVILLA E., B. MARTIN-LUNA, L. VELA, M.T. BES, M.F. FILLAT et M.L. PELEATO (2008). Iron availability affects mcyD expression and microcystin-LR synthesis in Microcystis aeruginosa PCC7806. Environ. Microbiol., 10, 2476-2483.
- SIVONEN K. et G. JONES (1999). Cyanobacterial toxins. . Dans : Toxic Cyanobacteria In Water : A Guide To Their Public Health Consequences, Monitoring And Management. CHORUS, I. et J. BARTRAM, (Éditeurs), E & FP Spon, London, pp. 41-111.
- SKULBERG O.M., W.W. CARMICHAEL, G.A. CODD et R. SKULBERG (1993). Taxonomie des cyanophycées toxiques (cyanobactéries). Les toxines d'algues dans les produits de la mer et l'eau potable. Falconer I.R. (Éditeur). Academic Press, San Diego, Californie, CA, États-Unis, pp.145-164.
- SMITH V.H. (1986). Light and nutrient effects on the relative biomass of blue-green algae in lake phytoplankton. Can. J. Fish. Aquat. Sci., 43, 148-153.
- TONK L., (2005). The microcystin composition of the cyanobacterium Planktothrix agardhii changes toward a more toxic variant with increasing light intensity. Appl. Environ. Microbiol., 71, 5177-5181.
- TSUJI K., T. WATANUKI, F. KONDO, MF. WATANABE, H. NAKAZAWA, M. SUZUKI, H. UCHIDA et K.I. HARADA (1997). Stability of microcystins from cyanobacteria in effect of chlorination on decomposition. Toxicon, 35, 1033-1041.
- VEZIE C., F. BENOUFELLA, K. SIVONEN, G. BERTRU et A. LAPLANCHE (1996). Detection of toxicity of cyanobacterial strains using Artemia salina and microtox assays compared with mouse bioassay results. Phycologia, 35, 198-202.
- WATANABE M.F. et S. OISHI (1985). Effects of environmental factors on toxicity of cyanobacterium Microcystis aeruginosa under culture conditions. Appl. Environ. Microbiol., 49, 1342-1344.
- WHO (1998). Cyanobacterial toxins: microcystin-LR. Dans : Guidelines for drinking water quality. 2e édition, Addendum au vol. 2, Health criteria and other supporting information. World Health Organization, Genève, Suisse, pp. 95-110.
- YU S.J. (1995). Primary prevention of hepatocellular carcinoma. J. Gastroenterol. Hepatol., 10, 674-682.
- ZHANG H., J. ZHANG et Y. ZHU (2009). Identification of microcystins in waters used for daily life by people who live on Tai Lake during a serious cyanobacteria dominated bloom with risk analysis to human health. Environ. Toxicol., 24, 82-86.
- ZIDANE F., K. CHEGGARI, J.F. BLAIS, P. DROGUI, J. BENSAID et S. IBN AHMED (2010). Contribution à l’étude de l’effet de la coagulation avant chloration sur la formation des trihalométhanes (THM) et composés organohalogénés (COX) dans les eaux alimentant la ville de Casablanca au Maroc. Rev. Can. Genie Civ., 37, 1-8.
Liste des figures
Figure 1
Carte du Maroc représentant les sites de prélèvement (a) Retenue de barrage SMBA (eau brute), (b) Réservoir de stockage de Tit Mellil (eau traitée).
Map of Morocco representing sites of sample (a) of dam SMBA (raw water) (b) storage reservoir of Tit Méllil (treated water).
Figure 2
Courbe d’étalonnage du % de la PP2A en fonction de la concentration de Microcystine–LR (ng•L-1).
Calibration curve of the % of PP2A according to the concentration of Microcystin–LR (ng•L-1)
Figure 3
Variation temporelle de la concentration de microcystines dissoutes et intracellulaires dans l'eau brute et traitée par rapport au seuil recommandé par l’OMS.
Temporal variation of the dissolved and intracellular microcystins concentrations in raw and treated water in comparison with the threshold recommended by the WHO.
Figure 4
Variation temporelle de la concentration de microcystines dissoutes dans l'eau traitée à l’entrée et à la sortie du réservoir du stockage.
Temporal variation of dissolved microcystin concentrations in treated water at the entrance and exit of the storage reservoir.
Liste des tableaux
Tableau 1
Caractéristiques morphologiques, hydrologiques, de l’eau de retenue du barrage Sidi Mohammed Ben Abdellah.
Morphological and hydrological characteristics of the waters of Sidi Mohammed Ben Abdellah dam.
Tableau 2
État de la qualité des eaux de retenue du barrage SMBA (eau brute) comparée à la norme française et du réservoir de Tit Mellil (eau traitée) comparée aux normes marocaines d’eau potable NM 03.7.001.
Quality of the waters of the SMBA dam (raw water) compared with the French water quality standards and of the waters of the Tit Mellil reservoir (treated water) compared with the Moroccan drinking water standard NM 03.7.001.