Résumés
Résumé
La spéciation physique des métaux rejetés par les effluents d’eaux usées municipales est fortement influencée par les conditions physico-chimiques des eaux réceptrices. Les zones de rejet d’effluents municipaux sont des milieux riches en matières organiques où les métaux sont susceptibles d’être fortement complexés et où la présence de colloïdes peut modifier la bioaccumulation et la biodisponibilité des métaux. La distribution de métaux (Al, Cd, Cu, Fe, Mn, Ag et Zn) a été déterminée dans les fractions dissoute (< 0,45 µm), colloïdale (< 0,45 µm et > 10 kDa) et perméable (ultrafiltrée < 10 kDa) à différents sites le long du panache de dispersion de l’effluent municipal majeur de la ville de Montréal. Les concentrations de métaux sous formes colloïdale et perméable sont généralement élevées près du point de rejet de l’effluent étudié. À cause du type de traitement des eaux usées utilisé par la ville de Montréal, ce rejet est une source importante de fer et plus de 70 % du fer dissous se retrouve sous forme colloïdale. Parmi les métaux traces étudiés, l’Ag, suivi du Cu, étaient les plus fortement associés aux colloïdes près du point de rejet de l’effluent. Les colloïdes, présents dans la phase dite dissoute ou filtrable, peuvent influencer différemment le transport et le devenir des métaux rejetés. La proportion colloïdale diminue toutefois rapidement comparativement à celle perméable lors du mélange des eaux usées avec les eaux réceptrices, ce qui semble indiquer que cette fraction a une importance limitée dans le transport à longue distance des métaux provenant de l’effluent. Les résultats de cette étude précisent le rôle des colloïdes dans le devenir géochimique des métaux lors du mélange des eaux usées de l’effluent avec les eaux réceptrices. L’étude souligne donc l’importance d’évaluer la spéciation physique des métaux dans une étude d’impact environnemental d’une zone de rejet urbain.
Mot-clés:
- métal,
- colloïde,
- perméable,
- devenir,
- eaux réceptrices,
- eaux usées municipales,
- ultrafiltration,
- taille
Abstract
The physical speciation of metals contained in municipal effluents is significantly influenced by the physical and chemical conditions of the receiving water. Waters in the immediate area of an effluent outfall are rich in organic matter; metals are largely complexed and the abundance of colloids can modify metal bioavailability and bioaccumulation. The distributions of aluminum (Al), cadmium (Cd), copper (Cu), iron (Fe), manganese (Mn), silver (Ag) and zinc (Zn) were determined in the dissolved (< 0.45 µm), colloidal (< 0.45 µm and > 10 kDa) and permeable fractions (ultrafiltered < 10 kDa) at different points within the dispersion plume of the major effluent from the Montreal treatment plant. Concentrations of colloidal and permeable metals were typically high near the effluent outfall. Because of the treatment process used by the City of Montreal, this effluent is a major source of Fe and more than 70% of dissolved Fe is present in colloidal form. Of the metals studied, Ag was most associated with colloids near the outfall, followed by Cu. Colloids found in the so-called dissolved or filterable phase can influence the transport and fate of discharged metals in different ways. The colloidal proportion, however, declines rapidly during the mixing of wastewater with receiving water, which seems to suggest that this fraction, by its lower abundance, could have limited influence on the long-range transport of metals released by the effluent. Our results provide information on the role of colloids in determining the geochemical fate of metals contained in wastewater once they are released to the receiving environment. The study highlights the importance of physical speciation in the assessment of the environmental impact of urban effluents on discharge areas.
Key words:
- metal,
- colloid,
- permeable,
- fate,
- receiving waters,
- municipal wastewaters,
- ultrafiltration,
- size
Corps de l’article
1. Introduction
Les effluents municipaux représentent une source majeure de contaminants chimiques dans l’environnement aquatique (CHAMBERS et al., 1997). Plusieurs études ont montré que des métaux et des substances organiques sont largement présents dans les effluents municipaux (p. ex., GOBEIL et al., 2005; MINISTÈRE DE L’ENVIRONNEMENT DU QUÉBEC et ENVIRONNEMENT CANADA, 2001). L’évaluation des impacts environnementaux des métaux provenant des effluents d’eaux usées municipales requiert une connaissance des caractéristiques chimiques et physiques des eaux réceptrices qui affectent l’absorption des métaux par les organismes aquatiques exposés. Ces caractéristiques physico-chimiques influencent la spéciation des métaux tant particulaires que dissous et, par conséquent, leur biodisponibilité et leur toxicité (GAGNON et SAULNIER, 2003; LIJKLEMA et al., 1993; VIGNEAULT et al., 2005). L’ensemble des processus géochimiques influe significativement sur la distribution des métaux dans les phases dissoute et particulaire dans le panache de dispersion des effluents d’eaux usées municipales (GAGNON et SAULNIER, 2003; KARVELAS et al., 2003). Il est nécessaire de mieux déterminer la spéciation tant chimique que physique des métaux afin de mieux évaluer leur devenir et leur biodisponibilité dans l’environnement récepteur de ces rejets (BUZIER et al., 2006; CAMPBELL et al., 1988; GAGNON et FISHER, 1997; LUOMA, 1983; WANG et al., 1997). La phase dissoute des métaux peut être une importante voie d’exposition pour les organismes aquatiques, particulièrement les filtreurs (CARPENE et GEORGE, 1981; GAGNON et al., 2006). Par contre, on a observé, suite à une exposition de moules encagées, que la biodisponibilité des métaux dans le panache de dispersion d’un important effluent municipal était particulièrement faible près de son point de rejet (GAGNON et al., 2006).
Dans l’environnement aquatique, les métaux traces sont distribués en différentes phases (particulaire, colloïdale et dissoute) et les relations entre ces phases influencent le devenir des métaux et, par conséquent, les impacts de ces derniers sur le milieu. Par exemple, l’échange lent de métaux entre les fractions dissoute et particulaire peut se produire par l’agrégation de colloïdes (FARLEY et MOREL, 1986). De plus, les métaux associés aux ligands de faible poids moléculaire de la phase dissoute ont un temps de résidence élevé dans les eaux et peuvent être transportés sur de plus grandes distances, comparativement aux métaux associés à de très petites particules comme les colloïdes (SIGG et al., 2000). L’association des métaux aux colloïdes peut diminuer leur biodisponibilité pour certains organismes aquatiques (GAGNOnet al., 2006; GUO et al., 2001; PAN et WANG, 2004). Les métaux associés aux colloïdes doivent ainsi être considérés distinctement de ceux qui sont perméables (vraiment dissous). Cette dernière fraction doit faire l’objet d’un intérêt particulier pour en arriver à une meilleure évaluation écotoxicologique d’un rejet (CARVALHO et al., 1999; KOUKAL et al., 2003; RAN et al., 2000; VIGNATI et al., 2005; WANG et GUO, 2000).
La distribution des tailles des métaux traces est donc une caractéristique complémentaire de leur spéciation chimique et est importante pour comprendre leur devenir environnemental et leurs impacts sur les organismes aquatiques (MULLER, 1996; SANUDO-WILHELMY et al., 1996; SIGG et al., 2000). Avec les méthodes traditionnelles utilisées pour séparer les phases dissoute et particulaire au moyen d’un filtre de porosité de 0,45 µm, les colloïdes (< 0,45 µm et > 10 kDa) sont inclus dans la fraction dite dissoute. Cette absence de séparation entre la fraction colloïdale et la fraction perméable peut avoir certaines conséquences dans les études portant sur le devenir et le comportement de contaminants dans l’environnement aquatique. Ainsi, on reconnaît de plus en plus l’importance distincte des phases perméable et colloïdale sur le devenir biogéochimique des métaux traces dans l’environnement aquatique (CARVALHO et al., 1999; PAN et WANG, 2004; RODITI et al., 2000).
Le rôle des colloïdes dans la complexation des métaux a été étudié dans divers systèmes aquatiques (BENOIT et al., 1994; BUFFLE, 1988; SANUDO-WILHELMY et al., 1996; SIGG et al., 2000). La plupart de ces études portent sur les eaux naturelles (p. ex. PHAM et GARNIER, 1998; RAN et al., 2000; SIGG et al., 2000; VIGNATI et al., 2005) et les eaux de ruissellement urbaines (p. ex. GROUT et al., 1999; TUCCILLO, 2006), et l’effet des colloïdes sur les associations métalliques dans un milieu aquatique contaminé par des eaux usées municipales est peu connu. Cette étude détermine la distribution des métaux le long du panache de dispersion de l’effluent urbain de la ville de Montréal, le plus important rejet d’eaux usées municipales dans le fleuve Saint-Laurent, et évalue l’importance de la spéciation physique des métaux sur leur devenir dans les eaux réceptrices.
2. Méthodes
2.1 Échantillonnage de l’eau
Le panache de dispersion a déjà été caractérisé par une évaluation à l’aide de traceurs pour les effluents municipaux, comme les coliformes fécaux et totaux (GAGNÉ et al., 2001) (Figure 1). Deux campagnes d’échantillonnage ont été menées sur le panache au cours de deux années consécutives, soit en 2001 et en 2002. L’eau de surface a été échantillonnée à différents sites couvrant une distance de 0,5 à 15 km en aval du point de rejet de l’effluent de la ville de Montréal, soit l’effluent municipal majeur se déversant dans le fleuve Saint-Laurent (Figure 1). Des échantillons d’eau de référence ont aussi été prélevés à une station située à 1 km en amont du point de rejet afin de connaître les conditions initiales des eaux réceptrices. Les échantillons d’eau de surface ont été prélevés à l’aide d’une pompe en téflon préalablement lavée à l’acide selon la méthode d’échantillonnage requise pour les métaux traces décrite par COSSA et al. (1996). Les paramètres physico-chimiques comme le pH et la conductivité ont été mesurés sur le site à l’aide d’une multisonde YSI 63 (YSI Environmental), tandis que le potentiel d’oxydo-réduction (potentiel redox, EH) a été évalué avec une électrode de potentiel d’oxydo-réduction (ORP; Cole-Parmer™) calibrée à l’aide d’une solution Zobell.
2.2 Analyses des échantillons d’eau
Les échantillons d’eau (1,5 L) ont été filtrés sur des membranes de téflon de 0,45 µm de porosité (diamètre 47 mm, Millipore™ Type FH) afin de séparer les phases dissoute et particulaire. Ensuite, une partie des échantillons filtrés sur 0,45 µm a aussi été ultrafiltrée afin de séparer la fraction colloïdale à haut poids moléculaire (> 10 kDa) de la fraction perméable, de plus faible poids moléculaire (< 10 kDa) (Tableau 1). Le système d’ultrafiltration à flux tangentiel était composé d’une pompe péristaltique et d’une cartouche de cellulose régénérée (Millipore Prep/Scale™-TFF 1 pi2) donnant une séparation à 10 kDa. La pression sur la membrane a été maintenue entre 97 et 110 kPa durant l’ultrafiltration. Le débit de l’eau était réglé à environ 6 L/min avant le début de l’ultrafiltration. Les échantillons d’eau filtrés et ultrafiltrés ont ensuite été acidifiés (0,2 % HNO3, Baseline Quality Seastar) et conservés dans des bouteilles en polyéthylène faible densité (LDPE) préalablement lavées à l’acide (COSSA et al., 1996). Les métaux ont été quantifiés par ICP-Spectroscopie de masse (modèle 4500 Argilent) avec les isotopes suivants : 56Fe, 27Al, 63Cu, 111Cd, 55Mn, 66Zn et 107Ag. Les teneurs en matières particulaires en suspension (MPS), en carbone organique dissous (COD) et particulaire (COP) et les autres paramètres explicatifs ont aussi été déterminés selon des méthodes standards (APHA 1998; COSSA et al., 1998).
Figure 1
Carte du site d’étude montrant les stations d’échantillonnage le long du panache de dispersion de l’effluent municipal de la ville de Montréal (Québec).
Map of the study site showing sampling stations along the dispersion plume of the municipal effluent of the City of Montreal (Quebec).
Tableau 1
Définition des tailles des phases étudiées.
Definition of studied fraction sizes.
Fraction |
Taille |
|---|---|
Particulaire |
> 0,45 µm |
Dissous ou filtrable |
< 0,45 µm (Perméable + colloïdale) |
Colloïdale |
< 0,45 µm et > 10kDa |
Perméable ou vraiment dissous |
< 10 kDa |
2.2.1 Assurance de qualité et contrôle de qualité
Toutes les filtrations des échantillons d’eau pour les analyses de métaux traces ont été exécutées en salle blanche de classe 100 (COSSA et al., 1996). Les activités d’assurance de qualité incluaient le traitement régulier de blancs de réactifs et l’utilisation de matériaux de référence. La précision et l’exactitude des analyses de métaux traces dans les phases dissoute et ultrafiltrée ont été évaluées à l’aide de matériaux de référence internes. Pour tous les métaux, la précision, exprimée par le coefficient de variation, était de 12 % au maximum. L’exactitude, pour tous les métaux, était comprise entre 82 % et 100 %. Des matériaux de référence internes ont été utilisés pour l’évaluation de la reproductibilité et de la récupération des analyses de MPS, de COD et de COP. Pour ces trois paramètres, le coefficient de variation était égal ou supérieur à 5 % et la récupération variait entre 85 % et 95 %.
3. Résultats et discussion
3.1 Caractéristiques physico-chimiques des eaux
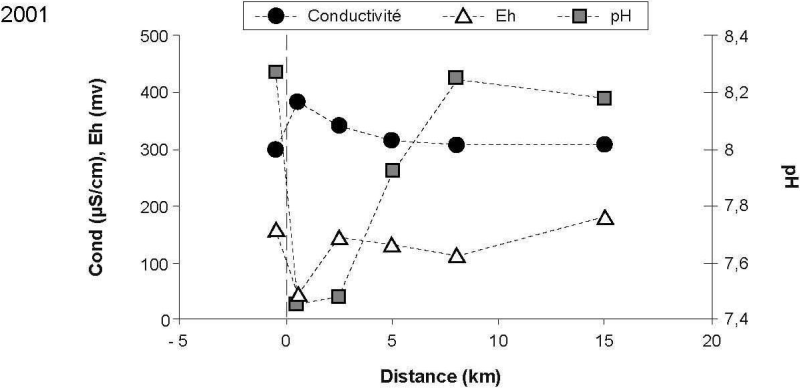
Les paramètres tels que le pH, la conductivité et le potentiel rédox (EH) ont été mesurés afin de caractériser le mélange des eaux usées avec les eaux réceptrices du fleuve Saint-Laurent (Figure 2). La conductivité des eaux du fleuve (station de référence) variait de 270 à 298 µS/cm pour les deux campagnes. Près du point de rejet (0,5 km en aval), des valeurs de conductivité de plus de 350 µS/cm ont été mesurées. En raison de la dilution des eaux usées de l’effluent, la conductivité observée dans le panache de dispersion à 5 km en aval du point de rejet était redevenue semblable à la valeur de référence.
Près du point de rejet de l’effluent, les valeurs de pH diminuaient rapidement pour atteindre des valeurs d’environ 7,5 alors que le pH mesuré des eaux réceptrices du fleuve Saint-Laurent était de 8,3‑8,4 (Figure 2). Après le mélange des eaux usées avec celles du fleuve, les valeurs observées dans le panache de dispersion à 8 km en aval du rejet redevenaient similaires à celles mesurées à la station de référence en amont.
Figure 2
Variations des paramètres physico-chimiques (conductivité, pH, Eh) dans le panache de dispersion de l’effluent. (a) 2001; (b) 2002.
Variations in physico-chemical parameters (conductivity, pH, Eh) in the effluent dispersion plume. (a) 2001; (b) 2002).
(a)
(b)
Les valeurs de potentiel rédox (EH) observées (Figure 2) dans le panache de dispersion montrent bien le mélange des eaux usées avec celles bien oxygénées du fleuve (8,9 mg/L O2, données non publiées). Le EH des eaux réceptrices (référence) était de plus de 150 mV et chutait à près de 50 mV au voisinage du point de rejet, et ce, même après une distance de dilution de 0,5 km. La forte demande chimique et biologique en oxygène de ces eaux usées explique cette variation de EH observée au point de rejet. Ensuite, le mélange avec les eaux réceptrices oxygénées permet aux valeurs de EH des eaux du panache de dispersion de revenir rapidement (~2 km en aval) près des valeurs de référence.
Les matières particulaires en suspension (MPS) ainsi que le carbone organique dissous (COD) et particulaire (COP) ont aussi été mesurés afin de caractériser les eaux réceptrices et celles de l’effluent et de mieux comprendre leur influence sur le devenir des métaux déversés par ce rejet (Figure 3). Ces paramètres illustrent l’enrichissement des eaux réceptrices par l’effluent. Les concentrations de COD, de COP et de MPS mesurées en aval du point de rejet sont plus élevées que celles observées à la station de référence, et ce, par des facteurs d’enrichissement de 3,3, 15 et 3,4 respectivement, en 2001, et de 1,6, 5,7 et 1,6 en 2002. Suivant le mélange avec les eaux réceptrices, ces concentrations diminuent jusqu’à des niveaux similaires à ceux observés en amont du point de rejet. La variation des concentrations reflète la dilution des eaux usées qui s’effectue le long du panache de dispersion. La longueur de la zone de mélange, influencée par les conditions hydrologiques, variait de 2,5 à 8 km, d’une campagne d’échantillonnage à l’autre. GAGNON et SAULNIER (2003) ont constaté une dilution de 75 % du panache de 0,5 km à 5 km en aval du point de rejet, alors que 90 % de la dilution de l’effluent était atteinte dans les dix premiers kilomètres du panache de dispersion.
3.2 Distribution des métaux majeurs dans les eaux réceptrices
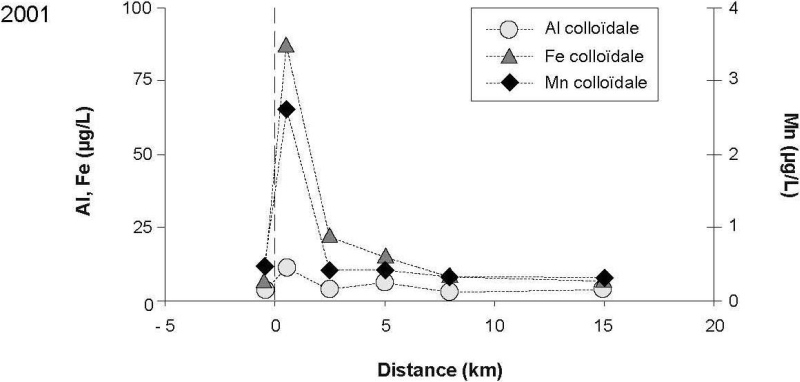
L’effluent constitue un apport de fer (Fe) dans les eaux réceptrices du fleuve Saint-Laurent. De fortes concentrations de Fe dissous (108 µg/L en 2001 et 33 µg/L en 2002) ont été mesurées près du point de rejet (0,5 km en aval). Les eaux de l’effluent étudié sont riches en fer en raison des procédés de traitement par floculation qui utilisent principalement le chlorure ferrique (FeCl3) (<http://services.ville.montreal.qc.ca/ station>). Il est à noter que les plus faibles valeurs de Fe dissous mesurées au point de rejet lors de la campagne de 2002 seraient expliquées par l’utilisation variable des floculants FeCl3 et alun. Par contre, l’effluent rejetait de plus fortes quantités d’aluminium (Al) dissous lors de cette campagne comparativement à celle de 2001. Le fer dans ces eaux rejetées, suite à son parcours dans l’émissaire de 5 km de long, serait partiellement sous forme réduite et dissoute puisque le milieu serait anoxique en raison de la forte demande biologique et chimique en oxygène (GAGNON et SAULNIER, 2003). Au point de rejet dans les eaux réceptrices, des changements de conditions d’oxydo-réduction sont vraisemblables et les variations du potentiel redox (EH) observées le long du panache de dispersion (Figure 2) témoignent de ce changement de conditions. Ainsi, lors du mélange des eaux usées de plus faible potentiel redox avec les eaux réceptrices bien oxygénées du fleuve Saint-Laurent, les formes colloïdales du fer et, de façon similaire, du manganèse (Mn), sont susceptibles d’être produites comme formes intermédiaires de l’oxydation de ces éléments et de leur transformation en oxydes et hydroxydes de Fe et de Mn.
Figure 3
Variations des concentrations de matières particulaires en suspension (MPS) et de carbone organique dissous (COD) et particulaire (COP). (a) 2001; (b) 2002.
Variations in concentrations of suspended particulate matter (MPS) and dissolved (COD) and particulate organic carbon (COP). (a) 2001; (b) 2002.
(a)
(b)
Ainsi, malgré l’apport considérable en Fe dissous, la fraction perméable du Fe demeurait faible en proportion (< 20 %) près du point de rejet, avec des concentrations atteignant 21 µg/L et 8 µg/L, respectivement, pour les campagnes de 2001 et 2002 (Figure 3). De telles proportions où la fraction colloïdale des métaux Al et Fe excédait 84 % de la concentration totale dissoute ont déjà été rapportées (SANUDO-WILHELMY et al., 1996).
Le manganèse, un autre élément sensible aux changements de conditions d’oxydo-réduction du milieu, présentait des profils semblables à ceux du Fe dissous le long du panache de dispersion (Figure 4). Ainsi, des teneurs en Mn dissous atteignant 7 µg/L ont été mesurées près du point de rejet. Contrairement au cas du Fe, la majorité (> 85 %) du Mn dissous était sous forme perméable et demeurait en grande proportion perméable dans la zone de mélange de l’effluent. La complexation du Mn (II) par des constituants organiques de faibles poids moléculaires (p. ex. substances fulviques) et inorganiques (p. ex. carbonates) et sa cinétique d’oxydation plus lente pourraient expliquer sa présence préférentielle sous forme perméable.
L’effluent est aussi une source d’Al dissous pour les eaux réceptrices. La concentration d’Al dissous près du point de rejet était de 94 µg/L comparativement à 9 µg/L à la station de référence pour la campagne de 2002 (Figure 4). Près du point de rejet, l’Al dissous était en grande proportion (> 60 %) sous forme perméable. Seule la zone de mélange à proximité du point de rejet (les deux premiers kilomètres) présentait des teneurs en Al perméable relativement élevées (jusqu’à plus de 60 µg/L) en 2002, tandis que la valeur de référence à la station en amont atteignait 5 µg/L. Alors que les concentrations d’Al dissous diminuaient rapidement le long du panache, celles d’Al perméable demeuraient relativement constantes aux stations situées plus en aval.
3.3 Distributions des métaux traces dans les eaux réceptrices
Tous les métaux dissous totaux étudiés, sans exception, étaient en plus grandes concentrations près du point de rejet de l’effluent comparativement à la station de référence (amont) (Figure 4). Les valeurs maximales observées dans le panache de dispersion pour les métaux traces cadmium (Cd), cuivre (Cu), argent (Ag) et zinc (Zn) étaient respectivement de 0,02, 5,5, 0,09 et 3,6 µg/L. D’importants facteurs d’enrichissement en métaux totaux dissous ont ainsi été observés à 0,5 km du rejet, comparativement à la station de référence. Pour la campagne 2001, ces facteurs étaient de 2,5, 3,7, 9 et 4, respectivement, pour le Cd, le Cu, l’Ag et le Zn. Dans le cas de la campagne de 2002, ces valeurs étaient de 1,7, 4,1, 41 et 5,8, respectivement.
En général, les concentrations de métaux dissous totaux (< 0,45 µm) diminuaient rapidement le long du panache de dispersion de l’effluent (Figure 4). On a déjà rapporté que les concentrations de métaux de la phase dissoute diminuent radicalement par rapport à celles de la phase particulaire dans les cinq premiers kilomètres de la zone de mélange (GAGNON et SAULNIER, 2003). Cette contribution en métaux est importante pour le fleuve Saint-Laurent, du moins localement, lorsqu’on la compare aux concentrations ambiantes relativement faibles rapportées pour ce système aquatique (COSSA et al., 1998; GOBEIL et al., 2005; QUÉMERAIS et LUM, 1997). Toutefois, les formes chimiques des métaux rejetés et leur proportion assimilable par la faune et la flore aquatiques représentent des informations essentielles pour une évaluation plus complète des impacts potentiels de ce type de rejet de métaux, évaluation considérant mieux la biodisponibilité, la bioaccumulation et, finalement, la toxicité des métaux rejetés.
Figure 4
Distribution des métaux dissous et perméables dans le panache de dispersion de l’effluent. (a) Al, Fe; (b) Cd, Ag; (c) Cu, Zn.
Distribution of dissolved and permeable metals in the effluent dispersion plume . (a) Al, Fe; (b) Cd, Ag; (c) Cu, Zn.
(a)
(b)
(c)
Les distributions des métaux traces perméables (c.-à-d. < 10 kDa), accompagnées de celles de la phase dissoute (< 0,45 µm), sont présentées à la figure 4. Les concentrations relativement faibles de certains métaux dans la fraction perméable par rapport à l’ensemble de la fraction dissoute peuvent souligner l’importance des colloïdes dans la distribution des métaux. Les distributions des métaux dans la fraction colloïdale (c.-à-d. > 10 kDa et < 0,45 µm) sont présentées à la figure 5. En général, les plus grandes proportions de métal colloïdal sont observées près du point de rejet de l’effluent. Les distributions des concentrations de métaux colloïdaux observées indiquent que cette forme ne serait abondante que près du point de rejet (0,5 km en aval). Ainsi, à cette distance, des valeurs de concentration maximale de 0,01, 3,2, 0,08 et 1,5 µg/L ont été mesurées respectivement pour le Cd, le Cu, l’Ag et le Zn. Par exemple, 65 % du Cd dissous et 96 % de l’Ag dissous ont été mesurés sous forme colloïdale près du point de rejet tandis que près de la moitié du Cu et du Zn était sous forme colloïdale (Tableau 2). Il a été rapporté que la fraction colloïdale de l’Ag pouvait excéder 84 % de la concentration dissoute dans les eaux naturelles (SANUDO-WILHELMY et al., 1996). Ce métal réactif a été mesuré en proportion significative (30‑35 %) dans la fraction colloïdale (< 0,45 µm et > 10 kDa) d’échantillons d’eau provenant du panache de dispersion d’un effluent (ADAMS et KRAMER, 1999).
Figure 5
Distribution des métaux colloïdaux dans le panache de dispersion de l’effluent. (a) Al, Fe; (b) Ag, Cd.
Distribution of colloidal metals in the effluent dispersion plume. (a) Al, Fe; (b) Ag, Cd.
(a)
(b)
À partir de taux de dilution estimés par la variation de la conductivité et des concentrations mesurées, des concentrations en métaux dissous et perméables ont été simulées le long du panache de dispersion. La comparaison des résultats simulés avec ceux mesurés, sous forme de ratio mesuré/estimé, a été utilisée pour évaluer le comportement conservateur ou non des métaux lors de la dilution des eaux usées dans les eaux réceptrices (Tableau 3). Nos résultats montrent que la dilution est le facteur principal pour expliquer la décroissance des concentrations en métaux le long du panache. Cependant, les ratios calculés indiquent un certain enrichissement de la phase dissoute et perméable pour l’Al et le Cd. L’enrichissement de la fraction perméable suite au mélange des eaux est beaucoup plus marqué dans le cas du Cd. Ces augmentations indiqueraient une remobilisation de ces métaux associés aux particules ou colloïdes lors du mélange. D’autres métaux comme le Fe, Mn, Ag, Cu et Zn semblent avoir été partiellement adsorbés ou précipités, comme l’indiquent les ratios de valeur moindre que 1. Le Fe et le Mn ont potentiellement été transformés principalement en formes plus oxydées tandis que l’Ag, le Cu et le Zn ont été adsorbés par les particules et colloïdes de nature organique ou piégés par les oxydes de Mn et Fe nouvellement formés. L’Ag et le Zn présentent un comportement d’un élément relativement plus réactif que le Cu. Ainsi malgré que le facteur principal soit la dilution des eaux, les variations observées dans les concentrations de certains métaux résultent partiellement de leur réactivité et leur comportement peu conservateur dans le panache de dispersion.
La forte présence de colloïdes peut influencer la biodisponibilité des métaux (GUO et al., 2001). Certains métaux comme l’Ag et le Cd - lesquels peuvent avoir une plus grande affinité pour les colloïdes (PHAM et GARNIER, 1998) - ont été rapportés être moins biodisponibles près du point de rejet de cet effluent comparativement à un site de référence dans le fleuve Saint-Laurent (GAGNON et al., 2006). Dans le cas du Cu, une forte relation entre la fraction colloïdale et celle non-labile vis-à-vis une résine Chelex a été observée et indiquerait une plus faible réactivité du Cu associé aux colloïdes (SHAFER et al., 2004). Ces observations pourraient suggérer que les formes du métal pourraient être moins assimilables par les organismes aquatiques près du point de rejet.
Tableau 2
Proportion (%) de la fraction colloïdale (< 10 kDa) dans la phase dissoute (< 0,45 µm) (2001).
Percentage of colloidal fraction (< 10 kDa) in the dissolved phase (< 0.45 µm) (2001).
|
% colloïdale |
||||||
|---|---|---|---|---|---|---|---|
|
Distance (km) |
Al |
Fe |
Mn |
Cd |
Ag |
Cu |
Zn |
‑0.5 |
43 |
86 |
64 |
- |
20 |
20 |
9 |
0.5 |
22 |
81 |
22 |
65 |
96 |
60 |
42 |
2.5 |
10 |
76 |
6 |
44 |
83 |
26 |
32 |
5 |
23 |
83 |
17 |
58 |
88 |
28 |
34 |
8 |
23 |
80 |
23 |
70 |
42 |
25 |
15 |
15 |
33 |
78 |
27 |
47 |
- |
27 |
54 |
Tableau 3
Ratios des concentrations mesurées/simulées pour les fractions dissoute et perméable (2001).
Measured: simulated concentration ratios for the dissolved and permeable fractions (2001).
|
Ratio |
|||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Al |
Fe |
Mn |
Cd |
Ag |
Cu |
Zn |
|||||||
|
Distance (km) |
D |
P |
D |
P |
D |
P |
D |
P |
D |
P |
D |
P |
D |
P |
2,5 |
1,3 |
1,6 |
0,5 |
0,6 |
1,0 |
1,2 |
0,6 |
1,4 |
0,8 |
1,2 |
0,5 |
0,8 |
1,1 |
1,1 |
5 |
1,7 |
1,8 |
0,7 |
0,8 |
0,8 |
1,0 |
1,2 |
3,8 |
0,7 |
0,3 |
0,8 |
0,9 |
0,9 |
0,8 |
8 |
1,1 |
1,3 |
0,6 |
0,9 |
0,7 |
0,8 |
1,1 |
4,0 |
0,7 |
0,9 |
0,8 |
0,9 |
0,4 |
0,4 |
15 |
1,1 |
1,1 |
0,5 |
1,0 |
0,6 |
0,7 |
1,9 |
13 |
0,2 |
0,8 |
0,8 |
0,9 |
0,5 |
0,3 |
D : fraction dissoute (< 0,45 µm)
P : fraction perméable (< 10 kDa)
Ratio : concentration mesurée/concentration simulée
Malgré les concentrations observées relativement élevées pour la fraction colloïdale des métaux en tête du panache de dispersion, cette fraction devient progressivement beaucoup moins importante plus en aval le long du panache. En général, après seulement 5 km, les concentrations de métaux dissous totaux sont faibles et sont similaires à celles mesurées dans les eaux de référence du fleuve (station en amont du point de rejet) (Figure 5). Ainsi, les concentrations de métaux perméables et colloïdaux observées à ces distances sont semblables à celles mesurées à la station de référence. Ces observations indiqueraient que cet effluent majeur aurait peu d’influence sur la concentration et la spéciation physique des métaux dans le fleuve au-delà de 5 à 8 km en aval du point de rejet.
3.4 Coefficient de distribution de phase des métaux
La répartition des métaux traces entre les phases particulaire et dissoute est généralement définie par le coefficient de distribution Kd1. Les valeurs calculées de Kd1, variant de 3 x 103 à 3 x 105 (Tableau 4), étaient similaires à celles observées dans d’autres systèmes aquatiques (BENOIT et al., 1994; SANUDO-WILHELMY et al., 1996). Ces coefficients Kd1 traditionnels (c.-à-d. qui incluent, pour le calcul, les colloïdes dans la phase dissoute) tendent à diminuer avec une augmentation de la concentration de particules (BENOIT, 1995; SANUDO-WILHELMY et al., 1996). Cette relation entre le Kd1 et la concentration de matières particulaires en suspension peut être expliquée par la séparation incomplète des espèces colloïdales de celles perméables (c.-à-d. vraiment dissoutes) (BENOIT et al., 1994; BENOIT, 1995).
Un coefficient de distribution qui exclut la fraction colloïdale a donc été calculé pour les métaux, soit le coefficient Kd2 calculé entre la fraction particulaire et la fraction perméable (< 10 kDa) (Tableau 4). Les valeurs calculées étaient comparables à celles obtenues dans un système d’eau de surface à l’équilibre (PHAM et GARNIER, 1998). La présence de métaux associés aux colloïdes affecte le coefficient de distribution phase particulaire-phase dissoute (Kd1). Les valeurs de Kd2 (qui excluent les colloïdes) étaient, dans tous les cas, nettement supérieures à celles de Kd1 près du point de rejet, ce qui indique une contribution des colloïdes du rejet à la fraction des métaux adsorbés sur l’ensemble du matériel (particules et colloïdes) en suspension. Par contre, les valeurs de Kd1 et de Kd2 étaient très similaires en amont du rejet. La différence de valeurs de coefficient dans le panache de dispersion était généralement la plus marquée (5 %‑20 %) près du point de rejet (0,5 km), zone où de plus fortes concentrations de métaux colloïdaux et de COD ont été observées. Parmi les métaux traces étudiés, l’Ag présentait les plus grands écarts entres les deux types de coefficients, écarts qui pourraient être principalement expliqués par son affinité pour les colloïdes (PHAM et GARNIER, 1998).
Tableau 4
Coefficients de distribution de phase des métaux traces (Kd1 et Kd2)(2001).
Partitioning coefficients (Kd1 and Kd2) of trace metals (2001).
|
Distance (km) |
Cd |
Cu |
Ag |
Zn |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
[M]pa (mg/kg) |
log Kd1b |
log Kd2c |
[M]p (mg/kg) |
log Kd1 |
log Kd2 |
[M]p (mg/kg) |
log Kd1 |
log Kd2 |
[M]p (mg/kg) |
log Kd1 |
log Kd2 |
|
‑1 |
0,77 |
4,78 |
-- |
74 |
4,49 |
4,58 |
0,1 |
3,48 |
3,57 |
346 |
5,37 |
5,41 |
0,5 |
4,24 |
5,32 |
5,78 |
482 |
4,94 |
5,34 |
19,7 |
5,34 |
6,69 |
356 |
4,99 |
5,23 |
2,5 |
3,42 |
5,50 |
5,75 |
354 |
5,19 |
5,32 |
14,3 |
5,47 |
6,23 |
247 |
4,91 |
5,08 |
5 |
2,30 |
5,05 |
5,43 |
211 |
4,83 |
4,98 |
6,2 |
5,33 |
6,26 |
233 |
5,02 |
5,20 |
8 |
1,14 |
4,86 |
5,38 |
99 |
4,59 |
4,72 |
2,8 |
5,16 |
5,40 |
167 |
5,35 |
5,42 |
15 |
0,89 |
4,56 |
4,87 |
77 |
4,58 |
4,72 |
0,8 |
5,31 |
5,01 |
181 |
5,38 |
5,72 |
[M]p : Concentration de métaux particulaires (tiré de Gagnonet al., 2006)
Kd1 : [M]p (mg/kg)/[M] dissous (mg/L)
Kd2 : [M]p (mg/kg)/[M] perméable (mg/L)
La comparaison de ces deux types de coefficient aux valeurs relativement semblables dans le panache peut aussi suggérer que la nature chimique des surfaces contrôle les propriétés d’adsorption tant des particules que des colloïdes. Ces deux types de particules (grosses particules et colloïdes) possèderaient des densités semblables de sites d’adsorption de métaux (SANUDO-WILHELMY et al., 1996), où l’échange métallique peut se produire par l’agrégation de colloïdes (FARLEY et MOREL, 1986).
4. Conclusions
De façon générale, la fraction perméable des métaux était relativement faible près du point de rejet de l’effluent et pourrait donc être considérée comme moins assimilable pour les organismes aquatiques dans cette zone. Les métaux traces Ag et Cu semblaient être les plus associés aux colloïdes près du point de rejet, zone plus riche en carbone organique dissous. Toutefois, les proportions de métaux colloïdaux et perméables diminuaient rapidement dans la zone de dispersion, allant jusqu’à 2,5 km à 5 km du point de rejet, puis atteignaient des niveaux semblables à ceux des eaux du fleuve Saint-Laurent. Cette contribution en métaux est importante pour le fleuve Saint-Laurent, du moins dans la zone de mélange, lorsque comparée aux faibles concentrations ambiantes des eaux réceptrices. Les changements observés dans la spéciation physique des métaux traces dans le panache de dispersion de ce rejet majeur soulignent l’importance de distinguer la phase perméable (vraiment dissoute) de l’ensemble des espèces dissoutes pour une meilleure évaluation environnementale d’un rejet municipal.
Parties annexes
Remerciements
Nous remercions L. Gougeon, I. Saulnier, M. Arseneau et G. Brault pour leur aide lors des travaux d’échantillonnage et en laboratoire. La révision linguistique de ce document a été faite par S. Lalonde. Ce projet a été financé par le Centre Saint-Laurent d’Environnement Canada dans le cadre de son programme de recherche sur les rejets urbains.
Références bibliographiques
- ADAMS N.W.H. et J.R. KRAMER (1999). Silver speciation in wastewater effluent, surface water, and porewaters. Environ. Sci. Technol., 18, 2667-2673.
- APHA (1998). Standard methods for the examination of water and wastewater. 20e édition, Clesceri L.S., Greenberg A.E., Eaton A.P. (Éditeurs), Baltimore, MD, États-Unis.
- BENOIT G. (1995). Evidence of the particle concentration effect for lead and other metals in fresh waters based on ultraclean technique analyses. Geochim. Cosmochim. Acta, 59, 2677‑2687.
- BENOIT G., S.D. OKTAY-MARSHALL, A.L. CANTU, E.M. HOOD, C.H. COLEMAN, M.O. CORAPCIOGLU et P.H. SANTSCHI (1994). Partitioning of Cu, Pb, Ag, Zn, Fe, Al and Mn between filter-retained particles, colloids and solution in six Texas estuaries. Mar. Chem., 45, 307-336.
- BUFFLE J., R.A. CHARLMERS, M.R. MASON et D. MIDGLEY (1988). Complexation reactions in aquatic systems, an analytical approach. Elis Horwood Ltd (Éditeur), Chichester, West Sussex, Grande-Bretagne.
- BUZIER R., M.-H. TUSSEAU-VUILLEMIN et J.-M. MOUCHEL (2006). Evaluation of DGT film as a metal speciation tool in wastewater. Sci. Total. Environ., 358, 277-285.
- CAMPBELL P.G.C., A.G. LEWIS, P.M. CHAPMAN, A.A. CROWDER, W.K. FLETCHER, B. IMBER, S.N. LUOMA, P.M. STOKES et M. WINFREY (1988). Biologically available metals in sediments. NRCC No 27694. National Research Council of Canada, Ottawa, ON, Canada.
- CARVALHO R.A., M.C. BENFIELD et P.H. SANTSCHI (1999). Comparative bioaccumulation studies of colloidally complexed and free-ionic heavy metals in junevile brown shrimp Penaeus aztecus (Crustacea: Decapoda: Denaeidae). Limnol. Oceanogr., 44, 403-414.
- CARPENE E. et S.G. GEORGE (1981). Adsorption of cadmium by gills of Mytilus edulis. Mol. Physiol., 1, 23-24.
- CHAMBERS P.A., M. ALLARD, S.L. WALKER, J. MARSALEK, J. LAWRENCE, M. SERVOS, J. BUSNARDA, K.S. MUNGER, C. JEFFERSON, R.A. KENT, M.P. WONG et K. ADARE (1997). Impacts of municipal wastewater effluents on Canadian waters: A review. Water Qual. Res. J. Can., 32, 659-713.
- COSSA D., B. RONDEAU, T.T. PHAM, S. PROULX et B. QUÉMERAIS (1996). Principes et pratiques d’échantillonnage d’eaux naturelles en vue du dosage de substances et d’éléments présents à l’état de traces et ultra-traces. Environnement Canada – Région du Québec, Conservation de l’environnement, Centre Saint-Laurent, Montréal, QC, Canada. Rapport scientifique et technique ST-5, 28 p.
- COSSA D., T.T. PHAM, B. RONDEAU, B. QUÉMERAIS, S. PROULX et C. SURETTE (1998). Bilan massique des contaminants chimiques dans le fleuve Saint-Laurent. Environnement Canada – Région du Québec, Conservation de l’environnement, Centre Saint-Laurent, Montréal, QC, Canada.. Rapport scientifique et technique ST-163, 258 p.
- FARLEY K.J. et F.M.M. MOREL (1986). Role of coagulation in sedimentation kinetics. Environ. Sci. Technol., 20, 187‑195.
- GAGNÉ F., D.J. MARCOGLIESE, C. BLAISE et A.D. GENDRON (2001). Occurrence of compounds estrogenic to freshwater mussels in surface waters in an urban area. Environ. Toxicol., 16, 260-268.
- GAGNON C. et N.S. FISHER (1997). The bioavailability of sediment-bound Cd, Co and Ag to the mussel Mytilus edulis. Can. J. Fish. Aquat. Sci., 54, 147-156.
- GAGNON C. et I. SAULNIER (2003). Distribution and fate of metals in the dispersion plume of a major municipal effluent. Environ. Pollut., 124, 47-55.
- GAGNON C., F. GAGNÉ, P. TURCOTTE, I. SAULNIER, C. BLAISE, M. SALAZAR et S. SALAZAR (2006). Metal exposure to caged mussels in a primary-treated municipal wastewater plume. Chemosphere, 62, 998-1010.
- GOBEIL C., B. RONDEAU et L. BEAUDIN (200)5. Contribution of municipal effluents to metal fluxes in the St. Lawrence river. Environ. Sci. Technol., 39, 456-464.
- GROUT H., M.R. WIESNER et J.-Y. BOTTERO (1999). Analysis of colloidal phases in urban stormwater runoff. Environ. Sci. Technol., 33, 831-839.
- GUO L., B.J. HUNT, P.H. SANTSCHI et S.M. RAY (2001). Effects of dissolved organic matter on the uptake of trace metals by American oysters. Environ. Sci. Technol., 35, 885-893.
- KARVELAS M., A. KATSOYIANNIS et C. SAMARA (2003). Occurrence and fate of heavy metals in the wastewater treatment process. Chemosphere, 53, 1201-1210.
- KOUKAL B., C. GUÉGUEN, M. PARDOS, J. DOMINIK (2003). Influence of humic substances on the toxic effects of cadmium and zinc to the green alga. Chemosphere, 53, 953-961.
- LIJKLEMA L., J.M. TYSON et A. LESOU (1993). Interactions between sewers, treatment plants and receiving waters in urban areas: A summary of the INTERURBA’92 workshop conclusions. Water Sci. Technol., 27, 1-29.
- LUOMA S.N. (1983). Bioavailability of trace metals to aquatic organisms - A review. Sci. Tot. Environ., 28, 1-22.
- Ministère de l’Environnement du Québec et Environment Canada, 2001. Toxic potential assessment of municipal wastewater treatment plant effluents in Quebec: Final report. St. Lawrence Vision 2000, Phase III - Industrial and Urban component, 136 p. + annexes.
- Muller F.L.L. (1996). Interactions of copper, lead and cadmium with the dissolved, colloidal and particulate components of estuarine and coastal waters. Mar. Chem., 52, 245-268.
- PAN J.-F. et W.-X. WANG (2004). Influences of dissolved and colloidal organic carbon on the uptake of Ag, Cd, and Cr by the marine mussel Perna viridis. Environ. Pollut., 129, 467-477.
- PHAM M.K. et J.-M. GARNIER (1998). Distribution of trace elements associated with dissolved compounds (< 0.45 um ‑ 1.0 nm) in freshwater using coupled (frontal cascade) ultrafiltration and chromatographic separations. Environ. Sci. Technol., 32, 440-449.
- QUÉMERAIS B. et K.R. LUM (1997). Distribution and temporal variation of cadmium in the St. Lawrence River bassin. Aquat. Sci., 59, 243-259.
- RAN Y., J.M. FU, G.Y. SHENG, R. BECKETT et B.T. HART (2000). Fractionation and composition of colloidal and suspended particulate materials in rivers. Chemosphere, 41, 33-43.
- RODITI H.A., N.S. FISHER et S.A. SANUDO-WILHELMY (2000). Uptake of dissolved organic carbon and trace elements by zebra mussels. Nature, 407, 78-80.
- SANUDO-WILHELMY S.A., I. RIVERA-DUARTE et A.R. FLEGAL (1996). Distribution of colloidal trace metals in the San Francisco Bay estuary. Geochim. Cosmochim. Acta, 60, 3218-3225.
- SHAFER M.M., S.R. HOFFMANN, J.T. OVERDIER et D.E. ARMSTRONG (2004). Physical and kinetic speciation of copper and zinc in three geochemically contrasting marine estuaries. Environ. Sci. Technol., 38, 3810-3819.
- SIGG L., H. XUE, D. KISTLER et R. SCHÖNENBERGER (2000). Size distribution (dissolved, colloidal and particulate) of trace metals in the Thur River, Switzerland. Aquat. Geochem., 6, 413-434.
- TUCCILLO M.E. (2006). Size fractionation of metals in runoff from residential and highway storm sewers. Sci. Tot. Environ., 355, 288-300.
- VIGNATI D.A.L., T. DWORAK, B. FERRARI, B. KOUKAL, J.-L. LOIZEAU, M. MINOUFLET, M.I. GAMUSSO, S. POLESELLO et J. DOMINIK (2005). Assessment of the geochemical role of colloids and their impact on contaminant toxicity in freshwaters: An example for the Lambro-Po System (Italy). Environ. Sci. Technol., 39, 489‑497.
- VIGNEAULT B., C. GAGNON et P. TURCOTTE (2005). Modelling the fate and the geochemistry of Cd, Cu and Zn from effluent discharges in receiving waters. Proc. of 8th International Conference on the Biogeochemistry of Trace Elements. LOMBI E. (Éditeur). Adelaide, Australia. pp. 594-595.
- WANG W.-X. et L. GUO (2000). Influences of natural colloids on metal bioavailability to two marine bivalves. Environ. Sci. Technol., 34, 4571-4576.
- WANG W.-X., S.B. GRISCOM et N.S. FISHER (1997). Bioavailability of Cr(III) and Cr(VI) to marine mussels from solute and particulate pathways. Environ. Sci. Technol., 31, 603-611.
Liste des figures
Figure 1
Carte du site d’étude montrant les stations d’échantillonnage le long du panache de dispersion de l’effluent municipal de la ville de Montréal (Québec).
Map of the study site showing sampling stations along the dispersion plume of the municipal effluent of the City of Montreal (Quebec).
Figure 2
Variations des paramètres physico-chimiques (conductivité, pH, Eh) dans le panache de dispersion de l’effluent. (a) 2001; (b) 2002.
Variations in physico-chemical parameters (conductivity, pH, Eh) in the effluent dispersion plume. (a) 2001; (b) 2002).
(a)
(b)
Figure 3
Variations des concentrations de matières particulaires en suspension (MPS) et de carbone organique dissous (COD) et particulaire (COP). (a) 2001; (b) 2002.
Variations in concentrations of suspended particulate matter (MPS) and dissolved (COD) and particulate organic carbon (COP). (a) 2001; (b) 2002.
(a)
(b)
Figure 4
Distribution des métaux dissous et perméables dans le panache de dispersion de l’effluent. (a) Al, Fe; (b) Cd, Ag; (c) Cu, Zn.
Distribution of dissolved and permeable metals in the effluent dispersion plume . (a) Al, Fe; (b) Cd, Ag; (c) Cu, Zn.
(a)
(b)
(c)
Liste des tableaux
Tableau 1
Définition des tailles des phases étudiées.
Definition of studied fraction sizes.
Fraction |
Taille |
|---|---|
Particulaire |
> 0,45 µm |
Dissous ou filtrable |
< 0,45 µm (Perméable + colloïdale) |
Colloïdale |
< 0,45 µm et > 10kDa |
Perméable ou vraiment dissous |
< 10 kDa |
Tableau 2
Proportion (%) de la fraction colloïdale (< 10 kDa) dans la phase dissoute (< 0,45 µm) (2001).
Percentage of colloidal fraction (< 10 kDa) in the dissolved phase (< 0.45 µm) (2001).
|
% colloïdale |
||||||
|---|---|---|---|---|---|---|---|
|
Distance (km) |
Al |
Fe |
Mn |
Cd |
Ag |
Cu |
Zn |
‑0.5 |
43 |
86 |
64 |
- |
20 |
20 |
9 |
0.5 |
22 |
81 |
22 |
65 |
96 |
60 |
42 |
2.5 |
10 |
76 |
6 |
44 |
83 |
26 |
32 |
5 |
23 |
83 |
17 |
58 |
88 |
28 |
34 |
8 |
23 |
80 |
23 |
70 |
42 |
25 |
15 |
15 |
33 |
78 |
27 |
47 |
- |
27 |
54 |
Tableau 3
Ratios des concentrations mesurées/simulées pour les fractions dissoute et perméable (2001).
Measured: simulated concentration ratios for the dissolved and permeable fractions (2001).
|
Ratio |
|||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Al |
Fe |
Mn |
Cd |
Ag |
Cu |
Zn |
|||||||
|
Distance (km) |
D |
P |
D |
P |
D |
P |
D |
P |
D |
P |
D |
P |
D |
P |
2,5 |
1,3 |
1,6 |
0,5 |
0,6 |
1,0 |
1,2 |
0,6 |
1,4 |
0,8 |
1,2 |
0,5 |
0,8 |
1,1 |
1,1 |
5 |
1,7 |
1,8 |
0,7 |
0,8 |
0,8 |
1,0 |
1,2 |
3,8 |
0,7 |
0,3 |
0,8 |
0,9 |
0,9 |
0,8 |
8 |
1,1 |
1,3 |
0,6 |
0,9 |
0,7 |
0,8 |
1,1 |
4,0 |
0,7 |
0,9 |
0,8 |
0,9 |
0,4 |
0,4 |
15 |
1,1 |
1,1 |
0,5 |
1,0 |
0,6 |
0,7 |
1,9 |
13 |
0,2 |
0,8 |
0,8 |
0,9 |
0,5 |
0,3 |
D : fraction dissoute (< 0,45 µm)
P : fraction perméable (< 10 kDa)
Ratio : concentration mesurée/concentration simulée
Tableau 4
Coefficients de distribution de phase des métaux traces (Kd1 et Kd2)(2001).
Partitioning coefficients (Kd1 and Kd2) of trace metals (2001).
|
Distance (km) |
Cd |
Cu |
Ag |
Zn |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
[M]pa (mg/kg) |
log Kd1b |
log Kd2c |
[M]p (mg/kg) |
log Kd1 |
log Kd2 |
[M]p (mg/kg) |
log Kd1 |
log Kd2 |
[M]p (mg/kg) |
log Kd1 |
log Kd2 |
|
‑1 |
0,77 |
4,78 |
-- |
74 |
4,49 |
4,58 |
0,1 |
3,48 |
3,57 |
346 |
5,37 |
5,41 |
0,5 |
4,24 |
5,32 |
5,78 |
482 |
4,94 |
5,34 |
19,7 |
5,34 |
6,69 |
356 |
4,99 |
5,23 |
2,5 |
3,42 |
5,50 |
5,75 |
354 |
5,19 |
5,32 |
14,3 |
5,47 |
6,23 |
247 |
4,91 |
5,08 |
5 |
2,30 |
5,05 |
5,43 |
211 |
4,83 |
4,98 |
6,2 |
5,33 |
6,26 |
233 |
5,02 |
5,20 |
8 |
1,14 |
4,86 |
5,38 |
99 |
4,59 |
4,72 |
2,8 |
5,16 |
5,40 |
167 |
5,35 |
5,42 |
15 |
0,89 |
4,56 |
4,87 |
77 |
4,58 |
4,72 |
0,8 |
5,31 |
5,01 |
181 |
5,38 |
5,72 |
[M]p : Concentration de métaux particulaires (tiré de Gagnonet al., 2006)
Kd1 : [M]p (mg/kg)/[M] dissous (mg/L)
Kd2 : [M]p (mg/kg)/[M] perméable (mg/L)