Résumés
Résumé
Après avoir été longtemps dépendante des pesticides, l’agriculture mondiale est aujourd’hui frappée par un courant qui favorise des pratiques plus durables et plus respectueuses de l’environnement. Pour répondre à ces nouvelles exigences, les agriculteurs doivent se tourner vers l’exploitation et la rentabilisation des ressources naturelles par le biais de pratiques agricoles combinant la performance et la protection des cultures à un moindre coût écologique. Dans ce contexte, le développement de molécules biologiques capables de stimuler les défenses naturelles des végétaux (SDN) est une stratégie qui attire de plus en plus l’attention. Une molécule SDN est un éliciteur susceptible de déclencher une série d’évènements biochimiques menant à l’expression de la résistance chez la plante. La perception du signal par des récepteurs membranaires spécifiques et sa transduction par diverses voies de signalisation conduisent à la synthèse et à l’accumulation synchronisée de molécules défensives parmi lesquelles certaines jouent un rôle structural alors que d’autres exercent une fonction antimicrobienne directe. Les barrières structurales contribuent à retarder la progression de l’agent pathogène dans les tissus de la plante et à empêcher la diffusion de substances délétères telles des enzymes de dégradation des parois ou des toxines. Les mécanismes biochimiques incluent, entre autres, la synthèse de protéines de stress et d’inhibiteurs de protéases ainsi que la production de phytoalexines, des métabolites secondaires ayant un fort potentiel antimicrobien. Les progrès remarquables accomplis ces dernières années en termes de compréhension des mécanismes impliqués dans la résistance induite chez les plantes se traduisent aujourd’hui par la commercialisation d’un nombre de plus en plus important de SDN capables de stimuler le « système immunitaire » des plantes en mimant l’effet des agents pathogènes.
Mots-clés :
- Agriculture durable,
- barrières structurales,
- éliciteur,
- inhibiteurs de protéase,
- perception du signal,
- phytoalexines,
- protection des plantes,
- protéines de stress,
- résistance induite végétale,
- SDN (stimulateurs des défenses naturelles des plantes),
- transduction du signal
Abstract
For a long time, agriculture across the world was dependent on pesticides. Today, it is influenced by a movement that favours practices that are more sustainable and environmentally safe. To meet these new demands, producers wishing to exploit natural resources and make them profitable must turn to new agronomic practices that combine culture performance and protection at a low environmental cost. In this context, the development of biological molecules able to stimulate natural defence mechanisms in plants (or SDN, for “stimulateurs des défenses naturelles des plantes”) is a strategy that attracts much attention. A SDN molecule is an elicitor capable of initiating a series of biochemical events leading to the expression of disease resistance in plants. Signal perception by ultra-specific membrane receptors and its transduction by diverse signalling pathways lead to the synthesis and synchronized accumulation of defence molecules; some of these molecules play a structural role while others have a direct antimicrobial function. Structural barriers contribute to delaying pathogen ingress in plant tissues and prevent the diffusion of deleterious substances such as cell wall hydrolytic enzymes or toxins. Biochemical mechanisms include, among others, the synthesis of stress proteins and protease inhibitors as well as the production of phytoalexins, which are secondary metabolites with a strong antimicrobial potential. The remarkable advances made over the last few years as regards our understanding of the mechanisms involved in induced resistance in plants now translate into the marketing of an increasing number of SDN molecules able to stimulate a plant’s “immune system” by mimicking the effect of pathogens.
Keywords:
- Elicitor,
- phytoalexins,
- plant induced resistance,
- plant protection,
- protease inhibitors,
- SDN (“stimulateurs des défenses naturelles des plantes”),
- signal perception,
- signal transduction,
- stress proteins,
- structural barriers,
- sustainable agriculture
Corps de l’article
Introduction
À une époque où l’industrie agricole mondiale est en plein essor et où ses ventes atteignent une valeur estimée à plusieurs milliards de dollars, un nouveau type de production et de protection des cultures se profile à l’horizon. Ce système se caractérise par de profondes mutations et surtout par la conception d’une agriculture écologiquement intensive. Pour répondre aux préoccupations environnementales et sociales, les pays industrialisés se sont en effet engagés dans une phase de transition menant à l’intégration progressive de nouvelles pratiques susceptibles de préserver les services écosystémiques assurés par les ressources naturelles de notre planète. Puisque les agriculteurs dépendent d’un large éventail de services écosystémiques et qu’ils en produisent également un nombre important, la gestion durable des ressources naturelles est devenue l’un des principaux enjeux du XXIe siècle. La réduction de la dépendance du secteur agricole envers les intrants chimiques est incontestablement l’un des plus importants défis auquel devront faire face les producteurs au cours des prochaines années.
La conception d’une telle transition implique nécessairement le développement de nouvelles solutions alternatives en accord avec la notion de développement durable. Ces alternatives aux intrants chimiques regroupées sous le vocable générique de biopesticides tardent cependant à s’implanter massivement sur le marché et font souvent l’objet de débats tant en raison d’un niveau de protection des cultures jugé insuffisant pour certains qu’en raison des risques biologiques que l’introduction de microorganismes vivants dans l’environnement pourrait générer. Pourtant, cette prise de conscience et la volonté politique en matière de réduction des risques associés à une utilisation abusive de pesticides font qu’aujourd’hui les filières agricole et horticole n’ont souvent d’autre choix que de s’engager activement dans la voie du biocontrôle pour minimiser la pollution environnementale et l’impact négatif des produits chimiques sur la santé humaine.
L’agriculture mondiale est donc aujourd’hui soumise à un triple défi : produire plus, développer de nouvelles cultures et, surtout, produire autrement pour répondre aux attentes d’un public de plus en plus sensibilisé à sa santé et aux risques environnementaux. Selon les spécialistes mondiaux en la matière, les agriculteurs devront inévitablement s’adapter à des contraintes que l’on voit déjà se profiler : la hausse des prix de l’énergie, l’ouverture des marchés internationaux, le retrait du marché de plusieurs fongicides à large spectre, les changements climatiques et l’émergence de nouvelles maladies. Pourtant, on estime qu’il faudra doubler la production agricole au cours des 50 prochaines années puisque la population mondiale ne cesse de croître et qu’elle devrait atteindre les 9 milliards en 2050. Pour répondre à de telles exigences, les agriculteurs n’auront d’autre choix que de se tourner vers l’exploitation et la rentabilisation des ressources naturelles dans le cadre de nouvelles pratiques agricoles combinant la performance et la protection des cultures à un moindre coût écologique. Un tel enjeu s’avère d’autant plus complexe que la plupart des variétés cultivées ont été sélectionnées sur la base de deux critères essentiels, soit la productivité et la qualité organoleptique, sans réellement tenir compte de leur capacité à résister aux agents pathogènes. Les avancées scientifiques des dernières années permettent cependant d’envisager l’avenir avec un certain optimisme, car de nouvelles pratiques sont initiées pour sortir de cette impasse. En effet, diverses stratégies incluant la lutte biologique (par l’utilisation de microorganismes antagonistes), l’introduction de gènes de résistance aux maladies par croisement ou par génie génétique (production d’organismes génétiquement modifiés, ou OGM) et la stimulation du « système immunitaire » des plantes par des produits biologiques ou synthétiques (comme le benzothiadiazole, ou BTH) appelés éliciteurs ou stimulateurs des défenses naturelles (SDN) sont de plus en plus considérées comme des approches phytosanitaires capables d’assurer une protection efficace des maladies tout en réduisant les risques de pollution environnementale.
N’étant pas dotées d’un système immunitaire aussi élaboré que dans le règne animal, au sein duquel des cellules circulantes assurent la défense de l’organisme (ex. : lymphocytes), les plantes répondent aux agressions biotiques (invasion microbienne, insectes ravageurs, herbivores) et abiotiques (froid, gel, sécheresse, etc.) par la synthèse d’une variété de molécules organiques ayant la capacité d’agir de façon directe (biochimique) ou indirecte (structurale) sur l’envahisseur microbien (Benhamou 2009; Klarzynski et Fritig 2001). L’expression globale de la résistance est la résultante d’une synergie d’action coordonnée dans le temps et dans l’espace entre tous les mécanismes de défense, qu’ils soient directs ou indirects. Parmi les mécanismes indirects se retrouvent le renforcement pariétal par incrustation de molécules polysaccharidiques, comme la callose, de métabolites issus du sentier des phénylpropanoïdes, comme la lignine et les composés phénoliques, et des protéines et glycoprotéines structurales, comme les glycoprotéines riches en hydroxyproline (HRGPs). Ce renforcement pariétal se traduit le plus souvent par la formation de nouvelles barrières dénommées papilles ou appositions pariétales qui contribuent fortement à retarder la progression de l’agent pathogène dans les tissus de la plante et à empêcher la diffusion de substances délétères telles des enzymes de dégradation des parois ou des toxines (Aist 1976). Les mécanismes directs incluent, entre autres, la synthèse de nouvelles protéines telles que des protéines de stress, des enzymes et des inhibiteurs de protéases ainsi que la production de phytoalexines, des métabolites secondaires ayant un potentiel antimicrobien (Benhamou 2009).
Dans le contexte de l’affrontement entre les deux protagonistes, la vitesse avec laquelle la plante réagit à l’attaque microbienne est un paramètre fondamental dans le devenir de l’interaction. À la base même de ce concept est née l’hypothèse selon laquelle « immuniser » préalablement une plante avec un agent inducteur de résistance pourrait générer une protection accrue, dans certains cas systémique et durable, contre l’agresseur lui-même ou encore contre d’autres agresseurs potentiels (Kùc 1987; Lafontaine et Benhamou 1996). Ce concept, lié à l’idée qu’une sensibilisation préalable du système défensif de la plante (principe similaire à celui de la vaccination) peut engendrer une résistance accrue contre une attaque subséquente par un agent pathogène, a été confirmé par l’observation d’une réduction substantielle des symptômes causés par des parasites racinaires à la suite de l’introduction dans la rhizosphère de certains microorganismes reconnus pour leur action bénéfique sur la croissance végétale (Benhamou et al. 1996c; Wei et al. 1994). Les agents inducteurs de résistance chez les plantes sont de nature diverse et peuvent aussi bien inclure des facteurs physiques que des facteurs biologiques, microbiens ou de synthèse (Ebel et Cosio 1994). Bien qu’on puisse penser a priori que la réponse des plantes à ces agents inducteurs soit généralisée, plusieurs études indiquent des différences aussi bien qualitatives que quantitatives quant à la synthèse et à l’accumulation des molécules de défense, indiquant donc une spécificité liée à la nature même de la plante hôte. Ces observations conduisent aujourd’hui à penser que des voies différentes de transduction sont empruntées pour transmettre au génome de la plante le signal donné par un agent inducteur particulier. Cette possibilité est attrayante puisqu’elle pourrait mener à une amplification de la réponse de la plante par l’utilisation d’au moins deux, voire plusieurs agents inducteurs. On pourrait alors parler de protection écointégrée, une notion qui représente l’un des enjeux majeurs pour l’agriculture du XXIe siècle puisque cette approche permettrait de bénéficier de l’efficacité des pesticides tout en préservant l’environnement des résidus toxiques.
Le non-renouvellement de l’homologation de nombreux produits phytosanitaires chimiques et l’introduction concomitante sur le marché des premiers SDN des plantes ont largement contribué à créer, dans le monde agricole, l’espoir de disposer enfin de produits phytosanitaires plus écologiques. En effet, l’utilisation rationnelle de ces bioproduits sur des plantes cultivées à grand intérêt économique, comme la vigne (Vitis vinifera L.), permettrait de réduire substantiellement la quantité de pesticides nécessaire à la protection d’une culture. Ainsi, certaines de ces substances stimulatrices de réactions de défense naturelle sont déjà utilisées en culture maraîchère, mais toutes ne sont malheureusement pas disponibles et encore moins homologuées par des instances officielles. Cependant, leur innocuité prétendue permet d’envisager une ouverture prochaine des marchés, car elles représentent l’une des meilleures solutions à l’objectif « zéro résidu de pesticide » dans les légumes. Malgré tout, le fait que la production de SDN soit en cours de développement industriel en Europe et en Amérique du Nord donne, dans le contexte socioéconomique actuel, un élan certain à ce passionnant champ de recherche et de développement.
La résistance chez les plantes
Au cours de leur évolution, toutes les plantes ont élaboré un véritable « système immunitaire » capable de déceler un danger, que ce dernier soit de nature biotique (microorganisme pathogène, insecte ravageur) ou abiotique (pluie, grêle, gel, vent). En l’absence des lymphocytes et anticorps que l’on retrouve dans le système immunitaire humain, le « système phytoimmunitaire » se distingue par la variété des molécules de défense qu’il produit en réponse à un stress. Cette stratégie défensive, activée par l’agression, conduit à des modifications considérables de l’activité métabolique des cellules végétales, se traduisant par une cascade d’événements destinés à restreindre la progression des agents infectieux et à réduire les dommages causés par des blessures.
On retrouve chez les plantes deux types de résistance : la résistance passive, impliquant des barrières préformées ou constitutives dont la plante s’est dotée à la suite d’une adaptation climatique, et la résistance active, impliquant des barrières nouvellement formées en réponse au stress.
La résistance passive
Chaque plante possède, de façon naturelle, une variété de moyens de défense constitutifs. Ces mécanismes varient d’une plante à l’autre, car ils sont très souvent le résultat d’une adaptation temporelle à des conditions climatiques ou environnementales particulières. Ainsi, les feuilles des plantes poussant dans des zones tropicales auront tendance à être recouvertes d’une cuticule plus épaisse que celles poussant sous des climats pluvieux. De la même façon, les plantes aromatiques qui poussent à l’état sauvage dans les pays méditerranéens ont une concentration plus élevée en métabolites secondaires (huiles essentielles) en raison de leur adaptation à une certaine sècheresse du sol sur une longue période. La résistance passive, responsable de la protection des plantes à la plupart des agents pathogènes et des prédateurs auxquels elles sont confrontées en permanence, existe donc chez toutes les plantes, mais à des degrés divers. Elle se divise en deux grandes catégories : 1) les barrières structurales constitutives et 2) les substances chimiques préformées.
Les barrières structurales constitutives représentent le premier obstacle qu’un agent pathogène rencontre avant son contact avec les parois des cellules épidermiques de la plante où s’effectuera le premier niveau de reconnaissance responsable du devenir de l’interaction. Les virus et les bactéries pénètrent ces barrières de façon purement passive en profitant de microblessures causées, par exemple, par les piqûres d’insectes, la pluie, le gel ou les oiseaux. Les champignons pathogènes peuvent aussi traverser ces barrières de façon passive, mais ils ont également acquis au cours de leur évolution la capacité de produire des enzymes susceptibles d’hydrolyser certains composés structuraux de ces barrières. Parmi toutes les barrières constitutives présentes chez les plantes, la cuticule est probablement la structure de protection la plus efficace. Composée de cutine, un polymère insoluble intimement imbriqué dans un réseau de cires (Jeffree 1996), la cuticule est hydrophobe. La plupart des champignons pathogènes ont acquis la capacité de traverser cet obstacle au moyen d’enzymes spécifiques que l’on nomme cutinases (Iwasaki et Hioki 1988). Les autres barrières structurales susceptibles de contrer la progression d’un agent pathogène sont représentées par les poils, les trichomes, les épines et les aiguillons.
Les barrières chimiques constitutives sont fabriquées continuellement, même en l’absence d’agents pathogènes. Au sein de ces molécules, appelées phytoanticipines, sont regroupés les composés phénoliques, les alcaloïdes, les lactones, les saponines, les glycosides cyanogéniques et les huiles. Les composés phénoliques regroupent une large gamme de substances possédant un noyau aromatique comportant des résidus hydroxyles (OH-) ainsi que leurs dérivés fonctionnels (Nicholson et Hammerschmidt 1992). Il y a quatre principales familles de composés phénoliques : les acides phénoliques simples, comme le catéchol et l’acide protocatéchuique, les flavones, l’acide chlorogénique et les quinones (King et Young 1999). Les composés phénoliques sont bien connus pour leur potentiel antifongique et antibactérien. En règle générale, les composés phénoliques peuvent avoir un effet délétère sur : 1) la germination des spores; 2) la croissance mycélienne; 3) la production d’enzymes hydrolytiques comme les pectinases; et 4) la synthèse et l’activité biologique des toxines fongiques (par une détoxification).
Lorsque cette résistance dite passive (parce qu’elle est constitutive) est insuffisante pour contrer une attaque par des agents biotiques ou abiotiques particulièrement agressifs, une résistance active se met alors en place ayant pour objectif la destruction de l’agresseur ou, à tout le moins, son confinement au site de pénétration potentielle. La résistance induite, dite active parce qu’elle est induite en réponse à un stress, est un phénomène très bien synchronisé au plan spatiotemporel. Elle est la résultante de toute une cascade d’évènements cytomoléculaires impliquant une large gamme de molécules produites de façon coordonnée, selon divers sentiers métaboliques.
La résistance active
Lorsqu’un agent pathogène réussit à contourner la première ligne de défense passive (ex. : la cuticule), un nouveau système de résistance se met en place au moment où il est détecté par la plante ayant pour unique objectif le confinement de l’agresseur dans les cellules attaquées; la plante est prête, dans certains cas, à sacrifier ces cellules pour assurer sa survie. Cette confrontation plante–agent pathogène est responsable de l’activation de plusieurs voies métaboliques pour : 1) renforcer les barrières externes, comme la paroi, afin de retarder ou même d’empêcher la pénétration de l’agent pathogène; et 2) favoriser la création d’un environnement toxique au cas où le parasite parviendrait à franchir les barrières structurales nouvellement formées. Bien que les modalités de la résistance soient variables (résistance généralisée ou spécifique), on assiste dans tous les cas à un scénario relativement identique au cours duquel les cellules végétales, ayant perçu une alarme, réagissent en émettant à leur tour des signaux d’alerte (Fig. 1). Ces cellules « alertées » s’activent pour élaborer une stratégie défensive qui sera coûteuse sur le plan énergétique.
Figure 1
Schéma illustrant l’induction des gènes de défense chez les plantes.
La résistance spécifique est une résistance dite génétique selon la théorie « gène pour gène » découverte par Flor (1971). Pour que la plante soit résistante à un agent pathogène spécifique, les deux protagonistes doivent posséder des gènes complémentaires : un gène de résistance R pour la plante et un gène d’avirulence Avr pour l’agent pathogène. L’interaction entre les produits (ou leurs dérivés) de ces deux gènes (R et Avr) conduit à une résistance spécifique se traduisant par une réaction hypersensible (RH) caractérisée par une lésion nécrotique des cellules végétales aux sites agressés (Fig. 1). L’absence ou l’altération de l’un ou l’autre des gènes conduit inévitablement à la manifestation des symptômes de la maladie.
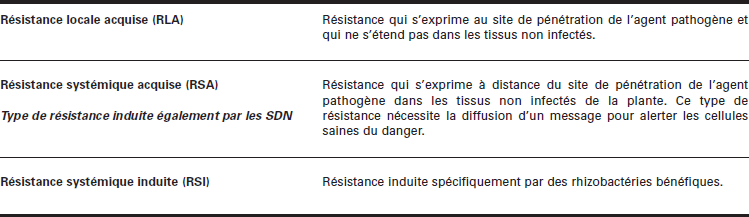
La résistance généralisée ou non spécifique, quant à elle, peut s’exercer au niveau local (résistance locale acquise, ou RLA), c’est-à-dire au site de l’agression, ou au contraire se propager à distance des cellules attaquées. On parle alors de résistance systémique acquise (RSA), un phénomène de résistance générale induite qui protège efficacement la plante contre son agresseur initial et la rend également plus performante envers d’autres attaques potentielles (Tableau 1).
Tableau 1
Les trois types de résistance active chez les plantes
La résistance non spécifique
Toutes les plantes, même si elles ne possèdent pas de gène R de résistance, ont la capacité de se défendre contre un agresseur. En revanche, la rapidité avec laquelle s’exprime la réponse de la plante est, sans nul doute, le critère le plus crucial dans l’issue d’une interaction plante–agent pathogène puisqu’il déterminera l’établissement de la résistance ou l’expression de la maladie. Cependant, dans tous les cas, la résistance d’une plante ne peut se manifester qu’à la suite d’une infection préalable par un agent pathogène ou d’un traitement avec un produit capable de mimer une situation de stress. On parle alors de résistance généralisée ou de résistance non spécifique, car les stratégies mises en place par la plante ne sont pas seulement ciblées contre l’agresseur ayant déclenché la machinerie, mais plutôt contre tout agresseur éventuel. Ainsi, la réponse de la plante s’inscrit dans une dualité d’action où la priorité est, dans un premier temps, de limiter la progression de l’agent pathogène envahisseur, voire de le détruire (RLA), et, dans un deuxième temps, d’alerter les cellules voisines afin qu’elles préparent activement leur propre défense (RSA). Il existe un troisième type de résistance non spécifique exclusivement induite par des rhizobactéries bénéfiques : la résistance systémique induite (RSI) (Tableau 1).
La résistance systémique acquise (RSA). Dans les années 1930, Chester mentionnait déjà la possibilité qu’une « immunité physiologique acquise » puisse exister chez les plantes (Chester 1933). Il faudra cependant attendre les années 1960 pour que Ross reprenne ce concept, l’explicite et introduise les termes de « résistance locale acquise » et de « résistance systémique acquise » (Ross 1961a, b). Ross sera donc le premier à démontrer qu’un plant de tabac (Nicotiana tabacum L.) initialement infecté avec le virus de la mosaïque du tabac est protégé contre une infection virale subséquente. Dans le même ordre d’idée, d’autres chercheurs apporteront un nouvel éclairage à la notion de prémunition en prouvant que cette dernière est efficace non seulement contre l’agent pathogène qui l’a initiée, mais aussi contre une large gamme d’autres agents pathogènes (Sticher et al. 1997).
L’expression de la RSA implique nécessairement la diffusion du message de stress en direction des tissus sains. Plusieurs molécules, appelées des messagers secondaires, ont été identifiées sans pour autant connaître avec précision leur rôle exact. Par exemple, l’acide salicylique, un composé phénolique de faible poids moléculaire, a longtemps été considéré comme le candidat idéal pour assurer cette signalisation (Gaffney et al. 1993). Les raisons ayant conduit à croire en l’implication majeure de l’acide salicylique dans le processus de diffusion du signal résultent de plusieurs observations. Ainsi, des dosages de l’acide salicylique ont montré que sa concentration augmentait considérablement (x 100) chez plusieurs plantes à la suite d’une attaque par un agent pathogène (Yalpani et al. 1993). Par ailleurs, plusieurs chercheurs ont montré qu’un traitement exogène d’acide salicylique était capable d’induire la RSA, même en l’absence d’infection (Vernooij et al. 1994). Il a également été rapporté que des plants de tabac et d’Arabidopsis thaliana (L.) transgéniques (plants dits « nahG » car ils expriment la salicylate hydroxylase bactérienne NahG, une enzyme qui catalyse la conversion de l’acide salicylique en catéchol) n’étaient plus capables de synthétiser et d’accumuler l’acide salicylique. En l’absence d’acide salicylique, ces plants n’exprimaient plus la RSA envers différents agents pathogènes (viraux, fongiques et bactériens) (Delaney et al. 1994; Dong 1998). Enfin, la mobilité de l’acide salicylique dans la plante a été démontrée par des expériences de marquage qui ont révélé que cette petite molécule, produite lors des interactions tabac–virus de la mosaïque du tabac ou tabac/virus de la nécrose du tabac, était transloquée dans toute la plante et s’accumulait dans les tissus non infectés (Molders et al. 1996). L’ensemble de ces données scientifiques militait donc en faveur d’une implication majeure de l’acide salicylique en tant que signal de la RSA. D’autres expériences ont par la suite nuancé ces conclusions concernant le rôle réel de l’acide salicylique dans l’expression de la RSA. En effet, les travaux de Rasmussen et al. (1991), réalisés sur des feuilles de concombre (Cucumis sativus L.) excisées 6 h après l’inoculation de la bactérie Pseudomonas syringae, (c’est-à-dire avant que l’acide salicylique ne s’accumule dans le phloème) ont montré qu’une RSA s’exprimait au niveau de la plante. Par ailleurs, des plants de tabac greffés (partie racinaire de la plante nahG, partie foliaire de type sauvage) dont les racines sont inoculées avec le virus de la mosaïque du tabac n’accumulent que très peu d’acide salicylique dans les racines, mais expriment une RSA dans les parties aériennes (Vernooij et al. 1994). À l’heure actuelle, le rôle exact de l’acide salicylique dans la transmission du signal de stress n’est pas totalement élucidé et il est probable qu’il partage cette fonction biologique avec d’autres molécules telles que l’acide jasmonique, l’éthylène, le peroxyde d’hydrogène ou les protéines phosphorylées dans le contexte d’une résistance non spécifique (Dong 1998; Vlot et al. 2009). Dans le cas de l’éthylène, les résultats sont controversés. Pour certains auteurs, l’éthylène serait un messager indispensable à la stimulation des gènes de défense (Knoester et al. 1995) alors que pour d’autres, l’activation de ces gènes serait indépendante de l’éthylène (Lawton et al. 1994, 1995). L’acide jasmonique, un dérivé lipidique issu de l’hydroperoxydation de l’acide linolénique membranaire par la lipoxygénase (LOX), semble être une molécule importante dans la régulation des réponses de défense chez les plantes (Denness et al. 2011; Memelink et al. 2001).
La RSA contribue donc à l’établissement d’un état de veille permanent qui permet à la plante d’être en alerte en cas d’attaque potentielle et de répondre promptement à l’agression.
La résistance systémique induite (RSI). Proche de la RSA, la RSI est une forme de résistance stimulée spécifiquement par des rhizobactéries plus connues sous l’appellation « PGPR » (Plant Growth Promoting Rhizobacteria). Au cours des années 1980, les PGPR ont surtout attiré l’attention en raison de leur capacité à stimuler la croissance végétale (Kloepper et Schroth 1981). Bien que ces bactéries aient fait l’objet de nombreuses investigations physiologiques et biochimiques en relation avec leur effet bénéfique sur la croissance, plusieurs études descriptives ont aussi montré que certaines souches de ces bactéries (en particulier des Pseudomonas spp.) avaient la capacité de réduire l’impact de plusieurs maladies racinaires chez une multitude de plantes cultivées (Kloepper 1991; Paulitz et al. 1992). La possibilité que ces rhizobactéries puissent devenir des agents de lutte biologique n’a cessé de se confirmer depuis la première démonstration par Scheffer (1983) qu’un prétraitement de l’orme (Ulmus americana L.) avec des souches du P. fluorescens résultait en une réduction importante des symptômes causés par le champignon Ophiostoma ulmi (Buisman) Nannf. Par la suite, une protection accrue contre différentes maladies a été observée dans plusieurs systèmes biologiques (Alström 1991; Lemanceau et Alabouvette 1993; Rankin et Paulitz 1994). Les mécanismes exacts au moyen desquels ces rhizobactéries contribuent à réduire l’incidence des maladies racinaires sont encore assez mal connus, même si plusieurs hypothèses, incluant la compétition pour les nutriments (Lemanceau 1989), l’antibiose, la production d’enzymes hydrolytiques des parois fongiques et la sécrétion de facteurs antifongiques (Weller 1988), ont été émises. Bien qu’il ne fasse aucun doute que des effets antimicrobiens directs sur les populations pathogènes soient responsables, au moins partiellement, de la protection accrue décrite par plusieurs auteurs, la possibilité que les PGPR puissent aussi induire des effets indirects en sensibilisant la plante à se défendre contre l’attaque microbienne par l’activation des gènes de défense a été prouvée dans les années 1990, ouvrant ainsi une nouvelle voie de recherche (Kloepper 1993; Wei et al. 1994). Ce concept de la résistance systémique induite par les PGPR trouvait sa justification dans certaines études biochimiques indiquant que la protection des plantes traitées avec des PGPR était associée à de profonds changements métaboliques incluant la production de phytoalexines (Van Peer et al. 1991), l’accumulation de protéines de stress (Zdor et Anderson 1992) et la déposition de polymères structuraux (Albert et Anderson 1987). C’est en 1996 que Benhamou et al. (1996a, b, c) vont montrer, pour la première fois, que les PGPR se multiplient activement à la surface racinaire et ne colonisent que quelques espaces intercellulaires des cellules épidermiques et corticales de la plante. Lorsque ces plantes sont inoculées avec un champignon pathogène, le microorganisme ne parvient pas à se multiplier et à se propager dans les tissus comme il le fait chez les plantes témoins (non traitées avec les PGPR). Bien qu’une action antifongique directe soit détectée à la surface racinaire, probablement en relation avec des antibiotiques produits par les rhizobactéries, la progression des quelques hyphes pathogènes ayant réussi à pénétrer le système racinaire semble retardée, voire arrêtée par plusieurs réactions de défense élaborées par la plante. Ces réactions incluent non seulement la formation de barrières structurales enrichies en callose et lignine, mais aussi l’accumulation de composés phénoliques à potentiel antifongique direct (Figs. 2 et 3).
Figure 2
Coupes transversales de racines de tomate colorées au bleu de toluidine
A) Racine de tomate infectée par le champignon pathogène, Fusarium oxysporum f. sp. radicis-lycopersici, l’agent de la pourriture fusarienne. À noter la multiplication abondante du champignon (C) dans tous les tissus, incluant l’épiderme (E) et le système vasculaire (SV) (x 1000). B) Racine de tomate pré-inoculée avec Pseudomonas fluorescens et infectée par Fusarium oxysporum f. sp. radicis-lycopersici. À noter la restriction de la croissance fongique (C) à la zone épidermique. Les autres tissus, incluant le système vasculaire, ne sont pas colonisés (x 1000).
Figure 3
Coupes transversales de racines de tomate préinoculées avec Pseudomonas fluorescens et infectées par Fusarium oxysporum f. sp. radicis-lycopersici
Observation en microscopie électronique à transmission après coloration à l’acétate d’uranyle et au citrate de plomb. A) Présence des rhizobactéries dans les espaces intercellulaires (EI) de l’épiderme (x 5000). B) Présence d’une apposition pariétale (AP) le long d’une cellule parasitée par le champignon (C). À noter le dépôt d’une bande de matériel dense aux électrons autour des cellules fongiques (x 25 000). C) Dépôt d’une large quantité de matériel dense (MD) riche en composés phénoliques polymérisés. La cellule fongique (C) piégée par ce matériel est sévèrement altérée (x 15 000).
Le post-transcriptional gene silencing : un mécanisme spécifiquement impliqué dans la résistance aux virus
Si la réaction hypersensible demeure la réponse la plus couramment observée à la suite d’une attaque virale, un autre mécanisme de résistance induite par les virus à ARN, le post-transcriptionnal gene silencing (PTGS), ou encore virus-induced gene silencing (VIGS), fait l’objet depuis quelques années d’une attention particulière (Voinnet 2001).
Le VIGS, aussi connu sous le nom de RNAi (interférence à l’ARN), est un processus de dégradation d’une séquence spécifique d’ARN. Ce processus affecte toutes les séquences homologues dans lesquelles des molécules d’ARN anormales, surexprimées ou étrangères sont ciblées pour ensuite être détruites de façon séquentielle (Baulcombe 2001). L’utilisation de mutants d’Arabidopsis thaliana L., déficients dans leur capacité à activer ce processus, manifestent une grande sensibilité à l’infection virale (Mourrain et al. 2000). Les résultats obtenus avec plusieurs plantes transgéniques ont confirmé le concept selon lequel le RNA silencing a évolué au cours du temps pour devenir un mécanisme intrinsèque de protection contre les infections virales chez tous les organismes multicellulaires (Waterhouse et al. 2001). Bien que l’ARN simple brin soit prédominant dans le cytoplasme des cellules eucaryotes, la présence d’ARN double brin est le résultat du cycle de réplication de la plupart des virus à ARN. L’ARN double brin est produit par l’intervention d’un complexe ARN polymérase. Ainsi, la synthèse d’ARN double brin dans la cellule végétale devient un signal d’alerte, indiquant à la plante qu’elle subit une attaque virale (Baulcombe 2001).
L’une des caractéristiques essentielles du processus de RNA silencing concerne sa diffusion à la plante entière (Voinnet et Baulcombe 1997). Le signal transloqué dans la plante consiste en une courte séquence de 21 à 25 nucléotides. Ces petites séquences, appelées short interfering RNAs, sont produites sous l’action d’une ribonucléase appelée Dicer (Dunoyer et al. 2005). Selon les modèles actuels, la ribonucléase Dicer reconnaît l’ARN double brin, puis le clive en petits ARNs de 21 à 25 nucléotides qui jouent un rôle de séquences guides permettant au complexe de ribonucléases de dégrader les ARNs complémentaires en petits ARNs (Bernstein et al. 2001). Dans le domaine de l’agriculture, l’introduction du PTGS chez des plants de tomate (Lycopersicon esculentum Mill.) confère une excellente résistance à diverses infections virales (Baulcombe 2004). Cependant, la restriction en termes de production de plantes transgéniques dans le monde fait que cette technologie innovatrice n’a pas encore été adoptée.
Les évènements clés de la RSA
Les étapes chronologiques de l’initiation des différentes réactions de défense élaborées par les plantes à la suite d’une attaque par un agent pathogène ont fait l’objet d’études qui ont démontré que la reconnaissance du microorganisme pathogène par la plante est initiée par la perception de molécules « signal » : les éliciteurs. Ces derniers se lient de façon spécifique à des récepteurs membranaires entraînant une dépolarisation instantanée de cette membrane accompagnée d’une production massive de formes actives de l’oxygène (FAO), un phénomène nommé burst oxydatif, ou stress oxydatif (Lamb et Dixon 1997). La suite des évènements inclut une modification intense des flux ioniques (Wendehenne et al. 2002), une réaction de phosphorylation/ déphosphorylation des protéines (Xing et al. 2002) et l’activation de molécules capables d’acheminer les messages de stress au noyau où seront stimulés les gènes de défense (Garcia-Brugger et al. 2006).
La production du signal éliciteur
Un éliciteur (mot issu du verbe anglais « to elicit », qui signifie provoquer ou induire) est une substance capable de déclencher une cascade d’évènements menant à l’expression des réactions de défense chez la plante. Ce terme, restreint à l’origine à des molécules capables de stimuler la synthèse de phytoalexines, est aujourd’hui attribué à toutes les molécules capables d’induire une ou plusieurs réactions de défense (Boller 1995; Ebel et Cosio 1994). Cette définition élargie permet d’inclure deux grands groupes d’agents inducteurs : les éliciteurs biotiques et les éliciteurs abiotiques. Les éliciteurs, aussi appelés stimulateurs des défenses naturelles (SDN) ou, encore plus récemment, stimulateurs des défenses des plantes (SDP), ont un large spectre d’action sur diverses maladies et favorisent, dans certains cas, la tolérance à des stress climatiques (ex. : stress hydrique). Avec l’avancée des connaissances sur les éliciteurs a émergé l’idée que ces derniers pourraient être utilisés en tant que produits phytosanitaires d’origine naturelle pour protéger les plantes cultivées contre certaines maladies. Le premier produit développé dans les années 1980 et revendiquant un mode d’action de type SDN est un analogue de l’acide salicylique, l’acibenzolar-S-methyl (ASM), plus connu sous le nom de BTH et commercialisé par Syngenta aux États-Unis sous l’appellation commerciale Bion®. Ce produit est aujourd’hui utilisé sur les cultures de blé (Triticum aestivum L.), de laitue (Lactuca sativa L.), d’épinard (Spinacia oleracea L.), de radis (Raphanus sativus L.) ou de tomate. Par la suite, d’autres produits phytosanitaires composés d’une matière active de type SDN ont vu le jour, comme 1) le Milsana® (KHH BioSci Inc., États-Unis), dont la matière active est un extrait de la plante Reynoutria sacchalinensis ((F. Schmidt) Nakai); 2) le Iodus40® (Goëmar, France), dont le principe actif est la laminarine (un polymère de β-1,3-glucanes) extraite de l’algue brune, Laminaria digitata ((Hudson) J.V. Lamoureux); 3) le Messenger® (Eden Bioscience, États-Unis), dont le principe actif est une protéine bactérienne, la harpine; 4) le Stifénia® (Société Occitane de Fabrication et de Technologies (SOFT), France), dont la matière active est un produit naturel extrait de la graine d’une légumineuse proche de la luzerne (Medicago L. spp.), le fenugrec (Trigonella foenum-graecum L.), qui est principalement cultivée en Afrique; et 5) le Elexa™ (Glycogenesys Inc., États-Unis), dont le principe actif est un polysaccharide, le chitosane.
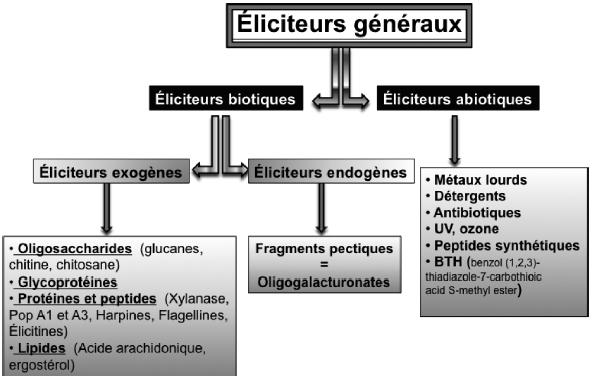
Le schéma général synthétisant les principales familles d’éliciteurs est illustré à la figure 4. Les éliciteurs biotiques se divisent en deux grandes catégories : les éliciteurs exogènes, qui comprennent des molécules d’origines diverses (oligosaccharidique, glycoprotéique, peptidique ou lipidique), et les éliciteurs endogènes représentés par les fragments pectiques libérés de la paroi végétale sous l’effet d’endopolygalacturonases microbiennes. Les éliciteurs abiotiques sont très diversifiés (radiations ultraviolettes, ozone, métaux lourds, etc.).
Figure 4
Principales familles d’éliciteurs généraux
Les éliciteurs biotiques exogènes
Les éliciteurs biotiques exogènes sont nombreux et variés. Bien que la plupart d’entre eux soient d’origine fongique ou bactérienne, quelques molécules élicitrices provenant de virus et même d’insectes phytophages ont été identifiées et décrites. Parmi les éliciteurs les mieux caractérisés chez les insectes on retrouve un complexe acide aminé–acide gras produit par la chenille Manduca sexta (L.) qui induit la synthèse de composés volatils, lesquels activent, en retour, les gènes de défense de la plante et agissent de façon indirecte sur l’attraction des prédateurs naturels de la chenille (Kessler et Baldwin 2002).
Le premier, et probablement le mieux caractérisé de tous les éliciteurs exogènes, est un oligomère de β-glucanes extrait de la paroi de Phytophthora megasperma (Drechs.) f. sp. Glycinea (T. Kuan and D.C. Erwin) (Davill et Albersheim 1984). Il s’agit d’un hepta-β-glucoside avec sept molécules de glucose. La chaîne linéaire comporte cinq molécules de glucose en liaison β-1,6. En position 2 et 4 se retrouvent deux chaînes latérales composées d’une molécule de glucose en liaison β-1,3 (Fig. 5).
Figure 5
Structure d’un glucane éliciteur
En 1997, un site de fixation pour les β-1,3-glucanes éliciteurs a été identifié chez le soja (Glycine max L. Merr.) (Umemoto et al. 1997), puis caractérisé chez Medicago trunculata (L.) et Lotus japonicus (Regel) K. Larsen (Côté et al. 2000). Il s’agit d’une protéine de 75 kDa ne présentant pas d’homologie avec des protéines connues et n’ayant pas de domaines transmembranaires bien définis (Tyler 2002).
L’activité élicitrice d’autres oligosaccharides (fragments de chitine ou de chitosane) issus de la paroi fongique a par la suite été identifiée (Barber et al. 1989; Yoshikawa et al. 1993). La chitine possède une structure cristalline organisée en un réseau de fibres proche de celui de la cellulose; elle confère rigidité et résistance aux organismes qui en contiennent dans leur paroi. Ce polymère est constitué d’unités répétitives de N-acétyl D-glucosamine associées par des liens β-1,4. Sa désacétylation donne naissance au chitosane qui est un polymère de D-glucosamine.
Depuis la première démonstration d’un changement de perméabilité membranaire chez des cellules végétales exposées au chitosane, de nombreuses études ont rapporté l’induction de réactions de défense chez des plantes entières (Ait-Barka et al. 2004; Kendra et Hadwiger 1984; Lafontaine et Benhamou 1996). Les mécanismes par lesquels le chitosane contribue à protéger les plantes contre l’infection ne sont pas encore totalement élucidés. Cependant, il semble que l’interaction entre les charges positives du chitosane et les charges négatives de phospholipides situés au niveau de la membrane des cellules végétales soit responsable d’une forte altération de la perméabilité membranaire, activant ainsi une série d’évènements précédant l’établissement de la résistance (Benhamou et al. 1994). Kauss et al. (1989) ont suggéré que l’effet bénéfique du chitosane n’était pas associé à une interaction avec des récepteurs spécifiques, mais plutôt à des modifications importantes des propriétés membranaires (flux ionique). La taille des oligomères de chitosane joue un rôle important dans l’induction de résistance. Ainsi, des oligomères de 7 à 12 unités sont plus performants en termes d’activité antimicrobienne et de capacité élicitrice de résistance que des chaînes plus courtes ou plus longues (Kauss et al. 1989). Un autre paramètre à considérer concerne le groupement en bout de chaîne. Ainsi, des oligomères de chitosane pourvus d’un groupement O-méthyle à leur extrémité sont plus actifs que ceux portant un groupement O-méthoxyphényle (Hadwiger et al. 1994).
Des travaux réalisés par différents laboratoires dans le monde ont clairement montré qu’un traitement avec des oligomères de chitosane stimulait plusieurs réactions de défense, y compris la production de FAO (Lin et al. 2005), la synthèse accrue d’acide jasmonique (Doares et al. 1995), la production de phytoalexines et le renforcement pariétal (Mitchell et al. 1994; Walker-Simmons et Ryan 1984), ainsi que l’induction d’acide salicylique et la synthèse de protéines de stress (Hadwiger 1999).
Parmi les autres éliciteurs exogènes, plusieurs glycoprotéines sont impliquées dans des phénomènes de reconnaissance. Stekoll et West (1978) ont été les premiers à extraire du milieu de culture de Rhizopus stolonifer (Ehrenb.:Fr.) une glycoprotéine susceptible d’induire des phytoalexines chez le ricin (Ricinus communis L.). Cette molécule de 32 kDa est une glycoprotéine dont la portion polysaccharidique comporte 92 % de mannose et 8 % de glucosamine. Des traitements à la pronase et au périodate ont prouvé que la glycoprotéine n’exerçait son pouvoir inducteur qu’en présence des deux portions (polysaccharidique et peptidique). Quelques années plus tard, Lee et West (1981) découvraient que cet éliciteur glycoprotéique avait une activité de type endopolygalacturonase. Ainsi, les endopolygalacturonases fongiques pouvaient être considérées comme des éliciteurs de réactions de défense. Cette propriété indirecte résulte probablement de la libération de fragments pectiques à la suite de l’hydrolyse de la pectine pariétale. On les appelle des prééliciteurs parce qu’ils favorisent la libération des vrais éliciteurs. Plusieurs autres glycoprotéines extraites des parois de divers champignons pathogènes se sont par la suite avérées être des éliciteurs potentiels de réactions de défense (Anderson 1989). Dans tous les cas, la sensibilité de ces glycoprotéines à la mannosidase a confirmé le rôle crucial joué par le mannose.
Les éliciteurs exogènes incluent également certaines protéines et peptides produits par des champignons ou des bactéries qui sont le plus souvent des pathogènes de plantes. On retrouve dans ce répertoire : 1) les xylanases (Boller et Félix 1996); 2) les PopA1 et PopA3, deux protéines thermostables de 38 et 28 kDa, respectivement, qui sont sécrétées par Pseudomonas solanacearum (E. F. Sm.), une bactérie pathogène de la tomate (Arlat et al. 1994); 3) les harpines, de petites protéines de 35 à 45 kDa, acides, thermostables et riches en glycine, qui sont produites par des bactéries phytopathogènes gram-négatif comme Erwinia amylovora (Burr. Winsl. et al.), Pseudomonas syringae f. sp. phaseolica ((Burkh.) Young, Dye & Wilkie) ou Xanthomonas campestris (Pammel) Dowson (Gough et al. 1992); 4) les flagellines, des constituants protéiques du flagelle des eubactéries (Samatey et al. 2001) qui peuvent, dans certains cas, s’accumuler dans le milieu extracellulaire (Komoriya et al. 1999); ces protéines élicitrices, produites par de nombreuses bactéries gram-négatif, sont pourvues de domaines N et C-terminaux très conservés ainsi que d’une partie centrale hypervariable (Samatey et al. 2001) et ce sont les régions conservées de la protéine qui sont responsables de l’activité inductrice de résistance des flagellines (Meindl et al. 2000); et 5) les élicitines, des peptides produits par les champignons oomycètes du genre Phytophthora (Ricci et al. 1989) ainsi que par certains Pythium spp. non pathogènes (Panabières et al. 1997).
Les élicitines produites par les Phytophthora spp. ont fait l’objet d’études approfondies en relation avec leur rôle tant au niveau de la physiologie de l’organisme oomycète qu’au niveau de leur capacité élicitrice de résistance chez les plantes. Elles appartiennent à une famille de protéines capables de stimuler la stratégie défensive de certaines plantes, dont le tabac et la tomate. Ces petites protéines (10 kDa) sont différentes de toutes les protéines connues, qu’elles soient impliquées ou non dans les mécanismes de défense (ex. : protéines de stress). En revanche, elles possèdent entre elles une homologie d’environ 85 % dans la séquence d’acides aminés et possèdent une « signature » qui permet de les identifier spécifiquement. Les principales caractéristiques de cette signature sont : 1) la présence de 98 acides aminés; 2) la composition particulière du peptide avec une présence majoritaire de sérine et thréonine (30 % de la molécule), de leucine (10 % de la molécule) et d’alanine (10 % de la molécule) et une absence de tryptophane, d’histidine et d’arginine; 3) la présence de six cystéines reliées par des ponts disulfures intramoléculaires dans les régions très conservées de la molécule; 4) un spectre UV particulier dû à l’absence de tryptophane; 5) une structure tridimensionnelle typique, telle que déterminée par rayon X et résonance magnétique nucléaire (toutes sont des protéines globulaires contenant cinq hélices liées entre elles par des ponts hydrogènes et disulfures); 6) la capacité de se déplacer dans la plante; en effet, contrairement à la plupart des éliciteurs connus, les élicitines se déplacent dans la plante via le système vasculaire; et 7) leur fonction en tant que transporteurs de stérols. Les élicitines sont des capteurs de stérols membranaires et leur efficacité est liée à cette propriété. Pour être active, une élicitine doit impérativement être chargée en stérol (Mikes et al. 1997; Vauthrin et al. 1999).
Le fait que les oomycètes du genre Phytophthora soient incapables de synthétiser les stérols indispensables à leur croissance, à leur développement et à leur reproduction (Hendrix 1970) a conduit au concept que l’une des fonctions premières des élicitines serait d’agir comme des navettes à la recherche de stérols dans les membranes biologiques (microbiennes ou végétales). Une fois chargées en stérols, ces navettes retournent vers le champignon, lui permettant alors de passer d’une phase végétative à une phase de reproduction intense. Ce concept a d’ailleurs été conforté par des essais démontrant que le seul fait d’ajouter des stérols dans le milieu de culture des Phytophthora spp. conduisait à la conversion d’une phase végétative en une phase de reproduction active (Ponchet et al. 1999).
L’utilisation de la cryptogéine (élicitine produite par le Phytophthora cryptogea (Pethybr. & Laff.)) marquée à l’iode 125 a permis la détection de sites de liaison au niveau de la membrane plasmique des cellules végétales (Wendehenne et al. 1995). Quelques minutes après un traitement de cellules en suspension par la cryptogéine, une entrée massive de calcium est détectable dans le cytosol (Tavernier et al. 1995). Cet influx précède toutes les autres réponses cellulaires. Ces observations ont mené à la conclusion que le récepteur d’une élicitine chargée en stérols se trouvait au niveau du canal calcique. La liaison élicitine–récepteur induit un gonflement du canal calcique, ce qui en retour se traduit par une entrée massive de calcium. L’augmentation du calcium intracellulaire conduit à la formation immédiate de callose, un polymère de β-1,3-glucanes considéré comme étant le premier composé impliqué dans le renforcement pariétal. Le calcium va également activer des protéines kinases, lesquelles vont en retour stimuler la phosphorylation de protéines (Viard et al. 1994). La production de FAO ainsi que l’efflux de potassium et d’anions (Cl-, NO3-) sont d’autres réactions précoces observées à la suite d’un traitement avec la cryptogéine (Pugin et al. 1997; Rustérucci et al. 1996; Simon-Plas et al. 1997). Les réponses plus tardives incluent la synthèse et l’accumulation de composés de consolidation des parois (lignine, HRGPs, extensions fibrillaires de pectines riches en ions calcium) (Kieffer et al. 2000; Lherminier et al. 2003), ainsi que la production d’éthylène et de phytoalexines (Milat et al. 1991). La résultante de ces réponses est l’expression d’une forme de résistance qui peut être soit la RSA, soit la réaction hypersensible (RH) avec processus d’apoptose menant à la mort cellulaire programmée (Coll et al. 2011).
Les éliciteurs biotiques endogènes
À la fin des années 1970, alors qu’ils viennent de découvrir et de décrire l’existence d’oligosaccharides éliciteurs de résistance dans la paroi de certains champignons, Albersheim et ses collaborateurs s’aperçoivent que des fragments pectiques de la paroi végétale elle-même produisent un effet similaire (Hahn et al. 1989). Ces fragments, essentiellement générés par des composés pectiques sous l’action d’endopolygalacturonases (endoPGs) fongiques, induisent la cascade d’évènements menant à l’expression de la résistance en quelques minutes (Côté et Hahn 1994). Contrairement au très haut degré de spécificité structurale des éliciteurs fongiques, les inducteurs oligosaccharidiques de plante semblent être moins définis puisque aucune structure bien précise n’a été identifiée (Aldington et Fry 1993). La relation structure–fonction des oligogalacturonates éliciteurs semble plutôt dépendre de la plante. Par exemple, une réponse des cellules de tabac en suspension ne peut être obtenue qu’avec des oligogalacturonates dont le degré de polymérisation (DP) est compris entre 10 et 16 (Mathieu et al. 1991). Par contre, des oligogalacturonates avec un DP compris entre 9 et 18 sont très efficaces sur des cellules de soja en culture (Fig. 6). Cependant, de façon générale, des oligogalacturonates avec un DP inférieur à 5 ou supérieur à 18 n’ont que peu ou pas d’activité inductrice.
Figure 6
Structure d’un oligogalacturonate constitué d’une chaîne linéaire d’acides galacturoniques en α–1,4
Les oligogalacturonates, formés par le clivage enzymatique de longues chaînes d’homogalacturonanes, doivent donc avoir une certaine taille pour être actifs. Or, les agents pathogènes, champignons et bactéries sécrètent continuellement des enzymes hydrolytiques des parois végétales, particulièrement des pectinases (endopolygalacturonases), qui sont d’ailleurs les premières enzymes microbiennes à être produites (Collmer et Keen 1986). Les endopolygalacturonases microbiennes ont la capacité de convertir très rapidement des fragments pectiques éliciteurs (DP entre 11 et 14) en acides mono-, di- ou trigalacturoniques non inducteurs (Cook et al. 1999). Cette découverte a conduit les chercheurs à s’interroger sur le mécanisme de régulation de l’activité enzymatique microbienne par la plante. Une première réponse sera apportée par Lafitte et al. (1984) lorsqu’ils vont isoler, dans la paroi du haricot (Phaseolus spp.), une molécule capable de réguler l’endopolygalacturonase produite par le champignon pathogène Colletotrichum lindemuthianum ((Sacc. & Magnus) Lams.-Scrib.). Cette molécule est une glycoprotéine de 46 kDa qui se lie spécifiquement à l’endopolygalacturonase et que les auteurs nomment polygalacturonase-inhibiting protein ou, plus communément, PGIP (Cervone et al. 1989, 1990). L’activité des PGIPs sur les endopolygalacturonases permet d’obtenir des fragments pectiques ayant un DP supérieur à 10 pendant plusieurs heures au lieu de quelques minutes (Cervone et al. 1989) (Fig. 7). Les analyses structurales et fonctionnelles des PGIPs indiquent que ces glycoprotéines pariétales font partie intégrante du système défensif inné des plantes. Elles sont capables de s’adapter à la pression de sélection exercée par les endopolygalacturonases microbiennes et peuvent acquérir de nouvelles aptitudes pour la reconnaissance de ces enzymes.
Figure 7
Effet des PGIPs sur la réduction de l’activité des endopolygalacturonases
Sans PGIP, les fragments pectiques sont inactifs en 15 min. En présence de PGIP, ils conservent une activité élicitrice pendant au moins 24 h. Cette activité décroît par la suite.
Les éliciteurs abiotiques
Les éliciteurs abiotiques incluent des sels de métaux lourds comme des sels de cadmium, d’argent et de plomb, des détergents, des antibiotiques, des peptides synthétiques, des dérivés de l’acide salicylique comme le benzol (1,2,3)-thiadiazole-7-acide carbothioique S-méthyl ester (BTH) (Benhamou et Bélanger 1998; Kessmann et al. 1994), ainsi que des stress environnementaux, comme le stress hydrique (Bray 1997). Une exposition prolongée à des radiations ultraviolettes ou à des doses élevées d’ozone atmosphérique peut aussi induire des réactions de défense chez les plantes (Baier et al. 2005; Charles et al. 2008a). Charles et al. (2008b) ont montré qu’une phytoalexine, la rishitine, s’accumulait chez la tomate infectée par Botrytis cinerea (Pers.:Fr.) en réponse à une irradiation ultraviolette. Par ailleurs, le renforcement des barrières structurales avec incrustation de lignine et de subérine est aussi une réponse communément observée chez les plantes et les fruits exposés à une lumière ultraviolette (Charles et al. 2008a). L’ozone, quant à lui, interagit avec des composantes de la membrane plasmique comme les canaux ioniques et les canaux calciques, entraînant des perturbations membranaires importantes et la production immédiate et massive de FAO et de certaines enzymes comme la superoxyde dismutase et les peroxydases (Oksanen et al. 2004).
La perception du signal éliciteur
La perception du signal éliciteur par un récepteur spécifique est un prérequis indispensable au déclenchement de la cascade d’évènements aboutissant à la stimulation des gènes de défense. Ce n’est toutefois qu’au cours de la dernière décennie que certaines découvertes fondamentales ont permis une analyse fine de la structure/fonction de plusieurs récepteurs à haute affinité (Chrisholm et al. 2006; De Wit 2007; Tichtinsky et al. 2003). La connaissance approfondie du génome d’Arabidopsis thaliana L. a par exemple apporté un éclairage nouveau sur les récepteurs. Ainsi, la reconnaissance d’un agent pathogène semble être étroitement liée à la présence de plusieurs récepteurs protéiques organisés en diverses catégories. Deux de ces catégories comprennent des récepteurs membranaires (receptor-like proteins, ou RLPs) et des récepteurs de type kinase (receptor-like kinase, ou RLKs). Deux autres classes incluent des récepteurs intracytoplasmiques qui possèdent un domaine LRR (Leucine-Rich-Repeats) et un domaine NB (Nucleotide Binding), c’est-à-dire un domaine permettant la fixation de nucléotides. L’ensemble de ces récepteurs est aujourd’hui connu sous le vocable de Pattern Recognition Receptors, ou PRRs (Jones et Dangl 2006).
De façon générale, les plantes possèdent de nombreux récepteurs qui reconnaissent spécifiquement les motifs moléculaires des éliciteurs. Ces motifs, connus sous l’appellation Pathogen-Associated Molecular Patterns, ou PAMPs, sont produits par tous les microorganismes, incluant les oomycètes. Malgré les avancées spectaculaires de ces dernières années, plusieurs aspects ne sont pas encore élucidés : 1) L’activation de plusieurs récepteurs amplifie-t-elle la réponse « immunitaire » des plantes? 2) Les protéines kinases peuvent-elles agir en synergie pour percevoir les PAMPs? 3) Y a-t-il un « turn-over » des récepteurs?
En aval de cette interaction éliciteur–récepteur, les plantes ont mis en place un système hautement sophistiqué de transduction du signal d’élicitation. Ce système d’une grande complexité est constitué de voies de signalisation qui s’entrecroisent pour se renforcer ou, au contraire, s’inhiber (Stulemeijer et Joosten 2008).
La réponse précoce au signal éliciteur
Une fois le signal éliciteur perçu par des récepteurs hautement spécifiques de la membrane plasmique, la dépolarisation membranaire subséquente déclenche très rapidement une série d’évènements destinés à transmettre le signal capté au noyau de la cellule (Nürnberger et Scheel 2001). Parmi ces évènements précoces, l’activation des protéines G et des protéines kinases, la stimulation des mécanismes de phosphorylation/déphosphorylation des protéines, la modification des flux ioniques en relation avec d’importantes perturbations de la perméabilité membranaire et la production de FAO associée à la peroxydation des lipides membranaires représentent les modifications cellulaires et moléculaires les plus importantes. L’importance relative de chacun de ces évènements ainsi que leur intervention temporelle dans la cascade menant à l’expression de la résistance peut varier d’une plante à l’autre. Ces évènements précoces incluent :
L’activation des protéines G, une classe de protéines très conservées chez les eucaryotes. Bien que certaines protéines G soient monomériques, la plupart sont hétérotrimériques et composées de trois sous-unités dénommées Gα, Gβ et Gγ. Ces protéines G hétérotrimériques se lient de façon spécifique à des récepteurs membranaires, les G-protein-coupled receptors (GPCRs) (Assmann 2002). Les protéines G sont étroitement impliquées dans plusieurs voies de signalisation de par leur capacité à transmettre le signal de stress aux canaux ioniques, aux phospholipases membranaires ou à des GTPases qui, à leur tour, sont à l’origine d’une cascade d’évènements menant, par exemple, à l’entrée massive du calcium, à l’efflux de potassium, de nitrates et de protons, ou à la peroxydation des lipides membranaires (Roos et al. 1999).
-
L’activation des protéines kinases impliquées dans la phosphorylation/déphosphorylation des protéines. Compte tenu du rôle incontournable de la phosphorylation dans bon nombre de mécanismes de signalisation intracellulaire, sa contrepartie, la déphosphorylation, joue un rôle tout aussi important. Les réactions de phosphorylation/déphosphorylation des protéines sont des évènements biochimiques cruciaux dans la régulation de l’activité cellulaire. Parmi les diverses protéines kinases impliquées dans ces processus, les mitogen-activated protein kinases (MAPK) sont distribuées de façon ubiquitaire chez tous les eucaryotes (champignons, animaux et plantes) (Suarez-Rodriguez et al. 2010). La phosphorylation des protéines est considérée comme la modification covalente et réversible la plus importante chez les protéines, car elle a la capacité de modifier l’activité biologique d’une protéine, sa localisation et sa durée de vie (Xing et al. 2002). Les réactions de phosphorylation/déphosphorylation des protéines permettent une amplification efficace du signal initial et des interconnections ou des ramifications pour l’activation de plusieurs voies de défense. La première mise en évidence de leur implication dans les années 1990 s’est faite par l’analyse des changements dans les profils de phosphorylation après le traitement de suspensions cellulaires avec divers types d’éliciteurs (Viard et al. 1994). L’utilisation d’inhibiteurs de phosphorylation tels que la staurosporine et le K252a a par la suite confirmé le rôle clé de ce processus dans la régulation de l’activité cellulaire (Romeis et al. 1999; Scheel 1998). Avec les élicitines, par exemple, la phosphorylation est l’évènement le plus précoce de la transduction cellulaire. L’addition d’inhibiteurs de phosphorylation (staurosporine ou K252a) à des cellules en suspension traitées par la cryptogéine bloque l’ensemble des réponses cellulaires généralement observées (Pugin et al. 1997). Des inhibiteurs de phosphorylases, comme la calyculine A, qui sont capables de mimer certains des effets observés sur les cellules végétales à la suite de leur élicitation, induisent une hyperphosphorylation des protéines chez des cellules de tomate (Felix et al. 1994) et un stress oxydatif chez des suspensions cellulaires de tabac (Mathieu et al. 1996).
La perception d’un signal éliciteur résulte le plus souvent en l’activation des kinases et des phosphatases (Suarez-Rodriguez et al. 2010). Une fois activées, leur « patron » de phosphorylation cellulaire change, car plusieurs protéines deviennent phosphorylées ou, au contraire, déphosphorylées (Tena et al. 2011). La grande majorité des protéines qui sont phosphorylées à la suite de la perception d’un signal de stress sont des protéines kinases qui vont ensuite entretenir une phosphorylation en cascade jusqu’à ce que le signal soit transmis dans toute la cellule. Dans ce système, la cascade peut débuter avec le récepteur (car c’est lui-même une kinase) ou avec une kinase cytoplasmique. Cette cascade fonctionne jusqu’à ce que les phosphatases soient activées et viennent inhiber le processus (Fig. 8).
Figure 8
Une protéine initialement inactive peut devenir phosphorylée par une protéine kinase
Le processus de phosphorylation est réversible puisqu’une phosphatase peut déphosphoryler la protéine activée et la rendre inactive.
Les modifications de flux ioniques. Ces derniers, initiés par la dépolarisation membranaire, concernent des efflux de K+, de Cl- et de nitrates ainsi que des influx massifs de Ca2+ et de protons H+ (Wendehenne et al. 2002; White et Broadley 2003). L’activation des canaux ioniques à la suite de l’interaction éliciteur–récepteur semble être à l’origine de ces échanges membranaires inhabituels, tel qu’illustré par diverses expériences utilisant des antagonistes de canaux ioniques des cellules animales sur des cellules végétales (Zimmermann et al. 1997). L’influx de Ca2+ et l’efflux de Cl- sont tous deux responsables d’une acidification du cytoplasme. Cette dernière est considérée comme une étape clé dans l’établissement du burst oxydatif et dans la transduction subséquente du signal de stress (Sakano 2001). L’acidification du cytoplasme n’est donc pas seulement le résultat d’une modification des flux ioniques; elle contribue également à la régulation de divers mécanismes cellulaires et moléculaires. Il est désormais établi que le calcium intervient en tant que messager intracellulaire dans le contrôle de nombreuses réponses physiologiques chez les plantes. La notion de messager intracellulaire signifie qu’une variation rapide et transitoire du taux d’un composé intracellulaire, observée à l’issue de la perception d’un signal extracellulaire, constitue un message interprétable par la cellule et que le décodage de ce message par des éléments-relais assure sa conversion en une réponse biologique appropriée. D’une manière générale, l’augmentation de calcium est due soit à une entrée (un influx) de calcium venant du milieu extérieur par les canaux calciques, soit à une libération de calcium à partir des réserves internes au niveau du réticulum endo- ou sarcoplasmique. Les canaux calciques sont activables par des variations de potentiel membranaire, d’où l’appellation de « canaux voltage dépendants ». Lorsque la membrane est à son potentiel de repos, les canaux calciques sont fermés, alors que sous l’effet d’une dépolarisation (à la suite de l’interaction éliciteur–récepteur membranaire), ces canaux s’ouvrent et le calcium entre de façon passive dans la cellule suivant un gradient électrochimique. Plusieurs études ont montré que l’influx de calcium extracellulaire était un évènement très précoce qui : 1) succédait à la phosphorylation des protéines (Lecourieux-Ouaked et al. 2000); 2) coïncidait avec l’efflux de chlore et de nitrates et avec l’acidification du cytosol; et 3) précédait plusieurs autres évènements, dont l’activation d’une NADPH-oxydase responsable de la production des FAO (Pugin et al. 1997), la production d’oxyde nitrique (NO) (Foissner et al. 2000), l’activation des protéines kinases et l’activation d’une β-1,3-glucane-synthase impliquée dans la synthèse de callose (Lebrun-Garcia et al. 1998).
La production de formes actives de l’oxygène (FAO). Le stress oxydant est un autre évènement précoce qui coïncide avec la modification de flux ionique. En conditions normales, les radicaux libres sont produits en faible quantité et cette production est parfaitement maîtrisée par plusieurs systèmes de défense constitutifs. On est alors dans une situation où la balance « pro-oxydant versus antioxydant » est en équilibre. Lorsque la cellule subit une agression biotique ou un stress abiotique, une surproduction des FAO est observée, conduisant à un déséquilibre de la balance initiale et à l’établissement d’un stress oxydant. Cette rupture d’équilibre est lourde de conséquences puisque la cellule végétale va accumuler des radicaux toxiques pour se défendre, au risque de s’intoxiquer elle-même. Une fois produites, les FAO peuvent induire des dommages oxydatifs majeurs au niveau d’une gamme de substrats potentiels comme l’ADN, les lipides membranaires, les protéines et certaines enzymes. En contrepartie, ces molécules oxydantes interviennent dans diverses activités liées à l’expression de la résistance : défense antimicrobienne directe, régulation de gènes et mise en place de l’apoptose lors de la réaction hypersensible. Afin que les FAO n’exercent pas de façon incontrôlée leur effet délétère sur les cellules, la plante, comme tous les organismes vivants et les mammifères en particulier, dispose d’un réseau défensif constitué d’enzymes antioxydantes comme la superoxyde dismutase (SOD), les catalases et les peroxydases. À cela s’ajoutent quelques oligo-éléments comme le sélénium, le cuivre et le zinc qui sont des cofacteurs importants dans la régulation de ces enzymes.
Le stress oxydant, ou burst oxydatif, se définit comme un déséquilibre du ratio FAO/enzymes antioxydantes, en faveur des FAO. Même s’il entraîne certains dommages, le burst oxydatif est indispensable pour déclencher la cascade d’évènements conduisant, in fine, à l’activation des gènes de défense. De leur côté, les antioxydants jouent un rôle crucial de par leur capacité à neutraliser certains dérivés toxiques de l’oxygène. Le rôle des antioxydants ne se limite pas seulement à la régulation de la production des FAO. Les percées des dernières années dans le secteur de la biologie moléculaire indiquent que les antioxydants seraient également impliqués dans les mécanismes de régulation de l’expression des gènes associés au stress oxydant (Foyer et Noctor 2005).
Une des principales formes chimiques dangereuses de l’oxygène est l’anion superoxyde O2-, lequel est rapidement converti en peroxyde d’hydrogène (H2O2) sous l’action de la SOD, une enzyme que toutes les cellules possèdent à l’état constitutif (Fig. 9). Les FAO, en particulier le H2O2, peuvent exercer un effet direct sur les agents pathogènes par leur toxicité. Elles peuvent également agir de façon indirecte en favorisant le renforcement pariétal par pontages oxydatifs de protéines et de glycoprotéines comme les HRGPs ou par l’oxydation de polysaccharides et de composés phénoliques (Lamb et Dixon 1997). Cet évènement très précoce a pour conséquence de ralentir la progression de l’agent pathogène, laissant ainsi aux autres mécanismes de défense le temps de se mettre en place. Les FAO interviennent également dans la modification des flux ioniques, la phosphorylation des protéines, l’expression de gènes de défense et l’initiation de la réaction hypersensible (Low et Merida 1996). Les FAO ne sont pas seulement produites en réponse à un stress biotique; en effet, de nombreuses contraintes abiotiques (sécheresse, haut taux de salinité, températures élevées ou trop basses) conduisent à l’accumulation de FAO (Bray 1997). Il en est de même pour les rayonnements ultraviolets et les émissions importantes d’ozone ou de métaux lourds dans l’environnement (Baier et al. 2005; Dat et al. 2000).
Figure 9
Les principales formes actives de l’oxygène (FAO)
Les FAO sont étroitement impliquées dans la peroxydation des lipides membranaires, l’un des phénomènes les plus délétères du stress oxydatif. L’augmentation du calcium intracellulaire ainsi que les protéines G activées stimulent ensuite l’activité des phospholipases du complexe lipide acyle hydrolase (Dhondt et al. 2000). Les phospholipases activées hydrolysent alors des lipides membranaires et les expulsent de la membrane. Les acides α-linolénique (C18:3) et linoléique (C18:2) libérés deviennent les précurseurs des oxylipines parmi lesquelles figure l’acide jasmonique, qui est de loin l’oxylipine la plus étudiée (Dong 1998). La biosynthèse des oxylipines débute généralement par l’intervention d’une lipoxygénase (LOX) sur ces acides gras polyinsaturés. Les hydroperoxydes formés sont au carrefour de plusieurs voies métaboliques et vont conduire à des dérivés finaux en général plus stables et dotés d’activités biologiques diverses (Mosblech et al. 2009). C’est au niveau des membranes de l’enveloppe des chloroplastes que se situe le site cellulaire de métabolisation de ces hydroperoxydes et en particulier de l’acide jasmonique (Blée et Joyard 1996; Wasternack et Kombrink 2010). Les étapes ultérieures sont probablement catalysées dans les peroxysomes (Schaller 2001).
La production de FAO est donc une réponse cellulaire commune à de nombreux stress chez les plantes (Van Breusegem et Dat 2006). L’identification d’une nouvelle enzyme, l’alternative oxydase (AOX) produite au niveau des mitochondries, a conduit à considérer ces organites cytoplasmiques comme des acteurs majeurs dans la régulation du stress oxydatif (Cvetkovska et Vanlerberghe 2012; Maxwell et al. 1999). Il a été suggéré que les mitochondries pourraient agir comme médiateurs entre les changements métaboliques, la production de FAO et l’induction de gènes (Rhoads et Subbaiah 2007). Cependant, les chloroplastes demeurent les organites au niveau desquels sont observées les plus fortes accumulations de FAO (Mittler 2002). En condition de stress abiotique, la photosynthèse diminue et les électrons, qui ne participent plus à la fixation du CO2, entraînent la production et l’accumulation de FAO.
La transduction du signal éliciteur
L’implication des FAO dans la signalisation est généralement admise. Ainsi, la capacité du H2O2 à s’infiltrer au travers de la membrane plasmique par les canaux aqueux et à oxyder des protéines à distance de son site de synthèse est considérée comme une preuve de son implication dans la signalisation (Henzler et Steudle 2000; Levine et al. 1994). Par ailleurs, les FAO sont également associées à la cascade d’évènements régulant l’expression génique. Ainsi, la production systématique et régulière de FAO durant de nombreux processus métaboliques, associée à des pics de production en réponse à des stress biotiques et abiotiques, permet aux cellules d’exploiter l’effet négatif des radicaux oxygénés et de convertir cet effet délétère en un système de surveillance (Mittler et al. 2011). L’atteinte d’un certain seuil dans la concentration en FAO servirait alors de signal capable d’induire et de réguler l’expression de gènes de défense (Bolwell 1999).
L’acide jasmonique, issu de la peroxydation des lipides membranaires, ainsi que l’éthylène, une phytohormone volatile, sont connus pour être des modulateurs de la RSI. La RSA nécessite aussi l’acide jasmonique et l’éthylène, une association qui résulte en l’induction de l’expression de plusieurs gènes codant pour des défensines et des thionines qui sont deux protéines de stress (Penninckx et al. 1998). La combinaison acide jasmonique–éthylène est probablement l’une des associations les plus significatives car elle influence plusieurs aspects de la physiologie des plantes lors des interactions plante–agent pathogène et plante–insecte lors d’une blessure ou lors d’une exposition à l’ozone. Ensemble, l’acide jasmonique et l’éthylène régulent plusieurs réactions de défense (Schmelz et al. 2003). Par exemple, l’éthylène renforce l’activité de l’acide jasmonique dans la stimulation de la production de taxol chez les Taxus spp. (Mirjalili et Linden 1996).
L’acide jasmonique interfère avec d’autres voies métaboliques et particulièrement avec celle de l’acide salicylique, un autre messager secondaire issu du sentier des phénylpropanoïdes (Maleck et al. 2000; Sendon et al. 2011). Ainsi, l’acide salicylique et ses dérivés sont des inhibiteurs potentiels de la biosynthèse de l’acide jasmonique qui interagissent négativement avec la voie de signalisation de ce dernier (Kim et al. 2003). Il est possible que cet antagonisme opère par l’intermédiaire d’un groupe de facteurs de transcription (Li et al. 2004). Diverses études ont montré de façon convaincante que certaines molécules de défense étaient induites par l’acide salicylique, alors que d’autres étaient plutôt stimulées par l’acide jasmonique (Mikkelsen et al. 2003). La voie de signalisation de l’acide jasmonique semble également être inhibée par des cytokinines et par des doses très faibles d’acide ascorbique (Tamogami et al. 1997).
Au cours de la dernière décennie, les percées spectaculaires de la biologie moléculaire ont non seulement permis de décrypter certains aspects encore méconnus de la signalisation, mais aussi de découvrir que les plantes avaient la capacité d’activer de façon différentielle une ou des voies de signalisation spécifiques à un agresseur donné (Bostock 1999). Dans ce réseau complexe où s’entrecroisent plusieurs voies, l’acide salicylique, l’acide jasmonique, l’éthylène, la systémine et même l’acide abscissique (ABA) sont des acteurs essentiels, car chacune de ces molécules, qu’elle agisse par synergie, potentialisation ou antagonisme, détermine l’issue de la réponse à un agresseur donné (Robert-Seilaniantz et al. 2011). Ainsi, bloquer la réponse à l’un de ces signaux peut conférer une plus grande vulnérabilité des plantes envers leur agresseur. Dans ce contexte, l’acide salicylique semble, dans certains cas, agir de concert avec l’acide jasmonique et l’éthylène (Penninckx et al. 1998), alors que dans d’autres cas, il se comporte plutôt en antagoniste, empêchant la synthèse de l’acide jasmonique et de l’éthylène (Doares et al. 1995). Si certains exemples montrent que l’acide jasmonique, de concert avec l’éthylène, stimule l’activité de l’acide salicylique (Xu et al. 1994), d’autres décrivent au contraire un effet antagoniste (Niki et al. 1998). La situation dépend donc des interactions plante–bioagresseur. Il semble également que les interactions entre les différentes voies de signalisation jouent un rôle crucial dans la régulation fine des mécanismes de résistance et aident la plante à prioriser une voie selon ses besoins en termes de défense (Lu 2009).
Au fil des avancées scientifiques, la notion initiale de voie de signalisation s’est élargie à la notion de réseaux de voies de signalisation dans lesquels les différents circuits véhiculent les informations adéquates tout en étant modulés par les autres circuits. Dans ces réseaux, le peroxyde d’hydrogène, le calcium, les protéines kinases, les protéines phosphorylées et les phytohormones (acide jasmonique, acide salicylique, éthylène, acide abscissique) sont situés à des carrefours de voies de signalisation et opèrent comme des interrupteurs moléculaires capables d’exercer une fonction d’aiguillage. Ainsi, selon la voie empruntée ou selon l’interconnection entre les voies, les plantes acquièrent et expriment un type de résistance, lequel est souvent adapté au stress auquel elles sont confrontées (Chehab et Braam 2012).
La réponse de la plante au signal éliciteur
L’arsenal défensif de la plante comprend toute une gamme de molécules, les unes ayant pour but de renforcer la paroi végétale afin de ralentir la pénétration de l’agent pathogène, les autres ayant un rôle antimicrobien direct, telles les phytoalexines et certaines protéines de stress.
Les barrières structurales
Les barrières structurales élaborées par les plantes en réponse à l’infection par un agent pathogène ont d’abord pour but de consolider la paroi et de la rendre imperméable à la diffusion de substances délétères produites par l’agent pathogène (enzymes hydrolytiques, toxines, antibiotiques). La plante va donc renforcer sa muraille extérieure pour au moins retarder l’agent pathogène dans sa progression avant d’activer sa deuxième ligne défensive qui comprend une panoplie de molécules antimicrobiennes. La formation de papilles et, plus généralement, d’appositions pariétales est un phénomène fréquemment rencontré dans de multiples interactions plante–microorganisme, que l’agent infectieux soit biotrophe ou nécrotrophe (Benhamou et al. 1997; Chérif et al. 1992; Kunoh et al. 1996).
Les papilles sont des protubérances hémisphériques formées entre la paroi et la membrane plasmique rétractée dans un espace appelé l’espace paramural (Fig. 10A). Chez toutes les plantes, la formation de papilles coïncide avec la déposition de callose, un polysaccharide composé de molécules de glucose en liaison β-1,3 (Benhamou et Nicole 1999). La synthèse de la callose est sous la dépendance d’un complexe protéique membranaire, la β-1,3-glucane synthase (ou callosesynthase), une glycosyltransférase qui catalyse le transfert d’un résidu monosaccharidique provenant d’un sucre-phosphate activé comme l’UDP (uridine-diphosphate)-glucose sur un accepteur qui est, généralement, un alcool. Cette enzyme, activée par le Ca2+, transforme l’UDP-glucose en β-1,3-glucane, un polymère dont la structure apparaît amorphe en microscopie électronique. Au fil du temps, la matrice de callose se renforce grâce à l’incrustation d’autres composés incluant des glycoprotéines riches en hydroxyproline (HRGPs), de la lignine, un polymère hétérogène constitué de phénylpropanes (Bhuiyan et al. 2009) et des phénols polymérisés (Benhamou et Lafontaine 1995). Plus les papilles sont matures, c’est-à-dire imprégnées de substances denses aux électrons, plus il sera difficile pour le champignon pathogène de traverser cette structure (Fig. 10B). Dans la plupart des cas, ces tentatives échouent et on assiste à une dégénérescence du canal de pénétration du champignon pathogène au niveau de la papille.
Figure 10
Formation de papilles dans des tissus racinaires de plants de tomate infectés par le Fusarium oxysporum f. sp. radicis-lycopersici
Observations en microscopie électronique à haute résolution. A) Formation d’une papille (P) hétérogène entre la paroi et le cytoplasme rétracté (x 25 000). B) Tentative de pénétration d’une papille par le champignon pathogène (C) (x 20 000).
Les autres réponses structurales concernent l’occlusion des espaces intercellulaires par des substances riches en composés phénoliques (Fig. 11) et l’élaboration de barrières vasculaires incluant des gels de nature pectique, des thylles (excroissances cellulaires) et un tapissement de l’intérieur des vaisseaux du xylème par des phénols polymérisés (Fig. 12) (Shi et al. 1992).
Figure 11
Tapissement (Ta) d’un espace intercellulaire (EI) par un matériel dense enrichi en composés phénoliques
Figure 12
Tapissement (Ta) de l’intérieur d’un vaisseau du xylème (VX) par une épaisse couche de phénols polymérisés qui se déposent le long des parois secondaires
Les barrières chimiques
En plus de renforcer son architecture pariétale, la cellule végétale en alerte va produire de nombreuses molécules chimiques à potentiel antimicrobien. Ces molécules, produites de façon séquentielle, agissent en synergie pour assurer une protection efficace et stable de la plante contre l’agression microbienne.
Les phytoalexines
L’hypothèse que des cellules végétales puissent produire des substances antibiotiques lorsqu’elles sont agressées a été formulée pour la première fois par Müller et Börger en 1940. Le terme phytoalexine a été choisi pour désigner des molécules dont la synthèse est induite chez les plantes en réponse à un stress pathogénique, chimique ou abiotique (froid, etc.). Selon la définition actuelle, les phytoalexines sont des antibiotiques produits par les plantes à la suite d’une séquence métabolique induite soit de façon biotique (microorganismes), soit de façon abiotique (stimulus physique ou chimique) (Ingham 1973). Les paramètres qui déterminent l’induction de la synthèse de phytoalexines chez les plantes semblent donc être liés à une perturbation du système métabolique plutôt qu’à la structure ou la nature même de l’éliciteur (Dixon et al. 1995). Tous les éliciteurs semblent être capables de déclencher le signal d’alarme menant à l’activation de la vingtaine de gènes impliqués dans la synthèse des phytoalexines (Dixon et Harrison 1994). Plus de 350 phytoalexines appartenant à au moins 30 familles de plantes différentes ont été isolées et caractérisées en termes de structure/fonction (Ahuja et al. 2012). Au sein des dicotylédones, le plus grand nombre de phytoalexines identifiées se trouve chez les légumineuses (environ 130) (Dakora et Phillips 1996). Cependant, elles sont également présentes chez plusieurs autres familles comme les solanacées, les convolvulacées, les ombellifères et les cucurbitacées (Fawe et al. 1998; Fofana et al. 2005; Rouxel 1989). Les phytoalexines ont été isolées dans la plupart des organes de la plante, incluant les tiges, les feuilles, les racines et les fruits. Tout comme les composés phénoliques, les phytoalexines sont principalement synthétisées par la voie de l’acide shikimique. Deux autres voies peuvent néanmoins conduire à la synthèse des phytoalexines : la voie de l’acétate-mévalonate et celle de l’acétate-malonate (Benhamou 2009).
L’importance des phytoalexines dans la stratégie défensive des plantes a été prouvée en transformant des plants de tabac, de tomate et de luzerne avec le gène codant pour une stilbène synthase, une enzyme impliquée dans la synthèse d’une phytoalexine de la vigne, le resvératrol. Ayant acquis la capacité de synthétiser cette phytoalexine, les plants de tabac transformés expriment une résistance accrue envers Botrytis cinerea (Hain et al. 1993), alors que les plants de tomate et de luzerne transformés sont plus résistants au Phytophthora infestans ((Mont.) de Bary) (Thomzik et al. 1997) et au Phoma medicaginis (Malbr. & Roum.) (Hipskind et Paiva 2000), respectivement. À l’inverse, des plants de pois (Pisum sativum L.) transgéniques ayant perdu leur capacité à produire la pisatine sont beaucoup moins résistants à l’infection fongique (Wu et VanEtten 2004). En utilisant la microscopie à fluorescence et la microscopie confocale, McNally et al. (2003) ont montré que les phytoalexines nouvellement synthétisées s’accumulaient bien au niveau des hyphes fongiques in planta. De leur côté, Fofana et al. (2005) ont rapporté que le blocage de la voie métabolique des isoflavonoïdes par l’utilisation d’inhibiteurs de différentes enzymes impliquées dans cette voie conduisait à une suppression de la résistance induite contre l’oïdium chez le concombre (Sphaerotheca fuliginea). D’une manière générale, l’effet antifongique des phytoalexines peut se manifester par l’inhibition de la germination des spores, de l’élongation du tube germinatif ou de la croissance mycélienne (Skipp et Bailey 1976). Certaines phytoalexines exercent également un effet antibactérien notable (Gnanamanickam et Patil 1977).
Si les phytoalexines jouent un rôle indiscutablement important dans la défense chimique des plantes à une agression microbienne, il n’en reste pas moins vrai que l’agent pathogène va tenter de contourner cette barrière chimique de différentes façons. Il peut ainsi : 1) supprimer la synthèse de phytoalexines grâce à des suppresseurs (oligosaccharides ou glycopeptides de la paroi fongique) (Yamada et al. 1989); 2) détoxifier certaines phytoalexines; et 3) avoir acquis la capacité de tolérer des doses toxiques de phytoalexines (VanEtten et al. 2001).
Les protéines de stress ou protéines PR (Pathogenesis-related proteins)
Outre les phytoalexines qui jouent un rôle crucial dans la RSA, l’arsenal défensif des plantes comprend aussi de nombreuses protéines de défense, dont les protéines PR qui ont fait l’objet d’études approfondies (Sels et al. 2008). Ces protéines de stress, découvertes en 1970 chez le tabac par deux groupes de chercheurs (Gianinazzi et al. 1970; Van Loon et Van Kammen 1970), se distinguent de toutes les autres protéines connues par leur poids moléculaire (entre 10 à 30 kDa), leur solubilité, leur grande résistance à la digestion protéolytique et leur localisation principalement extracellulaire (Kauffmann et al. 1999). En fait, le critère majeur pour qu’une protéine soit incluse dans la classification des protéines PR était, à l’origine, lié à son induction par un stress biotique, même si cette induction n’était pas généralisée à tous les agents pathogènes (Van Loon 1999).
Actuellement, 17 classes de protéines PR sont répertoriées selon l’ordre de leur découverte. Pour certaines d’entre elles, la fonction biologique demeure un mystère. Néanmoins, la plupart des protéines PR identifiées semblent avoir un potentiel antimicrobien direct (ex. : chitinases et glucanases) ou indirect (ex. : osmotines et permatines) (Kombrick et Somssich 1997). Il n’est pas rare que certaines protéines PR agissent en synergie. C’est le cas, par exemple, des chitinases et des glucanases qui sont produites simultanément pour permettre une dégradation plus efficace de la paroi des champignons pathogènes (Theis et Stahl 2004). D’autres protéines PR comme les oxalates-oxydases (PR-15) catalysent l’oxydation de l’acide oxalique, une puissante toxine fongique, en dioxyde de carbone (CO2) et en peroxyde d’hydrogène (H2O2) (Hu et al. 2003). Les autres protéines PR incluent des ribonucléases, des défensines et des thionines (Thomma et al. 1998), des protéines de transfert des lipides (José-Estanyol et al. 2004) ainsi que certains inhibiteurs de protéases (Pulliam et al. 2001).
Les inhibiteurs de protéases
Les inhibiteurs de protéases (IPs) sont des protéines défensives caractérisées par leur capacité à inactiver des enzymes protéolytiques d’origine endogène ou exogène (Ryan 1990). D’une part, ils protègent la plante contre une activité protéolytique endogène incontrôlée et, d’autre part, ils assurent le contrôle des protéases exogènes sécrétées par des insectes herbivores ou des agents pathogènes. Ils sont subdivisés en quatre catégories selon le type de protéases auquel ils s’associent : 1) les inhibiteurs de protéases à sérine, très largement distribués chez les plantes; 2) les inhibiteurs de protéases à cystéine, également abondants chez les plantes; 3) les inhibiteurs de métalloprotéases, relativement rares chez les plantes; et 4) les inhibiteurs de protéases acides, peu présents chez les plantes (Selitrennikoff 2001). En collaboration avec d’autres molécules comme les phytoalexines, les IPs jouent un rôle important dans l’arsenal défensif des plantes (Schimoler-O’Rourke et al. 2001).
De nombreuses études se sont concentrées sur l’effet de l’ingestion d’IPs sur la survie de l’insecte. L’ensemble des résultats obtenus en conditions expérimentales converge vers l’idée que les IPs ingérés par les larves d’insecte sont des molécules antimétaboliques et antinutritives qui inhibent les protéases digestives, les privant ainsi des acides aminés indispensables à leur croissance et à leur développement (Orr et al. 1994). Cependant, les caractères défensifs des plantes ont entraîné la mise en place chez les insectes et les agents pathogènes de divers mécanismes adaptatifs leur permettant de contourner les effets toxiques, répulsifs ou antiappétents des molécules de défense (Kessler et Baldwin 2002). Les relations entre les plantes et leurs agresseurs sont donc en perpétuelle évolution, ce qui semble être responsable de la biodiversité sur la terre.
Conclusion
Les progrès remarquables accomplis ces dernières années en termes de compréhension des mécanismes qui sous-tendent la résistance induite chez les plantes ont pavé la voie au développement d’agents et de produits susceptibles de mimer l’effet des éliciteurs naturels de réactions de défense (ex. : oligogalacturonates). Par exemple, des éliciteurs isolés de paroi de levure (Saccharomyces cerevisiae (Meyen ex Hansen)) permettent un contrôle efficace (95 %) de l’oïdium chez le blé (Blumeria graminis f. sp. tritici (DC.)) cultivé en plein champ (Reglinski et al. 1994). De façon similaire, la laminarine, un polymère de β-1,3-glucanes provenant de l’algue brune, protège la vigne contre l’infection par les champignons pathogènes Botrytis cinerea et Plasmopara viticola ((Berk. & M.A. Curtis) Berl. & De Toni) (Aziz et al. 2003). La progression exponentielle des connaissances sur les voies de signalisation et, en particulier, sur ce petit composé phénolique qu’est l’acide salicylique a conduit les chercheurs à penser que cette molécule avait le potentiel pour devenir l’un des plus prometteurs stimulateurs de défense naturelle chez les plantes (Malamy et Klessig 1992). Cependant, la nécessité d’appliquer des doses très élevées de cette molécule parce que les plantes la métabolisent promptement a éliminé tout espoir de commercialisation potentielle à des fins agronomiques. En revanche, la possibilité que d’autres composés mimant l’effet de l’acide salicylique puissent être utilisés a suscité un intérêt depuis la découverte par Ciba-Geigy Corp. (par la suite Novartis et maintenant Syngenta) de deux composés capables d’induire la résistance systémique acquise (RSA). Ces deux molécules, l’acide méthyle-2,6-dichloroisonicotinique (INA) et le S-méthyle benzo [1,2,3] thiadiazole-7-carbothiate (BTH), ne démontrent aucune activité antimicrobienne directe. En revanche, elles se comportent de manière similaire à l’acide salicylique (Lawton et al. 1996) et activent la plupart des gènes de défense induits par cet éliciteur (Heidel et Baldwin 2004). Le BTH est le premier stimulateur de RSA à avoir été commercialisé en Europe sous l’appellation Bion® et aux États-Unis sous l’appellation Actigard 50 WG®.
L’avancée des connaissances sur les mécanismes de défense naturelle des plantes a donc permis au secteur de la R&D de développer de nouveaux produits capables de conférer aux plantes les moyens de se défendre elles-mêmes contre diverses agressions. Les SDN, dont le concept dérive directement de ces découvertes, font aujourd’hui partie intégrante des stratégies émergentes dans les programmes de lutte contre les agents pathogènes et les insectes ravageurs des cultures. Ces stratégies innovatrices pourraient fort bien contribuer à résoudre les grands défis de l’avenir. Dans ce contexte, la protection des plantes par l’utilisation de SDN est une réponse non négligeable aux attentes grandissantes d’un monde qui n’a d’autre choix que d’affronter les changements qui se profilent à l’horizon, et ce, dans le respect de l’environnement et de la santé humaine.
Parties annexes
Remerciements
Nous remercions les éditions Lavoisier Tec & Doc (Paris, France) d’avoir aimablement autorisé la reproduction de certaines figures extraites de l’ouvrage « La Résistance chez les plantes : Principes de la stratégie défensive et applications agronomiques », N. Benhamou (2009).
Bibliographie
- Ahuja, I., R. Kissen et A.M. Bones. 2012. Phytoalexins in defense against pathogens. Trends Plant Sci. 17 : 73-90.
- Aist, J.R. 1976. Papillae and related wound plugs of plant cells. Annu. Rev. Phytopathol. 14 : 145-163.
- Ait-Barka, E., P. Eullaffroy, C. Clément et G. Vernet. 2004. Chitosan improves development and protects Vitis vinifera L. against Botrytis cinerea. Plant Cell Rep. 22 : 608-614.
- Albert, F. et A.J. Anderson. 1987. The effect of Pseudomonas putida colonization on root surface peroxydase. Plant Physiol. 85 : 537-541.
- Aldington, S. et S.C. Fry. 1993. Oligosaccharins. Adv. Bot. Res. 19 : 1-101.
- Alström, S. 1991. Induction of disease resistance in common bean susceptible to halo blight bacterial pathogen after seed bacterization with rhizosphere Pseudomonads. J. Gen. Appl. Microbiol. 37 : 495-501.
- Anderson, A.J. 1989. The biology of glycoproteins as elicitors. Pages 87-130 dans T. Kosuge et E.W. Nester (éds.), Plant–microbe interactions: Molecular and genetic perspectives. McGraw Hill, New York, É.-U.
- Arlat, M., F. Van Gijsegem, J.C. Huet, J.C. Pernollet et C.A. Boucher. 1994. PopA1, a protein which induces a hypersensitivity-like response on specific Petunia genotypes, is secreted via the Hrp pathway of Pseudomonas solanacearum. EMBO J. 13 : 543-553.
- Assmann, S.M. 2002. Heterotrimeric and unconventional GTP binding proteins in plant cell signaling. Plant Cell 14 : 355-373.
- Aziz, A., B. Poinssot, X. Daire, M. Adrian, A. Bézier, B. Lambert, J.M. Joubert et A. Pugin. 2003. Laminarin elicits defense responses in grapevine and induces protection against Botrytis cinerea and Plasmopara viticola. Mol. Plant-Microbe Interact. 16 : 1118-1128.
- Baier, M., A. Kandlbinder, D. Golldack et K.J. Dietz. 2005. Oxidative stress and ozone: perception, signalling and response. Plant Cell Environ. 28 : 1012-1020.
- Barber, M.S., R.E. Bertram et J.P. Ride. 1989. Chitin oligosaccharides elicit lignification in wounded wheat leaves. Physiol. Mol. Plant Pathol. 34 : 3-12.
- Baulcombe, D. 2001. Diced defense: RNA silencing. Nature 409 : 295-296.
- Baulcombe, D. 2004. RNA silencing in plants. Nature 431 : 356-363.
- Benhamou, N. 2009. La résistance chez les plantes : principes de la stratégie défensive et applications agronomiques. Lavoisier, France. 376 p.
- Benhamou, N. et R.R. Bélanger. 1998. Benzothiadiazole-mediated induced resistance to Fusarium oxysporum f. sp. radicis-lycopersici in tomato. Plant Physiol. 118 : 1203-1212.
- Benhamou, N. et P.J. Lafontaine. 1995. Ultrastructural and cytochemical characterization of elicitor-induced structural responses in tomato root tissues infected by Fusarium oxysporum f. sp. radicis-lycopersici. Planta 197 : 89-102.
- Benhamou, N. et M. Nicole. 1999. Cell biology of plant immunization against microbial infection: the potential of induced resistance in controlling plant diseases. Plant Physiol. Biochem. 37 : 703-719.
- Benhamou, N., P.J. Lafontaine et M. Nicole. 1994. Induction of systemic resistance to Fusarium crown and root rot in tomato plants by seed treatment with chitosan. Phytopathology 84 : 1432-1444.
- Benhamou, N., R.R. Bélanger et T.C. Paulitz. 1996a. Ultrastructural and cytochemical aspects of the interaction between Pseudomonas fluorescens and Ri T-DNA transformed pea roots: host response to colonization by Pythium ultimum Trow. Planta 199 : 105-117.
- Benhamou, N., R.R. Bélanger et T.C. Paulitz. 1996b. Induction of differential host responses by Pseudomonas fluorescens in RiT-DNA transformed pea roots after challenge with Fusarium oxysporum f. sp. pisi and Pythium ultimum. Phytopathology 86 : 1174-1185.
- Benhamou, N., J.W. Kloepper, A. Quadt-Hallman et S. Tuzun. 1996c. Induction of defense-related ultrastructural modifications in pea root tissues inoculated with endophytic bacteria. Plant Physiol. 112 : 919-929.
- Benhamou, N., P. Rey, M. Chérif, J. Hockenhull et Y. Tirilly. 1997. Treatment with the mycoparasite Pythium oligandrum triggers induction of defense-related reactions in tomato roots when challenged with Fusarium oxysporum f. sp. radicis-lycopersici. Phytopathology 87 : 108-122.
- Bernstein, E., A.A. Caudy, S.M. Hammond et G.J. Hannon. 2001. Role of a bidentate ribonuclease in the initiation step of RNA interference. Nature 409 : 363-366.
- Blée, E. et J. Joyard. 1996. Envelope membranes from spinach chloroplasts are a site of metabolism of fatty acid hydroperoxides. Plant Physiol. 110 : 445-454.
- Bhuiyan, N.H., G. Selvaraj, Y. Wei et J. King. 2009. Role of lignification in plant defense. Plant Signal. Behav. 4: 158-159.
- Boller, T. 1995. Chemoperception of microbial signals in plant cells. Annu. Rev. Plant Physiol. Plant Mol. Biol. 46: 189-214.
- Boller, T. et G. Felix. 1996. Olfaction in plants: specific perception of common microbial molecules. Pages 1-8 dans G. Stacey, B. Mullin et P.M. Gresshoff (éds.), Biology of plant-microbe interactions. International Society for Molecular Plant-Microbe Interactions, Knoxville, É.-U.
- Bolwell, G.P. 1999. Role of active oxygen species and NO in plant defence responses. Curr. Opin. Plant Biol. 2 : 287-294.
- Bostock, R.M. 1999. Signal conflicts and synergies in induced resistance to multiple attackers. Physiol. Mol. Plant Pathol. 55 : 99-109.
- Bray, E.A. 1997. Plant responses to water deficit. Trends Plant Sci. 2 : 48-54.
- Cervone, F., M.G. Hahn, G. de Lorenzo, A. Darvill et P. Albersheim. 1989. Host-pathogen interactions. XXXIII. A plant protein converts a fungal pathogenesis factor into an elicitor of plant defense responses. Plant Physiol. 90 : 542-548.
- Cervone, F., G. de Lorenzo, R. Pressey, A.G. Darvill et P. Albersheim. 1990. Can Phaseolus PGIP inhibit pectic enzymes from microbes and plants? Phytochemistry 29 : 447-449.
- Charles, M.T., A. Goulet et J. Arul. 2008a. Physiological basis of UV-C induced resistance to Botrytis cinerea in tomato fruit. IV. Biochemical modification of structural barriers. Postharvest Biol. Technol. 47 : 41-53.
- Charles, M.T., N. Benhamou et J. Arul. 2008b. Physiological basis of UV-C induced resistance to Botrytis cinerea in tomato fruit. III. Ultrastructural modifications and their impact on fungal colonization. Postharvest Biol. Technol. 47 : 27-40.
- Chehab, E.W. et J. Braam. 2012. Jasmonates in plant defense responses. Pages 67-88 dans G. Witzany et F. Baluska (éds.), Signaling and communication in plants, Vol. 14. Springer-Verlag, Berlin.
- Chérif, M., N. Benhamou, J.G. Menzies et R.R. Bélanger. 1992. Silicon-induced resistance in cucumber plants against Pythium ultimum. Physiol. Mol. Plant Pathol. 41 : 411-425.
- Chester, K.S. 1933. The problem with acquired physiological immunity in plants. Quart. Rev. Biol. 8 : 129-154.
- Chrisholm, S.T., G. Coaker, B. Day et B.J. Staskawicz. 2006. Host-microbe interactions: shaping and evolution of the plant immune response. Cell 124 : 803-814.
- Coll, N.S., P. Epple et J.L. Dangl. 2011. Programmed cell death in the plant immune system. Cell Death Differ. 18 : 1247-1256.
- Collmer, A. et N.T. Keen. 1986. The role of pectic enzymes in plant pathogenesis. Annu. Rev. Phytopathol. 24 : 383-409.
- Cook, B.J., R.P. Clay, C.W. Bergmann, P. Albersheim et A.G. Darvill. 1999. Fungal polygalacturonases exhibit different substrate degradation patterns and differ in their susceptibilities to polygalacturonase-inhibiting proteins. Mol. Plant-Microbe Interact. 12 : 703-711.
- Côté, F. et M.G. Hahn. 1994. Oligosaccharins: structures and signal transduction. Plant Mol. Biol. 26 : 1379-1411.
- Côté, F., K.A. Roberts et M.G. Hahn. 2000. Identification of high-affinity binding sites for the hepta-beta-glucoside elicitor in membranes of the model legumes Medicago truncatula and Lotus japonicus. Planta 211 : 596-605.
- Cvetkovska, M. et G.C. Vanlerberghe. 2012. Alternative oxidase modulates leaf mitochondrial concentrations of superoxide and nitric oxide. New Phytol. 195 : 32-39.
- Dakora, F.D. et D.A. Phillips. 1996. Diverse functions of isoflavonoids in legume transcend anti-microbial definitions of phytoalexins. Physiol. Mol. Plant Pathol. 49 : 1-20.
- Darvill, A. et P. Albersheim. 1984. Phytoalexins and their elicitors - a defense against microbial infection in plants. Annu. Rev. Plant Physiol. 35 : 243-275.
- Dat, J., S. Vandenabeele, E. Vranová, M. Van Montagu, D. Inzé et F. Van Breusegem. 2000. Dual action of active oxygen species during plant stress responses. Cell. Mol. Life Sci. 57 : 779-795.
- Delaney, T.P., S. Uknes, B. Vernooij, L. Friedrich, K. Weymann, D. Negrotto, T. Gaffney, M. Gut-Rella, H. Kessmann, E. Ward et J. Ryals. 1994. A central role of salicylic acid in plant disease resistance. Science 266 : 1247-1250.
- Denness, L., J.F. McKenna, C. Segonzac, A. Wormit, P. Madhou, M. Bennett, J. Mansfield, C. Ziepfel et T. Hamann. 2011. Cell wall damage-induced lignin biosynthesis is regulated by a reactive oxygen species- and jasmonic acid-dependent process in Arabidopsis. Plant Physiol. 156: 1364-1374.
- De Wit, P.J.G.M. 2007. How plants recognize pathogens and defend themselves. Cell. Mol. Life Sci. 64 : 2726-2732.
- Dhondt, S., P. Geoffroy, B.A. Stelmach, M. Legrand et T. Heitz. 2000. Soluble phospholipase A2 activity is induced before oxylipin accumulation in tobacco mosaic virus-infected tobacco leaves and is contributed by patatin-like enzymes. Plant J. 23 : 431-440.
- Dixon, R.A., M.J. Harrison et C.J. Lamb. 1994. Early events in the activation of plant defense responses. Annu. Rev. Phytopathol. 32 : 479-501.
- Dixon, R.A., M.J. Harrison et N.L. Paiva. 1995. The isoflavonoid phytoalexin pathway: from enzymes to genes to transcription factors. Physiol. Plant. 93 : 385-392.
- Doares, S.H., T. Syrovets, E.W. Weiler et C.A. Ryan. 1995. Oligogalacturonides and chitosan activate plant defensive genes through the octadecanoid pathway. Proc. Natl. Acad. Sci. USA 92 : 4095-4098.
- Dong, X. 1998. SA, JA, ethylene, and disease resistance in plants. Curr. Opin. Plant Biol. 1 : 316-323.
- Dunoyer, P., C. Himber et O. Voinnet. 2005. DICER-LIKE 4 is required for RNA interference and produces the 21-nucleotide small interfering RNA component of the plant cell-to-cell silencing signal. Nat. Genet. 37 : 1356-1360.
- Ebel, J. et E.G. Cosio. 1994. Elicitors of plant defense responses. Int. Rev. Cytol. 148 : 1-36.
- Fawe, A., M. Abou-Zaid, J.G. Menzies et R.R. Bélanger. 1998. Silicon-mediated accumulation of flavonoid phytoalexins in cucumber. Phytopathology 88 : 396-401.
- Felix, G., M. Regenass, P. Spanu et T. Boller. 1994. The protein phosphatase inhibitor calyculin A mimics elicitor action in plant cells and induces rapid hyperphosphorylation of specific proteins as revealed by pulse labeling with [33P] phosphate. Proc. Natl. Acad. Sci. USA 91 : 952-956.
- Flor, H.H. 1971. Current status of the gene-for-gene concept. Annu. Rev. Phytopathol. 9 : 275-296.
- Fofana, B., N. Benhamou, D. McNally, C. Labbé, A. Séguin et R.R. Bélanger. 2005. Suppression of induced resistance in cucumber through disruption of the flavonoid pathway. Phytopathology 95 : 114-123.
- Foissner, I., D. Wendehenne, C. Langebartels et J. Durner. 2000. In vivo imaging of an elicitor-induced nitric oxide burst in tobacco. Plant J. 23 : 817-824.
- Foyer, C.H. et G. Noctor. 2005. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context. Plant Cell Environ. 28 : 1056-1071.
- Gaffney, T., L. Friedrich, B. Vernooij, D. Negrotto, G. Nye, S. Uknes, E. Ward, H. Kessmann et J. Ryals. 1993. Requirement of salicylic acid for the induction of systemic acquired resistance. Science 261 : 754-756.
- Garcia-Brugger, A., O. Lamotte, E. Vandelle, S. Bourque, D. Lecourieux, B. Poinssot, D. Wendehenne et A. Pugin. 2006. Early signaling events induced by elicitors of plant defenses. Mol. Plant-Microbe Interact. 19 : 711-724.
- Gianinazzi, S., J.C. Martin et J.C. Vallée. 1970. Hypersensibilité aux virus, température et protéines solubles chez Nicotiana xanthi n.c. Apparition de nouvelles macromolécules lors de la répression de la synthèse virale. C. R. Acad. Sci. Paris 270 : 2383-2386.
- Gnanamanickam, S.S. et S.S. Patil. 1977. Accumulation of antibacterial isoflavonoids in hypersensitively responding bean leaf tisues inoculated with Pseudomonas phaseolicola. Physiol. Plant Pathol. 10 : 159-168.
- Gough, C.L., S. Genin, C. Zischek et C.A. Boucher. 1992. Hrp genes of Pseudomonas solanacearum are homologous to pathogenicity determinants of animal pathogenic bacteria and are conserved among plant pathogenic bacteria. Mol. Plant-Microbe Interact. 5 : 384-389.
- Hadwiger, L.A. 1999. Host–parasite interactions: elicitation of defence responses in plants with chitosan. EXS 87 : 185-200.
- Hadwiger, L.A., T. Ogawa et H. Kuyama. 1994. Chitosan polymer sizes effective in inducing phytoalexin accumulation and fungal suppression are verified with synthesized oligomers. Mol. Plant-Microbe Interact. 7 : 531-533.
- Hahn, M.G., P. Bucheli, F. Cervone, S.H. Doares, R.A. O’Neill, A.G. Darvill et P. Albersheim. 1989. The role of cell wall constituents in plant-pathogen interactions. Pages 131-181 dans T. Kosuge et E.W. Nester (éds.), Plant–microbe interactions: Molecular and genetic perspectives. McGraw Hill, New York, É.-U.
- Hain, R., H.J. Reif, E. Krause, R. Langebartels, H. Kindl, B. Vornam, W. Wiese, E. Schmelzer, P.H. Schreier, R.H. Stöcker et K. Strenzel. 1993. Disease resistance results from foreign phytoalexin expression in a novel plant. Nature 361 : 153-156.
- Heidel, A.J. et I.T. Baldwin. 2004. Microarray analysis of salicylic acid- and jasmonic acid-signalling in responses of Nicotiana attenuata to attack by insects from multiple feeding guilds. Plant Cell Environ. 27: 1362-1373.
- Hendrix, J.W. 1970. Sterols in growth and reproduction of fungi. Annu. Rev. Phytopathol. 8 : 111-130.
- Henzler, T. et E. Steudle. 2000. Transport and metabolic degradation of hydrogen peroxide in Chara corallina: model calculations and measurements with the pressure probe suggest transport of H2O2 across water channels. J. Exp. Bot. 51 : 2053-2066.
- Hipskind, J.D. et N.L. Paiva. 2000. Constitutive accumulation of a resveratrol-glucoside in transgenic alfalfa increases resistance to Phoma medicaginis. Mol. Plant-Microbe Interact. 13 : 551-562.
- Hu, X., D.L. Bidney, N. Yalpani, J.P. Duvick, O. Crasta, O. Folkerts et G. Lu. 2003. Overexpression of a gene encoding hydrogen peroxide-generating oxalate oxidase evokes defense responses in sunflower. Plant Physiol. 133 : 170-181.
- Ingham, J.L. 1973. Disease resistance in higher plants. The concept of pre-infectional and post-infectional resistance. Phytopathol. Z. 78 : 314-335.
- Iwasaki, T. et Y. Hioki. 1988. Enhancement of biocide. U.S. Pat. No. 4,762,547.
- Jeffree, C.E. 1996. Structure and ontogeny of plant cuticles. Pages 33-82 dans G. Kerstiens (éd.), Plant cuticles: an integrated functional approach. Bios Scientific Publishers, Oxford, G.-B.
- Jones, J.D.G. et J.L. Dangl. 2006. The plant immune system. Nature 444 : 323-329.
- José-Estanyol, M., F.X. Gomis-Rüth et P. Puigdomènech. 2004. The eight-cysteine motif, a versatile structure in plant proteins. Plant Physiol. Biochem. 42 : 355-365.
- Kauffmann, S., S. Dorey et B. Fritig. 1999. Les stratégies de défense des plantes. Pour la Science 262 : 30-37.
- Kauss, H., W. Jeblick et A. Domard. 1989. The degrees of polymerization and N-acetylation of chitosan determine its ability to elicit callose formation in suspension cells and protoplasts of Catharanthus roseus. Planta 178 : 385-392.
- Kendra, D.F. et L.A. Hadwiger. 1984. Characterization of the smallest chitosan oligomer that is maximally antifungal to Fusarium solani and elicits pisatin formation in Pisum sativum. Exp. Mycol. 8 : 276-281.
- Kessler, A. et I.T. Balwin. 2002. Plant responses to insect herbivory: the emerging molecular analysis. Annu. Rev. Plant Biol. 53 : 299-328.
- Kessmann, H., T. Staub, C. Hofmann, T. Maetzke, J. Herzog, E. Ward, S. Uknes et J. Ryals. 1994. Induction of systemic acquired disease resistance in plants by chemicals. Annu. Rev. Phytopathol. 32 : 439-459.
- Kieffer, F., J. Lherminier, F. Simon-Plas, M. Nicole, M. Paynot, T. Elmayan et J.P. Blein. 2000. The fungal elicitor cryptogein induces cell wall modifications on tobacco cell suspension. J. Exp. Bot. 51 : 1799-1811.
- Kim, S.T., K.S. Cho, S.G. Kim, S.Y. Kang et K.Y. Kang. 2003. A rice isoflavone reductase-like gene, OsIRL, is induced by rice blast fungal elicitor. Mol. Cell 16 : 224-231.
- King, A. et G. Young. 1999. Characteristics and occurrence of phenolic phytochemicals. J. Am. Diet. Assoc. 99 : 213-218.
- Klarzynski, O. et B. Fritig. 2001. Stimulation des défenses naturelles des plantes. C. R. Acad. Sci. Paris, Ser. III. 324 : 953-963.
- Kloepper, J.W. 1991. Plant growth-promoting rhizobacteria as biological control agents of soilborne diseases. Pages 142-156 dans J. Bay-Petersen (éd.), Biological control of plant diseases. FFTC Booh Series No 42. Food and Fertilizer Technology Center, Taiwan.
- Kloepper, J.W. 1993. Plant growth-promoting rhizobacteria as biological control agents. Pages 255-274 dans B. Melting (éd.), Soil microbial technologies. M. Dekker Inc., New York, É.-U.
- Kloepper, J.W. et M.N. Schroteh. 1981. Plant growth-promoting rhizobacteria and plant growth under gnoto-biotic conditions. Phytopathology 71 : 642-644.
- Knoester, M., J.F. Bol, L.C. van Loon et H.J.M. Linthorst. 1995. Virus-induced gene expression for enzymes of ethylene biosynthesis in hypersensitively reacting tobacco. Mol. Plant-Microbe Interact. 8 : 177-180.
- Kombrink, E. et I.E. Somssich. 1997. Pathogenesis-related proteins and plant defense. Pages 107-128 dans G.C. Carroll et P. Tudzynski (éds.), The Mycota V, Part A: Plant relationships. Springer-Verlag, Berlin.
- Komoriya, K., N. Shibano, T. Higano, N. Azuma, S. Yamaguchi et S.I. Aizawa. 1999. Flagellar proteins and type III-exported virulence factors are the predominant proteins secreted into the culture media of Salmonella typhimurium. Mol. Microbiol. 34 : 767-779.
- Kùc, J. 1987. Plant immunization and its applicability for disease control. Pages 255-274 dans I. Chet (éd.), Innovative approaches to plant disease control. John Wiley & Sons, New York, É.-U.
- Kunoh, H., K. Matsuoka et I. Kobayashi. 1996. Ultrastructure of papillae induced in barley coleoptile cells by a pathogen, Erysiphe graminis, and a non-pathogen, E. pisi. Fitopatol. Brasil. 21 : 418–425.
- Lafitte C., J.P. Barthe, J.L. Montillet et A. Touzé. 1984. Glycoprotein inhibitors of Colletotrichum lindemuthianum endopolygalacturonase in near isogenic lines of Phaseolus vulgaris resistant and susceptible to anthracnose. Physiol. Plant Pathol. 25 : 39-53.
- Lafontaine, P.J. et N. Benhamou. 1996. Chitosan treatment: an emerging strategy for enhancing resistance of greenhouse tomato plants to infection by Fusarium oxysporum f. sp. radicis-lycopersici. Biocontrol Sci. Technol. 6 : 111-124.
- Lamb, C.J. et R.A. Dixon. 1997. The oxidative burst in plant disease resistance. Annu. Rev. Plant Physiol. Plant Mol. Biol. 48 : 251-275.
- Lawton, K.A., S.L. Potter, S. Uknes et J. Ryals. 1994. Acquired resistance signal transduction in Arabidopsis is ethylene independent. Plant Cell 6 : 581-588.
- Lawton, K.A., K. Weymann, L. Friedrich, B. Vernooij, S. Uknes et J. Ryals. 1995. Systemic acquired resistance in Arabidopsis requires salicylic acid but not ethylene. Mol. Plant-Microbe Interact. 8 : 863-870.
- Lawton, K.A., L. Friedrich, M. Hunt, K. Weymann, T. Delaney, H. Kessmann, T. Staub et J. Ryals. 1996. Benzothiadiazole induces disease resistance in Arabidopsis by activation of the systemic acquired resistance signal transduction pathway. Plant J. 10 : 71-82.
- Lebrun-Garcia, A., F. Ouaked, A. Chiltz et A. Pugin. 1998. Activation of MAPK homologues by elicitors in tobacco cells. Plant J. 15 : 773-781.
- Lecourieux-Ouaked, F., A. Pugin et A. Lebrun-Garcia. 2000. Phosphoproteins involved in the signal transduction of cryptogein, an elicitor of defense reactions in tobacco. Mol. Plant-Microbe Interact. 13 : 821-829.
- Lee, S.C. et C.A. West. 1981. Properties of Rhizopus stolonifer polygalacturanase, an elicitor of casbene synthetase activity in castor bean (Ricinus communis L.) seedlings. Plant Physiol. 67 : 640-645.
- Lemanceau, P. 1989. Role of competition for carbon and iron in mechanisms of soil suppressiveness to Fusarium wilts. Pages 385-396 dans E.C. Tjamos et C.H. Beckman (éds.), Vascular wilts diseases of plants: Basic studies and control. Springer-Verlag, Berlin.
- Lemanceau, P. et C. Alabouvette. 1993. Suppression of Fusarium wilts by fluorescent pseudomonads: mechanisms and applications. Biocontrol Sci. Technol. 3 : 219-234.
- Levine, A., R. Tenhaken, R. Dixon et C. Lamb. 1994. H2O2 from the oxidative burst orchestrates the plant hypersensitive disease resistance response. Cell 79 : 583-593.
- Lherminier, J., N. Benhamou, J. Larrue, M.L. Milat, E. Boudon-Padieu, M. Nicole et J.P. Blein. 2003. Cytological characterization of elicitin-induced protection in tobacco plants infected by Phytophthora parasitica or phytoplasma. Phytopathology 93 : 1308-1319.
- Li, J., G. Brader et E.T. Palva. 2004. The WRKY70 transcription factor: a node of convergence for jasmonate- mediated and salicylate-mediated signals in plant defense. Plant Cell 16 : 319-331.
- Lin, W., X. Hu, W. Zhang, W.J. Rogers et W. Cai. 2005. Hydrogen peroxide mediates defence responses induced by chitosans of different molecular weights in rice. J. Plant Physiol. 162 : 937-944.
- Low, P.S. et J.R. Merida. 1996. The oxidative burst in plant defense: function and signal transduction. Physiol. Plant. 96 : 533-542.
- Lu, H. 2009. Dissection of salicylic acid-mediated defense signaling networks. Plant Signal. Behav. 4 : 713-717.
- Malamy, J. et D.F. Klessig. 1992. Salicylic acid and plant disease resistance. Plant J. 2 : 643-654.
- Maleck, K., A. Levine, T. Eulgem, A. Morgen, J. Schmid, K.A. Lawton, J.L. Dangl et R.A. Dietrich. 2000. The transcriptome of Arabidopsis thaliana during systemic acquired resistance. Nat. Genet. 26 : 403-410.
- Mathieu, Y., A. Kurkdjian, H. Xia, J. Guern, A. Koller, M.D. Spiro, M. O’Neill, P. Albersheim et A. Darvill. 1991. Membrane responses induced by oligogalacturonides in suspension-cultured tobacco cells. Plant J. 1 : 333-343.
- Mathieu, Y., D. Lapous, S. Thomine, C. Laurière et J. Guern. 1996. Cytoplasmic acidification as an early phosphorylation-dependent response of tobacco cells to elicitors. Planta 199 : 416-424.
- Maxwell, D.P., Y. Wang et L. McIntosh. 1999. The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells. Proc. Natl. Acad. Sci. USA 96 : 8271-8276.
- McNally, D.J., K.V. Wurms, C. Labbé et R.R. Bélanger. 2003. Synthesis of C-glycosyl flavonoid phytoalexins as a site-specific response to fungal penetration in cucumber. Physiol. Mol. Plant Pathol. 63 : 293-303.
- Meindl, T., T. Boller et G. Felix. 2000. The bacterial elicitor flagellin activates its receptor in tomato cells according to the address-message concept. Plant Cell 12 : 1783-1794.
- Memelink, J., R. Verpoorte et J.W. Kijne. 2001. Organization of jasmonate-responsive gene expression in alkaloid metabolism. Trends Plant Sci. 6 : 212-219.
- Mikes, V., M.L. Milat, M. Ponchet, P. Ricci et J.P. Blein. 1997. The fungal elicitor cryptogein is a sterol carrier protein. FEBS Lett. 416 : 190-192.
- Mikkelsen, M.D., B.L. Peterson, E. Glawisching, A.B. Jensen, E. Andreasson et B.A. Halkier. 2003. Modulation of CYP79 genes and glucosinolate profiles in Arabidopsis by defense signalling pathways. Plant Physiol. 131 : 298-308.
- Milat, M.L., P. Ricci, P. Bonnet et J.P. Blein. 1991. Capsidiol and ethylene production by tobacco cells in response to cryptogein, an elicitor from Phytophthora cryptogea. Phytochemistry 30 : 2171-2173.
- Mirjalili, N. et J.C. Linden. 1996. Methyl jasmonate induced production of taxol in suspension cultures of Taxus cuspidate: ethylene interaction and induction models. Biotechnol. Prog. 12 : 110-118.
- Mitchell, H.J., J.L. Hall et M.S. Barber. 1994. Elicitor-induced cinnamyl alcohol dehydrogenase activity in lignifying wheat (Triticum aestivum L.) leaves. Plant Physiol. 104 : 551-556.
- Mittler, R., S. Vanderauwera, N. Suzuki, G. Miller, V.B. Tognetti, K. Vandepoele, M. Gollery, V. Shulaev et F. Van Breusegem. 2011. ROS signaling: the new wave? Trends Plant Sci. 16 : 300-309.
- Molders, W., A. Buchala et J.P. Metraux. 1996. Transport of salicylic acid in tobacco necrosis virus-infected cucumber plants. Plant Physiol. 112 : 787-792.
- Mosblech, A., I. Feussner et I. Heilmann. 2009. Oxylipins: structurally diverse metabolites from fatty acid oxidation. Plant Physiol. Biochem. 47: 511-517.
- Mourrain, P., C. Béclin, T. Elmayan, F. Feuerbach, C. Gordon, J.B. Morel, D. Jouette, A.M. Lacombe, S. Nikic, N. Picault, K. Rémoué, M. Sanial, T.A. Vo et H. Vaucheret. 2000.Arabidopsis SGS2 and SGS3 genes are required for posttranscriptional gene silencing and natural virus resistance. Cell 101 : 533-542.
- Müller, K.O. et H. Börger. 1940. Experimentelle untersuchungen über die Phytophthora resistenz der kartoffel. Arb. Biol. Reichsanst. Land-Forstwirtsch, Berlin-Dahlem. 23 : 189-231.
- Nicholson, R.L. et R. Hammerschmidt. 1992. Phenolic compounds and their role in disease resistance. Annu. Rev. Phytopathol. 30 : 369-389.
- Niki, T., I. Mitsuhara, S. Seo, N. Ohtsubo et Y. Ohashi. 1998. Antagonistic effect of salicylic acid and jasmonic acid on the expression of pathogenesis-related (PR) protein genes in wounded mature tobacco leaves. Plant Cell Physiol. 39 : 500-507.
- Nürnberger, T. et D. Scheel. 2001. Signal transmission in the plant immune response. Trends Plant Sci. 6 : 372-379.
- Oksanen, E., E. Häikiö, J. Sober et D.F. Karnosky. 2004. Ozone-induced H2O2 accumulation in field-grown aspen and birch is linked to foliar ultrastructure and peroxisomal activity. New Phytol. 161 : 791-799.
- Orr, G.L., J.A. Strickland et T.A. Walsh. 1994. Inhibition of Diabrotica larval growth by a multicystatin from potato tubers. J. Insect Physiol. 40 : 893-900.
- Panabières, F., M. Ponchet, V. Allasia, L. Cardin et P. Ricci. 1997. Characterization of border species among Pythiaceae: several Pythium isolates produce elicitins, typical proteins from Phytophthora spp. Mycol. Res. 101 : 1459-1468.
- Paulitz, T.C., T. Zhou et L. Rankin. 1992. Selection of rhizospere bacteria for biological control of Pythium aphanidermatum on hydroponically grown cucumber. Biol. Control. 2 : 226-237.
- Penninckx, I.A., B.P. Thomma, A. Buchala, J.P. Métraux et W.F. Broekaert. 1998. Concomitant activation of jasmonate and ethylene response pathways is required for induction of a plant defensin gene in Arabidopsis. Plant Cell 10 : 2103-2113.
- Ponchet, M., F. Panabières, M.L. Milat, V. Mikes, J.L. Montillet, L. Suty, C. Triantaphylides, Y. Tirilly et J.P. Blein. 1999. Are elicitins cryptograms in plant-Oomycete communications? Cell. Mol. Life Sci. 56 : 1020-1047.
- Pugin, A., J.M. Frachisse, E. Tavernier, R. Bligny, E. Gout, R. Douce et J. Guern. 1997. Early events induced by the elicitor cryptogein in tobacco cells: involvement of a plasma membrane NADPH oxidase and activation of glycolysis and the pentose phosphate pathway. Plant Cell 9 : 2077-2091.
- Pulliam, D.A., D.L. Williams, R.M. Broadway et C.N. Stewart. 2001. Isolation and characterization of a serine protenase inhibitor cDNA from cabbage and its antibiosis in transgenic tobacco plants. Plant Cell Biotechnol. Mol. Biol. 2 : 19-32.
- Rankin, L. et T.C. Paulitz. 1994. Evaluation of rhizosphere bacteria for biological control of Pythium root rot of greenhouse cucumbers in hydroponic culture. Plant Dis. 78 : 447-451.
- Rasmussen, J.B., R. Hammerschmidt et M.N. Zook. 1991. Systemic induction of salicylic acid accumulation in cucumber after inoculation with Pseudomonas syringae pv syringae. Plant Physiol. 97 : 1342-1347.
- Reglinski, T., G.D. Lyon et A.C. Newton. 1994. Assessment of the ability of yeast-derived elicitors to control barley powdery mildew in the field. J. Plant Dis. Prot. 101 : 1-10.
- Rhoads, D.M. et C.C. Subbaiah. 2007. Mitochondria retrograde regulation in plants. Mitochondrion 7 : 177-194.
- Ricci, P., P. Bonnet, J.C. Huet, M. Sallantin, F. Beauvais-Cante, M. Bruneteau, V. Billard, G. Michel et J.C. Pernollet. 1989. Structure and activity of proteins from pathogenic fungi Phytophthora eliciting necrosis and acquired resistance in tobacco. Eur. J. Biochem. 183 : 555-563.
- Robert-Seilaniantz, A., M. Grant et J.D.G. Jones. 2011. Hormone crosstalk in plant disease and defense: more than just JASMONATE-SALICYLATE antagonism. Annu. Rev. Phytopathol. 49 : 317-343.
- Romeis, T., P. Piedras, S. Zhang, D.F. Klessig, H. Hirt et J.D. Jones. 1999. Rapid Avr9- and Cf-9-dependent activation of MAP kinases in tobacco cell cultures and leaves: convergence of resistance gene, elicitor, wound, and salicylate responses. Plant Cell 11 : 273-287.
- Roos, W., B. Dordschbal, J. Steighardt, M. Hieke, D. Weiss et G. Saalbach. 1999. A redox-dependent G-protein-coupled phospholipase A of the plasma membrane is involved in the elicitation of alkaloid biosynthesis in Eschscholtzia californica. Biochem. Biophys. Acta 1448 : 390-402.
- Ross, A.F. 1961a. Localized acquired resistance to plant virus infection in hypersensitive hosts. Virology 14 : 329-339.
- Ross, A.F. 1961b. Systemic acquired resistance induced by localized virus infections in plants. Virology 14 : 340-358.
- Rouxel, T. 1989. Les phytoalexines et leur intervention dans la résistance hypersensible aux champignons phytopathogènes. Agronomie 9 : 529-545.
- Rustérucci, C., V. Stallaert, M.L. Milat, A. Pugin, P. Ricci et J.P. Blein. 1996. Relationship between active oxygen species, lipid peroxidation, necrosis, and phytoalexin production induced by elicitins in Nicotiana. Plant Physiol. 111 : 885-891.
- Ryan, C.A. 1990. Protease inhibitors in plants: genes for improving defenses against insects and pathogens. Annu. Rev. Phytopathol. 28 : 425-449.
- Sakano, K. 2001. Metabolic regulation of pH in plant cells: role of cytoplasmic pH in defense reaction and secondary metabolism. Int. Rev. Cytol. 206 : 1-44.
- Samatey, F.A., K. Imada, S. Nagashima, F. Vonderviszt, T. Kumasaka, M. Yamamoto et K. Namba. 2001. Structure of the bacterial flagellar protofilament and implications for a switch for supercoiling. Nature 410 : 331-337.
- Schaller, F. 2001. Enzymes of the biosynthesis of octadecanoid-derived signalling molecules. J. Exp. Bot. 52 : 11-23.
- Scheel, D. 1998. Resistance response physiology and signal transduction. Curr. Opin. Plant Biol. 1 : 305-310.
- Scheffer, R.J. 1983. Biological control of dutch elm disease by Pseudomonas species. Ann. Appl. Biol. 103 : 21-30.
- Schimoler-O’Rourke, R., M. Richardson et C.P. Selitrennikoff. 2001. Zeamatin inhibits trypsin and α-amylase activities. Appl. Environ. Microbiol. 67 : 2365-2366.
- Schmelz, E.A., J. Engelberth, H.T. Alborn, P. O’Donnell, M. Sammons, H. Toshima et J.H Tumlinson. 2003. Simultaneous analysis of phytohormones, phytotoxins, and volatile organic compounds in plants. Proc. Natl. Acad. Sci. USA 100 : 10552-10557.
- Selitrennikoff, C.P. 2001. Antifungal proteins. Appl. Environ. Microbiol. 67 : 2883-2894.
- Sels, J., J. Mathys, B.M.A. De Coninck, B.P.A. Cammue, et M.F.C. De Bolle. 2008. Plant pathogenesis-related (PR) proteins: a focus on PR peptides. Plant Physiol. Biochem. 46 : 941-950.
- Sendon, P.M., H.S. Seo et J.T. Song. 2011. Salicylic acid signaling: biosynthesis, metabolism, and crosstalk with jasmonic acid. J. Korean Soc. Appl. Biol. Chem. 54 : 501-506.
- Shi, J., W.C. Mueller et C.H. Beckman. 1992. Vessel occlusion and secretory activities of vessel contact cells in resistant and susceptible cotton plants infected with Fusarium oxysporum f. sp. vasinfectum. Physiol. Mol. Plant Pathol. 40 : 133-147.
- Simon-Plas, F., C. Rustérucci, M.L. Milat, C. Humbert, J.L. Montillet et J.P. Blein. 1997. Active oxygen species production in tobacco cells elicited by cryptogein. Plant Cell Environ. 20 : 1573-1579.
- Skipp, R.A. et J.A. Bailey. 1976. The effect of phaseollin on the growth of Colletotrichum lindemuthianum in bio-assays designed to measure fungitoxicity. Physiol. Plant Pathol. 9 : 253-257.
- Stekoll, M. et C.A. West. 1978. Purification and properties of an elicitor of castor bean phytoalexin from culture filtrates of the fungus Rhizopus stolonifer. Plant Physiol. 61 : 38-45.
- Sticher, L., B. Mauch-Mani et J.P. Métraux. 1997. Systemic acquired resistance. Annu. Rev. Phytopathol. 35 : 235-270.
- Stulemeijer, I.J.E. et M.H.A.J. Joosten. 2008. Post-translational modification of host proteins in pathogen-triggered defence signalling in plants. Mol. Plant Pathol. 9 : 545-560.
- Suarez-Rodriguez, M.C., M. Petersen et J. Mundy. 2010. Mitogen-activated protein kinase signaling in plants. Annu. Rev. Plant Biol. 61: 621-649.
- Tamogami, S., R. Rakwa et O. Kodama. 1997. Phytoalexin production elicited by exogenously applied jasmonic acid in rice leaves (Oryza sativa L.) is under the control of cytokinins and ascorbic acid. FEBS Lett. 412 : 61-64.
- Tavernier, E., D. Wendehenne, J.P. Blein et A. Pugin. 1995. Involvement of free calcium in action of cryptogein, a proteinaceous elicitor of hypersensitive reaction in tobacco cells. Plant Physiol. 109 : 1025-1031.
- Tena, G., M. Boudsocq et J. Sheen. 2011. Protein kinase signaling networks in plant innate immunity. Curr. Opin. Plant Biol. 14 : 519-529.
- Theis, T., et U. Stahl. 2004. Antifungal proteins: targets, mechanisms and prospective applications. Cell. Mol. Life Sci. 61 : 437-455.
- Thomma, B.P.H.J., K. Eggermont, I.A.M.A. Penninckx, B. Mauch-Mani, R. Vogelsang, B.P.A. Cammue et W.F. Broekaert. 1998. Separate jasmonate-dependent and salicylate-dependent defense response pathways in Arabidopsis are essential for resistance to distinct microbial pathogens. Proc. Natl. Acad. Sci. USA 95 : 15107-15111.
- Thomzik, J.E., K. Stenzel, R. Stöcker, P.H. Schreier, R. Hain et D.J. Stahl. 1997. Synthesis of a grapevine phytoalexin in transgenic tomatoes (Lycopersicon esculentum Mill.) conditions resistance against Phytophthora infestans. Physiol. Mol. Plant Pathol. 51 : 265-278.
- Tichtinsky, G., V. Vanoosthuyse, J.M. Cock et T. Gaude. 2003. Making inroads into plant receptor kinase signalling pathways. Trends Plant Sci. 8 : 231-237.
- Tyler, B.M. 2002. Molecular basis of recognition between Phytophthora pathogens and their hosts. Annu. Rev. Phytopathol. 40 : 137-167.
- Umemoto, N., M. Kakitani, A. Iwamatsu, M. Yoshikawa, N. Yamaoka et I. Ishida. 1997. The structure and function of a soybean beta-glucan-elicitor-binding protein. Proc. Natl. Acad. Sci. USA 94 : 1029-1034.
- Van Breusegem, F. et J.F. Dat. 2006. Reactive oxygen species in plant cell death. Plant Physiol. 141 : 384-390.
- VanEtten, H., E. Temporini et C. Wasmann. 2001. Phytoalexin (and phytoanticipin) tolerance as a virulence trait: why is it not required by all pathogens? Physiol. Mol. Plant Pathol. 59 : 83-93.
- Van Loon, L.C. 1999. Occurrence and properties of plant pathogenesis-related proteins. Pages 1-19 dans S.K. Datta et S. Muthukrishnan (éd.), Pathogenesis-related proteins in plants. CRC Press, Boca Raton, É.-U.
- Van Loon, L.C. et A. Van Kammen. 1970. Polyacrylamide disc electrophoresis of the soluble leaf proteins from Nicotiana tabacum var. samsun and samsun NN: II. Changes in protein constitution after infection with tobacco mosaic virus. Virology 40 : 199-211.
- Van Peer, R., G.J. Niemann et B. Schippers. 1991. Induced resistance and phytoalexin accumulation in biological control of Fusarium wilt of carnation by Pseudomonas sp. strain WCS417r. Phytopathology 81 : 728-734.
- Vauthrin, S., V. Mikes, M.L. Milat, M. Ponchet, B. Maume, H. Osman et J.P. Blein. 1999. Elicitins trap and transfer sterols from micelles, liposomes and plant plasma membranes. Biochem. Biophys. Acta 1419 : 335-342.
- Vernooij, B., L. Friedrich, A. Morse, R. Reist, R. Kolditz-Jawhar, E. Ward, S. Uknes, H. Kessmann et J. Ryals. 1994. Salicylic acid is not the translocated signal responsible for inducing systemic acquired resistance but is required in signal transduction. Plant Cell 6 : 959-965.
- Viard, M.P., F. Martin, A. Pugin, P. Ricci et J.P. Blein. 1994. Protein phosphorylation is induced in tobacco cells by the elicitor cryptogein. Plant Physiol. 104 : 1245-1249.
- Vlot, A.C., D.A. Dempsey et D.F. Klessig. 2009. Salicylic acid, a multifaceted hormone to combat disease. Annu. Rev. Phytopathol. 47 : 177-206.
- Voinnet, O. 2001. RNA silencing as a plant immune system against viruses. Trends Genet. 17 : 449-459.
- Voinnet, O. et D.C. Baulcombe. 1997. Systemic signalling in gene silencing. Nature 389 : 553.
- Walker-Simmons, M. et C.A. Ryan. 1984. Proteinase inhibitor synthesis in tomato leaves. Induction by chitosan oligomers and chemically modified chitosan and chitin. Plant Pathol. 76 : 787-790.
- Wasternack, C. et E. Kombrink. 2010. Jasmonates: structural requirements for lipid-derived signals active in plant stress responses and development. ACS Chem. Biol. 5 : 63-77.
- Waterhouse, P.M., M.B. Wang et T. Lough. 2001. Gene silencing as an adaptative defence against viruses. Nature 411 : 834-842.
- Wei, G., J.W. Kloepper et S. Tuzun. 1994. Induced systemic resistance to cucumber diseases and increase plant growth by plant growth-promoting rhizobacteria under field conditions. Pages 70-71 dans M.H. Ryder, P.M. Stephens et G.D. Bowen (éds.), Improving plant productivity with rhizosphere bacteria. CSIRO, Glen Osmond, Australie.
- Weller, D.M. 1988. Biological control of soilborne plant pathogens in the rhizosphere with bacteria. Annu. Rev. Phytopathol. 26 : 379-407.
- Wendehenne, D., M.N. Binet, J.P. Blein, P. Ricci et A. Pugin. 1995. Evidence for specific, high affinity binding sites for a proteinaceous elicitor in tobacco plasma membrane. FEBS Lett. 374 : 203-207.
- Wendehenne, D., O. Lamotte, J.M. Frachisse, H. Barbier-Brygoo et A. Pugin. 2002. Nitrate efflux is an essential component of the cryptogein signaling pathway leading to defense responses and hypersensitive cell death in tobacco. Plant Cell 14 : 1937-1951.
- White, P.J. et M.R. Broadley. 2003. Calcium in plants. Ann. Bot. 92 : 487-511.
- Wu, Q. et H.D. VanEtten. 2004. Introduction of plant and fungal genes into pea (Pisum sativum L.) hairy roots reduces their ability to produce pisatin and affects their response to a fungal pathogen. Mol. Plant-Microbe Interact. 17 : 798-804.
- Xing, T., T. Ouellet et B.L. Miki. 2002. Towards genomic and proteomic studies of protein phosphorylation in plant-pathogen interactions. Trends Plant Sci. 7 : 224-230.
- Xu, Y., P.F.L. Chang, D. Liu, M.L. Narasimhan, K.G. Raghothama, P.M. Hasegawa et R.A. Bressan. 1994. Plant defense genes are synergistically induced by ethylene and methyl jasmonate. Plant Cell 6 : 1077-1085.
- Yalpani, N., V. Shulaev et I. Raskin. 1993. Endogenous salicylic acid levels correlate with accumulation of pathogenesis-related proteins and virus resistance in tobacco. Phytopathology 83 : 702-708.
- Yamada, T., H. Hashimota, T. Shiraishi et H. Oker. 1989. Suppression of pisatin, phenylalanine ammonia-lyase mRNA and chalcone synthase mRNA accumulation by a putative pathogenicity factor from the fungus Mycosphaerella pinodes. Mol. Plant-Microbe Interact. 2 : 256-261.
- Yoshikawa, M., N. Yamaoka et Y. Takeuchi. 1993. Elicitors: their significance and primary modes of action in the induction of plant defense reactions. Plant Cell Physiol. 34 : 1163-1173.
- Zdor, R.E. et A.J. Anderson. 1992. Influence of root colonizing bacteria on the defense response of bean. Plant Soil 140 : 99-107.
- Zimmermann, S., T. Nurnberger, J.M. Frachisse, W. Wirtz, J. Guern, R. Hedrich et D. Scheel. 1997. Receptor-mediated activation of a plant Ca2+-permeable ion channel involved in pathogen defense. Proc. Natl. Acad. Sci. USA 94 : 2751-2755.
Liste des figures
Figure 1
Schéma illustrant l’induction des gènes de défense chez les plantes.
Figure 2
Coupes transversales de racines de tomate colorées au bleu de toluidine
A) Racine de tomate infectée par le champignon pathogène, Fusarium oxysporum f. sp. radicis-lycopersici, l’agent de la pourriture fusarienne. À noter la multiplication abondante du champignon (C) dans tous les tissus, incluant l’épiderme (E) et le système vasculaire (SV) (x 1000). B) Racine de tomate pré-inoculée avec Pseudomonas fluorescens et infectée par Fusarium oxysporum f. sp. radicis-lycopersici. À noter la restriction de la croissance fongique (C) à la zone épidermique. Les autres tissus, incluant le système vasculaire, ne sont pas colonisés (x 1000).
Figure 3
Coupes transversales de racines de tomate préinoculées avec Pseudomonas fluorescens et infectées par Fusarium oxysporum f. sp. radicis-lycopersici
Observation en microscopie électronique à transmission après coloration à l’acétate d’uranyle et au citrate de plomb. A) Présence des rhizobactéries dans les espaces intercellulaires (EI) de l’épiderme (x 5000). B) Présence d’une apposition pariétale (AP) le long d’une cellule parasitée par le champignon (C). À noter le dépôt d’une bande de matériel dense aux électrons autour des cellules fongiques (x 25 000). C) Dépôt d’une large quantité de matériel dense (MD) riche en composés phénoliques polymérisés. La cellule fongique (C) piégée par ce matériel est sévèrement altérée (x 15 000).
Figure 4
Principales familles d’éliciteurs généraux
Figure 5
Structure d’un glucane éliciteur
Figure 6
Structure d’un oligogalacturonate constitué d’une chaîne linéaire d’acides galacturoniques en α–1,4
Figure 7
Effet des PGIPs sur la réduction de l’activité des endopolygalacturonases
Figure 8
Une protéine initialement inactive peut devenir phosphorylée par une protéine kinase
Figure 9
Les principales formes actives de l’oxygène (FAO)
Figure 10
Formation de papilles dans des tissus racinaires de plants de tomate infectés par le Fusarium oxysporum f. sp. radicis-lycopersici
Figure 11
Tapissement (Ta) d’un espace intercellulaire (EI) par un matériel dense enrichi en composés phénoliques
Figure 12
Tapissement (Ta) de l’intérieur d’un vaisseau du xylème (VX) par une épaisse couche de phénols polymérisés qui se déposent le long des parois secondaires
Liste des tableaux
Tableau 1
Les trois types de résistance active chez les plantes