Résumés
Résumé
Nous avons étudié les effets de populations françaises du puceron du pois (Acyrthosiphon pisum) de trois origines (Champagne, Languedoc, Poitou), prélevées dans des luzernières lors de diverses saisons et années, sur la résistance du cultivar CUF 101 de luzerne (Medicago sativa). Les populations aphidiennes de chaque origine ont été caractérisées par quatre marqueurs biochimiques, à deux reprises : lors des prélèvements réalisés au champ, et lors des tests d’estimation de la résistance réalisés en conditions contrôlées. Nous avons relevé 28 % de diminution de la variabilité génétique aphidienne (exprimée par les marqueurs biochimiques et leur couleur) entre ces deux séries. Dans les populations aphidiennes utilisées lors des tests, une faible diversification, estimée par l’indice de fixation FST se manifeste entre champs d’une même origine géographique, entre années et entre saisons. Cette diversification est plus marquée entre les zones géographiques distantes de 500 km. Cette variabilité des populations aphidiennes n’a pas d’effet majeur sur le niveau de résistance du cultivar CUF 101, puisque ce n’est que dans moins de 3 % des cas que son niveau de résistance élevé décroît de façon nette à un niveau intermédiaire. La discussion porte sur les effets de la constitution génétique des souches aphidiennes dans l’estimation de la résistance variétale.
Summary
We estimated the level of resistance of CUF 101 cv of alfalfa (Medicago sativa) to French populations of the pea aphid (Acyrthosiphon pisum) collected from alfalfa fields of three different regions (Champagne, Languedoc, Poitou), from various seasons and years. Allozymes from individual aphids of each origin were used as markers to examine the genetic structure of aphid populations on two occasions: when populations were collected in the field and when resistance tests were conducted under controlled conditions. A decrease of 28% in aphid genetic variability (biochemical markers and color) was noticed between these two occasions. The aphid populations used in the resistance tests were weakly differentiated (low FST) between fields of the same region, seasons or years in each region, but were differentiated regionally (higher FST). Aphid variability has low consequences on the resistance of CUF 101. In less than 3% of the resistance tests a distinct lowering from resistant to intermediate level of resistance was observed. We discuss the benefit of understanding genetic variability of aphid populations when developing plant resistance programs.
Corps de l’article
Introduction
Les programmes sur la résistance des plantes aux ennemis des cultures doivent inclure l’appréciation des risques de dépassement sous l’effet de la variabilité des populations parasitaires. Puterka et Burton (1990), dans leur mise au point sur la génétique aphidienne en relation avec la résistance de l’hôte végétal, rapportent le cas de huit espèces d’aphides chez lesquelles la variabilité des populations induit une variabilité infraspécifique des réponses des plantes. Parmi ces espèces, figure le puceron du pois Acyrthosiphon pisum (Harris). L’existence de biotypes d’A. pisum modifiant la résistance variétale de la luzerne cultivée (Medicago sativa L.), du pois (Pisum sativum L.) et du trèfle violet (Trifolium pratense L.) a été signalée par Auclair (1989) dans sa synthèse sur la résistance des plantes aux aphides. En France, nous avons trouvé quelques modifications du classement de cultivars de luzerne sélectionnés aux Etats-Unis pour leur résistance à A. pisum. Nous avons noté ces variations en utilisant des méthodes d’évaluation qui prennent en compte soit des éléments biologiques de l’aphide (Bournoville 1980), soit la tolérance de plantules à l’infestation aphidienne (Landré et al. 1999). Comme le soulignent Smith et al. (1994), l’analyse de la structure génétique des populations aphidiennes doit contribuer à caractériser les biotypes aphidiens. L’utilisation de marqueurs génétiques (allozymes, RAPD-PCR, couleur) nous a permis de différencier, à l’échelle de grandes régions géographiques françaises, des clones d’A. pisum dont certains peuvent induire des modifications modérées de classement du niveau de résistance d’un cultivar de luzerne utilisé comme référence (Bournoville et al. 2000). C’est le cas de deux clones originaires du Sud-ouest, dont les caractéristiques sont homogènes pour ces marqueurs.
Nous complétons ces estimations en nous intéressant ici à des populations d’A. pisum que nous avons prélevées dans trois zones géographiques françaises, à différentes époques (saison et année). Notre étude porte sur les aspects temporels et spatiaux de la variabilité des populations du puceron du pois prélevées dans les luzernières en conditions agronomiques et de ses effets sur la résistance variétale de la luzerne. Elle contribue par ailleurs à la compréhension des effets du maintien en élevage des populations aphidiennes sur leur structure génétique.
Matériel et méthodes
Les prélèvements aphidiens et l’entretien des souches
Les pucerons ont été prélevés dans des parcelles de luzerne de un à dix ha exploitées de façon agronomique dans trois zones géographiques distantes de 500 km environ. Celles-ci sont représentatives de l’aire de répartition de la luzerne en France, production fourragère qui couvre 360 000 ha. Il s’agit de la Champagne (lat. 48,37°N, long. 4,37°E) à une vingtaine de km à l’est de Châlons en Champagne, du Poitou (lat. 46,43°N, long. 0,12°E) à une trentaine de km à l’ouest de Poitiers et du Languedoc (lat. 43,18°N, long. 3,00°E) à une dizaine de km au nord de Narbonne. Nous avons visité chaque zone au printemps et à l’automne, pour y réaliser des prélèvements de pucerons du pois dans cinq luzernières distantes de moins de 10 km entre elles. L’absence d’aphides dans les luzernières du Languedoc à l’automne 1998 y a restreint le nombre de prélèvements à deux parcelles. Un même site (Poitou) a fait l’objet de prélèvements en 1997 et 1998. Les dates de prélèvements sont en Poitou les 2 avril 1997 (populations A, B, C, D, E), 24 octobre 1997 (populations P, Q, R, S, T), 24 mars 1998 (populations U, V, W, X, Y) et 21 septembre 1998 (populations FF, GG, HH, II, JJ). Elles se situent en Champagne les 25 mai (populations F, G, H, I, J) et 23 septembre 1997 (populations K, L, M, N, O), et en Languedoc les 5 mai (populations AA, BB, CC, DD, EE) et 21 octobre 1998 (populations KK, LL). Aucun cultivar de luzerne du catalogue français des variétés de luzerne ne présente de résistance au puceron du pois. Nos prélèvements au champ ont donc concerné des luzernes sensibles à cet aphide.
Nous avons prélevé les pucerons par une série de coups de filet-fauchoir répartis sur l’ensemble de la surface de chaque luzernière. Dans les échantillons ainsi recueillis au champ, nous avons extrait des pucerons adultes que nous avons mis dans un cryoconservateur, pour l’examen ultérieur de leur polymorphisme enzymatique; ils sont qualifiés de « populations d’origine » dans ce texte. Par ailleurs, une soixantaine de larves âgées ont également été recueillies dans chaque luzernière et placées en élevage au laboratoire, sur des plantes de luzerne du cv. Europe, sensible au puceron du pois (Landré et al. 1999), en conditions contrôlées (20°C ; photophase : 16 h). Après l’élimination d’éventuels individus parasités, ils ont constitué les souches qui ont servi à la réalisation des tests d’évaluation de la résistance variétale. Lors de ceux-ci, ces populations sont qualifiées de « populations de test ».
Caractérisation biochimique des populations d’aphides
Nous avons utilisé l’analyse allozymique d’individus pris un à un, provenant pour chaque luzernière, d’une part de la population d’origine, et d’autre part de la population de test. Sur l’ensemble des 37 populations, c’est en moyenne 49,1 individus (erreur type = 1,0) qui ont été analysés pour les populations d’origine et 47,8 (erreur type = 0,8) pour les populations d’élevage. Nous avons pratiqué l’électrophorèse sur gels d’acétate de cellulose selon la méthode décrite par Hebert et Beaton (1989). Quatre loci enzymatiques ont été examinés : Sdh (Sorbitol deshydrogenase), Idh (Isocitrate deshydrogenase), Pep-LGG (Tripeptidase Leu-Gly-Gly) et Pep-GL (Dipeptidase Gly-Leu), qui se sont révélés polymorphes dans notre précédente étude (Bournoville et al. 2000). Les quatre loci étudiés, auxquels on peut ajouter le caractère génétique de leur couleur (en Europe, les lignées d’A. pisum provenant de fondatrices des luzernières peuvent être de couleur verte ou de couleur rose), ont permis de caractériser dans chaque population la présence et la fréquence de génotypes précis, que nous qualifierons de génotypes multilocus.
Tests d’évaluation des effets des populations de test sur un cultivar résistant
Après un délai moyen d’environ un mois et demi de maintien des souches d’aphides en élevage, nous avons réalisé les tests d’évaluation de la résistance sur des plantules du cultivar de luzerne CUF 101. Celui-ci, sélectionné aux Etats-Unis, est considéré comme un témoin de résistance pour les tests relatifs au puceron du pois, tant dans les travaux américains que dans nos résultats antérieurs. Nous avons utilisé la technique décrite par Bournoville et al. (1999) et mise en oeuvre précédemment par Bournoville et al. (2000), dans l’estimation de la résistance de CUF 101 à des clones d’A. pisum de diverses origines. Nous avons utilisé sept répétitions d’unités élémentaires de 50 plantules de luzerne par population aphidienne à tester. Ce test est pratiqué en conditions contrôlées (20°C ; photophase : 16 h). On infeste les plantules à deux reprises : au stade « cotylédons ouverts » et 6 j après, avec à chaque fois une biomasse de 150 mg de puceron par unité élémentaire. Lors des infestations aphidiennes, la pesée d’un lot de 20 pucerons adultes fournit une estimation de l’état de chaque population de test. Au bout de 13 j, l’infestation aphidienne est stoppée par un traitement insecticide, également pratiqué sur un lot témoin, non infesté par les aphides, qui permet de contrôler l’absence de mortalité des plantules en l’absence de la contrainte aphidienne. Au 27e j, on note l’état des plantules selon deux catégories, saines et mortes. Un cultivar résistant présente moins du tiers de mortalité des plantules, un cultivar sensible plus des deux tiers (Bournoville et al. 1999).
Analyse de données
Structure des populations aphidiennes
Le programme GENEPOP version 3.3 (Raymond et Rousset 1995), a été utilisé pour le calcul des fréquences alléliques et génotypiques des analyses allozymiques sur les deux catégories de populations aphidiennes. Le logiciel permet d’obtenir également les F-statistiques qui évaluent la structuration des populations (Weir et Cokerham 1984). La comparaison entre les populations d’origine et de test s’est appuyée sur l’examen des structures multigénotypiques définies par les marqueurs allozymiques et la couleur des aphides et sur la comparaison des indices de fixation (Indice Fst de Wright).
Pour le cas des populations de test, deux catégories d’analyses ont été conduites. Les effets globaux ont utilisé l’analyse de variance en considérant les fréquences alléliques. Par ailleurs, sur la base des informations relatives aux analyses individuelles des aphides, le calcul de l’indice de fixation (FST) a permis de préciser les différenciations génétiques relatives à divers niveaux spatiaux (zones) et temporels (saisons ou années).
Analyse des tests d’évaluation de la résistance
Nous avons comparé l’effet des populations de test sur les plantules de luzerne par des analyses de variance portant sur les effectifs de plantes mortes. Les moyennes ont été comparées entre elles avec le test de Tukey (taux d’erreur de 0,05).
Résultats
Structure génétique des populations
Diversité allélique des populations
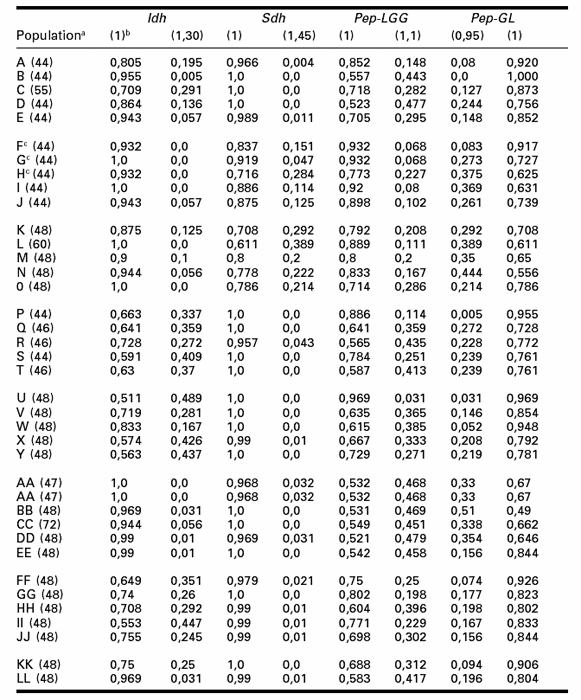
Les éléments du tableau 1 récapitulent les fréquences alléliques des populations de test. Comme dans notre étude antérieure sur les clones d’A. pisum (Bournoville et al. 2000), deux allèles sont détectés dans chaque système. Exceptionnellement, on a noté deux cas d’allèles rares des loci Idh et Sdh dans trois luzernières (F, G, H) de la Champagne au printemps. De façon générale, pour chaque locus, un des allèles présente une fréquence dominante.
Tableau 1
Fréquences alléliques de quatre loci allozymiques des populations de test d’Acyrthosiphon pisum de diverses origines
a Chaque population est désignée par une ou deux lettres (cf. matériel et méthodes). Cette dénomination est suivie entre parenthèses du nombre d’individus analysés.
b Les allèles sont codés selon la valeur de leur mobilité relative, l’allèle le plus commun prend la valeur 1.
c Cas où ont été repérés, en Champagne, des allèles rares.
Comparaison des structures génétiques des populations d’aphides d’origine et de test
Nous avons estimé la dérive génétique que peut constituer la phase d’élevage et de multiplication des aphides avant la réalisation des tests d’évaluation de la résistance variétale. Pour cela, nous avons évalué la diversité multigénotypique exprimée dans les populations d’origine et de tests. En prenant la zone géographique comme élément de base vis-à-vis des différentes modalités temporelles, le tableau 2 met en évidence une réduction de 15 à 52 % de la diversité multigénotypique dans les huit modalités examinées.
Tableau 2
Effectifs de génotypes multilocus dans les populations d’A. pisum (p = prélèvements de printemps, a = prélèvements d’automne)
Variabilités génétiques spatiale et temporelle exprimées par les populations aphidiennes
Parmi les facteurs considérés dans les analyses de variance des fréquences alléliques des populations de test, le facteur lieu (trois zones géographiques) fournit des effets significatifs pour l’ensemble des systèmes (pour Idh, F = 25,9; pour Sdh, F = 59,2; pour Pep-LGG, F = 17,1; pour Pep-GL, F = 9,4; d.l. = 2, 36). Il n’y a pas d’effet significatif pour le facteur saison (printemps, automne). Quant à l’effet année, il n’est significatif que dans le cas des deux systèmes Sdh et Pep-LGG (F = 11,5 et F = 6,4, respectivement; d.l. = 1, 36).
Nous avons examiné la possible différenciation existant entre les diverses luzernières d’un même site géographique pour une même période de prélèvement. Les valeurs des FST obtenues (tableau 3) indiquent à ce niveau une diversification faible à modérée, qui s’accroît cependant entre les populations d’origine et les populations de test. En rassemblant en pool les données élémentaires provenant des champs d’une même région pour une même saison et une même année, la diversification se situe à un niveau plus élevé lorsqu’on compare l’origine géographique des trois régions, puisqu’il atteint le seuil de 0,15 pour le Poitou et le Languedoc qui caractérise la borne inférieure d’une diversification importante. Quant aux aspects temporels, ils font l’objet de comparaisons toujours avec les données rassemblées. Pour l’aspect saisonnier, la diversification pour les populations de test se situe à un niveau faible (FST (Champagne 1997) = 0,00; FST (Poitou 1997) = 0,04; FST (Poitou, 1998) = 0,00) avec des valeurs comparables pour les populations d’origine (FST (Champagne 1997) = 0,00; FST (Poitou 1997 = 0,06); FST (Poitou, 1998) = 0,02). Dans le cas du facteur année, nous avons comparé, en Poitou, le niveau de différenciation pour chacune des saisons; les valeurs de FST pour les populations de test au printemps (FST 1997-1998 = 0,04) et à l’automne (FST 1997-1998 = 0,003) sont faibles, comme celles des populations d’origine (FST respectivement de 0,012 au printemps et de 0,005 à l’automne).
Tableau 3
Indices de fixation (FST) des populations d’A. pisum de test (et des populations d’origine, entre parenthèses et en italique) des luzernières d’une même zone et par zone
Effets des populations aphidiennes sur CUF 101
Le niveau des poids moyens des adultes de pucerons utilisés lors des tests prouve un bon état des souches, puisqu’ils se situent dans une amplitude de 2,12 à 3,86 mg. La différence observée entre les moyennes des poids des adultes aux deux dates d’infestation (poids moyen lors de la première infestation : 2,80 mg, et lors de la seconde : 3,32 mg) n’atteint pas une valeur susceptible d’interférer sur la réalisation du test.
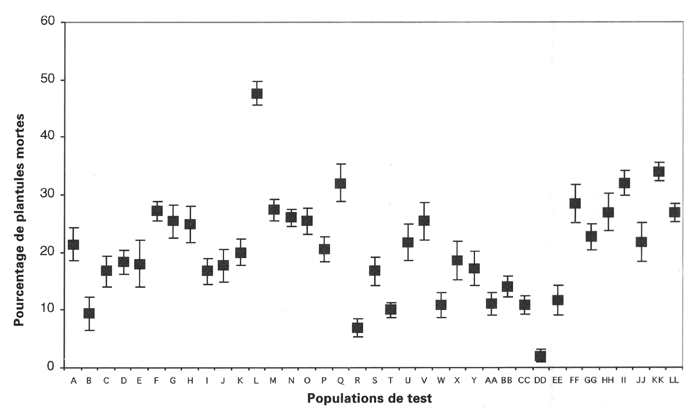
La figure 1 indique la mortalité des plantules de CUF 101 pour l’ensemble des populations de test. Ce cultivar présente un fort niveau de résistance, puisque sur l’ensemble des 37 données, la moyenne du taux de plantes mortes se situe à 20,6 %. Parmi les lots présentant une mortalité élevée, on signalera le cas du champ L en Champagne (47,6 %). Dans ce cas, le classement de CUF 101 est modifié, passant de la catégorie résistante à un niveau intermédiaire entre la résistance et la sensibilité selon le classement en trois classes que nous avons établi (Bournoville et al. 1999). Nous avons comparé les huit séries de résultats relatifs aux régions, années et saisons par une ANOVA à un facteur contrôlé. Cette analyse, fondée sur les effectifs de plantes mortes, conduit à un résultat hautement significatif (F = 19,05; P = 0,000; d.l. = 7, 254). Les moyennes (tableau 4) des parcelles des zones du Poitou sont relativement homogènes entre elles, ce qui est vrai également pour celles de Champagne. En revanche, les moyennes des parcelles du Languedoc au printemps et à l’automne sont séparées par une plus forte amplitude.
Figure 1
Taux de mortalité (%) des plantules du cultivar CUF 101 de luzerne soumises à une infestation contrôlée des populations de test d’Acyrthosiphon pisum (moyennes ± erreur type).
Tableau 4
Test d’évaluation de la résistance du cultivar CUF 101 aux populations de test d’A. pisum des huit séries de prélèvement : nombre moyen de plantules mortes par unité élémentaire de 50 plantules
a L = Languedoc; P = Poitou; C = Champagne.
b Période de prélèvement : p = printemps; a = automne.
c Les valeurs suivies d’une même lettre ne sont pas significativement différentes, selon le test de Tukey (P = 0,05).
Discussion
Notre étude apporte une première série de résultats sur le plan méthodologique. Le bon niveau des poids moyens des adultes de pucerons lors de la réalisation des tests d’évaluation variétale permet de considérer que les génotypes aphidiens des populations élevées pour les tests sont bien adaptés à la luzerne. Après le prélèvement, le maintien en élevage des populations de pucerons puis leur multiplication entraîne cependant une diminution de leur composition multigénotypique. Ce résultat peut entraîner une certaine dérive de la constitution des populations au moment du test. Les éléments du tableau 3 montrent en effet que cette limitation du nombre de génotypes accroît les différences génétiques entre parcelles d’une même zone. Le même tableau prouve que ces variations sont estompées lorsqu’on rassemble les données en pool dans la comparaison entre zones. Dans l’intervalle de temps assez court qui séparait les prélèvements des tests, cette dérive a été relativement limitée, mais sur des temps plus longs, il est possible qu’on élimine davantage de génotypes, voire même qu’on aboutisse à cloner des souches d’élevage. Divers auteurs (Delpuech et al. 1993; Roush et Hopper 1995) conseillent, pour maintenir la variabilité génétique d’une population du champ d’élever un nombre modéré de lignées isofemelles, permettant de reconstituer une population représentative au moment d’une expérience.
La caractérisation des génotypes par divers marqueurs disponibles fait l’objet de publications actuelles dans la détermination des races d’hôtes du puceron du pois. Ainsi, Via (1999) et Via et al. (2000) examinent, aux Etats-Unis, le changement de fréquences génotypiques au niveau du locus (Pep-GL) associé à l’hôte végétal dans des populations sympatriques d’A. pisum sur du trèfle violet et de la luzerne. On dispose de peu d’éléments en revanche sur l’analyse des effets de la structure génétique de populations d’insectes caractérisées par des marqueurs sur l’expression de la résistance variétale. Dans leur étude portant sur la structure spatiale et temporelle des populations de Brevicoryne brassicae L., qui utilise les marqueurs allozymiques, Cole et Lynn (1996) signalent des différences significatives entre champs distants de 1 km tout comme entre dates de prélèvements. Ils concluent à la nécessité de prendre en compte les variations de fréquences géniques aphidiennes pour le criblage variétal des plantes pour la résistance. Les travaux de Sandström (1994) sur les performances de clones d’A. pisum sur le pois, insistent sur la nécessité pour le sélectionneur de matériel végétal d’appréhender le niveau de variation génétique des populations d’aphides pour estimer leur potentialité d’adaptation à un nouveau cultivar.
Dans un travail antérieur (Bournoville et al. 2000), la caractérisation des clones aphidiens par les marqueurs allozymiques et RAPD-PCR, nous a permis de faire ressortir un type de clone d’origine méridionale, trouvé dans les départements du Tarn et de l’Aude, plus agressif pour le cultivar CUF 101. Les caractéristiques allozymiques de ce clone sont les suivantes : homozygote pour l’allèle lent de Sdh et de Idh, hétérozygote pour Pep-LGG et homozygote pour l’allèle rapide de Pep-GL. Il se retrouve dans nos populations testées dans 2 % des cas du lot M, 15 % du lot BB, 8 % du lot CC, 13 % du lot DD et 2 % du lot KK. Les fréquences les plus élevées de ce génotype paraissent le rattacher plutôt à une répartition méridionale (Languedoc), ce qui est en accord avec notre mention antérieure. En revanche, aux fréquences que nous avons observées dans les populations de test, ce génotype n’induit pas des risques plus élevés vis-à-vis du cv. CUF 101 de luzerne pour d’éventuels dépassements de résistance.
La prise en compte de clones très agressifs dans les programmes ne peut avoir de signification que s’ils sont dominants aux plans spatial et temporel. Nos résultats prouvent que nous ne sommes pas dans une telle situation, tant pour les années et que pour les lieux que nous avons étudiés qui recoupent la répartition géographique de la culture de luzerne en France. La structuration génétique des populations dans les luzernières d’A. pisum paraît faible, au moins entre parcelles d’une même zone, et au plan temporel en considérant les saisons et les années consécutives. Une structuration plus marquée existe certes au plan géographique, mais elle n’est pas corrélée à une gamme de virulence des populations aphidiennes. Ce n’est que dans un cas sur trente sept que nous avons constaté une variation nette du classement de CUF 101. Il s’agit, à l’automne, de la parcelle L de la zone champennoise. Selon les classes que nous avons définies antérieurement, le pourcentage de plantes mortes situe ce cultivar à un niveau intermédiaire entre sensibilité et résistance. Un cas (parcelle KK) à l’automne dans le Narbonnais atteint tout juste la classe intermédiaire. Sur ce constat, nous déduisons qu’on ne doit pas craindre dans les conditions françaises d’interférence majeure de la variabilité des populations d’A. pisum sur la résistance de la luzerne à cet aphide.
Parties annexes
Remerciements
Ce texte est dédié à la mémoire de notre collègue Bernard Landré. Sa collaboration à ce programme, malgré sa maladie, a toujours conservé les qualités d’attention et de soin qui caractérisaient son activité.
Les auteurs remercient le Dr J.C. Simon (INRA, Rennes) des conseils et échanges fructueux, leurs collègues les Dr I. Badenhausser et C. Girousse de leurs commentaires utiles sur le manuscrit et les collaborateurs techniques qui ont participé aux expérimentations : Christelle Dupont, Francette Malineau et Marilyn Vandier.
Références
- Auclair, J.L. 1989. Host plant resistance. Pages 225-265 in A.K. Minks et P. Harrewinj (éds.), Aphids: their biology, natural enemies and control. Vol 2C. Elsevier Science Publishers, Amsterdam.
- Bournoville, R. 1980. Varietal characteristic under French conditions of some cultivars selected for resistance to two insects. EPPO Bull. 10 : 317-322.
- Bournoville, R., B. Landré, P. Aupinel, C. Girousse et I. Badenhausser. 1999. Des-cription et mise en oeuvre d’une métho-dologie d’estimation de la résistance variétale de la luzerne au puceron du pois. Fourrages 158 : 157-168.
- Bournoville, R., J.C. Simon, I. Badenhaus-ser, C. Girousse, T. Guilloux et S. André. 2000. Variability in the effect of French pea aphid lines (Acyrthosiphon pisum : Homoptera : Aphididae) distinguished by genetic markers. Bull. Entomol. Res. 90 : 33-39.
- Cole, R.A. et J. Lynn. 1996. Spatial and temporal population structure of Brevicoryne brassicae. Entomol. Exp. Appl. 78 : 121-127.
- Delpuech, J-M., Y. Carton et R.T. Roush. 1993. Conserving genetic variability of a wild insect population under laboratory conditions. Entomol. Exp. Appl. 67 : 233-239.
- Hebert, P.D.N. et M.J. Beaton. 1989. Methodologies for allozyme analysis using cellulose acetate electrophoresis. Helena Laboratories, Beaumont, Texas. 31 pp.
- Landré, B., R. Bournoville, P. Aupinel, S. Carré, I. Badenhausser, C. Girousse et B. Julier. 1999. Ranking of some lucerne and medics cultivars for pea aphid resistance. Pages 231-238 in F. Veronesi et D. Rosellini (éds), Proceedings of the XII Eucarpia Medicago sativa spp. Group Meeting. Lucerne and medics for the XXI century. 13-16 sept, Perugia, Italy.
- Puterka, G.J. et R.L. Burton. 1990. Aphid genetics in relation to host plant resistance. Pages 59-69 in D.C. Peters, J.A. Webster et C.S. Chlouber (éds.), Aphid-plant interactions: populations to molecules. Stillwater, Oklahoma, USA. 12-17 Août 1990.
- Raymond, M. et F. Rousset. 1995. Genepop, a population genetics software for exact tests and oecumenicism. J. Hered. 86 : 248-249.
- Roush, R.T. et K.R. Hopper. 1995. Use of single family lines to preserve genetic variation in laboratory colonies. Ann. Entomol. Soc. Am. 88 : 713-717.
- Sandström, J. 1994. High variation in host adaptation among clones of the pea aphid, Acyrthosiphon pisum on peas, Pisum sativum. Entomol. Exp. Appl. 71 : 245-256.
- Smith, C.M., Z.R. Khan et M.D. Pathak. 1994. Techniques for evaluating insect resistance in crop plants. Vol. 1. CRC Press, Boca Raton, Florida. 320 pp.
- Via, S. 1999. Reproductive isolation between sympatric races of pea aphids. I. Gene flow restriction and habitat choice. Evolution 53 : 1446-1457.
- Via, S., A.C. Bouck et S. Skilman. 2000. Reproductive isolation between divergent races of pea aphids on two hosts. II. Selection against migrants and hybrids in the parental environments. Evolution 54 : 1626-1637.
- Weir, B.S et C.C. Cockerham. 1984. Estimating F-statistics for the analysis of population structure. Evolution 38 : 1358-1370.
Liste des figures
Figure 1
Taux de mortalité (%) des plantules du cultivar CUF 101 de luzerne soumises à une infestation contrôlée des populations de test d’Acyrthosiphon pisum (moyennes ± erreur type).
Liste des tableaux
Tableau 1
Fréquences alléliques de quatre loci allozymiques des populations de test d’Acyrthosiphon pisum de diverses origines
a Chaque population est désignée par une ou deux lettres (cf. matériel et méthodes). Cette dénomination est suivie entre parenthèses du nombre d’individus analysés.
b Les allèles sont codés selon la valeur de leur mobilité relative, l’allèle le plus commun prend la valeur 1.
c Cas où ont été repérés, en Champagne, des allèles rares.
Tableau 2
Effectifs de génotypes multilocus dans les populations d’A. pisum (p = prélèvements de printemps, a = prélèvements d’automne)
Tableau 3
Indices de fixation (FST) des populations d’A. pisum de test (et des populations d’origine, entre parenthèses et en italique) des luzernières d’une même zone et par zone
Tableau 4
Test d’évaluation de la résistance du cultivar CUF 101 aux populations de test d’A. pisum des huit séries de prélèvement : nombre moyen de plantules mortes par unité élémentaire de 50 plantules