Résumés
Résumé
La maladie d’Alzheimer et les syndromes apparentés (c’est-à-dire les autres causes de démences, essentiellement) sont devenus un problème majeur de santé publique en France et sont en passe de devenir, enfin, une priorité, en raison du vieillissement de la population. L’épidémiologie de ces affections est un des éléments essentiels pour la décision en santé publique et pour la connaissance de ces maladies et de leurs déterminants. Selon les estimations les plus raisonnables, il y aurait actuellement en France environ 850 000 cas de maladie d’Alzheimer et syndromes apparentés, et environ 220 000 nouveaux cas par an. Les progrès de la prise en charge font que la durée de la maladie augmente, ainsi que le nombre des malades. En dehors du développement d’un traitement curatif bien peu probable à court terme, seule une politique de prévention devrait permettre de contenir l’accroissement de ce nombre dans un proche avenir. Quatre pistes de prévention sont crédibles : les facteurs de risques cardiovasculaire, notamment l’hypertension artérielle ; la nutrition ; les activités stimulantes et physiques ; l’équilibre affectif et social.
Summary
Alzheimer’s disease and related disorders (dementia) are a major public health problem due to the number of cases in the general population, the projections for the future, and the consequences of these diseases. We can estimate that about 850 000 cases of dementia were present in France in 2005 and this number will increase to 1 200 000 in 2020 and 2 100 000 in 2040 if the incidence and the duration of the disease did not change. The development of prevention is therefore necessary. Four ways of prevention are credible. The most important is the treatment of vascular risk factors and particularly hypertension. Other ways are nutritionnal factors, stimulating leisure activities and depression.
Corps de l’article
La maladie d’Alzheimer et les syndromes apparentés sont devenus un problème majeur de santé publique en France ; l’objectif de cet article est de présenter les estimations les plus fiables de prévalence, incidence et durée de la démence, de proposer des projections pour un proche avenir, et de faire le point sur les pistes de prévention possibles.
Prévalence et incidence de la maladie
Estimation de la prévalence
La majorité des cas de démences se rencontre après 65 ans, et même après 75 ou 80 ans. Ce sont ces cas, nombreux, qui constituent un réel problème de santé publique : les données épidémiologiques seront donc présentées uniquement pour ces tranches d’âges.
La maladie existe pourtant avant 65, et même avant 60 ans ; si, individuellement, une maladie survenant précocement est tragique, ces démences précoces représentent en revanche une faible proportion de cas. Pour ces cas plus jeunes, les problèmes posés sont différents de ceux rencontrés pour les cas plus âgés, et nous ne disposons pas de données épidémiologiques vraiment fiables. Des estimations réalisées par le groupe Eurodem (réunissant les données de plusieurs études de cohortes européennes) en 1991 donnaient une prévalence de démence de 0,5 % chez les femmes et 1,6 % chez les hommes entre 60 et 64 ans, et de 0,1 % chez les femmes et 0,2 % chez les hommes avant 60 ans [1], soit une estimation de 32 000 personnes de moins de 65 ans présentant une démence en 2004, en France. Ces démences précoces sont le plus souvent diagnostiquées et médicalisées, même si l’on peut supposer que le délai est parfois long (ce qui n’est pas le cas des démences plus tardives), en raison de la rareté de survenue dans cette tranche d’âge. Pour ces cas précoces, le problème principal est le manque de structures adaptées pour prendre en charge ces sujets relativement jeunes.
En raison du sous-diagnostic de la maladie d’Alzheimer et des syndromes apparentés, et des difficultés du diagnostic de ces maladies en population, des données fiables concernant son épidémiologie ne peuvent être obtenues qu’à partir d’études longitudinales réalisées en population, dans lesquelles un diagnostic actif de démence est réalisé. Dans le même ordre d’idée, le diagnostic différentiel avec un état confusionnel persistant plus de deux semaines peut être difficile et nécessite un minimum de suivi des sujets. Devant les écarts entre les différentes estimations concernant la prévalence et l’incidence de cette maladie, un rapport récent de l’OCDE (Organisation de coopération et de développement économiques) [2] préconisait de se fonder sur les estimations fournies par le groupe Eurodem [3]. Toutefois, le diagnostic de démence a considérablement évolué depuis quelques années, notamment en raison de la commercialisation des premiers inhibiteurs de l’acétylcholinestérase, qui a favorisé une prise de conscience vis-à-vis de cette maladie ; or, les estimations fournies par Eurodem, à partir de données transversales le plus souvent, datent pour la plupart du début des années 90, et nécessitent probablement d’être ré-actualisées. De plus, une évolution réelle de la prévalence de la démence ne peut être exclue (évolution de l’espérance de vie, meilleure prise en charge…).
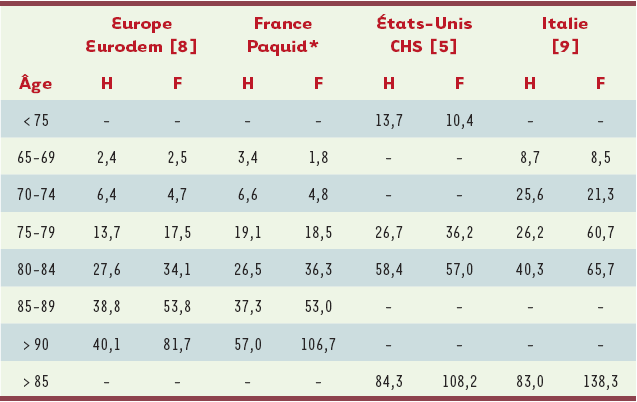
Du fait de la durée et du coût des études longitudinales en population, il existe peu de publications récentes concernant la prévalence de la maladie d’Alzheimer et des syndromes apparentés. Les estimations les plus récentes ont été publiées en 2003 (pour la France) [4], 2004 (pour les États-Unis) [5] et 2005 (pour l’Italie) [6] (Tableau I) ; ces estimations montrent une grande disparité, avec des prévalences beaucoup plus faibles dans l’étude Eurodem et beaucoup plus élevées dans la Cardiovascular health study (CHS) nord-américaine. Devant la disparité de ces chiffres (les raisons citées précédemment pouvant expliquer les faibles prévalences retrouvées dans Eurodem) et la similarité des estimations retrouvées en France et en Italie, il semble raisonnable de se fonder sur les données de l’étude Paquid (Personnes âgées Quid) pour fournir des estimations françaises de prévalence et d’incidence de démence après l’âge de 75 ans ; les données pour la tranche d’âge 65-74 ans ont, quant à elles, été estimées à partir des données italiennes. Globalement, la prévalence chez les sujets de 75 ans et plus est estimée à 13,2 % pour les hommes et à 20,5 % pour les femmes dans Paquid, et à 11,7 % et 15,4 %, respectivement, dans l’étude italienne ; la prévalence globale chez les 65 ans et plus est bien sûr beaucoup plus faible, 6,1 % chez les hommes et 8,9 % chez les femmes.
Tableau I
Prévalence (%) de la maladie d’Alzheimer et des syndromes apparentés en fonction de l’âge et du sexe.
En rapportant ces chiffres à la population métropolitaine française fournie par l’Insee pour 2004 [7], on peut estimer le nombre de sujets déments en France métropolitaine à 856 662 chez les personnes de 65 ans et plus (Tableau II) ; ces cas surviennent pour 72 % chez des femmes, et pour 73 % chez des personnes âgées de 80 ans et plus. L’estimation du nombre de cas de démence varie selon les études, en raison essentiellement des cas les plus difficiles à diagnostiquer, notamment au stade de début de la maladie ; il existe moins d’imprécision sur les cas à un stade plus avancé. Dans Paquid, le degré de sévérité de la démence a été évalué grâce au MMS (mini mental state) : ce test global d’évaluation des fonctions cognitives est coté de 0 à 30, les sujets ayant un score ≤ à 15 étant considérés comme ayant une démence à un stade modérément sévère ou sévère. Chez les 75 ans et plus, 43,4 % des démences sont à un stade au moins modérément sévère. En appliquant cette proportion au nombre de cas estimés de démence, on peut estimer que 332 628 personnes de 75 ans et plus présentaient une démence à un stade modérément sévère ou sévère en France en 2004. La prise en compte de ce stade de sévérité est importante : en effet, si 57 % de l’ensemble des démences présentent une dépendance pour les activités de base de la vie quotidienne (toilette, habillage, locomotion, alimentation, aller aux toilettes), cette proportion s’élève à 89 % pour les démences à un stade modérément sévère ou sévère.
Tableau II
Estimation du nombre de personnes atteintes de démence en 2004 en France métropolitaine (d’après [4, 6]).
Estimation de l’incidence
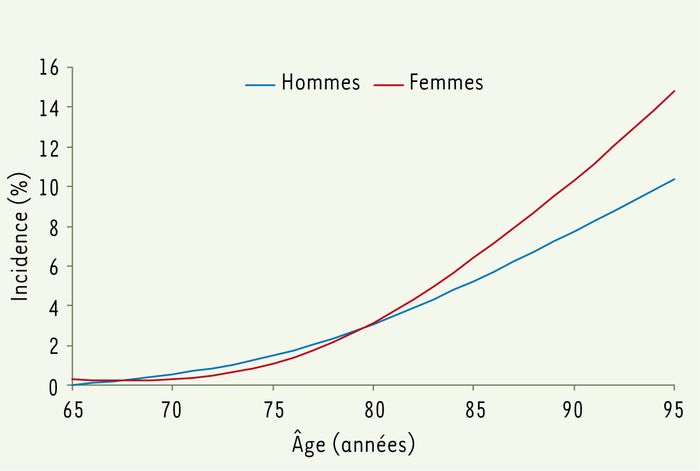
Comme pour les données de prévalence, les estimations d’incidence sont très variables dans les données publiées (Tableau III). Devant ces différentes estimations, nous avons ré-analysé l’incidence de la démence sur les 13 années de suivi de Paquid, avec des modèles biostatistiques adaptés, permettant de prendre en compte les différents biais rencontrés dans les études de cohorte pour l’estimation de l’incidence. Les résultats sont présentés dans la Figure 1.
Tableau III
Incidence de la maladie d’Alzheimer et des syndromes apparentés en fonction de l’âge et du sexe.
Figure 1
Incidence des démences selon l’âge (données Paquid 1988-2001).
En appliquant ces données d’incidence à la population française de 2004, le nombre de nouveaux cas annuels de démences peut être estimé à 225 263, alors qu’il était estimé à 186 586 à partir des données initiales de Paquid.
Projections pour les prochaines années
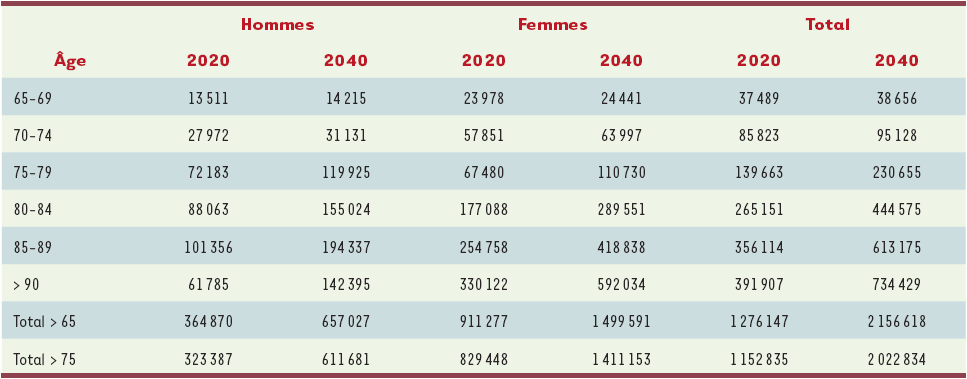
Des projections sur le nombre de personnes atteintes de maladie d’Alzheimer ou d’un syndrome apparenté dans les prochaines années peuvent être réalisées en partant des projections de populations fournies par l’Insee [7]. Les scénarios démographiques de l’Insee (scénario central, scénario de fécondité haute et scénario de fécondité basse) montrent une augmentation de la population totale de la France pour les prochaines années, mais surtout une augmentation de la proportion des personnes âgées : à titre d’exemple, selon le scénario central de projection de population, la proportion de personnes de 65 ans et plus, qui était de 16,5 % en 2004, devrait passer à 21 % en 2020 et 28 % en 2040 ; pour les 75 ans et plus, les chiffres sont encore plus impressionnants, puisque ces proportions devraient passer respectivement de 8,0 % à 9,6 %, puis à 16,1 %.
Estimations
Dans l’hypothèse d’une prévalence constante de la maladie, le nombre absolu de démences augmentera dans l’avenir (Tableau IV), mais également l’âge des malades : alors que 73 % des déments avaient 80 ans ou plus en 2004, cette proportion devrait augmenter à 79,4 % en 2020, et à 83,1 % en 2040. Du fait de la nature des scénarios choisis, fondés sur une variation de la fécondité, le nombre absolu de personnes atteintes de démence ne devrait pas varier en fonction du scénario employé jusqu’en 2040. Le taux pour 1 000 habitants, en revanche, variera : de 14,5 ‰ en 2004, il devrait passer à 21,3 ‰ en 2020 et 36,3 ‰ en 2040, selon l’hypothèse de fécondité basse, et à 20,3 ‰ en 2020 et 31,9 ‰ en 2040, selon l’hypothèse de fécondité haute.
Tableau IV
Estimation* du nombre de personnes atteintes de démence en France métropolitaine en 2020 et en 2040.
Sous l’hypothèse d’une répartition constante de la sévérité des démences, les estimations pour les démences à un stade modérément sévère ou sévère chez les 75 ans et plus seraient de 500 330 cas en 2020 et 877 910 (soit plus que le nombre de démences actuelles) en 2040.
Remarques
Tout d’abord, proposer des estimations jusqu’en 2040 est un exercice délicat. On peut en effet espérer que, d’ici 2040, des progrès auront été réalisés et un traitement curatif efficace mis au point. Si tel est le cas, ces estimations seront totalement dépassées. Les récents essais concernant le « vaccin », bien qu’interrompus en raison d’effets secondaires importants, ont fait naître des espoirs dans ce sens [10].
Par ailleurs, les estimations précédentes ont été réalisées dans l’hypothèse d’une prévalence constante de la maladie, alors qu’il est difficile de savoir si, même en l’absence de thérapeutiques innovantes, la prévalence sera constante sur les prochaines années. Dans l’étude Paquid, à âge égal, la prévalence est plus élevée 10 ans après le début de l’étude (1998-99) qu’à la phase d’inclusion (1988-89) [11]. Bien qu’il s’agisse d’une évolution au sein de la même étude de recherche, nous ne pouvons exclure que cette augmentation de prévalence soit en partie expliquée par une meilleure sensibilisation au diagnostic de démence. De plus, les estimations de prévalence réalisées en 1998-99, après 10 ans de suivi des performances cognitives des personnes, reposent sur un diagnostic probablement plus précis qu’à l’inclusion. Néanmoins, les récentes données d’incidence obtenues dans une cohorte italienne présentent des chiffres d’incidence, obtenus entre 1999 et 2004, bien plus élevés que ceux publiés jusqu’à maintenant [9] : ces chiffres pourraient refléter une augmentation réelle de l’incidence des démences.
Plusieurs hypothèses peuvent être formulées concernant l’évolution de l’incidence, et donc de la prévalence des démences : il est possible qu’une meilleure prise en charge des autres pathologies, et notamment des maladies cardiovasculaires, entraîne, pour un âge donné, une augmentation de prévalence des démences. Un des facteurs de risque intervenant dans la maladie d’Alzheimer est un variant allélique (ε4) du gène codant pour l’apolipoprotéine E, impliquée dans le transport des lipides : les personnes présentant un ou deux allèles ε4 sont plus à risque de développer la maladie que celles ayant la forme allélique ε2 [13]. Ce gène est également un facteur de risque de maladie cardiovasculaire [14]. Or, les progrès de la chirurgie cardiaque (pontage, dilatation) réalisés ces dernières années devrait permettre la survie de patients qui, en raison de certains facteurs de risque communs aux deux maladies, sont probablement plus à risque de développer une démence dans l’avenir. Le même raisonnement peut être appliqué à d’autres facteurs de risque potentiels, comme les facteurs de risque vasculaires, notamment, et pourrait aussi se vérifier pour d’autres maladies, comme le cancer.
D’un autre côté, on peut supposer que, grâce à une évolution du mode de vie (meilleure prise en charge de l’état de santé, meilleur contrôle des facteurs de risque, meilleure hygiène de vie), l’âge de début de maladie soit, à l’avenir, plus tardif, ce qui s’accompagnerait d’une diminution de la prévalence. En 1998, des estimations sur la population américaine ont été effectuées, montrant que si l’âge de début de maladie reculait de 1 an, la prévalence diminuerait de 7,3 % au bout de 10 ans, et de 8,9 % au bout de 50 ans [12]. De plus, outre l’incidence et l’âge de début de maladie, la durée de la maladie doit également être prise en compte pour prédire la prévalence : si l’on s’occupe mieux des malades, cette durée pourrait augmenter dans les années futures. Néanmoins, la prise en charge doit avoir pour objectif d’augmenter la durée à la phase précoce de la maladie, avant l’apparition des complications.
En raison de la difficulté d’élaborer des hypothèses réalistes dans le sens d’une augmentation ou au contraire d’une diminution de prévalence, il est raisonnable de considérer une fourchette de ± 10 % de variation de prévalence dans laquelle celle-ci a de grandes chances de se situer dans les prochaines années (en l’absence, bien sûr, de la mise au point d’un traitement curatif). Le Tableau V propose les bornes inférieure et supérieure du nombre estimé de personnes atteintes de démences, pour 2020 et pour 2040, ainsi que les taux pour 1 000 habitants.
Tableau V
Estimation des bornes inférieure et supérieure du nombre de cas de démences (n) et de leur taux (pour 1 000 habitants) en 2020 et en 2040.
Durée de la maladie
La majorité des études s’accordent sur le fait que la démence diminue l’espérance de vie [15-17]. Néanmoins, les données de la littérature concernant la durée de survie des sujets déments sont très variables : ces durées de vie moyennes, obtenues souvent à partir d’échantillons très sélectionnés, suivis dans des centres spécialisés, sont fréquemment surestimées, mettant en évidence des durées de survie pouvant aller de 5 à 10 ans. Pour évaluer correctement cette durée, il est nécessaire de se fonder sur des études en population : dans la Canadian study of aging, la médiane de survie a été estimée à 3,3 ans (2,7-4,0) [15-17]. Toutefois, la durée de vie des personnes démentes varie bien sûr en fonction de l’âge : une telle valeur a été estimée à partir des 13 années de suivi de Paquid, et comparée aux données publiées aux États-Unis [18] (Tableau VI) : les résultats sont très proches, avec des espérances de vie supérieures chez les femmes, mais nettement plus faibles que celles de la population générale française. Cependant, du fait de l’évolution du diagnostic et de la considération apportée à cette maladie, il est impossible aujourd’hui d’indiquer, de façon fiable, si la survie des personnes démentes a augmenté ou non au cours des dernières années.
Tableau VI
Espérance de vie selon l’âge chez les sujets déments et en population générale.
Pistes de prévention
De nombreux facteurs de risque ont été incriminés dans la survenue de la maladie d’Alzheimer. Parmi les principaux, l’âge, l’allèle ε4 de l'apolipoprotéine E et le sexe ne sont bien évidemment pas accessibles à la prévention. D’autres facteurs potentiels ont également été évoqués, et des pistes de prévention, passant par le contrôle de ces facteurs de risque, peuvent être envisagées. Il ne s’agit toutefois que de pistes qui ne sont pas encore confirmées. Néanmoins, pour la plupart d’entre elles, les recommandations qui peuvent être faites devraient aussi entraîner un bénéfice pour d’autres pathologies, et participer à une meilleure qualité de vie des personnes âgées.
Facteurs de risque vasculaires
Plusieurs facteurs de risque vasculaires, notamment à l’âge moyen de la vie, pourraient être des facteurs de risque de démence, notamment de maladie d’Alzheimer : hypertension artérielle [19-21], diabète [22-24], hypercholestérolémie [21], tabagisme [25-27], alcoolisme chronique [25], surpoids [28], accidents vasculaires cérébraux (AVC) [29-35], fibrillation auriculaire [36], athérosclérose [37] ou, encore, hyperhomocystéinémie [38, 39]… Des études d’observation ont montré que les patients hypertendus traités semblaient avoir moins de risque de démence que les hypertendus non traités [20, 40-43], de même que les patients hypercholestérolémiques traités semblaient avoir moins de risque de démence que les hypercholestérolémiques non traités [44-46]. Cependant, seul le traitement de l’hypertension a confirmé une efficacité sur la prévention de la démence dans des études prospectives randomisées (études Syst-Eur [47, 48] et Progress [49]).
Par ailleurs, si les AVC sont un facteur de risque de démence, la démence est en retour un facteur de risque d’AVC [50-52] ; l’incidence des AVC et celle de la démence sont ainsi liées chez les personnes de plus de 85 ans [53]. Une démence préexistant à un AVC (retrouvée chez environ 15 % des patients de plus de 40 ans hospitalisés pour un AVC [54-57]) est associée à un risque de confusion mentale [58], de symptômes dépressifs [59], d’épilepsie tardive (au-delà de 3 mois) [60], d’un pronostic fonctionnel moins bon [61], de récidive [62] et de mortalité à 3 ans (indépendamment du risque de récidive) [63]. Or la démence, qui est le plus souvent de nature dégénérative, de type maladie d’Alzheimer [64, 65], n’est pas diagnostiquée dans la plupart des cas au moment de l’AVC, et la prévention des complications secondaires n’est pas mise en place.
On ne connaît pas l’influence de la démence sur la tolérance aux traitements de la phase aiguë de l’AVC (thrombolyse, agents antiplaquettaires) ou de sa prévention secondaire (agents antiplaquettaires, chirurgie carotidienne). Certaines indications tendent à montrer que le contrôle des facteurs de risque vasculaires (comme la fibrillation auriculaire [66] ou l’hypercholestérolémie [67]) aurait un effet bénéfique sur la cognition.
À lésions « Alzheimer » (plaques amyloïdes, dégénérescences neurofibrillaires) équivalentes dans le cerveau, la démence est plus sévère, ou s’exprime plus vite, chez les patients ayant également des lésions lacunaires (de nature vasculaire) dans le cerveau, même s’ils n’ont jamais présenté d’AVC [68, 69]. Chez les sujets âgés, les lésions dues à la maladie d’Alzheimer sont rarement isolées, des lésions vasculaires étant associées de façon significative chez au moins un tiers des patients [70-72].
Chez les patients atteints de maladie d’Alzheimer avérée, si la présence de petites lésions vasculaires ne semble pas influencer le déclin cognitif [73-75], elle est associée à des troubles moteurs (de type parkinsonien) et de la marche [76, 77], des symptômes psychologiques et comportementaux (dont des symptômes dépressifs) [78], et une dysautonomie cardiovasculaire (hypotension orthostatique, hypersensibilité vagale) [79].
Autres facteurs
Les facteurs favorisant le maintien d’activités cognitives stimulantes sont probablement une autre voie d’action préventive possible : les personnes ayant un haut niveau d’éducation, de même que celles pratiquant certaines activités de loisirs développeraient en effet la maladie plus tardivement [80, 81]. La promotion d’une vie active et de la pratique d’activités après la retraite pourrait ainsi aider à retarder l’apparition d’une démence.
De même, l’environnement social des personnes âgées semble très important, et les personnes célibataires, ou ayant un faible entourage social, semblent plus à risque de développer une démence [8, 82] ; là encore, il semble nécessaire de favoriser les contacts sociaux chez les personnes âgées. La dépression pourrait aussi être un facteur favorisant la survenue d’une démence [83], et une prise en charge adaptée de la dépression, souvent négligée chez les personnes âgées, pourrait être bénéfique.
L’alimentation pourrait aussi jouer un rôle. Une consommation modérée de vin, une consommation régulière de poisson, et une consommation suffisante de fruits et de légumes pourraient être associées à un risque moindre de développer la maladie [84-86] : plusieurs mécanismes sous-jacents, passant par des effets anti-oxydants, vasculaires ou anti-inflammatoires ont été proposés. Les bénéfices observés ne sont peut-être pas uniquement dus à l’alimentation, mais également à tout ce qui accompagne les repas : choix des aliments, environnement et convivialité des repas. Les recommandations faites dans le cadre du Programme national nutrition santé (PNNS) semblent adaptées également pour la prévention du risque de démence [87].
Enfin, trois études récentes ont mis en évidence que la pratique de la marche ou du sport pourrait être associée à un risque moindre de développer une démence [88-90]. L’activité physique pourrait en effet jouer un rôle par différents mécanismes ; quel que soit le mécanisme impliqué (que l’activité physique agisse directement ou en favorisant les contacts sociaux entre les personnes), de tels résultats devraient inciter à conseiller aux personnes âgées la pratique d’une ou plusieurs activités physiques adaptées à leur âge.
Essais thérapeutiques de prévention
Outre ces pistes de prévention visant à mieux prendre en charge des facteurs de risque ou à inciter à la pratique d’activités préventives, un effet préventif de certains traitements a été évoqué. Pour l’instant, aucun essai thérapeutique n’a pu confirmer l’efficacité réelle d’un traitement préventif, hormis le traitement de l’hypertension artérielle, mais toutes les conditions n’étaient pas réunies pour apporter une réponse définitive.
Hypolipémiants
In vitro, le cholestérol favorise la formation de peptide β-amyloïde [91, 92] et accélère le développement de la pathologie amyloïde chez l’animal transgénique [93, 94] ; une étude autopsique a aussi montré un lien entre hypercholestérolémie, dépôts amyloïdes et dégénérescence neurofibrillaire [95]. De plus, l’hypercholestérolémie est associée à une augmentation de l’activation de la microglie et à une infiltration leucocytaire, comme on peut l’observer dans les plaques amyloïdes. Cette activation microgliale contribuerait à la neurodégénérescence via la production de cytokines et de radicaux libres [96]. Les statines réduisent le niveau intracellulaire de cholestérol et ont un effet inhibiteur sur la production de bêta-amyloïde dans les cultures cellulaires [97, 98] ; elles ont également des effets pléiotropes qui pourraient ralentir la progression de la maladie [99]. Si certaines études d’observation ont montré un effet bénéfique des statines sur le déclin cognitif [44-46], deux essais thérapeutiques n’ont pu confirmer leur efficacité pour la prévention des démences [100, 101] : ces essais n’ont pas mis en évidence d’effet statistiquement significatif sur la cognition, que ce soit avec la pravastatine ou avec la simvastatine [100, 101]. Toutefois, la cognition était analysée comme critère secondaire dans ces essais.
Oestrogènes
Les données épidémiologiques montrent que les femmes ont un risque plus élevé de maladie d’Alzheimer que les hommes après l’âge de 80 ou 85 ans ; la diminution post-ménopausique des oestrogènes endogènes pourrait en partie expliquer ce risque. Les oestrogènes exerceraient des effets neuroprotecteurs sur le cerveau âgé, notamment via l’inhibition de la formation de peptides bêta-amyloïde [102], la stimulation de l’activité cholinergique et la diminution des lésions cellulaires liées au stress oxydatif [103]. Plusieurs études ont exploré le rôle du traitement hormonal substitutif (THS) sur le risque de maladie d’Alzheimer chez les femmes âgées ; les résultats sont mitigés : une méta-analyse incluant 10 études d’observation, dont 8 études cas-témoins et 2 études prospectives, a montré que le risque de maladie d’Alzheimer chez les femmes ménopausées ayant été traitées par oestrogènes était réduit de 29 % par rapport aux femmes qui n’avaient jamais reçu d’oestrogènes [104]. Cependant, dans ces études, les femmes sous THS pourraient avoir un niveau d’éducation, un statut économique et un accès aux soins médicaux meilleurs que les autres femmes. L’étude prospective Cache study montre que le THS est surtout utile au moment de la ménopause, au moment où la déplétion en oestrogènes pourrait avoir les conséquences les plus importantes sur les neurones [105]. Deux autres études vont dans ce même sens d’un rôle neuroprotecteur d’autant plus efficace que le traitement est appliqué longtemps avant l’apparition des signes cliniques de maladie d’Alzheimer [106, 107] ; les oestrogènes ne se montrent d’ailleurs pas efficaces lorsque la maladie est installée [108-110].
L’essai négatif de la Women’s health initiative memory study (WHIMS) [111, 112], réalisée avec des oestrogènes équins non utilisés en France, n’est pas complètement concluant dans la mesure où les femmes ont été traitées à l’âge de 65 et plus, alors que c’est au moment de la ménopause (chute brutale en oestrogènes) que le traitement serait le plus pertinent [113] ; cette étude ne devrait pas mettre un frein à l’exploration de cette voie thérapeutique [114]. Il est également possible que le polymorphisme génétique entraîne une variation des effets des oestrogènes selon les femmes [115] : il a notamment été montré que les traitements par oestrogènes avaient un effet différent sur la cognition des femmes selon qu’elles étaient ou non porteuses d’un allèle ε4 de l’apolipoprotéine E [18, 116].
La génétique, outre son intérêt en recherche fondamentale, aurait donc un intérêt clinique non seulement diagnostique, mais aussi, peut-être, dans la détermination des traitements ou des associations de traitements de prévention les plus favorables, à l’échelon individuel ou à celui d’une population.
À juste titre, le rapport d’orientation réalisé par l’Anaes (Agence nationale d’accréditation et d’évaluation en santé) sur ce sujet ne recommande pas, à l'heure actuelle, la prise d’un traitement hormonal substitutif pour la prévention des démences.
Anti-inflammatoires non stéroïdiens (AINS)
Les essais de traitement par les AINS, reposant sur l’observation que les sujets ayant reçu des anti-inflammatoires au long cours avaient moins de risque de démence que les sujets n’en ayant pas reçu, n’ont pas confirmé l’efficacité des AINS ; par ailleurs, un essai sur le sujet (Alzheimer’s disease anti-inflammatory prevention trial, Adapt) a été interrompu, en raison d’une augmentation des effets secondaires cardiovasculaires dans le groupe des sujets traités.
Conclusions
La maladie d’Alzheimer et les syndromes apparentés concernent donc aujourd’hui un peu plus de 855 000 personnes en France métropolitaine, avec chaque année plus de 225 000 nouveaux cas ; si les choses n’évoluent pas, près de 1 300 000 personnes devraient être atteintes en 2020. Les études de cohorte sont indispensables pour suivre l’évolution de cette maladie. Les personnes participant à la cohorte Paquid ont maintenant vieilli (elles ont aujourd’hui 82 ans et plus), ce qui rendra impossible le suivi de cette maladie chez les plus jeunes dans les années à venir. Dans un proche avenir, la cohorte des 3 Cités [117], même si elle n’est pas représentative de la population des personnes âgées, devrait pouvoir fournir des indications, notamment sur l’adéquation entre l’allocation personnalisée d’autonomie (APA) et la démence. Néanmoins, il semble nécessaire de se donner les moyens de surveiller cette maladie à plus long terme, en mettant en place et en suivant des cohortes de grande envergure, représentatives de la population des personnes âgées. Idéalement, afin d’assurer une meilleure représentativité et un meilleur suivi, ces cohortes pourraient être développées à partir des données de l’Assurance maladie. Enfin, afin de tester l’efficacité de stratégies préventives, la mise en place d’essais d’intervention de grande taille, associant des actions sur plusieurs facteurs de risque, semble nécessaire.
Parties annexes
Références
- 1. Hofman A, Rocca WA, Brayne C, et al. The prevalence of dementia in Europe : a collaborative study of 1980-1990 findings. Eurodem prevalence research group. Int J Epidemiol 1991 ; 20 : 736-48.
- 2. Moise P, Schwarzinger M, Um MY, and the dementia Experts’ Group. Dementia care in 9 OECD countries : a comparative analysis. Paris : Organisation de Coopération et de Développement Économiques (OCDE), 2004.
- 3. Lobo A, Launer LJ, Fratiglioni L, et al. Prevalence of dementia and major subtypes in Europe : a collaborative study of population-based cohorts. Neurology 2000 ; 54 (suppl 5) : S4-9.
- 4. Ramaroson H, Helmer C, Barberger-Gateau P, et al. Prévalence de la démence et de la maladie d’Alzheimer chez les personnes de 75 ans et plus : données réactualisées de la cohorte Paquid. Rev Neurol 2003 ; 159 : 405-11.
- 5. Fitzpatrick AL, Kuller LH, Ives DG, et al. Incidence and prevalence of dementia in the Cardiovascular health study. J Am Geriatr Soc 2004 ; 52 : 195-204.
- 6. De Ronchi D, Berardi D, Menchetti M, et al. Occurrence of cognitive impairment and dementia after the age of 60 : a population-based study from Northern Italy. Dement Geriatr Cogn Disord 2005 ; 19 : 97-105.
- 7. Institut National de la Statistique et des Études Economiques (INSEE). Projections démographiques pour la France, ses régions et ses départements (Horizon 2030/2050). Paris : INSEE Résultats, 2003 : 3-38.
- 8. Fratiglioni L, Wang HX, Ericsson K, et al. Influence of social network on occurence of dementia : a community-based longitudinal study. Lancet 2000 ; 355 : 1315-9.
- 9. Ravaglia G, Forti P, Maioli F, et al. Incidence and etiology of dementia in a large elderly Italian population. Neurology 2005 ; 64 : 1525-30.
- 10. Gilman S, Koller M, Black RS, et al. Clinical effects of Abeta immunization (AN1792) in patients with AD in an interrupted trial. Neurology 2005 ; 64 : 1553-62.
- 11. Letenneur L, Dequae L, Jacqmin H, et al. Prévalence de la démence en Gironde (France). Rev Epidemiol Sante Publ 1993 ; 41 : 139-45.
- 12. Brookmeyer R, Gray S, Kawas C. Projections of Alzheimer’s disease in the United States and the public health impact of delaying disease onset. Am J Publ Health 1998 ; 88 : 1337-42.
- 13. Farrer LA, Cupples LA, Haines JL, et al. Effects of age, sex, and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease. A meta-analysis. APOE and Alzheimer disease meta-analysis consortium. JAMA 1997 ; 278 : 1349-56.
- 14. Cumming AM, Robertson F. Polymorphism at the apo E locus in relation to risk of coronary disease. Clin Genet 1984 ; 25 : 310-3.
- 15. Agero-Torres H, Fratiglioni L, Guo Z, et al. Mortality from dementia in advanced age : a 5-year follow-up study of incident dementia cases. J Clin Epidemiol 1999 ; 52 : 737-43.
- 16. Wolfson C, Wolfson DB, Asgharian M, et al. A reevaluation of the duration of survival after the onset of dementia. N Engl J Med 2001 ; 344 : 1111-6.
- 17. Helmer C, Joly P, Letenneur L, et al. Mortality with dementia : results from a French prospective community-based cohort. Am J Epidemiol 2001 ; 154 : 642-8.
- 18. Larson EB, Shadlen MF, Wang L, et al. Survival after initial diagnosis of Alzheimer disease. Ann Intern Med 2004 ; 140 : 501-9.
- 19. Skoog I, Lernfelt B, Landahl S, et al. 15-year longitudinal study of blood pressure and dementia. Lancet 1996 ; 347 : 1141-5.
- 20. Launer LJ, Ross GW, Petrovitch H, et al. Midlife blood pressure and dementia : the Honolulu-Asia aging study. Neurobiol Aging 2000 ; 21 : 49-55.
- 21. Kivipelto M, Helkala E-L, Laasko MP, et al. Midlife vascular risk factors and Alzheimer’s disease in later life : longitudinal, population based study. Br Med J 2001 ; 322 : 1447-51.
- 22. Ott A, Stolk RP, Hofman A, et al. Association of diabetes mellitus and dementia : the Rotterdam study. Diabetologia 1996 ; 39 : 1392-7.
- 23. Knopman D, Boland LL, Mosley T, et al. Cardiovascular risk factors and cognitive decline in middle-aged adults. Neurology 2001 ; 56 : 42-8.
- 24. Xu WL, Qiu CX, Wahlin A, et al. Diabetes mellitus and risk of dementia in the Kungsholmen project : a 6-year follow-up study. Neurology 2004 ; 63 : 1181-1186.
- 25. Graves A, Van Duijn C, Chandra V, et al. Alcohol and tobacco consumption as risk factors for Alzheimer’s disease : a collaborative reanalysis of case-control studies. Eurodem risk factors research group. Int J Epidemiol 1991 ; 20 : 48-57.
- 26. Ott A, Slooter AJ, Hofman A, et al. Smoking and risk of dementia and Alzheimer’s disease in a population-based cohort study : the Rotterdam Study. Lancet 1998 ; 351 : 1840-3.
- 27. Juan D, Zhou DH, Li J, et al. A 2-year follow-up study of cigarette smoking and risk of dementia. Eur J Neurol 2004 ; 11 : 277-82.
- 28. Gustafson D, Rothenberg E, Blennow K, et al. An-18-year follow-up of overweight and risk of Alzheimer disease. Arch Intern Med 2003 ; 163 : 1524-8.
- 29. Tatemichi TK, Paik M, Bagiella E, et al. Risk of dementia after stroke in a hospitalized cohort : results of a longitudinal study. Neurology 1994 ; 44 : 1885-91.
- 30. Prencipe M, Ferretti C, Casini AR, et al. Stroke, disability, and dementia : results of a population survey. Stroke 1997 ; 28 : 531-6.
- 31. Henon H, Durieu I, Guerouaou D, et al. Poststroke dementia : incidence and relationship to prestroke cognitive decline. Neurology 2001 ; 57 : 1216-22.
- 32. Desmond DW, Moroney JT, Sano M, Stern Y. Incidence of dementia after ischemic stroke : results of a longitudinal study. Stroke 2002 ; 33 : 2254-60.
- 33. Lowery K, Ballard C, Rodgers H, et al. Cognitive decline in a prospectively studied group of stroke survivors, with a particular emphasis on the > 75’s. Age Ageing 2002 ; 31 (suppl 3) : 24-7.
- 34. Ivan CS, Seshadri S, Beiser A, et al. Dementia after stroke : the Framingham study. Stroke 2004 ; 35 : 1264-8.
- 35. Altieri M, Di Piero V, Pasquini M, et al. Delayed poststroke dementia : a 4-year follow-up study. Neurology 2004 ; 62 : 2193-7.
- 36. Ott A, Breteler MMB, De Bruyne MC, et al. Atrial fibrillation and dementia in a population-based study. The Rotterdam study. Stroke 1997 ; 28 : 316-21.
- 37. Hofman A, Ott A, Breteler MMB, et al. Atherosclerosis, apolipoprotein E, and prevalence of dementia and Alzheimer’s disease in the Rotterdam study. Lancet 1997 ; 349 : 151-4.
- 38. Kalmijn S, Launer LJ, Lindemans J, et al. Total homocysteine and cognitive decline in a community-based sample of elderly subjects : the Rotterdam Study. Am J Epidemiol 1999 ; 150 : 283-9.
- 39. Hogervorst E, Ribeiro HM, Molyneux A, et al. Plasma homocysteine levels, cerebrovascular risk factors, and cerebral white matter changes (leukoaraiosis) in patients with Alzheimer disease. Arch Neurol 2002 ; 59 : 787-93.
- 40. Guo Z, Fratiglioni L, Zhu L, et al. Occurence and progression of dementia in a community population aged 75 years and older : relationship of antihypertensive medication use. Arch Neurol 1999 ; 56 : 991-6.
- 41. Tzourio C, Dufouil C, Ducimetière P, Alpérovitch A. Cognitive decline in individuals with high blood pressure. Neurology 1999 ; 53 : 1948-52.
- 42. Richards SS, Emsley CL, Roberts J, et al. The association between vascular risk-factor-mediating medications and cognition an dementia diagnosis in a community-based sample of African-Americans. J Am Geriatr Soc 2000 ; 48 : 1035-41.
- 43. in t’ Veld BA, Ruitenberg A, Hofman A, et al. Antihypertensive drugs and incidence of dementia : the Rotterdam study. Neurobiol Aging 2001 ; 22 : 407-12.
- 44. Jick H, Zornberg GL, Jick SS, et al. Statins and the risk of dementia. Lancet 2000 ; 356 : 1627-31.
- 45. Wolozin B, Kellman W, Ruosseau P, et al. Decreased prevalence of Alzheimer disease associated with 3-hydroxy-3-methyglutaryl coenzyme A reductase inhibitors. Arch Neurol 2000 ; 57 : 1439-43.
- 46. Yaffe K, Barrett-Connor E, Lin F, Grady D. Serum lipoprotein levels, statin use, and cognitive function in older women. Arch Neurol 2002 ; 59 : 378-84.
- 47. Forette F, Seux M-L, Staessen JA, et al. Prevention of dementia in randomised double-blind placebo-controlled systolic hypertension in Europe (Syst-Eur) trial. Lancet 1998 ; 352 : 1347-51.
- 48. Forette F, Seux ML, Staessen JA, et al. The prevention of dementia with antihypertensive treatment : new evidence from the systolic hypertension in Europe (Syst-Eur) study. Arch Intern Med 2002 ; 162 : 2046-52.
- 49. Tzourio C, Anderson C, Chapman N, et al. Effects of blood pressure lowering with perindopril and indapamide therapy on dementia and cognitive decline in patients with cerebrovascular disease. Arch Intern Med 2003 ; 163 : 1069-75.
- 50. Ferrucci L, Guralnik JM, Salive ME, et al. Cognitive impairment and risk of stroke in the older population. J Am Geriatr Soc 1996 ; 44 : 237-41.
- 51. Zhu L, Fratiglioni L, Guo Z, et al. Incidence of stroke in relation to cognitive function and dementia in the Kungsholmen project. Neurology 2000 ; 54 : 2103-07.
- 52. Helmer C, Joly P, Letenneur L, et al. Mortality with dementia : results from a French prospective community-based cohort. Am J Epidemiol 2001 ; 54 : 642-8.
- 53. Liebetrau M, Steen B, Skoog I. Stroke in 85-year-olds : prevalence, incidence, risk factors, and relation to mortality and dementia. Stroke 2003 ; 34 : 2617-22.
- 54. Henon H, Pasquier F, Durieu I, et al. Preexisting dementia in stroke patients. Baseline frequency, associated factors, and outcome. Stroke 1997 ; 28 : 2429-36.
- 55. Barba R, Castro MD, del Mar Morin M, et al. Prestroke dementia. Cerebrovasc Dis 2001 ; 11 : 216-24.
- 56. Klimkowicz A, Dziedzic T, Slowik A, Szczudlik A. Incidence of pre- and poststroke dementia : Cracow stroke registry. Dement Geriatr Cogn Disord 2002 ; 14 : 137-40.
- 57. Tang WK, Chan SS, Chiu HF, et al. Frequency and determinants of prestroke dementia in a Chinese cohort. J Neurol 2004 ; 251 : 604-8.
- 58. Henon H, Lebert F, Durieu I, et al. Confusional state in stroke : relation to preexisting dementia, patient characteristics, and outcome. Stroke 1999 ; 30 : 773-9.
- 59. Verdelho A, Hénon H, Lebert F, et al. Depressive symptoms after stroke and relationship with dementia : a three-year follow-up study. Neurology 2004 ; 62 : 905-11.
- 60. Cordonnier C, Henon H, Derambure P, et al. Influence of pre-stroke dementia on the risk of post-stroke epileptic seizures. J Neurol Neurosurg Psychiatry 2005 ; 76 : 1649-53.
- 61. Heruti RJ, Lusky A, Dankner R, et al. Rehabilitation outcome of elderly patients after a first stroke : effect of cognitive status at admission on the functional outcome. Arch Phys Med Rehabil 2002 ; 83 : 742-9.
- 62. Moroney JT, Bagiella E, Tatemichi TK, et al. Dementia after stroke increases the risk of long-term stroke recurrence. Neurology 1997 ; 48 : 1317-25.
- 63. Henon H, Durieu I, Lebert F, et al. Influence of prestroke dementia on early and delayed mortality in stroke patients. J Neurol 2003 ; 250 : 10-6.
- 64. Henon H, Pasquier F, Durieu I, et al. Medial temporal lobe atrophy in stroke patients : relation to pre-existing dementia. J Neurol Neurosurg Psychiatry 1998 ; 65 : 641-7.
- 65. Pohjasvaara T, Mantyla R, Aronen HJ, et al. Clinical and radiological determinants of prestroke cognitive decline in a stroke cohort. J Neurol Neurosurg Psychiatry 1999 ; 67 : 742-8.
- 66. Kilander L, Andren B, Nyman H, et al. Atrial fibrillation is an independent determinant of low cognitive function : a cross-sectional study in elderly men. Stroke 1998 ; 29 : 1816-20.
- 67. Masse I, Bordet R, Deplanque D, et al. Lipid-lowering agents are associated with a slower cognitive decline in Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2005 ; 76 : 1624-9.
- 68. Snowdon DA, Greiner LH, Mortimer JA, et al. Brain infarction and the clinical expression of Alzheimer disease. The Nun study. JAMA 1997 ; 277 : 813-7.
- 69. Nagy Z, Esiri MM, Jobst KA, et al. The effects of additional pathology on the cognitive deficit in Alzheimer’s disease. J Neuropathol Exp Neurol 1997 ; 56 : 165-70.
- 70. Kalaria RN, Ballard C. Overlap between pathology of Alzheimer disease and vascular dementia. Alzheimer Dis Assoc Disord 1999 ; 13 (suppl 3) : S115-23.
- 71. Jellinger KA, Mitter-Ferstl E. The impact of cerebrovascular lesions in Alzheimer disease : a comparative autopsy study. J Neurol 2003 ; 250 : 1050-5.
- 72. Fernando MS, Ince PG. Vascular pathologies and cognition in a population-based cohort of elderly people. J Neurol Sci 2004 ; 226 : 13-7.
- 73. Bowler JV, Munoz DG, Merskey H, Hachinski V. Factors affecting the age of onset and rate of progression of Alzheimer’s disease. J Neurol Neurosurg Psychiatry 1998 ; 65 : 184-90.
- 74. Lee JH, Olichney JM, Hansen LA, et al. Small concomitant vascular lesions do not influence rates of cognitive decline in patients with Alzheimer disease. Arch Neurol 2000 ; 57 : 1474-9.
- 75. Jellinger KA. Small concomitant cerebrovascular lesions are not important for cognitive decline in severe Alzheimer disease. Arch Neurol 2001 ; 58 : 520-1.
- 76. Guo X, Skoog I, Matousek M, et al. A population-based study on motor performance and white matter lesions in older women. J Am Geriatr Soc 2000 ; 48 : 967-70.
- 77. Frisoni GB, Geroldi C. Cerebrovascular disease affects noncognitive symptoms in Alzheimer disease. Arch Neurol 2001 ; 58 : 1939-40.
- 78. O’Brien J, Ames D, Chiu E, et al. Severe deep white matter lesions and outcome in elderly patients with major depressive disorder : follow-up study. Br Med J 1998 ; 317 : 982-4.
- 79. Ballard C, O’Brien J, Barber B, et al. Neurocardiovascular instability, hypotensive episodes, and MRI lesions in neurodegerative dementia. Ann NY Acad Sci 2000 ; 903 : 442-5.
- 80. Fabrigoule C, Letenneur L, Dartigues JF, et al. Social and leisure activities and risk of dementia : a prospective longitudinal study. J Am Geriatr Soc 1995 ; 43 : 485-90.
- 81. Letenneur L, Gilleron V, Commenges D, et al. Are sex and educational level independent predictors of dementia and Alzheimer’s disease? Incidence data from the PAQUID project. J Neurol Neurosurg Psychiatry 1999 ; 66 : 177-83.
- 82. Helmer C, Damon D, Letenneur L, et al. Marital status and risk of Alzheimer’s disease : a French population-based cohort study. Neurology 1999 ; 53 : 1953-8.
- 83. Jorm AF. Is depression a risk factor for dementia or cognitive decline? A review. Gerontology 2000 ; 46 : 219-27.
- 84. Engelhart MJ, Geerlings MI, Ruitenberg A, et al. Dietary intake of antioxidants and risk of Alzheimer disease. JAMA 2002 ; 287 : 3223-9.
- 85. Morris MC, Evans DA, Bienias JL, et al. Dietary intake of antioxidant nutrients and the risk of incident Alzheimer disease in a biracial community study. JAMA 2002 ; 287 : 3230-7.
- 86. Larrieu S, Letenneur L, Helmer C, et al. Nutritional factors and risk of incident dementia in the PAQUID longitudinal cohort. J Nutr Health Aging 2004 ; 8 : 150-4.
- 87. Programme National Nutrition Santé (PNNS). La santé vient en mangeant. Le guide alimentaire pour tous. Paris : INPES, 2002.
- 88. Abbott RD, White LR, Ross GW, et al. Walking and dementia in physically capable elderly men. JAMA 2004 ; 292 : 1447-53.
- 89. Weuve J, Kang JH, Manson JE, et al. Physical activity, including walking, and cognitive function in older women. JAMA 2004 ; 292 : 1454-61.
- 90. Podewils LJ, Guallar E, Kuller LH, et al. Physical activity, APOE genotype, and dementia risk : findings from the Cardiovascular health cognition study. Am J Epidemiol 2005 ; 161 : 639-51.
- 91. Bodovitz S, Klein WL. Cholesterol modulates alpha-secretase cleavage of amyloid precursor protein. J Biol Chem 1996 ; 271 : 4436-40.
- 92. Frears ER, Stephens DJ, Walters CE, et al. The role of cholesterol in the biosynthesis of beta-amyloid. NeuroReport 1999 ; 10 : 1699-705.
- 93. Howland DS, Trusko SP, Savage MJ, et al. Modulation of secreted beta-amyloid precursor protein and amyloid beta-peptide in brain by cholesterol. J Biol Chem 1998 ; 273 : 16576-82.
- 94. Refolo LM, Malester B, LaFrancois J, et al. Hypercholesterolemia accelerates the Alzheimer’s amyloid pathology in a transgenic mouse model. Neurobiol Dis 2000 ; 7 : 321-31.
- 95. Launer LJ, White LR, Petrovitch H, et al. Cholesterol and neuropathologic markers of AD. A population-based autopsy study. Neurology 2001 ; 57 : 1447-52.
- 96. Streit WJ, Sparks DL. Activation of microglia in the brains of humans with heart disease and hypercholesterolemic rabbits. J Mol Med 1997 ; 75 : 130-8.
- 97. Simons M, Keller P, De Strooper B, et al. Cholesterol depletion inhibits the generation of beta-amyloid in hippocampal neurons. Proc Natl Acad Sci USA 1998 ; 95 : 6460-4.
- 98. Fassbender K, Simons M, Bergmann C, et al. Simvastatin strongly reduces levels of Alzheimer’s disease beta -amyloid peptides Abeta 42 and Abeta 40 in vitro and in vivo. Proc Natl Acad Sci USA 2001 ; 98 : 5856-61.
- 99. Crisby M, Carlson LA, Winblad B. Statins in the prevention and treatment of Alzheimer disease. Alzheimer Dis Assoc Disord 2002 ; 16 : 131-6.
- 100. Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER) : a randomised controlled trial. Lancet 2002 ; 360 : 1623-30.
- 101. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals : a randomised placebo controlled trial. Lancet 2002 ; 360 : 7-22.
- 102. Xu H, Gouras GK, Greenfield JP, et al. Estrogen reduces neuronal generation of Alzheimer beta-amyloid peptides. Nat Med 1998 ; 4 : 447-51.
- 103. McEwen BS. Clinical review 108 : the molecular and neuroanatomical basis for estrogen effects in the central nervous system. J Clin Endocrinol Metab 1999 ; 84 : 1790-7.
- 104. Yaffe K, Sawaya G, Lieberburg I, Grady D. Estrogen therapy in postmenopausal women : effects on cognitive function and dementia. JAMA 1998 ; 279 : 688-95.
- 105. Zandi PP, Carlson MC, Plassman BL, et al. Hormone replacement therapy and the incidence of Alzheimer disease in older women. The Cache County study. JAMA 2002 ; 288 : 2123-9.
- 106. Tang MX, Jacobs D, Stern Y, et al. Effect of oestrogen during menopause on risk and age at onset of Alzheimer’s disease. Lancet 1996 ; 348 : 429-32.
- 107. Kawas C, Resnick S, Morrison A, et al. A prospective study of estrogen replacement therapy and the risk of developing Alzheimer’s disease : the Baltimore longitudinal study of aging. Neurology 1997 ; 48 : 1517-21.
- 108. Henderson VW, Paganini-Hill A, Miller BL, et al. Estrogen for Alzheimer’s disease in women : randomized, double-blind, placebo-controlled trial. Neurology 2000 ; 54 : 295-301.
- 109. Mulnard RA, Cotman CW, Kawas C, et al. Estrogen replacement therapy for treatment of mild to moderate Alzheimer’s disease : a 1-year randomized controlled trial. Alzheimer’s disease cooperative study. JAMA 2000 ; 283 : 1007-15.
- 110. Marder K, Sano M. Estrogen to treat Alzheimer’s disease : too little, too late? So what’s a woman to do? Neurology 2000 ; 54 : 2035-7.
- 111. Rapp SR, Espeland MA, Shumaker SA, et al. Effect of estrogen plus progestin on global cognitive function in postmenopausal women. JAMA 2003 ; 289 : 2663-72.
- 112. Shumaker SA, Legault C, Rapp SR, et al. Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women. The Women’s health initiative memory study : a randomized controlled trial. JAMA 2003 ; 289 : 2651-62.
- 113. Henderson VW, Benke KS, Green RC, et al. Postmenopausal hormone therapy and Alzheimer’s disease risk : interaction with age. J Neurol Neurosurg Psychiatry 2005 ; 76 : 103-5.
- 114. Bluming AZ. Hormone replacement therapy : the debate should continue. Geriatrics 2004 ; 59 : 30-1, 35-7.
- 115. Yaffe K. Hormone therapy and the brain. Déjà vu all over again? JAMA 2003 ; 289 : 2717-9.
- 116. Burkhardt MS, Foster JK, Laws SM, et al. Oestrogen replacement therapy may improve memory functioning in the absence of APOE epsilon4. J Alzheimer Dis 2004 ; 6 : 221-8.
- 117. 3C Study Group. Vascular factors and risk of dementia : design of the Three-City study and baseline characteristics of the study population. Neuroepidemiology 2003 ; 22 : 316-25.
Liste des figures
Figure 1
Incidence des démences selon l’âge (données Paquid 1988-2001).
Liste des tableaux
Tableau I
Prévalence (%) de la maladie d’Alzheimer et des syndromes apparentés en fonction de l’âge et du sexe.
Tableau II
Estimation du nombre de personnes atteintes de démence en 2004 en France métropolitaine (d’après [4, 6]).
Tableau III
Incidence de la maladie d’Alzheimer et des syndromes apparentés en fonction de l’âge et du sexe.
Tableau IV
Estimation* du nombre de personnes atteintes de démence en France métropolitaine en 2020 et en 2040.
Tableau V
Estimation des bornes inférieure et supérieure du nombre de cas de démences (n) et de leur taux (pour 1 000 habitants) en 2020 et en 2040.
Tableau VI
Espérance de vie selon l’âge chez les sujets déments et en population générale.



![Estimation du nombre de personnes atteintes de démence en 2004 en France métropolitaine (d’après [4, 6]).](/fr/revues/ms/2006-v22-n3-ms1125/012784ar/media/012784art002n.png)