Résumés
Résumé
Les cellules de Langerhans (CL) de l’épiderme et des épithéliums pluristratifiés appartiennent au système immunitaire. Ces cellules ont un éventail de fonctions très différentes, avec des implications qui vont bien au-delà de la peau, en raison de leurs propriétés de migration qui leur permettent d’informer les lymphocytes T dans les ganglions drainants. Les CL furent longtemps considérées comme les acteurs principaux de la réponse immune dans les maladies infectieuses, tel le sida, l’allergie, les réactions inflammatoires chroniques, les rejets de tumeur ou la transplantation. Découvertes il y a près de 140 ans, elles restent cependant énigmatiques par de nombreux aspects, et leur rôle précis dans le déclenchement de la réaction immunitaire cutanée ou dans l’établissement d’une tolérance aux composants du soi reste controversé.
Summary
Epidermal Langerhans cells, a constituent of the skin immune system, have a spectrum of different functions with implications that extend far beyond the skin. They have the potential to internalize particulate agents and macromolecules, and display migratory properties that endow them with the unique capacity to journey between skin and draining lymph nodes where they encounter antigen-specific T lymphocytes. In addition, LC are considered to play a pivotal role in infectious disease such as Aids, allergy, chronic inflammatory reactions, tumor rejections or transplantation. Herein, we will review the features of Langerhans cells, emphasizing characteristics representative of their life-cycle stages that occur within the skin.
Corps de l’article
Histoire et description des cellules de Langerhans
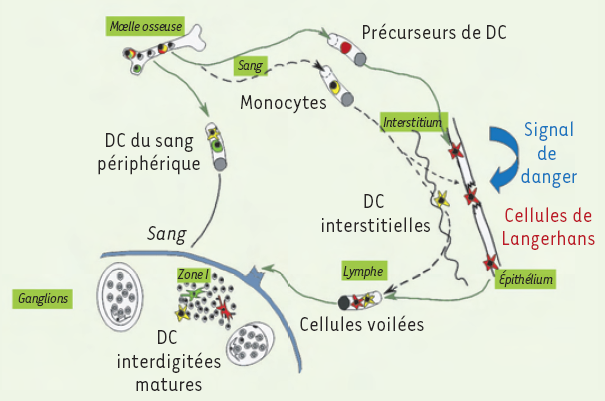
Les cellules de Langerhans (CL) ont, dans un premier temps, été décrites comme des neurones intra-épidermiques, par Paul Langerhans en 1868 [1]. Cent ans plus tard, le travail pionnier de Ralph Steinman a permis la caractérisation des cellules présentatrices d’antigène professionnelles, les cellules dendritiques (dendritic cells, DC), capables d’activer des lymphocytes T naïfs [2]. Ce n’est que beaucoup plus tard qu’il fut montré que les cellules de Langerhans sont, en réalité, des cellules dendritiques à un stade immature de leur vie [3] (Figure 1). Elles constituent un réseau dense dans la peau et dans toutes les muqueuses pluristratifiées de l’organisme (Figure 2) : ce réseau peut être visualisé en vidéomicroscopie, en utilisant des souris exprimant une protéine fluorescente sous contrôle de promoteurs spécifiques [4, 5]. Les cellules de Langerhans représentent 2 % à 4 % de la population des cellules épidermiques, et leur densité varie de 200 à 1 000 cellules/mm2 selon leur localisation anatomique.
Figure 1
Cycle de vie des cellules de Langerhans.
Les cellules de Langerhans (CL) procèdent, au cours de leur maturation, à des changements phénotypiques et fonctionnels. Elles se transforment en cellules dendritiques (DC) dites matures, ayant les caractéristiques des DC retrouvées dans les organes lymphoïdes secondaires : de ces constatations est né le concept de cycle de vie des CL. Ainsi, suivant l’état de l’épithélium, des précurseurs hématopoïétiques ou des monocytes colonisent les épithéliums, où ils se différencient en CL capables de reconnaître et d’internaliser les pathogènes. Un signal de danger entraîne alors la migration des CL vers les organes lymphoïdes secondaires, où elles sont appelées cellules dendritiques interdigitées matures. Ces cellules sont capables de présenter des complexes CMH-Ag (complexe majeur d’histocompatibilité-antigène) à des lymphocytes T spécifiques. Au cours de leur migration dans la lymphe, les DC sont nommées cellules voilées.
Figure 2
Réseau de cellules de Langerhans au sein d’un feuillet de l’épiderme.
À partir de peau humaine normale, l’action d’enzymes telles que la trypsine permet de dissocier le derme de l’épiderme : ce feuillet épidermique peut alors être marqué par différents procédés enzymatiques (comme, ici, l’ATPase) ou immunohistologiques, révélant un réseau dense de cellules de Langerhans en microscopie optique (Cliché : Dr Colette Dezutter-Dambuyant).
Caractérisation
Les cellules de Langerhans, localisées dans les couches basales et suprabasales de l’épiderme, sont caractérisées in situ par la présence d’extensions cytoplasmiques longues et fines, émergeant de corps cellulaires de petite taille (Figure 2). Birbeck fut le premier à montrer, par microscopie électronique, que les CL possèdent un noyau plurilobé entouré d’un cytoplasme clair dépourvu de tonofilaments, de desmosomes ou de mélanosomes, et qu’elles possèdent des organites intracytoplasmiques spécifiques permettant de les identifier avec certitude : les granules de Birbeck (GB) [6]. Ces granules, souvent observés sous une forme dite en « raquette de tennis », sont formés par deux membranes accolées, séparées par une zone régulièrement striée en « fermeture Eclair® » (Figure 3). Ils résultent de l’expression élevée d’une lectine de type II, la langerine, qui leur est spécifique [7] ; toutefois, leurs fonctions restent controversées.
Figure 3
Granules de Birbeck au sein d’une cellule de Langerhans épidermique.
Les cellules de Langerhans isolées de la peau humaine normale par l’action de la trypsine sont purifiées par centrifugation sur un coussin de Ficoll. Après avoir été fixées et coupées, les cellules de Langerhans sont observées à l’aide d’un microscope électronique : des granules de Birbeck caractéristiques, « en raquette de tennis », sont visualisés (Cliché : Dr Colette Dezutter-Dambuyant).
Le phénotype des CL est lié à leurs fonctions : en tant que leucocytes, elles expriment le marqueur CD45 ainsi que les marqueurs propres aux lignées hématopoïétiques myéloïdes, tels CD33 et CD13. Chez l’homme, la molécule CD1a, caractéristique des thymocytes CD4+CD8+ et impliquée dans la présentation d’antigènes glycolipidiques, sert aussi de marqueur des CL. Ces dernières expriment également des molécules d’adhérence, telle l’E-cadhérine, qui leur permet une adhérence homotypique avec les kératinocytes. Enfin, les CL possèdent tous les composants de la machinerie de présentation antigénique, molécules du complexe majeur d’histocompatibilité (CMH) de classe I et II et chaîne invariante Ii/CD74 [8].
Origine
L’origine hématopoïétique des cellules de Langerhans a clairement été établie par l’étude de transplantation de moelle osseuse [9]. Le rôle clé de la cytokine TGFβ a ensuite pu être mis en évidence chez des souris déficientes pour ce gène, où les CL sont absentes de la peau. En accord avec cette conclusion, on n’observe aucune CL chez des souris déficientes pour le facteur de transcription Id2, lequel est induit par le TGFβ [10]. Chez l’homme, l’obtention de CL in vitro, à partir de progéniteurs hématopoïétiques CD34+ ou de monocytes, est également strictement dépendante de cette cytokine [11, 12] ; les CL issues de monocytes n’expriment alors plus le marqueur CD14.
Bien que des études in vitro aient montré que l’engagement de la différenciation des CL est déjà établi au niveau de précurseurs circulant très tôt au cours de l’ontogenèse [13], il est possible que cette différenciation dépende de cytokines présentes dans l’environnement une fois les progéniteurs entrés dans le tissu conjonctif de la peau, ou au niveau de précurseurs résidant dans le derme [14]. Par ailleurs, chez des souris irradiées ayant reçu une greffe de moelle, les CL provenant de l’hôte sont maintenues pendant au moins 18 mois ; cependant, si la peau est exposée aux rayons UV, les CL disparaissent rapidement et sont alors remplacées par des précurseurs circulants, dans un délai de 2 semaines : au repos, la plupart des CL sont donc maintenues localement, tandis que des modifications inflammatoires de la peau entraînent leur remplacement par des progéniteurs circulants [15].
Internalisation des antigènes
À l’aide de traceurs tels que le FITC (fluoresceine isothiocyanate)-dextran ou la luciférase yellow, ou encore de billes de latex, différentes études ont montré que les cellules de Langerhans utilisent efficacement l’endocytose médiée par récepteur, la macropinocytose et la phagocytose. Reis e Sousa et ses collaborateurs ont par ailleurs prouvé que les CL de souris fraîchement isolées internalisent S. cerevisae, L. parvum, et S. aureus [16].
Pour fixer les pathogènes, les CL des lectines de type C (dépendantes du calcium) : la langerine, permettant notamment la capture d’antigènes glycolipidiques dérivés des mycobactéries ou la protéine d’enveloppe gp120 du virus VIH [17, 18], et la lectine Dectin1, récepteur des β-glucanes [19]. Il est probable aussi que des pathogènes opsonisés soient reconnus par des récepteurs des fragments Fc d’immunoglobulines, dans la mesure où les CL expriment les FcRI (CD64), FcRIII (CD16) et FcRII (CD32) [20]. Enfin, les CL humaines expriment le récepteur du complément CR3 (Figure 4).
Figure 4
Récepteurs potentiellement impliqués dans la reconnaissance et la capture des pathogènes par les cellules de Langerhans.
Différentes familles de récepteurs exprimés par les cellules de Langerhans sont capables de reconnaître ou d’internaliser les pathogènes. Les lectines de type C, dépendantes du calcium, reconnaissent des motifs oligo-saccharidiques présents à la surface des pathogènes. Les récepteurs des fragments Fc des Ig et les récepteurs du complément (CR) permettent, quant à eux, la reconnaissance de pathogènes ou de corps apoptotiques opsonisés. Enfin, des lectines de type I (Dec205) ou II (Dectine 1), certains récepteurs des fragments Fc des Ig, mais surtout les TLR (Toll-like receptors), transmettent ensuite un signal de danger aux cellules de Langerhans, induisant leur maturation phénotypique et fonctionnelle.
Par ailleurs, la capacité des CL à internaliser des corps apoptotiques suggère qu’elles jouent un rôle dans l’induction des processus de tolérance aux antigènes du soi : des CL ayant émigré hors d’explants de peau de souris contiennent en effet des mélanocytes apoptotiques [21]. Chez l’homme, les CL peuvent contenir des fragments cellulaires issus de cellules apoptotiques obtenues lors d’érythèmes induits par les rayons UV [22].
Signaux d’activation
L’activation de CD40 par CD40L, mimant une interaction avec un lymphocyte T, induit la maturation des cellules dendritiques. Par ailleurs, les cellules de Langerhans maturent, en réponse à divers composés, des pathogènes principalement identifiés par une famille de récepteurs, les Toll-like receptors (TLR) [23] (Figure 4) : ces derniers reconnaissent des motifs particuliers présents à la surface des micro-organismes ou contenus dans leur génome ((→) m/s 2006, n° 2, p. 149). De façon surprenante, les CL fraîchement isolées ou dérivées de monocytes expriment des niveaux indétectables de TLR4, et ne maturent pas de manière significative, en réponse au LPS, son ligand ([24] et nos résultats non publiés). Dans le même contexte, les kératinocytes expriment TLR4, et son activation induit la sécrétion de cytokines pro-inflammatoires, certainement responsables des effets observés sur les CL avoisinantes. Enfin, les CL humaines ne subissent pas de maturation phénotypique en réponse à l’Imiquimod et au R-848, des ligands synthétiques de TLR7 et TLR8 [25].
Diverses études ont également montré que des composés endogènes, issus de la dégradation de la matrice extracellulaire ou d’un stress cellulaire, peuvent induire la maturation des DC : la nature de ces composés demeure encore mal définie, mais des protéines de choc thermique, le hyaluronate, les héparanes sulfate solubles, des lipides oxydés et des cristaux d’acide urique sont des activateurs des DC [26]. Toutefois, très peu de résultats ont été rapportés dans des études utilisant des CL fraîchement isolées.
Enfin, le signal de danger est également reconnu de façon indirecte par les CL, par l’intermédiaire de la libération de médiateurs inflammatoires tels que le TNFα et l’IL-1, dont la sécrétion par les cellules épithéliales avoisinantes peut être déclenchée par les pathogènes.
Migration
Les récepteurs des chimiokines jouent un rôle prépondérant dans la colonisation et la migration des cellules de Langerhans vers les ganglions lymphatiques [27] : les cellules de Langerhans de souris déficientes pour le CCR7, par exemple, ne migrent plus [28] ; par ailleurs, des lipides tels que le leucotriène C(4) modulent la réponse aux chimiokines [29]. Les propriétés d’adhérence des CL, notamment via le CD44, les intégrines β1 et la E-cadhérine, sont également modifiées pour permettre leur migration. Enfin, l’expression des métalloprotéinases matricielles MMP-2 et -9 est nécessaire à leur passage vers les vaisseaux lymphatiques [30].
Il faut noter que le processus de migration n’intervient pas obligatoirement en même temps que la maturation fonctionnelle [31]. Très récemment, Kissempfening et ses collaborateurs ont utilisé des souris exprimant une protéine fluorescente sous contrôle du promoteur de la langerine, et ont confirmé l’existence, à l’homéostasie, d’une population résidente de CL dans les organes lymphoïdes secondaires et le thymus [4] ; cependant, ces cellules présentent un phénotype mature identique à celui des CL ayant migré en conditions inflammatoires. Ainsi, à l’homéostasie, les CL seraient activées seulement partiellement (et dites intermédiaires ?), mais suffisamment pour permettre le déclenchement de leur migration vers les ganglions. Dans ce contexte, la sécrétion d’IL-12, cytokine clé dans le déclenchement d’une réponse de type Th1, n’a jamais été observée dans les CL, excepté en présence d’une activation forte couplant un signal CD40L et TLR-dépendant [24, 32]. Par ailleurs, en utilisant une application topique d’un antigène fluorescent, Kissempfening et ses collaborateurs ont montré que l’antigène est transporté plus rapidement par les DC interstitielles du derme que par les CL. Dans cette étude, et de façon très étrange, les CL et les autres DC présentent cet antigène dans des zones riches en lymphocytes T distinctes. La fonctionnalité de cette compartimentation anatomique est encore inconnue.
Conclusions et perspectives
De nombreux pathogènes ont appris comment détourner les systèmes de défense des organismes et infectent efficacement les cellules dendritiques : les virus HIV, EBV (virus d’Epstein-Barr), CMV (cytomégalovirus), HSV (herpès virus), le virus de la rougeole, les bactéries et mycobactéries telles que M. tuberculosis, Y. enterocolitica ou L. monocytogenes, les parasites Leishmania major, Leishmania donovani, Toxoplasma gondi et Plasmodium falciparum en sont des exemples parmi tant d’autres. Les DC cutanées jouent également un rôle essentiel dans le déclenchement des rejets de greffes ou de la maladie du greffon contre l’hôte (GVHD). Dans toutes ces pathologies, il est important de noter qu’une image très partielle émerge quant à la contribution relative des différentes sous-populations de DC dans le déclenchement ou non de la réponse immune. Des études récentes ont mis en avant la nécessité de revisiter le paradigme des cellules de Langerhans, qui veut que ces dernières capturent l’antigène, migrent dans les ganglions drainants et activent les lymphocytes T spécifiques : en effet, l’infection de souris par HSV a comme conséquence l’activation des lymphocytes T spécifiques, mais par une population de DC distincte des CL [33] ; de plus, des travaux très récents ont montré qu’en absence de CL, l’établissement d’une réaction d’hypersensibilité retardée est orchestré par un autre type cellulaire [4, 34]. Ainsi, cette revue s’est concentrée sur la caractérisation des CL et des événements physiologiques qu’elles subissent dans la peau, omettant volontairement de décrire leur rôle dans le contrôle de la réponse immune, d’une part parce que ce rôle est assuré à un stade plus avancé de leur vie, dit mature, et d’autre part parce qu’il demeure très mal connu.
Le défi à venir devrait être de comprendre le rôle joué par les diverses sous-populations cutanées de cellules dendritiques pour réguler l’équilibre entre immunité et tolérance. Si les cellules dendritiques sont de véritables adjuvants naturels, leur manipulation à des fins thérapeutiques n’en est toutefois qu’à ses balbutiements.
Parties annexes
Remerciements
Je souhaite remercier vivement l’Agence nationale pour la recherche contre le Sida, le Sidaction, la Société française de dermatologie, et le Cancéropole Rhône-Alpes pour leur soutien financier et scientifique. Je remercie également le Dr Colette Dezutter-Dambuyant pour ses précieux conseils et son soutien permanent.
Références
- 1. Langerhans P. Uber die Nerven der menschlichen Haut. Virchows Arch Path Anat 1868 ; 44 : 325-37.
- 2. Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med 1973 ; 137 : 1142-62.
- 3. Romani N, Lenz A, Glassel H, et al. Cultured human Langerhans cells resemble lymphoid dendritic cells in phenotype and function. J Invest Dermatol 1989 ; 93 : 600-9.
- 4. Kissenpfennig A, Henri S, Dubois B, et al. Dynamics and function of Langerhans cells in vivo dermal dendritic cells colonize lymph node areas distinct from slower migrating Langerhans cells. Immunity 2005 ; 22 : 643-54.
- 5. Boes M, Cerny J, Massol R, et al. T-cell engagement of dendritic cells rapidly rearranges MHC class II transport. Nature 2002 ; 418 : 983-8.
- 6. Birbeck MS, Breathnach AS, Everall JD. An electron microscope study of basal melanocytes and high-level clear cells (Langerhans cells) in vitiligo. J Invest Dermatol 1961 ; 37: 51-64.
- 7. Valladeau J, Ravel O, Dezutter-Dambuyant C, et al. Langerin, a novel C-type lectin specific to Langerhans cells, is an endocytic receptor that induces the formation of Birbeck granules. Immunity 2000 ; 12 : 71-81.
- 8. Valladeau J, Saeland S. Cutaneous dendritic cells. Semin Immunol 2005 ; 17: 273-83
- 9. Katz SI, Tamaki K, Sachs DH. Epidermal Langerhans cells are derived from cells originating in bone marrow. Nature 1979 ; 282 : 324-6.
- 10. Hacker C, Kirsch RD, Ju XS, et al. Transcriptional profiling identifies Id2 function in dendritic cell development. Nat Immunol 2003 ; 4 : 380-6.
- 11. Caux C, Dezutter-Dambuyant C, Schmitt D, Banchereau J. GM-CSF and TNF-alpha cooperate in the generation of dendritic Langerhans cells. Nature 1992 ; 360 : 258-61.
- 12. Geissmann F, Prost C, Monnet JP, et al. Transforming growth factor beta1, in the presence of granulocyte/macrophage colony-stimulating factor and interleukin 4, induces differentiation of human peripheral blood monocytes into dendritic Langerhans cells. J Exp Med 1998 ; 187 : 961-6.
- 13. Strunk D, Egger C, Leitner G, et al. A skin homing molecule defines the Langerhans cell progenitor in human peripheral blood. J Exp Med 1997 ; 185 : 1131-6.
- 14. Larregina AT, Morelli AE, Spencer LA, et al. Dermal-resident CD14+ cells differentiate into Langerhans cells. Nat Immunol 2001 ; 2 : 1151-8.
- 15. Merad M, Manz MG, Karsunky H, et al. Langerhans cells renew in the skin throughout life under steady-state conditions. Nat Immunol 2002 ; 3 : 1135-41.
- 16. Reis e Sousa C, Stahl PD, Austyn JM. Phagocytosis of antigens by Langerhans cells in vitro. J Exp Med 1993 ; 178 : 509-19.
- 17. Hunger RE, Sieling PA, Ochoa MT, et al. Langerhans cells utilize CD1a and langerin to efficiently present nonpeptide antigens to T cells. J Clin Invest 2004 ; 113 : 701-8.
- 18. Turville SG, Cameron PU, Handley A, et al. Diversity of receptors binding HIV on dendritic cell subsets. Nat Immunol 2002 ; 3 : 975-83.
- 19. Yokota K, Takashima A, Bergstresser PR, Ariizumi K. Identification of a human homologue of the dendritic cell-associated C-type lectin-1, dectin-1. Gene 2001 ; 272 : 51-60.
- 20. de la Salle H, Haegel-Kronenberger H, Bausinger H, et al. Functions of Fc receptors on human dendritic Langerhans cells. Int Rev Immunol 1997 ; 16 : 187-203.
- 21. Stoitzner P, Pfaller K, Stossel H, Romani N. A close-up view of migrating Langerhans cells in the skin. J Invest Dermatol 2002 ; 118 : 117-25.
- 22. Bayerl C, Ueltzhoffer A, Jung EG. Langerhans cells enclosing sunburn cells in acute UV erythema in vivo. Arch Dermatol Res 1999 ; 291 : 303-5.
- 23. Takeda K, Kaisho T, Akira S. Toll-like receptors. Annu Rev Immunol 2003 ; 21: 335-76.
- 24. Peiser M, Wanner R, Kolde G. Human epidermal Langerhans cells differ from monocyte-derived Langerhans cells in CD80 expression and in secretion of IL-12 after CD40 cross-linking. J Leukoc Biol 2004 ; 76 : 616-22.
- 25. Burns RP Jr, Ferbel B, Tomai M, et al. The imidazoquinolines, imiquimod and R-848, induce functional, but not phenotypic, maturation of human epidermal Langerhans’ cells. Clin Immunol 2000 ; 94 : 13-23.
- 26. Albert ML. Death-defying immunity: do apoptotic cells influence antigen processing and presentation? Nat Rev Immunol 2004 ; 4 : 223-31.
- 27. Gunn MD. Chemokine mediated control of dendritic cell migration and function. Semin Immunol 2003 ; 15 : 271-6.
- 28. Ohl L, Mohaupt M, Czeloth N, et al. CCR7 governs skin dendritic cell migration under inflammatory and steady-state conditions. Immunity 2004 ; 21 : 279-88.
- 29. Robbiani DF, Finch RA, Jager D, et al. The leukotriene C(4) transporter MRP1 regulates CCL19 (MIP-3beta, ELC)-dependent mobilization of dendritic cells to lymph nodes. Cell 2000 ; 103 : 757-68.
- 30. Jakob T, Ring J, Udey MC. Multistep navigation of Langerhans/dendritic cells in and out of the skin. J Allergy Clin Immunol 2001 ;108 : 688-96.
- 31. Sporri R, Reis e Sousa C. Inflammatory mediators are insufficient for full dendritic cell activation and promote expansion of CD4+ T cell populations lacking helper function. Nat Immunol 2005 ; 6 : 163-70.
- 32. Schulz O, Edwards AD, Schito M, et al. CD40 triggering of heterodimeric IL-12 p70 production by dendritic cells in vivo requires a microbial priming signal. Immunity 2000 ; 13 : 453-62.
- 33. Allan RS, Smith CM, Belz GT, et al. Epidermal viral immunity induced by CD8alpha+ dendritic cells but not by Langerhans cells. Science 2003 ; 301 : 1925-8.
- 34. Bennett CL, van Rijn E, Jung S, et al. Inducible ablation of mouse Langerhans cells diminishes but fails to abrogate contact hypersensitivity. J Cell Biol 2005 ; 169 : 569-76.
Liste des figures
Figure 1
Cycle de vie des cellules de Langerhans.
Les cellules de Langerhans (CL) procèdent, au cours de leur maturation, à des changements phénotypiques et fonctionnels. Elles se transforment en cellules dendritiques (DC) dites matures, ayant les caractéristiques des DC retrouvées dans les organes lymphoïdes secondaires : de ces constatations est né le concept de cycle de vie des CL. Ainsi, suivant l’état de l’épithélium, des précurseurs hématopoïétiques ou des monocytes colonisent les épithéliums, où ils se différencient en CL capables de reconnaître et d’internaliser les pathogènes. Un signal de danger entraîne alors la migration des CL vers les organes lymphoïdes secondaires, où elles sont appelées cellules dendritiques interdigitées matures. Ces cellules sont capables de présenter des complexes CMH-Ag (complexe majeur d’histocompatibilité-antigène) à des lymphocytes T spécifiques. Au cours de leur migration dans la lymphe, les DC sont nommées cellules voilées.
Figure 2
Réseau de cellules de Langerhans au sein d’un feuillet de l’épiderme.
À partir de peau humaine normale, l’action d’enzymes telles que la trypsine permet de dissocier le derme de l’épiderme : ce feuillet épidermique peut alors être marqué par différents procédés enzymatiques (comme, ici, l’ATPase) ou immunohistologiques, révélant un réseau dense de cellules de Langerhans en microscopie optique (Cliché : Dr Colette Dezutter-Dambuyant).
Figure 3
Granules de Birbeck au sein d’une cellule de Langerhans épidermique.
Les cellules de Langerhans isolées de la peau humaine normale par l’action de la trypsine sont purifiées par centrifugation sur un coussin de Ficoll. Après avoir été fixées et coupées, les cellules de Langerhans sont observées à l’aide d’un microscope électronique : des granules de Birbeck caractéristiques, « en raquette de tennis », sont visualisés (Cliché : Dr Colette Dezutter-Dambuyant).
Figure 4
Récepteurs potentiellement impliqués dans la reconnaissance et la capture des pathogènes par les cellules de Langerhans.
Différentes familles de récepteurs exprimés par les cellules de Langerhans sont capables de reconnaître ou d’internaliser les pathogènes. Les lectines de type C, dépendantes du calcium, reconnaissent des motifs oligo-saccharidiques présents à la surface des pathogènes. Les récepteurs des fragments Fc des Ig et les récepteurs du complément (CR) permettent, quant à eux, la reconnaissance de pathogènes ou de corps apoptotiques opsonisés. Enfin, des lectines de type I (Dec205) ou II (Dectine 1), certains récepteurs des fragments Fc des Ig, mais surtout les TLR (Toll-like receptors), transmettent ensuite un signal de danger aux cellules de Langerhans, induisant leur maturation phénotypique et fonctionnelle.