Corps de l’article
De nombreuses bactéries à Gram négatif sont équipées d’un système de sécrétion de type III (TTSS, type III secretion system), visible au microscope électronique [1] et capable d’injecter des protéines dans les cellules humaines. C’est le cas de Shigella flexneri, l’agent de la dysenterie bacillaire qui tue chaque année environ 500 000 enfants dans le monde, sa résistance aux antibiotiques ne cessant d’augmenter.
Les shigelloses
L’agression de la muqueuse intestinale provoque une réaction inflammatoire intense avec destruction de l’épithélium intestinal, formation d’abcès dans la muqueuse, oedème sous-muqueux, afflux de polynucléaires et production de peptides antibactériens contre lesquels Shigella se protège grâce à un revêtement, le lipopolysaccharide (LPS), constitué, entre autres, d’unités répétées d’un polysaccharide, l’antigène O [2].
Cependant, ce manteau moléculaire recouvre l’appareil de sécrétion TTSS et l’empêche d’entrer en contact avec les cellules du tractus intestinal. Dans ces conditions, comment Shigella réussit-elle à attaquer ? C’est cette stratégie quasi militaire que viennent d’élucider les équipes de Philippe Sansonetti (Institut Pasteur, Paris, France) et de Christoph M. Tang (Imperial College, Londres, Royaume-Uni) [3].
À partir d’un modèle de shigellose expérimentale sur iléon de lapin, des mutants de S. flexneri atténués, ayant perdu des gènes impliqués dans la biosynthèse du LPS, ont été sélectionnés.
Glycosylation de l’antigène O
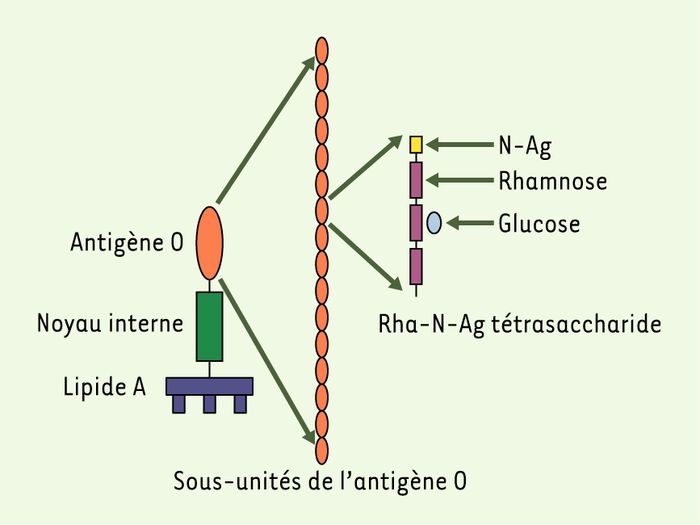
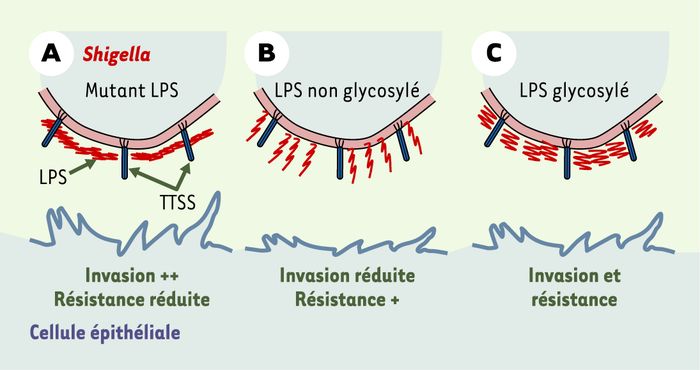
Rappelons que le LPS comprend trois régions : une base lipidique, un noyau interne et une série de sous-unités formant l’antigène O. Elles sont constituées de tétrasaccharides modifiés par l’ajout de glucose et/ou d’acétate, selon le sérotype (Figure 1). Parmi les variants atténués, certains étaient incapables de synthétiser ou de fixer l’antigène O et résistaient donc beaucoup moins aux peptides antibactériens in vivo. Mais d’autres avaient un antigène O normal en nombre de sous-unités ; ils avaient toutefois perdu la capacité de glycosylation (par perte des gènes de l’opéron Gtr). Quel que soit le sérotype d’origine, ils étaient moins invasifs et provoquaient une réponse inflammatoire nettement plus faible, suggérant une insuffisance du système TTSS. Effectivement, un anticorps monoclonal Ipa B (invasion plasmid antigen), capable de reconnaître l’extrémité de l’injectisome montrait que celle-ci était peu présente à la surface de la bactérie chez les mutants défectifs à la glycosylation. Après avoir envisagé un certain nombre d’hypothèses et effectué des expériences de restauration de l’infectiosité, les auteurs ont pu trouver l’explication et éclairer ainsi l’ingénieuse façon qui permet à la fois à Shigella d’attaquer et de se protéger. La glycosylation entraîne une modification de conformation des sous-unités de l’antigène O. Elle réduit de moitié l’épaisseur de la couche de LPS, ce qui augmente la capacité de « dégainer » l’injectisome tout en conservant une protection contre les agents antibactériens (Figure 2). Certes les souches dépourvues de LPS sont très invasives in vitro grâce à la capacité de l’injectisome d’accéder directement au contact des cellules, mais malheureusement pour elles, in vivo, elles sont incapables de résister aux facteurs antibactériens.
Figure 1
Structure du lipopolysaccharide (LPS).
Figure 2
Variation des capacités d’invasion et de résistance aux agents antibactériens de Shigella en fonction de l’état du LPS.
A. Mutant avec anomalie du LPS. B. LPS non glycosylé. C. LPS glycosylé permettant à la bactérie normale à la fois d’envahir et de résister aux agents antimicrobiens.
Les auteurs ont pu montrer que ce mécanisme est visible au microscope électronique après cryofixation : les aiguilles du TTSS se voient dans la couche de 35 nm environ à la surface de la bactérie (souches sauvages), tandis qu’elles ne sont pas perceptibles dans la couche moins compacte et plus épaisse (70 nm) à la surface des mutants défectifs à la glycosylation.
Et les autres entérobactéries
À la lumière de cet élégant travail, il convient à présent de réanalyser le fonctionnement des autres entérobactéries. On sait que l’aiguille de Salmonella est plus longue que celle de Shigella.
Escherichia coli possède une protéine (Esp A) qui se polymérise pour former une extension et allonger l’aiguille de l’injectisome.
Chez Yersinia (y compris Yersinia pestis), de la longueur de l’aiguille dépend la translocation de protéines appelées Yop, capables d’activer la caspase et d’induire l’apoptose des macrophages. Une récente publication montre que la longueur de l’aiguille est corrélée à l’adhésine Yad A [4]. Celle-ci, en forme de sucette, repose sur un cône de longueur variable. Si elle s’allonge, l’efficacité de l’injectisome diminue. D’une façon plus générale, l’aiguille doit avoir une longueur minimale suffisante pour être fonctionnelle [5].
Conclusions
L’efficacité d’un vaccin dépend de la connaissance des sérotypes de Shigella. On conçoit donc que la compréhension des stratégies bactériennes et des signatures moléculaires soit essentielle pour améliorer l’efficacité des vaccins. Et l’on ne peut s’empêcher d’admirer l’ingéniosité des bactéries.
Parties annexes
Références
- 1. Tran Van Nhieu G, Cossart P. Détournement de fonctions cellulaires clés par les bactéries pathogènes. Med Sci(Paris) 2001 ; 17 : 701-11.
- 2. Finley BB, Cossard P. Exploitation of mammalian host cell functions by bacterial pathogens. Science 1997 ; 276 : 718-25.
- 3. West NP, Sansonetti P, Mounier J, et al. Optimization of virulence functions through glucosylation of Shigella LPS. Science 2005 ; 307 : 1313-7.
- 4. Motta LJ, Journet L, Sorg I, et al. Bacterial insectisomes : needle length does matter. Science 2005 ; 307 : 1278.
- 5. Normark S, Nilsson C, Henriques Normark B. A pathogen attacks while keeping-up defense. Science 2005 ; 307 : 1211-2.
Liste des figures
Figure 1
Structure du lipopolysaccharide (LPS).
Figure 2
Variation des capacités d’invasion et de résistance aux agents antibactériens de Shigella en fonction de l’état du LPS.