Corps de l’article
L’endocytose est un processus fondamental par lequel des composés extracellulaires ainsi que des constituants membranaires sont internalisés, puis acheminés vers différents compartiments intracellulaires. Le recyclage d’une partie des éléments endocytosés (Figure 1) joue un rôle clé dans de nombreux événements cellulaires comme l’incorporation de nutriments, le maintien de la polarité cellulaire, la mobilité cellulaire ou encore la transduction du signal [1, 2]. Après internalisation, protéines et lipides membranaires sont, dans un premier temps, transportés vers les endosomes précoces ou les ensodomes de tri. Dans ce compartiment, s’opère le tri entre les molécules qui seront dirigées vers les endosomes tardifs, puis éventuellement vers les lysosomes pour y être dégradés, et celles qui seront recyclées vers la membrane plasmique, soit directement, soit après avoir transité par les endosomes de recyclage (ERC, endocytic recycling compartment). Les compartiments impliqués dans cette voie sont extrêmement dynamiques. Les chemins suivis par les molécules endocytosées sont nombreux, complexes et impliquent l’action coordonnée d’un grand nombre de molécules assurant leur tri et leur adressage précis aux différents compartiments intracellulaires [3].
Figure 1
La voie de recyclage.
Les vésicules d’endocytose formées après invagination de la membrane plasmique sont dirigées vers les endosomes de tri (ou endosomes précoces) avec lesquels elles fusionnent. Dans ce compartiment s’effectue un tri sélectif entre les molécules qui seront dégradées et celles qui seront recyclées vers la membrane plasmique. Ces dernières peuvent être recyclées directement depuis les endosomes de tri ou transiter via les endosomes de recyclage (ERC, endocytic recycling compartment). Les inhibiteurs des phosphatidyl-inositol-3-kinases tels que la wortmannine et le LY294002 inhibent le recyclage depuis les endosomes de tri. La surexpression de la Rififyline affecte le recyclage depuis l’ERC.
À l’heure actuelle, nos connaissances sur les mécanismes de régulation du trafic le long de la voie de recyclage sont assez limitées [4]. Une première raison à cela est que seul un petit nombre de molécules localisées dans les endosomes de recyclage a été caractérisé à ce jour ; parmi celles-ci se trouve la protéine Rab11 qui est impliquée dans le contrôle du trafic membranaire à travers l’ERC [5]. Une seconde raison est qu’il existe très peu d’outils agissant spécifiquement sur la voie de recyclage et permettant ainsi sa caractérisation détaillée.
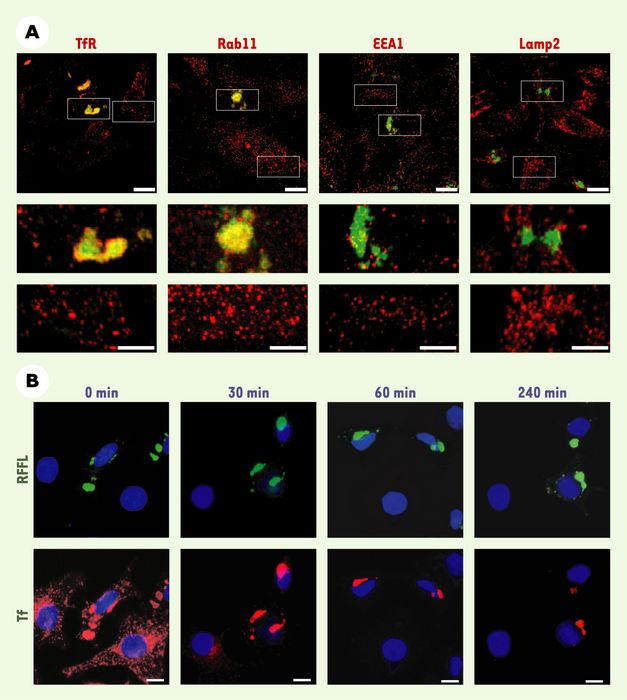
Récemment, une nouvelle piste a été ouverte par l’étude d’un gène appelé Rififyline [6]. Celui-ci est exprimé dans de nombreux tissus et code pour une protéine de 40 kDa présentant un domaine à doigts de zinc à chaque extrémité. Dans les cellules en culture, sa surexpression provoque la condensation, dans la région périnucléaire, de tubules et de vésicules d’endocytose présentant à leur membrane la transferrine, ainsi que son récepteur. La distribution de marqueurs des différents compartiments d’endocytose montre que les altérations morphologiques induites par la Rififyline sont spécifiques de l’ERC (Figure 2A). Par ailleurs, la surexpression de Rififyline retarde fortement le recyclage vers la membrane plasmique de la transferrine internalisée dans l’ERC (Figure 2B). Cela se traduit par la réduction de moitié du nombre de récepteurs de la transferrine à la surface des cellules et par l’inhibition d’environ 40 % de la quantité de transferrine recyclée après 30 minutes.
Figure 2
La surexpression de la Rififyline affecte la morphologie et la fonction des endosomes de recyclage (ERC).
A. La surexpression de la Rififyline provoque l’agrégation des endosomes de recyclage contenant le récepteur de la transferrine (TfR) et la petite GTPase Rab11. Les distributions cellulaires des protéines EEA1, un marqueur des endosomes de tri, et Lamp2, un marqueur des endosomes tardifs (voie de dégradation), ne sont pas affectées par la surexpression de la Rififyline. B. Des cellules surexprimant ou non la Rififyline (RFFL, en vert) ont été incubées en présence de transferrine marquée (Tf, en rouge). Après internalisation (0 min), une « chasse » de 4 heures a été effectuée. Après 30 minutes, la majorité des cellules nont transfectées ont recyclé la transferrine, alors que, dans les cellules surexprimant la Rififyline, une quantité importante de transferrine est toujours détectée dans l’ERC après 4 heures de « chasse ».
L’étude de mutants de délétion a permis d’identifier le domaine protéique essentiel à l’action de la Rififyline sur l’ERC. Dans sa partie carboxy-terminale, la Rififyline possède un domaine RING, motif présent dans plusieurs centaines de protéines humaines et impliqué dans la réaction d’ubiquitinylation de certaines protéines [7]. Le domaine RING de la Rififyline n’est toutefois pas impliqué dans l’inhibition du recyclage. Dans sa partie amino-terminale, la Rififyline possède un domaine appelé FYVE-like, car apparenté au domaine FYVE (acronyme des protéines Fab1p, YOTB, Vac1p et EEA1). Présent dans une trentaine de protéines humaines, ce dernier est un domaine à doigt de zinc d’environ 70 acides aminés, qui se lie spécifiquement au phosphatidyl-inositol-3-phosphate (PI3P) [8]. Une concentration locale accrue de PI3P est responsable du recrutement, sur la membrane des endosomes de tri, de plusieurs protéines à domaine FYVE régulatrices de l’endocytose. De façon similaire, le domaine FYVE-like de la Rififyline constitue un domaine d’adressage aux membranes de l’ERC. En effet, fusionné à la green fluorescent protein, il permet le ciblage de la protéine de fusion spécifiquement à l’ERC. De plus, la protéine Rififyline dépourvue de domaine FYVE-like se distribue dans le cytosol et la surexpression de la protéine tronquée est sans effet sur l’ERC. Par ailleurs, il a été montré, chez le rat, que la Rififyline est modifiée par l’ajout d’un groupement palmitate dans sa partie amino-terminale [9]. Cette modification post-traductionnelle participe probablement à la stabilisation de l’interaction de la Rififyline avec les membranes de l’ERC.
Le site principal d’interaction du domaine FYVE avec le PI3P est une poche de résidus hydrophobes [8]. Plusieurs résidus critiques de cette poche ne sont pas conservés dans le domaine FYVE-like de la Rififyline, suggérant que ce dernier ne se lie pas au PI3P. Cela a été confirmé par l’observation selon laquelle, contrairement aux protéines possédant un domaine FYVE bona fide, la distribution de la Rififyline n’est pas modifiée lors de la déplétion du PIP3 induite par le LY294002. L’identification du ligand du domaine FYVE-like sera déterminante pour la compréhension du mécanisme d’action de la Rififyline.
Un autre moyen d’inhiber la voie de recyclage est de bloquer l’activité des phosphatidyl-inositol-3-kinases (PI3-kinases) par le LY294002 [10]. Il est à noter que les effets inhibiteurs de la surexpression de la Rififyline et du traitement par le LY294002 sur le recyclage de la transferrine s’additionnent, suggérant que la Rififyline et les inhibiteurs des PI3-kinases agissent sur des voies différentes. Ces derniers agiraient sur le recyclage à partir des endosomes de tri, notamment en diminuant le recrutement des protéines régulatrices interagissant avec le PI3P, alors que la Rififyline agirait sur les voies de recyclage à partir de l’ERC (Figure 1). Ainsi, la surexpression de la Rififyline agit spécifiquement sur l’un des compartiments les moins bien caractérisés de la voie. À l’avenir, son utilisation permettra certainement de mieux comprendre les mécanismes impliqués dans le trafic des protéines membranaires le long de voie de recyclage.
Parties annexes
Références
- 1. Mukherjee S, Ghosh RN, Maxfield FR. Endocytosis. Physiol Rev 1997 ; 77 : 759-803.
- 2. Piddini E, Vincent JP. Modulation of developmental signals by endocytosis: different means and many ends. Curr Opin Cell Biol 2003 ; 15 : 474-81.
- 3. Gruenberg J. The endocytic pathway : a mosaic of domains. Nat Rev Mol Cell Biol 2001 ; 2 : 721-30.
- 4. Maxfield FR, McGraw TE. Endocytic recycling. Nat Rev Mol Cell Biol 2004 ; 5 : 121-32.
- 5. Ullrich O, Reinsch S, Urbe S, et al. Rab11 regulates recycling through the pericentriolar recycling endosome. J Cell Biol 1996 ; 135 : 913-24.
- 6. Coumailleau F, Das V, Alcover A, et al. Over-expression of rififylin, a new RING finger and FYVE-like domain-containing protein, inhibits recycling from the endocytic recycling compartment. Mol Biol Cell 2004 ; 15 : 4444-56.
- 7. Weissman AM. Themes and variations on ubiquitynation. Nat Rev Mol Cell Biol 2001 ; 2 : 169-78.
- 8. Stenmark H, Aasland R, Driscoll PC. The phosphatidylinositol 3-phosphate-binding FYVE finger. FEBS Lett 2002 ; 513 : 77-84.
- 9. Araki K, Kawamura M, Suzuki T, et al. A palmitoylated RING finger ubiquitin ligase and its homologue in the brain membranes. J Neurochem 2003 ; 86 : 749-62.
- 10. van Dam EM, Ten Broeke T, Jansen K, et al. Endocytosed transferrin receptors recycle via distinct dynamin and phosphatidylinositol 3-kinase-dependent pathways. J Biol Chem 2002 ; 277 : 48876-83.
Liste des figures
Figure 1
La voie de recyclage.
Les vésicules d’endocytose formées après invagination de la membrane plasmique sont dirigées vers les endosomes de tri (ou endosomes précoces) avec lesquels elles fusionnent. Dans ce compartiment s’effectue un tri sélectif entre les molécules qui seront dégradées et celles qui seront recyclées vers la membrane plasmique. Ces dernières peuvent être recyclées directement depuis les endosomes de tri ou transiter via les endosomes de recyclage (ERC, endocytic recycling compartment). Les inhibiteurs des phosphatidyl-inositol-3-kinases tels que la wortmannine et le LY294002 inhibent le recyclage depuis les endosomes de tri. La surexpression de la Rififyline affecte le recyclage depuis l’ERC.
Figure 2
La surexpression de la Rififyline affecte la morphologie et la fonction des endosomes de recyclage (ERC).
A. La surexpression de la Rififyline provoque l’agrégation des endosomes de recyclage contenant le récepteur de la transferrine (TfR) et la petite GTPase Rab11. Les distributions cellulaires des protéines EEA1, un marqueur des endosomes de tri, et Lamp2, un marqueur des endosomes tardifs (voie de dégradation), ne sont pas affectées par la surexpression de la Rififyline. B. Des cellules surexprimant ou non la Rififyline (RFFL, en vert) ont été incubées en présence de transferrine marquée (Tf, en rouge). Après internalisation (0 min), une « chasse » de 4 heures a été effectuée. Après 30 minutes, la majorité des cellules nont transfectées ont recyclé la transferrine, alors que, dans les cellules surexprimant la Rififyline, une quantité importante de transferrine est toujours détectée dans l’ERC après 4 heures de « chasse ».