Résumés
Résumé
La translocase des nucléotides adényliques (ANT) réalise l’échange ATP/ADP entre le cytoplasme et la mitochondrie. Les isoformes ANT1 (musculaire) et ANT3 (ubiquitaire) exportent l’ATP produit par les phosphorylations oxydatives mitochondriales. L’isoforme ANT2 est spécifiquement exprimée dans les cellules en prolifération, dotées d’un métabolisme majoritairement glycolytique. ANT2 est ainsi associée à la dédifférenciation cellulaire, caractéristique majeure de la cancérogenèse. Son rôle serait d’importer dans la mitochondrie l’ATP produit par la glycolyse, énergie indispensable à différentes fonctions intramitochondriales, notamment au maintien du gradient de potentiel membranaire qui conditionne la survie et la prolifération cellulaires. Le mécanisme de régénération de ce gradient pourrait impliquer trois protéines majeures : l’hexokinase II, l’ANT2 et la partie F1 de l’ATP synthétase mitochondriale. Ainsi, l’ANT2, grâce à son rôle déterminant dans la croissance de la cellule tumorale, pourrait être choisie comme cible dans une stratégie anticancéreuse.
Summary
In the mitochondrial internal membrane, the adenine nucleotide translocator (ANT) carries out the ATP/ADP exchange between cytoplasm and mitochondrial matrix. Three isoforms with different kinetic properties are encoded from three different genes in Human : the muscle specific ANT1 and the ubiquitary ANT3 isoforms export ATP produced by mitochondrial oxidative phosphorylation (OXPHOS). The ANT2 isoform is specifically expressed in proliferative cells with a predominant glycolytic metabolism and is associated with cellular undifferentiation which is a major characteristic in carcinogenesis. Its role would be to import into mitochondria ATP produced by the glycolysis, energy essential to several intramitochondrial functions, particularly to maintenance of the membrne potential (ΔΨm), conditioning cellular survival and proliferation. The mechanism of regeneration of this ΔΨm gradient would involve at least three major proteins : the hexokinase II isoform, the ANT2 isoform and the F1 part of the mitochondrial ATP synthase complex. Taking into account this major role of ANT2 in cell proliferation and the very low expression of this isoform in differentiated tissues, this protein or its transcript could be chosen as a target for an anticancer strategy. Furthermore, previous studies showed that molecules of the cisplatin family, used as chemotherapeutic agents, led to the destruction of the mitochondrial membrane potential and thus to cell death. Does the anticancer effect of these molecules result, at least partially, from this mitochondrial aggression ? If it is the case, the ANT2 isoform, mainly involved in the generation of this potential by its ATP4–/ADP3– exchange, could be considered as a more specific targeting by an RNA interference approach.
Corps de l’article
Dans les premières étapes de l’évolution, une structure intracellulaire d’origine bactérienne, l’ancêtre de la mitochondrie, s’est mise en symbiose avec d’autres cellules primitives issues du milieu aqueux originel et leur a permis d’affronter l’oxygène atmosphérique. Véritable réacteur miniature, elle nous permet maintenant d’utiliser cet oxygène pour la production de notre énergie sous forme d’ATP. Cette production d’ATP est réalisée par une chaîne d’enzymes mitochondriales : les complexes des phosphorylations oxydatives (OXPHOS) qui captent l’énergie issue de la dégradation des molécules organiques cellulaires en CO2 et H2O et la transforment en ATP. Cet ATP est nécessaire au développement de l’organisme et à toute fonction cellulaire. Cependant, les cellules soumises à un environnement partiellement ou strictement dépourvu d’oxygène sont orientées vers un métabolisme principalement glycolytique. Or, de nombreuses voies métaboliques font intervenir une étape mitochondriale, ce qui rend indispensable - dans ces cellules où la production mitochondriale d’ATP est inactive - l’importation d’ATP glycolytique dans la mitochondrie. Qui plus est, cet apport doit être d’autant plus important que la cinétique de croissance cellulaire est rapide, comme c’est le cas pour les cellules embryonnaires et les cellules tumorales.
Translocase des nucléotides adényliques (ANT) : fonction et organisation
Fonction : dernière étape de production d’ATP par la mitochondrie
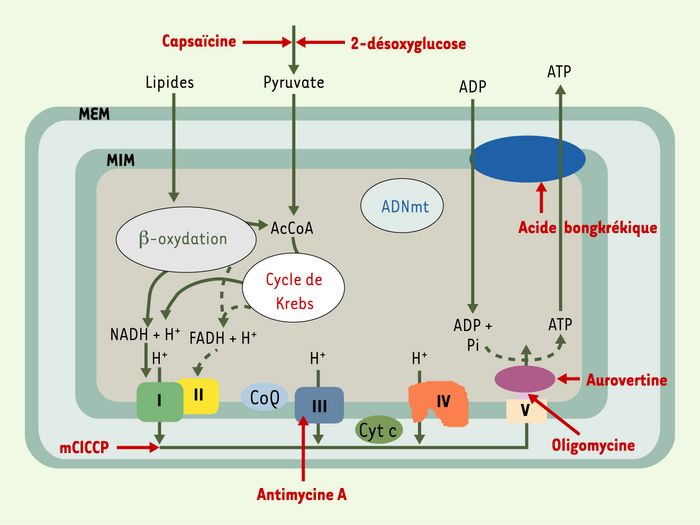
L’ATP mitochondrial produit par les phosphorylations oxydatives (Figure 1) est pris en charge par le transporteur des nucléotides adényliques, l’ANT. Également désignée sous le terme générique d’ADP/ATP carrier (AAC), l’ANT est une protéine codée par le génome nucléaire et insérée dans la membrane interne de la mitochondrie. Elle permet l’échange des nucléotides adényliques ATP et ADP entre l’espace matriciel de la mitochondrie et le cytoplasme. Une telle fonction est primordiale, puisque l’ANT serait la seule protéine de la membrane interne capable de véhiculer cette énergie. La cristallisation de cette protéine très hydrophobe vient d’être réalisée par un groupe français [2], ce qui a permis de préciser son mécanisme d’action.
Figure 1
Synthèse de l’ATP par les phosphorylations oxydatives mitochondriales.
Cette synthèse de l’ATP fait intervenir deux réactions successives : l’oxydation par la chaîne respiratoire des substrats provenant du métabolisme des lipides et des sucres, ce qui conduit à une consommation d’oxygène et à une éjection de protons à l’origine du gradient de potentiel transmembranaire mitochondrial ΔΨm, et à la phosphorylation de l’ADP mitochondrial en ATP grâce à ce gradient de protons. Ces réactions sont réalisées par cinq complexes multi-enzymatiques intégrés dans la membrane interne de la mitochondrie, assemblés à partir de sous-unités codées pour leur majorité (87 caractérisées actuellement) par le génome nucléaire, et pour 13 d’entre elles par le génome mitochondrial. Les complexes I, II, III et IV assurent le transfert d’électrons le long de la chaîne respiratoire [1], le complexe V étant chargé de la synthèse de l’ATP. Complexes I : NADH-ubiquinone oxydoréductase ; II : succinate ubiquinone oxydoréductase ; III : ubiquinol cytochrome c oxydoréductase ; IV : cytochrome c oxydase ; V : ATP synthétase ; ANT : adénine nucléotide translocase ; NADH,H+ : nicotinamide-adénine-dinucléotide ; FADH2 : flavine-adénine-dinucléotide ; CoQ : ubiquinone ; cyt c : cytochrome c ; AcCoA : acétyl coenzyme A ; ADNmt : ADN mitochondrial ; MEM : membrane externe mitochondriale ; MIM : membrane interne mitochondriale. En rouge : site d’action de différents inhibiteurs des phosphorylations oxydatives et de la glycolyse (voir Figure 4).
Un gène pour chacune des trois isoformes de la translocase ATP/ADP humaine
L’importance de cette protéine ANT est soulignée par le fait qu’il existe, de la levure à l’homme, trois isoformes présentant des cinétiques différentes, codées par trois gènes indépendants, ce qui permet d’adapter la production de l’énergie cellulaire aux paramètres métaboliques liés à l’environnement de la cellule et aux étapes de son cycle de division (Tableau I) [3]. Par exemple, les propriétés cinétiques de l’isoforme ANT1 (spécifique du tissu musculaire chez l’homme) favoriseraient un transfert rapide et massif d’ATP nécessaire à la contraction musculaire.
Tableau I
Nomenclature et expression des gènes ANT chez l’homme et dans différentes espèces.
Les séquences peptidiques de ces trois isoformes, très voisines (96 % d’identité), ne diffèrent que par quelques acides aminés probablement impliqués dans les interactions avec l’ATP ou l’ADP. Chez les rongeurs, le gène Ant3 aurait été perdu au cours de l’évolution. Le rôle d’ANT3, protéine ubiquitaire chez l’homme, c’est-à-dire ayant une expression dans tous les types cellulaires, pourrait être tenu chez les rongeurs par Ant1. Il est probable que leur physiologie, à la différence de celle de l’homme, ne nécessite pas l’existence de deux isoformes (ANT1 et ANT3) ayant des cinétiques différentes. Cette hypothèse semble renforcée par la disparition, chez les rongeurs, d’une séquence de régulation du promoteur du gène ANT1, le motif OXBOX [4], à l’origine de l’expression spécifiquement musculaire de cette isoforme.
La dernière isoforme, ANT2, n’est pas - ou seulement très peu - exprimée dans les tissus humains, à l’exception des cellules en prolifération à métabolisme principalement glycolytique, comme les cellules embryonnaires ou transformées. Nous avions suggéré que le rôle de cette isoforme ANT2 serait d’assurer un transport inverse de celui des deux autres isoformes, c’est-à-dire le transport d’ATP glycolytique vers la matrice mitochondriale (Figure 2) [3]. Nous avons identifié une séquence de régulation spécifique dans la zone promotrice de son gène : le motif GRBOX (glycolysis regulated box) [5]. Une séquence similaire est présente dans le gène correspondant de levure, AAC3, codant pour une isoforme exprimée spécifiquement en conditions d’anaérobiose. D’autres auteurs ont montré que, dans des cellules en arrêt de croissance, l’ANT2 serait également réprimée par un facteur de transcription de la famille NF1 (nuclear factor 1) [6].
Figure 2
Création et maintien du potentiel de membrane mitochondrial dans diverses conditions.
A. En condition aérobie, les phosphorylations oxydatives (OXPHOS) sont responsables de la création du potentiel de membrane mitochondrial, ΔΨm, utilisé comme force protomotrice par l’ATP synthétase pour la synthèse d’ATP à partir d’ADP et de Pi (phosphate inorganique). B. Aucune synthèse d’ATP par l’ATP synthétase ne peut avoir lieu dans la cellule ρ°. En revanche, la partie F1 de l’ATP synthétase hydrolyse l’ATP importé par l’ANT2. Cet échange ATP4-/ ADP3- électrogénique participe ainsi au maintien du potentiel de membrane mitochondrial. PIC : transporteur du phosphate ; MEM : membrane externe mitochondriale ; MIM : membrane interne mitochondriale ; VDAC : voltage dependant anion channel ; OXPHOS : complexes responsables des phosphorylations oxydatives.
La présence de deux isoformes, l’ANT2 « glycolytique » et l’ANT3 « oxydative », dans les cellules en division rapide était a priori surprenante, puisque ces deux isoformes ont une cinétique de transport inverse. Cependant, cette présence simultanée n’est démontrée qu’à un niveau transcriptionnel : aucun anticorps vraiment spécifique de chaque isoforme n’a pu être produit. Un élément de réponse peut être fourni par les travaux récents de cristallisation de l’ANT1 de coeur de boeuf [2] : ces résultats supposent la présence quasi exclusive de la protéine ANT1 dans le muscle cardiaque, alors que le messager de l’ANT3 avait été précédemment identifié dans ce tissu par plusieurs équipes. L’explication la plus plausible serait que l’afflux d’un messager induit (ANT1 dans la cellule musculaire, ANT2 dans la cellule en division) entraînerait une compétition entre ces messagers (ou les protéines correspondantes) et le messager de l’isoforme ubiquitaire. Au cours des divisions cellulaires, cette compétition tournerait peu à peu en faveur des isoformes induites.
Mise en évidence de la dualité de fonction de l’ANT au cours de l’évolution
Des travaux récents réalisés sur des organismes tels que les plastides (Rickettsies) montrent que ces organismes primitifs intracellulaires, ancêtres de la mitochondrie, sont capables d’importer l’énergie d’origine glycolytique de la cellule hôte, mais aussi d’utiliser l’ATP produit grâce à leurs propres phosphorylations oxydatives [10].
Ainsi, dès le début de l’évolution, une stratégie coopérative s’est instaurée entre endosymbionte (pré-mitochondrie) et hôte : une faible teneur en oxygène favorise une production d’ATP glycolytique par la cellule hôte et un transporteur ATP/ADP doit importer cet ATP dans cette pré-mitochondrie afin d’assurer sa survie. C’est pourquoi deux isoformes différentes, au moins, étaient requises : l’une disposant de propriétés cinétiques permettant l’exportation de l’ATP produit par la pré-mitochondrie, l’autre, avec une polarité inverse, capable d’importer l’ATP glycolytique de la cellule hôte.
Cette dualité apparaît ensuite tout au long de l’évolution : chez S. cerevisiae par exemple, en condition d’aérobiose, un triple mutant délété des trois gènes AAC peut partiellement croître en aérobiose (condition où l’ATP est synthétisé simultanément par la glycolyse et par la mitochondrie). En revanche, un simple mutant AAC3 (homologue d’ANT2) est incapable de se développer en condition d’anaérobiose (aucune énergie ne peut être produite ou importée dans la mitochondrie).
Importation de l’ATP glycolytique dans la matrice mitochondriale de la cellule cancéreuse
Dans la cellule différenciée, les réactions OXPHOS conduisent à une faible vitesse de production d’ATP (catabolisme complet des substrats jusqu’à CO2 + H2O), mais avec un fort rendement (32 ATP par glucose). Dans la cellule cancéreuse, la glycolyse seule conduit au contraire à une synthèse rapide d’ATP, mais avec un rendement très faible (2 ATP par glucose), conséquence d’une dégradation incomplète des métabolites. Ces intermédiaires des voies métaboliques, et plus particulièrement le lactate, sont alors disponibles pour un anabolisme très actif, et favorisent ainsi la multiplication cellulaire. Cette particularité a été décrite il y a plus d’un demi-siècle sous le nom d’effet « Warburg », qui caractérise cette propension de la cellule à proliférer plus rapidement avec un métabolisme glycolytique.
Plusieurs travaux nous conduisent à proposer un mécanisme précis d’importation de cet ATP glycolytique dans la mitochondrie (Figure 3). Ce mécanisme ferait intervenir trois protéines principales : l’hexokinase II (HK II), l’ANT2 et l’ATP synthétase β (sous-unité du complexe ATP synthétase), protéines dont l’expression est induite au cours de la cancérogenèse.
Figure 3
Modèle d’importation d’ATP et d’inhibition des OXPHOS dans la cellule tumorale.
L’isoforme II mitochondriale de l’hexokinase (HK II) fournirait l’ATP à partir de glucose 6-P (G-6P) produit par l’hexokinase cytosolique (HK) et d’ADP. L’ATP, importé dans la mitochondrie via le VDAC puis par l’ANT2, participe alors au maintien du potentiel de membrane mitochondrial (ΔΨm) et aux activités enzymatiques intramitochondriales. L’ATP pourrait également participer à l’inhibition des OXPHOS par fixation de l’ATP au niveau du complexe IV (flèche rouge) [25] (abréviations, voir légende de la Figure 2).
Dans la cellule cancéreuse, HK II, isoforme de l’hexokinase spécifiquement associée à la membrane externe mitochondriale, verrait son expression contrôlée par plusieurs inducteurs, dont le glucose, la protéine p53 et le facteur HIF-1α (hypoxia-inducible factor-1α) [11, 12]. Cette isoforme HK II pourrait être spécifiquement associée à la mitochondrie afin de favoriser l’importation d’ATP glycolytique nécessaire au maintien du potentiel de membrane et aux activités enzymatiques intramitochondriales. Sur le plan biochimique, HK II catalyse la réaction exergonique : glucose + ATP → glucose-6P + ADP. Lors d’un arrêt de production mitochondriale d’ATP, les concentrations en ATP et en ADP conduiraient à une ΔG nulle, et ainsi à une réaction inverse. Ainsi, le glucose-6P produit en grande quantité par l’hexokinase cytosolique deviendrait le substrat de HK II, ce qui permettrait une production d’ATP au contact de la mitochondrie et une libération de glucose. L’ATP4- serait ensuite directement pris en charge par l’isoforme ANT2 et importé dans la matrice mitochondriale. Cette énergie pourrait alors alimenter des fonctions intramitochondriales indispensables à la survie cellulaire, et plus particulièrement le maintien du gradient de potentiel membranaire ΔΨm. Ce potentiel (2 charges négatives par ATP importé) serait produit par la déphosphorylation de l’ATP4- en ADP3- par la partie F1 de l’ATP synthétase mitochondriale, puis par l’éjection de cet ADP3- (par l’ANT2) et d’un proton (par l’ATP synthétase).
Notre étude récente par cytométrie de flux de l’évolution de ce potentiel ΔΨm sous l’effet de différents inhibiteurs des phosphorylations oxydatives et de l’ANT (Figure 4) confirme cette hypothèse : un traitement simultané par de l’acide bongkrékique (inhibiteur de l’ANT) et de l’aurovertine (inhibiteur de l’ATP synthétase) annule complètement le ΔΨm de cellules essentiellement (cellules d’ostéosarcome 143B) ou exclusivement (cellules ρ° sans ADN mitochondrial) glycolytiques. Au contraire, le potentiel de cellules partiellement oxydatives (cellules HepG2 d’hépatocarcinome) peut être maintenu, dans une certaine mesure, par l’éjection de protons de la chaîne respiratoire.
Figure 4
Effet de l’inhibition des phosphorylations oxydatives et de la glycolyse sur le gradient de potentiel membranaire mitochondrial dans les cellules HepG2, 143B et ρ°.
La fluorescence émise par la molécule de DiOC6(3) est proportionnelle au potentiel de membrane de la membrane interne mitochondriale. Les cellules HepG2 (cellules d’hépatocarcinome, background oxydatif), 143B (cellules d’ostéosarcome, principalement glycolytiques) et ρ° sans ADNmt (exclusivement glycolytiques) sont traitées soit par des inhibiteurs mitochondriaux - antimycine A (inhibiteur de la chaîne respiratoire), oligomycine (inhibiteur de l’ATP synthétase), acide bongkrékique et aurovertine (inhibiteurs respectifs du transport et de l’hydrolyse de l’ATP), soit par des inhibiteurs de la glycolyse - 2-désoxyglucose (inhibiteur de l’oxydation du glucose) et capsaïcine (inhibiteur de la NADH déshydrogénase cytosolique) (voir le site d’action de ces inhibiteurs sur la Figure 1) [26].
Les ANT dans les maladies humaines et l’apoptose
Des altérations de l’isoforme ANT1 « musculaire » ont été récemment mises en cause dans plusieurs maladies, que ce soit par une mutation de son gène [13, 14] ou un dérèglement de son expression [15]. L’implication de l’ANT1 dans divers syndromes a été confirmée chez la souris par une invalidation du gène ANT1 [16] ; ces animaux présentent toutes les caractéristiques physiologiques, histologiques et biochimiques des myopathies et des cardiomyopathies : une déficience de l’état 3 de la respiration, des fibres rouges déchiquetées, une hypertrophie cardiaque, une élévation des taux d’acides lactique et citrique et, enfin, une intolérance à l’exercice. Par ailleurs, de récentes études ont montré que cette isoforme ANT1 aurait un rôle dans l’effet seuil (threshold effect) observé dans les maladies mitochondriales [17].
En revanche, aucune étude ne fait référence à l’existence de maladies liées à une mutation de l’isoforme « glycolytique » ANT2 ou de l’isoforme ubiquitaire ANT3. Cela peut être expliqué par le rôle primordial de ces deux isoformes dans la vie cellulaire : rôle clé de l’ANT2 au cours de l’embryogenèse, et rôle constitutif de l’ANT3 dans tous les types cellulaires. Chez la souris, seul un mutant conditionnel Ant2-/- a pu être obtenu dans le foie, et seuls quelques stades du développement ont pu être atteints pour les autres tissus [18].
De nombreux travaux ont suspecté que la mitochondrie jouait un rôle important dans le déclenchement de l’apoptose, notamment par le biais d’un phénomène appelé « transition de perméabilité », exploré depuis près d’une décennie [19]. L’ANT interagirait avec plusieurs protéines locales telles que le récepteur périphérique des benzodiazépines, la porine, l’hexokinase, la créatine kinase, la cyclophiline D, ainsi que les protéines proapoptotiques de la famille Bcl-2, pour former un complexe multiprotéique favorisant la formation de pores de transition de perméabilité (PTP) et, ainsi, la dissipation du gradient de potentiel transmembranaire mitochondrial indispensable à la synthèse de l’ATP et à la vie cellulaire [20]. Contrairement aux isoformes ANT1 et ANT3, et malgré leurs séquences protéiques très voisines, ANT2 n’interviendrait pas dans l’élaboration de ce PTP [21, 22].
Cette théorie de l’implication des protéines ANT dans le PTP vient d’être remise en cause par des travaux réalisés chez des souris dont les gènes ANT ont été invalidés de manière permanente ou conditionnelle. La suppression ou l’inactivation des gènes ANT n’aurait pas d’incidence sur le déclenchement de l’apoptose [18]. L’implication des ANT dans les processus d’apoptose serait alors plutôt indirecte, liée aux mouvements de l’ATP, ce qui expliquerait pourquoi l’isoforme ANT2, dont la cinétique est inverse de celle des deux autres isoformes, n’intervient pas dans le déclenchement de l’apoptose. Au contraire, les cellules exprimant l’ANT2 disposeraient d’un métabolisme principalement glycolytique et seraient ainsi plutôt moins sensibles à un effondrement de leur potentiel de membrane mitochondrial, et par conséquent à l’arrêt de la production mitochondriale d’ATP.
Perspectives pour une thérapie anticancéreuse : l’ANT2 pour cible ?
Compte tenu de ce rôle majeur de l’isoforme ANT2 dans la croissance et la division cellulaire, et de sa (très) faible expression dans les tissus différenciés, cette protéine est rapidement apparue comme la cible possible d’une stratégie anticancéreuse. L’hexokinase II, intervenant en amont de ce transport de l’ATP glycolytique, et spécifiquement induite dans un tel contexte métabolique, représente également une cible éventuelle. Une stratégie antisens visant l’hexokinase vient d’ailleurs d’être mise en place [12]. De plus, des travaux ont montré que certaines molécules anticancéreuses de la famille du cisplatine conduisaient à une destruction du gradient de potentiel membranaire mitochondrial, et ainsi à l’apoptose cellulaire [23]. L’effet antitumoral de cette molécule résulte-t-il, au moins partiellement, de cette atteinte mitochondriale ? Si c’est le cas, un ciblage de l’ANT2, responsable de la production de ce potentiel par son échange ATP4-/ADP3-, serait une stratégie visant plus spécifiquement la cellule tumorale. De plus, cette stratégie anti-ANT2 serait également applicable aux cellules tumorales ayant acquis une résistance aux molécules anticancéreuses, ce qui reste un problème majeur dans le traitement du cancer [24].
Pendant plusieurs années, notre équipe a tenté de détruire des messagers ANT2 par des oligonucléotides antisens phosphorothioates, mais cette technique n’a pas donné les résultats espérés : le taux de pénétration des oligonucléotides dans la cellule était vraisemblablement très inférieur au taux d’expression du messager ANT2. Nous avons très récemment entrepris une stratégie utilisant l’interférence par l’ARN, qui pourrait conduire à une inhibition spécifique de l’expression de la protéine ANT2.
Conclusions
L’étude des protéines ANT, transporteurs mitochondriaux d’ATP, permet de mieux comprendre le rôle des fonctions mitochondriales dans les maladies humaines, notamment le cancer. Cette protéine ANT - à plusieurs isoformes régulées - est un modèle d’avenir pour l’étude de mécanismes de régulation génique. Ainsi, ce thème de recherche, compte tenu de l’essor de la « promotologie »[1], devrait être un tremplin dans l’étude des régulations cellulaires et pourrait conduire à l’émergence de nouvelles thérapies anticancéreuses.
Parties annexes
Remerciements
Les auteurs tiennent à remercier vivement Aïcha Demidem et Daniel Morvan pour leur lecture critique du manuscrit.
Note
-
[1]
Étude des mécanismes moléculaires de régulation génique.
Références
- 1. Capaldi RA, Halphen DG, Zhang YZ, Yanamura W. Complexity and tissue specificity of the mitochondrial respiratory chain. J Bioenerg Biomembr 1988 ; 20 : 291-311.
- 2. Pebay-Peyroula E, Dahout-Gonzalez C, Kahn R, et al. Structure of mitochondrial ADP/ATP carrier in complex with carboxyatractyloside. Nature 2003 ; 426 : 39-44.
- 3. Stepien G, Torroni A, Chung A, et al. Differential expression of adenine nucleotide translocator isoforms in mammalian tissues and during cell differentiation. J Biol Chem 1992 ; 267 : 14592-7.
- 4. Li K, Hodge JA, Wallace DC. OXBOX, a positive transcriptional element of the heart-skeletal muscle ADP/ATP translocator gene. J Biol Chem 1990 ; 265 : 20585-8.
- 5. Giraud S, Bonod-Bidaud C, Wesolowski-Louvel M, Stepien G. Expression of human ANT2 gene in highly proliferative cells : GRBOX, a new transcriptional element, is involved in the regulation of glycolytic ATP import into mitochondria. J Mol Biol 1998 ; 281 : 409-18.
- 6. Luciakova K, Barath P, Poliakova D, et al. Repression of the human adenine nucleotide translocase-2 gene in growth-arrested human diploid cells : the role of nuclear factor-1. J Biol Chem 2003 ; 278 : 30624-33.
- 7. Ku DH, Kagan J, Chen ST, et al. The human fibroblast adenine nucleotide translocator gene : molecular cloning and sequence. J Biol Chem 1990 ; 265 : 16060-3.
- 8. Barath P, Luciakova K, Hodny Z, et al. The growth-dependent expression of the adenine nucleotide translocase-2 (ANT2) gene is regulated at the level of transcription and is a marker of cell proliferation. Exp Cell Res 1999 ; 248 : 583-8.
- 9. Jang JY, Lee CE. Mitochondrial adenine nucleotide translocator 3 is regulated by IL-4 and IFN-gamma via STAT-dependent pathways. Cell Immunol 2003 ; 226 : 11-9.
- 10. Amiri H, Karlberg O, Andersson SE. Deep origin of plastid/parasite ATP/ADP translocases. J Mol Evol 2003 ; 56 : 137-50.
- 11. Mathupala SP, Rempel A, Pedersen PL. Glucose catabolism in cancer cells : identification and characterization of a marked activation response of the type II hexokinase gene to hypoxic conditions. J Biol Chem 2001 ; 276 : 43407-12.
- 12. Pedersen PL, Mathupala S, Rempel A, et al. Mitochondrial bound type II hexokinase : a key player in the growth and survival of many cancers and an ideal prospect for therapeutic intervention. Biochim Biophys Acta 2002 ; 1555 : 14-20.
- 13. Napoli L, Bordoni A, Zeviani M, et al. A novel missense adenine nucleotide translocator-1 gene mutation in a Greek adPEO family. Neurology 2001 ; 57 : 2295-8.
- 14. Siciliano G, Tessa A, Petrini S, et al. Autosomal dominant external ophthalmoplegia and bipolar affective disorder associated with a mutation in the ANT1 gene. Neuromuscul Disord 2003 ; 13 : 162-5.
- 15. Jordens EZ, Palmieri L, Huizing M, et al. Adenine nucleotide translocator 1 deficiency associated with Sengers syndrome. Ann Neurol 2002 ; 52 : 95-9.
- 16. Graham BH, Waymire KG, Cottrell B, et al. A mouse model for mitochondrial myopathy and cardiomyopathy resulting from a deficiency in the heart/muscle isoform of the adenine nucleotide translocator. Nat Genet 1997 ; 16 : 226-34.
- 17. Faustin B, Rossignol R, Rocher C, et al. Mobilization of adenine nucleotide translocators as molecular bases of the biochemical threshold effect observed in mitochondrial diseases. J Biol Chem 2004 ; 279 : 20411-21.
- 18. Kokoszka JE, Waymire KG, Levy SE, et al. The ADP/ATP translocator is not essential for the mitochondrial permeability transition pore. Nature 2004 ; 427 : 461-5.
- 19. Kroemer G, Zamzami N, Susin SA. Mitochondrial control of apoptosis. Immunol Today 1997 ; 18 : 44-51.
- 20. Brenner C, Cadiou H, Vieira HL, et al. Bcl-2 and Bax regulate the channel activity of the mitochondrial adenine nucleotide translocator. Oncogene 2000 ; 19 : 329-36.
- 21. Bauer MK, Schubert A, Rocks O, Grimm S. Adenine nucleotide translocase-1, a component of the permeability transition pore, can dominantly induce apoptosis. J Cell Biol 1999 ; 147 : 1493-502.
- 22. Zamora M, Granell M, Mampel T, Vinas O. Adenine nucleotide translocase 3 (ANT3) overexpression induces apoptosis in cultured cells. FEBS Lett 2004 ; 563 : 155-160.
- 23. Ara G, Kusumoto T, Korbut TT, et al.Cis-diamminedichloroplatinum(II) resistant human tumor cell lines are collaterally sensitive to PtCl4(Rh-123)2 : evidence for mitochondrial involvement. Cancer Res 1994 ; 54 : 1497-502.
- 24. Harper ME, Antoniou A, Villalobos-Menuey E, et al. Characterization of a novel metabolic strategy used by drug-resistant tumor cells. Faseb J 2002 ; 16 : 1550-7.
- 25. Ludwig B, Bender E, Arnold S, et al. Cytochrome C oxidase and the regulation of oxidative phosphorylation. Chem Biochem 2001 ; 2 : 392-403.
- 26. Chevrollier A, Loiseau D, Gautier F, et al. ANT2 expression under hypoxic conditions produces opposite cell-cycle behavior in 143B and HepG2 cancer cells. Mol Carcinogen 2005 ; 42 : 1-8.
Liste des figures
Figure 1
Synthèse de l’ATP par les phosphorylations oxydatives mitochondriales.
Cette synthèse de l’ATP fait intervenir deux réactions successives : l’oxydation par la chaîne respiratoire des substrats provenant du métabolisme des lipides et des sucres, ce qui conduit à une consommation d’oxygène et à une éjection de protons à l’origine du gradient de potentiel transmembranaire mitochondrial ΔΨm, et à la phosphorylation de l’ADP mitochondrial en ATP grâce à ce gradient de protons. Ces réactions sont réalisées par cinq complexes multi-enzymatiques intégrés dans la membrane interne de la mitochondrie, assemblés à partir de sous-unités codées pour leur majorité (87 caractérisées actuellement) par le génome nucléaire, et pour 13 d’entre elles par le génome mitochondrial. Les complexes I, II, III et IV assurent le transfert d’électrons le long de la chaîne respiratoire [1], le complexe V étant chargé de la synthèse de l’ATP. Complexes I : NADH-ubiquinone oxydoréductase ; II : succinate ubiquinone oxydoréductase ; III : ubiquinol cytochrome c oxydoréductase ; IV : cytochrome c oxydase ; V : ATP synthétase ; ANT : adénine nucléotide translocase ; NADH,H+ : nicotinamide-adénine-dinucléotide ; FADH2 : flavine-adénine-dinucléotide ; CoQ : ubiquinone ; cyt c : cytochrome c ; AcCoA : acétyl coenzyme A ; ADNmt : ADN mitochondrial ; MEM : membrane externe mitochondriale ; MIM : membrane interne mitochondriale. En rouge : site d’action de différents inhibiteurs des phosphorylations oxydatives et de la glycolyse (voir Figure 4).
Figure 2
Création et maintien du potentiel de membrane mitochondrial dans diverses conditions.
A. En condition aérobie, les phosphorylations oxydatives (OXPHOS) sont responsables de la création du potentiel de membrane mitochondrial, ΔΨm, utilisé comme force protomotrice par l’ATP synthétase pour la synthèse d’ATP à partir d’ADP et de Pi (phosphate inorganique). B. Aucune synthèse d’ATP par l’ATP synthétase ne peut avoir lieu dans la cellule ρ°. En revanche, la partie F1 de l’ATP synthétase hydrolyse l’ATP importé par l’ANT2. Cet échange ATP4-/ ADP3- électrogénique participe ainsi au maintien du potentiel de membrane mitochondrial. PIC : transporteur du phosphate ; MEM : membrane externe mitochondriale ; MIM : membrane interne mitochondriale ; VDAC : voltage dependant anion channel ; OXPHOS : complexes responsables des phosphorylations oxydatives.
Figure 3
Modèle d’importation d’ATP et d’inhibition des OXPHOS dans la cellule tumorale.
L’isoforme II mitochondriale de l’hexokinase (HK II) fournirait l’ATP à partir de glucose 6-P (G-6P) produit par l’hexokinase cytosolique (HK) et d’ADP. L’ATP, importé dans la mitochondrie via le VDAC puis par l’ANT2, participe alors au maintien du potentiel de membrane mitochondrial (ΔΨm) et aux activités enzymatiques intramitochondriales. L’ATP pourrait également participer à l’inhibition des OXPHOS par fixation de l’ATP au niveau du complexe IV (flèche rouge) [25] (abréviations, voir légende de la Figure 2).
Figure 4
Effet de l’inhibition des phosphorylations oxydatives et de la glycolyse sur le gradient de potentiel membranaire mitochondrial dans les cellules HepG2, 143B et ρ°.
La fluorescence émise par la molécule de DiOC6(3) est proportionnelle au potentiel de membrane de la membrane interne mitochondriale. Les cellules HepG2 (cellules d’hépatocarcinome, background oxydatif), 143B (cellules d’ostéosarcome, principalement glycolytiques) et ρ° sans ADNmt (exclusivement glycolytiques) sont traitées soit par des inhibiteurs mitochondriaux - antimycine A (inhibiteur de la chaîne respiratoire), oligomycine (inhibiteur de l’ATP synthétase), acide bongkrékique et aurovertine (inhibiteurs respectifs du transport et de l’hydrolyse de l’ATP), soit par des inhibiteurs de la glycolyse - 2-désoxyglucose (inhibiteur de l’oxydation du glucose) et capsaïcine (inhibiteur de la NADH déshydrogénase cytosolique) (voir le site d’action de ces inhibiteurs sur la Figure 1) [26].
Liste des tableaux
Tableau I
Nomenclature et expression des gènes ANT chez l’homme et dans différentes espèces.