Résumés
Résumé
Yves Chauvin, 75 ans, est un ancien élève de l’École Supérieure de Chimie Physique Électronique de Lyon (promotion 1954). Directeur de Recherche à l’Institut Français du Pétrole, il fait preuve d’une créativité scientifique remarquable dans le domaine de la catalyse homogène. Il est à l’heure actuelle Directeur de Recherche Émérite à l’UMR 9986 à Lyon (France).
Richard R. Schrock, 60 ans, obtient son PhD à Harvard (États-Unis) en 1971 sous la direction de J.A. Osborn. Après un séjour post-doctoral avec Jack Lewis à Cambridge et un début de carrière chez duPont de Nemours, il est nommé professeur au Massachussetts Institute of Technology (MIT) à Cambridge (États-Unis) en 1980.
Robert H. Grubbs, 63 ans, obtient son PhD à l’Université de Columbia (New York, États-Unis). Après un séjour postdoctoral à Stanford (California, États-Unis) sous la direction de Jim Collman, il rejoint en 1978 le California Institute of Technology (Caltech, Pasadena, États-Unis) où il est à l’heure actuelle professeur de chimie.
Corps de l’article
Le prix Nobel de Chimie 2005 vient d’être attribué à Yves Chauvin (Directeur de Recherche Emérite à l’UMR 9986 CNRS/École Supérieure de Chimie Physique Électronique de Lyon), Robert H. Grubbs (Professeur au California Institute of Technology, Pasadena, États-Unis) et Richard R. Schrock (MIT, Boston, États-Unis), pour leurs travaux sur les réactions de métathèse. Comme le souligne l’Académie royale suédoise des sciences, ils ont réussi à développer la métathèse pour en faire l’une des réactions les plus utiles en chimie organique, en ouvrant des possibilités fantastiques pour, entre autres, la fabrication des médicaments.
La métathèse est une réaction entre deux molécules possédant une liaison carbone-carbone multiple (double dans les alcènes, triple dans les alcynes) au cours de laquelle il y a échange des motifs carbonés (Figure 1).
Figure 1
C’est dans les années 1950-60 que des chercheurs de l’industrie pétrolière montrent que la réaction existe et a lieu par exemple sur le propène en présence d’un mélange complexe contenant des sels de molybdène ou de tungstène, avec formation d’éthylène et de butène. Le mécanisme de cette réaction tout à fait fascinante, puisqu’elle fait intervenir la cassure d’une liaison carbone-carbone très stable et la reformation d’une telle liaison entre entités carbonées, est resté incompris pendant de nombreuses années. C’est Yves Chauvin et ses collaborateurs qui vont dissiper le mystère en proposant, en 1971, un mécanisme faisant intervenir un acteur clé du processus catalytique, un métallocarbène, c’est-à-dire un complexe du métal de transition, utilisé comme catalyseur, lié à un atome de carbone ne portant que deux substituants (Figure 2).
Figure 2
C’est donc le métal de transition qui est capable de lier et de stabiliser de façon transitoire des carbènes CRR’ et qui permet, de façon catalytique, la cassure et la reformation de liaisons carbone-carbone multiples. Ce « mécanisme de Chauvin » va servir de guide et de source d’inspiration pour un très grand nombre de chercheurs ; il ouvre la voie à 30 ans de recherche qui vont faire de la métathèse une des réactions majeures en synthèse organique et en chimie des polymères.
Presque à la même époque, en fait en 1974, Richard Schrock réussit à préparer le premier complexe métallocarbénique du type de ceux proposés par Y. Chauvin comme acteurs majeurs de la métathèse. Toutefois, ce complexe qui comportait une liaison Ta=CHC(CH3)3, et tous ses successeurs décrits par R. Schrock entre 1974 et 1979 ne se révèlent pas capables de catalyser la métathèse des alcènes. Ce n’est qu’en 1980 que Schrock et al. publient la synthèse d’un complexe carbénique du tantale actif comme catalyseur de métathèse, en apportant ainsi une des premières preuves claires en faveur du mécanisme de Chauvin. Entre 1980 et 1990, l’équipe de Schrock obtient une série impressionnante de complexes carbéniques du molybdène et du tungstène, dont certains sont, même à l’heure actuelle, les meilleurs catalyseurs de métathèse des alcènes.
Un autre chercheur américain, Robert Grubbs, va faire progresser considérablement le domaine, dans le début des années 90, en montrant que certains complexes carbéniques du ruthénium sont d’excellents catalyseurs pour les réactions de métathèse faisant intervenir des alcènes porteurs de groupes fonctionnels très divers. Cette dernière propriété, ainsi que la grande stabilité à l’air de ces complexes du ruthénium, ouvraient très largement la porte à l’utilisation de la métathèse en synthèse organique, et un très grand nombre d’équipes ont mis en évidence, au cours de ces quinze dernières années, les applications multiples de la réaction de métathèse dans des domaines très divers.
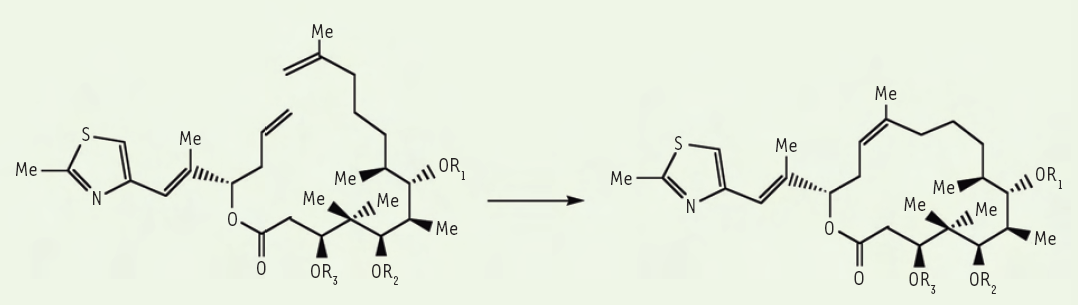
Historiquement, les premières applications concernent les domaines de la pétrochimie, avec la mise au point de nombreux procédés de production d’alcènes, et des matériaux de type polymères. Plus récemment, la réaction de métathèse a été très largement utilisée pour la synthèse de molécules complexes comme les médicaments ou les composés utilisés en agrochimie. La réaction de cyclisation de diènes par métathèse est ainsi devenue la méthode de choix pour l’accès aux grands cycles que l’on trouve dans beaucoup de substances naturelles comme les antibiotiques macrolides, les alcaloïdes ou certaines neurotoxines d’origine marine. L’équation ci-dessous montre un exemple, l’élaboration du macrocycle complexe et polyfonctionnel de l’épothilone B, un composé antitumoral, qui a pu être réalisée en une étape grâce à une réaction de métathèse (Figure 3).
Figure 3
De façon plus générale, il est clair que cette possibilité de déplacer des motifs carbonés CRR’ grâce à une liaison transitoire avec un métal de transition utilisé comme catalyseur ouvre des possibilités fantastiques non seulement dans les divers domaines de la chimie indiqués ci-dessus, mais aussi en biochimie (cyclisation de polypeptides, pontages sélectifs de peptides par exemple) et dans l’utilisation de la biomasse comme source d’intermédiaires pour la chimie fine et la chimie industrielle.
Parties annexes
Références
- 1. Hérisson JL, Chauvin Y. Makromol Chem 1971 ; 141 : 161-7.
- 2. Schrock RR, Hoveyda AH. Angew Chem Int Ed 2003 ; 42 : 4592-633.
- 3. Trnka TM, Grubbs RH. Acc Chem Res 2001 ; 34 : 18-29.
Liste des figures
Figure 1
Figure 2
Figure 3