Résumés
Résumé
Disposer de la séquence de nombreux génomes est une étape importante pour notre compréhension des organismes vivants. Mais les biologistes rêvaient de pouvoir transformer ces informations « statiques » en données fonctionnelles. La découverte du rôle inhibiteur de l’expression génique des ARN double brin a fourni une approche expérimentale qui répond presque complètement à cette attente. En effet, pour diminuer l’expression d’un gène, il suffit d’introduire dans les cellules de petits ARN double brin qui ont la même séquence que le messager correspondant et interfèrent ainsi avec l’ARN. Il apparaît de plus que ce mécanisme d’interférence par l’ARN est un élément important des régulations de l’expression génique chez les mammifères, du moins sous une forme spécifique, les microARN. Au-delà des études fonctionnelles à l’échelle d’un gène, cette technique rend possible des criblages « géniques » à grande échelle, couvrant à terme l’ensemble du génome. Ainsi, l’interférence par l’ARN ouvre-t-elle l’ère de la génomique fonctionnelle.
Summary
The discovery of the induction of RNA degradation by double stranded RNA in C. elegans, «RNA interference», makes it possible to envision systematic studies of gene function in mammalian cells. Indeed, in spite of the existence in mammals of the interferon response to double stranded RNA, the introduction of small interfering RNA can induce a sequence specific inhibition of gene expression either through RNA degradation or by blocking translation. Although the inhibition is transient and usually not complete, strategies have been developed to achieve long term gene silencing. The issue of target specificity is still not completely clear and will probably constitute a limitation of this approach. However, because of the unprecedented ease with which large scale screens can be performed, RNA interference has already established itself as the tool of choice to initiate functional genomics in mammalian cells.
Corps de l’article
Depuis 1998, il a été montré chez de nombreux eucaryotes[1] que l’ARN double brin pouvait induire une suppression de l’expression génique par des mécanismes spécifiques de séquence. L’inhibition de l’expression peut avoir lieu à différents niveaux (transcription, traduction, dégradation de l’ARNm). Initialement, l’appellation d’interférence par l’ARN désignait la dégradation ciblée des ARN messagers induite par l’ARN double brin [1]. Mais il est apparu ensuite que le blocage de la traduction constituait probablement un autre aspect du même mécanisme.
Mécanisme de l’interférence par l’ARN
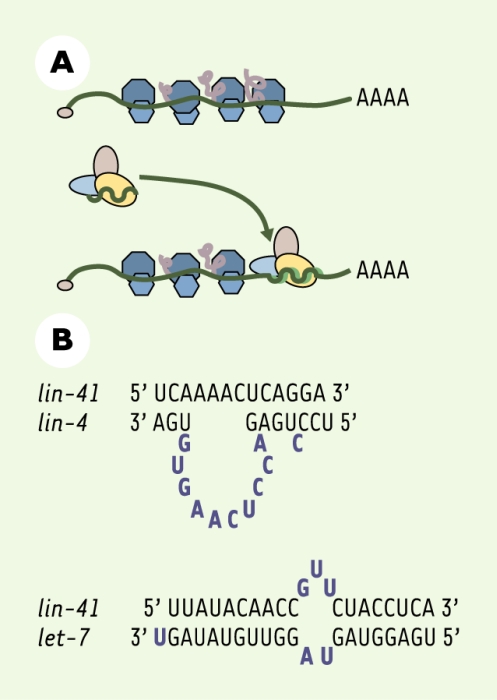
C’est en 1998 que le groupe d’A. Fire a mis en évidence chez le nématode Caenorhabditis elegans la capacité de l’ARN double brin d’induire la dégradation des ARN simple brin contenant les mêmes séquences [1]. Grâce aux données obtenues chez les plantes, le champignon ascomycète Neurospora crassa, C. elegans, la drosophile et, plus récemment, chez les mammifères, les grandes lignes du mécanisme sous-jacent ont pu être établies (Figure 1). Les molécules d’ARN double brin sont d’abord découpées par une RNase double brin, l’éminceuse (Dicer) [2], produisant des fragments d’environ 21 nucléotides, les petits ARN interférants (short interfering RNA, siRNA). Ces petits ARN sont ensuite incorporés sous forme de simple brin dans un complexe ribonucléoprotéique où ils servent de guide pour la reconnaissance de la cible. Le complexe, dénommé RISC (RNA-induced silencing complex), peut avoir soit une activité de nucléase spécifique de séquence [3] (Figure 1), soit induire un blocage de l’élongation de la traduction (Figure 2A). Il semble que ce soit le même complexe RISC (ou des variantes très proches entre elles [4]) qui assure ces deux fonctions, la nature de l’appariement avec la cible déterminant le résultat : coupure endonucléolytique pour un appariement « parfait », blocage de la traduction dans certains cas d’appariement imparfait générant une boucle centrale (Figure 2B). Parmi les constituants de RISC, figurent une protéine de la famille argonaute (eIF2C2, un homologue du facteur d’initiation de la traduction eIF2 chez les mammifères) et le produit du gène de l’X fragile qui est un régulateur de la traduction [5]. En revanche, la nucléase responsable de la coupure endonucléolytique n’a pas encore été identifiée.
Figure 1
Interférence par l’ARN.
Les molécules d’ARN double brin sont d’abord découpées par une RNase double brin, l’éminceuse (Dicer), qui produit des fragments d’environ 21 nucléotides, les petits ARN interférants. Ceux-ci sont incorporés sous forme simple brin dans un complexe ribonucléoprotéique dénommé RISC (RNA-induced silencing complex) où ils servent de guide pour la reconnaissance de la cible. Un appariement « parfait » avec l’ARNm cible détermine une activité de nucléase spécifique de séquence du complexe avec la coupure endonucléolytique et la dégradation des fragments.
Figure 2
Inhibition de la traduction par le complexe RISC (RNA-induced silencing complex).
A. Le complexe RISC peut induire un blocage de l’élongation de la traduction. B. Séquence des sites de fixation des petits ARN lin-4 et let-7 sur leur cible commune lin-41; l’appariement imparfait de ces séquences produit une boucle centrale. Ces sites sont situés dans la région 3’ non codante de ces messagers.
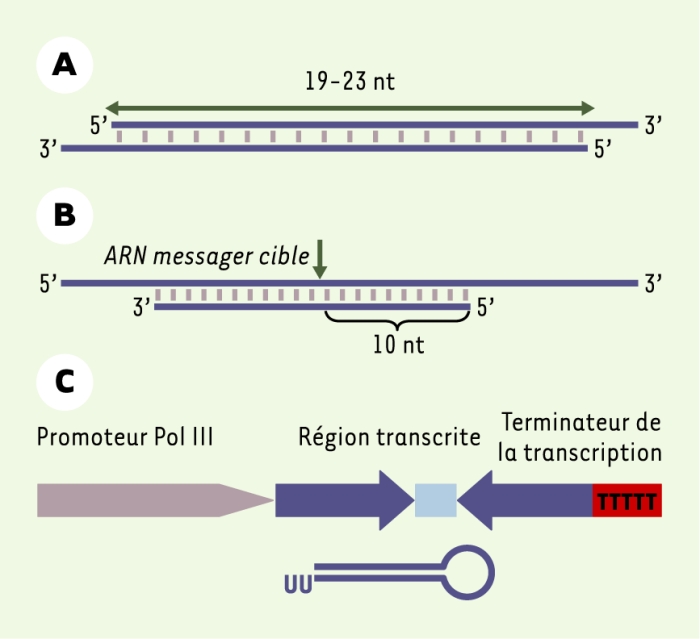
Il est possible d’induire une interférence en introduisant directement dans les cellules les petits ARN interférants à la place des ARN double brin de grande taille. Le schéma d’un ARN interférant « consensus » est présenté dans la Figure 3A. Ces molécules étant produites par une RNase III, ont des extrémités 3’ qui comprennent en moyenne deux nucléotides non appariés. Il semble que la nature de ces deux nucléotides ne joue pas de rôle essentiel dans l’interférence ; ils peuvent donc ne pas être complémentaires de la séquence du gène cible et être modifiés (désoxynucléotides, nucléotides biotinylés). La phosphorylation préalable de l’extrémité 5’ des molécules n’étant pas indispensable en raison de l’existence d’une kinase cellulaire, il est possible d’utiliser des molécules synthétisées chimiquement (avec des extrémités 5’-OH). Dans des lysats cellulaire, le site de coupure a pu être déterminé : il est localisé en face de la liaison 10-11 de l’ARN guide (Figure 3B).
Figure 3
Les petits ARN interférants.
A. ARN interférant « consensus ». Produites par une RNase III, ces molécules ont des extrémités 3’ qui comprennent en moyenne deux nucléotides (nt) non appariés. B. Dans des expériences in vitro, le site de coupure a pu être déterminé et est localisé en face de la liaison 10-11 de l’ARN guide. C. Un vecteur d’expression pour un ARN en épingle à cheveux permet d’induire et de maintenir à long terme une interférence car des nucléases cellulaires transforment la molécule en épingle à cheveux en une molécule linéaire proche d’un petit ARN interférant capable d’induire l’interférence.
Utilisation de l’interférence chez les mammifères
Dans des cellules de mammifères, la présence d’ARN double brin induit généralement une réponse de type interféron qui comporte également une dégradation des ARNm et une inhibition de la traduction qui ne sont pas spécifiques de séquence. L’interférence par l’ARN existe pourtant bien chez les mammifères comme le montrent des travaux utilisant des ARN double brin de grande taille dans des contextes cellulaires où la réponse de type interféron est absente (développement précoce chez la souris [6], cellules souches embryonnaires [ES] et de tératocarcinome).
L’induction de la réponse de type interféron n’étant efficace que pour des ARN double brin de plus de 30 nucléotides, il était plausible que l’introduction de petits ARN interférants n’induise pas ou peu de réponse de type interféron. C’est ce que le groupe de T. Tuschl a montré en 2001 [7], qui a de plus rapidement établi la faisabilité de cette approche en l’appliquant à une vingtaine de gènes [8]. La petite taille des ARN interférants rend leur introduction dans des cellules de mammifère plus facile que celle de plasmides et il est possible d’induire une interférence dans plus de 90 % des cellules pour les lignées cellulaires facilement transfectables. Le niveau d’inhibition est souvent de l’ordre de 80 % en ARN ou en protéine.
Vecteurs d’expression et utilisation in vivo
Chez les mammifères, contrairement aux plantes, aux champignons et au nématode, il ne semble pas exister de mécanisme d’amplification ou de régénération de l’ARN double brin. En conséquence, l’introduction de petits ARN interférants n’induit qu’une suppression transitoire de l’expression, de quelques jours à deux semaines, en fonction de la quantité d’ARN transfectée et de la prolifération des cellules. Pour obtenir une suppression à long terme de l’expression, la stratégie la plus simple est d’utiliser un vecteur d’expression qui produit dans la cellule une molécule en épingle à cheveux dont la structure est proche de celle d’un petit ARN interférant (Figure 3C). De nombreux vecteurs ont été construits avec un promoteur polymérase III, car cette polymérase qui transcrit la plupart des petits ARN cellulaires, n’est pas couplée à une enzyme de coiffage de l’extrémité 5’ du transcrit, et s’arrête spécifiquement dans une séquence de terminaison de la transcription (TTTTT). Les promoteurs les plus utilisés sont ceux du petit ARN U6 impliqué dans l’épissage, et de l’ARN H1, un composant de la RNase P, ces promoteurs étant fonctionnels dans tous les types cellulaires [9, 10]. La séquence de la boucle ne semble pas jouer de rôle spécifique .
Ces cassettes d’expression pour des molécules en épingle à cheveux ont été introduites dans des vecteurs viraux et ne semblent pas interférer avec la production virale, même pour des rétrovirus [11]. Des vecteurs lentiviraux ont également été utilisés et permettent l’infection de cellules ES et de cellules quiescentes [12].
Plusieurs études ont montré que les petits ARN interférants ou des vecteurs d’expression pour des molécules en épingle à cheveux pouvaient être utilisés in vivo chez la souris, par exemple avec la méthode de transfection hydrodynamique [13]. Des vecteurs viraux ont aussi été utilisés in vivo chez la souris. Enfin, H. Hasuwa et al. ont utilisé un vecteur d’expression avec le promoteur H1 dans des souris transgéniques et obtenu une bonne efficacité d’inhibition dans tous les tissus étudiés, démontrant directement le large domaine d’action de l’interférence [14].
Choix de la séquence cible et spécificité
Il semble que la question de l’accessibilité soit moins critique pour les petits ARN interférants que pour les oligonucléotides antisens, puisque des séquences choisies de manière arbitraire ont une activité biologique dans près de la moitié des cas. La présence des protéines du complexe RISC contribue probablement à ce résultat. Cependant, pour certains gènes, il peut être nécessaire de tester beaucoup de séquences avant de trouver des petits ARN interférants qui soient actifs. La composition en bases G/C, qui détermine la structure secondaire, est un des éléments à prendre en compte pour choisir une cible (voir [15] pour une discussion des critères de choix). Une meilleure compréhension de l’insertion des petits ARN interférants dans le complexe RISC permet d’expliquer une partie des échecs. En effet, c’est le brin du petit ARN interférant dont l’extrémité 5’ peut se désapparier le plus facilement qui est introduit dans le complexe tandis que l’autre brin est dégradé. Ce biais d’incorporation peut conduire au ciblage presque exclusif d’un ARNm ou de sa séquence complémentaire [16, 17].
Tout indique que le complexe RISC agit via un appariement de l’ARN guide avec l’ARN cible. Les petits ARN interférants ont une taille suffisante pour être spécifiques d’un gène (16 nucléotides sont en principe suffisants). Cependant, la spécificité nécessite que l’énergie d’hybridation soit sensible à la présence de mésappariements et donc que la séquence ne soit pas trop longue. De fait, un ARN guide dont la séquence ne serait complémentaire qu’avec 18 ou 17 nucléotides de l’ARN cible pourrait former un hybride stable et induire une coupure efficace de celui-ci [18]. Tant que le seuil à partir duquel une interférence peut exister n’a pas été clairement établi, les recherches in silico ne peuvent constituer qu’un guide vis-à-vis des cibles potentielles. De plus, une complémentarité imparfaite peut conduire à une inhibition de la traduction [19]. Dans des études expérimentales via le transcriptome, l’existence de cibles collatérales a été observée, mais avec des efficacités limitées [20]. Pour confirmer un phénotype, il est donc indispensable d’utiliser deux ARN interférants qui ciblent des séquences différentes sur le même gène [21].
Au-delà des cibles collatérales, la question de l’innocuité pour la cellule d’un traitement par des petits ARN interférants ou des vecteurs d’expression reste ouverte. En particulier, l’induction de gènes de la réponse de type interféron, dont celui de l’oligoA synthétase, a été observée en réponse à certains petits ARN interférants [22, 23]. Une autre source de difficultés repose sur l’idée même de réorienter une machinerie cellulaire vers des cibles choisies par l’expérimentateur. Il est donc souhaitable de n’utiliser que la dose minimale efficace d’ARN interférants.
Amplitude de l’inhibition
Un autre aspect de l’interférence par l’ARN qui a fait l’objet de réserves est celui de l’inhibition incomplète de l’expression. En fait, ce caractère partiel de l’inhibition peut aussi constituer un des points forts de cette approche en permettant d’analyser la fonction de gènes essentiels et, de manière plus générale, d’étudier la relation entre le niveau d’expression et la physiologie cellulaire. Ainsi, dans le cas du gène suppresseur de tumeur p53, trois vecteurs d’expression pour des ARN en épingle à cheveux ont permis d’obtenir trois niveaux d’inhibition différents et d’analyser le lien entre le niveau d’expression de p53 et l’agressivité des cellules tumorales [24]. L’interférence par l’ARN permet donc d’aborder la physiopathologie des régulations génétiques.
Cribles à grande échelle
Chez C. elegans, il est possible d’induire l’interférence par l’ARN à l’aide de plusieurs stratégies expérimentales, généralement mises en oeuvre chez la larve. Cette flexibilité reflète l’existence d’un transport de l’ARN double brin dans les cellules, ce qui permet d’observer une inhibition systémique chez l’adulte [25]. Cette propagation, et surtout la transmission à la descendance de l’inhibition sur une génération, reflètent également l’implication d’une polymérase ARN dépendante de l’ARN (pAdA) qui peut amplifier le signal inducteur de l’interférence. Chez les mammifères, il existe un homologue du transporteur de l’ARN double brin mais sa fonctionnalité n’a pas encore été établie.
L’administration par voie alimentaire offre une approche particulièrement simple pour la mise en oeuvre de cribles géniques à grande échelle chez C. elegans. J. Ahringer et al. ont réalisé une collection de 16 757 souches d’E. coli dont chacune exprime de l’ARN double brin correspondant à un gène de C. elegans, ce qui permet d’inactiver individuellement 86 % des gènes identifiés chez cet organisme [26]. Cette collection a déjà servi à réaliser plusieurs cribles pour rechercher les gènes impliqués dans le développement embryonnaire, le stockage des lipides, la réparation de l’ADN et la longévité. Du fait de la possibilité d’analyser le phénotype à la génération suivante et de l’efficacité de l’interférence chez C. elegans, cette approche épigénétique est pratiquement aussi puissante qu’une approche génétique réelle et plus simple à mettre en oeuvre.
La transposition d’une telle approche chez des mammifères doit tenir compte des contraintes expérimentales : utilisation de petits ARN, effets transitoires et inhibition partielle de l’expression. L’utilisation de vecteurs d’expression permet de s’affranchir de l’effet transitoire et, via la conservation de souches bactériennes, de disposer d’une ressource renouvelable. à moins d’utiliser un vecteur viral, la mise en oeuvre de cet outil nécessite une transfection et l’interférence ne touchera donc qu’une partie des cellules. Plusieurs collections de plasmides sont en cours de construction [27, 28] et des criblages sur des familles enzymatiques ont déjà donné des résultats importants [29].
à terme, cette stratégie devrait pouvoir être utilisée pour l’ensemble des gènes humains ou murins[2]. Elle restera quand même plus lourde à mettre en oeuvre que chez C. elegans, même s’il est possible d’inactiver simultanément plusieurs gènes ou d’utiliser une sélection positive pour les cellules ayant acquis le phénotype recherché.
Cibles endogènes des petits ARN
Chez les plantes, l’interférence par l’ARN joue un rôle central dans la défense contre les infections virales, la plupart des virus ayant un génome ARN et produisant de l’ARN double brin au cours du cycle viral. D’ailleurs, de nombreux virus contiennent un gène qui code pour un inhibiteur de l’interférence par l’ARN [30]. Outre des virus, les séquences répétées dans le génome sont des cibles probables de l’interférence par l’ARN pour peu qu’elles soient transcrites sur les deux brins à partir de copies réarrangées ou intégrées tête-bêche dans le génome. Selon R. Plasterk, l’interférence par l’ARN constituerait pour le génome des plantes un analogue du système immunitaire en limitant la prolifération d’éléments génétiques « parasites ». La mutation de certains des gènes nécessaires à l’interférence par l’ARN conduit d’ailleurs à une activation des éléments transposables chez C. elegans [31] ((→) m/s 2004, n° 8-9, p. 767).
Les expériences de clonage systématique des petits ARN cellulaires chez différentes espèces ont révélé la présence de nombreux petits ARN simple brin d’environ 21 nucléotides, les microARN [32]. Ces molécules sont issues de la maturation par l’éminceuse d’un transcrit fortement structuré d’environ 70 nucléotides. Chez les mammifères, on estime qu’il existe plus de deux cents microARN et qu’ils sont majoritairement impliqués dans une régulation de la traduction. Une prédiction des cibles possibles chez les mammifères vient d’ailleurs d’être effectuée, il s’agit de gènes impliqués dans le développement et le cycle cellulaire, mais aussi dans le métabolisme [33]. C’est probablement ce rôle dans la maturation des microARN qui fait de l’éminceuse un gène essentiel chez la souris.
Conclusions
En quelques années, l’interférence par l’ARN s’est imposée comme la meilleure technique pour inhiber l’expression d’un gène dans des cellules de mammifères en culture, de manière transitoire ou à long terme, et peut-être même in vivo. Si la spécificité de l’inhibition reste une difficulté majeure, la facilité de mise en oeuvre de cette approche représente un atout important. Il est déjà évident que l’interférence par l’ARN sera l’outil de choix de la génomique fonctionnelle à travers des criblages systématiques, mais aussi des expériences de colétalité ou de complémentation. Enfin, la possibilité de disposer d’ARN interférants ayant des efficacités d’inhibition différentes permet d’explorer quantitativement les réseaux de régulation.
Parties annexes
Notes
Références
- 1. Fire A, Xu S, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998 ; 391 : 806-11.
- 2. Bernstein E, Caudy AA, Hammond SM, Hannon GJ. Role for a bidentate ribonuclease in the initiation step of RNA interference.Nature 2001 ; 409 : 363-6.
- 3. Hammond SM, Bernstein E, Beach D, Hannon GJ. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature 2000 ; 404 : 293-6.
- 4. Lee YS, Nakahara K, Pham JW, et al. Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways. Cell 2004 ; 117 : 69-81.
- 5. Ishizuka A, Siomi MC, Siomi H. A Drosophila fragile X protein interacts with components of RNAi and ribosomal proteins. Genes Dev 2002 ; 16 : 2497-508.
- 6. Wianny F, Zernicka-Goetz M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol 2000 ; 2 : 70-5.
- 7. Elbashir SM, Harborth J, Lendeckel W, et al. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature 2001 ; 411 : 494-8.
- 8. Harborth J, Elbashir SM, Bechert K, et al. Identification of essential genes in cultured mammalian cells using small interfering RNAs. J Cell Sci 2001 ; 114 : 4557-65.
- 9. Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science 2002 ; 296 : 550-3.
- 10. Paul CP, Good PD, Winer I, et al. Effective expression of small interfering RNA in human cells. Nat Biotechnol 2002 ; 20 : 505-8.
- 11. Brummelkamp T, Bernards R, Agami R. Stable suppression of tumorigenicity by virus-mediated RNA interference. Cancer Cell 2002 ; 2 : 243-7.
- 12. Rubinson DA, Dillon CP, Kwiatkowski AV, et al. A lentivirus-based system to functionally silence genes in primary mammalian cells, stem cells and transgenic mice by RNA interference. Nat Genet 2003 ; 33 : 401-6.
- 13. McCaffrey AP, Meuse L, Pham TT, et al. RNA interference in adult mice. Nature 2002 ; 418 : 38-9.
- 14. Hasuwa H, Kaseda K, Einarsdottir T, et al. Small interfering RNA and gene silencing in transgenic mice and rats. FEBS Lett 2002 ; 532 : 227-30.
- 15. Reynolds A, Leake D, Boese Q, et al. Rational siRNA design for RNA interference. Nat Biotechnol 2004 ; 22 : 326-30.
- 16. Schwarz DS, Hutvagner G, Du T, et al. Asymmetry in the assembly of the RNAi enzyme complex. Cell 2003 ; 115 : 199-208.
- 17. Khvorova A, Reynolds A, Jayasena SD. Functional siRNAs and miRNAs exhibit strand bias. Cell 2003 ; 115 : 209-16.
- 18. Amarzguioui M, Holen T, Babaie E, et al. Tolerance for mutations and chemical modifications in a siRNA. Nucleic Acids Res 2003 ; 31 : 589-95.
- 19. Saxena S, Jonsson ZO, Dutta A. Small RNAs with imperfect match to endogenous mRNA repress translation. Implications for off-target activity of small inhibitory RNA in mammalian cells. J Biol Chem 2003 ; 278 : 44312-9.
- 20. Jackson AL, Bartz SR, Schelter J, et al. Expression profiling reveals off-target gene regulation by RNAi. Nat Biotechnol 2003 ; 21 : 635-7.
- 21. Anonymous. Whither RNAi ? Nat Cell Biol 2003 ; 5 : 489-90.
- 22. Sledz CA, Holko M, de Veer MJ, et al. Activation of the interferon system by short-interfering RNAs. Nat Cell Biol 2003 ; 5 : 834-9.
- 23. Persengiev SP, Zhu X, Green MR. Nonspecific, concentration-dependent stimulation and repression of mammalian gene expression by small interfering RNAs (siRNAs). RNA 2004 ; 10 : 12-8.
- 24. Hemann MT, Fridman JS, Zilfou JT, et al. An epi-allelic series of p53 hypomorphs created by stable RNAi produces distinct tumor phenotypes in vivo. Nat Genet 2003 ; 33 : 396-400.
- 25. Feinberg EH, Hunter CP. Transport of dsRNA into cells by the transmembrane protein SID-1. Science 2003 ; 301 : 1545-7.
- 26. Kamath RS, Fraser AG, Dong Y, et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature 2003 ; 421 : 231-7.
- 27. Berns K, Hijmans EM, Mullenders J, et al. A large-scale RNAi screen in human cells identifies new components of the p53 pathway. Nature 2004 ; 428 : 431-7.
- 28. Paddison PJ, Silva JM, Conklin DS, et al. A resource for large-scale RNA-interference-based screens in mammals. Nature 2004 ; 428 : 427-31.
- 29. Brummelkamp TR, Nijman SM, Dirac AM, Bernards R. Loss of the cylindromatosis tumour suppressor inhibits apoptosis by activating NF-kappaB. Nature 2003 ; 424 : 797-801.
- 30. Vaucheret H, Beclin C, Fagard M. Post-transcriptional gene silencing in plants. J Cell Sci 2001 ; 114 : 3083-91.
- 31. Tabara H, Sarkissian M, Kelly WG, et al. The rde-1 gene, RNA interference, and transposon silencing in C. elegans. Cell 1999 ; 99 : 123-32.
- 32. Bartel DP. MicroRNAs : Genomics, biogenesis, mechanism, and function. Cell 2004 ; 116 : 281-97.
- 33. Lewis BP, Shih IH, Jones-Rhoades MW, et al. Prediction of mammalian microRNA targets. Cell 2003 ; 115 : 787-8.
Liste des figures
Figure 1
Interférence par l’ARN.
Les molécules d’ARN double brin sont d’abord découpées par une RNase double brin, l’éminceuse (Dicer), qui produit des fragments d’environ 21 nucléotides, les petits ARN interférants. Ceux-ci sont incorporés sous forme simple brin dans un complexe ribonucléoprotéique dénommé RISC (RNA-induced silencing complex) où ils servent de guide pour la reconnaissance de la cible. Un appariement « parfait » avec l’ARNm cible détermine une activité de nucléase spécifique de séquence du complexe avec la coupure endonucléolytique et la dégradation des fragments.
Figure 2
Inhibition de la traduction par le complexe RISC (RNA-induced silencing complex).
A. Le complexe RISC peut induire un blocage de l’élongation de la traduction. B. Séquence des sites de fixation des petits ARN lin-4 et let-7 sur leur cible commune lin-41; l’appariement imparfait de ces séquences produit une boucle centrale. Ces sites sont situés dans la région 3’ non codante de ces messagers.
Figure 3
Les petits ARN interférants.
A. ARN interférant « consensus ». Produites par une RNase III, ces molécules ont des extrémités 3’ qui comprennent en moyenne deux nucléotides (nt) non appariés. B. Dans des expériences in vitro, le site de coupure a pu être déterminé et est localisé en face de la liaison 10-11 de l’ARN guide. C. Un vecteur d’expression pour un ARN en épingle à cheveux permet d’induire et de maintenir à long terme une interférence car des nucléases cellulaires transforment la molécule en épingle à cheveux en une molécule linéaire proche d’un petit ARN interférant capable d’induire l’interférence.