Résumés
Résumé
L’incidence du cancer de la prostate, cancer le plus fréquent après l’âge de 50 ans, varie selon les pays. Les seuls facteurs de risque identifiés avec certitude sont l’origine ethnique et les antécédents familiaux d’un cancer du même type. Les formes familiales sont observées dans environ 20 % des cas, et une transmission héréditaire est retrouvée dans 5 % des cas. Six locus de prédisposition sont connus, mais d’autres restent à identifier. L’hétérogénéité génétique de la prédisposition au cancer de la prostate est associée à la diversité de l’origine ethnogéographique des familles. Dans certaines formes familiales, l’association d’un cancer de la prostate à un autre type de cancer suggère l’existence de gènes de prédisposition communs. Les autres formes familiales et sporadiques impliqueraient un mode d’hérédité polygénique ou multifactoriel. Ainsi, certains polymorphismes génétiques ont été associés à un risque individuel accru de cancers de la prostate et pourraient expliquer les importantes variations d’incidence.
Summary
Prostate cancer is the most frequent malignant tumor among men over 50 years old. Its incidence varies according to countries and ethnic group. Known risk factors are race and positive family history of the disease. Familial aggregation (at least 2 cases in the family) is observed in about 20 % of cases and an hereditary form of prostate cancer in 5 %. This proportion increases with younger age at diagnosis. Six putative loci are already identified but undoubtedly, others will be found in forthcoming studies. The genetic heterogeneity observed in hereditary prostate cancer reflects variety of origins of the studied families. In some families, agreggation of prostate cancer and other cancers suggests the involvement of common predisposing genes. In other familial and in sporadic cases, the genetic component should be polygenic : prostate cancer wouldn’t result to segregation of a major gene mutations transmitted according to a monogenic inheritance, but rather to sharing of alleles at many loci, each contributing to a small increase in cancer risk. Indeed, several genetic polymorphism were associated with an increased risk of developing prostate cancer and could explain the variations of prostate cancer incidence observed between populations.
Corps de l’article
En France, l’incidence du cancer de la prostate était de 56/100 000 hommes en l’an 2000. Alors que ce taux a augmenté régulièrement de 10/100 000 par décade, la mortalité par cancer prostatique progressait : 8 234 décès en 1986, soit 10 % des décès par cancer, et 9 239, soit 11 %, en 2000. Les estimations en termes de santé publique sont pessimistes en raison du vieillissement de la population, le cancer de la prostate apparaissant comme la deuxième cause de mortalité par cancer chez l’homme et la première chez les hommes de plus de 70 ans [1].
L’étude de l’histoire naturelle des cancers de la prostate montre que les hommes atteints perdent en moyenne 40 % de leur espérance de vie. L’évolution de l’incidence du cancer de la prostate ces dix dernières années, ainsi que le retentissement économique qu’elle implique, ont motivé la recherche de facteurs de risques et posé le problème du diagnostic précoce et du dépistage de cette affection à un stade curable [2].
Les seuls facteurs de risque actuellement identifiés avec certitude sont l’origine ethnique et l’existence d’un antécédent familial du même cancer. Les formes familiales de cancers de la prostate sont observées dans environ 20 % des cas et l’existence d’une transmission héréditaire compatible avec une transmission mendélienne est retrouvée dans environ 5 % des cas. La majorité des autres formes familiales et des formes sporadiques intégreraient également des facteurs génétiques, mais dans un mode d’hérédité polygénique ou multifactoriel [3]. L’importance des facteurs génétiques concernerait une proportion de cancers de la prostate d’autant plus importante qu’ils surviennent à un jeune âge : 34 % des cancers diagnostiqués à l’âge de 70 ans, contre 43 % à l’âge de 55 ans.
Des données anatomopathologiques et cliniques suggèrent l’existence d’une forme « latente » de cancer de la prostate, non évolutive, qui, à la différence de la forme « clinique », ne serait pas soumise à des variations mésologiques (liées au milieu) ou ethnogéographiques. Il pourrait donc exister deux niveaux au moins de déterminisme génétique, l’un associé à la phase d’initiation du cancer (carcinogenèse), l’autre à la phase de promotion (progression) des cancers de la prostate [4].
Formes familiales et héréditaires associées à des mutations rares
Aspects épidémiologiques
Dès les années 1950, les travaux cliniques de G. Morganti et al. [5] avaient relevé l’existence d’une agrégation familiale possible pour le cancer de la prostate. Plus récemment, des études cliniques cas-témoins [6] et des analyses de ségrégation [7] ont été conduites pour tenter d’évaluer la part des facteurs génétiques et leur mode d’hérédité dans ces formes familiales [8]. Elles concluent à la survenue d’une forme familiale de cancer de prostate (au moins 2 cas chez des apparentés du premier degré) dans 13 % à 26 % des cas, et à un risque relatif pour un parent du premier degré (père, fils ou frère du sujet atteint) de 1,6 à 11 : ce risque varie avec le nombre d’apparentés atteints, le degré de parenté et l’âge au diagnostic de l’apparenté porteur du cancer.
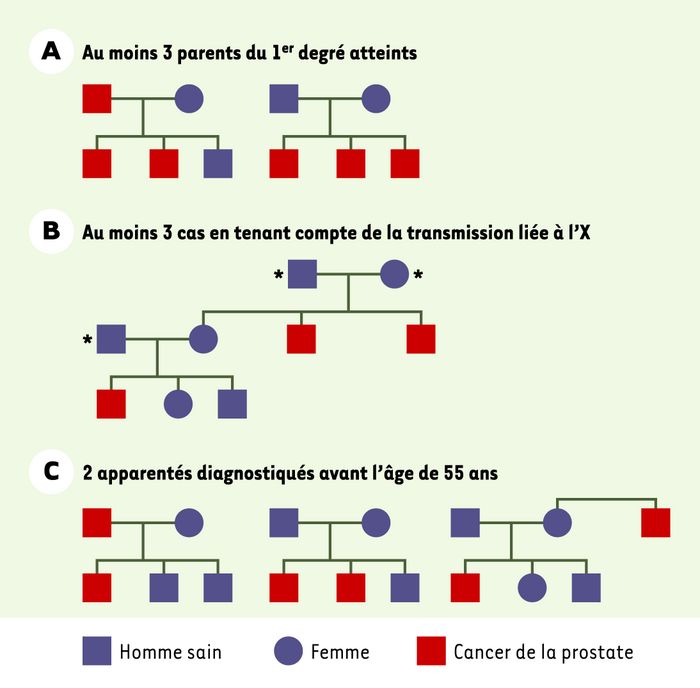
Au sein de ces familles, une forme héréditaire est reconnue avec des critères plus stricts : 3 cas chez des apparentés du premier ou du second degré, ou 2 cas diagnostiqués avant l’âge de 55 ans ; elle n’a été mise en évidence que chez 5 % des patients. La transmission héréditaire peut se faire non seulement sur un mode autosomique dominant (transmission par le père atteint ou par la mère), mais aussi sur un mode lié au sexe (la transmission par la mère touche alors l’ensemble de ses fils, qui en revanche ne transmettent pas la prédisposition à leur(s) propre(s) fils). Il est donc probablement nécessaire d’étendre les critères de reconnaissance des formes héréditaires aux familles chez lesquelles au moins 3 cas de cancer (ou 2 cas avant 55 ans) sont survenus chez des apparentés du second degré de la branche familiale des mères et des filles d’hommes atteints. Cette transmission liée au sexe est probablement sous-estimée, car la maladie saute régulièrement une génération (Figure 1).
Figure 1
Critères cliniques de reconnaissance des formes héréditaires de cancer de la prostate.
Aspects génétiques et anatomocliniques
En 1996, une équipe du John-Hopkins Hospital de Baltimore (MD) a suggéré que la région 1q24-25 du chromosome 1 contiendrait un gène de prédisposition au cancer de la prostate (HPC1, hereditary prostate cancer 1) [9]. En Europe, nous avons identifié en 1998 un locus de prédisposition, nommé PcaP (predisposing for prostate cancer), dans la région télomérique du bras long du chromosome 1 (1q42.2-43) [10, 11]. Depuis, plusieurs autres locus pour des gènes de prédisposition aux formes héréditaires de cancer de la prostate ont été identifiés : HPCX (Xq27-28), HPC20 (20q13), HPC2 (17p11), PG1 (prostate cancer susceptibility gene 1) (8p22-23). D’autres locus de prédisposition, dans les régions chromosomiques 5q31-33, 7q32 et 19q12, seraient associés à des formes familiales particulièrement agressives de la maladie. Ces résultats soulignent l’hétérogénéité génétique de la prédisposition au cancer de la prostate dans sa forme héréditaire [12] : double mode de transmission (automique dominant et lié au sexe) et implication variable des gènes de prédisposition selon l’origine ethnogéographique des familles.
Certains gènes candidats ont été étudiés dans les locus de prédisposition identifiés : RNASEL (RNAse L)/HPC1, ELAC2/HPC2, MSR1/PG1 (macrophage scavenger receptor 1). Le petit nombre de mutations observées dans les familles analysées n’a pas permis de définir clairement un gène dont les mutations seraient prédisposantes au cancer de la prostate héréditaire. Plusieurs variants (single nucleotide polymorphisms, SNP) pour les gènes RNASEL, ELAC2 ou MSR1 ont été associés au risque de cancer de la prostate lors d’études familiales ou cas-témoin ; ils partageraient une responsabilité dans la prédisposition au cancer de la prostate, au sein d’un modèle d’hérédité polygénique (Tableau I).
Tableau I
Cancers héréditaires de la prostate.
HPC : hereditary prostate cancer ; PCaP : predisposing for prostate cancer ; PG1/MSR1 : prostate cancer susceptibility gene 1/macrophage scavenger receptor 1 ; BRCA : breast cancer gene ; CAPB : cancer prostate and brain.
Hormis un âge de survenue plus précoce (de 5 à 10 ans), la majorité des études conclut qu’aucun élément anatomoclinique ou évolutif ne suggère que les cancers de la prostate familiaux ont un pronostic différent des formes sporadiques [13]. Cependant, l’hétérogénéité génétique (qui détermine les formes familiales) et la rareté des études de corrélation génotype/phénotype réalisées à ce jour ne permettent pas de conclure formellement sur ce point. D’ailleurs, une analyse focalisée sur les cancers de la prostate héréditaires associés au locus de prédisposition HPC1 a retrouvé des facteurs de mauvais pronostic au diagnostic, avec des stades tumoraux avancés et des tumeurs moins différenciées que dans les formes non héréditaires utilisées comme témoin [14, 15].
Cancers de la prostate familiaux et autres cancers
Des études épidémiologiques ont montré l’association possible d’autres cancers (cancers du sein, tumeurs cérébrales, lymphomes, cancers digestifs…) aux cancers de la prostate dans certaines familles, suggérant en cela l’existence de gènes de prédisposition communs [16].
Le risque de cancer prostatique est 1,4 fois plus élevé chez les hommes apparentés au premier et au deuxième degré à une femme présentant un cancer du sein. La comparaison des taux de mortalité de ces deux cancers montre une certaine corrélation, avec un rapport de 0,6 entre leur taux de mortalité, chiffre assez constant d’un pays à l’autre. Les gènes BRCA1 (breast cancer gene) (17q21) et BRCA2 (13q12-13), qui prédisposent au cancer du sein héréditaire, ont également été évoqués pour le cancer de la prostate. Aucune analyse de liaison n’a cependant, à ce jour, confirmé une prédisposition commune aux deux cancers. Actuellement, seule une famille où s’agrégeaient des cancers du sein et de la prostate a été rapportée, avec une mutation 185delAG de BRCA1. Cependant, dans les familles avec cancers du sein et de la prostate avant l’âge de 55 ans, des mutations de BRCA2 sont clairement identifiées, en particulier dans la région OCCR (ovarian cancer-cluster region) impliquée dans le risque d’association au cancer de l’ovaire située dans l’exon 11. Des mutations germinales de BRCA2 sont retrouvées chez 2 % des hommes atteints d’un cancer de la prostate avant l’âge de 55 ans [17, 18]. La proportion de cancers de la prostate héréditaires en rapport avec une mutation de BRCA2 reste cependant peu fréquente (moins de 5 % des formes de cancers de la prostate familiaux), expliquant probablement leur absence de mise en évidence dans les analyses de liaison.
L’association entre cancer de la prostate et tumeur cérébrale a été confirmée par la localisation du gène CAPB (cancer prostate and brain), situé en 1p36, prédisposant à ces deux tumeurs.
Enfin, une étude finlandaise a mis en évidence une élévation significative du risque de cancer gastrique dans la généalogie de patients présentant un début précoce de cancer prostatique (âge au diagnostic < 55 ans). Dans les familles concernées, la recherche de mutations germinales du gène de la cadhérine E, prédisposant à certaines formes familiales de cancer de l’estomac, n’a cependant pas retrouvé d’association avec le cancer de la prostate [19].
Hérédité multifactorielle et facteurs de risques associés aux polymorphismes génétiques
L’incidence standardisée pour 100 000 habitants du cancer clinique de la prostate, estimée à 56 en France, varie de 2 en Chine à 100 pour les Afro-américains. Pour expliquer les variations d’incidence selon les pays et les ethnies, des facteurs génétiques et épigénétiques ont été évoqués, sans qu’aucun facteur mésologique n’ait pu être incriminé avec une absolue certitude.
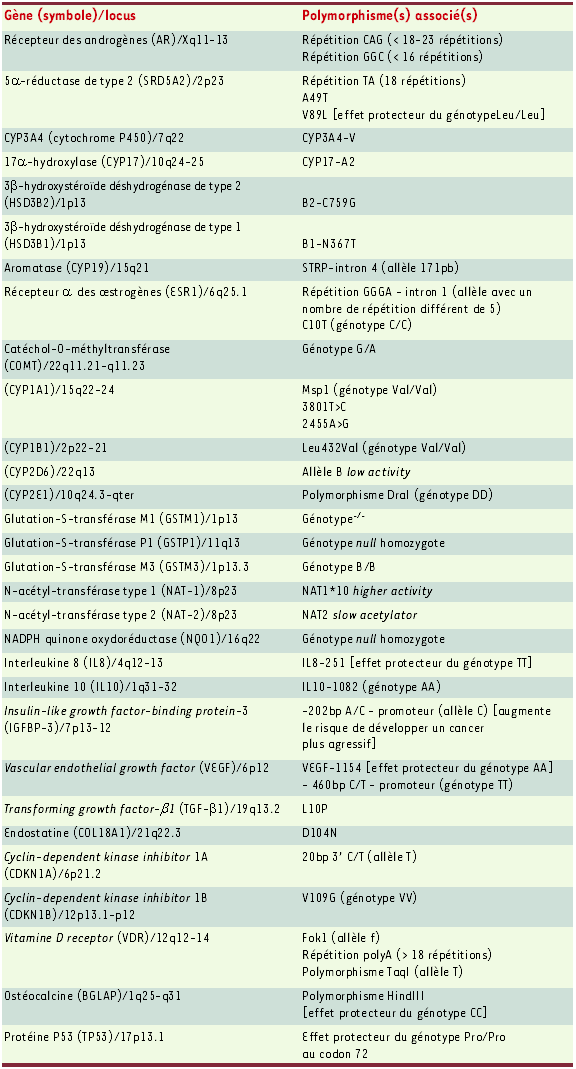
Aucune cause étiologique d’origine alimentaire ou liée à l’environnement n’a pu à ce jour être formellement identifiée. Certains facteurs endogènes (concentrations de testostérone, d’IGF1 [insulin-like growth factor] ou de vitamine D circulante) et polymorphismes génétiques ont été associés à un risque individuel ou familial accru de cancer de la prostate ; ils pourraient expliquer les importantes variations d’incidence observées entre populations, ainsi que certaines agrégations familiales. Ces polymorphismes concernent avant tout des gènes impliqués dans la régulation hormonale (stéroïdes) et le développement de la prostate, mais aussi dans le métabolisme des carcinogènes. Quelques études ont tenté d’identifier des associations entre un risque accru de cancer de la prostate et des polymorphismes de gènes impliqués dans différents mécanismes de la carcinogenèse tels que l’inflammation, l’angiogenèse ou le contrôle du cycle cellulaire (Tableau II) [4].
Tableau II
Polymorphismes génétiques associés au cancer de la prostate.
Métabolisme des androgènes et des oestrogènes et polymorphismes génétiques
Le rôle des androgènes dans le développement de la prostate, mais aussi dans la promotion des cancers de la prostate, est largement établi depuis les travaux de Huggins dans les années 1940 : il est à la base du traitement hormonal de ce cancer. Une des fonctions importantes du récepteur des androgènes est d’activer l’expression de gènes cibles contrôlant la différenciation et la prolifération des cellules prostatiques. L’activation du récepteur des androgènes par ses ligands dépend de leur concentration et de leur type. Les concentrations d’androgènes actifs dans la prostate sont déterminées par la concentration d’androgènes circulants d’origine testiculaire, essentiellement, et à un moindre degré surrénalienne, mais aussi par la transformation intraprostatique d’androgènes à partir des précurseurs androgéniques circulants. Ainsi, la testostérone circulante est métabolisée dans la prostate en dihydrotestostérone, 10 fois plus active sur le récepteur des androgènes que la testostérone, par l’enzyme 5α-réductase de type 2. Des inhibiteurs de cette enzyme sont d’ailleurs proposés en thérapeutique dans le traitement de l’hypertrophie bénigne prostatique et dans la prévention du cancer de la prostate.
L’aromatisation périphérique de la testostérone en oestrogènes et l’augmentation du rapport oestrogènes/testostérone au cours du climatère (baisse de la fonction gonadique) masculin a également suggéré que les oestrogènes pourraient jouer un rôle dans la carcinogenèse prostatique. Sur ce sujet, les données restent encore incomplètes et parfois contradictoires. En effet, le métabolisme des oestrogènes, sous l’action des enzymes CYP1A1 (cytochrome P450), CYP1B1 et CYP3A4, en hydroxyoestrogènes, qui sont des composés génotoxiques (en particulier pour la forme 4-hydroxy-), est en faveur d’un effet carcinogène de l’élévation des concentrations d’oestrogènes avec l’âge. Cependant, l’activation du récepteur β des oestrogènes par ses ligands régulerait négativement le récepteur des androgènes et est à l’origine d’essais de prévention des cancers de la prostate par des Serm (selective estrogen receptor modulator) tels que le tamoxifène.
Dans ce contexte biologique, la recherche de polymorphismes associés au risque de cancer de la prostate a porté sur les enzymes clés du métabolisme des androgènes et des oestrogènes, ainsi que sur les récepteurs de ces hormones [20, 21] (Tableau II).
L’activité transcriptionnelle du récepteur des androgènes (AR) est déterminée par sa région aminoterminale. Ce domaine transcriptionnel est codé par l’exon 1 contenant des répétitions CAG et GGC. Un petit nombre de répétitions CAG (< 18-23) ou GGC (< 16), correspondant à un haut niveau de transactivation du récepteur AR, a été associé à une augmentation du risque de développer un cancer de la prostate dans différentes études. Deux études ont montré que la prévalence des allèles courts (petit nombre de répétitions CAG et GGC) est élevée chez les Afro-Américains [22, 23].
Un autre polymorphisme génétique fréquemment retrouvé dans les populations afro-américaines a été associé au risque de cancer de la prostate. Ce polymorphisme concerne le gène de l’enzyme 5α-réductase de type 2 (SRD5A2). Il a été identifié au niveau de son dernier exon (région 3’ transcrite mais non traduite) sous forme de dinucléotides TA répétés 0, 9 ou 18 fois. Du fait de la localisation du polymorphisme, la variation des répétitions de TA ne devrait modifier ni la structure ni la fonction de l’enzyme. En revanche, elle pourrait modifier la régulation de sa production et conférer ainsi une susceptibilité individuelle accrue aux personnes ayant des allèles (TA)18. Ces derniers sont retrouvés quasi exclusivement dans les populations afro-américaines, et n’ont été observés en France que chez des sujets originaires des Antilles. Au niveau de l’exon 1, deux autres variants génétiques modifieraient l’activité de la 5α-réductase de type 2. Le variant A49T, qui augmente l’activité enzymatique, est associé à un risque de cancer de la prostate et de récurrence tumorale après traitement chirurgical. Sa fréquence a été estimée jusqu’à 14 % dans un groupe de patients afro-américains porteur d’un cancer de la prostate, et à environ 6 % des sujets atteints et des témoins de la population française (sujets caucasiens). Les sujets homozygotes pour le second variant identifié, V89L (plus fréquent dans les populations asiatiques), auraient moins de risque de développer un cancer de la prostate. Nous n’avons pas retrouvé cet effet protecteur dans une population française, caucasienne, où la fréquence des homozygotes était de 10 %.
La recherche d’une susceptibilité pour le cancer de la prostate a porté également sur plusieurs gènes candidats impliqués dans le métabolisme, la synthèse ou la sensibilité aux androgènes. L’enzyme CYP3A4 est impliquée dans le métabolisme des androgènes par l’oxydation de la testostérone en 2β, 6β ou 15β-hydroxytestostérone : un polymorphisme situé au niveau de la partie 5’ régulatrice du gène, nommé CYP3A4-V, serait associé aux adénocarcinomes prostatiques de grade et de stade supérieurs à ceux retrouvés en présence de l’allèle non muté [24]. De même, un polymorphisme associé aux gènes codant pour les enzymes CYP17 (17α-hydroxylase, variant CYP17-A2) et HSD3B1 et B2 (3β-hydroxystéroïde déshydrogénases de type 1 et type 2, variants B1-N367T et B2-C759G), impliquées dans la synthèse de la testostérone, a été associé à un risque accru de cancer de la prostate [25, 26].
À l’instar du cancer du sein, les variants génétiques impliqués dans le métabolisme des oestrogènes pourraient être en cause dans la carcinogenèse prostatique. Récemment, nous avons montré une augmentation du risque de cancer de la prostate associée au polymorphisme (allèle 171bp, STRP-intron 4) du gène codant pour le CYP19 (aromatase), impliqué dans la synthèse des oestrogènes, et du variant (répétition GGGA-intron 1) du gène du récepteur α des oestrogènes [27, 28]. De plus, quelques études ont suggéré que le polymorphisme du gène codant pour le CYP1B1, principale enzyme à l’origine des 4-hydroxy-oestrogènes, était également associé à un risque accru de cancer de la prostate [29].
Métabolisme des carcinogènes, inflammation, différenciation/prolifération cellulaire et polymorphismes génétiques
Ces variants génétiques potentiellement impliqués dans le risque de développer un cancer de la prostate, et identifiés par le biais d’études cas-témoins, sont présentés dans le Tableau II. Parmi ceux-ci, les polymorphismes du gène du récepteur de la vitamine D et des glutathion-S transférases (GST) ont été particulièrement étudiés.
Aux États-Unis, le taux de mortalité par cancer de la prostate est marqué par un gradient décroissant nord-sud. Ce gradient est ainsi corrélé au niveau de radiation UV, laissant supposer qu’une exposition basse aux rayons UV est un facteur de risque pour ce cancer : or une majeure partie des besoins de l’organisme en vitamine D, qui a des propriétés antitumorales, est synthétisée par la peau grâce aux radiations UV. Certaines études ont suggéré que des métabolites, ainsi que des analogues de la vitamine D, pourraient modifier la croissance de certains cancers. Par ailleurs, le gène VDR (vitamine D receptor) possède deux formes alléliques f et F qui présentent (allèle f) ou non (allèle F) le site de restriction Fok 1, et donnent naissance respectivement à un récepteur tronqué de trois acides aminés et à un récepteur intact. La prévalence de l’allèle f dans les populations européennes caucasiennes est plus élevée que dans les populations africaines. Une association entre le polymorphisme Fok I (allèle f) et le cancer de la prostate a été retrouvée dans une population de sujets caucasiens, d’origine française ou allemande [30].
Parmi les polymorphismes concernant les gènes impliqués dans le métabolisme des carcinogènes [31], les principales associations concernent les allélotypes déterminant des phénotypes fonctionnels présentant soit une diminution ou une absence d’activité enzymatique (allèle B du gène CYP2D6 et phénotype poor metabolizer [PM] et génotypes homozygotes pour l’allèle null de la GSTP1), soit une augmentation de l’activité enzymatique (allèle NAT1*10 et phénotype higher acetylor pour la N-acétyl-transférase).
Conclusions
Les déterminants génétiques et leurs interactions avec les facteurs environnementaux sont évidents dans la genèse du cancer de la prostate [32, 33]. Leur connaissance par une approche génétique est le fondement de nouvelles stratifications des candidats au dépistage du cancer de la prostate [34] et de nouvelles approches chimiopréventives [35].
Parties annexes
Références
- 1. http://www-dep.iarc.fr, 2000.
- 2. Labrie F, Candas B, Dupont A, et al. Screening decreases prostate cancer death : First analysis of the 1988 Quebec prospective randomized controlled trial. Prostate 1999 ; 38 : 83-91.
- 3. Cussenot O, Valeri A. Heterogeneity in genetic susceptibility to prostate cancer. Eur J Intern Med 2001 ; 12 : 11-6.
- 4. Cussenot O, Fournier G. Génétique et urologie. Paris : les Éditions Vingt et un. Progrès en Urologie 2000 : 417p.
- 5. Morganti G, Gianferrari L, Cresseri A, et al. Recherches clinico-statistiques et génétiques sur les néoplasies de la prostate. Acta Genet Stat Med 1956 ; 6 : 304-5.
- 6. Grönberg H, Damber L, Damber JE. Studies of genetic factors in prostate cancer in twin population. J Urol 1994 ; 152 : 1484-9.
- 7. Schaid DJ, McDonnell SK, Blute ML, et al. Evidence for autosomal dominant inheritance of prostate cancer. Am J Hum Genet 1998 ; 62 : 1425-38.
- 8. Carter BS, Beaty TH, Steinberg GD, et al. Mendelian inheritance of familial prostate cancer. Proc Natl Acad Sci USA 1992 ; 89 : 3367-71.
- 9. Xu J and the International consortium for prostate cancer genetics. Combined analysis of hereditary prostate cancer linkage to 1q24-25 : results from 772 hereditary prostate cancer families from the International consortium for prostate cancer genetics. Am J Hum Genet 2000 ; 66 : 945-57.
- 10. Berthon P, Valeri A, Cohen-Akenine A, et al. Predisposing gene for early-onset prostate cancer, localized on chromosome 1q42.2-43. Am J Hum Genet 1998 ; 62 : 1416-24.
- 11. Cancel-Tassin G, Latil A, Valeri A, et al. PCAP is the major known prostate cancer predisposing locus in families from south and west Europe. Eur J Hum Genet 2001 ; 9 : 135-42.
- 12. Karayi MK, Neal DE, Markham AF. Current status of linkage studies in hereditary prostate cancer. BJU Int 2000 ; 86 : 659-69.
- 13. Valeri A, Azzouzi R, Drelon E, et al. Early-onset hereditary prostate cancer is not associated with specific clinical biological features. Prostate 2000 ; 45 : 66-71.
- 14. Goode EL, Stanford JL, Peters MA, et al. Clinical characteristics of prostate cancer in an analysis of linkage to four putative susceptibility loci. Clin Cancer Res 2001 ; 7 : 2739-49.
- 15. Bratt O. Hereditary prostate cancer : Clinical aspects. J Urol 2002 ; 168 : 906-13.
- 16. Valeri A, Fournier G, Morin V, et al. Early onset and familial predisposition to prostate cancer significantly enhance the probability for breast cancer in first degree relatives. Int J Cancer 2000 ; 86 : 883-7.
- 17. Edwards SM, Kote-Jarai Z, Meitz J, et al. Two percent of men with early-onset prostate cancer harbor germline mutations in the BRCA2 gene. Am J Hum Genet 2003 ; 72 : 1-12.
- 18. Gayther SA, de Foy KA, Harrington P, et al. The frequency of germ-line mutations in the breast cancer predisposition genes BRCA1 and BRCA2 in familial prostate cancer. The cancer research campaign/British prostate group united kingdom familial prostate cancer study collaborators. Cancer Res 2000 ; 60 : 4513-8.
- 19. Jonsson BA, Bergh A, Stattin P, et al. Germline mutations in E-cadherin do not explain association of hereditary prostate cancer, gastric cancer and breast cancer. Int J Cancer 2002 ; 98 : 838-43.
- 20. Ross RK, Pike MC, Coetzee GA, et al. Androgen metabolism and prostate cancer : Establishing a model of genetic susceptibility. Cancer Res 1998 ; 58 : 4497-504.
- 21. Bosland MC. The role of steroid hormones in prostate carcinogenesis. J Natl Cancer Inst Monogr 2000 ; 27 : 39-66.
- 22. Irvine RA, Yu MC, Ross RK, et al. The CAG and GGC microsatellites of the androgen receptor gene are in linkage disequilibrium in men with prostate cancer. Cancer Res 1995 ; 55 : 1937-40.
- 23. Edwards A, Hammond HA, Jin L, et al. Genetic variation at five trimeric and tetrameric tandem repeat loci in four human population groups. Genomics 1992 ; 12 : 241-53.
- 24. Rebbeck TR, Jaffe JM, Walker AH, et al. Modification of clinical presentation of prostate tumors by a novel genetic variant in CYP3A4. J Natl Cancer Inst 1998 ; 90 : 1225-9.
- 25. Lunn RM, Bell DA, Mohler JL, et al. Prostate cancer risk and polymorphism in 17 hydroxylase (CYP17) and steroid reductase (SRD5A2). Carcinogenesis 1999 ; 20 : 1727-31.
- 26. Chang BL, Zheng SL, Hawkins GA, et al. Joint effect of HSD3B1 and HSD3B2 genes is associated with hereditary and sporadic prostate cancer susceptibility. Cancer Res 2002 ; 62 : 1784-9
- 27. Latil A, Azzouzi R, Cancel G, et al. Prostate carcinoma risk and allelic variants of genes involved in androgen biosynthesis and metabolism pathways. Cancer 2001 ; 92 : 1130-7.
- 28. Cancel-Tassin G, Latil A, Rousseau F, et al. Association study of polymorphisms in the human estrogen receptor alpha gene and prostate cancer risk. Eur Urol 2003 ; 44 : 487-90.
- 29. Tang YM, Green BL, Chen GF, et al. Human CYP1B1 Leu432Val gene polymorphism : ethnic distribution in African-Americans, Caucasians and Chinese ; oestradiol hydroxylase activity ; and distribution in prostate cancer cases and controls. Pharmacogenetics 2000 ; 10 : 761-6.
- 30. Correa-Cerro L, Berthon P, Haussler J, et al. Vitamin D receptor polymorphisms as markers in prostate cancer. Human Genet 1999 ; 105 : 281-7.
- 31. Reszka E, Wasowicz W. Genetic polymorphism of N-acetyltransferase and glutathione S-transferase related to neoplasm of genitourinary system. Neoplasma 2002 ; 49 : 209-16.
- 32. Simard J, Dumont M, Soucy P, et al. Perspective : prostate cancer susceptibility genes. Endocrinology2002 ; 143 : 2029-40.
- 33. Nwosu V, Carpten J, Trent JM, et al. Heterogeneity of genetic alterations in prostate cancer : Evidence of the complex nature of the disease. Hum Mol Genet 2001 ; 10 : 2313-8.
- 34. Valeri A, Cormier L, Moineau MP, et al. Targeted screening for prostate cancer in high risk families : Early onset is a significant risk factor for disease in first degree relatives. J Urol 2002 ; 168 : 483-7.
- 35. Novelli G, Margiotti K, Sangiuolo F, et al. Pharmacogenetics of human androgens and prostatic diseases. Pharmacogenomics 2001 ; 2 : 65-72.
Liste des figures
Figure 1
Critères cliniques de reconnaissance des formes héréditaires de cancer de la prostate.
Liste des tableaux
Tableau I
Cancers héréditaires de la prostate.
Tableau II
Polymorphismes génétiques associés au cancer de la prostate.