Corps de l’article
La tuberculose reste un problème majeur de santé publique. En effet, Mycobacterium tuberculosis, la bactérie responsable de cette maladie, cause environ un million et demi de morts chaque année et l’on estime qu’un tiers de la population mondiale est porteur du bacille sous forme d’infections latentes [1].
L’appareil respiratoire constitue la principale voie d’entrée du bacille dans l’organisme, M. tuberculosis ayant la capacité de résister à la dégradation par les macrophages (Mf) alvéolaires, et même de se multiplier à l’intérieur de ces cellules [2]. Pour entrer dans les Mf, M. tuberculosis utilise principalement le récepteur au complément de type 3 (CR3), en association avec d’autres molécules comme le CR4 et le récepteur au mannose (MR). Un autre type de cellules phagocytaires, les cellules dendritiques (CD), joue un rôle immunitaire primordial au cours de la tuberculose. Par leur localisation près des muqueuses et de la peau, elles sont idéalement placées pour rencontrer les agents infectieux et expriment à leur surface de nombreux récepteurs de phagocytose. Une fois infectées, les CD entrent dans un processus irréversible de maturation et migrent vers les ganglions lymphatiques où elles activent les lymphocytes T naïfs qui sont spécifiques des antigènes de l’agent infectieux ingéré [3]. De nombreux pathogènes, comme le virus de l’immunodéficience humaine (VIH), exploitent les propriétés migratoires uniques des CD pour disséminer dans l’hôte vers les organes lymphoïdes secondaires, comme les ganglions lymphatiques. Il est de plus en plus clair que M. tuberculosis pourrait faire de même.
En collaboration avec les équipes de P. Lagrange et J.C. Gluckman à l’Hôpital Saint-Louis à Paris, nous avons récemment montré que M. tuberculosis se lie aux CD humaines par le récepteur de surface DC-SIGN/CD209] [4] (Figure 1). DC-SIGN (pour dendritic cell-specific intercellular adhesion molecule-3 (ICAM-3) grabbing nonintegrin) est une lectine de type C qui a été décrite initialement comme spécifique des CD et pouvant lier la protéine gp120 du VIH [5] ((→) m/s 2000, n° 10, p. 1121). Les CD expriment aussi le CR3 et le MR, mais ces derniers semblent ne jouer aucun rôle dans l’attachement de M. tuberculosis à ces cellules. In vivo, plusieurs arguments suggèrent que DC-SIGN pourrait avoir un rôle important au cours de la tuberculose. En particulier, des antigènes mycobactériens ont été détectés dans des CD exprimant DC-SIGN, dans les ganglions lymphatiques de patients tuberculeux. On peut penser qu’in vivo, après infection et activation, les CD emportent des mycobactéries lors de leur migration vers les ganglions lymphatiques où les bacilles pourraient persister. Une autre mycobactérie à croissance lente, la souche vaccinale Mycobacterium bovis BCG s’attache à DC-SIGN. En revanche des bactéries à Gram positif ou négatif, comme celles des genres Listeria et Salmonella, ainsi que des mycobactéries saprophytes telles Mycobacterium smegmatis ou Mycobacterium fortuitum ne sont pas reconnues par DC-SIGN. En collaboration avec l’équipe de G Puzo du Cnrs à Toulouse, nous avons montré que cette spécificité de reconnaissance repose sur la nature du ligand mycobactérien reconnu par DC-SIGN, un motif oligo-mannosylé de l’extrémité d’un lipoglycane abondant de l’enveloppe de M. tuberculosis, le lipoarabinomannane (LAM) [6] ((→) m/s 2000, n° 6-7, p. 842). Ce motif est absent ou modifié dans les souches saprophytes ou d’autres souches mycobactériennes à croissance lente n’appartenant pas au complexe tuberculosis (comme Mycobacterium avium). DC-SIGN permettrait ainsi au système immunitaire de faire la différence entre des mycobactéries virulentes et des mycobactéries saprophytes ou opportunistes [6, 7].
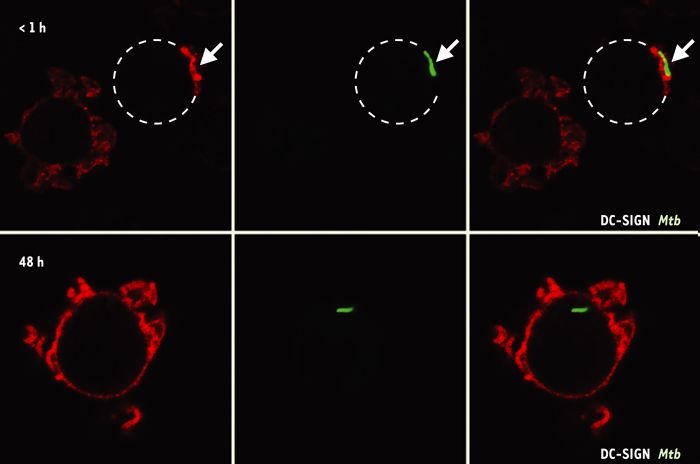
Figure 1
M. tuberculosis pénétre dans les cellules dentritiques (CD) par DC-SIGN.
Après s’être attachée à la protéine DC-SIGN (rouge) qui se concentre au point de contact entre la CD (pointillé) et la bactérie (vert), cette dernière est rapidement phagocytée (flèche sur le panel supérieur). Lorsque le phagosome est formé (panel inférieur), la protéine DC-SIGN recircule à la surface cellulaire et est exclue de la vacuole.
L’entrée de M. tuberculosis dans les Mf et les CD par des récepteurs différents pourrait expliquer le devenir différent du bacille dans les deux types cellulaires. En effet nous avons récemment montré qu’à l’inverse de ce qui est observé dans les Mf, M. tuberculosis ne se multiplie pas dans les CD humaines [8]. Ceci pourrait s’expliquer par l’adressage différentiel de M. tuberculosis dans les deux types cellulaires: dans les CD uniquement, le phagosome mycobactérien est déconnecté des voies de recyclages et de biosynthèse cellulaires, privant probablement le bacille de nutriments essentiels à sa croissance. Sur la base de l’ensemble de ces résultats, on peut donc imaginer qu’au cours de l’évolution, les CD ont développé des mécanismes spécifiques pour contrôler la croissance mycobactérienne tout en maintenant la bactérie vivante, une propriété dont on sait qu’elle permet une meilleure présentation antigénique aux lymphocytes [9]. Mais à l’inverse, on peut supposer que les mycobactéries du complexe tuberculosis ont évolué pour utiliser les CD comme un cheval de Troie afin de disséminer dans l’organisme et d’atteindre les ganglions lymphatiques. Ceci a été suggéré pour le VIH, et pourrait expliquer certaines manifestations cliniques de la tuberculose comme l’adénite médiastinale ou la formation de granulomes secondaires dans les ganglions. De plus, la liaison du LAM de M. tuberculosis à DC-SIGN induit la sécrétion d’interleukine-10 par les CD et la désactivation, au moins partielle, de ces cellules [7]. L’infection mycobactérienne directe des CD par le biais de DC-SIGN pourrait donc avoir des effets anti-inflammatoires et immunosuppresseurs importants, ce qui pourrait être préjudiciable au déclenchement d’une réponse immunitaire efficace, mais bénéfique pour le microbe. L’infection à M. tuberculosis induit pourtant une réponse immunitaire contre certains antigènes mycobactériens. On peut penser que cela est permis grâce à l’ingestion par les CD de cellules déjà infectées, apoptotiques par exemple.
La découverte que DC-SIGN est le récepteur majeur de M. tuberculosis à la surface des CD ouvre de nouvelles perspectives thérapeutiques. L’injection à des patients de ligands solubles de DC-SIGN empêcherait-elle la persistence mycobactérienne ou la dissémination dans l’organisme, ou au contraire serait-elle néfaste pour le déclenchement d’une réponse immunitaire anti-mycobactérienne efficace? Il est urgent de répondre à ces questions pour développer de nouvelles stratégies de lutte contre la tuberculose.
Parties annexes
Remerciements
Nos travaux sont financés par l’Institut Pasteur et par le programme de recherche de l’Union Européenne TB Vaccine Cluster.
Références
- 1. Kaufmann SH. How can immunology contribute to the control of tuberculosis? Nat Rev Immunol 2001; 1:20-30.
- 2. Russell DG. Mycobacterium tuberculosis: here today, and here tomorrow. Nat Rev Mol Cell Biol 2001; 2: 569-77.
- 3. Pulendran B, Palucka K, Banchereau J. Sensing pathogens and tuning immune responses. Science 2001; 293: 253-6.
- 4. Tailleux L, Schwartz O, Herrmann JL, et al. DC-SIGN is the major Mycobacterium tuberculosis receptor on human dendritic cells. J Exp Med 2003; 197: 121-7.
- 5. Curtis BM, Scharnowske S, Watson AJ. Sequence and expression of a membrane-associated C-type lectin that exhibits CD4-independent binding of human immunodeficiency virus envelope glycoprotein gp120. Proc Natl Acad Sci USA 1992; 89: 8356-60.
- 6. Maeda N, Nigou J. Herrmann JL et al. The cell surface receptor DC-SIGN discriminates between Mycobacterium species through selective recognition of the mannose caps on lipoarabinomannan. J Biol Chem 2003; 278: 5513-6.
- 7. Geijtenbeek TB, Van Vliet SJ, Koppel EA, et al. Mycobacteria target DC-SIGN to suppress dendritic cell function. J Exp Med 2003; 197: 7-17.
- 8. Tailleux L, Neyrolles O, Honore-Nouakline S, et al. Constrained intracellular survival of Mycobacterium tuberculosis in human dendritic cells. J Immunol 2003; 170: 1939-48.
- 9. Neyrolles O, Gould K, Gares MP, et al. Lipoprotein access to MHC class I presentation during infection of murine macrophages with live mycobacteria. J Immunol 2001; 166: 447-57.
Liste des figures
Figure 1
M. tuberculosis pénétre dans les cellules dentritiques (CD) par DC-SIGN.
Après s’être attachée à la protéine DC-SIGN (rouge) qui se concentre au point de contact entre la CD (pointillé) et la bactérie (vert), cette dernière est rapidement phagocytée (flèche sur le panel supérieur). Lorsque le phagosome est formé (panel inférieur), la protéine DC-SIGN recircule à la surface cellulaire et est exclue de la vacuole.