Corps de l’article
Au cours du développement, la répartition de déterminants spécifiques dans les cellules est un mécanisme fondamental de la diversification. En effet, ce mécanisme permet de déterminer un groupe de cellules à devenir un organe ou une cellule assurant une fonction bien spécifique. Un travail remarquable chez le mollusque aquatique Ilyanassa obsoleta a permis de mettre en évidence récemment un rôle du centrosome dans la ségrégation asymétrique d’ARNm codant pour des facteurs essentiels au développement de cet animal [1]. Ces travaux devraient ouvrir la voie à la compréhension des rôles essentiels du centrosome dans le développement et la différenciation.
Les mécanismes de création de la diversité cellulaire qui caractérise les organismes complexes ont toujours fasciné bon nombre de chercheurs. Comment, à partir d’une cellule unique - l’oeuf fécondé - obtenir la multitude de cellules différenciées qui composent un embryon puis un individu? Pour ce faire, la cellule doit disposer de moyens de répartir de façon asymétrique dans sa descendance des facteurs spécifiques pour assurer qu’une cellule A ne produit pas deux cellules A, mais une cellule B et une cellule C. Chaque cellule fille B et C est alors programmée par les facteurs distribués de façon asymétrique au cours de la division cellulaire, permettant à chacune d’évoluer vers une destinée qui lui est propre.
L’étude d’organismes eucaryotes invertébrés a permis d’identifier et de comprendre certains des mécanismes de base qui assurent cette distribution asymétrique de facteurs de détermination ((→) m/s 2000, n° 10, p. 1092). Avant que la publication de Nature n’implique le centrosome [1] deux mécanismes avaient été identifiés. Le premier fait intervenir des fibres d’actine qui transportent des ARNm et les répartissent de façon à ce qu’ils ne se trouvent que dans une seule des futures cellules filles. Ce premier mécanisme est utilisé chez la levure bourgeonnante pour piéger certains ARNm dans le bourgeon de la cellule fille. Le deuxième mécanisme suggère que des facteurs protéiques sont piégés de manière différentielle vers le cortex des futures cellules. Cela est le cas, par exemple, au cours des divisions dans le système nerveux de la drosophile où des protéines impliquées dans la détermination des cellules filles sont sélectivement recrutées vers un pôle de la cellule ((→) m/s 2000, n° 10, p. 1092). Dans les deux cas, les microfilaments d’actine jouent un rôle essentiel et le fuseau mitotique, par son orientation, et la cytocinèse, achèvent de sceller la répartition asymétrique de ces déterminants dans les cellules filles [4, 8]. Il est néanmoins possible que ces 2 mécanismes encore mal caractérisés fassent intervenir des gènes orthologues.
C’est en s’intéressant au comportement d’ARNm spécifiques impliqués dans la spécification de l’axe antéro-postérieur de I. obsoleta, qu’une équipe Américaine de l’Université de Tucson (Arizona) vient probablement de mettre en évidence un troisième et nouveau mécanisme. En étudiant les toutes premières divisions embryonnaires de l’animal, les auteurs ont découvert que certains ARN messagers, impliqués dans la spécification de l’axe antéro-postérieur de l’animal, sont séquestrés autour d’un seul centrosome puis répartis dans une seule des cellules filles lors de la mitose. Plus précisément, la ségrégation asymétrique des ARNm s’effectue en deux temps. Tout d’abord, les ARNm sont recrutés spécifiquement au niveau d’un seul centrosome durant l’interphase. La responsabilité des microtubules à cette étape du processus est attestée par l’inhibition du recrutement de ces ARNm au niveau des centrosomes en présence de drogues dépolymérisant les microtubules comme le nocodazole. En revanche, ils ne sont pas requis pour le maintien des ARNm sur les centrosomes. Les ARNm recrutés au niveau du centrosome sont ensuite transportés vers une zone limitée du cortex cellulaire durant la prophase, de manière à ce qu’au cours de la division cellulaire, ils ne se distribuent que dans une seule des deux cellules filles. Ce processus est fortement inhibé par la cytochalasine B, un inhibiteur du réseau d’actine; il est donc probable que le réseau d’actine intracellulaire soit nécessaire au mouvement des ARNm du centrosome vers le cortex. Une fois fixés à ces sites particuliers au niveau du cortex, ces ARNm y demeurent, et la cytochalasine est alors sans effet, éliminant un rôle du réseau d’actine dans cette fixation. Il y aurait donc selon les auteurs de ce travail, un mouvement en deux temps pour ces ARNm essentiels à la différenciation de certaines cellules: (1) ciblage des ARN au niveau des centrosomes via leur transport sur les microtubules; (2) dépôt des ARNm sur des sites particuliers au niveau du cortex cellulaire, via des fibres d’actine. La chronologie de ce processus semble être aussi essentielle puisque le recrutement des ARNm et leur distribution prennent place en début de mitose.
La localisation des ARNm sur un seul des centrosomes suggère que les deux centrosomes ne sont pas équivalents. De fait, les auteurs montrent que, dans une cellule dont on inhibe la cytokinèse et qui contient donc deux noyaux et quatre centrosomes, les ARNm sont localisés au niveau de deux centrosomes seulement. Il est donc fort probable que lors de chaque cycle cellulaire, et de la réplication des centrosomes, la propriété de liaison des ARNm est transmise par le centrosome compétent à sa descendance, ce qui n’est pas le cas pour l’autre, perpétuant ainsi la dissymétrie entre les deux centrosomes. Une telle idée n’est pas nouvelle puisque chez la levure bourgeonnante Saccharomycescerevisiae, le fuseau mitotique s’oriente vers le bourgeon durant la phase G2 du cycle cellulaire, et c’est toujours le centrosome (SPB) paternel qui s’oriente vers le bourgeon. De plus, des données récentes suggèrent que chacun des deux centrosomes possède une identité différente [9-11] ((→) m/s 2003, n° 3, p. 259).
Le centrosome a longtemps été considéré uniquement comme un centre organisateur des microtubules et du fuseau mitotique. L’idée que les centrosomes possèdent une identité propre au sein de la cellule et contrôlent des fonctions essentielles comme la distribution des facteurs de différenciation cellulaire est une étape importante vers une meilleure connaissance des mécanismes de développement et du cycle cellulaire.
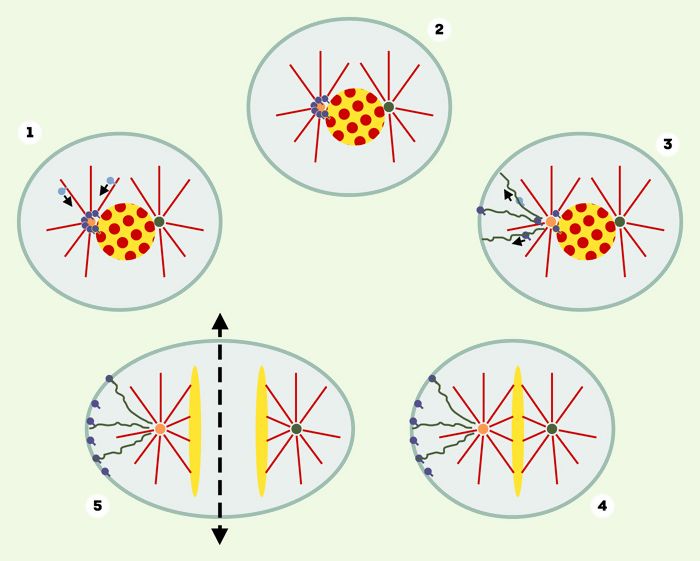
Figure 1
Ségrégation asymétrique d’ARNm impliqués dans la mise en place de l’axe antéro-postérieur.
1 et 2. Durant la prophase, certains ARNm liés à des facteurs protéiques (représentés en bleu) sont transportés vers un des centrosomes uniquement (cercle jaune) via les microtubules (rouges). Le centrosome symbolisé par un cercle vert n’est pas compétent pour « piéger » les ARNm. La localisation autour du matériel péri-centrosomal persiste en l’absence de microtubules. 3. Les complexes ARNm/protéines sont ensuite transportés via le cytosquelette d’actine (représenté en vert) jusqu’à une zone particulière du cortex cellulaire. 4. Une fois correctement localisés, les ARNm sont « piégés » indépendamment de l’actine. 5. Lors de la division cellulaire, les ARNm seront distribués de façon asymétrique dans une seule des cellules filles. Cela permettra l’évolution de chacune des cellules filles vers une destinée différente.
Parties annexes
Références
- 1. Lambert JD, Nagy LM. Asymmetric inheritance of centrosomally localized mRNAs during embryonic cleavages. Nature 2002; 420: 682-6.
- 2. Paoletti A, Bornens M. Organisation and functional regulation of the centrosome in animal cells. Prog Cell Cycle Res 1997; 3: 285-99.
- 3. Bornens M. Centrosome composition and microtubule anchoring mechanisms. Curr Opin Cell Biol 2002; 14: 25-34.
- 4. Boyd L, Guo S, Levitan D, Stinchcomb DT, Kemphues KJ. PAR-2 is asymmetrically distributed and promotes association of P granules and PAR-1 with the cortex in C. elegans embryos. Development 1996; 122: 3075-84.
- 5. Long RM, Singer RH, Meng X, Gonzalez I, Nasmyth K, Jansen RP. Mating type switching in yeast controlled by asymmetric localization of ASH1 Mrna. Science 1997; 277: 383-7.
- 6. Lu B, Ackerman L, Jan LY, Jan YN. Modes of protein movement that lead to the asymmetric localization of partner of Numb during Drosophila neuroblast division. Mol Cell 1999; 4: 883-91.
- 7. Spana EP, Doe CQ. The prospero transcription factor is asymmetrically localized to the cell cortex during neuroblast mitosis in Drosophila. Development 1995; 121: 3187-95.
- 8. Takizawa PA, Sil A, Swedlow JR, Herskowitz I, Vale RD. Actin-dependent localization of an RNA encoding a cell-fate determinant in yeast. Nature 1997; 389: 90-3.
- 9. Segal M, Bloom K. Control of spindle polarity and orientation in Saccharomyces cerevisiae. Trends Cell Biol 2001; 11: 160-6.
- 10. Piel M, Meyer P, Khodjakov A, Rieder CL, Bornens M. The respective contributions of the mother and daughter centrioles to centrosome activity and behavior in vertebrate cells. J Cell Biol 2000; 149: 317-30.
- 11. Piel M, Nordberg J, Euteneuer U, Bornens M. Centrosome-dependent exit of cytokinesis in animal cells. Science 2001; 291: 1550-3.
Liste des figures
Figure 1
Ségrégation asymétrique d’ARNm impliqués dans la mise en place de l’axe antéro-postérieur.
1 et 2. Durant la prophase, certains ARNm liés à des facteurs protéiques (représentés en bleu) sont transportés vers un des centrosomes uniquement (cercle jaune) via les microtubules (rouges). Le centrosome symbolisé par un cercle vert n’est pas compétent pour « piéger » les ARNm. La localisation autour du matériel péri-centrosomal persiste en l’absence de microtubules. 3. Les complexes ARNm/protéines sont ensuite transportés via le cytosquelette d’actine (représenté en vert) jusqu’à une zone particulière du cortex cellulaire. 4. Une fois correctement localisés, les ARNm sont « piégés » indépendamment de l’actine. 5. Lors de la division cellulaire, les ARNm seront distribués de façon asymétrique dans une seule des cellules filles. Cela permettra l’évolution de chacune des cellules filles vers une destinée différente.