Abstracts
Résumé
Le sens de l’agentivité (SdA) consiste à détecter que l’on est la cause d’une action (Gallagher, 2000). Il est lié au contrôle moteur, mais également à la conscience de soi et pourrait jouer un rôle important dans l’interaction sociale. Le trouble du spectre de l’autisme (TSA) est caractérisé par une altération des interactions sociales et de la communication (DSM-5 ; APA, 2013), et est souvent perçu comme relevant d’un déficit primaire de fonctions spécifiques à la cognition sociale. Pourtant, le contrôle moteur est également altéré dans le TSA. Nous faisons l’hypothèse que les symptômes moteurs et l’atteinte de l’interaction sociale pourraient relever d’une même atteinte du SdA. Nous présentons d’abord les modèles explicatifs généraux et les bases neurofonctionnelles du SdA implicite et explicite (Synofzik et al., 2008), puis les manifestations de ses perturbations dans d’autres troubles neuropsychiatriques comme la schizophrénie. Dans le TSA, la formation atypique des modèles internes de l’action lors de l’apprentissage moteur (Haswell et al., 2009) pourrait être à l’origine de l’altération du SdA implicite. Le manque de fidélité des indices d’agentivité sensorimoteurs (Zalla et al., 2015) pourrait de façon concomitante entraîner l’altération du SdA explicite. Nous discutons les principales manifestations cliniques du TSA qui seraient reliées aux altérations du SdA (difficultés dans la théorie de l’esprit et l’imitation, déficits de la coordination et des praxies, etc.)
Mots-clés :
- autisme,
- sens de l’agentivité,
- cognition sociale,
- modèles internes de l’action,
- interactions sociales
Abstract
The sense of agency (SoA) refers to the ability for one to detect that she is the cause of an action (Gallagher, 2000). The SoA is linked to motor control but also to self-awareness and could play an important role in social interactions. Autism spectrum disorder (ASD) is characterized by an alteration of social interactions and communication (DSM-5; APA, 2013) and is often seen as a primary deficit of functions specific to social cognition. However, motor control is also altered in ASD. We hypothesize that motor symptoms and social impairments could both arise from the same alteration of SoA. We first introduce theoretical models of implicit and explicit SoA (Synofzik et al., 2008) and present their neurofunctional basis. Then, we assess the clinical expressions of a disrupted SoA in different neuropsychiatric disorders such as schizophrenia. In ASD, the atypical formation of internal models of action during motor acquisition (Haswell et al., 2009) could be at the source of an altered implicit SoA. A lack of fidelity of sensorimotor agency cues (Zalla et al., 2015) could also entail an alteration of explicit SoA. We discuss the main clinical expressions of ASD that may ensue from a disrupted SoA (difficulties in theory of mind and imitation, deficits in motor coordination and praxis, etc.)
Keywords:
- autism,
- sense of agency,
- social cognition,
- internal models of action,
- social interactions
Article body
1) Introduction : la cognition sociale et les interactions en autisme
Le trouble du spectre de l’autisme (TSA) est un trouble neurodéveloppemental dont le diagnostic repose sur la présence de déficits dans la communication et les interactions sociales, ainsi que celle de patrons restreints d’intérêts et de comportements (American Psychiatric Association, 2013). Des particularités dans le traitement sensoriel et le contrôle moteur dans les TSA sont communément rapportés (cf. von Hofsten & Rosander, 2012 ; Gowen & Hamilton, 2013), mais le TSA demeure souvent perçu, à la suite de Kanner, comme « une incapacité innée à former le lien affectif usuel et biologique avec les autres personnes » (Kanner, 1943). Dans cette perspective, les études sur les bases neurocognitives du TSA suggèrent que les individus avec TSA explorent différemment les stimuli sociaux notamment les visages (cf. Guillon et al., 2014) et font des jugements atypiques sur les visages (Forgeot d’Arc et al., 2014). Ils font moins d’inférences spontanées sur les états mentaux d’autrui (Baron-Cohen et al., 1985 ; Senju et al., 2009) et ont de la difficulté à comprendre les situations sociales complexes. Ils accordent moins d’attention et d’intérêt aux situations sociales et en tirent moins de plaisir (Chevallier et al., 2012). Ainsi, le TSA est associé à un fonctionnement neurocognitif altéré dans différents aspects de la perception, de la compréhension et de la motivation pour l’environnement social. Cependant, il existe une grande hétérogénéité dans les fonctionnements individuels et un contraste encore mal compris entre les aspects altérés et préservés de la cognition sociale. De plus, l’ontogenèse de ces altérations et leur possible influence réciproque reste largement à explorer (Forgeot d’Arc & Mottron, 2012).
Les interactions sociales et la communication sont fondamentalement basées sur le mouvement (von Hofsten & Rosander, 2012). En effet, les actions fondamentales de la communication comme les signaux non verbaux et la parole sont constituées de séquences de mouvements complexes. Bien que les déficits du contrôle et de la conscience de l’action n’appartiennent pas à la définition du TSA, ils lui sont largement associés : la présence de comportements répétitifs et de déficits dans le contrôle postural, dans la perception du mouvement biologique, dans la planification des séquences de mouvements, dans l’exécution de praxies et dans l’imitation (von Hofsten & Rosander, 2012 ; Mostofsky & Ewen, 2011) pourraient refléter l’altération du contrôle de l’action dans le TSA. Le développement de la coordination motrice est également altéré chez une large majorité des personnes avec un TSA (Fournier et al., 2010). Une altération du contrôle et de la conscience de l’action pourrait ainsi constituer un important facteur limitant les interactions sociales, puisque toute interaction exige le traitement dynamique de ses propres actions et de celles d’autres agents. En effet, distinguer les conséquences de ses actions de celles des actions des autres, synchroniser son action avec un autre agent ou reproduire des séquences de mouvements par observation sont des exigences régulières des interactions en contexte écologique. Pourtant, le rôle du contrôle de l’action et du développement moteur dans l’altération de l’interaction sociale qui caractérise le TSA demeure mal compris.
Le sens de l’agentivité (SdA) est la capacité d’identifier que l’on est la cause d’une action ou d’une pensée (Gallagher, 2000) et de distinguer les conséquences des actions causées par soi de celles causées par les actions des autres (Balconi, 2010a). Le SdA est un aspect fondamental des représentations et du contrôle de l’action. L’étude du SdA offre un cadre conceptuel qui permet de comprendre l’impact du développement du contrôle de l’action sur les interactions entre plusieurs agents. Ses perturbations sont explorées en lien avec des troubles neuropsychiatriques comme la schizophrénie, le trouble obsessionnel compulsif et le syndrome de Tourette (Balconi, 2010c). Il pourrait aussi être affecté dans le TSA. L’objet du présent article est d’explorer le rôle possible du SdA comme lien entre les altérations de la motricité et de l’interaction sociale dans le TSA. Après avoir présenté les modèles explicatifs du SdA, l’impact de ses altérations dans différents troubles neuropsychiatriques, dont la schizophrénie, et les résultats parfois contradictoires concernant le SdA dans le TSA, nous discuterons comment une altération du SdA pourrait expliquer la présence de symptômes moteurs et sociaux dans le TSA.
2) Modèles explicatifs du SdA
Le SdA permet de distinguer les actions et leurs conséquences dans l’environnement qui sont autogénérées de celles qui sont générées par d’autres (Balconi, 2010a). Selon le modèle de Synofzik et al. (2008, 2009, 2013 ; le cadre conceptuel de l’intégration optimale des indices d’agentivité ; ci-après IOA), cette distinction peut s’opérer de façon implicite ou explicite. Le SdA implicite se limite à une représentation élémentaire de l’action comme étant causée ou non par soi. Ce processus ne conduit pas nécessairement à une représentation consciente. Le SdA explicite est en revanche une attribution causale consciente d’une action à un agent particulier. Ce processus métacognitif, qui peut être rapporté verbalement, se fonde partiellement sur le niveau implicite du SdA, mais intègre également d’autres indices (informations contextuelles, croyances préalables, etc.), qui peuvent même, selon les situations, déterminer complètement le jugement d’agentivité.
a) SdA implicite
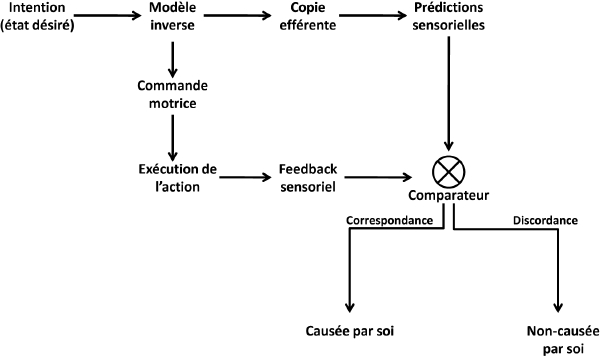
Le modèle du comparateur (MdC) (Frith et al., 2000 ; Blakemore et al., 2002) offre une base explicative du niveau implicite du SdA (Synofzik & Voss, 2010 ; Synofzik et al., 2013). Le MdC (Figure 1) suggère que l’expérience d’agentivité dépend de la comparaison entre les conséquences sensorielles réelles d’une action et les conséquences sensorielles prédites par un modèle interne de l’action. Il existe en fait deux types de modèles internes de l’action : une copie efférente, forward model, qui est produite en parallèle de la commande motrice et qui contient les prédictions sensorielles de l’action, et le modèle inverse, inverse model, qui fournit au système la commande motrice appropriée pour atteindre un état désiré. Un comparateur vérifie la correspondance entre l’état sensoriel prédit, qui est déterminé par la copie efférente, et l’état sensoriel réel de l’organisme, qui est déterminé par le feedback sensoriel. S’il y a correspondance, les conséquences de l’action sont considérées comme autogénérées et il y a émergence d’un SdA. Dans le cas d’une discordance entre ces signaux, les conséquences sensorielles sont attribuées à une source externe.
Lors de l’exécution d’une nouvelle action, les cortex moteur et sensoriel produisent respectivement, un « schéma moteur » et un « schéma corporel » de l’action, qui sont intégrés dans les cortex pariétaux (Daprati et al., 2010). Le cervelet reçoit une copie de ces schémas (Ito, 2005) qui contiennent l’information sensorielle et motrice dynamique nécessaire à la production du mouvement.
Figure 1
Modèle du comparateur (inspiré de Blakemore et al., 2002)
Le MdC prévoit donc que les mouvements autogénérés acquièrent une signature unique à travers le fonctionnement du comparateur. Tout d’abord, une convergence à ce comparateur entraîne une inhibition du feedback sensoriel prédit par la copie efférente. Ce phénomène appelé atténuation sensorielle provoque une réduction quantifiable dans l’intensité subjective des conséquences sensorielles associées à une action autogénérée. Par exemple, l’atténuation sensorielle explique pourquoi il est difficile de se chatouiller soi-même (Blakemore et al., 2000). L’atténuation sensorielle a été identifiée dans les modalités tactile, auditive (Weiss et al., 2011) et visuelle (Cardoso-Leite et al., 2010) et constitue donc un marqueur comportemental pertinent pour mesurer les mécanismes implicites du SdA. Au cours de l’action, une divergence entre les prédictions du cervelet et les conséquences sensorielles active le cortex pariétal postérieur et le lobule pariétal inférieur (LPI) (pour une revue du rôle de ces structures dans le SdA, cf. David, 2010). La convergence entre les prédictions et le feedback sensoriel produit une atténuation sensorielle. Par exemple, les stimuli tactiles autogénérés sont associés à une réduction de l’activité du cortex somatosensoriel secondaire par rapport à une stimulation équivalente générée par une source externe (Blakemore et al., 1998). Au cours de l’apprentissage d’un comportement, les patrons de comportements sont ajustés avec la répétition (Ito, 2008). Les patrons sélectionnés sont mémorisés dans les régions motrices du cortex (Houk et al., 2007 ; Koziol et al., 2012). L’expérience du SdA implicite est également accompagnée d’une compression subjective de l’intervalle temporel séparant un mouvement volontaire et les conséquences sensorielles de ce mouvement (glissements subjectifs du temps perçu de l’action vers la conséquence et du temps perçu de la conséquence vers l’action). Cet effet appelé couplage d’intentionnalité, intentional binding (Haggard et al., 2002), surviendrait à la suite d’un groupement perceptuel entre la copie efférente et les conséquences de l’action, puisqu’il est aboli lorsque le mouvement est passif ou que les conséquences de l’action sont imprévisibles (pour une revue du couplage d’intentionnalité comme marqueur du SdA, cf. Moore & Obhi, 2012). Cet effet robuste est utilisé comme marqueur expérimental du SdA implicite. L’effet de couplage d’intentionnalité peut être aboli par inhibition de l’aire motrice supplémentaire (Moore et al., 2010). Le niveau implicite peut ne pas être directement disponible à l’expérience explicite d’agentivité, mais des marqueurs comme l’atténuation sensorielle et le couplage d’intentionnalité permettent de l’évaluer.
Enfin, le comparateur produit un indice d’agentivité dit « rétrospectif », puisqu’il implique les réafférences sensorielles et devient donc disponible seulement après l’exécution de l’action. Le SdA peut également émerger à partir d’indices sensorimoteurs « prospectifs », c’est-à-dire d’informations disponibles avant l’exécution de l’action (pour la distinction prospectif/rétrospectif, cf. Chambon et al., 2014). Ainsi, la présence d’une intention, la sélection d’une action (d’un modèle inverse) ou la simple présence d’une copie efférente peuvent suffire dans certaines circonstances à l’émergence d’un SdA (voir Figure 2).
b) SdA explicite
Les facteurs sensorimoteurs ne suffisent toutefois pas à expliquer le SdA dans toutes les situations (Synofzik et al., 2008, 2013). Une théorie alternative du SdA (Wegner, 2002) suggère d’ailleurs que le SdA émerge d’une inférence post-hoc issue de la concordance d’une intention et d’une conséquence sensorielle compatible à l’intention. Ainsi, un agent ayant l’intention d’un mouvement finalement exécuté par un tiers peut faussement s’en croire l’auteur (Wegner et al., 2004). D’autres indices contextuels rétrospectifs peuvent également contribuer au SdA : les individus peuvent, par exemple, s’autoattribuer une action pour laquelle ils n’ont pas expérimenté de SdA implicite lorsqu’ils sont les seuls agents présents dans l’environnement. De plus, les croyances préalables de l’individu (p. ex. croyance en l’existence d’agents invisibles, connaissance de l’environnement, etc.), la valence émotionnelle des conséquences de l’action, la performance perçue et certains traits de personnalité (p. ex. le locus de contrôle) peuvent influencer les attributions d’agentivité (Figure 2). Ainsi l’émergence du SdA explicite repose-t-elle sur les indices sensorimoteurs prospectifs et rétrospectifs, ainsi que les indices contextuels rétrospectifs, et ces indices sont pondérés pour l’émergence d’un SdA au niveau explicite (Chambon et al., 2014 ; Zalla & Sperduti, 2015) selon leur disponibilité ou les exigences particulières d’un contexte donné (Synofzik et al., 2008, 2013).
Le IOA propose de concilier le MdC et le modèle des inférences post-hoc comme sources du SdA explicite. L’expérience d’agentivité est déterminée, selon le IOA, par l’intégration de ces deux classes d’indices et leur contribution relative varie en fonction de leur disponibilité et de leur fidélité dans un contexte donné.
Plusieurs marqueurs, obtenus par rapport verbal, sont employés pour examiner le niveau explicite du SdA. L’attribution d’agentivité soi-autre après l’exécution d’une action (p. ex. David, 2008), les jugements d’autocausation ou de contrôle sur une échelle de Likert (p. ex. Miele et al., 2011) constituent différents types de jugements d’agentivité (JdA) qui permettent de quantifier le SdA explicite. Des tests de mémoire de l’action et de monitoring de source (p. ex. Zalla et al., 2010) peuvent également mesurer indirectement le SdA. Ces mesures ne distinguent généralement pas les contributions relatives des indices sensorimoteurs implicites et des indices contextuels rétrospectifs dans l’émergence du SdA explicite.
Figure 2
Niveaux implicite et explicite du SdA (inspiré de Blakemore et al., 2002 ; Synofzik et al., 2013 ; Zalla & Sperduti, 2015)
Les jugements explicites sont associés à l’activation du cortex préfrontal antérieur gauche et du cortex orbitofrontal droit (Miele et al., 2011), généralement impliqués dans le traitement des informations sensorielles et affectives relatives à soi. Selon une méta-analyse de 15 études en imagerie cérébrale (Sperduti et al., 2011), les JdA autoattribués seraient associés à l’activité de l’insula (bilatérale) et les attributions externes à celle de la jonction temporo-pariétale, du cortex préfrontal dorso-médian et de la préaire motrice supplémentaire. La discordance entre les prédictions et les conséquences sensorielles activerait la jonction temporo-pariétale, tandis que le traitement autoréférentiel, les décisions sous incertitude, l’accès conscient de la discordance prédictions/conséquences seraient associés à l’activité du cortex préfrontal dorso-médian (David, 2010). La préaire motrice supplémentaire signalerait une disparité entre les intentions motrices et les conséquences de l’action (Sperduti et al., 2011).
c) Perturbations du SdA
Plusieurs symptômes neurologiques sont généralement considérés comme des atteintes du SdA : syndrome de la main alien, comportements d’utilisation, anosognosie, etc. (Frith et al., 2000 ; Balconi, 2010b). Le SdA serait également perturbé dans plusieurs troubles neuropsychiatriques comme le trouble obsessionnel compulsif, le syndrome de Tourette et le TSA (Balconi, 2010b), mais son étude en lien avec les troubles neuropsychiatriques s’est d’abord imposée en schizophrénie. Les modèles du SdA permettent d’expliquer les symptômes positifs de la schizophrénie comme les illusions de référence, les illusions de contrôle et les hallucinations acoustico-verbales (Georgieff & Jeannerod, 1998 ; Frith et al., 2000 ; Synofzik & Voss, 2010). L’étude du SdA dans la schizophrénie est aussi à la source de nombreuses avancées théoriques récentes comme la distinction entre niveaux implicite et explicite (Synofzik et al., 2008).
Dans la schizophrénie, le SdA implicite est altéré : en effet, des prédictions imprécises des conséquences sensorielles de l’action entraînent une réduction de l’atténuation sensorielle (Shergill et al., 2005). De même, lors d’une action aux conséquences fréquentes, mais inconstantes (75 % des actions), un couplage d’intentionnalité est habituellement présent chez la population générale que la conséquence de l’action survienne ou non, suggérant que le SdA peut émerger de l’anticipation de la conséquence. Chez les individus avec schizophrénie, en revanche, le couplage d’intentionnalité est présent – et même augmenté – uniquement dans les essais où la conséquence sensorielle survient (Voss et al., 2010). Ainsi, chez les personnes avec schizophrénie, le SdA implicite dépend excessivement d’indices sensorimoteurs rétrospectifs et repose moins sur des indices sensorimoteurs prospectifs.
L’altération du SdA implicite affecte le SdA explicite. L’IOA offre une base explicative contexte-dépendante des différentes erreurs d’attribution d’agentivité dans les troubles psychotiques : les prédictions sensorielles des conséquences de l’action (indices prospectifs) étant imprécises, le jugement d’agentivité se base davantage sur des indices alternatifs d’agentivité comme le feedback visuel et auditif, les croyances préalables et les inférences rétrospectives (Synofzik & Voss, 2010). Cette pondération accrue pour les indices rétrospectifs compenserait les prédictions imprécises des conséquences sensorielles de l’action, mais entraînerait certaines erreurs dans les contextes où les indices rétrospectifs alternatifs sont trompeurs ou absents, conduisant respectivement à s’autoattribuer (illusion de référence) ou se sous-attribuer (illusion de contrôle) la cause de l’action. L’intensité des hallucinations acoustico-verbales, des illusions de référence et des illusions de contrôle chez les patients schizophrènes est d’ailleurs corrélée avec le déficit de prédiction des conséquences de l’action qu’ils affichent (Voss et al., 2010).
3) Le SdA dans le TSA
Au cours du développement typique, la sensibilité à sa propre agentivité apparaît entre 9 et 18 mois (Johnson, 2003). Permettant d’établir une distinction claire entre soi et l’autre, elle pourrait être un préalable à l’attribution d’intentions et d’autres états mentaux (Pacherie, 1997) et à l’imitation (Nadel 2004). Ainsi, une altération précoce du SdA pourrait avoir un impact sur le développement de l’imitation et de l’attribution d’états mentaux (Russell, 1996). Comme les habiletés sociales nécessitent à la fois de s’engager dans une série de mouvements et de comprendre les mouvements des autres (ainsi que les intentions qui leur sont associées) (Beilin & Fireman, 1999), une altération des mécanismes du contrôle et de la conscience de l’action pourrait également limiter les interactions sociales et rendre difficile la communication. Dans le TSA, les troubles moteurs pourraient donc constituer, plutôt qu’un épiphénomène, un facteur causal de la réciprocité sociale altérée. Pourtant, peu d’études ont investigué le SdA dans l’autisme et son impact sur l’interaction sociale. Notons dès lors que, bien que le TSA présente une certaine comorbidité avec la déficience intellectuelle, la large majorité des études disponibles sur le SdA et sur les représentations de l’action en autisme ont été menées auprès d’une sous-population de personnes avec un diagnostic de TSA et un fonctionnement intellectuel normal.
a) SdA implicite
Dans l’unique étude sur l’atténuation sensorielle dans le TSA (Blakemore et al., 2006), des participants soumis au contact léger d’une éponge avec leur paume rapportaient (sur une échelle de 0 à 10) la sensation de chatouillement et l’intensité perçue. Les participants des 2 groupes rapportaient un chatouillement plus important lorsque la stimulation était activée par un tiers, mais la réduction de la perception d’intensité du stimulus provoqué par un tiers (atténuation sensorielle) n’était rapportée que par le groupe contrôle. La discordance entre ces 2 mesures subjectives incite à investiguer davantage l’atténuation sensorielle dans le TSA à l’aide de mesures objectives comme celles utilisées en schizophrénie (p. ex. Shergill et al., 2005). Récemment, le couplage d’intentionnalité a été rapporté intact dans le TSA pour la modalité auditive et la condition multimodale, mais aboli dans la modalité visuelle (Sperduti et al., 2014), ce qui suggère une altération des indices sensorimoteurs à contenus visuels du SdA. Cette altération du couplage d’intentionnalité diffère de celle observée chez les schizophrènes, alors que ces derniers montrent plutôt un renforcement du couplage d’intentionnalité lorsque des indices sensorimoteurs rétrospectifs sont disponibles (Voss et al., 2010). Dans l’autisme, les contributions respectives des indices prospectifs et rétrospectifs au patron atypique de couplage d’intentionnalité observé demeurent à explorer.
Il existe dans le TSA une association excessive entre l’action et ses conséquences proprioceptives, qui est corrélée avec l’intensité des symptômes sociaux (imitation, etc.) et moteurs (praxies, etc.) (Haswell et al., 2009). Ainsi, lors de l’apprentissage d’un nouveau mouvement, les enfants autistes acquièrent des modèles internes de l’action qui surdépendent de l’information proprioceptive par rapport à l’information visuelle. Cette particularité dans la formation de modèles internes de l’action, qui est spécifique au TSA (par rapport au trouble de l’attention) (Izawa et al., 2012), concorde avec la découverte que l’intégration multisensorielle est affectée chez les personnes avec un TSA et que leur mode de traitement est davantage unimodal (Collignon et al., 2013). De plus, la surdépendance au signal proprioceptif dans la formation de modèles internes semble constituer une importante différence entre les personnes avec un TSA et celles avec schizophrénie. En effet, les personnes schizophrènes dépendent excessivement du signal réafférent visuel et des indices rétrospectifs dans l’adaptation de leurs mouvements et dans l’émergence de leur SdA (Synofzik & Voss, 2010 ; Synofzik et al., 2010). La surdépendance au signal proprioceptif des personnes avec un TSA dans la formation de modèles internes de l’action suggère que les indices sensorimoteurs visuels prospectifs et rétrospectifs pourraient ne pas être disponibles pour contribuer à leur SdA implicite. Cette difficulté à se représenter l’action dans la modalité visuelle pourrait être à la source de leurs difficultés dans l’imitation (Mostofsky & Ewen, 2011).
La surdépendance à la proprioception pourrait être expliquée par une connectivité cérébrale altérée, plus précisément par une surconnectivité locale et par une sous-connectivité globale (Mostofsky & Ewen, 2011 ; mais pour l’hypothèse d’une connectivité idiosyncratique dans le TSA, cf. Hahamy et al., 2015). La formation de modèles internes basée sur le signal proprioceptif se réaliserait par l’entremise de connexions de courte distance en raison de la proximité spatiale entre les cortex somatosensoriel et moteur. En revanche, l’utilisation du feedback visuel dans la constitution des modèles internes nécessiterait plutôt des connexions de longue distance. Le fait que le volume de matière blanche locale dans le cortex moteur chez les enfants avec un TSA est un facteur prédictif robuste des déficits moteurs (Mostofsky et al., 2007) vient appuyer cette hypothèse. Le cervelet joue également un rôle majeur dans la formation des modèles internes et constitue une des régions cérébrales les plus systématiquement identifiées comme présentant des anomalies chez les personnes avec un TSA (Fatemi et al., 2012). L’activation cérébelleuse est d’ailleurs atypique chez les personnes avec un TSA lors de l’exécution de divers mouvements (Mostofsky et al., 2009) et de mouvements oculaires (Takarae et al., 2007).
Enfin, l’abolition du couplage d’intentionnalité dans la modalité visuelle constitue une première preuve de l’altération du SdA implicite dans le TSA. Cette altération coïncide avec une association excessive entre l’action et les conséquences proprioceptives (par rapport à visuelles) lors de la formation de modèles internes. Il reste toutefois à déterminer, pour le TSA, si l’altération du SdA implicite est attribuable à une altération des indices sensorimoteurs prospectifs et/ou rétrospectifs. Ceci pourrait être vérifié par l’emploi en TSA de paradigmes déjà utilisés en schizophrénie (p. ex. Voss et al., 2010), mais cette vérification doit être effectuée en distinguant les modalités visuelle, auditive et somatosensorielle (proprioceptive et tactile). De plus, l’atténuation sensorielle dans le TSA reste à explorer dans l’ensemble des modalités, alors que le couplage d’intentionnalité n’a jamais été testé dans une modalité somatosensorielle.
b) SdA explicite
Le monitoring de source (la capacité d’associer explicitement dans un test de mémoire les différents auteurs d’une série d’actions) semble préservé chez les personnes avec TSA (Hill & Russell, 2002 ; Williams & Happé, 2009 ; Grainger et al., 2014 ; Zalla et al., 2010, mais cf. Russell & Jarrold, 1999 pour un résultat divergent). Cependant, le bénéfice de mémoire en rappel libre habituellement associé aux actions autogénérées n’est pas retrouvé chez les individus avec TSA (Zalla et al., 2010 ; Hare et al., 2007). Ces mesures différées du SdA demeurent cependant difficiles à interpréter, puisque le lien entre mémoire et SdA est encore mal compris et qu’il est ardu, dans ces paradigmes, d’évaluer les contributions respectives des différents indices d’agentivité.
Ayant testé plus directement le SdA explicite par le biais d’attributions d’agentivité (soi-autre) effectuée essai par essai lors d’une tâche d’atteinte de cibles, David et al. (2008) n’ont pas identifié de différence entre personnes avec un TSA et les participants contrôles. Comme le feedback visuel donné au participant durant cette tâche était imprévisible et que les distorsions du feedback n’étaient pas contrôlées de façon paramétrique, la contribution des indices sensorimoteurs (autant prospectifs que rétrospectifs) ne pouvait être évaluée et il est possible que le SdA explicite ait été préservé par une utilisation adéquate des indices contextuels rétrospectifs. En ce sens, Zalla et al. (2015) ont montré que les personnes avec un TSA, malgré des performances préservées en JdA (évalué sur une échelle continue), sous-utilisent, par rapport aux contrôles, les indices sensorimoteurs quand elles rapportent un SdA explicite. Dans cette expérience, si les sujets typiques utilisaient la disparité entre la prédiction de la conséquence visuelle et le feedback visuel (altéré) pour établir leur JdA, les JdA des participants avec un TSA se fondaient sur les indices contextuels rétrospectifs. Il est à noter que la disparité était détectable dans la modalité visuelle seulement (et non pas proprioceptive). La formation atypique des modèles internes pourrait résulter en une faible sensibilité du comparateur à la disparité visuelle et/ou en l’absence de prédictions des conséquences visuelles de l’action sur lesquelles fonder un SdA explicite et expliquer pourquoi les indices contextuels sont préférés aux indices sensorimoteurs. Le SdA explicite serait donc préservé chez les personnes avec un TSA lorsque le contexte permet l’utilisation d’indices rétrospectifs (Zalla & Sperduti, 2015), mais l’altération du SdA implicite entraînerait une pondération atypique des indices d’agentivité. L’étude de Zalla et al. (2015) a également montré que moins les personnes autistes fondaient leurs JdA sur les indices sensorimoteurs, moins leur score de performance dans un test de théorie de l’esprit (Faux-Pas) était élevé. Ces particularités du SdA dans l’autisme pourraient donc avoir un impact sur les habiletés sociales. En ce sens, une altération du SdA pour les mouvements oculaires chez les personnes avec un TSA a été associée à une compréhension réduite des interactions sociales dans le contexte écologique d’une conversation (Grynszpan et al., 2012).
4) Conclusion
Le SdA semble donc présenter plusieurs atypies dans le TSA : les mécanismes sensorimoteurs à la source du niveau implicite du SdA sont altérés et la formation des modèles internes de l’action s’appuie excessivement sur l’information proprioceptive aux dépens de l’information visuelle. Toutefois, l’intégration pondérée de différents indices d’agentivité (dont les indices sensorimoteurs prospectifs et rétrospectifs, mais également les indices contextuels rétrospectifs comme les croyances préalables ou la performance perçue) semble avantager l’utilisation d’indices rétrospectifs dans le TSA. Une majorité d’études portant sur la métacognition d’agentivité chez les personnes avec un TSA ne distinguent toutefois pas l’influence de ces divers indices, ce qui pourrait être à l’origine des résultats contradictoires quant à l’intégrité du SdA dans le TSA. Ainsi, il a été suggéré que le rôle prépondérant des indices rétrospectifs dans l’émergence d’un SdA explicite pourrait être occasionné par un manque de fidélité des indices prospectifs (Zalla & Sperduti 2015), mais cette hypothèse reste à valider.
Aussi, des travaux récents suggèrent un lien entre SdA et interaction sociale dans le TSA (Grynszpan et al., 2012 ; Zalla et al., 2015). Ces résultats, combinés aux travaux sur la formation des modèles internes de l’action dans le TSA (Haswell et al., 2009 ; Izawa et al., 2012), semblent suggérer une implication de l’altération du SdA dans la présence concomitante de déficits de la motricité et de l’interaction sociale. Les recherches à venir devront : 1) comprendre les divergences observées avec différentes mesures du SdA implicite (atténuation sensorielle, couplage d’intentionnalité) en fonction des différentes modalités sensorielles ; 2) distinguer l’intégrité du SdA implicite de la compensation par un SdA explicite (basé sur des indices contextuels) en isolant les contributions des indices sensorimoteurs prospectifs et rétrospectifs puis contextuels rétrospectifs, notamment en quantifiant simultanément pour une même action le SdA implicite et explicite ; 3) établir un lien de causalité direct entre un marqueur témoignant d’une altération du SdA et différents indicateurs du fonctionnement social (théorie de l’esprit, imitation, etc.) et moteur (praxies, etc.). De cette manière, une étude plus intégrée des différents aspects du SdA et de la cognition sociale pourrait contribuer à une meilleure compréhension des symptômes sociaux et des symptômes moteurs, qui coexistent dans le TSA.
Appendices
Bibliographie
- American Psychiatric Association. (2013) Diagnostic and Statistical Manual of Mental Disorders (5e ed.). Washington, DC : American Psychiatric Association Publishing.
- Balconi, M. (2010a). The sense of Agency in Psychology and Neuropsychology. Dans M. Balconi (Ed.), Neuropsychology of the Sense of Agency : From Consciousness to Action (3-22). New York, NY : Springer.
- Balconi, M. (2010b). Disruption of the Sense of Agency : From Perception to Self-Knowledge. Dans M. Balconi (Ed.), Neuropsychology of the Sense of Agency : From Consciousness to Action (125-144). New York, NY : Springer.
- Baron-Cohen, S., Leslie, A. M. & Firth, U. (1985). Does the autistic child have a “theory of mind” ? Cognition, 21(1), 37-46.
- Beilin, H. & Fireman, G. (1999). The foundation of Piaget’s theories : mental and physical action. Advances in Child Development and Behavior, 27, 221-46.
- Blakemore, S. J., Tavassoli, T., Calo, S., Thomas, R. M., Catmur, C., Frith, U. & Haggard, P. (2006). Tactile sensitivity in Asperger syndrome. Brain and Cognition, 61, 5-13.
- Blakemore, S. J., Wolpert, D. M. & Frith, C. D. (1998). Central cancellation of self-produced tickle sensation. Nature Neuroscience, 1, 635-640.
- Blakemore, S. J., Wolpert, D. M. & Frith, C. D. (2002). Abnormalities in the awareness of action. Trends in Cognitive Sciences, 6, 237-242.
- Blakemore, S. J., Wolpert, D. & Frith, C. (2000). Why can’t you tickle yourself ? Neuroreport. 11. R11-R16.
- Cardoso-Leite, P., Mamassian, P., Schütz-Bosbach, S. & Waszak, F. (2010). A new look at sensory attenuation. Action-effect anticipation affects sensitivity, not response bias. Psychological Science, 21(12), 1740-1745.
- Chambon, V., Sidarus, N. & Haggard, P. (2014). From action intentions to action effects : how does the sense of agency come about ? Frontiers in Human Neuroscience, 320(8), 1-9.
- Chevallier, C., Grezes, J., Molesworth, C., Berthoz, S. & Happé, F. (2012) Brief report : selective social anhedonia in high functioning autism. Journal of Autism and Developmental Disorders, 42, 1504-1509.
- Collignon, O., Charbonneau, G., Peters, F., Nassim, M., Lassonde, M., Lepore, F., … Bertone, A. (2012). Reduced multisensory facilitation in persons with autism. Cortex, 49 (6), 1-7.
- Daprati, E., Sirigu, A. & Nico, D. (2010). Body and movement : consciousness in the parietal lobes. Neuropsychologia, 48, 756-762.
- David, N., Gawronski, A., Santos, N. S., Huff, W., Lehnhardt, F.-G., Newen, A. & Vogeley, K. (2008). Dissociation Between Key Processes of Social Cognition in Autism : Impaired Mentalizing But Intact Sense of Agency. Journal of Autism and Developmental Disorders, 38, 593-605.
- David, N. (2010). Functional Anatomy of the Sense of Agency : Past Evidence and Future Directions. Dans M. Balconi (Ed.), Neuropsychology of the Sense of Agency : From Consciousness to Action, (69-80). New York, NY : Springer.
- Fatemi, S. H., Aldinger, K. A., Ashwood, P., Bauman, M. L., Blaha, C. D., Blatt, G. J., … Welsh, J. P. (2012). Consensus Paper : Pathological role of the cerebellum in autism. Cerebellum. 11, 777-807.
- Forgeot d’Arc, B. & Mottron, L. (2012) Social Cognition in Autism. Dans V. Anderson & M. Beauchamp (Eds), Developmental Social Neuroscience and Childhood Brain Insult : Implications for Theory and Practice (299-324). New York, NY : Guilford Press.
- Forgeot d’Arc, B., Ramus, F., Lefebvre, A., Brottier, D., Zalla, T., Moukawane, S., … Delorme, R. (2014). Atypical Social Judgment and Sensitivity to Perceptual Cues in Autism Spectrum Disorders. Journal of Autism and Developmental Disorders. doi : 10.1007/s10803-014-2208-5
- Fournier, K. A., Hass, C. J., Naik, S. K., Lodha, N. & Cauraugh, J. H. (2010). Motor Coordination in Autism Spectrum Disorders : A Synthesis and Meta-Analysis. Journal of Autism and Developmental Disorders, 40, 1227-1240.
- Frith, C. D., Blakemore, S. J. & Wolpert, D. M. (2000). Abnormalities in the awareness and control of action. Philosophical Transactions of the Royal Society of London B : Biological Sciences, 355, 1771-1788.
- Gallagher, S. (2000). Philosophical conceptions of the self : implications for cognitive science. Trends in Cognitive Sciences, 4, 14-21.
- Georgieff, N. & Jeannerod, M. (1998). Beyond Consciousness of External Reality : A “Who” System for Consciousness of Action and Self-Consciousness. Consciousness and Cognition, 7, 465-477.
- Gowen, E. & Hamilton, A. (2013). Motor abilities in Autism : A Review Using a Computational Context. Journal of Autism and Developmental Disorders, 43(2), 323-344.
- Grainger, C., Williams, D. M. & Lind, S. E. (2014). Online action monitoring and memory for self-performed actions in autism spectrum disorder. Journal of Autism and Developmental Disorders, 44, 1193-1206.
- Grynszpan, O., Nadel, J., Martin, J.-C., Simonin, J., Bailleul, P, Wang, Y., … Constant, J. (2012). Self-Monitoring of Gaze in High Functioning Autism. Journal of Autism and Developmental Disorders, 42, 1642-1650.
- Guillon, Q., Hadjikhani, N., Baduel, S. & Rogé, B. (2014). Visual social attention in autism spectrum disorder : Insights from eye-tracking studies. Neuroscience and Behavioral Reviews, 42, 279-297.
- Haggard, P., Aschersleben, G., Gehrke, J. & Prinz. W. (2002) Action, binding, and awareness. Dans W. Prinz & B. Hommel (Eds), Common Mechanisms in Perception and Action : Attention and Performance, XIX(226-285). Oxford, UK : Oxford University Press.
- Hahamy, A., Behrmann, M. & Balach, R. (2015). The idiosyncratic brain : distortion of spontaneous connectivity patterns in autism spectrum disorder. Nature Neuroscience, 18(2), 302-309.
- Hare, D. J., Mellor, C., & Azmi, S. (2007). Episodic memory in adults with autistic spectrum disorders : recall for self- versus other-experienced events. Research in Developmental Disabilities, 28(3), 317-329.
- Haswell, C. C., Izawa, J., Dowell, L. R., Mostofsky, S. H. & Shadmehr, R. (2009). Representation of internal models of action in the autistic brain. Nature Neuroscience, 12(8). 970-972.
- Hill, E. L. & Russell, J. (2002). Action memory and self-monitoring in children with autism : Self versus other. Infant and Child Development, 11, 159-170.
- Houk, J. C., Bastianen, C., Fansler, D., Fishbach, A., Fraser, D., Reber, P. J., … Simo, L. S. (2007). Action selection and refinement in subcortical loops through basal ganglia and cerebellum. Philosophical Transactions of the Royal Society of London B : Biological Sciences, 362, 1573-1583.
- Ito, M. (2005). Bases and implications of learning in the cerebellum--adaptive control and internal model mechanism. Progress in Brain Research, 148, 95-109.
- Ito, M. (2008). Control of mental activities by internal models in the cerebellum. Nature Reviews Neurosciences, 9, 304-313.
- Izawa, J., Pekny, S. E., Marko, M. K., Haswell, C. C., Shadmehr, R. et Mostofsky, S. H. (2012) Motor Learning Relies on Integrated Sensory Inputs in ADHD, but Over-Selectively on Proprioception in Autism Spectrum Disorder. Autism Research, 5, 124-136.
- Johnson, S. C. (2003). Detecting agents. Philosophical Transactions of the Royal Society of London. Series B. Biological Sciences, 358, 549-559.
- Koziol, L. F., Budding, D. E. & Chidekel, D. (2012). From movement to thought : executive function, embodied cognition, and the cerebellum. Cerebellum, 11, 505-525.
- Miele, D. B., Wager, T. D., Mitchell, J. P., M & Metcalfe, J. (2011). Dissociating Neural Correlates of Action Monitoring and Metacognition of Agency. Journal of Cognitive Neuroscience, 23(11). 3620-3636.
- Moore, J. W. & Obhi, S. S. (2012). Intentional binding and the sense of agency : a review. Consciousness and Cognition, 21(1). 546-561.
- Moore, J. W., Ruge, D., Wenke, D., Rothwell, J. & Haggard, P. (2010). Disrupting the experience of control in the human brain : pre-supplementary motor area contributes to the sense of agency. Proceedings of the Royal Society B, 277, 2503-2509.
- Mostofsky, S. H., Burgess, M. P. & Gidley Larson, J. C. (2007). Increased motor cortex white matter volume predicts motor impairment in autism. Brain, 130, 2117-2122.
- Mostofsky, S. H. & Ewen., J. B. (2011). Altered connectivity and action model formation in autism is autism. The Neuroscientist, 17(4), 437-448.
- Mostofsky, S. H., Powell, S. K., Simmonds, D. J., Goldberg, M. C., Caffo, B. et Pekar, J. J. (2009) Decreased connectivity and cerebellar activity in autism during motor task performance. Brain, 132, 2413-2425.
- Nadel, J. (2004). Early imitation and the emergence of a sense of agency. Paper presented at the 4th International Workshop on Epigenetic Robotics : Modeling Cognitive Development in Robotic Systems. Genoa, Italy.
- Pacherie, E. (1997). Motor images, self-consciousness and autism. Dans J. Russell (Éd.), Autism as an executive disorder (215-255). Oxford, UK : Oxford University Press.
- Russell, J. (1996). Agency : Its Role in Mental Development. Hove, UK : Lawrence Erlbaum Associates Ltd.
- Russell, J. & Jarrold, C. (1999). Memory for actions in children with autism : Self versus other. Cognitive Neuropsychiatry, 4, 303-331.
- Senju, A., Southgate, V., White, S. & Frith, U. (2009). Mindblind Eyes : An Absence of Spontaneous Theory of Mind in Asperger Syndrome. Science, 325, 883-885.
- Shergill, S. S., Samson, G., Bays, P. M., Frith, C. D. & Wolpert, D. M. (2005). Evidence for Sensory Prediction Deficits in Schizophrenia. American Journal of Psychiatry, 162, 2384-2386.
- Sperduti, M., Delaveau, P., Fossati, P. & Nadel, J. (2011) Different brain structures related to self- and external-agency attribution : a brief review and meta-analysis. Brain Structure and Function, 216. 151-157.
- Sperduti, M., Pieron, M., Leboyer, M. & Zalla, T. (2014) Altered Pre-Reflective Sense of Agency in Autism Spectrum Disordors as Revealed by Reduced Intentional Binding. Journal of Autism and Developmental Disorders, 44(343), 343-352.
- Synofzik, M., Vosgerau, G. & Lindner, A. (2009). Me or not me--an optimal integration of agency cues ? Consciousness and Cognition, 18(4), 1065-1068.
- Synofzik, M., Vosgerau, G. & Newen, A. (2008). Beyond the comparator model : a multifactorial two-step account of agency. Consciousness and Cognition, 17(1), 219-239.
- Synofzik, M., Vosgerau, G. & Voss, M. (2013). The experience of agency : an interplay between prediction and postdiction. Frontiers in Psychology, 127(4), 1-8.
- Synofzik, M. & Voss, M. (2010). Disturbances of the Sense of Agency in Schizophrenia. Dans Balconi (Ed.), Neuropsychology of the Sense of Agency : From Consciousness to Action (145-156). New York, NY : Springer.
- Takarae, Y., Minshew, N. J., Luna, B. & Sweeney, J. A. (2007) Atypical involvement of frontostriatal systems during sensorimotor control in autism. Psychiatry Research, 156(2), 117-27.
- von Hofsten, C. & Rosander, K. (2012). Perception-action in children with ASD. Frontiers in Integrative Neuroscience, 6(115), 1-6.
- Voss, M., Moore, J., Hauser, M., Gallinat, J., Heinz, A. & Haggard, P. (2010). Altered awareness of action in schizophrenia : a specific deficit in predicting action consequences. Brain, 133, 3104-3112.
- Wegner, D. M. (2002). The illusion of Conscious Will. Cambridge, MA : MIT Press.
- Wegner, D. M., Sparrow, B. & Winerman, L. (2004). Vicarious agency : experiencing control over the movements of others. Journal of Personality and Social Psychology, 86(6), 838-848.
- Weiss, C., Herwig, A. & Schütz-Bosbach, S. (2011). The self in action effects : Selective attenuation of self-generated sounds. Cognition, 121, 207-218.
- Williams, D. & Happé, F. (2009). Pre-Conceptual Aspects of Self-Awereness in Autism Spectrum Disorder : The Case of Action-Monitoring. Journal of Autism and Developmental Disorders, 39, 251-259.
- Zalla, T., Daprati, E., Sav, A.-M., Chaste, P., Nico, D. & Leboyer, M. (2010). Memory for Self-Performed Actions in Individuals with Asperger Syndrome. PLoS One, 5(10), e13370.
- Zalla, T., Miele, D., Leboyer, M. & Metcalfe, J. (2015). Metacognition of agency and theory of mind in adults with high functioning autism. Consciousness and Cognition, 31, 126-138.
- Zalla, T. & Sperduti, M. (2015). The sense of agency in autism spectrum disorders : a dissociation between prospective and retrospective mechanisms ? Frontiers in Psychology, 1278(6), 1-7.
List of figures
Figure 1
Modèle du comparateur (inspiré de Blakemore et al., 2002)
Figure 2
Niveaux implicite et explicite du SdA (inspiré de Blakemore et al., 2002 ; Synofzik et al., 2013 ; Zalla & Sperduti, 2015)