Abstracts
Résumé
L’étude porte sur la biomorphologie des crustacés du cours d’eau Matourou à Nkoukoum dans la région du Centre Cameroun. Ainsi, deux espèces de crevettes (Caridina sp. et Macrobrachium sp.) et trois morphotypes de crabe du genre Soudanonautes ont été récoltés, identifiés et caractérisés. Caridina sp., de petite taille (10-30 mm), est caractérisé par un rostre dorso-ventralement spinuleux. Macrobrachium sp. mesure entre 26 et 100 mm. Quant aux morphotypes de crabe de genre Soudanonautes, le type I est vert-jaunâtre, présentant une crête post-frontale légèrement incurvée vers l’arrière et largement interrompue au milieu. Il porte une dent épibranchiale très peu développée. Le type II comporte des dents ex-orbitales et intermédiaires développées et pointues. Le type III, par contre, a une dent épibranchiale deux fois plus petite comparativement aux deux autres types. Les coefficients d’allométrie b : 2,50, 2,38 et 2,60 respectivement pour Caridina sp., Macrobrachium sp. et Soudanonautes spp. montrent une croissance négativement allométrique pour ces trois espèces qui cohabitent dans cet écosystème aux eaux douces, neutres et fortement oxygénées. Les valeurs moyennes du facteur de condition K et du coefficient d’allométrie b obtenues pour les espèces les plus abondantes (Caridina sp. et Soudanonautes spp.) révèlent que les variables hydroécologiques du cours d’eau Matourou sont favorables à leur survie dans la zone forestière à Nkoukoum
Mots-clés :
- anthropisé,
- biomorphologie,
- cours d’eau Matourou,
- crabes,
- crustacés
Abstract
The study focuses on the biomorphology of crustaceans of the Matourou stream at Nkoukoum in the Central region of Cameroon. Two species of shrimp (Caridina sp. and Macrobrachium sp.) and three morphotypes of the Soudanonautes crab were harvested, identified and characterized. Caridina sp. of small size (10-30 mm) is characterized by a dorso-ventrally spinous rostrum. Macrobrachium sp. measures between 26 and 100 mm. As for the morphotypes of crab of genus Sudanonautes, type I is greenish-yellow, with a frontal ridge slightly curved backwards and widely interrupted in the middle. It carries a very poorly developed epibranchial tooth. Type II has developed pointed ex-orbital and intermediate teeth. Type III, on the other hand, has an epibranchial tooth that is half as large as the first two. The allometric coefficients b are 2.50, 2.38 and 2.60 respectively for Caridina sp., Macrobrachium sp. and Sudanonautes spp.; they indicate negative allometric growth for these three species that coexist in this ecosystem characterized by fresh, neutral and well-oxygenated waters. The average values of the condition factor K and the allometric coefficient b obtained for the most abundant species (Caridina sp. and Sudanonautes spp.) show that the hydroecological variables of the Matourou stream are favorable for their survival in the forested area of Nkoukoum.
Keywords:
- crustaceans,
- Matourou River,
- forest ecosystem,
- biomorphology
Article body
1. Introduction
Les cours d’eau en général et ceux du Cameroun en particulier constituent des écosystèmes complexes et dynamiques, caractérisés par une productivité biologique relativement élevée et une diversité de ressources considérable. Leur importance socioéconomique s'apprécie tant au regard de l'intensité de la pêche qu'on y pratique, que par la diversité des espèces qui y sont capturées (MINEF-ONUDI-PNUD-FEM, 1999). Par ailleurs, l'exploitation des crustacés des eaux intérieures représente une activité spécifique très ancienne pour laquelle diverses méthodes traditionnelles ont été mises au point par les pêcheurs.
Les crustacés sont des organismes appartenant à l’embranchement des arthropodes, dont le corps est revêtu d’un exosquelette chitinoprotéique appelé exocuticule et souvent imprégné de carbonate de calcium. Les crustacés décapodes occupent une place de choix dans le contexte scientifique du fait de leur grande importance économique. Par ailleurs, ils procurent à la population près du tiers de protéines d'origine animale dont elle a besoin pour son alimentation (AGADJIHOUEDE, 2006).
Dans le monde, de nombreuses données sont disponibles sur les crustacés (AGADJIHOUEDE, 2006; N’ZI et al., 2008; POUPIN et al., 2013; RODNEY et al., 2007). Au Cameroun particulièrement, quelques travaux ont été effectués sur ce groupe d’êtres vivants (KOJI et al., 2015; TUEKAM KAYO et al., 2012; TCHAKONTE et al., 2014) mais peu d’études ont porté sur la morphologie des crustacés décapodes d’eau douce malgré qu’ils fassent l'objet d'une exploitation commerciale locale très importante pour la pêche artisanale et que leur diversité soit fortement menacée par l’activité anthropique. L’objectif global de cette étude est de faire ressortir les caractéristiques morphologiques des crustacés décapodes nécessaires à la compréhension de leur mode de vie. Ceci passe donc par l’étude de leur biomorphologie. Plus précisément il s’agit de : 1) mesurer les variables physicochimiques, 2) d’étudier la diversité et l’abondance de crustacés qui peuplent le cours d’eau Matourou, 3) de mesurer les paramètres morphométriques à fin de mieux décrire la morphologie des différentes espèces et d’évaluer le modèle de croissance de chacune des espèces présentes dans ce cours d’eau.
2. Matériel et méthodes
L’étude a été menée en deux phases : la première, qui est allée de novembre à décembre 2013, a consisté en la prospection du site en vue d’une meilleure connaissance du bassin versant, du tracé du cours d’eau et du choix des stations d’échantillonnage. La seconde phase, qui s’est déroulée de janvier à juin 2014, a été consacrée à la prise des paramètres physicochimiques, aux échantillonnages des crustacés suivant une fréquence mensuelle, à la mesure des paramètres morphométriques des espèces récoltées et à la bioanalyse sur le rapport qualité de l’eau et ressource en crustacés.
2.1 Site d’étude
Cette étude a été menée dans le cours d’eau Matourou situé dans le village Koukoum de l’arrondissement de Makak (région du Centre Cameroun). Le village Koukoum est situé dans la région écologique du plateau Sud camerounais qui s’étend entre 3°30' et 3°58' de latitude nord et entre 11°20'et 11°40' de longitude est (INC, 1980). Le climat est de type équatorial à pluviométrie bimodale qui est caractérisé par des précipitations modérées (1 576 mm∙a-1 ) oscillant entre 1 500 et 1 700 mm∙a-1 (KODJO, 1998). Le cours d’eau Matourou est un affluent du Nyong et il est situé dans le village Koukoum à environ 10 km du centre-ville de Makak (Figure 1). Il est long d’environ 3,70 km et prend sa source dans le bas fond du village Koukoum à 3°31'N et 010°57'E et est orienté dans le sens N-E. Le cours d’eau Matourou est alimenté par quatre affluents : Makoube, Bissai, Mabogoo et Petit Matourou.
Figure 1
Bassin versant de Matourou (carte topographique d’Edéa et Yaoundé, feuille 1d au 1/200 000, source : INC)
The Matourou watershed (topographic map of Edéa and Yaoundé, sheet 1d at a scale of 1/200 000, source: INC)
2.2 Stations d’étude
Trois stations d’échantillonnage ont été choisies le long du cours d’eau Matourou : Mat 1, Mat 2 et Mat 3. La station Mat 1 (03°31'999''N et 010°57'151''E) est située sur le cours supérieur à environ 500 m de la source. La station Mat 2 (03°31'654''N et 010°57'316''E), située sur le cours moyen, est distante d’environ 1,86 km de la source. Enfin, la station Mat 3 (03°31'442''N et 010°57'471''E) est localisée sur le cours inférieur de Matourou à environ 3,5 km de la source et à environ 200 m de la zone de confluence avec le Nyong. Les trois stations Mat 1, Mat 2 et Mat 3 sont respectivement à 601,8 m, 561,9 m et 548,7 m d’altitude.
2.3 Mesure des variables physicochimiques
Les analyses physicochimiques ont été faites suivant les techniques préconisées par RODIER et al. (2009). Ainsi, les paramètres température et pH ont été mesurés sur le terrain, respectivement au moyen d'un thermomètre à mercure et d'un pH-mètre portatif Hach (HQ11d). L’oxydabilité a été mesurée par volumétrie, l'oxydant requis étant le permanganate de potassium. La teneur en azote ammoniacal a été mesurée au laboratoire à l’aide d’un spectrophotomètre Hach (DR/2800).
2.4 Mesure des paramètres biologiques
2.4.1 Échantillonnage et identification des crustacés
La technique d’échantillonnage des crustacés est celle du dipping, décrite par BONY et al. (2008). Cette technique consiste à récolter les organismes cibles dans différents microhabitats pendant 30 min, à l’aide d’un filet troubleau de 400 µm d’ouverture de maille. Ainsi, la densité des crustacés récoltés par unité de temps est estimée. La coloration de chaque spécimen a été notée avant leur conservation dans les piluliers contenant du formol à 10 %. Au laboratoire, les spécimens ont été lavés à l’eau du robinet puis conservés dans de l’éthanol à 70°. Par station, les organismes ont été transvasés dans des boîtes de Pétri, regroupés suivant leur taille et leur morphologie pour l’identification et le dénombrement sous une loupe binoculaire Wild M5. Après dissection, les observations ont été faites au microscope optique Ivymen. Les clés et ouvrages proposés par DURAND et LÉVÊQUE (1980), WRC (2001), TACHET et al. (2006), MOISAN (2010) et IRD (1999) ont été utilisés pour l’identification des crustacés.
2.4.2 Morphométrie et morphologie des crustacés
Au laboratoire et à l’aide d’un pied à coulisse de marque Vernier Caliper, les mensurations ont été faites sur 30 individus de chaque groupe. Les dimensions prises sur les crevettes sont : longueur totale du corps (Lt), longueur standard (Ls), longueur de la carapace (Lc), longueur du rostre (Lr), longueur de l’abdomen (La), longueur du mérus (Lm) et longueur du carpe (Lca) (Figure 2a). Les mensurations faites sur les crabes sont : longueur (Lc) et largeur (lc) de la carapace (Figure 2b). Toutes les mesures ont été faites à l'aide d'un pied à coulisse électronique Digital caliper (0-150 mm). Le poids total (Pt) de chaque spécimen a été mesuré chaque fois à l’aide d’une balance Sartorius (0,001 g de précision). Pour les données méristiques, les valeurs considérées chez les crevettes sont le nombre d'épines sur la face dorsale et ventrale du rostre et le nombre d’épines post-orbitales. Pour les crabes, le nombre d’épines distales et proximales du carpe sont prises en compte.
Figure 2
Paramètres morphométriques considérés chez les crustacés : a) crevette en vue latérale et b) crabe en vue dorsale. La : longueur de l’abdomen, Lc : longueur de la carapace, Lr : longueur du rostre, Ls : longueur standard, Lt : longueur totale du corps, Lm : longueur du mérus, Lca : longueur du carpe
Morphometric parameters considered in crustaceans: a) shrimp in lateral view and b) crab in dorsal view. La: length of the abdomen, Lc: length of the carapace, Lr: length of the rostrum, Ls: standard length, Lt: total body length, Lm: length of the merus, Lca: length of the carp
2.5 Analyse de données
Les données obtenues sont regroupées en moyennes et écarts types. Les fluctuations des différents paramètres sont mises en évidence par des histogrammes. Les différentes longueurs prises sur les crevettes ont été rapportées à la longueur standard afin de déterminer les différentes corrélations qui existent entre les différentes parties de chaque espèce d'une part et les différences entre les espèces de crustacés d'autre part. Ces rapports sont:
Lc/Ls : rapport longueur de la carapace (céphalothorax) sur la longueur standard;
Lr/Ls : rapport longueur du rostre sur longueur standard;
La/Ls : rapport longueur de l'abdomen sur longueur standard;
Lca/Lm : rapport longueur du carpe sur longueur du mérus;
Lc/lc : rapport longueur de la carapace sur sa largeur.
3. Résultats
3.1 Évolution spatiotemporelle des variables physicochimiques
Les valeurs moyennes de la température des eaux Matourou varient entre 23,18 ± 0,01 °C et 24,43 ± 0,10 °C. La température maximale (24,9 °C) a été observée à la station Mat 3 au mois de janvier. La minimale (23 °C) a été enregistrée à la station Mat 1 en mars et en avril et à la station Mat 3 en avril (Tableau 1).
Tableau 1
Variables physicochimiques du cours d’eau Matourou de janvier à juin 2014
Physicochemical variables of the Matourou stream from January to June 2014
Le pH varie entre 6,7 et 8,16. Les valeurs enregistrées au niveau de chaque station montrent une tendance à la neutralité et indiquent que les eaux de Matourou sont très faiblement basiques. Les valeurs les plus élevées ont été enregistrées à la station Mat 3 en février et en avril, alors que les plus faibles valeurs de pH sont observées à toutes les stations au mois de janvier (Tableau 1).
La teneur en oxygène dissous oscille d’un mois à l’autre et d’une station à l’autre. La plus faible valeur (68,7 %) a été observée à Mat 3 en mai alors que la valeur maximale (96,8 %) a été notée à Mat 2 en février. Les valeurs obtenues sont toutes supérieures à 50 % de saturation en oxygène (Tableau 1).
En ce qui concerne l’oxydabilité, les valeurs fluctuent entre 0 (stations Mat 1 et Mat 2 en mars et en avril et à la station Mat 3 en avril) et 5,4 mg∙L-1 (station Mat 1 en juin). Les valeurs de l’oxydabilité sont globalement inférieures à 10 mg∙L-1 indiquant la faible charge du cours d’eau Matourou en matières organiques biodégradables (Tableau 1).
Les teneurs en azote ammoniacal fluctuent entre 0,01 mg NH4∙L-1 (Mat 1 au mois de janvier) et 2,75 mg NH4∙L-1 (Mat 1 au mois de mai) et sont croissantes d’amont en aval (Tableau 1).
3.2 Composition spécifique des crustacés
Au cours de cette étude, 2 132 individus ont été récoltés appartenant tous à l’ordre des Décapodes chez lesquels les trois premières paires (P1 à P3) de thoracopodes ou péréiopodes sont transformées en maxillipèdes, les cinq paires suivantes (P4 à P8) étant les seules à fonction locomotrice. P1 est souvent transformée en pince (chélipède) et est particulièrement développée. Les périopodes sont généralement sans exopodites chez l’adulte. Ces individus sont répartis dans deux sous-ordres (Natantia et Reptantia), deux infra-ordres (Carididés et Brachyoures), trois familles (Atyidae, Paleamonidae et Potamidae), trois genres (Caridina, Macrobrachium et Soudanonautes), deux espèces de crevettes (Caridina sp., Macrobrachium sp.) et trois morphotypes de crabes du genre Soudanonautes (Figure 3).
Figure 3
Photographies des crustacés récoltés : a) Macrobrachium sp., b) Caridina sp., c), d) et e) morphotypes I, II et III de Soudanonautes spp. en vue dorso-ventrale (barre d’échelle : 10 mm)
Pictures of harvested crustaceans: a) Macrobrachium sp., b) Caridina sp., c), d) and e) morphotypes I, II and III of Soudanonautes spp. in dorso-ventral view (scale bar: 10 mm)
3.3 Caractéristiques morphologiques des différentes espèces de crustacés
3.3.1 Macrobrachium sp.
Chez cette espèce, les deux premières paires de pattes sont dissemblables; elles sont terminées par une pince. Les doigts sont tapissés de petites soies. Seule la deuxième paire est plus développée (plus puissante) avec un carpe simple et non divisé. La clé des familles de MONOD (1980) classe ces individus dans la famille des Palaemonidae. Cette famille comprend entre autres: les genres Desmocaris, Leander et Macrobrachium. Par ailleurs, les doigts des trois dernières paires de pattes (P3-P5) se terminant avec des pinces en crochets permettent de les rattacher au genre Macrobrachium selon DURAND et LÉVÊQUE (1980). Chez cette espèce, les P2 sont identiques et grêles, parcourues de fines soies sur toute leur longueur (Figure 3a). Le carpe est distinctement plus long que le mérus, le dactyle plus long que le carpe, le rostre est plus court que la carapace (Tableau 2). Chez le mâle adulte, la pince est sans tubercules autres que les quelques dents proximales sur le dactyle et le doigt. Une partie de P2 est pubescente. Le rostre peu convexe n’atteint pas l'extrémité de l'écaille antennaire. Il porte sur sa face dorsale cinq à sept épines et sur sa face ventrale trois à quatre épines; d'où la formule rostrale 5-7/3-4. Les femelles ovigères portent une vingtaine d’oeufs moyens de diamètre 5 mm collés aux pléopodes. Les individus de cette espèce sont de taille moyenne. La longueur totale varie entre 26,3 et 92,6 mm avec une moyenne de 44,1 ± 17,7 mm. Le poids des individus varie entre 18 et 455 g.
Tableau 2
Quelques données morphométriques de Caridina sp. et Macrobrachium sp.
Some morphometric data obtained on Caridina sp. and Macrobrachium sp.
3.3.2 Caridina sp.
Les individus de cette espèce ont les périopodes 1 et 2 terminés par des pinces, qui sont insérées plus ou moins obliquement dans l’échancrure distale du carpe, les doigts étant prolongés par un pinceau de soies et la mandibule dépourvue de palpe. En se référant à la clé des familles de DURAND et LÉVÊQUE (1980), ces individus sont de la famille des Atyidae. Cette famille comprend au total trois genres : Atya, Caridinopsis et Caridina. Par ailleurs, cette crevette est de petite taille (10-30 mm). Les pinces des deux paires de periopodes (P1-P2) ne sont pas fendues jusqu’à la base et présentent une portion palmaire distincte et un carpe peu ou pas échancré. Le crible digital est plus court que les pinces. P3 est grêle avec un dactyle bien développé. Le rostre est dorsalement spinuleux; P1 avec échancrure carpienne totale a une arthrobranchie à sa base. Ceci permet de les rattacher au genre Caridina (DURAND et LÉVÊQUE, 1980). Chez cette espèce, le rostre est dorsalement et ventralement spinuleux (Figure 3b). P1 est doté d’une échancrure carpienne totale. P3 très développé se termine par le dactyle. Le rostre est plus court que la carapace avec l’extrémité de l’apex rosâtre; le bord postérieur du telson porte 6-8 épines barbelées plus longues que les épines latérales internes. Chez le mâle les épines dorsales du rostre ne se limitent pas au même niveau que celles de la face ventrale, tandis que chez les femelles les épines tant de la face dorsale que ventrale du rostre se limitent au même niveau. Le corps est généralement blanc-crème avec des régions rosâtres. La longueur totale varie entre 7,76 et 29,61 mm avec une moyenne de 15,8 ± 3,0 mm. La longueur standard est plus longue que celle du rostre, de l’abdomen et de la carapace (Tableau 2).
3.3.3 Soudanonautes spp.
Les individus sont de la superfamille des Branchyoures, caractérisés par un corps aplati dorso-ventralement et une carapace élargie transversalement, sans rostre saillant individualisé; l’abdomen, très réduit, aplati, est replié sous le céphalothorax et ne porte pas d’éventail caudal. P1 est terminé par une pince ou chélipède. Selon DURAND et LÉVÊQUE (1980), les individus ayant un palpe mandibulaire avec un article terminal entier, adjacent à la mandibule appartiennent à la famille des Potamidés. Trois genres sont distingués au sein de cette famille: Potamonautes, Liberonautes et Soudanonautes. Par ailleurs, les individus dont le segment antérieur du bord antérolatéral possède une dent intermédiaire et le deuxième gonopode (Go 2) plus court que le premier gonopode (Go 1) avec l’article terminal réduit sont du genre Soudanonautes. Ainsi les crabes récoltés à Matourou appartiennent au genre Soudanonautes. En fonction de la morphologie de la carapace, la couleur, la morphologie et la disposition des pinces, et la grosseur des dents épibranchiales, trois morphotypes ont été catégorisés et caractérisés chez Soudanonautes peuplant le cours d’eau Motourou.
Chez le morphotype I, la carapace est plus large que longue, avec des contours jaunâtres (Figure 3c). La crête post-frontale est légèrement incurvée vers l’arrière et largement interrompue au milieu. La dent épibranchiale est très peu développée. Chez la femelle, l’abdomen est très large et les périopodes 1 (P1) sont de taille dissemblable en grosseur. Par contre, chez les mâles, l’abdomen est petit et les P1 sont identiques.
Chez le morphotype II, la crête post-frontale enjambe la carapace entière et se courbe brusquement vers l'arrière avant de rencontrer la dent épibranchiale (Figure 3d). Les dents ex-orbitale et intermédiaire sont grandes et pointues. Par contre, la dent épibranchiale est moins grande et se dirige à l'extérieur. Le dactyle du chélipède majeur a deux ou trois grandes dents fondues dans les régions proximales des deux doigts du chélipède et le reste des tranchants sont garnis des rangées de dents arrondies.
Chez le morphotype III, la dent ex-orbitale et la dent intermédiaire sont grandes et triangulaires alors que la dent épibranchiale est deux fois plus petite comparativement aux deux premières (Figure 3e). Les membranes arthrodiales entre les joints des chélipèdes et les péreiopodes sont rouge lumineux. La région proximale du pollex du propode du chélipède des adultes a une grande dent clairement aplatie.
3.4 Structuration des tailles et des poids des crustacés dans le cours d’eau Matourou
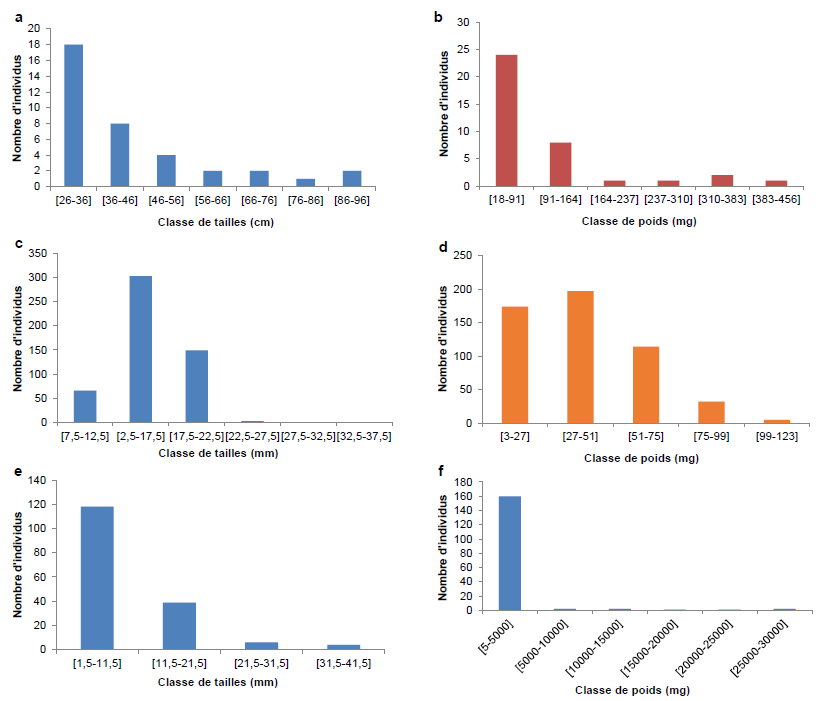
La structure des tailles et des poids est présentée par la figure 4. L’analyse des figures 4a et 4b révèle qu’en général la distribution des classes de taille et de poids chez Macrobrachium sp. est unimodale. Le mode de taille étant de 26-36 mm avec un effectif de 18 individus et celui du poids est de 18-91 g.
Figure 4
Variation d’abondance des spécimens en fonction de la taille et du poids : a) et b) Macrobrachium sp., c) et d) Caridina sp., e) et f) Soudanonautes spp.
Variation in specimen abundances according to their size and weight: a) and b) Macrobrachium sp., c) and d) Caridina sp., e) and f) Soudanonautes spp.
Les figures 4c et 4d, montrent que la distribution des classes de taille et du poids chez Caridina sp. est unimodale. La classe modale de taille est de 12,5-17,5 mm avec un effectif de 303 individus et la classe de taille la moins représentée est de 32,5-37,5 mm avec un individu (Figure 4c). Quant au poids, le mode est de 27-51 mg avec un effectif de 197 individus (Figure 4d).
La distribution des classes de taille et de poids chez Soudanonautes spp. est unimodale (Figures 4e et 4f). La classe de taille modale varie de 1,5-11,5 mm avec un effectif de 118 individus; par contre, la classe de taille la moins représentée varie de 31,5 à 41,5 mm avec quatre individus. Le mode de poids est compris entre 5 et 5 000 mg.
3.5 Relations poids/longueur des crustacés dans le cours d’eau Matourou
La figure 5 exprime les relations entre le poids total et la longueur totale de quelques espèces de crevettes rencontrées dans la zone d’étude. Chez Macrobrachium sp., le coefficient d'allométrie b est de 2,38 et le coefficient lié aux facteurs écologiques a est de 9 x 10-5 (Figure 5a). Le coefficient d’allométrie étant inférieur à 3, la croissance est négativement allométrique, l’espèce croît plus vite en longueur qu’en poids et le coefficient de détermination (R2 = 0,88) est fort élevé pour cette espèce. Le facteur de condition moyen Kmoy obtenu chez Macrobrachium sp. est de 0,75 ± 0,49
Figure 5
Droites de régression entre le poids (Pt) et la longueur totale du corps (Lt) chez les crustacés récoltés : a) Macrobrachium sp., b) Caridina sp. et c) Soudanonautes spp.
Regression lines between weight (Pt) and total body length (Lt) in harvested crustaceans: a) Macrobrachium sp., b) Caridina sp., and c) Soudanonautes spp.
La droite de régression est oblique chez Caridina sp., avec le coefficient d'allométrie b de 2,50 et le coefficient lié aux facteurs écologiques a de 4 x 10-5 et le coefficient de détermination R2 de 0,56 (Figure 5b). Le facteur b étant inférieur à 3, la croissance est négativement allométrique chez cette espèce, qui croît alors plus vite en longueur qu’en poids. Le facteur de condition moyen (Kmoy) est de 0,10 ± 0,04 chez cette espèce.
Le coefficient d'allométrie b de 2,60, le coefficient lié aux facteurs écologiques a de 0,001 et le coefficient de détermination R2 de 0,82 ont été obtenu pour Soudanonautes spp. (Figure 5c). Le facteur b < 3 traduit une croissance négativement allométrique, alors l’espèce croît plus vite en longueur qu’en poids. Le facteur de condition moyen Kmoy est de 2,39.
3.6 Dynamique des tailles des espèces de crustacés
Dans le temps, les tailles moyennes de Caridina sp. sont relativement constantes d’un mois à l’autre (19,50 ± 2,10 mm), pourtant celles de Macrobrachium sp. croissent globalement de janvier en mars (65,71 ± 4,24 mm), puis décroissent légèrement en avril et en mai (59,41 ± 3,78 mm) pour recroitre de mai en juin (66,70 ± 4,63 mm). Les moyennes de tailles de Soudanonautes spp. fluctuent légèrement d’un mois à un autre (Figure 6).
Figure 6
Variation temporelle de la longueur totale (Lt) des espèces de crustacés
Temporal variation in total lenght (Lt) of the crustacean species.
3.7 Analyse des paramètres morphométriques des crustacés
Il ressort clairement du tableau 1 que la longueur du rostre est plus petite que celle de la carapace et la longueur abdominale est plus petite que la longueur standard chez Caridina sp. et Macrobrachium sp. Le rapport moyen entre la longueur et la largeur de la carapace chez Soudanonautes spp. est de 0,78 ± 0,15 mm; ce rapport révèle que la carapace est plus large que longue.
4. Discussion
L’inventaire des crustacés dans le cours d’eau Matourou a permis de mettre en évidence trois espèces : deux crevettes et un crabe. Cette richesse en crustacés est proche de celle obtenue par FOTO MENBOHAN et al. (2013) sur le Nga en zone périurbaine de Yaoundé (région du Centre) où deux espèces de crevettes avaient été identifiées. En outre, les travaux de TCHAKONTE et al. (2014) sur la rivière Nsapè dans la banlieue de Douala (région du Littoral) ont montré l’existence de sept espèces : Caridina africana, C. nilotica, Macrobrachium tysi, M. scabriculum, M. equidens, Desmocaristri spinosa et Potamalpheop ssp. La faible richesse spécifique obtenue à Matourou serait probablement due à sa situation géographique. En effet, la région du Centre est éloignée de la mer par rapport à celle du littoral où plusieurs espèces marines remonteraient les eaux douces pour se reproduire. La richesse spécifique en crevette de la rivière Matourou est faible comparativement à celle de la rivière Boubo où N'ZI et al. (2008) ont identifié neuf espèces dans 19 points d'échantillonnage. Plusieurs facteurs expliqueraient également cette faible richesse spécifique du cours d’eau Matourou : les méthodes de pêche utilisées, les types de microhabitats échantillonnés et les périodes d’échantillonnage (KOUAMELAN et al. 2003). L’espèce Macrobrachium sp. que nous avons récoltée est différente des six espèces de Macrobrachium (M. macrobrachion, M. vollenhovenii, M. dux, M. spI, M. felicinum et M. raredens) recensées par AGADJIHOUEDE (2006) dans la lagune du Grand Popo au Bénin, mais se rapproche de M. macrobrachion.
La croissance allométrique négative observée chez Macrobrachium sp. est positive chez M. vollenhovenii, M. macrobrachion et M. dux récoltées dans la lagune du Grand Popo au Bénin par AGADJIHOUEDE (2006). L’augmentation de la taille des spécimens de Macrobrachium sp. au mois de mars serait assimilable à la saison sèche qui n’est pas propice à la reproduction. Le milieu est à cet effet peuplé d’adultes. En saison de pluies, par contre, la baisse de taille des spécimens récoltés serait liée à leur période de reproduction, ainsi le milieu est peuplé par des larves et des jeunes organismes. Les facteurs de condition K obtenus varient d’une espèce à l’autre. Les valeurs moyennes de Kmoy et de b obtenus pour l’espèce de crevette (Caridina sp.) et l’espèce de crabe (Soudanonautes spp.) les plus abondantes montrent que les conditions hydrologiques et physicochimiques du milieu sont acceptables pour l’espèce de Caridina sp. et Soudanonautes spp.
5. Conclusion
Notre étude portait sur la description des crustacés du cours d’eau Matourou. Ce cours d’eau est de très bonne qualité : bien oxygéné, faiblement minéralisé et présentant de faibles charges en matières en suspension. Il abrite deux espèces de crevettes Caridina sp. et Macrobrachium sp. et trois morphotypes de crabes du genre Soudanonautes. L’espèce Caridina sp., la plus dominante est une crevette de petite taille; la distribution de classe de taille est unimodale et son modèle de croissance est négativement allométrique. Macrobrachium sp., par contre, est une crevette de taille moyenne et a une croissance négativement allométrique. La carapace est plus large que longue chez les trois morphotypes de crabe Soudanonautes spp. Macrobrachium sp. présente également le même modèle de croissance que les crevettes. Les variables environnementales (température, pH, oxygène dissous, l’oxydabilité et l’azote ammoniacal) du cours d’eau Matourou seraient favorables au développement de Caridina sp. et Soudanonautes spp. régulièrement retrouvées dans les eaux saumâtres en zone littorale.
Appendices
Références bibliographiques
- AGADJIHOUEDE H. (2006). Diversité et exploitation des crevettes d’eau douce dans la lagune de Grand-Popo (Bas-Mono). Thèse d’ingénieur, Univ. Abomey-Calavi, Bénin, 67 p.
- BONY Y.K., N.C. KOUASSI, D. DIOMANDE, G. GOURE’NE, M. VERDOIT-JARRAYA et J.P. POINTIER (2008). Ecological conditions for the spread of the invasive snail Physa marmorata (Pulmonata: Physidae) in Ivory Coast. African Zoology, 43, 53-60.
- DURAND J.R. et C. LÉVÊQUE (1980). Flore et faune aquatiques de l’Afrique sahélo-soudanienne. Tome II, ORSTOM, Paris, France, 517 p.
- FOTO MENBOHAN S., S. TCHAKONTE, G. AJEAGAH, S.H. ZEBAZE TOGOUET, C.F. BILONG BILONG et T. NJINE (2013). Water quality assessment using benthic macroinvertebrates in a periurban stream (Cameroon). Int. J. Biotech., 2, 91-104.
- INSTITUT NATIONAL DE CARTOGRAPHIE (INC) (1980). Carte topographique d’Edéa et Yaoundé, feuille 1d au 1/200.000. Yaoundé, Cameroun.
- INSTITUT DE RECHERCHE POUR LE DÉVELOPPEMENT (IRD) (1999). The freshwater crabs of West Africa. Institut de recherche démographique, Collection faune et flore tropicale, France, 383 p.
- KODJO (1998). Recherche pour la maîtrise du ruissellement pluvial à Yaoundé. Thèse de doctorat, Univ. Yaoundé 1, Camroun, 299 p.
- KOJI E., C. LONTSI DJIMELI, A. TAMSA ARFAO, V. NOAH EWOTI, S. TCHAKONTE, G. BRICHEUX, M. NOLA et T. SIME-NGANDO (2015). Abundance dynamic of vibrio cells associated with freshwater shrimps Atyidae (Crustacea-Decapoda) in the coastal surface waters of Cameroon (Central Africa): Assessment of the role of some environmental factors. Int. J. Curr. Microbiol. App. Sci., 4 (6), 358-378.
- KOUAMELAN E.P., G.G. TEUGELS, V. N’DOUBA, G. GOORE BI et T. KONE (2003). Fish diversity and its relationships with environmental variables in a West African basin. Hydrobiologia, 505, 139-146.
- MINISTÈRE DES EAUX ET FORÊTS (MINEF) - ORGANISATION DES NATIONS UNIES POUR LE DÉVELOPPEMENT INDUSTRIEL (ONUDI) - PROGRAMME DES NATIONS UNIES POUR LE DÉVELOPPEMENT (PNUD) - FONDS POUR L'ENVIRONNEMENT MONDIAL (FEM) (1999). Profil côtier du Cameroun. Projet régional : Contrôle de la pollution de l'eau et conservation de la diversité biologique dans le grand écosystème marin du golfe de Guinée (GEM-GOG). Publié sous la direction du coordinateur régional du projet GEM-GOG, ADE Graphics Industries, Yaoundé, Cameroun, 113 p.
- MOISAN J. (2010). Guide d’identification des principaux macroinvertébrés benthiques d’eau douce du Québec. Surveillance volontaire des cours peu profonds. Direction du suivi de l’état de l’environnement, Ministère du Développement durable, de l’Environnement et des Parcs, Québec, QC, Canada, 82 p.
- MONOD T. (1980). Décapode. Dans : Flore et faune aquatiques de l’Afrique sahélo-soudanienne. DURAND J.R. et C. LÉVÊQUE (éd.), Vol. 1, 44, ORSTOM, Paris, France, pp. 369-389.
- N’ZI K.G., B.G. GOORE, E.P. KOUAMELAN, T. KONE, V. N’DOUBA et F. OLLEVIER (2008). Influence des facteurs environnementaux sur la répartition spatiale des crevettes dans un petit bassin ouest africain - rivière Boubo, Côte d’Ivoire. Tropicultura, 26 (1) ,17-23.
- POUPIN J., J.P. QUOD, M. ZUBIA, S. BOLLARD, A. BARRERE et H. MAGALON (2013). Les crustacés de La Réunion (Crustacea, Decapoda) dans la zone marine du Piton de la Fournaise. Rapport scientifique, Institut de recherche de l’école navale, Canada, 10 p.
- RODIER J., B. LEGUBE, N. MARLET, R. BRUNET (2009). L’analyse de l’eau. 9e édition, Dunod, Paris, France, 1579 p.
- RODNEY F., R.Y. LI et C.E. SCHWEITZER (2007). A new family, genus, and species of crab (Crustacea, Decapoda, Brachyura) from the Upper Cretaceous (Campanian) of Manitoba, Canada. Can. J. Earth Sci., 44 (12), 1741-1752.
- TACHET H., P. RICHOUX, M. BOURNAUD et P. USSEGLIO-POLATER (2006). Invertébrés d’eau douce : systématique, biologie et écologie. CNRS éditions, Paris, France, 588 p.
- TCHAKONTE S., G. AJEAGAH, D. DIOMANDE, A.I. CAMARA, M. KONAN KOFFI et P. NGASSAM (2014). Impact of anthropogenic activities on water quality and freshwater shrimps diversity and distribution in five rivers in Douala, Cameroon. J. Biodiversity Environ. Sci., 4 (2), 183-194.
- TUEKAM KAYO R., P. MARMONIER, S.H. ZEBAZE TOGOUET, M. NOLA et C. PISCART (2012). An annotated checklist of freshwater stygobiotic crustaceans of Africa and Madagascar. Crustaceana, 85 (12-13), 1613-1631.
- WATER RESEARCH COMISSION (WRC) (2001). Guides to the freshwater invertebrates of southern Africa. Volume 4: Crustacea III. Bathynellacea, Amphipoda, Isopoda, Pelaeogriphacea, Tanaidacea, Decapoda. DAY J.A., B.A. STEWART, I.J. MOOR et A.E. LOUW (éd.), WRC Report No TT 141/01, Pretoria, Afrique du Sud, 150 p.
List of figures
Figure 1
Bassin versant de Matourou (carte topographique d’Edéa et Yaoundé, feuille 1d au 1/200 000, source : INC)
The Matourou watershed (topographic map of Edéa and Yaoundé, sheet 1d at a scale of 1/200 000, source: INC)
Figure 2
Paramètres morphométriques considérés chez les crustacés : a) crevette en vue latérale et b) crabe en vue dorsale. La : longueur de l’abdomen, Lc : longueur de la carapace, Lr : longueur du rostre, Ls : longueur standard, Lt : longueur totale du corps, Lm : longueur du mérus, Lca : longueur du carpe
Morphometric parameters considered in crustaceans: a) shrimp in lateral view and b) crab in dorsal view. La: length of the abdomen, Lc: length of the carapace, Lr: length of the rostrum, Ls: standard length, Lt: total body length, Lm: length of the merus, Lca: length of the carp
Figure 3
Photographies des crustacés récoltés : a) Macrobrachium sp., b) Caridina sp., c), d) et e) morphotypes I, II et III de Soudanonautes spp. en vue dorso-ventrale (barre d’échelle : 10 mm)
Pictures of harvested crustaceans: a) Macrobrachium sp., b) Caridina sp., c), d) and e) morphotypes I, II and III of Soudanonautes spp. in dorso-ventral view (scale bar: 10 mm)
Figure 4
Variation d’abondance des spécimens en fonction de la taille et du poids : a) et b) Macrobrachium sp., c) et d) Caridina sp., e) et f) Soudanonautes spp.
Variation in specimen abundances according to their size and weight: a) and b) Macrobrachium sp., c) and d) Caridina sp., e) and f) Soudanonautes spp.
Figure 5
Droites de régression entre le poids (Pt) et la longueur totale du corps (Lt) chez les crustacés récoltés : a) Macrobrachium sp., b) Caridina sp. et c) Soudanonautes spp.
Regression lines between weight (Pt) and total body length (Lt) in harvested crustaceans: a) Macrobrachium sp., b) Caridina sp., and c) Soudanonautes spp.
Figure 6
Variation temporelle de la longueur totale (Lt) des espèces de crustacés
Temporal variation in total lenght (Lt) of the crustacean species.
List of tables
Tableau 1
Variables physicochimiques du cours d’eau Matourou de janvier à juin 2014
Physicochemical variables of the Matourou stream from January to June 2014
Tableau 2
Quelques données morphométriques de Caridina sp. et Macrobrachium sp.
Some morphometric data obtained on Caridina sp. and Macrobrachium sp.