Abstracts
Résumé
Cet article traite de l’aspect global et des effets positifs etnégatifs du phénomène de la décompositiondes feuilles, qui représente l’une des principalescaractéristiques du fonctionnement hétérotrophedes milieux aquatiques. L’objectif de cette étudeétait d’évaluer la relation entre les coursd’eau et les milieux terrestres adjacents, puisque c’est auniveau des interfaces terre/eau que se résument les grandesétapes du fonctionnement d’un écosystème.Nous avons utilisé la technique des sacs à mailles, avecdes sachets de 0,5 cm d’ouverture de mailles permettant ainsi unaccès plus facile à la majeure partie desinvertébrés aquatiques qui interviennent dans ladégradation des feuilles dans l’eau. Les sachetsétaient introduits dans l’eau avec deux ou trois pierrespermettant de les lester au fond. Au niveau de la dégradationdes feuilles, nous avons constaté que les feuilles de laurierrose se décomposent et perdent leurs poids plus rapidement quecelles d’eucalyptus, une perte d’ailleurs trèsrapide puisqu’elle atteint la valeur de 70 % du poidsinitial en 30 jours seulement. Cette perte du poids initial pourraitêtre liée au phénomène de lessivage desfeuilles, lui-même dépendant de la texture et de lastructure des feuilles et de l’action desinvertébrés, particulièrement celle des mollusques(dilacérateurs) et des diptères (filtreurs) quicontribuent pour une part très importante dans ladégradation des feuilles. Cette période est assez rapidepour les feuilles de laurier rose (15 jours), alors qu’elle estrelativement longue pour celles d’eucalyptus (30 jours) dont lacolonisation par les invertébrés, aussi bien en nombrequ’en biomasse, demeure plus faible par rapport à celledes feuilles de laurier.
Mots-clés :
- Décomposition,
- feuilles,
- milieux aquatiques,
- laurier rose,
- eucalyptus,
- lessivage
Abstract
This work deals with the overall process and the positive and negativeeffects of the breakdown of leaves, which is a major feature of thefunctioning of heterotrophic aquatic systems. The aim of the study wasto evaluate the relationship between the stream and the adjacentterrestrial ecosystem, since is at the land/water interface thatimportant features of ecosystem functioning can be found. We have usedthe technique of mesh bags with 0.5 cm openings that allow for easyaccess by a large proportion of the aquatic invertebrates thatcontribute to the degradation of leaves in water. We have alsointroduced two or three stones in order to anchor the mesh bags on thestreambed. Regarding the degradation of the leaves, we found that theoleander leaves decompose and lose their weight faster than theeucalyptus leaves, this loss being very rapid, reaching a value of 70%of the initial weight after 30 days. The initial weight loss could berelated to leaf leaching, which depends on the texture and structure ofthe leaves and the action of invertebrates, especially of molluscs(macerators) and Diptera (filterers) that contribute in large measureto the degradation of the leaves. This period of weight loss is quiteshort for oleander leaves (15 days), while it is relatively long forthose of eucalyptus (30 days), the colonization of which byinvertebrates, both in number and biomass, remains lower than that ofoleander bay leaves.
Keywords:
- Decomposition,
- leaves,
- aquatic,
- oleander,
- eucalyptus,
- leaching
Article body
1. Introduction
Avec la chute automnale des feuilles, qui représente une importante source d’énergie pour les communautés aquatiques animales (ANDERSON et SEDELL, 1979; CUMINS et al., 1966; FISHER et LIKENS, 1973), débute un ensemble de processus physiques, chimiques et biologiques complexes qui aboutissent à la minéralisation de la matière organique particulaire, et par conséquent, à la libération d’éléments biogènes. La dynamique de ces processus conditionne, dans une large mesure, la nutrition minérale et azotée des plantes aquatiques.
La décomposition des feuilles dans l’eau est le résultat de trois phases distinctes :
Le lessivage : phénomène de dissolution physique des substances hydrosolubles des feuilles (NYKVIST, 1963; BUNN, 1988; WEBSTER et BENFIELD, 1986);
La décomposition microbienne : action des bactéries et champignons qui transforment la matière organique végétale en protéines microbiennes pour augmenter leur propre biomasse. Cette décomposition microbiologique de la matière organique particulaire s’effectue par des enzymes microbiennes extracellulaires, qui sont généralement libérées à la limite des surfaces cellulaires (SINSABAUGH et al., 1981; SINSABAUGH et LIKENS, 1990);
L’action des invertébrés, particulièrement les dilacérateurs, qui s’attaquent à la matrice foliaire des résidus grossiers.
GESSNER et al. (1999) pensent que ces trois étapes de la décomposition des feuilles dans l’eau agissent simultanément. Les différents agents décomposeurs (dilacérateurs, champignons et bactéries) contribuent au processus par différents moyens, dépendant des conditions environnementales et de la qualité de litière (BERRAHOU, 1995).
L’ensemble de ces trois phases est également sous la dépendance des caractéristiques physico-chimiques du milieu récepteur (température, composition chimique de l’eau, vitesse du courant, etc.). Cet article traite de l’aspect global et des effets positifs et négatifs du phénomène de la décomposition des feuilles, qui représente l’une des principales caractéristiques du fonctionnement hétérotrophe des milieux aquatiques. L’objectif de cette étude est d’évaluer la relation entre les cours d’eau et les milieux terrestres adjacents, puisque c’est au niveau des interfaces terre/eau que se résument les grandes étapes du fonctionnement d’un écosystème.
Pour estimer la vitesse de décomposition des apports feuillus, certains auteurs (IVERSEN, 1973, 1975; PETERSEN et CUMINS, 1974; REICE, 1974; SEDELL et al., 1975; NAIMAN et SEDELL, 1979; ROUNICK et WINTERBOURN, 1983; ANDERSON et al., 1984; PATTEE et al., 1986) utilisent la différence de perte de poids par rapport au poids initial du matériel foliaire présent dans les échantillons aux différents stades de la décomposition.
D’autres (CHERGUI et PATTE, 1988, 1991) suggèrent que la mesure de la perte de poids au cours du temps ne décrit pas la décomposition de manière parfaite. Certains fragments de feuilles peuvent se détacher pour se décomposer plus tard, sur le fond (BENFIELD et al., 1977), éventuellement dans les bassins calmes par voie anaérobie (PETERSEN et CUMMINS, 1974), ou être transportés hors du système (FISHER et LIKENS, 1973). Ils préconisent d’utiliser le terme de dégradation au lieu de celui de décomposition.
2. Matériel et méthodes
2.1 Choix et récolte du matériel foliaire
Nous avons choisi pour notre étude les feuilles de deux essences végétales :
les feuilles d’eucalyptus (Eucalyptus camaldulensis). Cet arbre occupe une part importante de la couverture végétale du secteur d’étude (Aïn Chkef);
les feuilles de laurier rose (Nerium oleander), espèce largement répandue le long du cours d’eau d’Aïn Louali, mais pouvant être considérée comme étrangère au secteur d’étude.
Les feuilles des deux espèces étaient récoltées en automne lors de leur chute naturelle. Un tri préalable au laboratoire fut nécessaire, suivi d’un séjour à l’étuve à 40 °C pendant 48 h. Les feuilles étaient ensuite refroidies dans des dessiccateurs, puis pesées à 0,2 mg près par lots de 2 g environ et enfin stockées dans des sacs en plastique jusqu’à leur utilisation.
2.2 Techniques d’étude de la dégradation des feuilles dans l’eau
Pour suivre la dégradation des feuilles mortes dans les écosystèmes aquatiques, deux techniques sont généralement utilisées par les différents auteurs : les sacs à mailles (IVERSEN, 1975; DE LA CRUZ et POST, 1977; WINTERBOURN, 1978; ROUNICK et WINTERBOURN, 1983; PATTEE et al., 1986) et les paquets de feuilles attachées par leurs pétioles avec un fil (PETERSEN et CUMMINS, 1974; BENFIELD et al., 1977).
La technique des paquets de feuilles simule les accumulations naturelles des feuilles d’automne et permet ainsi un accès facile à tous les invertébrés aquatiques, quelles que soient leurs tailles, ce qui favorise une dégradation très proche de la dégradation naturelle. Cependant, l’utilisation de cette technique pose quelques problèmes pratiques. Les feuilles doivent être manipulées avec délicatesse pour éviter la cassure des pétioles au moment de leur assemblage, et surtout au moment de leur retrait de l’eau. Certains fragments grossiers peuvent en effet s’en détacher et dériver plus loin en aval, faussant la mesure de la perte de poids des feuilles.
La technique des sacs à mailles permet en revanche de récupérer la totalité du matériel foliaire restant. L’inconvénient de l’utilisation de cette technique, c’est qu’en fonction des tailles des sacs, certains représentants de la faune aquatique peuvent être exclus et ne participent pas ainsi au processus de dégradation des feuilles. En plus, ces sacs peuvent constituer des substrats pour la fixation de certaines composantes de la faune benthique sans qu’elles soient directement liées au processus de décomposition de la matière organique particulaire.
2.3 Technique utilisée dans le présent travail
Pour remédier aux problèmes cités plus haut, nous avons choisi la technique des sacs à mailles, mais avec des sachets de 0,5 cm d’ouverture de mailles, permettant ainsi un accès plus facile à la majeure partie des invertébrés aquatiques qui interviennent dans la dégradation des feuilles dans l’eau. Les sachets utilisés avaient 15 x 15 cm de côtés. Les lots de feuilles, préalablement préparés, étaient introduits chacun dans un sachet avec deux ou trois pierres permettant de le lester au fond de l’eau. Les sachets étaient ensuite attachés à la végétation riveraine à l’aide d’un fil de nylon, puis déposés au niveau des différents points de prélèvement. Chaque sachet portait une petite étiquette en plastique indiquant le poids exact des feuilles qu’il contenait.
2.4 Description du milieu d’étude
L’étude était réalisée dans le cours d’eau d’Aïn Chkef (Figure 1). C’est un petit cours d’eau qui prend sa source à Aïn Chkef à peu près à 7 km de la ville de Fès, au fond d’un cirque de falaises abruptes (coordonnées Lambert : X = 534.75; Y = 374) (TALASSE, 1953). Au niveau de la source, l’eau s’étale dans une dépression de 4,5 m de longueur et de 3 à 4 m de largeur avant de couler sur le reste de son parcours. Une partie de l’eau de la source est utilisée pour alimenter le complexe d’Aïn Chkef.
Figure 1
Localisation du milieu d’étude. Coordonnées géographiques d’Aïn Chkef : latitude = 38°58′N; longitude = 3°01′26′′O; altitude = 540 m
Location of the study site. Aïn Chkef geographic coordinates: latitude = 38°58′N; longitude = 3°01′26′′W; altitude = 540 m
La végétation aquatique est constituée d’algues vertes filamenteuses. La végétation riveraine est composée essentiellement d’Equisetum fluviatilis, de Scirpus lacustris, de Salix sp. et de Typha latifolia. Les versants de la vallée sont recouverts essentiellement d’Eucalyptus camaldulensis. Le lit du cours d’eau est recouvert essentiellement de sable et de vase avec quelques pierres par endroits. La faune aquatique est dominée principalement par Gambusia affinis (petit poisson qui joue un rôle important dans la lutte contre les anophèles, en consommant une grande quantité de larves) et par Melanopsis, gastéropode prosobranche considéré comme principal agent de dilacération des apports feuillus aux eaux douces (CHERGUI et PATTE, 1991).
Les sachets de feuilles (répartis par lots de trois sachets pour chaque point de prélèvement) étaient déposés tout au long des rives et camouflés sous le couvert de la végétation riveraine qui s’avance dans l’eau et dans les lacis des racines pour éviter tout acte de vandalisme.
2.5 Récupération et traitement des sachets
Toutes les deux semaines, trois sachets étaient prélevés pour les feuilles d’eucalyptus et trois autres pour les feuilles de laurier rose. Au moment de son retrait, chaque sachet de feuilles était immédiatement glissé dans un sac en plastique étanche afin d’éviter le départ de la faune associée aux feuilles et la perte de matériel foliaire. Une fois arrivé au laboratoire, chaque sachet était traité de la manière suivante :
lavages répétés (sur un tamis de 160 µm) de toutes les feuilles (ou du moins des fragments qui restaient) une à une, à l’aide d’un pinceau et sous un faible jet d’eau afin d’éliminer le détritus et le limon. Cette opération demande beaucoup de précautions, et elle est d’autant plus difficile que la durée de séjour des feuilles dans l’eau est plus grande;
séchage du matériel foliaire restant, à l’étuve à 40 °C pendant 48 h;
nouvelle pesée à 0,2 mg, après passage dans un dessiccateur.
Pour chaque date de prélèvement, la perte de poids des feuilles est estimée en déterminant le poids résiduel des feuilles en pourcentage à partir de la formule suivante :
où Pr = poids résiduel (%), Pi = poids initial des feuilles (g) et Pf = poids final des feuilles (g).
3. Résultats et discussion
Après trois mois et demi d’immersion dans l’eau, les feuilles de laurier rose ont perdu plus de 80 % de leur poids initial alors que les feuilles d’eucalyptus n’en ont perdu que 60 % (Figure 2). Les feuilles de laurier rose se fragmentent et se désagrègent plus rapidement que les feuilles d’eucalyptus. Les courbes de la figure 2, qui exprime la variation temporelle du poids résiduel des feuilles des deux espèces, montrent que :
pour les feuilles de laurier rose, il y a une première phase rapide qui dure environ 30 jours, durant laquelle les feuilles perdent plus de 70 % de leurs poids initiaux et d’une seconde phase, plus lente et plus régulière qui dure environ 80 jours, durant laquelle la perte de poids des feuilles ne dépasse pas les 10 %;
pour les feuilles d’eucalyptus, il y a une première phase relativement rapide d’une durée de 45 jours où la perte atteint 30 % du poids initial des feuilles et une seconde phase plus lente et régulière, d’une durée de 60 jours, durant laquelle les feuilles perdent 20 % de leur poids.
Figure 2
Évolution du poids résiduel des feuilles d’eucalyptus (a) et de laurier rose (b) dans l’eau
Change over time of the weight of eucalyptus (a) and oleander (b) leaves in water
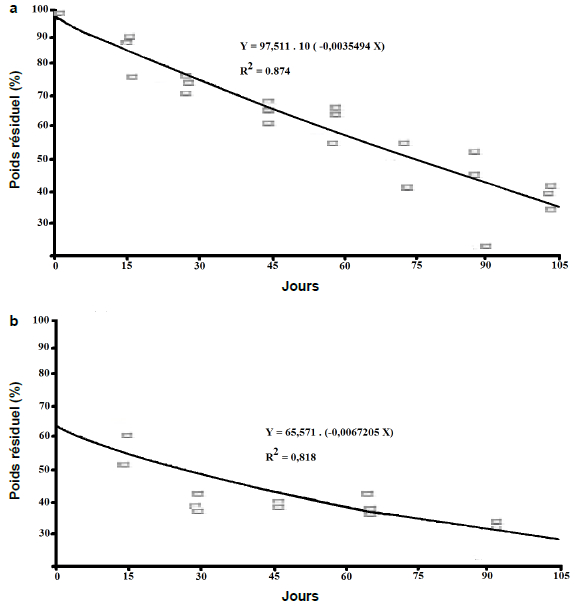
La première phase rapide correspondrait, en grande partie, au phénomène de lessivage. La perte de poids qui en résulte dépend de l’essence végétale considérée (POZO, 1993), sa texture, sa structure et son contenu en substances hydrosolubles. Pour les aiguilles de pin, par exemple, les substances solubles sont lessivées lentement alors que pour les litières feuillues, le lessivage est très rapide (NYKVIST, 1963). La deuxième phase plus lente et régulière, avec une perte de poids faible pour les feuilles des deux espèces, correspondrait à l’intervention des invertébrés aquatiques. Les coefficients de dégradation journalière de l’eucalyptus et du laurier rose sont respectivement de 0,0035 et 0,0067 (Figure 3).
Figure 3
Modélisation exponentielle de la dégradation des feuilles d’eucalyptus (a) et de laurier rose (b) dans l’eau
Exponential model of the degradation of eucalyptus (a) and oleander (b) leaves in water
Les feuilles d’eucalyptus peuvent ainsi persister pendant au moins six mois dans l’eau, sans qu’elles soient pour autant réfractaires. Comparées aux feuilles d’Eucalyptus globulus, qui ont été étudiées (LOPEZ et al., 1997) dans un petit cours d’eau de la région nord-ouest de l’Espagne (coefficients de dégradation de -0,00228 < k < -0,00449), Eucalyptus camaldulensis semble se placer dans la même gamme, avec toutefois une différence entre les deux espèces d’eucalyptus liée à l’état des feuilles avant leur immersion dans l’eau. Dans notre étude, les feuilles d’Eucalyptus camaldulensis étaient séchées avant leur incubation, alors que celles d’Eucalyptus globulus étaient utilisées à l’état frais. TIMMONS et al. (1970), STOUT et al. (1985), GESSNER et SCHOWOERBEL (1989), BÄRLOCHER (1992, 1995) et GESSNER et al. (1999) ont montré que quand les feuilles fraîches sont placées dans l’eau, le lessivage, la perte de masse et la colonisation microbienne sont tous beaucoup plus lents que pour les feuilles sèches.
Le climat intervient également par l’intermédiaire de la température et l’humidité. Sous climat méditerranéen chaud, tel que celui du Maroc, la décomposition est plus rapide. La température augmente la vitesse de décomposition indirectement en agissant sur l’activité des microorganismes et en accélérant les processus enzymatiques intervenant dans le processus de décomposition des feuilles (CHERGUI et LEGSSYER, 1995). Par ailleurs, la faible vitesse de la décomposition des feuilles de certaines espèces d’eucalyptus serait liée à leur texture et leur faible teneur en composés azotés (BUNN, 1988; POZO, 1993; MOLINERO et al., 1996).
PETERSEN et CUMMINS (1974) classent les feuilles en trois catégories en fonction de leur taux de décomposition dans les écosystèmes aquatiques : feuilles à dégradation lente, moyenne ou rapide. Cette classification est basée sur l’estimation du coefficient de dégradation journalière, k. Les deux essences végétales étudiées ici sont ainsi classées dans la catégorie des feuilles à décomposition lente (k = -0,003) pour l’eucalyptus et celle des feuilles à décomposition moyenne (k = -0,006) pour le laurier rose. La perte de poids des feuilles au cours du temps (Figure 2) peut être décrite par un modèle exponentiel (OLSON, 1963; PETERESEN et CUMMINS, 1974; HODKINSON, 1975; SEDELL et al., 1975; TRISKA et al., 1975; BENFIELD et al., 1977) :
où Yt = poids résiduel des feuilles au temps t, Y0 = poids initial des feuilles et k = coefficient de dégradation exponentielle. Signalons cependant que ce modèle simple ne différencie pas entre la perte par simple dissolution et la perte par dégradation.
Pour les deux types de feuilles étudiées et pendant toute la période de prélèvement, nous remarquons que les mollusques et les diptères occupent la première place en présence et en nombre, suivi des crustacés, des oligochètes, des coléoptères et des odonates; ces différents groupes jouent un rôle essentiel dans la dégradation des feuilles (Tableau 1).
Tableau 1
Abondance des invertébrés récoltés
Abundance of invertebrates collected
4. Conclusion
Dans cette étude comparative de la dégradation des feuilles d’eucalyptus et de laurier rose, nous constatons que les feuilles de laurier rose se décomposent et perdent leur poids plus rapidement que les feuilles d’eucalyptus. Cette perte atteint jusqu’à 70 % du poids initial en 30 jours seulement. Elle pourrait être liée au phénomène de lessivage des feuilles, lui-même dépendant de la texture et de la structure des feuilles. Après cette première phase de lessivage, l’action des invertébrés se manifeste, particulièrement celle des mollusques (dilacérateurs) et des diptères (filtreurs) qui contribuent pour une part très importante dans la dégradation des feuilles. Ces organismes abondent dans tous les prélèvements et pour les deux espèces, mais leur présence ne s’affirme qu’après la période de conditionnement des feuilles par la microflore aquatique. Cette période est assez rapide pour les feuilles de laurier rose (15 jours) alors qu’elle est relativement longue pour celles d’eucalyptus (30 jours) dont la colonisation par les invertébrés, aussi bien en nombre qu’en biomasse, demeure plus faible par rapport à celle des feuilles de laurier.
Appendices
Références bibliographiques
- ANDERSON N.H. et J.R. SEDELL (1979). Detritus processing by macroinvertebrates in stream ecosystems. Annu. Rev. Entomol., 24, 351-377.
- ANDERSON N.H., R.J. STEEDMAN et T. DUDLEY (1984). Patterns of exploitation by stream invertebrates of woos debris (xylophagy). Verh. Internat. Verein Limnol., 22, 1847-1852.
- BÄRLOCHER F. (1992). Effects of drying and freezing autumn leaves on leaching and colonization by aquatic hyphomycetes. Freshwater Biol., 28, 1-7.
- BÄRLOCHER F. (1995). Decomposition: how limnologists were led astray by soil ecologists., Verh. Internat. Verein Limnol., 26, 1813.
- BENFIELD E.F., D.S. JONES et M.F. PATTERSON (1977). Leaf pack processing in a pastureland stream. Oikos, 29, 99-103.
- BERRAHOU A. (1995). Recherche sur la distribution longitudinale des macroinvertebrés benthiques : cas du Rhône Français et des cours d’eaux marocains. Thèse de doctorat, Univ. Mohammed 1er, Oujda, Maroc, 211 p.
- BUNN S.E. (1988). Processing of leaf litter in a northern jarrah forest stream, Western Australia: 1. Seasonal differences. Hydrobiologia, 162, 201-210.
- CHERGUI H. et B. LEGSSYER (1995). Variation de l’activité des microorganismes au cours de la décomposition des feuilles de Salix pedicellata dans le réseau de la Basse Moulouya, Maroc oriental. Ann. Limnol - Int. J. Lim., 31, 287-298.
- CHERGUI H. et E. PATTEE (1988). The effect of water current on the decomposition of dead leaves and needles. Verh. Internat. Verein Limnol., 23, 1294-1298.
- CHERGUI H. et E. PATTEE (1991). Dégradation des feuilles mortes allochtones dans le réseau de la basse Moulouya au Maroc. Acta. Oecol., 12, 543-560.
- CUMMINS K. W. KOFFMAN W. P. et ROFFP A. (1966). Trophic relationships in a small woodland stream. Verh. Internat. Verein Limnol., 16, 627-638.
- DE LA CRUZ A.A. et H.A. POST (1977). Production and transport of organic matter in a woodland stream. Arch. Hydrobiol., 80, 227-238.
- FISHER S.G. et G.E. LIKENS (1973). Energy flow in Bear Brook, New Hampshire: an integrative approach to stream ecosystem metabolism. Ecol. Monogr., 43, 421-439.
- GESSNER M.O. et J. SCHOWOERBEL (1989). Leaching kinetics of fresh leaf litter with implications for the current concept of leaf processing in streams. Arch. Hydrobiol., 115, 81-90.
- GESSNER M.O., E. CHAUVET et M. DOBSON (1999). A perspective on leaf litter breakdown in streams. Oikos, 85, 377-384.
- HODKINSON I.D. (1975). Dry weight loss and chemical changes in vascular plant litter of terrestrial origin occurring in a beaver pond ecosystem. J. Ecol., 63, 131-142.
- IVERSEN T.M. (1973). Decomposition of autumn-shed leaves in a springbrook and its significance for fauna. Arch. Hydrobiol., 72, 305-312.
- IVERSEN T.M. (1975). Disappearance of autumn-shed beech leaves in bags in small streams. Verh. Internat. Verein Limnol., 19, 1687-1692.
- LOPEZ E.S., N. FELPETO et I. PARDO (1997). Comparisons of methods to study the processing of Alnus glutinosa and Eucalyptus globulus leaves in a forested headwater stream. Limnetica, 13, 13-18.
- MOLINERO J., J. POZO et R. GONZALES (1996). Litter breakdown in streams of the Aguera catchment; influence of dissolved nutrients and land use. Freshwater Biol., 36, 745-75.
- NAIMAN R.J. et J.R. SEDELL (1979). Benthic organic matter as a function of stream order in Oregon. Arch. Hydrobiol., 87, 404-422.
- NYKVIST N. (1963). Leaching and decomposition of water-soluble organic substances from different types of leaf and needle litter. Studia forestalia Suecica, 3, 1-31.
- OLSON J.S. (1963). Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 44, 322-331.
- PATTEE E., C. BORNARD et S. MOURELATOS (1986). La décomposition des feuilles mortes dans le réseau fluvial du Rhône : influence du milieu et principaux agents responsables. Rev. Fr. Sci. Eau, 5, 45-74.
- PETERSEN R.C. et K.W. CUMMINS (1974). Leaf processing in a woodland stream. Freshwater Biol., 4, 343-368.
- POZO J. (1993). Leaf litter processing of alder and eucalyptus in the Aguera stream system (north Spain). 1. Chemical changes. Arch. Hydrobiol., 127, 299-317.
- REICE S.R. (1974). Environmental patchiness and the breakdown of leaf litter in a woodland stream. Ecology, 55, 1271-1282.
- ROUNICK J.S. et M.J. WINTERBOURN (1983). Leaf processing in two contrasting beech forest streams: effects of physical and biotic factors on litter breakdown. Arch. Hydrobiol., 96, 448-474.
- SEDELL J.R., F.J. TRISKA et N.S. TRISKA (1975). The processing of conifer and hardwood leaves in two coniferous forest streams. 1. Weight loss and associated invertebrates. Verh. Internat. Verein Limnol., 19, 1617-1627.
- SINSABAUGH R.L. et A.E. LINKINS (1990). Enzymatic and chemical analysis of particulate organic matter from a boreal river. Freshwater Biol., 23, 301-309.
- SINSABAUGH R.L., E.F. BENFIELD et A.E. LINKINS (1981). Cellulase activity associated with the decomposition of leaf litter in a woodland stream. Oikos, 36, 198-190.
- STOUT R.J., W.T. TAFT et T. MERRITT (1985). Patterns of macroinvertebrate colonization on fresh and senescent alder leaves in two Michigan streams. Freshwater Biol., 15, 573-579.
- TIMMONS D.R., R.F. HOLT et J.J. LATERFELL (1970). Leaching of crop residues a source of nutrients in surface runoff water. Water Resour. Res., 6, 1367-1375.
- TRISKA F.J., J.R. SEDELL et B. BUCKLEY (1975). The processing of conifer and hardwood leaves in two coniferous forest streams. II. Biochemical and nutrient changes. Verh. Internat. Verein Limnol., 19, 1628-1639.
- WEBSTER J. et E.K. BENFIELD (1986). Vascular plant breakdown in freshwater ecosystems. Annu. Rev. Ecol. Syst., 17, 567-594.
- WINTERBOURN M.J. (1978). An evaluation of the mesh bag method for studying leaf colonization by stream invertebrates. Verh. Internat. Verein Limnol., 20, 1557-1561.
List of figures
Figure 1
Localisation du milieu d’étude. Coordonnées géographiques d’Aïn Chkef : latitude = 38°58′N; longitude = 3°01′26′′O; altitude = 540 m
Location of the study site. Aïn Chkef geographic coordinates: latitude = 38°58′N; longitude = 3°01′26′′W; altitude = 540 m
Figure 2
Évolution du poids résiduel des feuilles d’eucalyptus (a) et de laurier rose (b) dans l’eau
Change over time of the weight of eucalyptus (a) and oleander (b) leaves in water
Figure 3
Modélisation exponentielle de la dégradation des feuilles d’eucalyptus (a) et de laurier rose (b) dans l’eau
Exponential model of the degradation of eucalyptus (a) and oleander (b) leaves in water
List of tables
Tableau 1
Abondance des invertébrés récoltés
Abundance of invertebrates collected