Abstracts
Résumé
Les vitesses de phototransformation de quatre hormones (estradiol, éthinylestradiol, progestérone, testostérone) et de deux anti-inflammatoires non stéroïdiens (diclofénac et naproxen) ont été étudiées en milieu aqueux dilué. Les expériences de photolyse ont été réalisées sous irradiation monochromatique (254 nm) et sous irradiation polychromatique (λ > 280 nm). Les résultats expérimentaux ont montré que les rendements quantiques de photodécomposition sont faibles (entre 0,02 et 0,08) à l’exception du diclofénac (de l’ordre de 0,30). L’influence de la concentration en oxygène dissous sur les rendements quantiques de photolyse a aussi été examinée. À partir des résultats obtenus, les rendements d’élimination des composés étudiés dans les conditions de désinfection des eaux par irradiation UV à 254 nm ont été estimés.
Mots clés:
- Estradiol,
- Ethinylestradiol,
- Progestérone,
- Testostérone,
- Diclofénac,
- Naproxen,
- Photolyse,
- Irradiation UV,
- Rendement quantique
Abstract
The photodecomposition of some emerging organic pollutants (4 hormones: estradiol, ethynylestradiol, progesterone, testosterone; and 2 nonsteroidal anti-inflammatory drugs: diclofenac and naproxen) has been investigated in dilute aqueous solution. The photolysis experiments were carried out under monochromatic irradiation (254 nm) and under polychromatic irradiation (λ > 280 nm). The calculated quantum yields of photodecomposition under monochromatic irradiations were low (between 0.02 and 0.08) except for diclofenac for which the value was about 0.30. The influence of oxygen concentration was also examined and the removal yields of these compounds under the conditions used for the UV-disinfection of drinking water at 254 nm were estimated.
Key words:
- Estradiol,
- Ethynylestradiol,
- Progesterone,
- Testosterone,
- Diclofenac,
- Naproxen,
- Photolysis,
- Ultraviolet Irradiation,
- Quantum yield
Article body
I. Introduction
Depuis une quinzaine d’années, la communauté scientifique s’intéresse à la présence et au devenir des composés pharmaceutiques et d’hormones dans l’environnement en raison des effets biologiques que pourraient avoir ces molécules sur l’écosystème mais également sur la santé de l’Homme. Le développement des outils analytiques (techniques d’extraction et spectrométrie de masse en tandem) permet actuellement de détecter, à des niveaux de concentration de l’ordre du ng•L‑1, de très nombreuses classes de produits pharmaceutiques (antibiotiques, analgésiques, anti-inflammatoires, hormones, etc.) dans les eaux usées urbaines brutes et traitées, les eaux naturelles et à moindre niveau des eaux de distribution (ANDREOZZI et al., 2003; HALLING-SØRENSEN et al., 1998; HEBERER, 2002; JANEX et al., 2002; KOLPIN et al., 2002).
Dans les eaux naturelles, ces micropolluants peuvent subir des réactions de transformation par voies biologique, physico-chimique et photochimique. De nombreuses études ont ainsi été consacrées à l’étude de la dégradation des composés pharmaceutiques par irradiation solaire en vue d’évaluer la durée de vie de ces composés et d’identifier les sous-produits de photolyse (BOREEN et al., 2003). La photodégradation des composés pharmaceutiques est aussi possible lors de la désinfection des eaux par irradiation UV ou lors du traitement des eaux par des procédés d’oxydation par voie photochimique (H2O2/UV, TiO2/UV) (CANONICA et al., 2008; IKEHATA et al., 2006; PEREIRA et al., 2007).
Au cours de ce travail, nous avons étudié les cinétiques de phototransformation de quatre hormones stéroïdiennes : 17β estradiol (E2), 17β-éthinylestradiol (EE2), progestérone (PR) et testostérone (TE) et deux anti-inflammatoires non stéroïdiens : diclofénac (DF) et naproxen (NAP) (Tableau 1). Les rendements quantiques à 254 nm de photolyse de certains composés avaient été déterminés par d’autres auteurs. Ainsi, les valeurs suivantes ont été relevées pour le 17β estradiol (E2) (Φ254nm ≈ 0,043, ROSENFELT et LINDEN, 2004), le 17α-éthinylestradiol (EE2) (Φ254nm ≈ 0,026, ROSENFELD et LINDEN, 2004; Φ254nm ≈ 0,057 ± 0,006, CANONICA et al. 2008), le diclofénac (Φ254nm ≈ 0,384 ± 0,075, CANONICA et al., 2008) et le naproxen (Φ254nm ≈ 0,0093, PEREIRA et al., 2007). Des études ont évalué le comportement des composés sous irradiation solaire réelle ou simulée à partir d’expériences effectuées avec des composés dissous dans l’eau purifiée ou dans des eaux naturelles. Ces études indiquent que le diclofénac (ANDREOZZI et al., 2003; BUSER et al., 1998; PACKER et al., 2003) et le naproxen (LIN et REINHARD, 2005; PACKER et al., 2003) sont assez rapidement photolysés sous irradiation solaire et beaucoup plus rapidement dégradés que les deux estrogènes (LIN et REINHARD, 2005).
Tableau 1
Structure et propriétés chimiques des composés étudiés au cours de ce travail.
Chemical structure and properties of the compounds studied in the present work.
Nom |
Estradiol |
Ethinylestradiol |
Progestérone |
Testostérone |
Diclofénac |
Naproxen |
|---|---|---|---|---|---|---|
Structure chimique |
|
|
|
|
|
|
Abréviation |
E2 |
EE2 |
PR |
TE |
DF |
NAP |
Masse molaire |
272,4 g•mol‑1 |
296,4 g•mol‑1 |
314,4 g•mol‑1 |
288,4 g•mol‑1 |
296,4 g•mol‑1 |
230,2 g•mol‑1 |
Solubilité dans l’eau |
13 mg•L‑1 |
4,8 mg•L‑1 |
7 mg•L‑1 |
18 - 25 mg•L‑1 |
ND |
ND |
pKa |
10,4 |
10,4 |
Aucun |
17,4 |
4,0 ‑ 4,2 |
4,15 ‑ 4,70 |
Nous présenterons dans cette publication les résultats cinétiques obtenus dans le cadre d’une étude plus étendue consacrée à l’étude des mécanismes de photolyse des six molécules présentées dans le tableau 1 (MAZELLIER et al., 2008; MEITE, 2007). Cette étude a eu pour objectif principal de comparer dans les mêmes conditions expérimentales les vitesses de photolyse des composés et de préciser l’influence de la longueur d’onde et de l’oxygène dissous sur les rendements quantiques de photolyse.
2. Matériels et méthodes
Toutes les solutions ont été préparées dans l’eau purifiée délivrée par un système Milli RX75/Synergy 185 (Millipore). Les solutions mères de diclofénac et de naproxen (10‑4 M) ont été préparées en dissolvant directement les composés dans l’eau. Pour les autres composés (composés peu solubles, tableau 1), une masse de composé (30 à 40 mg) a été introduite dans 2 litres d’eau purifiée. Après 72 heures d’agitation, les solutions ont été filtrées sur filtres Millipore HVLP 0,45 µm et les concentrations en composés dissous ont été déterminées en CLHP et en utilisant une gamme étalon préparée dans un mélange eau-méthanol. Toutes les solutions ont été préparées dans l’eau purifiée non tamponnée et toutes les expériences de photolyse ont été effectuées à pH libre (pH : 5,5 ‑ 6).
Les expériences de photolyse avec les lampes UV (puissance électrique : 6 W) émettant un rayonnement monochromatique à 254 nm (lampe Vilbert et Lourmat, T6C) ou un rayonnement polychromatique centré dans l’UV à 312 nm (lampe Vilbert et Lourmat T6M; Figure 1) ont été effectuées à l’aide d’un réacteur photochimique cylindrique à double enveloppe (volume de solution : 4,00 L, épaisseur annulaire : 6,25 cm). La lampe est insérée dans un tube en quartz placé en position axiale dans le réacteur. Les solutions aqueuses ont été maintenues à 25 °C en cours de réaction grâce à une recirculation d’eau thermostatée dans l’enveloppe externe du réacteur. L’homogénéisation de la solution est effectuée par agitation magnétique.
Figure 1
Spectre d’émission de la lampe Vilbert et Lourmat T6M.
Emission spectrum of the Vilbert and Lourmat T6M lamp.
Les valeurs des flux photoniques reçus par les solutions à 254 nm ont été mesurées par actinométrie chimique, suivant la méthode décrite par NICOLE et al. (1990). Le flux photonique est calculé à partir des vitesses de photolyse du peroxyde d’hydrogène effectuées en milieu très dilué. Dans ce cas, l’absorbance de la solution de H2O2 est du même ordre de grandeur que les absorbances des solutions aqueuses de composés pharmaceutiques. Au cours de cette étude, les flux photoniques ont été mesurés à chaque série d’expériences. Dans le cas de la lampe émettant à 254 nm, plusieurs lampes Vilbert Lourmat T6C ont été utilisées au cours de cette étude et les valeurs des flux photoniques ont été comprises entre 3,55•10‑7 à 7,5•10‑7 E•L‑1•s‑1.
Les spectres d’absorption UV-visible et les valeurs d’absorbance ont été obtenues avec un spectrophotomètre à double faisceau SAFAS 190 DES (Double Energy Transfer) ou un appareil Secomam 1000 à simple faisceau avec des cuves en quartz de 5 cm de trajet optique. Les concentrations des composés ont été déterminées à l’aide de deux chaînes chromatographiques WATERS. La séparation a été effectuée avec une colonne Hypersil BDS C18 250*4,6 mm (5 µm). La phase mobile utilisée pour l’ensemble des composés est un mélange eau acidifiée (pH = 3,0) / méthanol à des proportions variables à un débit de 0,8 mL•min‑1. La détection a été effectuée à l’aide d’un détecteur UV-visible à barrette de diodes WATERS 996, ou bien d’un détecteur d’absorption UV WATERS 2487 ou d’un détecteur de fluorescence WATERS 2475.
Les concentrations en oxygène dissous ont été mesurées à l’aide d’un oxymètre Oxi 330i (WTW) équipé d’une sonde à oxygène Cellox 325 (WTW).
3. Résultats
3.1 Spectres d’absorption UV/visible
Les spectres d’absorption UV/Visible des composés sont présentés dans les figures 2 et 3 et les valeurs des coefficients d’absorption molaire aux longueurs d’onde d’irradiation utilisées sont reportées dans le tableau 2.
Figure 2
Spectres d’absorption UV de l’estradiol, de l’éthinylestradiol, de progestérone et de la testostérone en solution aqueuse.
UV absorption spectra of estradiol, ethynylestradiol, progesterone and testosterone in aqueous solution.
Figure 3
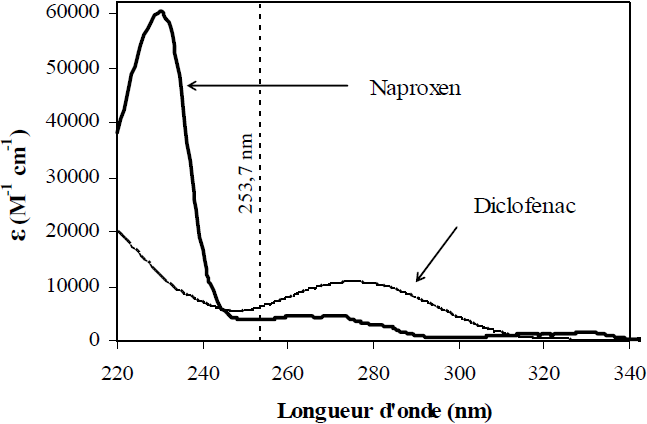
Spectres d’absorption UV-visible du naproxen et du diclofénac en solution aqueuse.
UV absorption spectra of naproxen and diclofenac in aqueous solution.
Tableau 2
Valeurs des coefficients d’absorption molaire (ε en M‑1•cm‑1) et des rendements quantiques de phototransformation à 254 nm (Φ en mol•E‑1) (les incertitudes sont obtenues à partir d’au moins trois mesures).
Molar extinction coefficients (ε, M‑1•cm‑1) and quantum yields of photodecomposition (Φ, mol•E‑1) at 254 nm (mean values from three experimental values).
Nom |
Estradiol |
Ethinylestradiol |
Progestérone |
Testostérone |
Diclofénac |
Naproxen |
|---|---|---|---|---|---|---|
Structure chimique |
|
|
|
|
|
|
Abréviation |
E2 |
EE2 |
PR |
TE |
DF |
NAP |
|
λmax, nm (ε M‑1 cm‑1) |
278 nm (2140) |
278 nm (2070) |
249 nm (18225) |
249 nm (15975) |
275 (10740) |
270 (4650) |
|
ε à 254 nm Φ à 254 nm |
420 ± 20 0,067 ± 0,007 |
440 ± 35 0,062 ± 0,007 |
17020 ± 350 0,022 ± 0,005 |
15140 ± 760 0,033 ± 0,005 |
6140 ± 80 0,28 ± 0,02 |
3946 ± 40 0,024 ± 0,005 |
ε à 280 nm |
2120 ± 50 |
2060 ± 40 |
890 ± 35 |
690 ± 25 |
10420 ± 100 |
2920 ± 145 |
La figure 2 montre que les spectres d’absorption UV‑visible de l’estradiol et de l’éthinylestradiol sont pratiquement identiques avec deux bandes d’absorption entre 200 et 300 nm liées à la présence du cycle aromatique phénolique. Cette allure de spectre est classiquement observée pour les dérivés phénoliques substitués. La première bande (vers 210 nm) se présente parfois sous la forme d’un épaulement plutôt que d’une bande bien résolue pour les dérivés substitués du benzène. Elle est identifiable vers 210-220 nm et correspond aux transitions π→π*. La deuxième bande centrée vers 280 nm correspond aux transitions η→π* (électrons η de l’oxygène du groupement OH sur le cycle aromatique; MAZELLIER et LEVERD, 2003).
La progestérone et la testostérone en solution aqueuse présentent une seule bande d’absorption très large dans l’intervalle de longueur d’onde 200 – 300 nm (Figure 2). Compte tenu de la structure chimique de ces composés (cétones α, β insaturées), deux bandes devraient également être observées : une bande correspondant à la transition η→π* et une bande correspondant à la transition π→π* (DANA, 1998). Dans le cas des deux composés étudiés, la large bande observée vers 240 nm correspond à la transition π→π*. L’étude spectrale des deux anti-inflammatoires non stéroïdiens en solution aqueuse (Figure 3) montre que le diclofénac possède deux bandes d’absorption : l’une entre 200 et 250 nm (absorption maximale vers 207 nm) et l’autre entre 250 et 320 nm (absorption maximale à 275 nm). À partir de 320 nm, il absorbe très faiblement, voire de façon négligeable. En ce qui concerne le naproxen, il possède deux bandes d’absorption entre 200 et 300 nm ainsi qu’une troisième, beaucoup moins intense, entre 300 et 350 nm.
Pour chaque composé étudié, le tableau 2 présente la longueur d’onde maximale d’absorption (λmax) ainsi que les coefficients d’absorption molaire à 254 nm et 280 nm (longueur d’onde de début de l’émission de notre lampe polychromatique, Figure 1).
3.2 Photolyse sous irradiation monochromatique
3.2.1 Détermination des rendements quantiques de photolyse à différentes longueurs d’onde
Les expériences de photolyse ont d’abord été réalisées en présence d’oxygène dissous ([O2] ≈ 0,26 mM, concentration en oxygène dissous en équilibre avec la concentration dans l’air sous pression atmosphérique et température ambiante). Les expériences ont été effectuées en milieu très dilué (0,1 à 0,5 µM) afin que la vitesse de photodécomposition obéisse à une loi cinétique d’ordre 1 apparent par rapport à la concentration en composé (Figure 1) :
avec ελ = le coefficient d’absorption molaire, Φλ = le rendement quantique de photolyse de C à la longueur d’onde λ, I0,λ = l’intensité lumineuse et 1 = le trajet optique.
Les résultats obtenus à partir des expériences de photolyse réalisées avec la lampe à vapeur de mercure basse pression émettant à 254 nm (Figure 4) montrent que les vitesses de photodécomposition peuvent effectivement être décrites par une loi cinétique d’ordre 1 par rapport à la concentration en composé organique.
Figure 4
Cinétique d’ordre 1 de photolyse des composés étudiés à 254 nm ([Composé]0 = 0,1 - 0,5 µM) dans l’eau purifiée ([O2] ≈ 0,26 mM).
First-order kinetic plots of the photodecomposition of the compounds at 254 nm ([Compound]0 = 0.1 - 0.5 µM) in purified water ([O2] ≈ 0.26 mM).
Les résultats présentés sur la figure 4 ont été obtenus à partir d’expériences échelonnées sur les trois ans de l’étude et avec des flux photoniques incidents (10 : 3,55•10‑7 à 7,5•10‑7 E•L‑1•s‑1) qui ne sont pas identiques pour chaque composé en raison du vieillissement de la lampe ou du remplacement d’une lampe usagée par une lampe neuve.
Les rendements quantiques de photodécomposition ont été calculés à partir des constantes cinétiques apparentes d’ordre 1 de disparition des composés organiques et des valeurs de flux photonique déterminées par actinométrie chimique. Les valeurs des rendements quantiques déterminées au cours de cette étude aux différentes longueurs d’onde d’irradiation (Φλ) ont été reportées dans le tableau 2. Les résultats obtenus montrent que Φλ varie entre 0,02 et 0,08 à l’exception du diclofénac (≈ 0,2 à 0,3).
Par rapport aux rares données bibliographiques, les valeurs de rendements quantiques obtenues au cours cette étude pour l’estradiol et l’éthinylestradiol sont proches (Φ254nm ≈ 0,06 – 0,07) mais supérieures à celle proposée par CANONICA et al. (2008) (Φ254nm ≈ 0,026 ± 0,006 pour l’éthinylestradiol) et celles obtenues par ROSENFELD et LINDEN (2004) (Φ254nm = 0,043 pour l’estradiol et Φ254nm 0,026 pour l’éthinylestradiol). Dans le cas du naproxen, la valeur obtenue (Φ254nm = 0,024) est presque trois fois plus élevée que celle obtenue par PEREIRA et al. (2007) (Φ254nm = 0,0093).
3.2.2. Influence de l’oxygène dissous (λ = 254 nm)
Les expériences effectuées en milieu saturé en argon ([O2] ≤ 0,01 mM), à l’air libre ([O2] ≈ 0,26 mM) et en milieu saturé en oxygène ([O2] ≈ 1,3 mM) ont montré que les vitesses ou les rendements quantiques de photodécomposition de l’estradiol, l’éthinylestradiol et du naproxen sont environ quatre à six fois plus élevés sous barbotage d’oxygène pur que sous barbotage d’argon (Figure 5, Tableau 3). Aucun effet significatif n’a été observé avec les trois autres molécules.
Figure 5
Influence de la concentration en oxygène dissous sur les vitesses de photodécomposition de l’estradiol (E2) et de l’éthinylestradiol (EE2) à 254 nm ([E2]0 ou [EE2]0 = 0,5 µM).
Effect of dissolved oxygen concentration on the photodecomposition rates of estradiol (E2) and ethynylestradiol (EE2) at 254 nm ([E2]0 or [EE2]0 = 0.5 µM).
Tableau 3
Influence de la concentration en oxygène dissous sur les rendements quantiques de phototransformation à 254 nm.
Effect of dissolved oxygen concentration on the quantum yields of photodecomposition at 254 nm.
Composé |
[O2] ≤ 0,01 mM (barbotage d’argon) |
[O2] = 0,26 mM (équilibre à l’air) |
[O2] ≤ 1,3 mM (barbotage d’oxygène) |
|
|---|---|---|---|---|
Estradiol |
0,029 ± 0,007 |
0,067 ± 0,007 |
0,115 ± 0,007 |
4,2 ± 1,3 |
Ethinylestradiol |
0,024 ± 0,007 |
0,062 ± 0,007 |
0,131 ± 0,007 |
6,0 ± 2,0 |
Naproxen |
0,015 ± 0,005 |
0,024 ± 0,002 |
0,056 ± 0,006 |
4,4 ± 1,9 |
Cet effet de la concentration d’oxygène dissous sur les vitesses de photolyse a déjà été observé dans des travaux similaires sur la photolyse des dérivés phénoliques comme le 2,6-diméthylphénol (MAZELLIER et al., 1998), le 4-tert-octylphénol (MAZELLIER et LEVERD, 2003).
Lors de l’excitation de dérivés phénoliques, le processus primaire suivant l’excitation est connu comme faisant intervenir un mécanisme de photo éjection d’électrons à partir de l’état excité du phénol (JOSCHEK et GROSSWEINER, 1966). Un état intermédiaire où les trois espèces radicales phénoxyle-électron-proton sont potentiellement formées est généralement proposé. Cependant, ces espèces ont tendance à se recombiner. La réaction de piégeage de l’électron par l’oxygène dissous est une voie qui permet d’empêcher cette recombinaison, expliquant ainsi la forte sensibilité des vitesses de photolyse des composés phénoliques aux variations de la concentration d’oxygène.
Le radical superoxyde formé (O2•-) et son acide conjugué (HO2•) conduisent par dismutation à la formation de H2O2. Les radicaux hydroxyles formés par photolyse de H2O2 pourraient oxyder les composés organiques et expliquer l’augmentation de la vitesse de photodécomposition de l’estradiol, l’éthinylestradiol et du naproxen en présence d’oxygène.
Cette contribution des radicaux hydroxyles à la dégradation des composés est cependant négligeable dans nos conditions expérimentales et elle ne pourrait pas expliquer une augmentation d’un facteur 4 à 6 des vitesses de photodécomposition en présence d’oxygène. Ceci a été confirmé par des calculs en modélisation cinétique (non décrits ici).
3.3 Irradiation polychromatique (λ > 280 nm)
Afin d’obtenir des données dans des conditions proches de celles de la lumière solaire, des expériences ont été réalisées avec une lampe Vilbert et Lourmat T6M qui émet en particulier un rayonnement à des longueurs d’onde comprises entre 280 et 400 nm. Les expériences réalisées avec la lampe Vilbert et Lourmat T6M permettent de comparer les vitesses de photodécomposition des différents composés étudiés par le rayonnement polychromatique émis par cette lampe (Figure 6). Les résultats obtenus montrent que tous les composés étudiés peuvent être photolysés car ils absorbent tous à des longueurs d’onde comprises entre 280 nm et 400 nm (Figures 2-3).
Figure 6
Cinétique d’ordre 1 de photolyse des composés étudiés par irradiation polychromatique (Lampe Vilbert et Lourmat T6M, émission : > 280 nm) ([Composé]0 = 0,1 à 3 µM) dans l’eau purifiée ([O2] ≈ 0,26 mM).
First-order kinetic plots of the photodecomposition of the compounds under polychromatic irradiation (Vilbert et Lourmat T6M lamp, emission > 280 nm) ([Compound]0 = 0.1 - 3 µM) in purified water ([O2] ≈ 0.26 mM).
Pour des conditions identiques d’irradiation, le tableau 4 donne pour chaque composé, le temps correspondant à 50 % de disparition du produit initial (t50 %). Comme toutes les expériences ont été réalisées dans les mêmes conditions, l’examen des valeurs de t50 % permet de comparer la stabilité des composés étudiés sous irradiation UV à des longueurs d’onde comprises entre 280 et 400 nm. Les résultats montrent ainsi que la demi-vie des composés étudiés est de l’ordre de 3 à 11 heures à l’exception du diclofénac qui est photolysé en quelques minutes sous nos conditions d’irradiation.
Tableau 4
Photolyse des composés organiques par la lampe polychromatique Vilbert et Lourmat T6M. Caractéristiques des spectres UV/Visible et temps de demi-vie (t50 %) obtenus au cours de cette étude ([Composé]0 ≈ 0,3 – 3 µM, Eau purifiée, [O2] ≈ 0,26 mM).
Photolysis of organic compounds under polychromatic irradiation (Vilbert-Lourmat T6M lamp). UV/Visible absorption properties and half-life times (t50%) obtained in the present work ([Compound]0 ≈ 0.3 – 3 µM, purified water, [O2] ≈ 0.26 mM).
|
E2 |
EE2 |
PR |
TE |
DF |
NAP |
|---|---|---|---|---|---|---|
Absorption UV/Visible (nm) |
200 à 305 |
200 à 305 |
200 à 345 |
200 à 322 |
200 à 375 |
200 à 405 |
ε à 290 nm |
1 010 ± 30 |
960 ± 30 |
345 ± 20 |
150 ± 40 |
7 865 ± 90 |
1 030 ± 140 |
ε à 312 nm |
130 ± 40 |
130 ± 40 |
150 ± 30 |
< 70 |
1 050 ± 35 |
1 015 ± 95 |
t50 % |
6,2 h |
5,9 h |
6,6 h |
11,2 h |
4,3 min |
3,2 h |
4. Conclusion
La désinfection des eaux peut être réalisée par irradiation UV à l’aide de lampes à vapeur de mercure moyenne pression (émission polychromatique à partir de 200 nm) ou basse pression (émission principale à 254 nm). Si la désinfection est réalisée par irradiation UV à 254 nm, le tableau 5 donne les rendements d’élimination des composés étudiés qui seraient obtenus par photolyse directe à la dose d’irradiation de 400 J•m‑2 (dose couramment utilisée pour la désinfection des eaux de distribution). Ces rendements ont été calculés pour des solutions très diluées de composés (< 1 µM) dans l’eau pure, et en présence d’oxygène dissous (8 à 10 mg•L‑1). Dans ces conditions, la vitesse de photolyse directe peut être décrite par une loi cinétique apparente d’ordre 1 par rapport à la concentration en composé organique avec une constante cinétique qui est proportionnelle au terme ε254nm•Φ254nm. Les résultats présentés dans le tableau 5 montrent que le diclofénac serait éliminé à hauteur de 44 % alors que la progestérone et la testostérone seraient éliminées avec des rendements de l’ordre de 15 %. Ces résultats indiquent donc que la désinfection UV peut entraîner la dégradation de molécules pharmaceutiques et que les sous-produits de dégradation doivent alors être pris en compte en vue de l’évaluation des risques sanitaires.
Tableau 5
Estimation des rendements d’élimination des composés étudiés lors de la désinfection des eaux potables par irradiation UV à 254 nm à une dose UV de 400 J•m‑2.
Estimates of the removal yields of the studied compounds under the conditions used for the UV-disinfection (400 J•m‑2) of drinking water at 254 nm.
Composé |
ε254nm x Φ254nm (L•mol‑1•cm‑1) |
Rendement d’élimination (%) |
|---|---|---|
Estradiol (E2) |
28,1 |
1 |
Ethinylestradiol (EE2) |
27,3 |
1 |
Progestérone (PR) |
374,4 |
12 |
Testostérone (TE) |
499,6 |
15 |
Diclofénac (DF) |
1 719,2 |
44 |
Naproxen (NAP) |
94,70 |
3 |
En ce qui concerne le devenir des composés étudiés dans les eaux naturelles, la durée de vie des micropolluants étudiés sous irradiation solaire ne peut pas être estimée correctement car la lampe polychromatique utilisée au cours de cette étude ne peut pas être considérée comme simulant parfaitement la lumière solaire. Cependant, les résultats qui ont été obtenus avec le diclofénac indiquent que ce composé sera assez facilement photolysé dans l’environnement sous rayonnement solaire et confirment les données bibliographiques (BUSER et al., 1998; POIGER et al., 2001). Il est donc important de connaître les structures des photoproduits formés, ainsi que leur stabilité comme nous l’avons décrit dans une publication récente (MAZELLIER et al., 2008). Par ailleurs, des réactions de photodégradation secondaires induites par la présence de matières organiques ou par des complexes métalliques peuvent participer à la dégradation des composés dans le milieu naturel (BOREEN et al., 2003).
Appendices
Références bibliographiques
- ANDREOZZI R., M. RAFFAELE et P. NICKLAS (2003). Pharmaceuticals in STP effluents and their solar photodegradation in aquatic environments. Chemosphere, 50, 1319-1330.
- BOREEN A.L., W.A. ARNOLD et K. McNELL (2003). Photodegradation of pharmaceuticals in the aquatic environment: A review. Aquat. Sci., 65, 320-340.
- BUSER H.-R., T. POIGER et M.D. MÜLLER (1998). Occurrence and fate of the pharmaceutical drug diclofenac in surface water: rapid photodegradation in a lake. Environ. Sci. Technol., 32, 3449-3456.
- CANONICA S., L. MEUNIER et U. VON GUNTEN (2008). Phototransformation of selected pharmaceuticals during UV treatment of drinking water. Water Res., 42, 121-128.
- DANA G. (1998). Constantes des spectres ultraviolets, techniques de l’ingénieur, traité des constantes physico-chimiques, K 1015-1 – K1015-15, Tech. Ing.,15 p.
- HALLING-SØRENSEN B., S.N. NIELSEN, P.F. LANDZKY, F. INGERSLEV, H.C.H. LÜTZHØFT et S.E. JØRGENSEN (1998). Occurrence, fate and effects of pharmaceutical substances in the environment – A review. Chemosphere, 36, 357-393.
- HEBERER T. (2002). Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data. Toxicol. Lett., 131, 5-17.
- IKEHATA K., N.J. NAGHASHKAR et M.G. EL-DIN (2006). Degradation of aqueous pharmaceuticals by ozonation and advanced oxidation process: A review. Ozone Sci. Eng., 28, 353-414.
- JANEX M.L., A. BRUCHET, Y. LEVI et T. TERNES (2002). Pharmaceutical compounds: occurrence in the environment and fate in drinking water treatment. Dans : Conférence AWWA WQTC, Seattle, États-Unis, 10-14 november 2002, 1625-1634.
- JOSCHEK H.-I. et L.I. GROSSWEINER (1966). Optical generation of hydrated electrons from aromatic compounds. II. J. Am. Chem. Soc., 88, 3261-3268.
- KOLPIN D., E.D. FURLONG, M.T. MEYER, E.M. THURMAN, S. ZAUGG, L.B. BARBER et H.T. BUXTON (2002). Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environ. Sci. Technol., 36, 1202-1211.
- LIN A.Y-C. et M. REINHARD (2005). Photodegradation of common environmental pharmaceuticals and estrogens in river water. Environ. Toxicol. Chem., 24, 1303-1309.
- MAZELLIER P., M. SARAKHA, A. ROSSI et M. BOLTE (1998). The aqueous photochemistry of 2,6-dimethylphenol. Evidence for the fragmentation of the αC-C bond. J. Photochem. Photobiol. A: Chem., 115, 117-121.
- MAZELLIER P. et J. LEVERD (2003). Transformation of 4-tert-octylphenol by UV irradiation and by an H2O2/UV process in aqueous solution. Photochem. Photobiol., Sci., 2, 946-953.
- MAZELLIER P., L. MEITE et J. DE LAAT (2008), Photodegradation of the steroid hormones 17β-estradiol (E2) and 17α-ethinylestradiol (EE2) in dilute aqueous solution. Chemosphere, 73, 1216–1223.
- MEITE L. (2007). Phototransformation de polluants organiques émergents (hormones, anti-inflammatoires) en solution aqueuse diluée. Thèse de Doctorat, Université de Poitiers, France, 230 p.
- NICOLE J., J. DE LAAT, M. DORÉ, J.P. DUGUET et C. BONNEL (1990). Use of UV radiation in water treatment measurement of photonic flux by hydrogen peroxide actinometry. Water Res., 24, 157-168.
- PACKER J.L, J.J. WERNER, D.E. LATCH, K. McNEILL et W.A. ARNOLD (2003). Photochemical fate of pharmaceuticals in the environment: naproxen, diclofenac, clofibric acid, and ibuprofen. Aquat. Sci., 65, 342-351.
- PEREIRA V.J., H.S. WEINBERG, K.G. LINDEN et P.C. SINGER (2007). UV degradation kinetics and modelling of pharmaceutical compounds in laboratory grade and surface water via direct and indirect photolysis at 254 nm. Environ. Sci. Technol., 41, 1682-1688.
- POIGER T., H.R. BUSER et M.D. MÜLLER (2001). Photodegradation of the pharmaceutical drug diclofenac in a lake: pathway, field measurements, and mathematical modelling. Environ. Toxicol. Chem., 20, 256-263.
- ROSENFELDT E.J. et K.G. LINDEN (2004). Degradation of endocrine disrupting chemicals bisphenol A, ethinylestradiol, and estradiol during UV photolysis and advanced oxidation processes. Environ. Sci. Technol., 38, 5476-5483.
List of figures
Figure 1
Spectre d’émission de la lampe Vilbert et Lourmat T6M.
Emission spectrum of the Vilbert and Lourmat T6M lamp.
Figure 2
Spectres d’absorption UV de l’estradiol, de l’éthinylestradiol, de progestérone et de la testostérone en solution aqueuse.
UV absorption spectra of estradiol, ethynylestradiol, progesterone and testosterone in aqueous solution.
Figure 3
Spectres d’absorption UV-visible du naproxen et du diclofénac en solution aqueuse.
UV absorption spectra of naproxen and diclofenac in aqueous solution.
Figure 4
Cinétique d’ordre 1 de photolyse des composés étudiés à 254 nm ([Composé]0 = 0,1 - 0,5 µM) dans l’eau purifiée ([O2] ≈ 0,26 mM).
First-order kinetic plots of the photodecomposition of the compounds at 254 nm ([Compound]0 = 0.1 - 0.5 µM) in purified water ([O2] ≈ 0.26 mM).
Figure 5
Influence de la concentration en oxygène dissous sur les vitesses de photodécomposition de l’estradiol (E2) et de l’éthinylestradiol (EE2) à 254 nm ([E2]0 ou [EE2]0 = 0,5 µM).
Effect of dissolved oxygen concentration on the photodecomposition rates of estradiol (E2) and ethynylestradiol (EE2) at 254 nm ([E2]0 or [EE2]0 = 0.5 µM).
Figure 6
Cinétique d’ordre 1 de photolyse des composés étudiés par irradiation polychromatique (Lampe Vilbert et Lourmat T6M, émission : > 280 nm) ([Composé]0 = 0,1 à 3 µM) dans l’eau purifiée ([O2] ≈ 0,26 mM).
First-order kinetic plots of the photodecomposition of the compounds under polychromatic irradiation (Vilbert et Lourmat T6M lamp, emission > 280 nm) ([Compound]0 = 0.1 - 3 µM) in purified water ([O2] ≈ 0.26 mM).
List of tables
Tableau 1
Structure et propriétés chimiques des composés étudiés au cours de ce travail.
Chemical structure and properties of the compounds studied in the present work.
Nom |
Estradiol |
Ethinylestradiol |
Progestérone |
Testostérone |
Diclofénac |
Naproxen |
|---|---|---|---|---|---|---|
Structure chimique |
|
|
|
|
|
|
Abréviation |
E2 |
EE2 |
PR |
TE |
DF |
NAP |
Masse molaire |
272,4 g•mol‑1 |
296,4 g•mol‑1 |
314,4 g•mol‑1 |
288,4 g•mol‑1 |
296,4 g•mol‑1 |
230,2 g•mol‑1 |
Solubilité dans l’eau |
13 mg•L‑1 |
4,8 mg•L‑1 |
7 mg•L‑1 |
18 - 25 mg•L‑1 |
ND |
ND |
pKa |
10,4 |
10,4 |
Aucun |
17,4 |
4,0 ‑ 4,2 |
4,15 ‑ 4,70 |
Tableau 2
Valeurs des coefficients d’absorption molaire (ε en M‑1•cm‑1) et des rendements quantiques de phototransformation à 254 nm (Φ en mol•E‑1) (les incertitudes sont obtenues à partir d’au moins trois mesures).
Molar extinction coefficients (ε, M‑1•cm‑1) and quantum yields of photodecomposition (Φ, mol•E‑1) at 254 nm (mean values from three experimental values).
Nom |
Estradiol |
Ethinylestradiol |
Progestérone |
Testostérone |
Diclofénac |
Naproxen |
|---|---|---|---|---|---|---|
Structure chimique |
|
|
|
|
|
|
Abréviation |
E2 |
EE2 |
PR |
TE |
DF |
NAP |
|
λmax, nm (ε M‑1 cm‑1) |
278 nm (2140) |
278 nm (2070) |
249 nm (18225) |
249 nm (15975) |
275 (10740) |
270 (4650) |
|
ε à 254 nm Φ à 254 nm |
420 ± 20 0,067 ± 0,007 |
440 ± 35 0,062 ± 0,007 |
17020 ± 350 0,022 ± 0,005 |
15140 ± 760 0,033 ± 0,005 |
6140 ± 80 0,28 ± 0,02 |
3946 ± 40 0,024 ± 0,005 |
ε à 280 nm |
2120 ± 50 |
2060 ± 40 |
890 ± 35 |
690 ± 25 |
10420 ± 100 |
2920 ± 145 |
Tableau 3
Influence de la concentration en oxygène dissous sur les rendements quantiques de phototransformation à 254 nm.
Effect of dissolved oxygen concentration on the quantum yields of photodecomposition at 254 nm.
Composé |
[O2] ≤ 0,01 mM (barbotage d’argon) |
[O2] = 0,26 mM (équilibre à l’air) |
[O2] ≤ 1,3 mM (barbotage d’oxygène) |
|
|---|---|---|---|---|
Estradiol |
0,029 ± 0,007 |
0,067 ± 0,007 |
0,115 ± 0,007 |
4,2 ± 1,3 |
Ethinylestradiol |
0,024 ± 0,007 |
0,062 ± 0,007 |
0,131 ± 0,007 |
6,0 ± 2,0 |
Naproxen |
0,015 ± 0,005 |
0,024 ± 0,002 |
0,056 ± 0,006 |
4,4 ± 1,9 |
Tableau 4
Photolyse des composés organiques par la lampe polychromatique Vilbert et Lourmat T6M. Caractéristiques des spectres UV/Visible et temps de demi-vie (t50 %) obtenus au cours de cette étude ([Composé]0 ≈ 0,3 – 3 µM, Eau purifiée, [O2] ≈ 0,26 mM).
Photolysis of organic compounds under polychromatic irradiation (Vilbert-Lourmat T6M lamp). UV/Visible absorption properties and half-life times (t50%) obtained in the present work ([Compound]0 ≈ 0.3 – 3 µM, purified water, [O2] ≈ 0.26 mM).
|
E2 |
EE2 |
PR |
TE |
DF |
NAP |
|---|---|---|---|---|---|---|
Absorption UV/Visible (nm) |
200 à 305 |
200 à 305 |
200 à 345 |
200 à 322 |
200 à 375 |
200 à 405 |
ε à 290 nm |
1 010 ± 30 |
960 ± 30 |
345 ± 20 |
150 ± 40 |
7 865 ± 90 |
1 030 ± 140 |
ε à 312 nm |
130 ± 40 |
130 ± 40 |
150 ± 30 |
< 70 |
1 050 ± 35 |
1 015 ± 95 |
t50 % |
6,2 h |
5,9 h |
6,6 h |
11,2 h |
4,3 min |
3,2 h |
Tableau 5
Estimation des rendements d’élimination des composés étudiés lors de la désinfection des eaux potables par irradiation UV à 254 nm à une dose UV de 400 J•m‑2.
Estimates of the removal yields of the studied compounds under the conditions used for the UV-disinfection (400 J•m‑2) of drinking water at 254 nm.
Composé |
ε254nm x Φ254nm (L•mol‑1•cm‑1) |
Rendement d’élimination (%) |
|---|---|---|
Estradiol (E2) |
28,1 |
1 |
Ethinylestradiol (EE2) |
27,3 |
1 |
Progestérone (PR) |
374,4 |
12 |
Testostérone (TE) |
499,6 |
15 |
Diclofénac (DF) |
1 719,2 |
44 |
Naproxen (NAP) |
94,70 |
3 |














![Cinétique d’ordre 1 de photolyse des composés étudiés à 254 nm ([Composé]0 = 0,1 - 0,5 µM) dans l’eau purifiée ([O2] ≈ 0,26 mM).](/en/journals/rseau/2010-v23-n1-rseau3590/038923ar/media/038923arf005n.png)
![Influence de la concentration en oxygène dissous sur les vitesses de photodécomposition de l’estradiol (E2) et de l’éthinylestradiol (EE2) à 254 nm ([E2]0 ou [EE2]0 = 0,5 µM).](/en/journals/rseau/2010-v23-n1-rseau3590/038923ar/media/038923arf006n.png)

![Cinétique d’ordre 1 de photolyse des composés étudiés par irradiation polychromatique (Lampe Vilbert et Lourmat T6M, émission : > 280 nm) ([Composé]0 = 0,1 à 3 µM) dans l’eau purifiée ([O2] ≈ 0,26 mM).](/en/journals/rseau/2010-v23-n1-rseau3590/038923ar/media/038923arf009n.png)