Abstracts
Résumé
Les effluents liquides des huileries d’olive (margines) produits par le processus d’extraction d’huile d’olive sont les principaux déchets nuisibles de cette industrie. La caractérisation de ces effluents suivie de l’élimination de la matière organique (demande chimique en oxygène (DCO), des polyphénols totaux, de la matière en suspension (MES) et de la couleur), de la matière minérale (phosphates et azote ammoniacal) et des métaux lourds (zinc et fer) ont été expérimentalement étudiées à l’aide de la technique d’électrocoagulation en utilisant des électrodes en aluminium. Il est constaté que l’augmentation du temps d’électrolyse et de la tension électrique améliore le traitement de façon significative. Toutefois, la consommation simultanée d’énergie et des électrodes a été observée. Les résultats de ces analyses ont montré que les margines diluées cinq fois sont des effluents à pH acides (4,2), très chargés en matière organique (20 000 mg•L‑l de Demande Chimique en Oxygène (DCO)), en sels (Conductivité Électrique (C.E) = 3,6 mS•cm‑1), en azote ammoniacal (NH4+) (32 mg•L‑1), en orthophosphates (PO43-) (22 mg•L‑1). Elles contiennent également des quantités appréciables de métaux lourds, notamment le zinc (3,69 mg•L‑1) et le fer (13,80 mg•L‑1).
L’évolution des paramètres physico-chimiques au cours du traitement par électrocoagulation montre que dans les conditions d’un temps d’électrolyse de 15 minutes et d’une tension électrique de 20 volts (correspond à 250 A•m‑2), la décoloration des margines diluées cinq fois est comprise entre 96-99 %, la réduction de la Demande Chimique en Oxygène (DCO) est d’environ 80-85 %, la réduction des polyphénols totaux est d’environ 75-80 %, l’élimination des particules colloïdales (Matière En Suspension (MES)) peut atteindre 7-8 kg•m‑3, la réduction des orthophosphates est 94-99 %, la réduction de l’ammonium est 80-85 %,la réduction du zinc est 70-75 %, la réduction du fer est 71-76 %, la masse perdue des électrodes est 0,6-0,7 kg•m‑3 et l’énergie consommée est 12‑14 kWh•m‑3. Ces niveaux opérationnels optimaux permettent d’avoir une bonne dégradation des margines.
Mots clés:
- Margine,
- caractérisation,
- électrocoagulation,
- électrodes en aluminium,
- décoloration,
- DCO,
- polyphénols
Abstract
Olive mill wastewater (OMWW) generated by the olive oil extraction process is the main waste product of this industry. These effluents have been characterized, followed by an experimental study of the elimination of organic matter (chemical oxygen demand (COD), phenolic compounds, suspended solids (SS) and colour), mineral matter (phosphate and ammonium nitrogen) and heavy metals (zinc and iron) using an electrocoagulation technique with aluminum electrodes. It was found that an increase in electrolysis time and voltage improved treatment significantly. However, a simultaneous increase in electrode and energy consumption was observed.
The results of these analyses showed that the olive mill wastewater (OMWW) effluent, diluted five times, is acidic (pH 4.2), has a very high organic matter concentration (chemical oxygen demand (COD) 20,000 g•L‑1) and is high in salts (Electric Conductivity E.C = 3.6 mS•cm‑1), ammonium nitrogen (NH4+) (32 mg•L‑1) and orthophosphate (PO43‑) (22 mg•L‑1). The OMWW also contains considerable amounts of heavy metals, in particular zinc (3.69 mg•L‑1) and iron (13.80 mg•L‑1).
The trend in physicochemical parameters during the electrocoagulation treatment shows that, after 15 minutes of electrolysis using an electrical voltage of 20 volts (corresponds to 250 A•m‑2), the discolouration of the OMWW, diluted five times, lay between 96-99%, the reduction of the chemical oxygen demand (COD) was approximately 80-85%, the reduction of phenolic compounds was approximately 75‑80%, the elimination of colloidal material (suspended solids) reached 7-8 kg•m‑3, the reduction of orthophosphates was 94-99% and the reduction of ammonium was 80-85%. The reduction of zinc was 70-75%, the reduction of iron was 71-76%, the electrode consumption was 0.6-0.7 kg•m‑3 and the amount of energy consumed was 12-14 kWh•m‑3. Under these optimal operational conditions, acceptable degradation of the OMWW was achieved.
Key words:
- olive mill wastewater,
- characterization,
- electrocoagulation,
- aluminium electrodes,
- chemical oxygen demand,
- discolouration,
- phenols
Article body
1. Introduction
Les effluents liquides des huileries d’olive ont une couleur brun à brun rougeâtre, d’aspect trouble (MEBIROUK, 2002; SANSOUCY, 1984). Ces effluents ont une forte charge saline et sont très acides, riches en matières organiques et en polyphénols peu biodégradables (AIT BADDI et al., 2003; SAMSUNLU et al., 1998; UBAY et ÖZTÜRK, 1997; VITOLO et al., 1999). Ces eaux sont caractérisées par un pH de 4,5 à 5 et une conductivité de l’ordre de 10 mS•cm‑1, dus surtout aux ions potassium, chlorure, calcium et magnésium. La demande chimique en oxygène (DCO) peut varier de 50 à 220 g•L‑1. La composition chimique des margines est assez variable (83‑88 % d’eau; 10,5‑15 % de matière organique, 1,5‑2 % de matières minérales, 1,25‑2,4 % de matières azotées totales, 0,03‑1 % de matières grasses, 1,0‑1,5 % de polyphénols) (CONTRIBUTION SPÉCIALE DE SBA, 2003) .Elle dépend de nombreux facteurs, en particulier du mode d’extraction de l’huile, mais aussi de la période de production.
Le traitement des effluents liquides des huileries d’olive est l’un des plus importants problèmes environnementaux des pays méditerranéens. Pour réduire leurs effets négatifs, plusieurs procédés d’épuration, notamment physico-chimiques, sont mis en oeuvre tels que la coagulation-floculation (MEYSSAMI et KASAEIAN, 2005; SARIKA et al., 2005) qui est considérée comme prétraitement pour les rejets industriels chargés (GÖHR et al., 1994). Le sulfate d’aluminium est le coagulant qui est le plus largement utilisé (EDZWALD, 1993). Cette technique produit des quantités importantes de boues qui causent d’autres problèmes environnementaux. L’oxydation chimique utilisant l’ozone (AMAT et al., 2003; BENITEZ et al., 1997), l’hydroxyde d’hydrogène (FLOURI et al., 1996), ou les procédés d’oxydation avancée (GERNJAK et al., 2004; KESTIOGLU et al., 2005) sont basés sur la production des hydroxydes radicalaires permettant la destruction complète de la matière organique contenue dans les margines. Cependant, cette technique demande une technologie sophistiquée, du personnel qualifié et un coût très élevé.
L’électrocoagulation est une technique dérivée de la coagulation-floculation. Son avantage est qu’elle permet de générer, in situ, des ions pouvant assurer la déstabilisation électrostatique à pH acide ou neutre. Elle a également l’avantage d’éliminer certaines pollutions (turbidité, matières colloïdales, couleur, métaux lourds) par adsorption sur les flocs d’hydroxyde métallique qui se forment lorsque le pH est basique (KASHEFIALASI et al., 2006). Les principaux avantages du procédé d’électrocoagulation mis en évidence par plusieurs auteurs (PERSIN et RUMEAU, 1989; POUET, 1994; SHEN et CHI, 1996) sont la compacité des installations, le volume des boues plus faible et l’élimination des particules colloïdales de petites tailles.
L’objectif de cette étude est la caractérisation suivie par l’oxydation électrochimique d’un effluent réel d’une huilerie marocaine en utilisant des électrodes en aluminium ainsi que l’optimisation des paramètres opératoires influençant le traitement tels que le temps et la tension électrique aux bornes des électrodes.
2. Matériels et méthodes
2.1 Effluents issus d’une usine de production d’huile d’olive
Cette étude a porté sur des eaux usées d’huileries d’olive appelées margines provenant d’une unité semi-industrielle située à Marrakech (Maroc Sud) durant la campagne oléicole 2003-2004. Aucun additif chimique n’est employé pendant la production de l’huile d’olive.
Les échantillons sont prélevés dans des bocaux en plastique, bien fermés et stockés à température ambiante.
Avant l’électrocoagulation, les échantillons sont décantés puis le surnageant est filtré par un filtre sous vide et des disques filtrants en microfibres de verre (Whatman GF/D) de porosité 2,7 µm.
2.2 Techniques expérimentales
La cellule d’électrocoagulation (Figure 1), de volume 100 mL, comporte deux électrodes d’aluminium, l’une servant de cathode et l’autre d’anode. Les électrodes sont de 45 mm x 40 mm et une distance interélectrodes de 2,8 cm. Un courant continu est appliqué aux électrodes par un générateur de courant (4 A, 30 V).
Figure 1
Cellule d’électrocoagulation.
Electrolytic cell.
Le mélange de la solution dans la cellule électrolytique est assuré par un agitateur magnétique placé au fond de la cuve et situé entre les deux électrodes. L’intensité de l’agitation est 200 rpm. Après traitement, on laisse les solutions décanter puis on filtre le surnageant par un filtre sous vide et des disques filtrants de porosité 0,45 µm.
Les principales réactions susceptibles de se produire aux électrodes sont :
À l’anode :
À la cathode en milieu basique :
Compte tenu du pH, l’aluminium ne reste pas sous forme cationique. Les cations formés réagissent avec l’eau pour former des complexes de type Al2(OH)5+, Al2(OH)24+, soit l’hydroxyde peu soluble Al(OH)3. Ce sont ces espèces qui jouent le rôle de coagulant en neutralisant les charges négatives à la surface des colloïdes.
La masse de métal dissoute à l’anode par seconde est donnée par la loi de Faraday :
où I est l’intensité imposée (A). M est la masse molaire du métal considéré (g•mol‑1), F est la constante de Faraday (C•mole‑1). z la valence de l’ion formé.
L’énergie consommée en KWh•m‑3 est donnée par l’équation suivante :
où U est la tension aux bornes des électrodes (V), I est l’intensité (A), t est le temps (h) et V est le volume (m3).
2.3 Techniques analytiques
Sur l’ensemble des échantillons traités, nous avons effectué les analyses physico-chimiques suivantes : pH, masse de boue formée (MES), demande chimique en oxygène, polyphénols, décoloration, masse perdue d’aluminium, azote ammoniacal, orthophosphates, concentration du zinc et du fer. La détermination de l’ensemble de ces paramètres a été effectuée selon les méthodes standards pour examen des eaux et eaux usées (APHA, 1992).
L’intensité de la couleur a été déterminée par la mesure de l’absorbance à 395 nm (KISSI et al., 2001; SAYADI et ALLOUZ, 1995), (spectrophotomètre U.V. visible (CARY 1E VARIAN)).
Un spectrophotomètre U.V. visible (CARY 1E VARIAN) a été utilisé pour les analyses photométriques des polyphénols, de l’azote ammoniacal et des orthophosphates.
Les électrodes ont été pesées (balance ANDGF-3000) avant et après chaque expérience afin de déterminer la perte de masse au cours de l’expérimentation.
Les métaux (Zn, Fe) ont été suivis par spectrophotométrie de plasma à couplage inductif (ICP-AES) à l’aide d’un appareil de marque Varian, modèle VistaAX.
La mesure du pH est réalisée à l’aide d’un pH mètre (MICROPROCESSEUR 99621).
La détermination de la concentration initiale des polyphénols totaux a été réalisée avec la procédure officielle par spectrophotométrie (720 nm) (SLINKARD et SINGLETON, 1977) dans laquelle le réactif de Folin-Ciocalteu a été utilisé comme réactif sélectif pour les polyphénols totaux. Les résultats sont exprimés en grammes d’acide gallique par litre. Le suivi des polyphénols totaux, au cours du traitement, a été réalisé par la mesure de l’absorbance à 278 nm (JOAUNI et al., 2005; JOAUNI et al., 2003; SAYADI et al., 1995).
3. Résultats et discussion
3.1 Caractéristiques des eaux usées issues d’industries de production d’huile d’olive
L’analyse de ces résultats (Tableau 1) montre que l’effluent est acide et son pH est de 4,2. Cette valeur faible de pH est due à la richesse des margines en acides organiques (acides phénoliques, acide gras, etc). Cette acidité élevée entrave toute épuration biologique de ces effluents (CAPASSO et al., 1992; AGGELIS et al., 2003).
Tableau 1
Caractéristiques physico-chimiques des margines utilisées diluées cinq fois.
Physicochemical characteristics of olive mill wastewaters, diluted five times.
Paramètres |
Valeurs |
|---|---|
pH (potentiel d’hydrogène) |
4,2 |
Conductivité électrique (CE) (mS•cm‑1) |
3,6 |
Demande chimique en oxygène (DCO) (mg d’O2•L‑1) |
20 000 |
Polyphénols (mg•L‑1) |
260 |
Matière en suspension (MES) (mg•L‑1) |
213 |
Chlorures (Cl-) (mg•L‑1) |
116 |
Sodium (Na+) (mg•L‑1) |
639 |
Potassium (K+)(mg•L‑1) |
465 |
Ammonium (NH4+)(mg•L‑1) |
32 |
Orthophosphates (PO43- )(mg•L‑1) |
22 |
Fer (Fe) (mg•L‑1) |
13,80 |
Zinc (Zn) (mg•L‑1) |
3,69 |
Aluminium (Al)(mg•L‑1) |
2,70 |
Manganèse (Mn) (mg•L‑1) |
0,26 |
Plomb (Pb) (mg•L‑1) |
0,20 |
La composition minérale des margines étudiées montre que ces eaux résiduaires présentent une forte charge saline due particulièrement aux chlorures de sodium, liée probablement au salage pratiqué pour conserver les olives jusqu’à leur trituration, en plus de la richesse naturelle des olives en sels minéraux. Ceci pourra expliquer les valeurs élevées de la conductivité électrique (3,6 mS•cm‑1), d’où l’intérêt de traiter les margines par électrocoagulation.
La teneur en orthophosphates est de 22 mg•L‑1 et elle dépend des conditions climatiques et de l’utilisation ou non des engrais (FIESTAS ROS DE URSINOS, 1981).
La concentration en ammonium (NH4+) assez élevée (32 mg•L‑1) et surtout stable sur plusieurs mesures effectuées sur le même échantillon conservé à température ambiante pour plusieurs jours. Ce qui nous laisse déduire que l’activité biologique des margines est très limitée.
Les margines ont besoin d’un taux d’oxygène très élevé pour leur oxydation. En effet, la demande chimique en oxygène (DCO) des margines étudiées est de 20 000 mg d’O2•L‑1, cette valeur montre que les margines peuvent engendrer une pollution très importante.
3.2 Traitement électrolytique des eaux usées issues d’industries d’huile d’olive
L’évolution de la concentration résiduelle de DCO en fonction du temps est utile à la détermination des conditions optimales de traitement en matière de coût et d’efficacité (Figure 2). Pour faire cette cinétique, nous avons traité des échantillons de margines avec un potentiel de 22 V correspondant à une densité de courant de 280 A•m‑2 (ADHOUM et al., 2004; INAN et al., 2004; TEZCAN et al., 2006) et un volume de 100 mL.
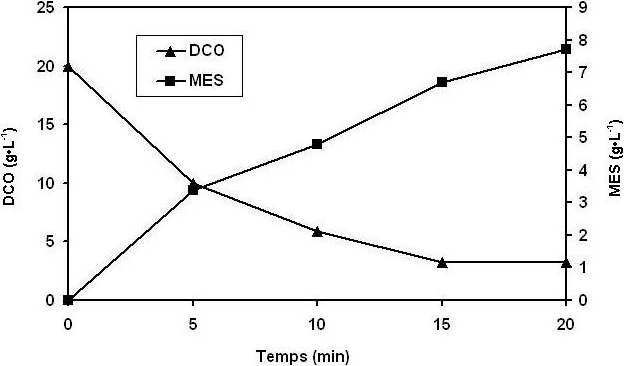
Figure 2
Variation de la demande chimique en oxygène (DCO) et de la matière en suspension (MES) formée au cours de l’électrocoagulation des margines (20 %) en fonction du temps.
Variation of the chemical oxygen demand (COD) and of the suspended solids (SS) formed during the electrocoagulation of the olive mill wastewaters (OMWW) (20%) as a function of time.
L’évolution de la Demande Chimique en Oxygène (DCO) résiduelle au cours du temps montre un abattement de plus de 50 % de la matière organique après seulement cinq min de traitement suivies d’une concentration quasi stable de 3 280 mg•L‑1 de DCO obtenue après 15 min de traitement.
L’élimination de la DCO est accompagnée par la formation de boue (MES) et de mousse. Le maximum de boue formée est atteint au bout de 15 à 20 minutes et la valeur mesurée est proche de 8 kg•m‑3 (ceci nécessite une filtration des eaux avant leurs rejets). Le temps optimum est 15 minutes.
3.2.1 Influence du temps de rétention
L’étude de la décoloration et de l’élimination de la matière organique par la méthode électrochimique nécessite l’optimisation de la tension électrique à imposer lors de l’électrolyse afin de minimiser les pertes énergétiques. Une étude a été effectuée pendant un temps d’électrolyse de 15 minutes pour des margines diluées cinq fois à pH normal des margines (4,2). La tension électrique varie de 1 à 30 V. Le volume des margines traitées est de 100 mL.
3.2.2 Influence de la tension électrique
a) Abattement de la DCO, MES, des polyphénols et de la couleur en fonction de la tension électrique
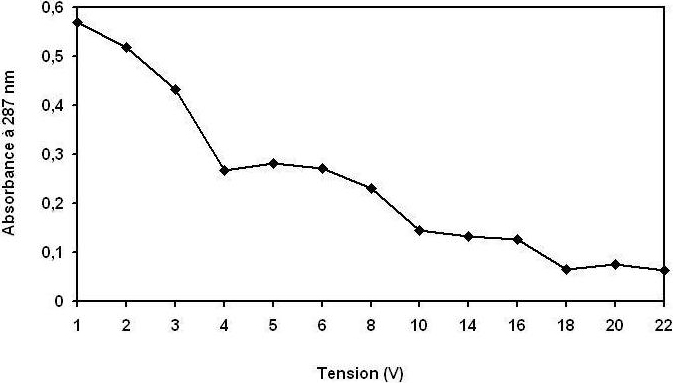
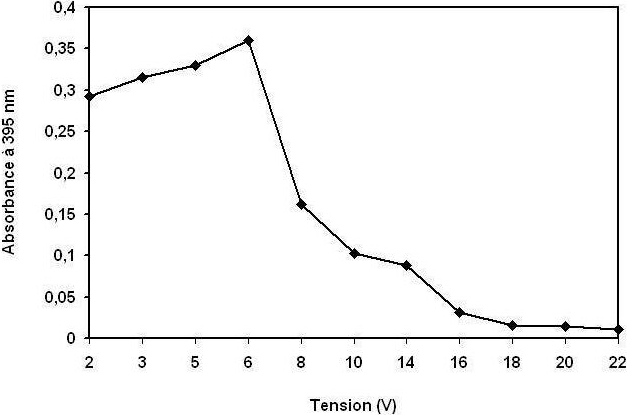
Il est bien connu que la densité de courant détermine non seulement la dose du coagulant mais aussi le taux de production des bulles et la croissance des flocs (HOLT et al., 2002; LETTERMAN et al., 1999) qui peuvent influencer l’efficacité du traitement par électrocoagulation. Par conséquent, l’effet de la tension électrique appliquée à la cellule sur l’élimination des polluants a été étudié. Les figures 3, 4 et 5 montrent l’effet de la tension électrique sur le taux d’élimination des polluants : (DCO), (MES), polyphénols et de la couleur. Comme on pouvait s’y attendre, il semble que, pour un temps donné, l’efficacité du traitement augmente significativement avec l’augmentation de la tension électrique. La plus haute tension (20 V correspond à 250 A•m‑2) a produit le traitement rapide de la DCO, des polyphénols et la décoloration des margines avec une réduction de 80 à 85 %, 75 à 80 % et 96 à 99 % respectivement, et la formation de 7 à 8 kg•m‑3 de boue, survenant après seulement 15 minutes. Cela est attribué au fait que, à tension électrique élevé, la densité du courant au sein de la cellule s’élève également, le taux d’aluminium oxydé augmente, entraînant une grande quantité de précipité et l’élimination de plus en plus de polluants. En outre, il a été démontré que la densité des bulles augmente et leur taille diminue avec l’augmentation de la densité de courant (KHOSLA et al., 1991), il en résulte une grande hausse des flux, un enlèvement plus rapide de polluants et la flottation des boues. La figure 5 montre qu’au début de l’électrocoagulation la couleur des margines devient de plus en plus foncée, du rouge-brun au noir; ceci peut être expliqué par une oxydation non totale des molécules organiques (ADHOUM et MONSER, 2004; ASSAS et al., 2002; KHOUFIA et al., 2007; MARINA et al., 2005), par conséquent la formation d’autres molécules intermédiaires. Par contre, en augmentant la tension électrique, la décoloration devient totale. On constate qu’il faut appliquer des tensions supérieures à 16 volts.
Figure 3
Variation de la demande chimique en oxygène (DCO) et de la matière en suspension (MES) formée au cours de l’électrocoagulation des margines (20 %) en fonction de la tension électrique et de l’intensité du courant.
Variation of the chemical oxygen demand (COD) and of the suspended solids (SS) formed during the electrocoagulation of the olive mill wastewaters (OMWW) (20%) as a function of the electrical voltage and the current intensity.
Figure 4
Évolution de l’absorbance U.V. maximale des phénols à 278 nm au cours du traitement en fonction de la tension électrique.
Evolution of maximum UV absorbance of phenols at 278 nm during the treatment as a function of the electrical voltage.
Figure 5
Évolution de l’absorbance U.V. maximale de la coloration à 395 nm en fonction de la tension électrique.
Evolution of maximum UV absorbance at 395 nm as a function of the electrical voltage.
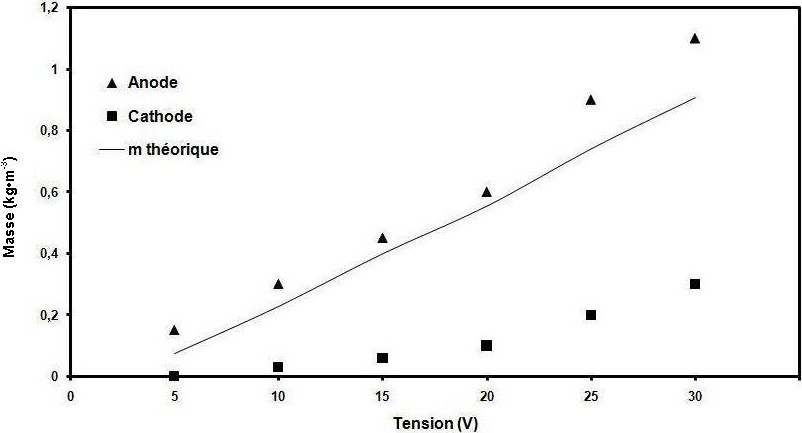
Le coût de ce procédé est déterminé par la consommation des électrodes et de l’énergie électrique. Par la suite, la quantité d’énergie nécessaire pour une meilleure élimination des polyphénols a été calculée. La figure 6 montre qu’au delà de 14 kWh•m‑3 l’abattement des polyphénols restait quasi stable. À partir des résultats présentés dans la figure 7, la consommation des électrodes d’aluminium (anode et cathode) (PICARD et al., 2000) par mètre cube des margines traitées augmente légèrement jusqu’à 20 V (250 A•m‑2). Toute nouvelle augmentation de la tension, au-delà de cette valeur, induit une augmentation relativement forte de la consommation des électrodes. Un comportement similaire a déjà été observé par HOLT et al. (2002) et a été expliqué par le fait que, aux courants plus élevés, la formation des ions d’aluminium est produite rapidement, par rapport aux processus de la coagulation, ce qui entraîne une baisse de rendement d’épuration. En outre, la suppression rapide de l’hydroxyde d’aluminium de la solution par flottation conduit à une réduction de la probabilité de collision entre les polluants et le coagulant. Ces résultats suggèrent que 250 A•m‑2 est la densité de courant optimale pour le traitement des margines, car elle assure un taux d’élimination rapide avec un coût plus bas.
Figure 6
Réduction des polyphénols en fonction de l’énergie consommée.
Removal of phenolic compounds as a function of energy consumption.
Figure 7
Effet de la tension électrique sur la perte de masse aux électrodes.
Effect of electrical voltage on electrode consumption.
b) Abattement de la concentration des orthophosphates et des ions ammonium en fonction de la tension électrique
Précédemment, on a montré que le traitement par électrocoagulation est influencé par la tension électrique et la densité du courant. D’après la figure 8, les ions ammonium sont éliminés davantage lorsque la tension électrique est plus grande. À 22 V, l’abattement de NH4+ peut s’élever à 85 %. Ceci pourra limiter l’impact de la pollution azotée sur les milieux récepteurs. La diminution de l’ammonium pourrait simplement être attribuée à un dégazage de l’ammoniaque induit par les bulles de gaz formées à la cathode.
Figure 8
Évolution de l’ammonium (NH4+) et des orthophosphates (PO43-) des margines (20 %) traitées par électrocoagulation en fonction de la tension électrique.
Evolution of the ammonium ion (NH4+) and orthophosphates (PO43-) in the olive mill wastewaters (OMWW) treated by electrocoagulation as a function of the electrical voltage.
La figure 8 montre également l’effet de la tension sur l’abattement des orthophosphates. L’élimination maximale (97 %) est observée pour des valeurs très basses de tension électrique (8 V correspondant à 90 A•m‑2). Les mêmes résultats ont été trouvés par d’autres auteurs (BEKTAS et al., 2003). Ils ont montré que l’abattement maximal des phosphates est atteint pour des pH compris entre 5 et 6. La figure 6 montre qu’au cours de l’électrocoagulation, le pH augmente avec l’augmentation de la tension électrique. À 8 V le pH final devient 5,5 (pH initial 4,2), ce qui est favorable pour la réduction des phosphates.
Les orthophosphates sont initialement sous la forme H2PO4‑ ou HPO42‑, ils sont probablement éliminés par précipitation avec les ions aluminium selon les réactions suivantes :
c) Évolution du pH en fonction de la tension électrique
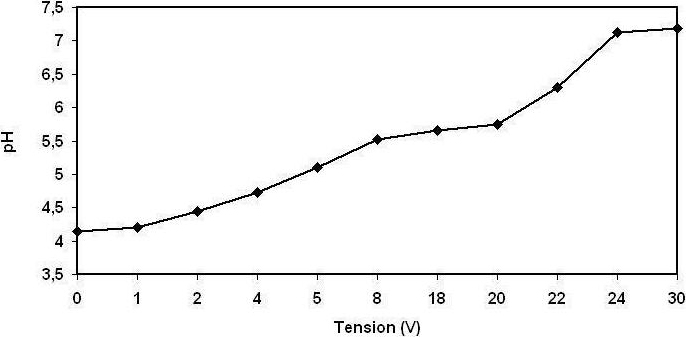
Le pH initial des margines avant traitement est de l’ordre de 4,2; après électrocoagulation, le pH augmente avec la tension appliquée à la cellule (Figure 9), il y a donc un abaissement de l’acidité jusqu’à la neutralisation à partir de 24 V. Ceci est dû essentiellement aux ions OH- produits par électrolyse de l’eau avec dégagement de l’hydrogène sur la cathode selon la réaction (8); Cela a été observé par d’autres chercheurs (CHEN et al., 2000, VIK et al., 1984).
Figure 9
Le pH des margines (20 %) traitées par électrocoagulation en fonction de la tension appliquée.
Final pH of the olive mill wastewaters (OMWW) (20%) treated by electrocoagulation as a function of the voltage applied.
Le pH final atteint 7,2, ce qui permet de rejeter l’effluent directement dans les milieux récepteurs naturels sans ajustement du pH. Ainsi, dans toutes nos expériences, les margines ont été traitées directement sans ajustement du pH initial.
d) Évolution de la concentration de fer et de zinc en fonction de la tension électrique
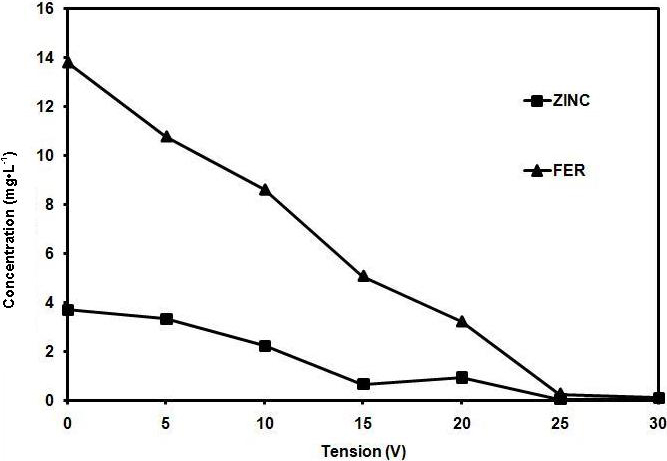
La figure 10 concernant l’abattement du zinc et du fer dénote l’effet de l’électrocoagulation sur ces deux métaux lourds. Cet effet augmente avec la tension appliquée aux bornes des électrodes. Les concentrations résiduelles du zinc et du fer sont respectivement de 2,21 mg•L‑1 (40 %) et 8,6 mg•L‑1 (38 %) pour une tension appliquée de 10 V, de 0,07 mg•L‑1 (98 %) et 0,12 mg•L‑1 (99 %) pour la tension de 30 V. Les rendements d’épuration augmentent lorsque la tension appliquée aux bornes des électrodes augmente. Ceci s’explique par l’augmentation du transport ionique vers les électrodes et l’accélération de l’électrocoagulation qui s’ensuit. Les résultats trouvés lors de nos essais effectués sur les métaux lourds sont confirmés par les résultats d’autres auteurs (HEIDMAN et CALMANO, 2007). Les métaux lourds présents à l’état cationique peuvent réagir dans le milieu réactionnel de différentes manières. Ils peuvent subir soit une réduction, soit une oxydation, soit une adsorption sur les flocs d’hydroxyde d’aluminium.
Figure 10
Concentration du fer et du zinc en fonction de la tension électrique appliquée.
Concentrations of iron and zinc as a function of the electrical voltage.
4. Conclusion
À l’issue de ce travail relatif à la caractérisation et au traitement des margines d’huileries de la ville de Marrakech, nous pouvons retenir qu’il s’agit d’effluents à pH acide (4,2), représentant une teneur élevée en matière organique (20 000 mg d’O2•L‑1), en matière en suspension et en polyphénols. Ces teneurs dépassent largement les teneurs des éléments chimiques de rejet des eaux usées domestiques ou urbaines.
L’analyse de la fraction minérale des margines a montré une dominance des chlorures de sodium, et ce, à cause de l’utilisation excessive du sel commercial, très riche en chlorure de sodium, pour la conservation des olives avant leur trituration.
L’électrocoagulation des margines par les électrodes d’aluminium est un procédé de traitement compact et efficace pour la réduction de la couleur (96-99 %), de la demande chimique en oxygène (80-85 %), des polyphénols (75-80 %), des orthophosphates (94-99 %), de l’ammonium (80-85 %), du zinc (70-75 %) et du fer (71-76 %) pour des margines diluées cinq fois et un temps d’électrolyse de 15 minutes, sans ajustement de pH, ce qui constitue une économie pour l’étape de neutralisation. L’efficacité du traitement est influencée fortement par la densité du courant, la tension électrique et le temps d’électrolyse.
La valeur optimale de la tension électrique engendrant un rendement maximal avec une consommation faible d’énergie et des électrodes est 20 V (250 A•m‑2).
Ces niveaux opérationnels optimaux permettent, d’une part, d’avoir une bonne réduction de la pollution des margines et, d’autre part, les eaux traitées pourront être épurées par voie biologique vu l’élimination importante des polyphénols.
Appendices
Références bibliographiques
- ADHOUM N., L. MONSER, N. BELLAKHAL et J. BELGAIED (2004). Treatment of electroplating wastewater containing Cu2+, Zn2+ and Cr(VI) by electrocoagulation. J. Hazard. Mater., 112, 207-213.
- ADHOUM N. et L. MONSER (2004). Decolorization and removal of phenolic compounds from olive mill wastewater by electrocoagulation. Chem. Eng. Process, 43, 1281‑1287.
- AIT BADDI G., M. HAFIDI, V. GILARD et J.C. REVEL (2003). Characterization of humic acids produced during composting of olive mill wastes: elemental and spectroscopic analyses (FTIR and 13C NMR). Agronomie, 23, 1‑6.
- AGGELIS G., D. ICONOMOU, M. CHRISTOU, D. BOKAS, S. KOTZAILIAS, G. CHRISTOU, V. TSAGOU et S. PAPANIKOLAOU (2003). Phenolic removal in a model olive oil mill wastewater using Pleurotus ostreatus in bioreactor cultures and biological evaluation of the process. Water Res., 37, 3897‑3904.
- AMAT A.M., A. ARQUES, H. BENEYTO, A. GARCIA, M.A. MIRANDA et S. SEGUI (2003). Ozonization coupled with biological degradation for treatment of phenolic pollutants: A mechanistically based study. Chemosphere, 53, 79‑86.
- APHA (1992). American public health association standard methods for analysis of water and wastewater. APHA Pub.,Washington, DC.
- ASSAS N., L. AYED, L. MAROUANI et M. HAMDI (2002). Decolorization of fresh and stored black olive mill wastewaters by Geotrichum Candidum. Process Biochem., 38, 361‑365.
- BEKTAS N., H. AKBULUTH, H. INANH et A. DIMOGLO (2003). Removal of phosphate from aqueous solutions by electro-coagulation. J. Hazard. Mater., 106, 101‑105.
- BENITEZ F.J., J. BELTRAN-HEREDIA et J. TERROGROSA (1997). Treatments of wastewaters from olive mills by UV radiation and by combined ozone-UV radiation. Toxicol. Environ. Chem., 61, 173‑185.
- CAPASSO R., G. CRISTINZIO, A. EVIDENTE et F. SCOGNAMIGLIO (1992). Isolation, spectroscopy selective phyto-toxic effects of polyphenols from vegetable waste waters. Phytochem., 31, 4125‑4128.
- CHEN X., G. CHE et P.L. YUE (2000). Separation of pollutants from restaurant wastewater by electrocoagulation. Sep. Purif. Technol., 19, 65‑76.
- CONTRIBUTION SPÉCIALE DE SUSTAINBALE BUSINESS ASSOCIATES (2003). Pollution and development issues in the Mediterranean basin. Dans : 2e conférence internationale Swiss Environmental Solutions For Emerging Countries (SESEC).
- EDZWAMD J.K. (1993). Coagulation in drinking water treatment: particles, organics and coagulants. Water Sci. Technol., 27, 21‑35.
- FEISTAS ROS DE URSINOS J. A. (1981). Différntes utilisations des margines. Dans : Proceedings of the Séminaire International sur la Valorisation des Sous-Produits De L’Olivier. Organisation des Nations Unies pour l’Alimentation et l’Agriculture (FAO), pp. 93-110, Tunisie.
- FLOURI F., D. SOTIRCHOS, S. JOANNIDOU et C. BALIS (1996). Decolorization of olive oil mill liquid wastes by chemical and biological means. Int. Biodeter. Biodegr., 38, 189‑192.
- GERNJAK W., M.L. MALDONADO, S. MALATO, J. CACERES, T. KRUTZLER, A. GLASER et R. BAUER (2004). Pilot-plant treatment of olive mill wastewater (OMW) by solar TiO2 photocatalysis and solar photo-Fenton. Sol. Energy, 77, 567‑572.
- GÖHR F., F. HERMANUTZ et W. OPPERMANN (1994). Ozonation: an important technique to comply with new Germany laws for textile wastewater treatment. Water Sci. Technol., 30, 255‑263.
- HEIDMANN I. et W. CALMANO (2007). Removal of Zn(II), Cu(II), Ni(II), Ag(I) and Cr(VI) present in aqueous solutions by aluminium electrocoagulation. J. Hazard. Mater., 152, 934‑941. doi:10.1016/j.jhazmat.2007.07.068.
- HOLT P.H., G.W. BARTON, M. WARK et A.A. MITCHELL (2002). A quantitative comparison between chemical dosing and electrocoagulation. Colloids Surf. A: Physicochem. Eng., 211, 233‑248.
- INAN H., A. DIMOGLO, H. SIMSEK et M. KARPUZCU (2004). Olive oil mill wastewater treatment by means of electro-coagulation. Sep. Purif. Technol., 36, 23‑31.
- JAOUANI A., S. SAYADI, M. VANTHOURNHOUT et M. PENNINCKX (2003). Potent fungi for decolourization of olive oil mill wastewater. Enzyme Microb. Technol., 33, 802‑809.
- JAOUANIA A., F. GUILLÉNB, M.J. PENNINCKXA, A.T. MARTÍNEZB et M.J. MARTÍNEZB (2005). Role of Pycnoporus coccineus laccase in the degradation of aromatic compounds in olive oil mill wastewater. Enzyme Microb. Technol., 36, 478‑486.
- KASHEFIALASI M., M. KHOSRAVI, R. MARANDA et K. SEYYEDI (2006). Treatement of dye solution containing colored index acid yellow 36 by electrocoagulation using iron electrodes. Inter. J. Envir. Sci. Technol., 2, 365‑371.
- KESTIOGLU K., T. YONAR et N. AZBAR (2005). Feasibility of physico-chemical treatment and advanced oxidation processes as a means of pretreatment of olive mill effluent. Process Biochem., 40, 2409‑2416.
- KHOSLA N.K., S. VENKACHALAM et P. SONRASUNDARAM (1991). Pulsed electrogeneration of bubbles for electroflotation. J. Appl. Electrochem., 21, 986‑990.
- KHOUFIA S., F. FEKIA et S. SAYADI (2007). Detoxification of olive mill wastewater by electrocoagulation and sedimentation processes. J. Hazard. Mater., 142, 58‑67.
- KISSI M., M. MOUNTADAR, O. ASSOBHEI, E. GARGIULO, G. PALMIERI et P. GIARDINA (2001). Roles of two white-rot basidiomycete fungi in decolorisation and detoxification of olive mill waste water. Appl Microbiol. Biotechnol., 57, 221‑226.
- LETTERMAN R.D., A. AMIRTHARAJAH et C.R. O’MELIA (1999). Water Quality Treatment - A Handbook of Community Water Supplies, R.D. LETTERMAN (Éditeur), 5e édition, AWWA, McGraw-Hill, New York, 1248 p.
- MARINA G., N. KALOGERAKIS, E. PSILLAKIS, P. SAMARAS et D. MANTZAVINOS (2005). Electrochemical oxidation of olive oil mill wastewaters. Water Res., 39, 4177‑4187.
- MEBIROUK M. (2002). Rejets des huileries, développement d’un procédé intégré pour la biodégradation des polyphénols dans la margine, CMPP News, 11.
- MEYSSAMI B. et A.B. KASAEIAN (2005). Use of coagulants in treatment of olive oil wastewater model solutions by induced air flotation. Bioresour. Technol., 96, 303‑307.
- PERSIN F et M. RUMEAU (1989). Le traitement électrochimique des eaux et des effluents. Tribune Eau, 42, 45-56.
- PICARD T., G. CATHALIFAUD–FEUILLADE, M. MAZET et C. VANDENSTEENDAM (2000). Cathodic dissolution in the electrocoagulation process using aluminium electrodes. J. Environ. Monit., 2, 77‑800.
- POUET M.F. (1994). Traitements physico-chimiques associés à une microfiltration d’eau usée urbaine. Thèse de Doctorat de l’Université de Montpellier II, 163 p., N° ordre 44313.
- SAMSUNLU A., O. TÜNAY et K. ALP (1998). Characteristic and treatment of olive oil wastewater. Dans : Proceedings of the Sixth Control Of Industrial Pollution Symposium, 3-5 juin, Istanbul, ITU, pp.93‑99.
- SANSOUCY R. (1984). Utilisation des sous-produits de l’olivier en alimentation animale dans le bassin méditerranéen, FAO, Rome.
- SARIKA R., N. KALOGERAKIS et D. MANTZAVINOS (2005). Treatment of olive mill effluents: Part II. Complete removal of solids by direct flocculation with poly electrolytes. Environ. Int., 31, 297‑304.
- SAYADI S. et R. ELLOUZ (1995). Roles of lignin peroxidase and manganese peroxidase from Phanerochaete chrysosporium in the decolorization of olive mill wastewaters. Appl. Environ. Microbiol., 61, 1098‑1103.
- SHEN G.H. IN et F. CHI. F.P. (1996). Continuous treatment of textile wastewater by combined coagulation, electrochemical oxidation and actived sludge. Water Res., 30, 387‑392.
- SLINKARD K. et V.L. SINGLETON (1977). Total phenol analyses: automation and comparison with manual methods. Am. J. Enol. Vitic., 28, 49‑56.
- TEZCAN ÜNA Ü., S. UGURA, A.S. KOPARALB et BAKIR Ü ÖGÜTVERENB (2006). Electrocoagulation of olive mill wastewaters. Sep. Purif. Technol., 52, 136-141.
- UBAY G. et I. ÖZTÜRK (1997). Anaerobic treatment of olive mill effluents. Water Sci. Technol., 36, 287‑294.
- VIK E.A., D.A. CARLSON, A.S. EIKUM et E.T. GJESSING (1984). Electrocoagulation of potable water. Water Res., 18, 1355‑1360.
- VITOLO S, I. PETARCA et B. BRESCI (1999). Treatment of olive oil industry wastes. Bioresour. Technol., 2, 129.
List of figures
Figure 1
Cellule d’électrocoagulation.
Electrolytic cell.
Figure 2
Variation de la demande chimique en oxygène (DCO) et de la matière en suspension (MES) formée au cours de l’électrocoagulation des margines (20 %) en fonction du temps.
Variation of the chemical oxygen demand (COD) and of the suspended solids (SS) formed during the electrocoagulation of the olive mill wastewaters (OMWW) (20%) as a function of time.
Figure 3
Variation de la demande chimique en oxygène (DCO) et de la matière en suspension (MES) formée au cours de l’électrocoagulation des margines (20 %) en fonction de la tension électrique et de l’intensité du courant.
Variation of the chemical oxygen demand (COD) and of the suspended solids (SS) formed during the electrocoagulation of the olive mill wastewaters (OMWW) (20%) as a function of the electrical voltage and the current intensity.
Figure 4
Évolution de l’absorbance U.V. maximale des phénols à 278 nm au cours du traitement en fonction de la tension électrique.
Evolution of maximum UV absorbance of phenols at 278 nm during the treatment as a function of the electrical voltage.
Figure 5
Évolution de l’absorbance U.V. maximale de la coloration à 395 nm en fonction de la tension électrique.
Evolution of maximum UV absorbance at 395 nm as a function of the electrical voltage.
Figure 6
Réduction des polyphénols en fonction de l’énergie consommée.
Removal of phenolic compounds as a function of energy consumption.
Figure 7
Effet de la tension électrique sur la perte de masse aux électrodes.
Effect of electrical voltage on electrode consumption.
Figure 8
Évolution de l’ammonium (NH4+) et des orthophosphates (PO43-) des margines (20 %) traitées par électrocoagulation en fonction de la tension électrique.
Evolution of the ammonium ion (NH4+) and orthophosphates (PO43-) in the olive mill wastewaters (OMWW) treated by electrocoagulation as a function of the electrical voltage.
Figure 9
Le pH des margines (20 %) traitées par électrocoagulation en fonction de la tension appliquée.
Final pH of the olive mill wastewaters (OMWW) (20%) treated by electrocoagulation as a function of the voltage applied.
Figure 10
Concentration du fer et du zinc en fonction de la tension électrique appliquée.
Concentrations of iron and zinc as a function of the electrical voltage.
List of tables
Tableau 1
Caractéristiques physico-chimiques des margines utilisées diluées cinq fois.
Physicochemical characteristics of olive mill wastewaters, diluted five times.
Paramètres |
Valeurs |
|---|---|
pH (potentiel d’hydrogène) |
4,2 |
Conductivité électrique (CE) (mS•cm‑1) |
3,6 |
Demande chimique en oxygène (DCO) (mg d’O2•L‑1) |
20 000 |
Polyphénols (mg•L‑1) |
260 |
Matière en suspension (MES) (mg•L‑1) |
213 |
Chlorures (Cl-) (mg•L‑1) |
116 |
Sodium (Na+) (mg•L‑1) |
639 |
Potassium (K+)(mg•L‑1) |
465 |
Ammonium (NH4+)(mg•L‑1) |
32 |
Orthophosphates (PO43- )(mg•L‑1) |
22 |
Fer (Fe) (mg•L‑1) |
13,80 |
Zinc (Zn) (mg•L‑1) |
3,69 |
Aluminium (Al)(mg•L‑1) |
2,70 |
Manganèse (Mn) (mg•L‑1) |
0,26 |
Plomb (Pb) (mg•L‑1) |
0,20 |