Abstracts
Résumé
Le présent travail reporte l’effet du cadmium (Cd), du benzo[a]pyrène (B[a]P) ainsi que leur mélange (Cd/B[a]P), à 1 µM, sur les activités d’enzymes impliqués dans la phase I et la phase II de biotransformation chez le polychète Nereis diversicolor en fonction du temps (après 12, 24, 36 et 48 h).
L’effet d’une contamination aiguë par du cadmium à une dose de 1 µM après 12, 24 et 36 h montre une inhibition de l’activité NADPH cytochrome C réductase chez les individus contaminés comparés à leurs témoins relatifs, alors que le seul effet du cadmium sur l’activité glutathion-S-transférase n’est enregistré qu’après 36 h d’exposition. Quant au benzo[a]pyrène, les résultats montrent une augmentation significative de l’activité NADPH cytochrome C réductase après 12, 24 et 36 h d’exposition, alors que pour l’activité glutathion-S‑transférase, la variation significative entre les animaux témoins et traités n’est enregistrée qu’à 36 h d’exposition. Le mélange (Cd/B[a]P) inhibe l’activité NADPH cytochrome C réductase chez les individus traités par comparaison aux témoins relatifs et montre un effet inducteur sur l’activité GST sauf après 36 h d’exposition. Ces résultats montrent ainsi les interactions entre les polluants ainsi que leurs effets sur les organismes.
Mots clés:
- Nereis diversicolor,
- cadmium,
- benzo[a]pyrène,
- NADPH cytochrome C reductase et glutathion-S-transferase
Abstract
The acute effects of cadmium and benzo[a]pyrene, individually and as a mixture, were evaluated on the phase I and phase II biotransformation enzymes of Nereis diversicolor (Polychaeta) collected from unpolluted sites. In the acute assay (1 µM) after 12, 24, 36 and 48 h, the comparison between worms exposed to cadmium and their controls showed an inhibited activity of NADPH cytochrome C reductase after 12, 24 and 36 h. For the activity of glutathione-S-transferase (GST), however, inhibition in the presence of Cd was only noted after 36 h of exposure. Although exposure to benzo[a]pyrene resulted in a significant increase in NADPH cytochrome C reductase activity after 12, 24 and 36 h, a significant difference in glutathione-S-transferase (GST) activity between treated and control animals was only observed after 36 h. The mixture (Cd/B[a]P) seemed to inhibit the activity of NADPH cytochrome C reductase and to induce the activity of GST in individuals but only up until 36 h of exposure. These findings illustrate the interactions between pollutants and their effects on organisms.
Keywords:
- Nereis diversicolor,
- cadmium,
- benzo[a]pyrene,
- NADPH cytochrome C reductase and glutathione-S-transferase
Article body
1. Introduction
La surveillance de la qualité des écosystèmes repose en grande partie sur l’évaluation de l’impact toxicologique des polluants grâce à des méthodes simples et fiables, spécifiquement adaptées à l’étude des effets des xénobiotiques sur les organismes vivants et sur leur environnement. Dans ce contexte, les marqueurs biologiques apparaissent désormais comme des outils pertinents permettant d’évaluer les effets d’expositions chroniques ou ponctuelles à un (ou des) xénobiotique(s) sur les écosystèmes.
Parmi les polluants présents dans le milieu marin figurent les hydrocarbures aromatiques polycycliques (HAP) et les métaux traces, connus par leurs effets plus ou moins néfastes sur les organismes aquatiques.
Le benzo[a]pyrène B[a]P est un composé ubiquiste très représentatif des HAP dans le milieu marin. Il s’agit d’un hydrocarbure aromatique polycyclique à cinq cycles dont les propriétés mutagènes et cancérigènes ont été largement étudiées chez les animaux aquatiques, aussi bien les vertébrés que les invertébrés (GRAVATO et SANTOS, 2002; METCALFE, 1988; PACHECO et SANTOS, 1997; PALMQVIST, 2003). On pense même que certains métabolites du B[a]P peuvent interférer dans les processus chimiques cellulaires. Cette interférence pourrait conduire à l’induction de cancers par altération du processus génétique et du processus de division cellulaire lors de la combinaison avec l’ADN (LEWINSKA et al.,2007; LIN et al., 2008).
Sous le nom d’éléments traces sont désignés les métaux et les métalloïdes présents dans les biotopes à des concentrations extrêmement faibles. Ces métaux se composent d’éléments essentiels ou oligo-éléments tels que le cuivre (Cu), le zinc (Zn) et le fer (Fe), et en éléments non essentiels ou toxiques tels que le cadmium (Cd) et le mercure (Hg). Il est communément admis que les métaux exercent leur toxicité par leur capacité à affecter de façon non spécifique des molécules cibles qui ont une fonctionnalité physiologique (RAINBOW, 1997; ROAST et al., 2001). Ainsi, plusieurs auteurs ont montré que certains métaux tels que le Cd, du fait de ses caractéristiques physico-chimiques (Cd2+, 0,96 Å) qui ressemblent à celles du calcium (Ca2+, 0,99 Å) facilitent son transport à travers les membranes cellulaires par le biais des voies d’échange du Ca2+ telles que les canaux Ca2+, les pompes Na+/Ca2+ ou bien les Ca2+ ATPases (VERBOST et al., 1989; BJERREGAARD et DEPLEDGE, 1994). De ce fait, certains métaux comme le Cu, le Zn, le Cd, et le Pb peuvent bloquer des perméases impliquées dans les transports ioniques, particulièrement les pompes Na+/K+ ATPase . Ces métaux peuvent aussi altérer les fonctions mitochondriales, la stabilité lysosomale ou la réplication de l’ADN (AMIARD et al., 2007; GOERING et al., 1987; VIARENGO et al., 1990).
Quant à l’effet combiné des métaux traces et des polluants organiques, plusieurs travaux ont montré la capacité de certains métaux tels que le Cd et le Cu à inhiber les mécanismes de biotransformation des polluants organiques, aussi bien in vivo qu’in vitro (CARPENTER et al., 2002; KORASHY et EL-KADI, 2004; OLIVEIRA et al., 2004; REGOLI et al., 2005), bien que d’autres auteurs ont par contre montré un effet inducteur du Cd sur l’activité de biotransformation EROD chez le loup de mer Dicentracus labrax coexposé au Cd et au B[a]P (LEMAIRE-GONY et al., 1995). VAN DEN HURK et al. (2000) ont montré une inhibition de la production des métallothionéines MTs suite à une exposition par le Cd et le B[a]P chez le poisson Fundulus heteroclitus par comparaison au niveau de production des ces métalloprotéines chez les organismes traités uniquement par le Cd.
C’est ainsi que plusieurs espèces d’organismes aquatiques ont été utilisées pour évaluer l’impact des polluants environnementaux, et ceci, par évaluation de certains paramètres biochimiques et physiologiques connus sous le terme de biomarqueurs. En effet, à partir des années soixante-dix, le développement de la toxicologie moléculaire utilisant les outils de la biochimie et de la biologie moléculaire a permis de progresser dans la connaissance des mécanismes de toxicité, principalement chez des mammifères modèles comme le rat. Par la suite, pour plusieurs polluants, des effets biochimiques spécifiques et non spécifiques ont pu être mis en évidence chez des espèces ayant un intérêt écotoxicologique telles que les poissons, les mollusques ou les annélides.
Parmi les espèces choisies pour étudier les effets des polluants environnementaux figure le polychète de mer Nereis diversicolor comme espèce bioindicatrice. Ce choix découle de plusieurs raisons : il s’agit d’une espèce largement répartie dans les lagunes et les estuaires de l’Afrique du Nord et de l’Europe (GILLET, 1993; METTAM, 1981), sédentaire, sentinelle et qui vit et se reproduit dans les sédiments, réservoirs de divers polluants (LEE et al., 2000; SUN et ZHOU, 2008). Par comparaison aux bivalves indicateurs de la qualité de la couche d’eau, le polychète Nereis diversicolor est considéré comme un bon indicateur de la qualité du sédiment marin (ERKUDEN et al., 2004).
L’objectif de ce travail consiste à étudier la réponse biochimique en fonction du temps du Nereis diversicolor suite à une exposition menée en laboratoire au cadmium (Cd) et au benzo[a]pyrène B[a]P, ainsi qu’à leur mélange pour une dose unique de 1 µM. Les paramètres biochimiques retenus pour évaluer l’impact des polluants sont les systèmes de biotransformation de phase I et de phase II, respectivement la NADPH cytochrome C réductase et la glutathion S-transférase.
2. Matériel et méthodes
2.1 Matériel biologique
Les polychètes utilisés ont été collectés dans la région de Téboulba (Sahel Tunisien), site peu pollué (BANNI, 2004). Ces individus ont été acclimatés pendant 72 heures dans des structures de stabulation (boite de Petri) contenant de l’eau de mer filtrée dont la température et la salinité sont respectivement 17 °C et 33 ‰.
Après cette étape d’acclimatation, ces organismes ont été transférés dans des boites de Petri contenant 100 mL d’eau de mer contaminée respectivement par le cadmium et le benzo[a]pyrène à une dose de 1 µM de chaque contaminant, soit 10 µL de solution de contamination par 100 mL d’eau de mer, le nombre de polychètes est de 8 individus•100 mL‑1. Le chlorure de cadmium (CdCl2) est solubilisé dans une solution de NaCl 9 ‰, alors que le benzo[a]pyrène est solubilisé dans une solution de diméthylsulfoxide (DMSO).
Parallèlement aux individus traités par les polluants, des groupes de polychètes témoins sont traités par du NaCl 9 ‰ et du DMSO pour un volume de 10 µL•100 mL‑1 d’eau de mer.
Un lot de polychètes contaminés et témoins est sacrifié après 12, 24, 36 et 48 heures puis conservés à -80 °C.
2.2 Préparation des extraits biologiques
Les vers sont homogénéisés avec un homogénéisateur Polytron (PCU 8) dans quatre volumes de tampon phosphate 100 mM, pH 8. L’homogénat obtenu est centrifugé à 4 °C pendant 25 minutes à 9 000 g.
Le surnageant obtenu est réparti dans plusieurs tubes servant pour le dosage des activités enzymatiques (biomarqueurs) et des protéines totales. Ces dernières ont été évaluées selon la méthode de BRADFORD (1976) en utilisant le sérum albumine bovine comme référence à une concentration de 1 mg BSA•mL‑1.
2.2 Dosage biochimique des biomarqueurs
2.2.1 Dosage de l’activité spécifique NADPH cytochrome C réductase
La NADPH cytochrome C réductase est une flavoprotéine située dans le réticulum endoplasmique lisse. Elle catalyse le transfert des électrons du NADPH vers le cytochrome P450. Le dosage de l’activité enzymatique spécifique a été réalisé selon la méthode décrite par HAYES (1982). Le principe consiste à faire réagir dans un milieu phosphate (100 mM, pH 8), 10 µL de l’extrait cytosolique en présence du NADPH et du cytochrome C dont les concentrations finales sont respectivement 20 et 10 mM. La variation de la densité optique par minute due à l’apparition du cytochrome C réduit est mesurée à 550 nm. L’activité enzymatique spécifique est exprimée en nmol de produit apparu par min et par mg de protéines totales.
2.2.2 Dosage de l’activité spécifique glutathion-S-transférase
Les glutathion-S-transférases constituent une famille d’isoenzymes principalement cytosoliques, qui catalysent des réactions de conjugaison entre une molécule exogène électrophile ou lipophile (issue de la phase I de fonctionnalisation) et un tripeptide : le glutathion réduit. Le dosage de l’activité enzymatique spécifique a été réalisé selon la méthode décrite par HABIG et al. (1974) et qui consiste à faire réagir dans un milieu phosphate (100 mM, pH 8), 10 µL de l’extrait cytosolique avec le 1‑chloro‑2,4‑dinitrobenzène (CDNB) comme substrat en présence du glutathion réduit (GSH) dont les concentrations finales sont respectivement 1 et 4 mM. La réaction entre ces deux produits entraîne la formation d’un complexe (CNDN-GS), qui absorbe la lumière à une longueur d’onde de 340 nm.
2.3 Analyses statistiques
L’étude statistique des résultats est réalisée par analyse de la variance (ANOVA). L’homogénéité des variances est vérifiée par le test de Duncan en utilisant le logiciel SPSS (Version 10.0; Microsoft et Redmond).
3. Résultats
3.1 Étude de la réponse de l’activité spécifique NADPH cytochrome C réductase
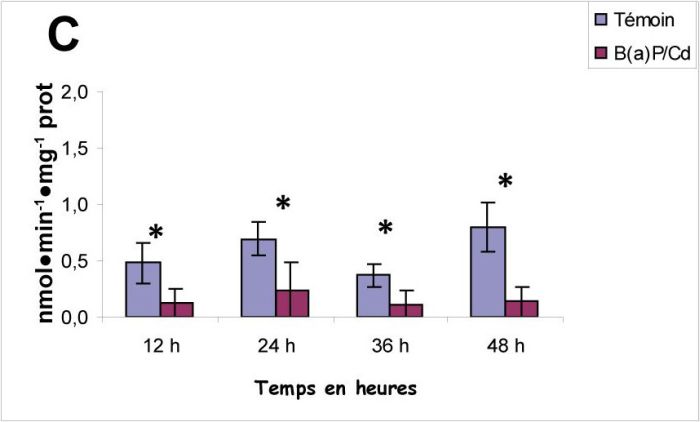
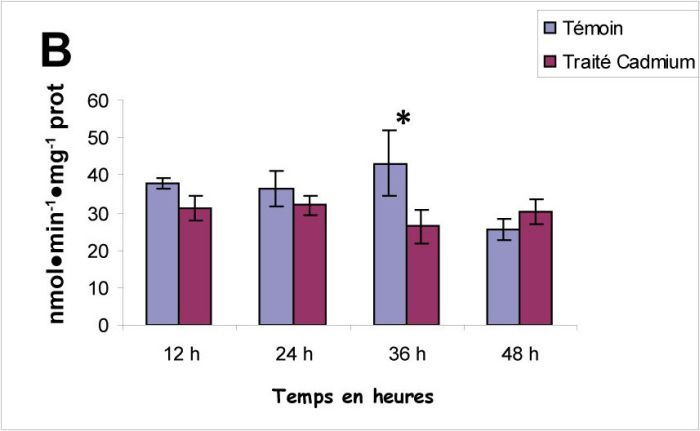
Le suivi de l’activité NADPH cytochrome C réductase dans toute la masse de Nereis diversicolor exposée à une dose sublétale de deux contaminants, à savoir le cadmium et le benzo[a]pyrène, montre une réponse différentielle en fonction des polluants par comparaison aux témoins (Figure 1A). Toutefois, la comparaison des résultats a révélé une induction de cette activité enzymatique après 12, 24, 36 h en réponse au benzo[a]pyrène pour un taux d’accroissement respectivement de 2,25 fois, 1,71 fois et 2,59 fois entre les animaux traités et leurs témoins relatifs. Quant à l’effet du cadmium, on a noté une diminution de cette activité pour des taux d’inhibition respectivement de 2 fois, 1,82 fois et 1,75 fois entre les animaux traités et leurs témoins relatifs (Figure 1B). De même, un traitement par le mélange B[a]P/Cd montre une inhibition de l’activité NADPH cytochrome C réductase enregistrée aux différents temps d’exposition (Figure 1C).
Figure1
Valeurs moyennes de l’activité NADPH cytochrome C (nmol•min‑1•mg‑1 de protéines ± écart-type) chez Nereis diversicolor exposé pendant 12, 24, 36 et 48 h au B[a]P (A), au Cd (B) et au mélange Cd+B[a]P (C) à une concentration de 1 µM. Nombre de répétitions = 8 (* : différence significative p <0,05).
Mean values of NADPH cytochrome C activity (nmol•min‑1•mg‑1protein ± standard deviation) for Nereis diversicolor exposed for 12, 24, 36 and 48 h to 1 µM B[a]P (A), 1 µM Cd (B) and 1 µM mixture of Cd+B[a]P (C). Number of replicates = 8 (*: significantly different p<0.05).
A
B
C
3.2 Étude de la réponse de l’activité spécifique glutathion-S‑transférase
L’étude cinétique de l’activité GST en réponse aux différents traitements a montré des variations relativement faibles entre les polychètes contaminés et les témoins relatifs (Figure 2). L’effet du benzo[a]pyrène sur l’activité GST n’a montré de différences significatives qu’après 36 et 48 h de contamination pour des valeurs respectives de 38,1 et 38,9 nmol•min‑1•mg‑1 de protéines totales par comparaison aux témoins relatifs dont les valeurs sont respectivement 26,2 et 25,8 nmol•min‑1•mg‑1 de protéines totales. Quant à l’effet du cadmium, le suivi de l’activité GST en fonction du temps a révélé une inhibition significative de cette activité après 36 h d’exposition avec une valeur de 26,4 nmol•min‑1•mg‑1 de protéines totales contre une valeur témoin de 43,2 nmol•min‑1•mg‑1 de protéines totales. L’effet du mélange Cd/B[a]P n’a de même montré une variation significative qu’après 36 h d’exposition pour une valeur de 43,3 nmol•min‑1•mg‑1 de protéines.
Figure 2
Valeurs moyennes de l’activité GST (nmol•min‑1•mg‑1 de protéine ± écart-type) chez Nereis diversicolor exposé pendant 12, 24, 36 et 48 h au B[a]P (A), au Cd (B) et au mélange Cd+B[a]P (C) pour une concentration de 1 µM. Nombre de répétitions = 8 (* : différence significative p <0,05).
Mean values of GST activity (nmol•min‑1•mg‑1 protein ± standard deviation) for Nereis diversicolor exposed for 12, 24, 36 and 48 h to 1 µM B[a]P (A), 1 µM Cd (B) and 1 µM mixture of Cd + B[a]P (C). Number of replicates = 8 (*: Significantly different p<0.05).
A
B
C
4. Discussion
Le processus de métabolisation des xénobiotiques implique une activation des systèmes enzymatiques de la phase I (cytochrome P450, activité benzo[a]pyrène hydroxylase, (BPH), NADPH cytochrome C réductase, etc.) ainsi que les enzymes de la phase II tels que les glutathion-S-transférases GST. De ce fait, ces réponses biochimiques sont couramment utilisées comme biomarqueurs de pollution du milieu aquatique (BOURAOUI et al., 2008; LIVINGSTONE et al., 1993).
Certaines espèces de poissons, bivalves et invertébrés sont utilisées comme matériel biologique pour estimer l’effet des contaminants chimiques dans le milieu aquatique. Ainsi, notre choix s’est porté dans ce travail à l’étude in vivo de la réponse biologique en fonction du temps (12, 24, 36 et 48 h) de l’annélide polychète Nereis diversicolor exposé au benzo[a]pyrène, au cadmium et au mélange B[a]P/Cd, en utilisant comme biomarqueur l’activité enzymatique NADPH cytochrome C réductase comme enzyme de phase I et les glutathion-S-transférases comme enzymes spécifiques de la phase II de biotransformation. Le choix de ces deux paramètres biochimiques découle du fait que le système de biotransformation (phase I et phase II) chez les annélides, dont notamment les polychètes, est particulièrement performant comme système de détoxification (LEE et SINGER, 1980).
L’induction des activités des oxygénases à fonctions multiples (MFO) est couramment enregistrée en réponse à une contamination par les polluants organiques (PETERS et al., 1997). Toutefois, en absence d’activité éthoxyrésorufine-O-dééthylase (EROD) chez le polychète Nereis diversicolor (ERKUDEN et al., 2004), l’activité NADPH cytochrome C réductase constitue ainsi une enzyme clé pour l’évaluation de l’activité des oxygénases à fonction multiple (MFO). Ainsi, dans ce travail, on a noté, suite à une contamination par le benzo[a]pyrène à une dose de 1 µM, une forte induction de la NADPH cytochrome C réductase après 12, 24 et 36 h, qui peut être rapportée à l’action du complexe enzymatique lié aux activités monooxygénases de phase I de fonctionnalisation dont la fonction primaire est de catalyser le métabolisme oxydatif des xénobiotiques (LINDAMOOD, 1991).
Quant à l’effet du cadmium sur l’activité NADPH cytochrome C réductase, pour la même dose de 1 µM, l’effet inhibiteur enregistré après 12, 24 et 36 h peut être expliqué par la toxicité du cadmium. En effet, ce métal intervient par l’altération du métabolisme cellulaire tel que le transport transmembranaire, en bloquant des perméases impliquées dans les transports ioniques, particulièrement les pompes Na+/K+ ATPase, et en provoquant une modification de la perméabilité des membranes et un déséquilibre de la balance ionique dans les cellules. Ce métal peut aussi altérer les fonctions mitochondriales, la stabilité lysosomale ou la réplication de l’ADN (WAISBERG et al., 2003) comme il peut aussi bloquer le site actif des enzymes (BANNI et al., 2005; GOERING et al., 1987; VIARENGO et al., 1990,). L’effet du cadmium a été aussi rapporté dans d’autres travaux, notamment de SANDRINI et al. (2008) qui ont montré l’effet inhibiteur de ce métal sur l’activité supéroxyde dismutase SOD chez le polychète Laeonereis acuta.
L’effet du mélange benzo[a]pyrène/cadmium a montré une inhibition de l’activité NADPH cytochrome C réductase, ce qui met en cause l’effet antagoniste de ces deux polluants. Des études similaires ont montré l’inhibition de l’activité éthoxyrésorufine-O-dééthylase (EROD) chez plusieurs espèces de poissons traités par le mélange Cd/B[a]P (BENEDETTI et al., 2007; OLIVEIRA et al., 2004; SORRENTINO et al., 2005), Cet effet antagoniste, observé suite aux contaminations par le Cd et B[a]P seuls et par leur mélange, peut être expliqué par la toxicité du cadmium qui peut perturber certains mécanismes moléculaires, dont notamment le mécanisme de transcription du gène codant pour l’enzyme NADPH cytochrome C réductase. En effet, certains travaux ont rapporté la capacité du cadmium à inhiber l’expression du gène CYP1A initialement induit par le 3-méthylcholanthrène (3MC) suite à un traitement par le mélange (Cd+3MC), (RISSO-DE FAVERNEY et al., 2000). Des études in vivo ont montré aussi la potentialité du Cd à perturber l’activité de certains facteurs de transcription tels que le « Nuclear Factor I » (NFI) et le « Nuclear Factor B » (NF-KB) impliqués dans l’expression du gène CYP (BAROUKI et MOREL, 2001; WAISBERG et al., 2003).
Quant à l’étude de la réponse des glutathion-S-transférases, il est connu que cette classe d’enzymes, impliquée dans les mécanismes de biotransformation de phase II, est induite en réponse à une contamination par les hydrocarbures aromatiques polycycliques (VIERA et al., 2008). Toutefois, dans ce présent travail, l’étude cinétique de la réponse des GST paraît peu significative vis‑à‑vis d’une contamination par le B(a)P, le Cd ainsi que leur mélange, et ceci, par comparaison aux niveaux d’induction chez les témoins relatifs. En effet, les seules différences significatives entre les polychètes traités par le B[a]P et leurs témoins relatifs ont été enregistrées après 36 et 48 h d’exposition, alors que pour le Cd ainsi que le mélange (B[a]P/Cd), le seul effet significatif enregistré a été signalé après 36 h. Ces résultats confirment ceux soutenus par d’autres auteurs concernant la réponse de cette classe d’enzymes. Ainsi, plusieurs travaux ont montré des résultats non concluants concernant l’effet de certains polluants sur l’activité GST. En effet, une inhibition de cette dernière a été observée chez la moule Mytilus galloprovincialis contaminée par le B[a]P (AKCHA et al., 2000). De même, une étude menée par STEPHENSEN et al. (2000) a montré une absence de changement chez le poisson Myoxocephalus scorpius provenant de sites contaminés par rapport à leurs témoins relatifs. Des études menées aussi en terrain ont montré de même une inhibition de la réponse des glutathion-S-transférases chez des bivalves Scrobicula plana collectés dans un site contaminé par comparaison à des organismes provenant de sites de référence (ERKUDEN et al., 2004).
Dans ce présent travail, bien qu’il est admis que les doses utilisées sont fortement supérieures à celles rencontrées en terrain, ces doses sont désormais inférieures aux paramètres de toxicité DL50 du cadmium et du benzo[a]pyrène chez l’espèce N. diversicolor. Toutefois, cette étude constitue un outil pour la compréhension et l’interprétation des relations dose-réponse susceptibles d’être observées en terrain dont l’application reste fonction des interactions possibles entre les polluants, dont notamment les effets additifs, synergiques et/ou antagonistes des polluants.
5. Conclusion
Le but de cette étude prospective était de déterminer la réponse biologique du ver de mer Nereis diversicolor suite à une contamination induite au laboratoire par le cadmium et le benzo[a]pyrène. À l’instar de ces biomarqueurs, l’utilisation des systèmes enzymatiques de détoxification comme indicateurs biologiques des effets des xénobiotiques chez les organismes vivants doit être vérifiée en terrain pour mieux comprendre les interactions possibles entre polluant-polluant, d’une part, et entre polluant-organisme, d’autre part, ainsi que les facteurs abiotiques tels que la salinité, le pH, la température, la biodisponibilité et la concentration des polluants qui peuvent fortement interagir dans le milieu.
Appendices
Remerciements
Ce travail a été financé partiellement par les fonds du ministère de l’Enseignement supérieur, de la Recherche scientifique et de la Technologie, unité de recherche « Biochimie et toxicologie de l’environnement », ISA Chott-Mariem et par la coopération interuniversitaire franco-tunisienne (projet CMCU n° 04G0907).
Références bibliographiques
- AKCHA F., C. IZUEL, P. VENIER, H. BUDZINSKI, T. BURGEOT, et J.F. NARBONNE (2000). Enzymatic biomarker measurement and study of DNA adduct formation in benzo(a)pyrene contaminated mussels Mytilus galloprovincialis.Aquat Toxicol., 49, 269-287.
- AMIARD J.C., A. GEFFARD, C. AMIARD-TRIQUET et C. CROUZET (2007). Relationship between the lability of sediment-bound metals (Cd, Cu, Zn) and their bioaccumulation in benthic invertebrates. Estuar. Coast. Shelf Sci., 72, 511-521.
- BANNI M. (2004). Étude biochimique, moléculaire et toxicologique de l’effet des contaminants sur l’environnement marin : cas du littoral tunisien. Thèse de doctorat, Univ. Monastir, Tunisie,144 p.
- BANNI M., J. JEBALI, M. DAUBEZE, C. CLERANDEAU, H. GUERBEJ, J.F. NARBONNE et H. BOUSSETTA (2005). Monitoring pollution in Tunisian coasts: application of a classification scale based on biochemical markers. Biomarkers, 10, 105-116.
- BAROUKI R. et Y. MOREL (2001). Repression of cytochrome P450 1A1 gene expression by oxidative stress: mechanisms and biological implications. Biochem. Pharmacol., 61, 511‑516.
- BENEDETTI M., G. MARTUCCIO, D. FATTORINI, A. CANAPA, M. BARUCCA, M. NIGRO et F. REGOLI (2007). Oxidative and modulatory effects of trace metals on metabolism of polycyclic aromatic hydrocarbons in the Antarctic fish Trematomus bernacchii. Aquat Toxicol., 85,167-175.
- BJERREGAARD P. et M.H. DEPLEDGE (1994). Cadmium accumulation in Littorina littorea, Mytilus edulis and Carcinus maenas: the influence of salinity and calcium ion concentrations. Mar. Biol., 119, 385-395.
- BOURAOUI Z, M. BANNI, J. GHEDIRA, C. CLERANDEAU, H. GUERBEJ, J.F. NARBONNE et H. BOUSSETTA (2008). Acute effects of cadmium on liver phase I and phase II enzymes and metallothionein accumulation on sea bream Sparus aurata. Fish Physiol. Biochem., 34, 201-207.
- BRADFORD M.M. (1976). A rapid and sensitive method for the quantification of microgram of protein utilizing the principal of protein-dye binding. Anal Biochem., 72, 248‑254.
- CARPENTER D.O., K. ARCARO, D.C. SPINK (2002). Understanding the human health effects of chemical mixtures. Environ. Health Perspect., 110, 25-42.
- ERKUDEN P., B. JULIAN et S. MONTSERRAT (2004). Biomarker responses to pollution in tow invertebrate species: Scrobicularia plana and Nereis diversicolor from the Cadiz Bay (SW Spain). Mar. Environ. Res., 58,275-279.
- GOERING P.L., P. MISTRY et B.A. FOWLER (1987). Mechanisms of metal induced cell injury. Dans : Handbook of Toxicology, Haley T.J. et W.O. Berndt (Éditeurs), Hemisphere Publishing Corporation, New-York, Chap 10, pp. 384-425.
- GRAVATO, C. et M.A. SANTOS (2002). Juvenile sea bass liver P450, EROD induction and erythrocytic genotoxic responses to PAH and PAH-like compounds. Ecotox. Environ. Saf., 51, 115-127.
- GILLET P. (1993). Impact de l’implantation d’un barrage sur la dynamique des populations de Nereis diversicolor (Annelide Polychete) de l’estuaire Du Bou Regreg, Maroc. J. Rech. Océanogr., 18,15-18.
- HABIG W.H., M.J. PABST et W.B. JAKOBY (1974). Glutathione S-transferases. The first enzymatic step in mercapturic acid formation. J. Biol. Chem., 249, 7130‑7139.
- HAYES, A.W. (1982). Principles and methods of toxicology. Raven Press, New york, NY, USA, 612 p.
- KORASHY H.M. et A.O.S. EL-KADI (2004). Differential effects of mercury, lead and copper on the constitutive and inducible expression of aryl hydrocarbon receptor (AHR)-regulated genes in cultured hepatoma Hepa 1c1c7 cells. Toxicol., 201, 153-172.
- LEE B.G, S.B. GRISCOM, J.S. LEE, H.G. CHOI, C.H. KOH, S.N. LUONA et N.S. FICHER (2000). Influence of dietary uptake and reactive sulfides on metal bioavaibility from aquatic sediments. Science, 287, 282-284.
- LEE R.F. et S.C. SINGER (1980). Detoxifying enzymes system in marine polychaetes; increases in activity after exposure to aromatic hydrocarbons. Rapp., p-v. réunion, Cons. Int. Explor. Mer, 179, 29-32.
- LEMAIRE-GONY S., P. LEMAIRE et A.L. PULSFORD (1995). Effects of cadmium and benzo(a)pyrene on the immune system, gill ATPase and EROD activity of European sea bass Dicentrarchus labrax. Aquat. Toxicol., 31, 297-313.
- LEWINSKA D., J. ARKUSZ, M. STANCZYK, J. PALUS, E. DZIUBALTOWSKA et M. STEPNIK (2007). Comparison of the effects of arsenic and cadmium on benzo(a)pyrene-induced micronuclei in mouse bone-marrow. Mutat. Res., 632, 37-43.
- LIN T., N.K. MAK, M.S. YANG (2008). MAPK regulate p53-dependent cell death induced by benzo[a]pyrene: Involvement of p53 phosphorylation and acetylation. Toxicol., 247, 145-153.
- LINDAMOOD C. (1991). Xenobiotic biotransformation. Dans : Hepatotoxicology. MEEKS R.G., S.D. HARRISON et R.J. BULL (Éditeurs). C.R.C Press, 1, pp. 139-180.
- LIVINGSTONE D.R, P. LEMAIRE, A. MATTEWS, L. PETERS, D. BUCKE et W.R. AMLAP (1993). Pro-oxidant, anti-oxidant and 7-Ethoxyresorufin-O-deethylase (EROD) activity responses in liver of Dab (Limanda limanda) exposed to sediment contaminated with hydrocarbons and other chemicals. Mar. Pollut. Bull., 26, 602-606.
- METCALFE C.D. (1988). Induction of micronuclei and nuclear abnormalities in the erythrocytes of mudminnows (Umbra limi) and brown bullhead (Ictalurus nebulosus). Bull. Environ. Contam. Toxicol., 40, 489-495.
- METTAM C. (1981). Survival strategies in estuarine Nereids. Dans : Feeding and Survival Strategies of Estuarine Organisms. JONES N.V. et W.J. WOLFF (Éditeurs), Macmillan Publishing Co., New-York, USA, pp. 65-77.
- OLIVEIRA M., M.A. SANTOS et M. PACHECO (2004). Glutathione protects heavy metal-induced inhibition of hepatic microsomal ethoxyresorufin-O-deethylase activity in Dicentrarchus labrax L.Ecotoxicol. Environ. Saf., 58, 379‑385.
- PACHECO M. et M.A. SANTOS (1997). Induction of liver EROD activity and genotoxic effects by polycyclic aromatic hydrocarbons and resin acids on the juvenile eel (Anguilla anguilla). Ecotoxicol. Environ. Saf., 38, 252-259.
- PALMQVIST A., H. SELCK, L.J. RASMUSSEN et V.E. FORBES (2003). Biotransformation and genotoxicity of fluoranthene in the deposit-feeding polychaete Capitella sp. I. Environ. Toxicol. Chem., 22, 2977-2985.
- PETERS L.D, H.R. MORSE, R. WATERS et D.R. LIVINGSTONE (1997). Responses of hepatic cytochrome P4501A and formation of DNA adducts in juveniles of Turbot (Scophtalmus maximus L) exposed to water-borne benzo[a]pyrene. Aquat. Toxicol., 38, 67-82.
- RAINBOW P.S. (1997). Ecophysiology of trace metal uptake in crustaceans. Estuar. Coast. Shelf Sci., 44, 169-175.
- RISSO-DE FAVERNEY C., M. LAFAURIE, J.P. GIRARE et R. RAHMANI (2000). The nitroxide stable radical tempo prevents metal-induced inhibition of CYP1A1 expression and induction. Toxicol. Lett., 111, 219-227.
- REGOLI F., M. NIGRO, M. BENEDETTI, S. GORBI, C. PRETTI, P.G. GERVASI et D. FATTORINI (2005). Interactions between metabolism of trace metals and xenobiotics agonists of the Ah receptor in the Antarctic fish Trematomus bernacchii: environmental perspectives. Environ. Toxicol. Chem., 24, 1475-1482.
- ROAST S.D., J. WIDDOWS et M.B JONES (2001). Effects of salinity and chemical speciation on cadmium accumulation and toxicity to two mysid species. Environ. Toxicol. Chem., 20, 1078-1084.
- SANDRINI J.Z, J.V. LIMA, F. REGOLI, F. FATTORINI, A. NOTTI, L.F. MARINS et J.M. MONSERRAT (2008). Antioxidant responses in the nereidid Laeonereis acuta (Annelida, Polychaeta) after cadmium exposure. Ecotoxicol. Environ. Saf., 70, 115-120.
- SORRENTINO C., N.K. ROY, S.C. COURTENAY et I. WIRGIN (2005). Co-exposure to metals modulates CYP1A mRNA inducibility in Atlantic tomcod Microgadus tomcod from two populations. Aquat. Toxicol., 75, 238-252.
- STEPHENSEN E., J. SVAVARSSON, J. STURVE, G. ERICON, M. ADOLFSON-ERICI et L. FORLIN (2000). Biochemical indicators of pollution exposure in shorthorn sculpin (Myoxocephalus scorpius), caught in four harbours on the south-west coast of Iceland. Aquat. Toxicol., 48, 431-442.
- SUN F.H et K.X. ZHOU (2008). Oxidative stress biomarkers of the polychaete Nereis diversicolor exposed to cadmium and petroleum hydrocarbons. Ecotoxicol. Environ. Saf., 70,106-114.
- VAN DEN HURK P., M. FAISAL et M.H. ROBERTS (2000). Interactive effects of cadmium and benzo[a]pyrene on metallothionein induction in mummichog (Fundulus heteroclitus). Mar. Environ. Res., 50, 83-87.
- VERBOST P.M., J. VAN ROOIJ, G. FLIK, R.A.C. LOCK et S.E. WENDELAAR BONGA (1989). The movement of cadmium through freshwater trout branchial epithelium and its interference with calcium transport. J. Exp. Biol., 145, 185-197.
- VIARENGO A., L. CANESI, M. PERTICA, G. POLI, M.N. MOORE et M. ORUNESU (1990). Heavy metal effects on lipid peroxidation in the tissues of Mytilus galloprovincialisLam. Comp. Biochem. Physiol., 97C, 37-42.
- VIERA L.R., A. SOUSA, M.F. FRASCOA, I. LIMA, F. Morgado et L. GUILHERMINO (2008). Acute effects of Benzo[a]pyrene, anthracene and a fuel oil on biomarkers of the common goby Pomatoschistus microps (Teleostei, Gobiidae). Sci. Total Environ., 395, 87-100.
- WAISBERG M., P. JOSEPH, B. HALE et D. BAYERSMANN (2003). Molecular and cellular mechanisms of cadmium carcinogenesis. Toxicol., 192, 95-117.
List of figures
Figure1
Valeurs moyennes de l’activité NADPH cytochrome C (nmol•min‑1•mg‑1 de protéines ± écart-type) chez Nereis diversicolor exposé pendant 12, 24, 36 et 48 h au B[a]P (A), au Cd (B) et au mélange Cd+B[a]P (C) à une concentration de 1 µM. Nombre de répétitions = 8 (* : différence significative p <0,05).
Mean values of NADPH cytochrome C activity (nmol•min‑1•mg‑1protein ± standard deviation) for Nereis diversicolor exposed for 12, 24, 36 and 48 h to 1 µM B[a]P (A), 1 µM Cd (B) and 1 µM mixture of Cd+B[a]P (C). Number of replicates = 8 (*: significantly different p<0.05).
A
B
C
Figure 2
Valeurs moyennes de l’activité GST (nmol•min‑1•mg‑1 de protéine ± écart-type) chez Nereis diversicolor exposé pendant 12, 24, 36 et 48 h au B[a]P (A), au Cd (B) et au mélange Cd+B[a]P (C) pour une concentration de 1 µM. Nombre de répétitions = 8 (* : différence significative p <0,05).
Mean values of GST activity (nmol•min‑1•mg‑1 protein ± standard deviation) for Nereis diversicolor exposed for 12, 24, 36 and 48 h to 1 µM B[a]P (A), 1 µM Cd (B) and 1 µM mixture of Cd + B[a]P (C). Number of replicates = 8 (*: Significantly different p<0.05).
A
B
C