Abstracts
Résumé
Le fjord du Saguenay, reconnu pour sa faune diversifiée mais aussi pour la contamination reliée aux activités industrielles et anthropiques, a fait l’objet d’un vaste programme de suivi environnemental, entrepris par notre équipe et qui visait à répondre à la question fondamentale : L’état de santé des myes s’est-il modifié dans le fjord du Saguenay ? Dans cet article de synthèse, nous avons regroupé des résultats déjà publiés sur la condition physiologique de Mya arenaria ainsi que des résultats originaux pour extraire des tendances, de façon à répertorier les sites qui s’avèrent critiques pour le bien-être physiologique de la mye. Mya arenaria (LINNÉ, 1758) ou mye des sables, choisie comme espèce sentinelle, a été échantillonnée de 1994 à 2007, en période de maturité sexuelle, dans des sites situés à l’intérieur du fjord et à son embouchure. Les objectifs de cet article sont de comparer les résultats de différents indices de condition et de suivis hormonaux et de la gamétogenèse de chaque site et en fonction des sexes, pour identifier les sites moins favorables pour la croissance et la reproduction de la mye. Nous avons démontré que les myes de Baie‑Sainte-Catherine subissent des retards de gamétogenèse tandis que les niveaux d’hormones stéroïdiennes sont très bas à Tadoussac. Ces deux sites sont soumis à des influences portuaires et à la circulation navale. Le site de Baie‑Éternité, plus en amont, se caractérise par des influences portuaires (huiles et peintures antisalissures) et une forte contamination métallique de sources urbaines et terrigènes. Anse‑aux‑Érables est un site près des influences industrielles, tandis que Anse‑Saint‑Jean est fortement influencée par les effluents municipaux et domestiques. D’amont en aval sur la rivière Saguenay, les myes des sites Anse‑à‑la‑Croix, Anse‑aux‑Érables, Petit‑Saguenay, Anse‑à‑la‑Barque, Tadoussac et Pointe‑aux‑Alouettes ont montré une croissance moindre. Les sites de Baie‑Éternité, Anse‑aux‑Érables, Anse‑Saint‑Jean et Baie-Sainte-Catherine ont un indice de maturité sexuelle moindre qu’aux autres sites, les données regroupées démontrant que ce sont les sites les plus influencés dans le fjord du Saguenay, résultats corroborés par les résultats de phagocytose. Toutes ces données démontrent que l’état physiologique de la mye répond à différents facteurs, anthropiques, biotiques et abiotiques, et que les sources ponctuelles de contamination viennent renforcer les effets négatifs de paramètres abiotiques telles la température et les conditions trophiques.
Mots clés:
- Bivalves,
- physiologie,
- contamination,
- reproduction,
- hormones
Abstract
The Saguenay fjord has been submitted for many years to anthropogenic influences. We surveyed this ecosystem between 1994 and 2007 to assess if Mya arenaria health status was altered by the contamination present in this ecosystem. The physiological condition of clams was determined using grouped annual data from sites at the mouth and in the Saguenay fjord. The results were analyzed according to sex and sites for all the samplings done during the active gametogenesis. The aims of this paper are to compare results of condition signs, gametogenesis stages and hormonal levels between sites and according to sex, to finally identify which sites were less favorable for the growth and reproduction of clams. We have shown that clams from Baie-Sainte-Catherine had delayed gametogenesis while those from Tadoussac showed very low steroid hormonal levels. Portuary and naval circulation influences could explain these particular results that also correspond to those from phagocytosis. Upstream in Baie‑Éternité, portuary influences (oils, anti-fouling paints) and metallic inputs from urban and terrigenous sources were reported. In Anse-aux-Érables, metallic contamination comes from industrial sources, while Anse-Saint‑Jean is influenced by sewage discharges from domestic and urban origin. From upstream to downstream, clams from Anse‑à‑la‑Croix, Anse‑aux‑Érables, Petit‑Saguenay, Anse‑à‑la‑Barque, Tadoussac and Pointe‑aux‑Alouettes showed decreased growth. Baie‑Éternité, Anse‑aux‑Érables, Anse‑Saint‑Jean and Baie-Sainte-Catherine sites, with their lower sexual maturity index and decreased phagocytosis, were shown to be the more influenced by contamination. All these data show that physiological condition of Mya arenaria reflects the combined effects of abiotic factors such as contamination, trophic conditions and site characteristics.
Key Words:
- Bivalves,
- physiology,
- contamination,
- reproduction,
- hormones
Article body
1. Introduction
La mye commune ou mye des sables (Mya arenaria L.) est présente sur la côte atlantique de l’Amérique du Nord, de la Caroline du Nord jusqu’à l’Arctique et dans le Pacifique sur la côte ouest américaine jusqu’en Alaska, son aire de distribution s’étendant jusqu’au sud et au centre de l’Europe et sur les côtes chinoises. Quoiqu’on la retrouve surtout dans les habitats vaseux de la zone intertidale, elle vit aussi dans les eaux subtidales et dans une variété de types de sédiments. Elle est euryhaline et tolère des salinités de 4 pour 1 000 et plus. Les deux sexes sont distincts chez l’espèce qui fraye en juin autant en Nouvelle-Écosse que dans le fjord du Saguenay (DFO‑MPO, 1996; GAUTHIER-CLERC et al., 2002). La longueur minimale pour l’atteinte de la maturité sexuelle a été estimée à 2,5 cm (VAN DER VEER et al., 2006). Elle fait partie de la communauté boréo-atlantique à Macoma balthica, celle-ci étant aussi appelée la telline de la Baltique (DESROSIERS et BRÊTHES, 1984). À titre de bivalve ubiquiste et sédentaire, Mya arenaria fut choisie comme une espèce sentinelle dans le Saguenay et l’estuaire du Saint-Laurent dans le but d’estimer les effets de l’exposition chronique à la contamination diffuse de ce système (BLAISE et al., 2002; GAUTHIER-CLERC et al., 2002). Les bivalves intrasédimentaires telles les myes (Mya arenaria) sont à la fois exposés à des régimes diurnes d’exposition à l’air et aux marées. Les apports trophiques sont variables grâce aux courants et à la présence de lagunes tidales. La mye se retrouve donc dans un habitat très variable défini par la grande variabilité des caractéristiques sédimentaires à petite et moyenne échelles spatiales (MAYRAND et al., 1995). De plus, une sensibilité différentielle aux toxiques selon le genre (mâle ou femelle) a été démontrée chez plusieurs bivalves dont Mya arenaria (FROUIN et al., 2006), Crassostrea virginica (WINTERMYER et COOPER, 2007) et Mercenaria mercenaria (MCCLELLAN-GREEN et al., 2007). Des évidences de dysfonctionnement physiologique et de la reproduction ont été démontrées à maintes reprises dans le fjord du Saguenay chez Mya arenaria (GAGNÉ et al., 2006, 2008; GAUTHIER-CLERC et al., 2002; PELLERIN al., 2003). Des résultats similaires et plus que significatifs ont été répertoriés chez d’autres bivalves et invertébrés présents dans d’autres écosystèmes (PELLERIN et AMIARD, 2008). Ces effets ont été reliés, tout au moins en partie, aux butylétains retrouvés dans la colonne d’eau (VIGLINO et PELLETIER, 2006) et dans les sédiments (GAGNÉ et al., 2006, 2008; GAGNÉ et al., 2008b). Les butylétains recensés sont à des niveaux (VIGLINO et PELLETIER, 2006) susceptibles de causer des effets toxiques chroniques sur la reproduction de plusieurs organismes et d’affaiblir leurs systèmes immunitaires. Le fjord du Saguenay renferme également, dans la matrice sédimentaire depuis les années 1950, des concentrations significatives de métaux (GAGNÉ et al., 2006, 2008) et d’hydrocarbures aromatiques polycycliques (HAP) (LUN et al., 1998; PELLETIER et al., 2009). Ces derniers y mentionnent que le niveau de contamination par les hydrocarbures est relativement peu élevé par rapport à d’autres sites et aux décennies passées. Les HAP retrouvés dans les myes et autres invertébrés sont légers (deux à trois cycles) et proviennent en bonne partie des hydrocarbures pétroliers déversés par les usagers du fjord (navigation et transport) et les effluents municipaux (lessivage des rues et stationnements). Toutefois, des données récentes provenant d’études en laboratoire démontrent que, même à concentrations faibles et comparables à celles retrouvées en milieu naturel, les HAP ont un potentiel de perturbateurs endocriniens (FROUIN et al., 2007). Outre les effets chroniques répertoriés chez la mye, sa contamination (GAGNÉ et al., 2006, 2008) peut être à risque pour le réseau trophique car elle constitue une proie facile pour le polychète Nereis virens et la plie rouge (VAILLANCOURT et al.,1985). En effet, plusieurs études ponctuelles sur une échelle de une à deux années ont été réalisées dans le fjord et elles démontrent que les contaminants en présence peuvent être la cause de la génotoxicité identifiée dans les extraits de tissus de myes (GAGNÉ et al., 2006; WHITE et al., 1997). Même s’il n’est pas clairement démontré que cette génotoxicité soit due aux HAP, elle est suffisante pour causer des dysfonctionnements chez les poissons se nourrissant de ces invertébrés (WHITE et al., 1998).
Le fjord du Saguenay présente donc une situation complexe et l’évaluation de la condition physiologique de bivalves en situations de stress et d’exposition à la contamination chronique nécessite l’utilisation de plusieurs mesures complémentaires (GAGNÉ et al., 2008b; PELLERIN et al., 2004; FROUIN et al., 2007). Chacune des années de cette surveillance environnementale nous a permis d’estimer la condition physiologique de la mye ainsi que de détecter de multiples effets négatifs sur la capacité immunitaire, la gamétogenèse et les niveaux hormonaux. Dans cette étude, nous avons regroupé les valeurs interannuelles de plusieurs indices de condition. Des indices de condition basés sur : 1) la masse de chair, 2) la longueur de la coquille, 3) la masse de la gonade, 4) la masse de l’hépatopancréas, 5) l’accroissement en chair par année et 6) un indice de maturité sexuelle. L’éventail des paramètres mesurés et présentés dans cet article permettra d’estimer la variabilité physiologique de Mya arenaria grâce à un suivi interannuel à long terme des indices de condition, de la phagocytose, de la gamétogenèse et des teneurs en stéroïdes sexuels. Les données ont été analysées pour en extraire les tendances selon les sexes et les sites.
1.1 Échantillonnages
Les échantillonnages ont été réalisés dans le fjord du Saguenay (Figure 1) en période de vive eau à chaque année entre 1994 et 2007 et généralement en juin, en période de reproduction de Mya arenaria. Les sites ont été choisis en fonction de leurs conditions trophiques (intérieur du fjord et embouchure) et en relation avec les sources éventuelles de contamination.
Figure 1
Situation des sites d’échantillonnages entre 1994 et 2007.
Sampling sites between 1994 and 2007.
1.2 Détermination des facteurs de condition
Plusieurs indices de condition ont été mesurés pour établir de façon précise la condition physiologique de Mya arenaria selon les sites échantillonnés et le niveau d’impact estimé :
Un indice de condition (IC) basé sur la masse de chair humide :
Un indice de condition basé sur la longueur de la coquille (ICL) (ERNST et al., 1991) :
Un indice gonado-somatique (GRANT et TYLER, 1983) qui rend compte de l’initiation de la gamétogenèse par l’augmentation du rapport de la masse de la gonade sur la masse totale de chair :
Un indice hépato-somatique (CARTIER et al., 2004) qui indique les variations de la masse de l’hépatopancréas en fonction des activités de détoxication et/ou de déplétion des réserves énergétiques :
Un indice de maturité sexuelle (Siah et al., 2003) :
où les facteurs de maturité sont : 1 = stade indifférencié; 2 = stade de développement; 3 = stade mûr; 4 = stade de ponte et 5 = stade passé.
1.3 Détermination des stades de gamétogenèse par histologie
Les stades de maturation sexuelle ont été déterminés sur chacun des individus ayant servi ultérieurement à des analyses biochimiques, telles les hormones stéroïdiennes, et pour l’évaluation de la condition physiologique par les indices de condition. En 1996 et 1997, les gonades ont été préparées pour leur examen sur des coupes enrobées de résine de méthacrylate (GAUTHIER-CLERC et al., 2002). Au cours des années subséquentes, l’examen se faisait directement par l’observation au microscope photonique d’émulsions de gonades dans du sérum physiologique (NaCl 0,15M). Les stades de développement de la gonade ont été classés sous cinq catégories ou stades (indifférencié, développement, mûr, ponte, passé) selon COE et TURNER (1938).
1.4 Mesure des teneurs en hormones stéroïdiennes
Les hormones stéroïdiennes (17ß-oestradiol, progestérone et testostérone) ont été mesurées dans les gonades grâce aux trousses ELISA commerciales de Cayman Chemical. Les procédures de préparation des aliquotes ont été réalisées selon les protocoles mis au point par SIAH et al. (2003) et GAUTHIER-CLERC et al. (2006a).
1.5 Phagocytose
La phagocytose a été estimée par cytométrie en flux selon la méthode décrite par BROUSSEAU et al. (1998). Les hémocytes ont été utilisés grâce à une ponction dans le muscle adducteur postérieur. Les résultats sont exprimés en pourcentage de phagocytes qui ont phagocyté une bille ou plus.
1.6 Analyse des métaux
Après digestion acide, les métaux ont été mesurés par spectrophotométrie d’absorption atomique selon les méthodes décrites dans AMIARD et al. (1987) et validées par des contrôles internes de qualité (matériel de référence standard de tissus d’huîtres et de moules BCR/278R‑N° 188) et des contrôles externes de qualité selon CAMPBELL et al. (2000)). Les concentrations métalliques ont été mesurées dans les branchies et la glande digestive des myes de Baie‑Éternité, de Anse‑Saint‑Étienne et de Moulin‑à‑Baude.
1.7 Analyses statistiques
Les analyses statistiques ont été réalisées grâce aux logiciels SPSS version 11 et Sigma Stat 3.5 (SPSS). La normalité de la distribution des données a été vérifiée par un test de Levene. Les différences entre groupes ont été vérifiées par une ANOVA à un facteur, lorsque la distribution des données était normale, ou par une ANOVA de type Kruskall-Wallis, en cas d’une distribution non paramétrique. Les différences spécifiques entre groupes ont été testées par le test de Dunn’s pour les données nonparamétriques, ce qui est recommandé pour les groupes ne possédant pas le même nombre de valeurs. Pour discriminer l’effet sites par rapport aux années ou au sexe, une ANOVA à deux facteurs a été effectuée lorsque nécessaire. Le niveau de significativité a été établi à P < 0,05.
2. Résultats et discussion
2.1 Condition physiologique
2.1.1 Indice de condition basé sur la masse de chair
Les indices de condition ((masse de chair / masse de chair totale) * 100) représentent la qualité de la chair et la condition physiologique des bivalves (CARTIER et al., 2004; GAGNÉ et al., 2007; LEMAIRE et al., 2006; ORBAN et al., 2002). Chez Mya arenaria, l’indice de condition augmente en période de croissance somatique et lors de l’initiation de la période de gamétogenèse car la gonade en phase active représente 10‑12 % de la masse de chair humide. Aux sites Anse-aux-Érables, Anse‑Saint‑Jean, Baie‑Éternité et Baie‑Sainte‑Catherine, GAGNÉ et al. (2007) avaient rapporté des indices de condition inférieurs par rapport aux sites Anse‑Saint‑Étienne et Moulin‑à‑Baude, lesquels constituent les sites de référence, l’un pour le Saguenay, l’autre pour l’estuaire du Saint‑Laurent. Pour toutes années regroupées (1994‑2007), des différences significatives entre les indices de condition (Figure 2) ont été trouvées entre les sites (H = 209, 184; dl = 12; P < 0,001). Les myes femelles (Figure 2A) ont un indice de condition plus élevé (P < 0,05) à Anse‑Saint‑Jean que les myes de Pointe‑aux‑Alouettes (près de Baie‑Sainte‑Catherine) à l’embouchure du Saguenay et de Anse‑à‑la‑Barque. Les indices de condition des myes femelles de Pointe‑aux‑Alouettes, avec un indice de condition faible de 0,285 ± 0,0287, sont inférieurs (P < 0,05) aux indices des myes des sites de Anse‑aux‑Érables, Baie‑Éternité, Anse‑au‑Cheval, Anse‑Saint‑Étienne, Moulin‑à‑Baude et Tadoussac. Les myes mâles (Figure 2B) de Anse‑Saint‑Jean ont un indice de condition élevé et significativement différent (P < 0,05) des indices des myes de Baie‑Sainte‑Catherine, de Anse‑à‑l’Île‑Coquart et de Pointe‑aux‑Alouettes. Contrairement aux résultats de GAGNÉ et al. (2002, 2007), qui avaient observé une condition inférieure des myes de Anse‑Saint‑Jean, les résultats présentés ici montrent globalement un meilleur indice de condition à Anse-Saint‑Jean ((masse de chair humide / masse totale) * 100). GAGNÉ et al. (2002) mentionnaient une perte de condition physiologique lorsqu’il y a exposition à des effluents municipaux riches en composés de matière organique, résidus pharmaceutiques et autres substances. Par contre, une resuspension de particules riches en matière organique dans une baie sableuse, situation retrouvée ici à Anse‑Saint‑Jean, peut être bénéfique aux mollusques bivalves, tel qu’il est mentionné par GRANT et al. (1990) chez l’huître Ostrea edulis. On doit noter que les myes de Pointe‑aux‑Alouettes, par leur exposition au trafic maritime lourd qui emprunte le chenal laurentien, sont soumises à la contamination ponctuelle par les butylétains (GAGNÉ et al., 2006; PELLERIN et AMIARD, 2008).
Figure 2
Indices de condition des myes femelles (A) et mâles (B) basés sur le rapport masse de chair humide / masse totale de la mye. Les trois premiers sites (Baie-Sainte-Catherine, Moulin-à-Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les lettres minuscules indiquent les différences significatives par rapport au site Anse‑Saint‑Jean. Les lettres majuscules indiquent les différences significatives par rapport au site Pointe‑aux‑Alouettes. Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet flesh weight and total wet weight of the clams. The first three sites (Baie-Sainte-Catherine, Moulin‑à‑Baude, Tadoussac) are located at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0,05). Letters in lowercase represent significant differences according to values from Anse‑Saint‑Jean. Capital letters represent significant differences according to values from Pointe‑aux‑Alouettes. Error bars represent the standard deviation.
A
B
2.1.2 Indice de condition basé sur la longueur
En conformité avec les résultats de GAGNÉ et al. (2007), nos résultats démontrent également que Anse-Saint‑Jean est un site influencé par les effluents municipaux. L’indice de condition basé sur la longueur de la coquille (ICL = masse de chair humide / longueur3) est plus élevé (P < 0,05) dans ce site. Cet indice (Figure 3) s’interprète comme étant en relation inverse avec l’indice de croissance basé sur l’âge (Figure 4). Un ICL élevé se retrouve pour des longueurs inférieures de la coquille et un ICR basé sur l’âge (ICR = Masse de chair humide / âge) comme étant un indice d’accroissement de la masse de chair plus important par année. Les résultats de GAGNÉ et al. (2007) se vérifient ici pour l’ensemble des données de l’ICL avec des valeurs plus fortes à Anse‑Saint‑Jean et Baie‑Éternité (0,0563 ± 0,0391 et 0,054 ± 0,0281) respectivement pour les femelles (Figure 3A), et pour les mâles (Figure 3B) (0,0503 ± 0,0249; 0,0501 ± 0,0213). Les myes mâles du site Pointe-aux-Alouettes ont, avec les myes de Anse-au‑Cheval l’indice de condition basé sur la longueur de coquille le plus faible (0,036 ± 0,00394) (Figure 3B). Ces résultats renforcent nos hypothèses de l’effet du trafic maritime et côtier sur la condition des myes basés sur le calcul de l’indice de condition (Figure 2) et celui basé sur la longueur de la coquille (Figure 3), d’autant plus que l’ICL des femelles à Pointe‑aux‑Alouettes est également inférieur à plusieurs sites. Des différences significatives ressortent entre Pointe‑aux-Alouettes (0,0359 ± 0,00543; P < 0,05) et les sites de Baie‑Éternité, Anse‑Saint‑Jean, Anse‑Saint‑Étienne, Anse‑aux‑Érables, Moulin‑à‑Baude et Tadoussac. Les valeurs de l’ICL des myes situées le long de la côte et près de l’embouchure rendent moins compte des effets physiologiques de la pollution diffuse qui y est retrouvée car basées sur la croissance de la coquille. Comme nous l’avons souligné précédemment, la croissance en chair varie grandement à cause de la production des gonades. De plus, tout stress subi par le bivalve entraînera une utilisation des réserves énergétiques. En période de jeûne, des pertes de biomasse de 78 % ont été rapportées chez M. edulis (KAUTSKY, 1982). Cette tolérance apparente à la perte de poids de bivalves en situation de stress nous montre bien leur plasticité phénotypique et leur adaptation aux conditions trophiques variables du système Saguenay‑Saint‑Laurent (GAUTHIER-CLERC et al., 2002).
Figure 3
Indices de condition des myes femelles (A) et mâles (B) basés sur le rapport masse de chair humide / longueur totale3 de la mye. Les trois premiers sites (Baie‑Sainte-Catherine, Moulin-à-Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet flesh weight and total lenght3 of the clams. The first three sites (Baie‑Sainte-Catherine, Moulin‑à‑Baude, Tadoussac) are situated at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0.05). Error bars represent the standard deviation.
A
B
Figure 4
Indices de condition des myes femelles (A) et mâles (B) basés sur le rapport masse de chair humide / âge de la mye. Les trois premiers sites (Baie‑Sainte-Catherine, Moulin-à-Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet flesh weight and age of the clams. The first three sites (Baie Sainte-Catherine, Moulin-à-Baude, Tadoussac) are situated at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0.05). Error bars represent the standard deviation.
A
B
2.1.3 Indice de condition basé sur l’accroissement annuel de la masse de chair
L’indice de croissance basé sur l’âge (ICR = masse de chair humide / âge) indique l’accroissement annuel de la masse en chair. Les valeurs les plus élevées chez les femelles (Figure 4A) et les mâles (Figure 4B) se retrouvent à Moulin‑à‑Baude et Anse‑Saint-Étienne, ces deux sites ayant servi de sites de références lors de nos études antérieures. Les myes de Moulin‑à‑Baude, à l’embouchure du Saguenay, profitent des conditions trophiques favorables de l’estuaire du Saint‑Laurent (GAUTHIER-CLERC et al., 2002) tandis que les myes de Anse‑Saint‑Étienne profitent d’un site où les conditions hydrodynamiques et de température sont favorables à la croissance. L’indice de croissance des myes femelles dans ces deux sites est significativement supérieur (P < 0,05) à celui des sites Anse‑aux‑Érables, Petit‑Saguenay, Anse‑au‑Cheval, Anse‑à‑la‑Barque, Pointe‑aux‑Alouettes et Tadoussac. Les condi-tions et effets reliés au trafic maritime se remarquent bien pour ces quatre derniers sites, de même que les possibles influences industrielles provenant de l’amont pour Anse‑aux‑Érables. Ces résultats se recoupent bien avec ceux de l’indice de condition présenté précédemment. Les ICR des myes mâles (Figure 4B) de l’Anse‑Saint‑Étienne et de Moulin‑à‑Baude, sont pour leur part, significativement plus élevés que les indices des myes de Anse‑à‑la‑Barque et de Pointe‑aux‑Alouettes. Ces résultats concordent bien avec les résultats présentés ci-haut chez les femelles et s’arriment parfaitement avec l’identification que nous avions faite de deux sites de référence, l’un dans le fjord du Saguenay (Anse‑Saint‑Étienne) et l’autre à l’embouchure (Moulin‑à‑Baude) (PELLERIN et al., 2004; PELLERIN et AMIARD, 2008) et reflètent des conditions plus favorables dans ces deux sites que ceux de Anse‑à‑la‑Barque et de Pointe‑aux‑Alouettes.
2.1.4 Indice hépatosomatique
Les données regroupées indiquent, pour l’indice hépato-somatique (masse de la glande digestive / masse totale de chair humide), des valeurs élevées à Anse-Saint-Jean, Baie‑Éternité, Anse-à-la-Barque et Tadoussac (Figure 5). Les myes femelles (Figure 5A) à Anse-Saint-Jean, Baie‑Éternité et Anse‑à‑la‑Barque ont des IHS significativement plus élevés qu’aux sites Petit‑Saguenay, Baie‑Sainte-Catherine et Moulin-à-Baude. Le site de Tadoussac présente des valeurs significativement plus élevées que les myes à Petit‑Saguenay (P < 0,05). Chez les mâles de Baie‑Éternité, Anse‑à‑la‑Barque et Tadoussac (Figure 5B), les IHS sont plus élevés et les valeurs de Tadoussac et Anse-à-la-Barque sont significativement plus grandes qu’aux sites Petit-Saguenay, Baie‑Sainte‑Catherine, Anse-Saint‑Étienne et Moulin-à‑Baude. L’IHS de Anse‑aux‑Érables est significative-ment inférieur aux valeurs du groupe de Tadoussac. En regroupant les sites des zones du fjord et de son embouchure, aucune relation ne peut être faite entre des sources de contamination et l’IHS. Il a été démontré antérieurement que la partie amont du fjord était une source majeure de métaux (Hg, Pb, Zn, Cu) (BARBEAU et al., 1981) et que les HAP se retrouvaient selon un gradient de contamination de l’amont vers l’aval, ou tout au moins, qu’ils étaient distribués linéairement le long du fjord (BROCHU et al., 1995; WHITE et al., 1997). Les données récentes de VIGLINO et PELLETIER (2007) démontrent l’omniprésence des organoétains autant dans les sédiments que dans la colonne d’eau et les organismes. La présence, même en concentrations faibles, de ces contaminants et/ou de rejets spécifiques dans les effluents domestiques et municipaux, constitue une pollution diffuse qui peut expliquer les variations des différents indices étudiés. Sur la base de la contamination en métaux, où les sites de Baie‑Sainte-Catherine, Anse-Saint-Jean, Baie‑Éternité, Anse-aux-Érables (GAGNÉ et al., 2007) ainsi que Moulin‑à‑Baude et Anse‑Saint-Étienne (Figure 6) sont les sites les plus contaminés en métaux; les résultats des indices précédents s’interprètent donc en fonction d’une contamination mixte et omniprésente. Même à Moulin‑à‑Baude, les métaux y sont présents et bioaccumulés dans les branchies, indiquant une source de métaux présente dans la colonne d’eau du Saint‑Laurent (GOBEIL et al., 1987).
Figure 5
Indices de condition des myes femelles (A) et mâles (B) basés sur le rapport de la masse de glande digestive humide / masse totale de chair de la mye. Les trois premiers sites (Baie‑Sainte‑Catherine, Moulin-à-Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet digestive gland weight and total flesh weight of the clams. The first three sites (Baie-Sainte‑Catherine, Moulin-à-Baude, Tadoussac) are situated at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0.05). Error bars represent the standard deviation.
A
B
Figure 6
Répartition spatiale des concentrations en Cd (graphique du haut), Cu (graphique du milieu) et Zn (graphique du bas) en µg•kg‑1 p.h. de branchies (cercles pleins) et de glande digestive (cercles vides).
Spatial metal concentrations of Cd (upper garph), Cu (middle graph) and Zn (bottom graph) in µg•kg‑1 w.w. in gills (filled circles) and digestive gland (open circles).
Comme nous l’avions démontré dans CARTIER et al.(2004), l’IHS est sensible aux variations de température, à la présence de contaminants (synthèse d’enzymes reliés aux voies de détoxication) (PEREIRA et al., 1993), au cycle reproducteur (LEMAIRE et al., 2006) et à la concentration de phytoplancton dans la colonne d’eau. Sensible à tous ces facteurs, l’IHS ne peut être considéré comme un indicateur de la qualité nutritionnelle du milieu, ni du potentiel de croissance des bivalves (LEMAIRE et al., 2006). Cependant, les mécanismes de détoxication peuvent induire des synthèses enzymatiques et de protéines, telle la métallothionéine, pouvant venir augmenter la valeur de l’indice hépato-somatique aux sites les plus contaminés en métaux (Anse-Saint‑Jean, Baie‑Éternité, Anse-aux-Érables, Moulin-à-Baude et Anse-Saint‑Étienne, à l’exception de Baie‑Sainte‑Catherine où l’IHS est plus bas). Les facteurs trophiques ne semblent pas être uniquement la cause des variations des IHS car tel qu’il est démontré par CÔTÉ et LACROIX (1979), GAUTHIER-CLERC et al. (2002)et THERRIAULT et al. (1990), le fjord du Saguenay a une productivité moindre que celle du Saint-Laurent, les IHS des myes présentes à l’intérieur du fjord devraient donc être inférieurs. Comme ces myes ont été échantillonnées dans des sites où les zones intertidales sont à bathymétrie variable et avec des courantologies différentes, il est probable qu’il y ait aussi une variabilité de l’apport en contaminants venant de l’amont du Saguenay et des municipalités limitrophes.
2.1.5 Concentrations en métaux
La figure 6 illustre les différences de concentrations en métaux (Cd, Cu et Zn) entre les sites Baie‑Éternité, Anse‑Saint‑Étienne et Moulin-à-Baude. Les sites de Baie‑Éternité et Anse‑Saint‑Étienne ont des concentrations similaires en Cd et en Cu autant dans la glande digestive que dans les branchies. Ces concentrations sont le double de celles mesurées au site Moulin‑à‑Baude et ces métaux proviennent probablement du bouclier canadien. Les concentrations beaucoup plus importantes en Cd et en Cu dans la glande digestive indiquent qu’il y a probablement un apport trophique en métaux chez la mye dans ces sites. Des répartitions différentes en métaux selon les organes ont été rapportées par plusieurs auteurs (CHOI et al., 2007 et références citées dans cet article). De fortes teneurs en Cd sont souvent retrouvées chez les bivalves et ceux-ci ont développé plusieurs stratégies pour contrer la toxicité qui y est associée. Une des stratégies est la liaison du Cd par la métallothionéine qui rendra le métal moins toxique pour l’animal (AMIARD et al., 2006).
2.1.6 L’indice gonadosomatique
Une variabilité intersites est observée également pour les indices gonadosomatiques (masse de la gonade / masse totale de chair humide x 100) des myes femelles (Figure 7A) et des myes mâles (Figure 7B). Aucune relation positive ou négative n’a pu être établie entre les indices gonado-somatiques et les sites présentant les fortes concentrations en métaux (Anse‑aux‑Érables, Baie‑Éternité, Anse‑Saint‑Jean, Anse‑Saint‑Étienne, Baie‑Sainte‑Catherine et Moulin‑à‑Baude) et les teneurs en métaux. Les valeurs les plus hautes de l’IGS ont été observées à Petit‑Saguenay (0,215 ± 0,0398 chez les mâles et 0,214 ± 0,0458 chez les femelles). Ce résultat corrobore les travaux de GAUTHIER-CLERC et al. (2002), où l’on retrouvait des valeurs plus élevées d’IGS et de plus grandes teneurs en réserves énergétiques lorsqu’il y avait retard dans la gamétogenèse. Au tableau 1, on retrouve effectivement des indices de maturité sexuelle moindres chez les myes femelles au site Petit-Saguenay. Ce retard pourrait être dû aux conditions environnementales moins favorables à Petit‑Saguenay. Ce site est situé en bordure du Saguenay, peu enclavé et soumis à des températures plus basses grâce à la présence des eaux froides du fjord. Les IGS des myes femelles aux sites Anse-à‑la‑Barque et Anse‑Saint‑Jean sont significativement inférieurs aux IGS des myes de Petit‑Saguenay (P < 0,05). Bien enclavées, ces deux baies ont une grande période d’exondation à marée basse, ce qui engendre des températures plus élevées et des conditions trophiques favorables à une gamétogenèse précoce, permettant ainsi la libération des gamètes. On pourrait également ajouter que les influences anthropiques (circulation maritime, effluents municipaux et contamination diffuse venant de l’amont du fjord) semblent moins influencer la reproduction dans ces sites, contrairement à ce qui a été observé dans d’autres sites comme Baie‑Sainte‑Catherine chez les myes mâles. Les valeurs faibles des IGS à Baie‑Sainte‑Catherine ainsi que les délais de maturité sexuelle (Tableaux 1 et 2) s’expliquent par la présence de contaminants provenant de la circulation maritime et des activités portuaires environnantes, telles que rapportées par GAGNÉ et al. (2006), PELLERIN et al. (2003, 2004) et PELLETIER et al. (2009). À Tadoussac, la situation est un peu différente des myes de Petit-Saguenay; l’IGS est élevé, l’indice de maturité sexuelle est moyen et les taux d’hormones stéroïdiennes sont très bas (Figure 8). La reproduction semble donc affectée ou bloquée à Tadoussac, lieu soumis aux influences de la circulation maritime et des rejets municipaux.
Figure 7
Indices gonadosomatiques des myes femelles (A) et mâles (B) basés sur le rapport de la masse de gonade humide / masse totale de chair de la mye. Les trois premiers sites (Baie‑Sainte‑Catherine, Moulin‑à‑Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet gonad weight and total flesh weight of the clams. The first three sites (Baie‑Sainte‑Catherine, Moulin‑à‑Baude, Tadoussac) are situated at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0.05). Error bars represent the standard deviation.
A
B
Tableau 1
Indices de maturité des myes femelles dans les sites à l’embouchure et dans le fjord du Saguenay (n = 30)
Maturity indices of female Mya arenaria in the Saguenay fjord (n = 30).
Sites |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Baie-Sainte-Catherine |
|
|
|
|
|
3,60 |
4,06 |
3,19 |
3,17 |
3,77 |
2,71 |
2,73 |
Baie-Sainte-Catherine (Pointe‑aux‑Alouettes) |
|
|
|
|
|
|
|
|
|
3,48 |
|
|
Baie-Sainte-Catherine (Quai) |
|
|
|
|
|
|
|
2,42 |
|
|
|
|
Moulin-À-Baude |
3,40 |
3,50 |
|
|
|
3,62 |
3,92 |
4,50 |
3,11 |
3,00 |
2,77 |
2,46 |
Tadoussac |
|
|
|
|
|
|
|
3,17 |
|
|
|
|
Anse-à-la-Barque |
|
|
|
|
|
|
|
3,43 |
|
3,19 |
3,68 |
2,27 |
Anse-Saint-Étienne |
3,00 |
3,00 |
|
|
|
|
|
|
3,54 |
3,05 |
3,76 |
2,96 |
Anse-à l’Île Coquart |
|
|
|
|
|
|
|
|
|
|
|
3,04 |
Anse-Saint-Jean |
|
|
|
|
|
2,71 |
|
|
3,23 |
2,48 |
2,84 |
2,00 |
Baie-Éternité |
2,43 |
2,67 |
|
|
|
3,25 |
|
|
|
4,31 |
2,03 |
2,15 |
Petit-Saguenay |
|
|
|
|
|
|
|
|
|
2,21 |
|
2,39 |
Anse-au-Cheval |
|
|
|
|
|
|
|
|
|
|
|
2,75 |
Anse-aux-Érables |
|
|
|
|
|
|
|
|
3,08 |
2,38 |
2,76 |
2,42 |
Baie-Sainte-Marguerite |
|
|
|
|
|
|
|
|
|
|
|
3,44 |
Tableau 2
Indices de maturité des myes mâles au Saguenay (n=30)
Maturity indices of male Mya arenaria in the Saguenay fjord (n=30)
Sites |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
|---|---|---|---|---|---|---|---|
Baie-Sainte-Catherine |
2,69 |
3,50 |
2,33 |
3,30 |
2,14 |
2,20 |
3,40 |
Baie-Sainte-Catherine (Pointe‑aux‑Alouettes) |
|
|
|
|
2,79 |
|
|
Baie-Sainte-Catherine (quai) |
|
|
2,39 |
|
|
|
|
Moulin-à-Baude |
3,35 |
3,29 |
4,13 |
3,32 |
3,03 |
2,40 |
2,28 |
Tadoussac |
|
|
2,97 |
|
|
|
|
Anse-à-la-Barque |
|
|
3,14 |
|
3,08 |
2,73 |
3,63 |
Anse-Saint-Étienne |
|
|
|
2,00 |
2,79 |
2,37 |
3,18 |
Anse à l’Ile Coquart |
|
|
|
|
|
|
3,94 |
Anse-Saint-Jean |
2,00 |
|
|
2,12 |
2,74 |
2,00 |
2,48 |
Baie-Éternité |
2,16 |
|
|
|
2,00 |
2,00 |
2,70 |
Petit-Saguenay |
|
|
|
|
2,77 |
|
3,33 |
Anse-au-Cheval |
|
|
|
|
|
|
2,73 |
Anse-aux-Érables |
|
|
|
2,00 |
2,58 |
2,00 |
2,29 |
Baie-Sainte-Marguerite |
|
|
|
|
|
|
2,00 |
Figure 8
Valeurs des stéroïdes sexuels tous sexes et toutes années confondus en fonction des sites : progestérone dans le graphique du haut et les valeurs de testostérone et d’oestradiol dans le graphique du bas. Les données de 2002, 2003 et 2006 ont été groupées ainsi que les valeurs obtenues par sexe, de façon à extraire les tendances à long terme de la stéroidogenèse chez la mye. Les données sont exprimées en ng•g‑1 de poids frais de gonade. Les lettres similaires indiquent qu’il n’y a pas de différence significative entre les sites (P > 0,05). Les barres d’erreur représentent les écarts-types et le seuil statistique a été placé à P < 0,05.
Sexual steroid levels in different sites including 2002, 2003 and 2006 values, as well as data from both sexes. Progesterone values are illustrated in the upper panel and testosterone and estradiol values in the bottom panel. Data are expressed ng•g‑1 wet gonad weight. Similar letters indicate that there are no significant differences between sites (P > 0.05). Error bars represent the standard deviation and statistical significance put at P < 0.05.
Quel que soit le sexe chez Mya arenaria (van der VEER et al., 2006), les variations saisonnières ne sont pas très contrastées comme il est précédemment décrit par GAUTHIER‑CLERC (2002) et comme l’ont démontré nos résultats dans cet article. Les valeurs de IGS rapportées dans cette étude à la veille de la ponte (~0,20) sont similaires à celles rapportées par van der VEER et al. (2006). Pour des gonades en phase de gamétogénèse active, discriminer les myes en fonction de leur stade de développement avec l’IGS est particulièrement difficile car la gonade de la mye se remplit en premier lieu de réserves (glycogène, lipides, vitellogénine) pendant sa phase de gamétogenèse précoce (GAUTHIER‑CLERC et al., 2002). Autant pour l’IGS que pour l’IHS, les variations ne peuvent être totalement expliquées par la situation des sites dans le fjord. En fait, le fjord se caractérise par des conditions trophiques inférieures au Saint-Laurent avec des eaux bien stratifiées et une productivité primaire faible (165 mg C m-2•jour‑1 (CÔTÉ et LACROIX, 1979). Les sites Moulin-à-Baude, Tadoussac, Baie‑Sainte-Catherine et Anse‑à‑la‑Barque étant sous influence des conditions de l’estuaire, on aurait pu s’attendre à des indices de condition plus favorables et un bien-être physiologique plus évident dans ces sites. Par contre, les influences portuaires (Tadoussac, Baie‑Sainte‑Catherine et Anse‑à‑la‑Barque) et le Cd terrigène (GOBEIL et al., 1987) présent spécialement à Moulin‑à‑Baude, viennent contrecarrer les effets bénéfiques de l’abondance de phytoplancton dans les eaux de l’estuaire et les remontées des eaux froides, riches en nutriments présents à l’embouchure du Saguenay (THIBODEAU et al., 2006).
2.1.7 Effets du site et du sexe sur les hormones stéroïdiennes
Les hormones stéroïdiennes (progestérone, 17ß-oestradiol et testostérone), sur les trois années où elles ont été mesurées, 2002, 2003 et 2006, ne varient selon le sexe que pour les teneurs en progestérone (Holm-Sidak P < 0,05) dans les sites Anse‑à‑la‑Barque et Tadoussac, ces dernières teneurs étant très faibles (Figure 8). Des analyses statistiques utilisant des ANOVA à deux facteurs montrent que l’année est le facteur explicatif des variations hormonales plutôt que le sexe (Tableaux 3, 4 et 5). Ceci est conforme aux résultats de GAUTHIER‑CLERC et al. (2006a) qui n’ont pas observé de profil spécifique au sexe dans leur étude saisonnière de la gamétogenèse en relation avec les profils de 17ß-oestradiol et de testostérone. Dans les résultats présentés ici, les variations de progestérone, testostérone et 17ß-oestradiol varient significativement selon l’année (P < 0,001 pour E2 et P; P < 0,005 pour T), entre 2002 et 2006 (P < 0,05) et 2002 et 2006 (P < 0,05) pour les trois hormones (Tableau 6).
Tableau 3
Détermination de l’influence du sexe et de l’année sur les niveaux de 17ß-estradiol, estimée avec une analyse de variance (ANOVA) à deux facteurs.
Influence of sex and year of sampling on 17 estradiol-ß levels according to a two-way ANOVA variance analysis
Source de variation |
DF |
SS |
MS |
F |
P |
|---|---|---|---|---|---|
Années |
2 |
3 875 |
1,937 |
25,643 |
<0,001 |
Sexes |
1 |
0,0502 |
0,0502 |
0,664 |
0,417 |
Années X Sexes |
2 |
0,0379 |
0,0190 |
0,251 |
0,778 |
Résidus |
113 |
8,537 |
0,0755 |
|
|
Total |
118 |
12,462 |
0,106 |
|
|
Tableau 4
Détermination de l’influence du sexe et de l’année sur les niveaux de progestérone, estimée par une analyse de variance (ANOVA) à deux facteurs.
Influence of sex and year of sampling on progesterone levels according to a two-way ANOVA variance analysis.
Source de variation |
DF |
SS |
MS |
F |
P |
|---|---|---|---|---|---|
Années |
2 |
137,3 |
68,650 |
27,431 |
<0,001 |
Sexes |
1 |
0,247 |
0,247 |
0,0987 |
0,754 |
Années X Sexes |
2 |
0,0337 |
0,0168 |
0,00673 |
0,993 |
Résidus |
113 |
282,797 |
2,503 |
|
|
Total |
118 |
424,123 |
3,594 |
|
|
Tableau 5
Détermination de l’influence du sexe et de l’année sur les niveaux de testostérone, estimée par une analyse de variance (ANOVA) à deux facteurs.
Influence of sex and year of sampling on testosterone levels according to a two-way ANOVA variance analysis.
Source de variation |
DF |
SS |
MS |
F |
P |
|---|---|---|---|---|---|
Années |
2 |
7,849 |
3,925 |
5,615 |
0,005 |
Sexes |
1 |
0,958 |
0,958 |
1,371 |
0,244 |
Années X Sexes |
2 |
2,015 |
1,008 |
1,442 |
0,241 |
Résidus |
113 |
78,981 |
0,699 |
|
|
Total |
118 |
88,760 |
0,752 |
|
|
Tableau 6
Variations des hormones stéroïdiennes en fonction des années. Méthode de Dunn.
Steroid hormone variations according to year of sampling. All Pairwise Multiple Comparison Procedures (Dunn’s Method).
Comparaison |
Progestérone |
Testostérone |
17 ß-estradiol |
||||||
|---|---|---|---|---|---|---|---|---|---|
|
Diff. de rangs |
Q |
P < 0,05 |
Diff. de rangs |
Q |
P < 0,05 |
Diff. de rangs |
Q |
P < 0,05 |
2002 vs 2003 |
4,994 |
0,626 |
Non |
30,041 |
3,768 |
Oui |
70,526 |
8,846 |
Oui |
2002 vs 2006 |
48,052 |
6,334 |
Oui |
44,828 |
5,909 |
Oui |
20,798 |
2,741 |
Oui |
2003 vs 2006 |
53,045 |
6,842 |
Oui |
74,869 |
9,657 |
Oui |
49,727 |
6,414 |
Oui |
Une étude de l’importance des stations versus les sexes montre que les stations expliquent les variations de progestérone (P < 0,001). Quel que soit le sexe, la station Anse‑à‑la‑Barque, avec des niveaux élevés de progestérone et un IGS faible, se démarque des sites de Tadoussac, Moulin-à-Baude, Baie‑Sainte‑Catherine, Baie‑Éternité et Anse‑aux‑Érables. Le site Anse‑Saint‑Jean diffère significativement des sites Moulin‑à‑Baude et Tadoussac (P < 0,001) (Figure 8). Nous avons aussi observé dans la présente étude des retards de gamétogenèse (résultats non montrés) chez les myes de Anse‑Saint‑Jean, Anse‑aux‑Érables, Baie‑Éternité, Petit‑Saguenay et Baie‑Sainte‑Catherine. Les myes femelles de Anse‑à‑la‑Barque et de Tadoussac avaient par contre une gamétogenèse synchrone avec les sites de références Anse‑Saint‑Étienne et Moulin‑à‑Baude. L’interprétation des profils hormonaux est complexe et aucune relation n’a pu être mise en évidence avec les stades de gamétogenèse, contrairement aux études antérieures (GAUTHIER‑CLERC et al., 2006; SIAH et al., 2002, 2003), ce qui laisse croire à des influences anthropiques. En fait, les influences négatives de rejets municipaux et d’organoétains ont déjà été démontrées sur la reproduction des myes au Saguenay (GAGNÉ et al., 2003, 2006).
Les résultats hormonaux à Tadoussac sont surprenants et peuvent être reliés à l’indice de croissance basé sur l’âge, où des valeurs inférieures avaient été trouvées chez les myes. Des niveaux hormonaux très bas, des IGS élevés, une gamétogenèse semblable aux sites de référence et un ICR bas, nous laissent croire à des influences anthropiques. Tadoussac est reconnu comme un des hauts lieux du tourisme en Amérique du Nord. Le village accueille bon an mal an quelque 300 000 visiteurs, ce qui en fait une agglomération moyenne et susceptible, par ses rejets domestiques et municipaux, de contaminer la baie. Une fois de plus, mentionnons que des résidus organostanniques et des résidus pétroliers pourraient se retrouver dans ce secteur, comme dans celui de Baie‑Sainte‑Catherine (GAGNÉ et al., 2003) à cause de la proximité de la circulation maritime et des activités portuaires touristiques.
Contrairement à ce qui fut remarqué chez Ensis arcuatus (DARRIBA et al., 2004), la gamétogenèse n’est pas synchrone entre mâles et femelles chez la mye (présente étude) et la moule (CARTIER et al., 2004; LEMAIRE et al., 2006) dans l’estuaire et le golfe du Saint‑Laurent. Même lorsque les IGS sont étudiés sur une échelle saisonnière (GAUTHIER‑CLERC et al., 2002), les variations intersites et interannuelles ne sont pas aussi marquées que celles décrites dans l’étude de DARRIBA et al., 2004. Les IGS observés chez Ensis arcuatus reflètent complètement l’état gamétogénique du bivalve, cette espèce n’entreposant pas de réserves énergétiques. Chez la mye, compte tenu des mobilisations des réserves énergétiques, la gonade subit des variations de masse qui peuvent venir augmenter la variabilité interindividuelle et rendre l’IGS un peu moins précis. L’estimation la plus courante de l’activité gamétogénique demeure la détermination de la proportion des différents stades par histologie (GAUTHIER-CLERC et al., 2002, SIAH et al., 2002, 2003) et éventuellement par la mesure de l’activité de l’aspartate transcarbamylase (ETCHIAN et PELLERIN, 2004).
2.1.8 L’indice de maturité
Le calcul de l’indice de maturité (GAUTHIER‑CLERC et al., 2006 a,b; SIAH et al., 2003) permet la discrimination des sites sur la base de l’évaluation des délais de maturation. Les tableaux 1 (femelles) et 2 (mâles) montrent pour les sites à l’embouchure du Saguenay des indices de maturité plus élevés chez les mâles à Moulin-à-Baude par rapport à Baie‑Sainte‑Catherine. De façon générale, sauf en 2007 à Baie‑Sainte‑Catherine, les femelles avaient une maturité sexuelle plus avancée que chez les mâles, observation qui se retrouve chez les myes à l’intérieur du fjord (Tableaux 1 et 2). Les sites Baie‑Éternité, Anse‑aux‑Érables, Anse‑Saint‑Jean sont les sites où on observe de façon systématique les stades les moins avancés de gamétogenèse chez les femelles (Tableau 1) et chez les mâles (Tableau 2), lorsque comparés au site Anse‑Saint‑Étienne, considéré comme référence dans le fjord. Ces résultats concordent tout à fait avec ceux de GAUTHIER‑CLERC et al. (2002). Les retards dans la gamétogenèse à Anse‑Saint‑Jean, Baie‑Éternité et Anse‑aux‑Érables pourraient donc s’expliquer par des apports nutritionnels moindres dans ces sites, comme déjà mentionné par GAUTHIER-CLERC et al. (2002). Cependant, les indices de condition calculés ne montrent pas de façon évidente une mauvaise condition physiologique de ces myes, mise à part l’observation visuelle de siphons flasques et des chairs en liquéfaction certaines années à Baie-Éternité. Même s’il est reconnu que la productivité phytoplanctonique dans le fjord est faible (THERRIAULT, 1990), les indices de maturité montrent à Anse‑Saint‑Étienne une gamétogenèse similaire à celle des myes de Moulin‑à‑Baude chez les femelles, contrairement aux résultats de GAUTHIER-CLERC et al. (2002), qui avaient trouvé en 1996-1997 des valeurs plus élevées à Moulin‑à‑Baude. Chez les mâles, par contre, l’indice de maturité est beaucoup plus élevé à Moulin‑à‑Baude qu’à Anse‑Saint‑Étienne, renforçant ainsi par ces résultats le contraste des observations à l’intérieur du fjord et l’embouchure, via la productivité variable. Les délais de maturité sexuelle à Anse‑Saint‑Jean, Baie‑Éternité et Anse‑aux‑Érables pourraient s’expliquer par des entreposages de réserves énergétiques qui ne sont pas mobilisées pour une gamétogenèse active. Comme mentionné par GAUTHIER-CLERC et al. (2002), la présence de contaminants à potentiel anti-ostrogénique pourrait expliquer ces délais de maturation dans des sites où l’on retrouve des effluents municipaux (Anse‑Saint‑Jean), des influences industrielles provenant de l’amont (Anse‑aux‑Érables : HAP, métaux et butylétains) et Baie‑Éternité (influences portuaires et métaux).
De façon générale, on compte environ 550 substances chimiques qui sont suspectées d’avoir une action sur les systèmes hormonaux auxquels est associé un risque écologique, car il existe dans de nombreux cas des ressemblances structurales entre le polluant et l’hormone, conduisant à une compétition pour les sites récepteurs. Chez les poissons, la nocivité des différents contaminants est relative à l’induction de la vitellogénine via l’exposition aux alkylphénols ou aux effets des butylétains (SUMPTER, 2003). Ceci fut également postulé chez les invertébrés et vérifié par LI et al. (2001) chez Crassostrea gigas et par BLAISE et al. (1999) qui ont démontré que le 17ß-oestradiol, le nonylphénol et le pentachlorophénol sont des inducteurs de vitellogénine chez Mya arenaria. De plus, en présence de perturbateurs endocriniens à effets estrogéniques, anti-estrogéniques ou androgéniques, la confirmation d’effets de modulation endocrinienne chez les invertébrés est encore à démontrer. Les systèmes endocriniens des bivalves ont peu en commun avec ceux des vertébrés, même s’il y a similitude de structures moléculaires avec les stéroïdes sexuels des mammifères pour la progestérone, la testostérone et le 17ß-oestradiol (GAUTHIER-CLERC et al., 2006a; SIAH et al., 2003). De possibles rétroactions avec des neuropeptides pourraient interagir avec le système reproducteur (GARNEROT et al., 2006). Une revue exhaustive des sources de perturbations endocriniennes, leurs mécanismes et les effets potentiels est maintenant disponible (DUROU et al., 2008; HUET et al., 2008; PELLERIN et AMIARD, 2008) et elle montre que les dissimilitudes des réponses des invertébrés avec les vertébrés sont nombreuses. De plus, les cycles reproducteurs sont complexes chez les invertébrés et sont sous l’influence de stimuli environnementaux telles la lumière, la nourriture, la diète et la température, affectant éventuellement le développement larvaire et la détermination du sexe. Toutefois, la présente étude multiannée nous permet de faire ressortir des points intéressants. Nous avons observé précédemment que des délais de maturation sexuelle se retrouvaient aux sites Anse-Saint-Jean, Baie‑Éternité et Anse‑aux‑Érables. SIAH et al. (2003) avaient rapporté que les activités portuaires associées aux contaminants, tels les butylétains par exemple au port de Rimouski Est, causaient des retards importants de gamétogenèse chez Mya arenaria et étaient associés significativement à des niveaux très bas de progestérone, ce qui correspond bien aux résultats observés dans cette étude chez les myes de Baie‑Éternité et d’Anse‑aux‑Érables. Ce dernier site se présente comme une baie ouverte influencée par le trafic maritime sur le Saguenay. Par contre, pour les myes de Anse‑Saint‑Jean, la variabilité interindividuelle des niveaux de progestérone ne nous permet pas de tirer les mêmes conclusions. Toutefois, les trois hormones sont en concentrations élevées à Anse‑Saint‑Jean, site déjà caractérisé par la présence de rejets municipaux (GAGNÉ et al., 2002). Ces teneurs très élevées reflètent les effets d’une contamination mixte et possiblement représentative de l’action de perturbateurs endocriniens. À l’embouchure du Saguenay, les sites Baie‑Sainte‑Catherine, Tadoussac et Moulin‑à‑Baude sont exposés au trafic maritime et présentent des taux hormonaux faibles (P et T) et des valeurs des butylétains variables au fil des années. Le site Tadoussac est directement exposé aux effluents municipaux et au trafic maritime. Tadoussac a des niveaux presqu’inexistants d’hormones stéroïdiennes, ce qui semble être la cause du retard de maturité sexuelle (indices de IM ˜ 3,10) par rapport au site de Moulin‑à‑Baude (IM = 4,5). Les niveaux hormonaux sont bas à l’embouchure du Saguenay, probablement causés par une diminution de la synthèse d’estradiol, tel que l’ont démontré GAGNÉ et al. (2002). Une telle inhibition de la synthèse de 17ß-oestradiol par les butylétains s’avère plausible chez les myes puisque chez les gastéropodes, ce contaminant est capable de bloquer la conversion de la testostérone en 17ß-oestradiol via l’aromatase du cytochrome P450 (SPOONER et al., 1991). Plusieurs études démontrent la grande capacité de bioaccumulation de différentes espèces de myes et leur potentiel comme espèces sentinelles. Chez Venerupis decussata, par exemple, le facteur de bioconcentration des butylétains varie de 10 000 à 40 000 tandis que le temps de dépuration varie de 11 à 36 jours (GOMEZ-ARIZA et al., 1999). Des données similaires se retrouvent chez Mya arenaria (YANG et al., 2006), laquelle montre une bioaccumulation préférentielle dans la glande digestive, indiquant une susceptibilité d’accumulation grâce aux apports alimentaires. La mye montre en plus une grande tolérance aux composés organostanniques et une plus faible capacité de dégrader les tributylétains en di-butylétains et mono-butylétains (HARINO et al., 2005).
2.1.9 Phagocytose
La figure 9 illustre les variations de la capacité phagocytaire des myes en fonction de sites étudiés. Les sites Moulin‑à‑Baude et Anse‑Saint‑Étienne se démarquent une fois de plus comme ayant la meilleure condition physiologique selon leur situa-tion, à l’embouchure et à l’intérieur du fjord respectivement. Nonobstant les concentrations en Cu et Cd retrouvées à Moulin‑à‑Baude, les myes de ce site semblent tolérantes aux métaux présents. Les diminutions de l’activité phagocytaire observées ici en 2005 et 2006 correspondent bien aux résultats décrits plus haut en ce qui a trait aux retards de gamétogenèse (Baie‑Sainte‑Catherine, Baie‑Éternité, Anse‑aux‑Érables et Anse‑Saint‑Jean) dans les sites influencés par les effluents urbains (Anse‑Saint‑Jean) et le trafic portuaire (Baie‑Sainte‑Catherine, Baie‑Éternité et Anse‑aux‑Érables). Par contre, les résultats de BLAISE et al. (2002) étaient différents de ceux retrouvés ici, les variations intersites étant peu marquées dans leur étude et reliées probablement au cycle de gamétogenèse. Toutefois, les résultats de BLAISE et al. (1999) relatant les variations de vitellogénine sont en conformité avec nos résultats, où nous avions trouvé des évidences de perturbations endocrines, Anse‑Saint‑Jean et Baie‑Éternité, par exemple, et des diminutions de phagocytose.
Figure 9
Variations de la phagocytose de myes provenant des sites BSC, MAB, BA, ASE, ASJ, BE et AAE en 2005 and 2006. L’ordonnée Y représente le % d’hémocytes ayant phagocité une bille fluorescente et plus. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les lettres minuscules indiquent les différences intersites en 2005 et les lettres majuscules les différences en 2006. La flèche indique que les sites ASJ, BE et AAE sont significativement différents des sites ASE (le site de référence à l’intérieur du fjord) et des sites MAB et BA. Les barres d’erreur représentent les écarts-types et le seuil statistique a été placé à P < 0,05.
Variations of phagocytic activity of clams in sites BSC, MAB, BA, ASE, ASJ, BE and AAE in 2005 and 2006. Y axis represents the percentage of hemocytes having engulfed one fluorescent bead or more. Similar letters (minuscules) indicate that there are no significant differences between sites in 2005 while letters in capitals indicate that there are no significant differences between sites in 2006 (p > 0.05). The arrow indicates that the sites ASJ, BE and AAE are significantly different from ASE (the reference site within the fjord) and with MAB and BA. Error bars represent the standard deviation and statistical significance put at P < 0.05.
Conclusion
Conclure sur le danger pour la survie des populations de myes au Saguenay serait probablement prématuré, n’ayant pas observé de chute drastique des populations lors des relevés écologiques et écotoxicologiques entre 1994 et 2007. Toutefois, les résultats obtenus concernant les effets différentiels chez les myes mâles et les myes femelles sont sans équivoque en ce qui a trait à la gamétogenèse et confirment nos résultats antérieurs d’une sensibilité particulière des myes mâles aux contaminants organiques (FROUIN et al., 2007). Ces effets, différents selon les genres, constitueraient une avenue à explorer pour mieux comprendre les effets des principaux contaminants retrouvés dans le fjord (organoétains, métaux, hydrocarbures polyaromatiques polycycliques). De plus, des travaux complémentaires réalisés dans notre laboratoire chez Mya arenaria (FROUIN et al., 2007) démontrent qu’une exposition à différents types de HAP (suies, mélange de HAP, coke vert, résidus de fonderie provenant d’une aluminerie) affectent le système immunitaire, la gamétogenèse et initient des réponses significatives de stress. Tout comme chez GAUTHIER‑CLERC et al. (2002) et dans ce manuscrit, nous observons des retards importants de gamétogenèse dans certains sites (Anse‑Saint‑Jean, Baie‑Éternité, Baie‑Sainte‑Catherine, Anse‑aux‑Érables) que nous avions reliés à la présence de contaminants, ceux-ci empêchant probablement la remobilisation des réserves énergétiques. Les résultats de FROUIN et al. (2007) suggèrent également que les HAP touchent de façon plus marquée les myes mâles que les myes femelles. De futurs suivis environnementaux dans le Saguenay devraient se pencher plus à fond sur ces effets, différents selon le sexe, ce qui nous amènera à l’étude en profondeur des mécanismes des perturbateurs endocriniens. Même si nos connaissances sur l’endocrinologie des invertébrés est très lacunaire, les nombreuses perturbations observées chez les myes représentent des indices supplémentaires de l’implication probable des hormones stéroïdiennes dans le contrôle de la reproduction. L’ensemble de ces résultats confirme aussi le potentiel de Mya arenaria comme une espèce sentinelle dans les futures études de perturbation endocrine chez les invertébrés. De nombreux facteurs expliquent les variations de condition physiologique observées dans ce manuscrit chez la mye. De multiples indices viennent accroître notre curiosité sur ces variations de son état de santé : 1) les variations très importantes des capacités immunitaires, 2) les retards de gamétogenèse, 3) les effets connus à ce jour des contaminants testés séparément et 4) les interrogations sur les interactions entre contaminants. L’observation que les indices biologiques et biochimiques sont particulièrement pertinents pour mettre en évidence les effets des contaminants en milieu naturel, est une découverte importante qui ressort clairement des relevés 1994-2007. Ils se sont avérés sensibles et montrent bien les effets d’une pollution chronique à très faible dose. Ces mesures sont donc les outils de choix pour bien appréhender l’état de santé des êtres vivants dans un contexte de pollution multiple et complexe.
Appendices
Remerciements
Les auteurs désirent remercier le CRSNG pour la subvention à la découverte octroyée à Jocelyne Pellerin et à l’UQAR, l’ISMER et Environnement Canada pour le soutien scientifique et technique.
Références bibliographiques
- AMIARD J.-C., A. PINEAU, H.L. BOITEAU, C. MÉTAYER et C. AMIARD-TRIQUET (1987). Application of atomic absorption spectrophotometry using Zeeman effect to the determination of eight trace elements (Ag, Cd, Cr, Cu, Mn, Ni, Pb and Se) in biological materials. Water Res., 21, 693-697.
- AMIARD J.-C., C. AMIARD-TRIQUET, S. BARKA, J. PELLERIN et P.S. RAINBOW (2006). Metallothioneins in aquatic invertebrates: Their role in metal detoxification and their use as biomarkers. Aquat. Toxicol., 76, 160-202.
- AVERY E.L., R.H. DUNSTAN et J.A. NELL (1996).The detection of pollutant impact in marine environments: condition index, oxidative DNA damage, and their associations with metal bioaccumulation in the Sydney rock oyster Saccostrea commercialis.Arch. Environ. Contam. Toxicol., 31,192-198.
- BARBEAU C., R. BOUGIE et J.E. CÔTÉ (1981). Temporal and spatial variations of mercury, lead, zinc and copper in sediments of the Saguenay fjord. Can. J. Earth Sci., 18, 1065-1074.
- BLAISE C., F. GAGNÉ et J. PELLERIN (2003). Bivalve population status and biomarker responses in Mya arenaria clams (Saguenay fjord, Québec, Canada). Fres. Environ. Bull., 12, 956-960.
- BLAISE C., F. GAGNÉ, J. PELLERIN et P.D. HANSEN (1999). Determination of vitellogenin-like properties in Mya arenaria hemolymph (Saguenay fjord, Québec, Canada): a potential biomarker for endocrine disruption. Environ. Toxicol., 14, 455-465.
- BLAISE C., F. GAGNÉ, J. PELLERIN, P.D. HANSEN et S. TROTTIER 2002. Molluscan shellfish biomarker study of the Quebec, Canada, Saguenay fjord with the soft-shell clam, Mya arenariaEnviron. Toxicol., 17, 170‑186.
- BROCHU C., S. MOORE et É. PELLETIER (1995). Poly-chlorinated dibenzo-p-dioxins and dibenzofurans in sediments and biota of the Saguenay estuary. Mar. Pollut. Bull., 30, 515‑523.
- BROUSSEAU P., Y. PAYETTE, B. BLAKLEY, H. BOERMANS, D. FLIPO, H. TRYPHONAS et M. FOURNIER (1998). Manual of Immunological Methods. CRC Press, Boston, USA.
- CAMPBELL M.J., Z. RADECKI, A. TRINKI et K.I. BURNS (2000). Report on the intercomparison runs for the determination of trace and minor elements in cabbage material, IAEA-359. Rep. IAEA/AL/123, Vienna, Austria
- CARTIER S., J. PELLERIN, M. FOURNIER, É. TAMI-GNEAUX et L. GIRAULT (2004). Use of an index based on the blue mussel digestive gland weight in assessing environmental conditions. Aquacult., 241, 633-654.
- CHOI J., J. JI, K.-H. CHUNG et I.-Y. AHN (2007). Cadmium bioaccumulation and detoxification in the gill and digestive gland of the Antarctic bivalve Laternula elliptica.Comp. Bioch. Physiol. C Toxicol. Pharm., 145, 227-235.
- COE W.R. et H.J. TURNER (1938). Development of the gonads and gametes in the soft-shell clam (Mya arenaria). J. Morphol., 62, 91–111.
- CÔTÉ R. et G. LACROIX (1979). Influence de débits élevés et variables d’eau douce sur le régime saisonnier de production primaire d’un fjord subarctique. Oceanol. Acta., 2, 299–315.
- DARRIBA S., F. SAN JUAN et A. GUERRA (2004). Reptoductive cycle of the razor clam Ensis arcuatus (Jeffreys, 1865) in northwest Spain and its relation to environmental conditions. J. Exp. Mar. Biol. Ecol., 311, 101-115.
- DESROSIERS G. et J.C.F. BRETHES (1984). Étude bionomique de la communauté à Macoma baltica de la batture de Rimouski. Sci. Tech. Eau, 17, 25-30.
- DUROU C., C. MOUNEYRAC, J. PELLERIN et A. DÉRY (2008). Conséquences des perturbations du métabolisme énergétique. Dans : Les biomarqueurs dans l’évaluation de l’état écologique des milieux aquatiques. AMIARD J.-C. et AMIARD-TRIQUET C. (Éditeurs), Éditions Tec & Doc, Lavoisier, pp. 273-294.
- ERNST W., H. WEIGELT, H. ROSENTHAL et P.D. HANSEN (1991). Testing bioconcentration of organic chemicals with the common mussel (Mytilus edulis). Dans : Bioaccumulation in Aquatic Systems. NAGEL, R. et R. LOSKILL (Éditeurs). VCH VerlagsgesellschaftmbH Publisher, Weinheim, Germany, pp. 99-131.
- L’ESCADRILLE SAGUENAY (2008). Mémoire consultation publique 2008. (Révision du plan directeur). Parc marin Saguenay-Saint Laurent, 21 mars 2008, 5 p.
- ETCHIAN O.A., J. PELLERIN, C. AUDET et M. MATHIEU (2004). Sexual maturation and related changes in aspartate transcarbamyl Anse-Saint-Étienne activity of gonad tissues in the soft shell clam (Mya arenaria). Comp. Biochem. Physiol. B Bioch. Mol. Biol., 139, 287-297.
- FROUIN H., J. PELLERIN, M. FOURNIER, É. PELLETIER, P. RICHARD, N. PICHAUD, C. ROULEAU et F. GARNEROT (2007). Physiological effects of polycyclic aromatic hydrocarbons on soft-shell clam Mya arenaria. Aquat. Toxicol., 82, 120-134.
- GAGNÉ F., C. BLAISE, C. ANDRÉ et J. PELLERIN (2007). Implication of site quality on mitochondrial electron transport activity and its interaction with temperature in feral Mya arenaria clams from the Saguenay Fjord. Envir. Res., 103, 238-246.
- GAGNÉ F., C. BLAISE, J. PELLERIN et S. GAUTHIER-CLERC (2002). Alteration of the biochemical properties of female gonads and vitellins in the clam Mya arenaria at contaminated sites in the Saguenay fjord. Mar. Environ. Res., 53, 295-310.
- GAGNÉ F., C. BLAISE, J. PELLERIN, M. FOURNIER, M.J. DURAND et A. TALBOT (2008). Relationships between intertidal clam population and health status of the softshell clam Mya arenaria in the St. Lawrence Estuary and Saguenay Fjord (Québec, Canada). Environ. Internat., 34, 30‑43.
- GAGNÉ F., C. BLAISE, J. PELLERIN, É. PELLETIER et J. STRAND (2006). Health status of Mya arenaria bivalves collected from contaminated sites in Canada (Saguenay fjord) and Denmark (Odense fjord) during their reproductive period. Ecotox. Environ. Safety, 64, 348-361.
- GAGNÉ, F., C. BLAISE, J. PELLERIN, É. PELLETIER, M. DOUVILLE, S. GAUTHIER-CLERC et L. VIGLINO (2003). Sex alteration in soft-shell clams (Mya arenaria) in an intertidal zone of the St. Lawrence River (Quebec, Canada), Comp. Biochem. Physiol. C Toxicol. Pharm., 134, 189-198.
- GARNEROT F., J. PELLERIN, C. BLAISE et M. MATHIEU (2006). Immunohistochemical localization of serotonin (5-hydroxytryptamine) in the gonad and digestive gland of Mya arenaria (Mollusca: Bivalvia). Gen. Comp. Endocrinol., 149, 278–284
- GAUTHIER-CLERC S, J. PELLERIN, C. BLAISE et F. GAGNÉ (2002). Delayed gametogenesis of Mya arenaria in the Saguenay fjord (Canada): a consequence of endocrine disruptors ? Comp. Biochem. Physiol. C Toxicol. Pharm., 131, 457-467.
- GAUTHIER-CLERC S., J. PELLERIN et J.C. AMIARD (2006a). Estradiol-17ß and testosterone concentrations in male and female Mya arenaria (Mollusca bivalvia) during the reproductive cycle. Gen. Comp. Endocrinol.,145, 133-139.
- GAUTHIER-CLERC S., J. PELLERIN, M. FOURNIER et J.-C. AMIARD (2006b). Immunological and biochemical responses in Mya arenaria (Mollusca Bivalvia) exposed to estradiol-17beta. Comp. Biochem. Physiol. C Toxicol.Pharm., 144, 228-234.
- GOBEIL C., N. SILVERBERG, B. SUNDBY et D. COSSA (1987). Cadmium diagenesis in Laurentian trough sediments. Geochim. cosmochim. Acta, 51, 589-596.
- GOMEZ-ARIZA J.L., I. GIRALDEZ, E. MORALES, F. ARIESE, W. COFINO et P. QUEVAUVILLER (1999). Stability and storage problems in organotin speciation in environmental samples, J. Environ. Monit., 1, 197‑202.
- GRANT J., C.T. ENRIGHT et A. GRISWOLD (1990). Resuspension and growth of Ostrea edulis: A field experiment. Mar. Biol., 104, 51-59.
- GRANT A., P.A. TYLER (1983). The analysis of data in studies of invertebrate reproduction. I. Introduction and statistical analysis of gonad indices and maturity indices. Int. J. Invert. Reprod., 6, 259-269.
- HARINO H., S.C.M. O’HARA, G.R. BURT, B.S. CHESMAN et W.J. LANGSTON (2005). Distribution of organotin compounds in tissues of mussels Mytilus edulis and clams Mya arenaria. Chemosphere, 58, 877‑881.
- HUET M., C. MINIER et J. PELLERIN (2008). Les perturbateurs endocriniens : études de cas. Dans : Les biomarqueurs dans l’évaluation de l’état écologique des milieux aquatiques. AMIARD J.-C. et C. AMIARD-TRIQUET (Éditeurs), Éditions Tec & Doc, Lavoisier, pp. 179-210.
- KAUTSKY N. (1982). Growth and size structure in a baltic Mytilus edulis population. Mar. Biol., 68, 117-133.
- LEMAIRE N., J. PELLERIN, M. FOURNIER, L. GIRAULT, É. TAMIGNEAUX, S. CARTIER et É. PELLETIER (2006). Seasonal variations of physiological parameters in the blue mussel Mytilus spp. from farm sites of eastern Quebec. Aquacult., 261, 729-751.
- LI Q., M. OSADA, K. MORI et R. WANG (2001). Effect of tributyltin oxide on sexual maturation of the Pacific oyster, Crassostrea gigas. J. Ocean Univ. Qingdao/Qingdao Haiyang Daxue Xuebao, 31, 701-706.
- LUN R., K. LEE, L. de MARCO, C. NALEWAJKO et D. MACKAY (1998). A model of the fate of polycyclic aromatic hydrocarbons in the Saguenay fjord, Canada. Environ. Toxicol. Chem.,17, 333‑341.
- MAYRAND E., J. PELLERIN-MASSICOTTE et B. VINCENT (1995). Effets à court terme de la disponibilité de nourriture, de la température et de la remise en suspension des sédiments sur les indices biochimiques de croissance du Mya arenaria (l) : une étude en milieu naturel. Can. J. Zool., 73, 532-541.
- Mc CLELLAN-GREEN P., J. ROMANO et E. OBERDÖRSTER (2007). Does gender really matter in contaminant exposure? A Anse-Saint-Étienne study using invertebrate models. Environ. Res., 104, 183-191.
- MPO PÊCHES DE L’ATLANTIQUE (1996). Rapport sur l’état des stocks 96/128F. www.dfo-mpo.gc.ca/csas/Csas/etat/1996/SSR_1996_128_f.pdf (consultation le 2 avril 2008).
- OLIVEIRA RIBEIRO C.A., J. PADRÓS. F.X. VALDEZ DOMINGOS, F.M. AKAISHI et É. PELLETIER (2007). Histopathological evidence of antagonistic effects of tributyltin on benzo[a]pyrene toxicity in the Arctic charr (Salvelinus apinus). Sci.Total Environ., 372, 549-553.
- ORBAN E., G. DI LENA, T. NEVIGATO, I. CASINI, A. MARZETTI et R. CAPRONI (2002). Seasonal changes in meat content, condition index and chemical composition of mussels (Mytilus galloprovincialis) cultured in two different Italian sites. Food Chem., 77, 57–65.
- PELLERIN J., P. RIOUX, L. VIGLINO, É. PELLETIER, H. DOUCET-BEAUPRÉ, C. BLAISE et F. GAGNÉ (2003). Evidence of endocrine disruption in Mya arenaria located near the mouth of the Saguenay fjord linked to TBT sediment contamination. Dans : 2e Symposium International sur les Sédiments Contaminés, 26 au 28 mai 2003, Québec, Canada.
- PELLERIN J. et J.-C. AMIARD (2008). Altérations des fonctions endocrines : causes et conséquences. Dans : Les biomarqueurs dans l’évaluation de l’état écologique des milieux aquatiques. AMIARD J.-C. et C. AMIARD-TRIQUET (Éditeurs). Éditions Tec & Doc, Lavoisier, Chap. 6, pp. 149-178.
- PELLERIN J., C. BLAISE, F. GAGNÉ, P. RIOUX, L. VIGLINO, É. PELLETIER et H. DOUCET-BEAUPRE (2003). Evidence of endocrine disruption of TBT in sediments of the Saguenay fjord in Mya arenaria. Dans : 2nd International Symposium on Contaminated Sediments: Characterization, Evaluation, Mitigation/Restoration, Management and Performance. May 26-28, 2003, Quebec City, Canada, Compte rendu, pp. 355-359.
- PELLERIN J., S. GAUTHIER-CLERC, A. SIAH et O. ASSOI-ETCHIAN (2004). Stress physiologique et perturbation endocrinienne chez les bivalves marins. Dans : Écotoxicologie moléculaire. Principes fondamentaux et perspectives de développement. PELLETIER É., F. DENIZEAU et P. CAMPBELL (Éditeurs). Presses de l’Université du Québec, pp. 350-400.
- PELLETIER É., I. DESBIENS, P. SARGIAN, N. CÔTÉ, A. CURTOSI et R. ST-LOUIS (2009). Présence des hydrocarbures aromatiques polycycliques (HAP) dans les compartiments biotiques et abiotiques de la rivière et du fjord du Saguenay. Rev. Sci. Eau, 22, (ce numéro).
- PEREIRA J.J., R. MERCALDO-ALLEN, C. KUROPAT, D. LUEDKE et G. SENNEFELDER (1993). Effect of cadmium accumulation on serum vitellogenin levels and hepatosomatic and gonadosomatic indices of winter flounder (Pleuronectes americanus). Arch. Environ. Contam. Toxicol., 24, 427-431.
- SIAH A., A. BENOSMAN, J. PELLERIN, J.-P. GAGNÉ, et J.C. AMIARD (2002). Seasonal gonad progesterone pattern in the soft-shell clam Mya arenaria. Comp. Biochem.Physiol.A Mol. Integr. Physiol., 132, 499-511.
- SIAH A., J. PELLERIN, J.-C. AMIARD, É. PELLETIER et L. VIGLINO (2003). Delayed gametogenesis and progesterone levels in soft-shell clams (Mya arenaria) in relation to in situ contamination to organotins and heavy metals in the St. Lawrence River (Canada). Comp. Biochem. Physiol. C, 135, 145-156.
- SPOONER N., P.E. GIBBS, G.W. BRYAN et L.J. GOAD (1991). The effects of tributyltin upon steroid titres in the female dogwelk, Nucella lapillus, and the development of Imposex. Mar. Environ. Res., 32, 37-49.
- SUMPTER J.P. (2003). Endocrine disruption in wildlife: the future? Pure Appl. Chem., 75, 2355-2360.
- THERRIAULT J.C., L. LEGENDRE. et S. DEMERS (1990). Dans : Coastal and Estuarine Studies. Oceanography of a Large Scale Estuarine System: The St. Lawrence Estuary. Oceanography and Ecology of Phytoplankton in the Saint-Lawrence Estuary. EL-SABH M.J. et N. SILVERBERG, (Éditeurs.), Springer-Verlag, Berlin, Germany, pp. 269‑295.
- THIBODEAU B., A. De VERNAL et A. MUCCI (2006). Recent eutrophication and consequent hypoxia in the bottom waters of the lower St. Lawrence Estuary: Micropaleontological and geochemical evidence. Mar. Geol., 231, 37-50.
- VAILLANCOURT R., J.-C.F. BRETHES et G. DESROSIERS (1985). Croissance de la plie rouge (Pseudopleuronectes americanus) de l’estuaire maritime du Saint-Laurent. Growth of the winter flounder Pseudopleuronectes americanus in the St. Lawrence Estuary. Can. J. Zool., 63, 1610-1616.
- van der VEER H.W., F.M.F. CARDOSO et J. van der MEER (2006). The estimation of DEB parameters for various Northeast Atlantic bivalve species. J. Sea Res., 56,107-124.
- VIGLINO L. et É. PELLETIER (2006). Butylétains dans les eaux du fjord du Saguenay (Canada) : menace pour l’écosystème d’un milieu semi-fermé ? Rev. Sci. Eau, 19, 11-22.
- WHITE P.A., C. BLAISE et J. B.RASMUSSEN (1997). Detection of genotoxic substances in bivalve molluscs from the Saguenay fjord (Canada), using SOS chromotest. Mutat. Res., 392, 277–300.
- WHITE P.A., J.B. RASMUSSEN et C. BLAISE (1998). Genotoxic substances in the St. Lawrence system in extracts of fish and macroinvertebrates from the St. Lawrence and Saguenay rivers, Canada. Environ. Toxicol. Chem., 17, 304‑316.
- WINTERMYER M.L. et K.R. COOPER (2007). The develop-ment of an aquatic bivalve model: Evaluating the toxic effects on gametogenesis following 2,3,7,8-tetrachlorodibenzo-p-dioxin (2,3,7,8-TCDD) exposure in the eastern oyster (Crassostrea virginica). Aquat. Toxicol., 81, 10-26.
- YANG R., Q. ZHOU, J LIU et G. JIANG (2006). Butyltins compounds in molluscs from Chinese Bohai coastal waters. Food Chem., 97, 637-643.
List of figures
Figure 1
Situation des sites d’échantillonnages entre 1994 et 2007.
Sampling sites between 1994 and 2007.
Figure 2
Indices de condition des myes femelles (A) et mâles (B) basés sur le rapport masse de chair humide / masse totale de la mye. Les trois premiers sites (Baie-Sainte-Catherine, Moulin-à-Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les lettres minuscules indiquent les différences significatives par rapport au site Anse‑Saint‑Jean. Les lettres majuscules indiquent les différences significatives par rapport au site Pointe‑aux‑Alouettes. Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet flesh weight and total wet weight of the clams. The first three sites (Baie-Sainte-Catherine, Moulin‑à‑Baude, Tadoussac) are located at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0,05). Letters in lowercase represent significant differences according to values from Anse‑Saint‑Jean. Capital letters represent significant differences according to values from Pointe‑aux‑Alouettes. Error bars represent the standard deviation.
A
B
Figure 3
Indices de condition des myes femelles (A) et mâles (B) basés sur le rapport masse de chair humide / longueur totale3 de la mye. Les trois premiers sites (Baie‑Sainte-Catherine, Moulin-à-Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet flesh weight and total lenght3 of the clams. The first three sites (Baie‑Sainte-Catherine, Moulin‑à‑Baude, Tadoussac) are situated at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0.05). Error bars represent the standard deviation.
A
B
Figure 4
Indices de condition des myes femelles (A) et mâles (B) basés sur le rapport masse de chair humide / âge de la mye. Les trois premiers sites (Baie‑Sainte-Catherine, Moulin-à-Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet flesh weight and age of the clams. The first three sites (Baie Sainte-Catherine, Moulin-à-Baude, Tadoussac) are situated at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0.05). Error bars represent the standard deviation.
A
B
Figure 5
Indices de condition des myes femelles (A) et mâles (B) basés sur le rapport de la masse de glande digestive humide / masse totale de chair de la mye. Les trois premiers sites (Baie‑Sainte‑Catherine, Moulin-à-Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet digestive gland weight and total flesh weight of the clams. The first three sites (Baie-Sainte‑Catherine, Moulin-à-Baude, Tadoussac) are situated at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0.05). Error bars represent the standard deviation.
A
B
Figure 6
Répartition spatiale des concentrations en Cd (graphique du haut), Cu (graphique du milieu) et Zn (graphique du bas) en µg•kg‑1 p.h. de branchies (cercles pleins) et de glande digestive (cercles vides).
Spatial metal concentrations of Cd (upper garph), Cu (middle graph) and Zn (bottom graph) in µg•kg‑1 w.w. in gills (filled circles) and digestive gland (open circles).
Figure 7
Indices gonadosomatiques des myes femelles (A) et mâles (B) basés sur le rapport de la masse de gonade humide / masse totale de chair de la mye. Les trois premiers sites (Baie‑Sainte‑Catherine, Moulin‑à‑Baude, Tadoussac) sont situés à l’embouchure du Saguenay. Les 11 autres sites sont situés à l’intérieur du fjord du Saguenay. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les barres verticales d’erreur représentent l’écart-type.
Condition indices of female (A) and male (B) clams based on the ratio between wet gonad weight and total flesh weight of the clams. The first three sites (Baie‑Sainte‑Catherine, Moulin‑à‑Baude, Tadoussac) are situated at the mouth of the Saguenay. The 11 other sites are located within the Saguenay fjord area. Similar letters indicate that there are no significant differences between sites (p > 0.05). Error bars represent the standard deviation.
A
B
Figure 8
Valeurs des stéroïdes sexuels tous sexes et toutes années confondus en fonction des sites : progestérone dans le graphique du haut et les valeurs de testostérone et d’oestradiol dans le graphique du bas. Les données de 2002, 2003 et 2006 ont été groupées ainsi que les valeurs obtenues par sexe, de façon à extraire les tendances à long terme de la stéroidogenèse chez la mye. Les données sont exprimées en ng•g‑1 de poids frais de gonade. Les lettres similaires indiquent qu’il n’y a pas de différence significative entre les sites (P > 0,05). Les barres d’erreur représentent les écarts-types et le seuil statistique a été placé à P < 0,05.
Sexual steroid levels in different sites including 2002, 2003 and 2006 values, as well as data from both sexes. Progesterone values are illustrated in the upper panel and testosterone and estradiol values in the bottom panel. Data are expressed ng•g‑1 wet gonad weight. Similar letters indicate that there are no significant differences between sites (P > 0.05). Error bars represent the standard deviation and statistical significance put at P < 0.05.
Figure 9
Variations de la phagocytose de myes provenant des sites BSC, MAB, BA, ASE, ASJ, BE et AAE en 2005 and 2006. L’ordonnée Y représente le % d’hémocytes ayant phagocité une bille fluorescente et plus. Les lettres identiques indiquent qu’il n’y a pas de différence significative entre les sites (p > 0,05). Les lettres minuscules indiquent les différences intersites en 2005 et les lettres majuscules les différences en 2006. La flèche indique que les sites ASJ, BE et AAE sont significativement différents des sites ASE (le site de référence à l’intérieur du fjord) et des sites MAB et BA. Les barres d’erreur représentent les écarts-types et le seuil statistique a été placé à P < 0,05.
Variations of phagocytic activity of clams in sites BSC, MAB, BA, ASE, ASJ, BE and AAE in 2005 and 2006. Y axis represents the percentage of hemocytes having engulfed one fluorescent bead or more. Similar letters (minuscules) indicate that there are no significant differences between sites in 2005 while letters in capitals indicate that there are no significant differences between sites in 2006 (p > 0.05). The arrow indicates that the sites ASJ, BE and AAE are significantly different from ASE (the reference site within the fjord) and with MAB and BA. Error bars represent the standard deviation and statistical significance put at P < 0.05.
List of tables
Tableau 1
Indices de maturité des myes femelles dans les sites à l’embouchure et dans le fjord du Saguenay (n = 30)
Maturity indices of female Mya arenaria in the Saguenay fjord (n = 30).
Sites |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Baie-Sainte-Catherine |
|
|
|
|
|
3,60 |
4,06 |
3,19 |
3,17 |
3,77 |
2,71 |
2,73 |
Baie-Sainte-Catherine (Pointe‑aux‑Alouettes) |
|
|
|
|
|
|
|
|
|
3,48 |
|
|
Baie-Sainte-Catherine (Quai) |
|
|
|
|
|
|
|
2,42 |
|
|
|
|
Moulin-À-Baude |
3,40 |
3,50 |
|
|
|
3,62 |
3,92 |
4,50 |
3,11 |
3,00 |
2,77 |
2,46 |
Tadoussac |
|
|
|
|
|
|
|
3,17 |
|
|
|
|
Anse-à-la-Barque |
|
|
|
|
|
|
|
3,43 |
|
3,19 |
3,68 |
2,27 |
Anse-Saint-Étienne |
3,00 |
3,00 |
|
|
|
|
|
|
3,54 |
3,05 |
3,76 |
2,96 |
Anse-à l’Île Coquart |
|
|
|
|
|
|
|
|
|
|
|
3,04 |
Anse-Saint-Jean |
|
|
|
|
|
2,71 |
|
|
3,23 |
2,48 |
2,84 |
2,00 |
Baie-Éternité |
2,43 |
2,67 |
|
|
|
3,25 |
|
|
|
4,31 |
2,03 |
2,15 |
Petit-Saguenay |
|
|
|
|
|
|
|
|
|
2,21 |
|
2,39 |
Anse-au-Cheval |
|
|
|
|
|
|
|
|
|
|
|
2,75 |
Anse-aux-Érables |
|
|
|
|
|
|
|
|
3,08 |
2,38 |
2,76 |
2,42 |
Baie-Sainte-Marguerite |
|
|
|
|
|
|
|
|
|
|
|
3,44 |
Tableau 2
Indices de maturité des myes mâles au Saguenay (n=30)
Maturity indices of male Mya arenaria in the Saguenay fjord (n=30)
Sites |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
|---|---|---|---|---|---|---|---|
Baie-Sainte-Catherine |
2,69 |
3,50 |
2,33 |
3,30 |
2,14 |
2,20 |
3,40 |
Baie-Sainte-Catherine (Pointe‑aux‑Alouettes) |
|
|
|
|
2,79 |
|
|
Baie-Sainte-Catherine (quai) |
|
|
2,39 |
|
|
|
|
Moulin-à-Baude |
3,35 |
3,29 |
4,13 |
3,32 |
3,03 |
2,40 |
2,28 |
Tadoussac |
|
|
2,97 |
|
|
|
|
Anse-à-la-Barque |
|
|
3,14 |
|
3,08 |
2,73 |
3,63 |
Anse-Saint-Étienne |
|
|
|
2,00 |
2,79 |
2,37 |
3,18 |
Anse à l’Ile Coquart |
|
|
|
|
|
|
3,94 |
Anse-Saint-Jean |
2,00 |
|
|
2,12 |
2,74 |
2,00 |
2,48 |
Baie-Éternité |
2,16 |
|
|
|
2,00 |
2,00 |
2,70 |
Petit-Saguenay |
|
|
|
|
2,77 |
|
3,33 |
Anse-au-Cheval |
|
|
|
|
|
|
2,73 |
Anse-aux-Érables |
|
|
|
2,00 |
2,58 |
2,00 |
2,29 |
Baie-Sainte-Marguerite |
|
|
|
|
|
|
2,00 |
Tableau 3
Détermination de l’influence du sexe et de l’année sur les niveaux de 17ß-estradiol, estimée avec une analyse de variance (ANOVA) à deux facteurs.
Influence of sex and year of sampling on 17 estradiol-ß levels according to a two-way ANOVA variance analysis
Source de variation |
DF |
SS |
MS |
F |
P |
|---|---|---|---|---|---|
Années |
2 |
3 875 |
1,937 |
25,643 |
<0,001 |
Sexes |
1 |
0,0502 |
0,0502 |
0,664 |
0,417 |
Années X Sexes |
2 |
0,0379 |
0,0190 |
0,251 |
0,778 |
Résidus |
113 |
8,537 |
0,0755 |
|
|
Total |
118 |
12,462 |
0,106 |
|
|
Tableau 4
Détermination de l’influence du sexe et de l’année sur les niveaux de progestérone, estimée par une analyse de variance (ANOVA) à deux facteurs.
Influence of sex and year of sampling on progesterone levels according to a two-way ANOVA variance analysis.
Source de variation |
DF |
SS |
MS |
F |
P |
|---|---|---|---|---|---|
Années |
2 |
137,3 |
68,650 |
27,431 |
<0,001 |
Sexes |
1 |
0,247 |
0,247 |
0,0987 |
0,754 |
Années X Sexes |
2 |
0,0337 |
0,0168 |
0,00673 |
0,993 |
Résidus |
113 |
282,797 |
2,503 |
|
|
Total |
118 |
424,123 |
3,594 |
|
|
Tableau 5
Détermination de l’influence du sexe et de l’année sur les niveaux de testostérone, estimée par une analyse de variance (ANOVA) à deux facteurs.
Influence of sex and year of sampling on testosterone levels according to a two-way ANOVA variance analysis.
Source de variation |
DF |
SS |
MS |
F |
P |
|---|---|---|---|---|---|
Années |
2 |
7,849 |
3,925 |
5,615 |
0,005 |
Sexes |
1 |
0,958 |
0,958 |
1,371 |
0,244 |
Années X Sexes |
2 |
2,015 |
1,008 |
1,442 |
0,241 |
Résidus |
113 |
78,981 |
0,699 |
|
|
Total |
118 |
88,760 |
0,752 |
|
|
Tableau 6
Variations des hormones stéroïdiennes en fonction des années. Méthode de Dunn.
Steroid hormone variations according to year of sampling. All Pairwise Multiple Comparison Procedures (Dunn’s Method).
Comparaison |
Progestérone |
Testostérone |
17 ß-estradiol |
||||||
|---|---|---|---|---|---|---|---|---|---|
|
Diff. de rangs |
Q |
P < 0,05 |
Diff. de rangs |
Q |
P < 0,05 |
Diff. de rangs |
Q |
P < 0,05 |
2002 vs 2003 |
4,994 |
0,626 |
Non |
30,041 |
3,768 |
Oui |
70,526 |
8,846 |
Oui |
2002 vs 2006 |
48,052 |
6,334 |
Oui |
44,828 |
5,909 |
Oui |
20,798 |
2,741 |
Oui |
2003 vs 2006 |
53,045 |
6,842 |
Oui |
74,869 |
9,657 |
Oui |
49,727 |
6,414 |
Oui |






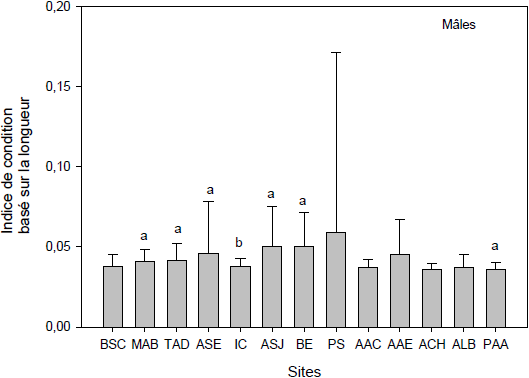
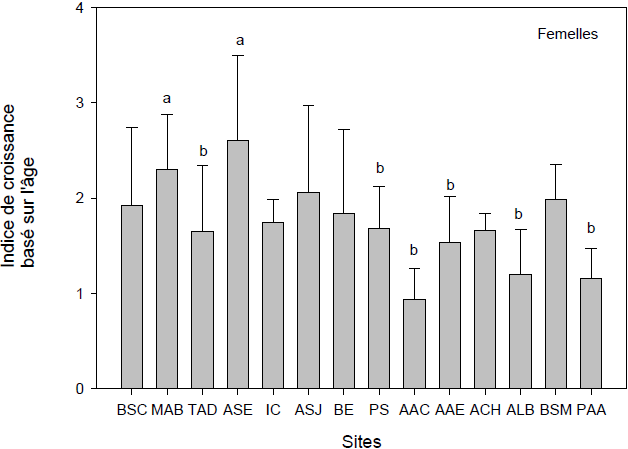


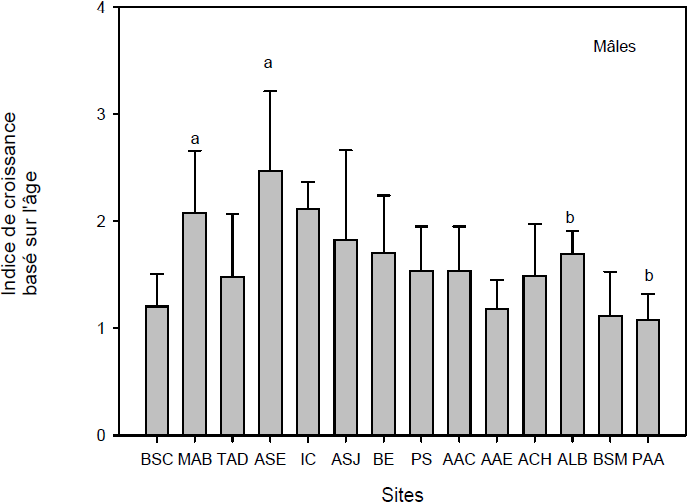
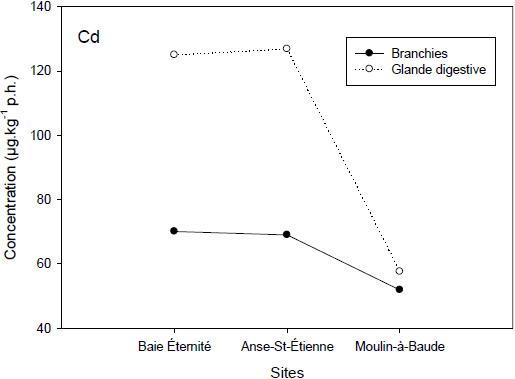

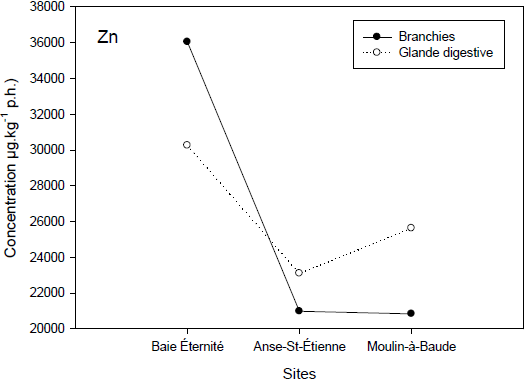
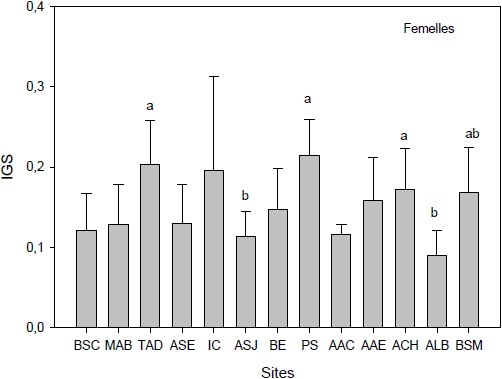

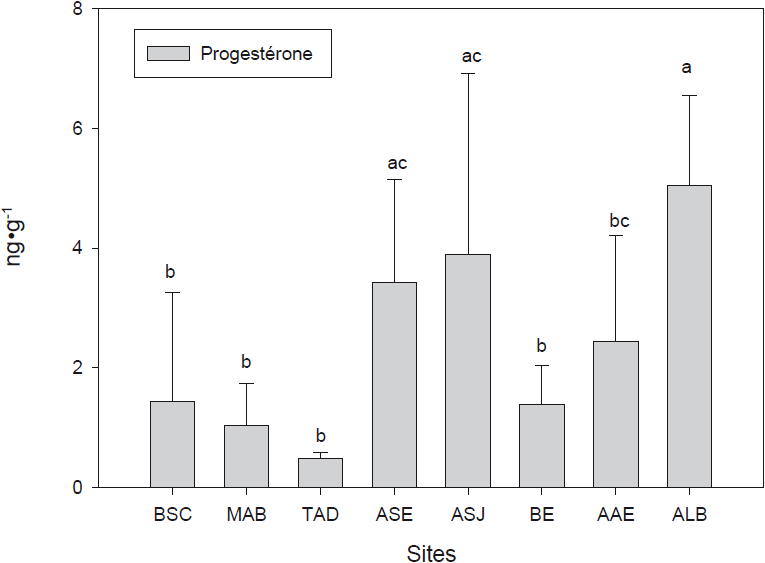

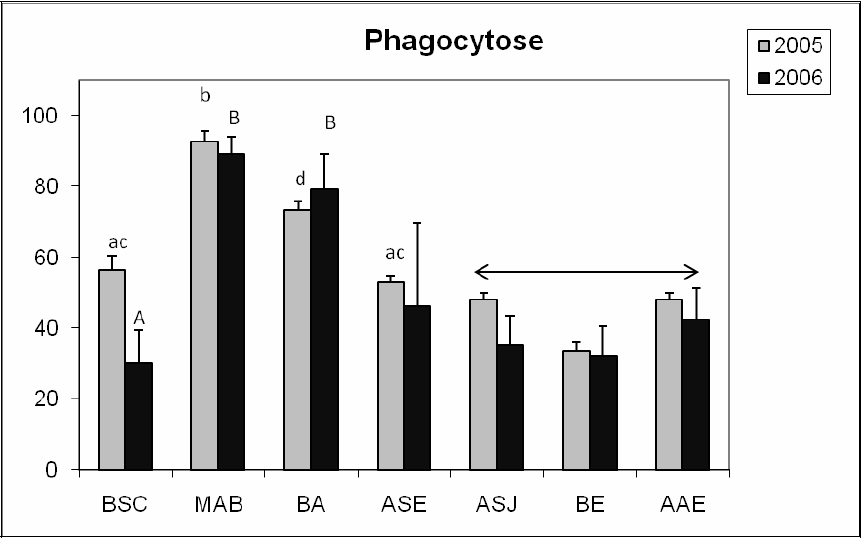
 10.7202/012260ar
10.7202/012260ar