Abstracts
Résumé
Le nématode à kyste du soja (NKS), Heterodera glycines, est un nématode phytoparasite causant des pertes de rendement considérables dans la culture de soja. Il a été détecté pour la première fois au Québec en 2013. Nous présentons ici les résultats d’une enquête visant à déterminer les régions affectées par ce ravageur et la densité de populations présentes au Québec. Au cours des trois dernières années (2013-2015), le NKS a été détecté dans 54 échantillons (32 % des champs testés) répartis dans les 10 régions productrices de soja du Québec. Les densités de populations trouvées étaient par contre très faibles, à la limite de détection. Parmi les régions testées, l’Estrie présentait la plus forte proportion de champs positifs (63 %). Étonnamment, cette proportion n’était que de 7 % en Montérégie-Ouest, là où la première détection a pourtant eu lieu et où se concentre la production de soja. Dans l’ensemble, la qualité des kystes récupérés était pauvre et le nombre d’oeufs très faible. Même si les populations sont encore négligeables, le NKS est bel et bien présent au Québec et il ne pourra pas être éradiqué. Diverses mesures devraient donc être mises en oeuvre afin de limiter la dispersion et l’accroissement des populations de ce ravageur important.
Mots-clés :
- Dépistage,
- Heterodera glycines,
- Québec,
- nématode à kyste,
- soja
Abstract
The soybean cyst nematode (SCN), Heterodera glycines, is a plant parasite that causes considerable yield loss in soybean crop. It was detected for the first time in Quebec in 2013. Here, we present the results of a survey aimed at identifying the regions affected by this pest and the density of its populations in Quebec. Over the last 3 years (2013-2015), SCN was detected in 54 samples (32% of fields tested) from the regions that produce soybean in Quebec. However, population density was very low, barely reaching the point of detection. Among the tested regions, the Eastern Townships had the highest proportion of fields that tested positive (63%). Surprisingly, this proportion was only 7% in Montérégie-Ouest, the centre of soybean production in Quebec, where SCN was first detected. Overall, the quality of the cysts collected was poor and the number of eggs was very low. Even if its populations are still low, SCN is present in Quebec and will not be eradicated. Therefore, different measures should be enforced to limit the spread and population growth of this important pest.
Keywords:
- cyst nematode,
- Heterodera glycines,
- monitoring,
- Quebec,
- soybean
Article body
Introduction
La culture du soja occupe une place de plus en plus importante dans l’agriculture canadienne. Les superficies dédiées à sa culture ont bondi de 1,2 million ha en 2005 à près de 2,3 millions ha en 2014. Au Manitoba seulement, les surfaces cultivées en soja sont passées de moins de 40 500 ha en 2005 à plus de 514 000 ha en 2014, soit une augmentation de plus de 1000 %. Pendant cette même période, les superficies québécoises ensemencées en soja sont passées de 187 000 ha à 348 000 ha (Fig. 1). Cela place donc cette culture tout juste derrière le maïs-grain (355 000 ha) en termes de superficies cultivées (Statistique Canada 2014). La hausse des superficies de soja est d’ailleurs généralisée dans le monde entier (FAOSTAT 2016). Plusieurs raisons expliquent cette soudaine popularité, dont les nombreux débouchés comme les huiles et les farines riches en protéines issues de cette oléo-protéagineuse (Ali 2010). Par contre, c’est surtout le développement de variétés mieux adaptées au climat frais et le contexte économique qui ont poussé les superficies à la hausse. De plus, l’introduction du soja dans un plan de rotation des cultures permet de réduire les coûts en fertilisants azotés et d’améliorer la santé des sols.
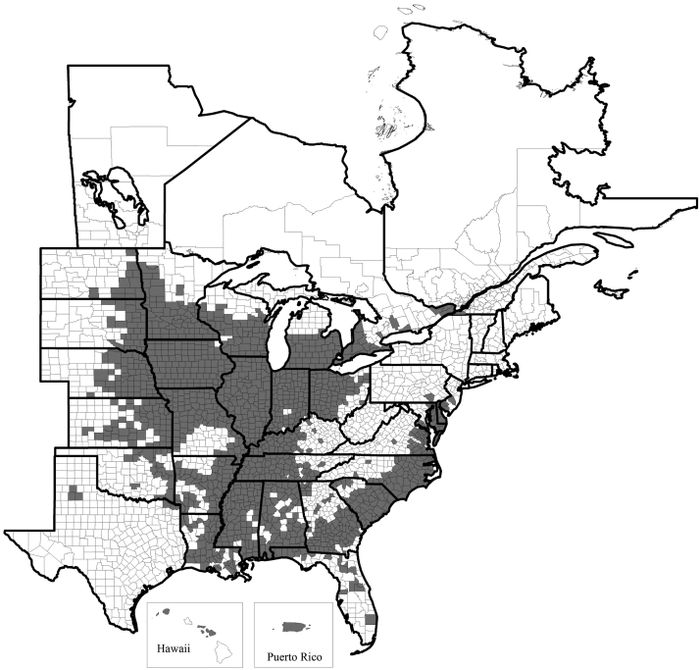
Généralement, les nouvelles régions de production bénéficient d’une faible pression de ravageurs ou de maladies durant les premières années de culture. Par contre, cette augmentation des superficies amène éventuellement de nouveaux problèmes phytosanitaires. La disponibilité de la plante hôte et la plus grande connectivité entre les champs facilitent la dispersion et l’établissement de nouveaux ravageurs, dont le nématode à kyste du soja (NKS), Heterodera glycines Ichinohe (Tylenchida : Heteroderidae). Le NKS est un endoparasite sédentaire des racines du soja qui cause des pertes de rendement évaluées à plus d’un milliard de dollars chaque année aux États-Unis (Koenning et Wrather 2010). Il est présent dans pratiquement tous les États américains producteurs de soja (Fig. 2). Au Canada, le NKS a été rapporté pour la première fois dans le sud-ouest de l’Ontario en 1987 (Anderson et al. 1988) et s’est graduellement étendu au reste de la province avec l’augmentation des superficies de soja (Yu 2011). Sa présence a été confirmée au Québec en 2013 dans un champ de soja situé à Saint-Anicet, en Montérégie (Mimee et al. 2014a).
Malheureusement, les pertes de rendement associées au NKS surviennent avant l’apparition de symptômes et peuvent être très importantes (Wang et al. 2003). De plus, les symptômes associés au NKS ne sont pas spécifiques et peuvent facilement être confondus avec d’autres désordres, tels que les carences en azote ou en potassium et les stress hydriques, ou avec d’autres maladies. Les plants infectés par le NKS sont d’ailleurs plus sensibles aux maladies fongiques comme le syndrome de la mort subite ou la pourriture brune de la tige (McLean et Lawrence 1993; Sugawara et al. 1997). De plus, les nématodes créent des portes d’entrée pour les maladies racinaires comme Pythium et Phytophthora (Kaitany et al. 2000). Dans les champs très infestés, les symptômes apparaissent généralement deux mois après le semis, surtout à l’entrée du champ et dans les endroits sujets aux stress hydriques (élévations, baissières, sols compactés, etc.). La distribution du nématode dans un champ étant irrégulière, les symptômes sont généralement observés seulement à certains endroits, sous forme de plaques jaunes arrondies ou ovales s’allongeant dans la direction du travail du sol. Les symptômes d’une infestation par le NKS comprennent notamment le rabougrissement des plants, la chlorose des feuilles (jaunissement), la réduction de la nodulation par Rhizobium, la réduction du nombre de racines latérales, la lenteur des rangs à se refermer sur eux-mêmes et la sénescence hâtive des plants (Niblack et Tylka 2012). La mort du plant peut survenir dans les cas extrêmes. Le seul signe spécifique et sans équivoque d’une infestation de NKS est la présence sur les racines de kystes blancs, jaunes ou bruns qui sont visibles à l’oeil nu.
Fig. 1
Superficies ensemencées en soja dans les provinces canadiennes de 1986 à 2014 (Statistique Canada 2014)
Fig. 2
Distribution du nématode à kyste du soja aux États-Unis et au Canada en 2014 (Tylka et Marett 2014)
Un ralentissement métabolique généralisé de la plante est causé par l’alimentation du NKS qui détourne les éléments nutritifs circulant dans le système vasculaire des racines à son avantage. Le cycle de vie du NKS débute au printemps, dès que les conditions climatiques sont propices, avec l’éclosion des oeufs. Les larves infectieuses du deuxième stade (J2) pénètrent les racines des plantes hôtes à proximité des kystes. La larve subit trois mues successives à l’intérieur de la racine avant de se développer soit en femelle, soit en mâle vermiforme qui quittera la racine à la recherche de femelles à féconder. La femelle adulte se développe à l’intérieur des racines et grossit rapidement jusqu’à saillir de cette racine en prenant une forme caractéristique de citron de couleur blanche ou jaune. Après sa mort, sa cuticule séchée sert d’enveloppe de protection pour les oeufs; c’est le kyste, qui prend une couleur brune. La femelle peut produire jusqu’à 600 oeufs, dont environ 200 sont contenus dans le kyste, où ils demeurent viables jusqu’à 11 années après sa formation (Inagaki et Tsutsumi 1971). Les autres oeufs sont relâchés dans le sol à l’intérieur d’une matrice gélatineuse et peuvent éclore immédiatement pour recommencer le cycle. Sous des conditions optimales, le cycle de vie entier du NKS peut se compléter en 22 jours, ce qui permet à plusieurs générations de se développer chaque année.
La gestion du NKS repose en grande partie sur la prévention, la rotation des cultures et l’utilisation de variétés résistantes. Bien que quelques nématicides ou fumigants existent, aucune étude n’a permis de démontrer un lien clair entre leur utilisation et un accroissement du rendement pouvant justifier l’investissement. De plus, ces produits ne permettent pas une réduction à long terme des populations qui sont souvent en augmentation dès l’automne qui suit le traitement (Niblack et al. 2006). À l’heure actuelle, la rotation des cultures avec des plantes non hôtes (maïs, céréales, plantes fourragères) et l’utilisation de cultivars résistants au NKS sont les méthodes de choix pour contrôler les populations de ce ravageur. Le dépistage précoce permet d’identifier les champs infestés et d’éviter la dispersion du NKS aux champs sains en travaillant ceux-ci en premier et en intensifiant les moyens de lutte dans les parcelles affectées. Il est donc impératif d’établir un portrait de la situation au Québec en procédant à un échantillonnage dans toutes les régions productrices. Nous présentons ici la première étude visant à déterminer les régions affectées par ce ravageur et à établir la densité des populations présentes au Québec.
Matériel et méthodes
Échantillonnage et extraction de sol
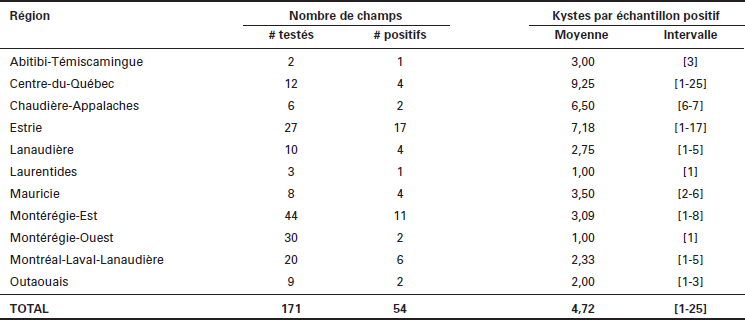
Au cours des automnes 2013, 2014 et 2015, 171 sites (n = 45, 54 et 72, respectivement) localisés dans 10 régions administratives du Québec ont été échantillonnés par les dépisteurs du Réseau d’avertissements phytosanitaires du ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec (MAPAQ), l’équipe de nématologie du Centre de recherche et développement de Saint-Jean-sur-Richelieu d’Agriculture et Agroalimentaire Canada (AAC) ou directement par les producteurs de soja (Tableau 1). Sur plusieurs rangs dans chacun des champs, 25 prélèvements de sol ont été effectués près des plants à l’aide d’une sonde ou d’une truelle à l’endroit où se trouvent les racines, à une profondeur variant de 0 à 20 cm, en faisant des zigzags pour couvrir une zone d’environ 2 ha ou la partie d’un champ qui semblait affectée. Ces sous-échantillons ont été mélangés dans une chaudière et 1000 cm3 de sol ont été récupérés et transférés dans un sac de plastique étanche bien identifié au nom du producteur avec l’adresse du lieu de prélèvement, les coordonnées GPS et la date du prélèvement. L’historique cultural du champ et la texture du sol ont également été notés pour les dépistages de 2014 et 2015. Ces échantillons de sol ont ensuite été envoyés au laboratoire de nématologie d’AAC à Saint-Jean-sur-Richelieu. Tous les échantillons de sol ont été homogénéisés dès leur réception et mis à sécher à température pièce. Une fois le sol sec, les kystes ont été extraits du sol par flottaison selon la méthode de Fenwick (1940). Le dénombrement des kystes et l’évaluation du nombre et de la qualité des oeufs se sont faits visuellement à l’aide d’un stéréomicroscope.
Tableau 1
Nombre de champs positifs pour la présence du nématode à kyste du soja et nombre de kystes trouvés par région administrative
Identification moléculaire du NKS
Pour chaque échantillon contenant des kystes répondant aux caractéristiques du NKS (forme de citron, < 1 mm), un kyste a été prélevé et placé dans un microtube pour identification moléculaire. L’ADN a été extrait à l’aide d’une méthode à la soude développée par Boucher et al. (2013). Un deuxième kyste a été testé pour tous les échantillons ayant présenté un résultat négatif pour l’identification comme H. glycines. Pour cette reprise, l’extraction d’ADN a été réalisée à l’aide de la trousse commerciale DNeasy Blood and Tissue Kit (Qiagen Inc., Mississauga, Ont., Canada) selon les instructions du manufacturier. L’identification des kystes à l’espèce a été réalisée par PCR quantitative grâce au test développé par Ye (2012). Les amorces sens (5’-AAATTCCAGGCCGCTATCTC-3’) et antisens (5’-CGTGGACTGAACTGGACAAAG-3’) de même que la sonde 5’-/56-FAM/TGGGCTGGGTGCTTCTAGAACTTTT/3IABkFQ/-3’ ont été utilisées afin d’amplifier un fragment spécifique de 83 pb. Les réactions d’amplification ont été réalisées dans un thermocycleur en temps réel Mx3000P (Agilent Technologies Canada Inc., Mississauga, Ont., Canada) à l’aide du mélange réactionnel QuantiFast Multiplex PCR Kit (Qiagen Inc.) Deux microlitres des extraits d’ADN des échantillons ont été testés dans un volume réactionnel de 20 µl. Un extrait d’ADN de H. glycines provenant d’une population de référence a été utilisé comme témoin positif alors que de l’eau stérile servait de témoin négatif dans tous les tests. Une réaction PCR en deux étapes a été utilisée; celle-ci incluait une phase de dénaturation initiale à 95 °C pendant 5 min, suivie de 45 cycles comprenant 30 s de dénaturation à 95 °C et 30 s d’hybridation-élongation à 62 °C.
Résultats
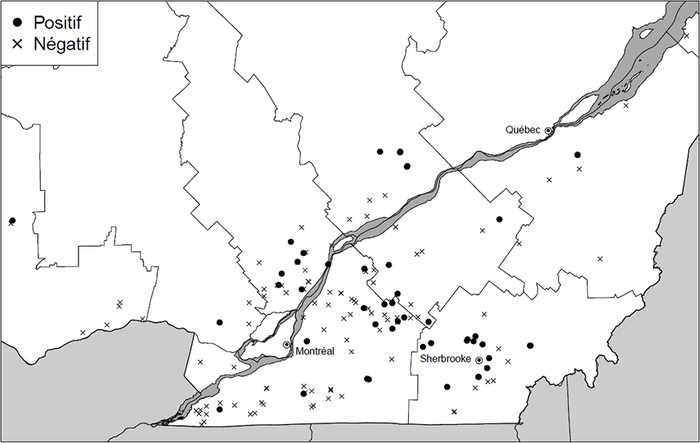
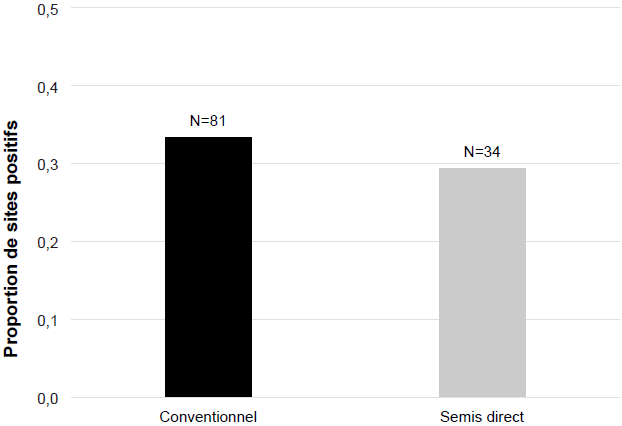
Des kystes brunâtres en forme de citron ont été retrouvés dans 54 des 171 champs échantillonnés (Fig. 3). L’identification de l’espèce H. glycines a été confirmée dans tous ces échantillons par qPCR. Les échantillons positifs contenaient des densités relativement faibles, avec une moyenne provinciale de 4,72 [1-25] kystes par 1000 cm3 de sol testé pour l’ensemble des trois années à l’étude (Tableau 1). Parmi toutes les régions testées, l’Estrie se classe en première position quant à la proportion de champs où le NKS a été détecté (63 %). La région de la Montérégie-Ouest affiche les taux les plus faibles, et ce, tant par rapport à la proportion des champs où la présence du NKS a été détectée (7 %) qu’au nombre moyen de kystes retrouvés par échantillon (1 kyste/1000 cm3 de sol). La région du Centre-du-Québec est celle pour laquelle la plus grande densité de kystes a été retrouvée durant les trois années à l’étude (9,25 kystes/1000 cm3 de sol), suivie par l’Estrie avec 7,18 kystes/1000 cm3 de sol. Dans l’ensemble, la qualité des kystes récupérés était plutôt pauvre et ceux-ci ne contenaient qu’un nombre très faible d’oeufs. Des kystes remplis d’oeufs viables, signe de reproduction active, n’ont été retrouvés que dans quelques échantillons (environ 15 % des sites positifs). Aucune corrélation entre la proportion de champs positifs et le type de sol n’a été observée (Fig. 4). De la même façon, aucun lien n’a été observé entre le nombre d’années en soja dans les précédents culturaux et le nombre d’échantillons positifs (Fig. 5), ni en fonction du type de régie de culture utilisé (conventionnel vs semis direct) (Fig. 6).
Fig. 3
Distribution des champs de soja testés de 2013 à 2015 et sites dans lesquels la présence du nématode à kyste du soja a été confirmée
Fig. 4
Proportion de sites positifs pour la présence du nématode à kyste du soja en fonction de la texture du sol des champs testés en 2014 et 2015
Fig. 5
Proportion de sites positifs pour la présence du nématode à kyste du soja en fonction du nombre d’années en soja dans les précédents culturaux des champs testés en 2014 et 2015
Fig. 6
Proportion de sites positifs pour la présence du nématode à kyste du soja en fonction de la régie culturale des champs testés en 2014 et 2015
Discussion
Le NKS continue de causer des pertes significatives dans tous les pays producteurs de soja et est la principale cause des pertes de rendement aux États-Unis. Au Canada, le NKS a été réglementé durant plus de 30 ans par l’Agence canadienne d’inspection des aliments (ACIA). Toutefois, en raison des défis liés à l’application du règlement concernant le transport à l’intérieur du pays et à l’impossibilité de contrôler la propagation du ravageur par des voies naturelles (oiseaux, eau, vent, etc.), l’ACIA a déréglementé le NKS partout au Canada à partir du 25 novembre 2013 (ACIA 2013). Aux États-Unis, ce ravageur n’est plus réglementé depuis 1972. Aucune mesure n’est donc prise par l’ACIA lorsque le NKS est découvert dans un champ et l’agence fédérale a cessé tout dépistage pour ce ravageur. Les dernières enquêtes de l’ACIA au Québec ont été réalisées en 2007 et 2009 et n’avaient alors pas détecté la présence du NKS. Or, la production de soja a continué de s’intensifier depuis pour s’établir à un niveau record en 2014 (Fig. 1). En Ontario, la présence du NKS est connue depuis près de 30 ans et aucune zone de quarantaine n’a jamais été appliquée.
Au cours de la présente enquête, des kystes répondant aux caractéristiques du NKS et s’avérant positifs au test de diagnostic moléculaire ont été trouvés dans 54 champs sur les 171 visités dans 10 régions du Québec. Il est étonnant de constater que la situation ait évolué autant en seulement quatre ans depuis la dernière enquête de l’ACIA. De plus, bien que le protocole d’échantillonnage utilisé ici ne soit pas identique à celui de l’ACIA, le volume de terre analysé à l’hectare et la probabilité de détection sont sensiblement les mêmes. Dans les champs du Québec, la densité des populations retrouvées était très faible, avec une densité moyenne de 4,72 kystes/1000 cm3 de sol dans les champs positifs, soit à la limite de la détection. Chacun de ces kystes ne contenait que très peu d’oeufs pour une densité moyenne dans les champs positifs estimée à 5 oeufs/100 g de sol. En comparaison, les champs du sud-ouest de l’Ontario présentent souvent des densités entre 500 et 2000 oeufs/100 g de sol et plusieurs champs ont des populations supérieures à 4000 oeufs/100 g de sol. Par contre, en conditions favorables, une population de NKS peut évoluer très rapidement et des pertes de rendement peuvent survenir même à de très faibles densités initiales (Wang et al. 2003). Les experts sont d’ailleurs d’avis que des mesures devraient être prises dès la détection d’un seul kyste dans un champ (Wang et al. 2003). Des pertes de rendement allant jusqu’à 30 % ont été rapportées en l’absence de symptômes et sans que la croissance des plants ne semble affectée (Noel 1992; Young 1996). De plus, la capacité de détecter des kystes par échantillonnage des sols est très en deçà du potentiel de propagation à travers un champ (Noel et Edwards 1996). À la suite d’une introduction expérimentale dans un champ non infesté, Noel et Edwards (1996) ont mesuré une augmentation graduelle des populations atteignant des niveaux réduisant le rendement après 5 à 6 ans de monoculture de soja sensible au NKS. Douze ans après cette introduction, il n’y avait toujours aucun symptôme visible malgré des pertes de rendement significatives. Cette même étude estime que les premiers symptômes visibles du NKS dans un système de maïs-soja sur 2 ans devraient apparaître 15 à 20 ans après la première infestation. Par contre, cela dépend de plusieurs facteurs (climat, type de sol, pratique culturale, etc.) et, tel que mentionné précédemment, les populations peuvent, dans certains cas, évoluer beaucoup plus rapidement.
Lors de la présente étude réalisée au Québec, aucune corrélation n’a été trouvée entre la détection du NKS et le type de sol (Fig. 4). D’autres études ont également démontré ce résultat pour le NKS (Workneh et al. 1999) qui, contrairement à d’autres nématodes, se développe bien dans tous les types de sol. À l’inverse, aucune corrélation n’a été trouvée entre la détection et le nombre d’années en soja dans les précédents culturaux (Fig. 5) ou le type de régie de culture (conventionnel vs semis direct) (Fig. 6) alors que ces facteurs sont bien documentés comme étant des facteurs aggravants (Workneh et al. 1999). Ces résultats, combinés aux faibles populations retrouvées, laissent croire que l’infestation est récente et qu’il n’y aurait que peu de reproduction active à l’heure actuelle dans les champs du Québec. La détection aléatoire de faibles quantités de kystes dégradés, sans foyer d’infestation dans une région précise, laisse plutôt croire à une contamination aérienne sur de longues distances. Il a été démontré que le NKS se propage rapidement d’une parcelle à l’autre et qu’il peut se disperser sur de longues distances avec des mouvements de sol par la machinerie agricole ou lors de l’installation de pylônes ou de gazoducs, mais aussi par le vent, les inondations et même les oiseaux migrateurs (Edward 1988; Epps 1971; Noel et Edwards 1996). L’expansion septentrionale dans les États du Minnesota et du Dakota du Nord s’est d’ailleurs faite de façon rapide et très soutenue au cours des dernières années, si bien que des champs à la frontière du Manitoba, la province où le soja est en plus forte expansion au Canada, sont maintenant infestés et font craindre le pire aux producteurs des provinces des Prairies (Tenuta et Tenuta 2015). Il ne faut pas non plus espérer que le climat empêchera le NKS de se développer au Québec. Des modélisations ont démontré que le développement de plusieurs générations de NKS est déjà possible au Québec et que cela s’accentuera dans le futur (Mimee et al. 2014b). Par ailleurs, l’évolution du climat pourrait influencer à la baisse la performance des cultivars résistants au NKS et complexifier sa gestion (Gendron St-Marseille et al. 2015).
Pour l’heure, il est bien documenté qu’un plan de gestion efficace et durable du NKS doit impérativement être basé sur la rotation des cultures et l’utilisation de cultivars résistants (Niblack 2005; Noel 2008). Ces pratiques simples et peu coûteuses sont très efficaces et peu contraignantes. D’ailleurs, l’utilisation assez généralisée d’une rotation minimale de maïs-soja au Québec pourrait avoir nui au développement actif du ravageur et ralenti sa progression. Les efforts effectués au cours des dernières décennies en amélioration génétique ont considérablement réduit les coûts de rendement associés aux cultivars résistants, de sorte que le risque économique lié à leur utilisation est pratiquement nul aujourd’hui (Tylka et al. 2002). Les pratiques culturales sont également importantes. Plusieurs mauvaises herbes supportent très bien le développement du NKS et pourraient servir de refuge ou contribuer à l’augmentation des populations (Venkatesh et al. 2000). Les labours affectent également les densités de NKS en modifiant les propriétés physiques du sol et en dispersant le ravageur; le semis direct limiterait donc l’augmentation des populations (Westphal et al. 2009).
Les interactions entre le NKS et les autres ravageurs ne sont pas non plus à négliger. Il a été démontré que la présence de pucerons augmentait le développement du NKS, et ce, même sur des cultivars résistants (McCarville et al. 2014). La pénétration du système racinaire par les nématodes rend également les jeunes plants plus sensibles à de nombreux champignons, dont Phytophthora sojae, en stressant la plante et en créant des portes d’entrée (Kaitany et al. 2000). Le NKS n’est d’ailleurs pas le seul nématode à favoriser le développement de maladies fongiques racinaires; le nématode des lésions, Pratylenchus penetrans, est lui aussi souvent montré du doigt (Back et al. 2002). Ce nématode est omniprésent dans les sols du Québec et se développe très bien dans les cultures de soja (Bélair et al. 2002). Au cours des dernières années, une augmentation du nombre d’infections racinaires causées par les Phytophthora, Pythium et Rizoctonia a d’ailleurs été observée au Québec (S. Rioux, comm. pers.). Il est dès lors tentant d’émettre l’hypothèse que le plafonnement, voire la baisse, des rendements à l’hectare observé certaines années pourrait être relié à la présence de ces nématodes en combinaison avec des conditions météorologiques propices au développement des maladies. Beaucoup d’inconnus demeurent, mais une certitude existe : le NKS est présent au Québec et il ne pourra pas être éradiqué. Tout devrait donc être mis en oeuvre afin de limiter la dispersion et l’accroissement des populations de ce ravageur important. Si la réglementation n’a pas été efficace pour le faire, il est nécessaire que les producteurs adoptent de bonnes pratiques. Cela comprend la rotation des cultures et l’utilisation de cultivars résistants, mais devrait aussi inclure un échantillonnage périodique, le lavage de la machinerie, la limitation des allées et venues entre les champs de même que des mesures d’atténuation de l’érosion éolienne, comme l’aménagement de haies brise-vent.
Appendices
Remerciements
Nous tenons à remercier tous les dépisteurs du Réseau d’avertissements phytosanitaires et les conseillers agricoles pour leur aide technique sur le terrain. Nous remercions également Alexis Latraverse pour la cartographie. Ce projet a été réalisé grâce au support financier du Réseau d’avertissements phytosanitaires (MAPAQ) et d’Agriculture et Agroalimentaire Canada.
Références
- Agence canadienne d’inspection des aliments (ACIA). 2013. Document de travail sur la gestion des risques phytosanitaires pour la déréglementation de Heterodera glycines Ichinohe (nématode à kyste du soja). Agence canadienne d’inspection des aliments, Ottawa, Ont., Canada. Répertoire des documents d’orientation, Document n° DGR-11-02.
- Ali, N. 2010. Soybean processing and utilization. Pages 345-374 in G. Singh (éd.). The Soybean: Botany, Production and Uses, 1st ed. CAB International, Oxford, G.-B.
- Anderson, T.R., T.W. Welacky, H.T. Olechowski, G. Ablett et B.A. Ebsary. 1988. First report of Heterodera glycines in Ontario, Canada. Plant Dis. 72 : 453.
- Back, M.A., P.P.J. Haydock et P. Jenkinson. 2002. Disease complexes involving plant parasitic nematodes and soilborne pathogens. Plant Pathol. 51 : 683-697.
- Bélair, G., Y. Fournier, N. Dauphinais et O.P. Dangi. 2002. Reproduction of Pratylenchus penetrans on various rotation crops in Quebec. Phytoprotection 83 : 111-114.
- Boucher, A.C., B. Mimee, J. Montarry, S. Bardou-Valette, G. Bélair, P. Moffett et E. Grenier. 2013. Genetic diversity of the golden potato cyst nematode Globodera rostochiensis and determination of the origin of populations in Quebec, Canada. Mol. Phylogen. Evol. 69 : 75-82.
- Edwards, D.I. 1988. The soybean cyst nematode. Pages 81-86 in T.D. Wyllie et D.H. Scott (éds.). Soybean Diseases of the North Central Region. The American Phytopathological Society, St. Paul, MN, É.-U.
- Epps, J.M. 1971. Recovery of soybean cyst nematodes (Heterodera glycines) from the digestive tracts of blackbirds. J. Nematol. 3 : 417-419.
- FAOSTAT. 2016. FAO Statistics Division. World soybean production from 2005-2014. [En ligne] http://faostat.fao.org/ (consulté le 8 septembre 2016).
- Fenwick, D.W. 1940. Methods for the recovery and counting of cysts of Heterodera schachtii from soil. J. Helminthol. 18 : 155-172.
- Gendron St-Marseille, A.-F., G. Bélair, J. Brodeur, G. Bourgeois et B. Mimee. 2015. Impact des changements climatiques sur les interactions moléculaires entre le nématode à kyste du soya (Heterodera glycines) et son hôte principal, le soya (Glycine max). Phytoprotection 95 : 41-47.
- Inagaki, H. et M. Tsutsumi. 1971. Survival of the soybean cyst nematode, Heterodera glycines Ichinohe (Tylenchida: Heteroderidae) under certain storing conditions. Appl. Entomol. Zool. 6 : 156-162.
- Kaitany, R., H. Melakeberhan, G.W. Bird et G. Safir. 2000. Association of Phytophthora sojae wtih Heterodera glycines and nutrient stressed soybeans. Nematropica 30 : 193-200.
- Koenning, S.R. et J.A. Wrather. 2010. Suppression of soybean yield potential in the continental United States by plant diseases from 2006 to 2009. Plant Health Prog. doi:10.1094/PHP-2010-1122-01-RS.
- McCarville, M.T., D.H. Soh, G.L. Tylka et M.E. O’Neal. 2014. Aboveground feeding by soybean aphid, Aphis glycines, affects soybean cyst nematode, Heterodera glycines, reproduction belowground. PLoS ONE 9 : e86415.
- McLean, K.S. et G.W. Lawrence. 1993. Interrelationship of Heterodera glycines and Fusarium solani in sudden death syndrome of soybean. J. Nematol. 25 : 434-439.
- Mimee, B., H. Peng, V. Popovic, Q. Yu, M.-O. Duceppe, M.-P. Tétreault et G. Bélair. 2014a. First report of soybean cyst nematode (Heterodera glycines Ichinohe) on soybean in the province of Quebec, Canada. Plant Dis. 98 : 429.
- Mimee, B., J. Brodeur, G. Bourgeois, J. Moiroux, A.-F. Gendron-St-Marseille et A.-È. Gagnon. 2014b. Quels enjeux représentent les changements climatiques en lien avec les espèces exotiques envahissantes pour la culture du soya au Québec? Ouranos, Projet 550012-103, Rapport final, Québec, Qué., Canada. 51 p.
- Niblack, T.L. 2005. Soybean cyst nematode management reconsidered. Plant Dis. 89 : 1020-1026.
- Niblack, T.L. et G.L. Tylka. 2012. Soybean Cyst Nematode Management Guide, 5th ed. North Central Soybean Research Program Publication. University of Missouri Printing Services, Columbia, MO, É.-U.
- Niblack, T.L., K.N. Lambert et G.L. Tylka. 2006. A model plant pathogen from the kingdom animalia: Heterodera glycines, the soybean cyst nematode. Annu. Rev. Phytopathol. 44 : 283-303.
- Noel, G.R. 2008. IPM of soybean cyst nematode in the USA. Pages 119-126 in A. Ciancia et K.G. Mukerji (éds.). Integrated Management and Biocontrol of Vegetable and Grain Crops Nematodes. Springer-Verlag, Dordrecht, Pays-Bas.
- Noel, G.R. et D.I. Edwards. 1996. Population development of Heterodera glycines and soybean yield in soybean-maize rotations following introduction into a noninfested field. J. Nematol. 28 : 335-342.
- Noel, G.R. 1992. History, distribution, and economics. Pages 1-3 in R.D. Riggs et J.A. Wrather (éds.). Biology and Management of the Soybean Cyst Nematode. American Phytopathological Society, St. Paul, MN, É.-U.
- Statistique Canada. 2014. Superficies des principales grandes cultures, juin 2014. Le Quotidien, 27 juin 2014. Composante du produit n° 11-001-X au catalogue de Statistiques Canada, Ottawa, Ont., Canada.
- Sugawara, K., K. Kobayashi et A. Ogoshi. 1997. Influence of the soybean cyst nematode (Heterodera glycines) on the incidence of brown stem rot in soybean and adzuki bean. Soil Biol. Biochem. 29 : 1491-1498.
- Tenuta, M. et A. Tenuta. 2015. Slowing the spread of soybean cyst nematode. Crops Soils Mag. 48 : 28-30.
- Tylka, G.L. et C.C. Marett 2014. Distribution of the soybean cyst nematode, Heterodera glycines, in the United States and Canada: 1954 to 2014. Plant Health Prog. doi:10.1094/PHP-BR-14-000e.
- Tylka G.L., G.D. Gebhart et C.C. Marett. 2002. Evaluation of soybean varieties resistant to soybean cyst nematode in Iowa. Iowa State University, Ames, IA, É.-U. IPM Bull. No. 52.
- Venkatesh, R., S.K. Harrison et R.M. Riedel. 2000. Weed hosts of soybean cyst nematode (Heterodera glycines) in Ohio. Weed Technol. 14 : 156-160.
- Wang, J., T.L. Niblack, J.A. Tremain, W.J. Wiebold, G.L. Tylka, C.C. Marett, G.R. Noel, O. Myers et M.E. Schmidt. 2003. Soybean cyst nematode reduces soybean yield without causing obvious aboveground symptoms. Plant Dis. 87 : 623-628.
- Westphal, A., L.J. Xing, R. Pillsbury et T.J. Vyn. 2009. Effect of tillage intensity on population densities of Heterodera glycines in intensive soybean production systems. Field Crops Res. 113 : 218-226.
- Workneh, F., X.B. Yang et G.L. Tylka. 1999. Soybean brown stem rot, Phytophthora sojae, and Heterodera glycines affected by soil texture and tillage relations. Phytopathology 89 : 844-850.
- Ye, W. 2012. Development of primetime-real-time PCR for species identification of soybean cyst nematode (Heterodera glycines Ichinohe, 1952) in North Carolina. J. Nematol. 44 : 284-290.
- Young, L.D. 1996. Yield loss in soybean caused by Heterodera glycines. J. Nematol. 28 : 604-607.
- Yu, Q. 2011. Soybean cyst nematode (Heterodera glycines Ichinohe). Pages 461-474 in H.A. El-Shemy (éd.). Soybean Physiology and Biochemistry. InTech, New York, NY, É.-U.
List of figures
Fig. 1
Superficies ensemencées en soja dans les provinces canadiennes de 1986 à 2014 (Statistique Canada 2014)
Fig. 2
Distribution du nématode à kyste du soja aux États-Unis et au Canada en 2014 (Tylka et Marett 2014)
Fig. 3
Distribution des champs de soja testés de 2013 à 2015 et sites dans lesquels la présence du nématode à kyste du soja a été confirmée
Fig. 4
Proportion de sites positifs pour la présence du nématode à kyste du soja en fonction de la texture du sol des champs testés en 2014 et 2015
Fig. 5
Proportion de sites positifs pour la présence du nématode à kyste du soja en fonction du nombre d’années en soja dans les précédents culturaux des champs testés en 2014 et 2015
Fig. 6
Proportion de sites positifs pour la présence du nématode à kyste du soja en fonction de la régie culturale des champs testés en 2014 et 2015
List of tables
Tableau 1
Nombre de champs positifs pour la présence du nématode à kyste du soja et nombre de kystes trouvés par région administrative





 10.7202/706233ar
10.7202/706233ar